一种以日本落叶松子叶为外植体的高效再生方法
1.本发明属于植物培育繁殖技术领域,具体涉及一种以日本落叶松子叶为外植体的高效再生方法。
背景技术:
2.日本落叶松(larch)是一种落叶乔木,属松科(pinaceae),日本落叶松属(larix)。全球日本落叶松属有25种天然分布在温带山区、寒温带的平原及高山气候区。在中国日本落叶松分布于大、小兴安岭海拔300-1200米地带,蓄积量多,森林面积大。日本落叶松具有适应性强、早期速生、成林快、病虫害少、材质优良的特点,是我国东北、西北、华北及南方亚高山地区的重要纸浆材及建筑材树种,也是退耕还林及防护林工程的主要造林树种。
3.日本落叶松的常规育种受自然条件影响较多,生长周期长,遗传操作难度大,且人力物力耗费较大,不能满足现代林木遗传育种的需求。近年来,随着基因工程育种的迅速发展,对针叶树植物进行遗传转化的研究也越来越多,目前在国内关于日本落叶松转基因的研究报道很少,没有一个好的日本落叶松再生体系是一个重要的原因,所以建立髙效稳定的针叶树植物组培体系是进行遗传转化的基础前提。之前已经有不少关于日本落叶松组培体系的报道,齐力旺等用当年生嫩茎段诱导出不定芽;吴克贤等用长白日本落叶松侧枝顶芽做外植体进行离体培养诱导出丛生芽,但诱导不定芽的效率均较低;王伟达等以未成熟合子胚为外植体诱导出不定芽,生根率较低制约了植株再生和遗传改良。
4.本发明通过日本落叶松实生苗子叶为外植体,经过诱导不定芽,伸长不定芽,到一定程度后成功生根并移栽到大棚的过程,建立了一个完整的日本落叶松再生体系,为后期日本落叶松的组培快繁和遗传改良奠定了一个良好的基础。日本落叶松子叶再生系统形成的不定芽数量多且遗传稳定性好,加之子叶具有较大的微粒接收面积,既适于基因枪介导的遗传转化与应用研究,也适于农杆菌介导的遗传转化体系。
技术实现要素:
5.本发明的目的在于提供一种以日本落叶松子叶为外植体的高效再生方法,其取材方便,成本低、操作简单,并具有扩繁速度快、繁殖系数高等特点,可为日本落叶松遗传转化体系提供高效再生体系。
6.为实现上述目的,本发明采用如下技术方案:一种以日本落叶松子叶为外植体的高效再生方法,包括如下步骤:1)播种:选取成熟饱满的种子,用自来水浸泡24 h后于播种于基质中,种子萌发15~20天后,选取生长健壮的幼苗作为下一步实验的材料;2)消毒:将步骤1)得到的幼苗用自来水清洗干净,去根后依次用75vol%酒精浸泡30-60s、0.1vol%升汞溶液浸泡5-7 min、无菌水冲洗5次;3)诱导培养:将步骤2)消毒后的幼苗取子叶切段作为外植体,接种到诱导培养基上培养30天,获得不定芽;所述诱导培养基的配方为:dcr培养基+ 1.5mg/l 6-ba +
0.001mg/l tdz;4)增殖培养:将步骤3)培养得到的不定芽经切割后转接到增殖培养基上培养60天,获得不定芽丛;所述增殖培养基的配方为:dcr培养基+1.5mg/l 6ba+0.001mg/l tdz+0.2g/l活性炭;5)生根培养:将步骤4)培养得到的不定芽丛接种到生根培养基上培养30~60天,获得生根苗;所述生根培养基的配方为:dcr培养基+0.05mg/lnaa+0.2g/l活性炭;6)炼苗:将步骤5)培养得到的生根苗转到炼苗室进行炼苗;7)移栽:在炼苗10天后,将生根苗移栽于基质中,温室培养1-2周,随后进行遮荫散光培养。
7.其中,所述基质是将营养土、蛭石和珍珠岩按体积比2:2:1混合制得。
8.其中,所述诱导培养、增殖培养、生根培养的条件均为:光照速率80 μmol
·
m-2
·
s-1
、光照时间16 h/d、室温25
±
2℃。
9.其中,所述步骤6)具体为:将步骤5)培养得到的生根苗放入自来水中呈半开瓶状态炼苗,炼苗室温度为25℃、光照时间为16 h/d、光照强度80 μmol
·
m-2
·
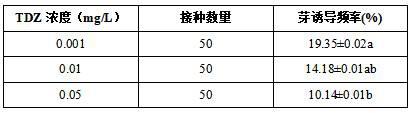
s-1
、湿度为65%。
10.其中,所述步骤7)具体为:在炼苗10天后,待根系由白色转变成灰白色时,将生根苗进行移栽,移栽时先将生根苗于清水中漂洗以去除根部的培养基,然后晾干根系的表面水分,再将生根苗移栽入装有基质的容器中,温室培养1-2周,温室培养条件为:光照时间16 h/d、光照强度2000 lux、温度21-26℃,随后进行遮荫散光培养,每天喷水,湿度保持在40%-60%。
11.上述一种高效再生方法在日本落叶松的离体繁殖中的应用。
12.上述一种高效再生方法在建立日本落叶松栽培体系中的应用。
13.上述一种高效再生方法在日本落叶松优良品系的种质保存中的应用。
14.由于采用了上述技术方案,本发明的有益效果是:(1)本发明选用温室萌发的日本落叶松实生苗子叶作为外植体的来源,其不仅具有取材简单、不受时间和数量限制的特点外,还具有省时省力的优点。
15.(2)本发明利用含有不同激素配比的培养基提供外植体在生根壮苗期间所需的因子,以提供良好的生根条件,促进苗健康茁壮,获得日本落叶松的再生苗,其培养方法取材方便,成本低、操作简单,并具有扩繁速度快、繁殖系数高的特点,可以为日本落叶松遗传转化后提供良好的再生体系。
附图说明
16.图1:不同浓度萘乙酸(naa)对日本落叶松不定芽诱导的影响。
17.图2:不同浓度活性炭对日本落叶松不定芽伸长的影响。
18.图3:以日本落叶松子叶为外植体的再生过程。其中,a为消毒后的外植体;b为外植体接入诱导培养基15d后生成的不定芽;c为外植体接入诱导培养基30d后生成的不定芽; d为不定芽接入增殖培养基后50天左右的单个不定芽;e为不定芽在培养皿中的增殖情况;f为壮苗培养基中培养的芽丛;g为生根的再生苗;h为移栽后的再生苗。图中标尺为1cm。
19.图4:日本落叶松子叶不定芽形成过程组织化学示意图。其中,a为刚接种的子叶纵切面;b为接种10d的子叶纵切面;c为分生组织突起;d-e为芽原基突起纵切面;f为形成的不
定芽纵切面。图中标尺为0.1mm。
具体实施方式
20.为了使本发明所述的内容更加便于理解,下面结合具体实施方式对本发明所述的技术方案做进一步的说明,但是本发明不仅限于此。
21.实施例1探讨不同浓度噻苯隆(tdz)对日本落叶松不定芽诱导的影响,步骤如下:1)播种:选取成熟饱满的日本落叶松种子,温水浸泡24小时,播种于含蛭石的栽培基质上,种子萌发15~20天后,选取生长健壮的幼苗作为下一步实验的材料。
22.2)消毒:将步骤1)得到的幼苗用自来水清洗干净,去根后依次用75vol%酒精浸泡30-60s、0.1vol%升汞溶液浸泡5-7 min,无菌水冲洗5次、每次1min;3)诱导培养:将消毒后的幼苗取子叶切段作为外植体,接种到诱导培养基上,在光照速率80 μmol
·
m-2
·
s-1
、光照时间16 h/d、培养温度25
±
2℃的条件下培养30天,观察并记录不定芽的诱导情况;所述诱导培养基的配方选自如下任意一种:
①
dcr培养基+0.75mg/l 6-ba +0.001mg/l tdz;
②
dcr培养基+0.75mg/l 6-ba +0.01mg/l tdz;
③
dcr培养基+0.75mg/l 6-ba +0.05mg/l tdz。
23.经分析表明,tdz浓度显著影响了芽诱导频率,tdz为0.001 mg/l时候,子叶不定芽的诱导率最高,可达19.35%;随着tdz的浓度升高,诱导率呈现降低趋势,在tdz 为0.05 mg/l时候,不定芽诱导率只有10.14%。可见,添加0.001 mg/l的tdz对日本落叶松不定芽的诱导有较好的效果(表1)。
24.表1 不同浓度tdz对日本落叶松不定芽诱导的影响注:数据为三次重复平均值
±
误差值,同一列中不同字母表示在0.05水平下差异显著,相同字母表示差异不显著。
25.实施例2探讨不同浓度萘乙酸(naa)对日本落叶松不定芽诱导的影响,步骤如下:1)播种:选取成熟饱满的日本落叶松种子,温水浸泡24小时,播种于含蛭石的栽培基质上,种子萌发15~20天后,选取生长健壮的幼苗作为下一步实验的材料。
26.2)消毒:将步骤1)得到的幼苗用自来水清洗干净,去根后依次用75vol%酒精浸泡30-60s、0.1vol%升汞溶液浸泡5-7 min,无菌水冲洗5次、每次1 min。
27.3)诱导培养:将消毒后的幼苗取子叶切段作为外植体,接种到诱导培养基上,在光照速率80 μmol
·
m-2
·
s-1
、光照时间16 h/d、培养温度25
±
2℃的条件下培养30天,观察并记录不定芽的诱导情况;所述诱导培养基的配方选自如下任意一种:
①
dcr培养基+0.75mg/l 6-ba +0.001mg/l tdz;
②
dcr培养基+0.75mg/l 6-ba +0.001mg/l tdz+0.1mg/l naa;
③
dcr培养基+0.75mg/l 6-ba +0.001mg/l tdz+0.3mg/l naa;
④
dcr培养基+0.75mg/l 6-ba +0.001mg/l tdz+0.5mg/l naa;
⑤
dcr培养基+0.75mg/l 6-ba +0.001mg/l tdz+1mg/l naa。
28.观察结果表明(图1),当不添加naa时,平均不定芽诱导率达到最大;随着添加的naa浓度升高,落叶松不定芽的诱导效率也逐渐降低;当浓度增加到0.3 mg/l 时,不定芽诱导效率降低到6.5%;且当naa浓度到达1 mg/l时,开始抑制不定芽的诱导,且不定芽的状态开始变差。说明了低浓度的或不添加naa配合tdz使用能有效促进不定芽诱导,而高浓度的naa则会抑制不定芽生成。鉴于naa对日本落叶松实生苗子叶不定芽的诱导效果不太明显,因此本实验后续将不再添加naa。
29.实施例3探讨不同浓度6-苄基腺嘌呤(6-ba)与噻苯隆(tdz)组合对日本落叶松不定芽诱导的影响,步骤如下:1)播种:选取成熟饱满的日本落叶松种子,温水浸泡24小时,播种于含蛭石的栽培基质上,种子萌发15~20天后,选取生长健壮的幼苗作为下一步实验的材料。
30.2)消毒:将步骤1)得到的幼苗用自来水清洗干净,去根后依次用75vol%酒精浸泡30-60s、0.1vol%升汞溶液浸泡5-7 min,无菌水冲洗5次、每次1 min。
31.3)诱导培养:将消毒后的幼苗取子叶切段作为外植体,接种到诱导培养基上,在光照速率80 μmol
·
m-2
·
s-1
、光照时间16 h/d、培养温度25
±
2℃的条件下培养30天,观察并记录不定芽的诱导情况;所述诱导培养基的配方选自如下任意一种:
①
dcr培养基+0.75mg/l 6-ba +0.001mg/l tdz;
②
dcr培养基+0.75mg/l 6-ba +0.01mg/l tdz;
③
dcr培养基+0.75mg/l 6-ba +0.05mg/l tdz;
④
dcr培养基+1.5mg/l 6-ba +0.001mg/l tdz;
⑤
dcr培养基+1.5mg/l 6-ba +0.01mg/l tdz;
⑥
dcr培养基+1.5mg/l 6-ba +0.05mg/l tdz;
⑦
dcr培养基+3mg/l 6-ba +0.001mg/l tdz;
⑧
dcr培养基+3mg/l 6-ba +0.01mg/l tdz;
⑨
dcr培养基+3mg/l 6-ba +0.05mg/l tdz。
32.结果表明(表2),当6-ba浓度为0.75mg/l和3mg/l的时候,不定芽诱导率均较低;当6-ba浓度为1.5mg/l时表现出相对较高的效率,说明了日本落叶松子叶对6-ba有一定的耐受性,过高过低反而不利于不定芽产生;因此添加了0.001mg/l tdz和1.5mg/l 6-ba的dcr培养基诱导落叶松外植体的效率最高。
33.表2 不同浓度6-ba与tdz组合对日本落叶松不定芽诱导的影响
实施例4探讨不同浓度活性炭对日本落叶松不定芽伸长的影响,步骤如下:1)播种:选取成熟饱满的日本落叶松种子,温水浸泡24小时,播种于含蛭石的栽培基质上,种子萌发15~20天后,选取生长健壮的幼苗作为下一步实验的材料。
34.2)消毒:将步骤1)得到的幼苗用自来水清洗干净,去根后依次用75vol%酒精浸泡30-60s、0.1vol%升汞溶液浸泡5-7 min,无菌水冲洗5次、每次1 min。
35.3)诱导培养:将消毒后的幼苗取子叶切段作为外植体,接种到诱导培养基上,在光照速率80 μmol
·
m-2
·
s-1
、光照时间16 h/d、培养温度25
±
2℃的条件下培养30天,观察并记录不定芽的诱导情况;所述诱导培养基的配方为:dcr培养基+1.5mg/l 6-ba +0.001mg/l tdz。
36.4)增殖培养:将培养得到的不定芽经切割后转接到增殖培养基上,在光照速率80 μmol
·
m-2
·
s-1
、光照时间16 h/d、培养温度25
±
2℃的条件下培养,观察并记录不定芽生长情况,60天后统计伸长率;所述增殖培养基的配方选自以下任意一种:
①
dcr培养基+1.5mg/l 6-ba +0.001mg/l tdz;
②
dcr培养基+1.5mg/l 6-ba +0.001mg/l tdz+0.2g/l活性炭;
③
dcr培养基+1.5mg/l 6-ba +0.001mg/l tdz+0.5g/l活性炭;
④
dcr培养基+1.5mg/l 6-ba +0.001mg/l tdz+1g/l活性炭。
37.结果表明(图2),随着活性炭用量的增加,不定芽伸长率先升高后降低,在活性炭用量为0.2g/l时伸长率达到最大值。因此,在后续实验中向培养基中加入0.2g/l的活性炭。
38.实施例5一种以日本落叶松子叶为外植体的高效再生方法,步骤如下:1)播种:选取成熟饱满的日本落叶松种子,温水浸泡24小时,播种于由营养土、蛭石和珍珠岩按2:2:1(v/v)混合制得的基质上,种子萌发15~20天后,选取生长健壮的幼苗作为下一步实验的材料。
39.2)消毒:将步骤1)得到的幼苗用自来水清洗干净,去根后依次用75vol%酒精浸泡30-60s、0.1vol%升汞溶液浸泡5-7 min,无菌水冲洗5次、每次1 min。
40.3)诱导培养:将消毒后的幼苗取子叶切段作为外植体,接种到诱导培养基上,在光照速率80 μmol
·
m-2
·
s-1
、光照时间16 h/d、培养温度25
±
2℃的条件下培养30天,获得不
定芽;所述诱导培养基的配方为:dcr培养基+1.5mg/l 6-ba +0.001mg/l tdz。
41.4)增殖培养:将培养得到的不定芽经切割后转接到增殖培养基上,在光照速率80 μmol
·
m-2
·
s-1
、光照时间16 h/d、培养温度25
±
2℃的条件下培养60天,获得不定芽丛;所述增殖培养基的配方为:dcr培养基+1.5mg/l 6-ba +0.001mg/l tdz+0.2g/l活性炭。
42.5)生根培养:将培养得到的不定芽丛接种到生根培养基上,在光照速率80 μmol
·
m-2
·
s-1
、光照时间16 h/d、培养温度25
±
2℃的条件下培养30-60天,获得生根苗;所述生根培养基的配方为:dcr培养基+0.05mg/lnaa+0.2g/l活性炭。在此条件下,生根率为50%。
43.6)炼苗:将培养得到的生根苗放入自来水中呈半开瓶状态炼苗,炼苗室温度为25℃、光照时间为16 h/d、光照强度80 μmol
·
m-2
·
s-1
、湿度为65%。
44.7)生根苗的移栽:在炼苗10天后,待根系由白色转变成灰白色时,将生根苗进行移栽,移栽时先将生根苗于清水中漂洗以去除根部的培养基,然后晾干根系的表面水分,再将生根苗移栽入装有由营养土、蛭石和珍珠岩按2:2:1(v/v)混合制得的基质的容器中,温室培养1-2周,温室培养条件为:光照时间16 h/d、光照强度2000 lux、温度21-26℃,随后进行遮荫散光培养,每天喷水,湿度保持在40%-60%。
45.再生过程如图3所示。将日本落叶松子叶(图3a)接种于不定芽诱导培养基上诱导培养15-20d,子叶开始膨大,细胞开始紧密地排列在细胞壁周围,培养21d时左右子叶表面开始逐渐产生小突起,这是不定芽开发生的信号,培养30d时不定芽逐渐形成(图3b~3c);增殖培养60d左右时,不定芽伸长到一定的长度,获得不定芽丛(图3d~3e);将获得的不定芽丛移动到生根培养基,促进生根并继续伸长(图3f~3g);生根培养30-60d时将幼苗从瓶中取出炼苗、移栽至土壤,并继续生长(图3h)。
46.根据石蜡切片结果可知(图4),日本落叶松子叶不定芽的发生未经愈伤组织阶段,且不定芽和母体保持维管联系,属于直接器官发生途径(图 4b~4d)。在激素的刺激下,子叶表面及表面下层的细胞快速分裂,形成分生组织,且开始突起(图4c),分生组织两侧的细胞也开始在激素的刺激下加速分裂开始形成芽原基(图4d),进一步形成肉眼可见的不定芽(图4e),将达到一定高度的不定芽转接入生根培养基,接种30d后可以观察到根原基。
47.以上所述仅为本发明的较佳实施例,凡依本发明申请专利范围所做的均等变化与修饰,皆应属本发明的涵盖范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1