一种富产γ‑氨基丁酸的乳酸菌型豆豉的制作方法与流程
本发明涉及真菌发酵技术领域,尤其涉及一种富产γ-氨基丁酸的乳酸菌型豆豉的制作方法。
背景技术:
豆豉是我国传统的发酵豆制品,由于其丰富的营养和独特的风味深受广大消费者的喜爱;特别是在南方,既可以做菜肴,又可以作为调味品被广泛食用。由于豆豉制备过程中的微生物发酵作用,不仅使得豆豉含有丰富的蛋白质、脂肪、碳水化合物、维生素和矿物质等营养成分,还在豆豉中形成了丰富的多肽,氨基酸,寡糖,单糖等物质,使豆豉更容易被人体吸收,促进消化,适合于肠胃吸收障碍的人群、消化能力减退的老人和消化不良的儿童食用。
由于地域差异,制作豆豉所利用的微生物也不尽相同,主要有曲霉型豆豉,如湖南浏阳豆豉;细菌型豆豉,如利用纳豆芽孢杆菌生产的日本纳豆;毛霉型豆豉,如重庆的永川豆豉;根霉型豆豉,如印尼的天培。
传统的豆豉制作工艺是:黄豆→浸泡→蒸煮→沥干冷却→接种→室温制曲→洗曲、添加辅料→后酵→豆豉→干燥→成品。上述工艺主要是在自然条件下发酵,使得豆豉制曲时间较长,而且豆豉的生产还受到季节的限制,大部分豆豉都在气温较高的夏季制作,并不能常年生产,因此严重影响了企业厂房的利用及豆豉的市场供求和生产规模的扩大,增加了生产成本。
为改善上述问题,利于生产推广,研究人员从菌种的改良,优化工艺方面着手。但是,该工艺普遍采取单菌种制曲来生产豆豉,参与发酵的微生物较少,分泌的酶种类不全,使得豆豉成品的风味不及传统发酵的豆豉。例如:
申请公布号为CN103621913A的中国发明专利申请文献公开了一种快速高效发酵保健豆豉的生产工艺,该生产工艺包括以下步骤:将大豆浸泡后混合麸皮,于121℃灭菌30分钟;熟料冷却至40℃左右接种三角瓶种曲,30℃培养至熟料表面行成白色即得豆豉曲;将豆豉曲加入10%的盐水,使豆豉醅的含水量达到80%~100%,于50℃进行高温发酵七天后豆豉醅即已成熟;将豆豉醅加入90℃以上热水保温2~4小时后过滤得粗酱油,剩余固体为淋油豆豉;将发酵好的纳豆芽胞杆菌液(2000IU/mL以上)按0.1-1%比例加入淋油豆豉中,得基础豆豉;在基础豆豉中加入米酒、辣椒、花椒等不同的香辛料,即可得获得花样豆豉。
与传统工艺相比,上述工艺杂菌污染少、发酵周期短、产品含盐量低,含纳豆激酶稳定;并且一次发酵,生产出酱油和豆豉不仅营养丰富,且花样繁多,适合大规模发酵生产;但是风味单一不及传统发酵的豆豉。
此外,目前工业生产推广的豆豉大多仅能满足消费者的常规口感要求,对于保健型豆豉的生产推广较少;其中,γ-氨基丁酸(GABA)作为现今食品中的保健因子,具有降血压,抗心律失调,调节激素分泌等作用;随着生活水平不断提高,人们对于保健型食品越来越重视,尤其是对能够适于“三高”人群食用的一些食品,更是深受欢迎。
因此,有必要进一步改善现有的生产工艺,提供一种豆豉风味更佳丰富、生产周期更短,更适合大规模推广,而且能够生产具有一定保健功能的豆豉的制作工艺。
技术实现要素:
本发明提供了一种富产γ-氨基丁酸的乳酸菌型豆豉的制作方法,该工艺不仅能够缩短发酵周期、降低生产成本,还能够在制备过程中显著提高成曲的蛋白酶活力和发酵产生的氨基态氮含量,并产生大量γ-氨基丁酸保健因子,从而改善豆豉的风味,提高豆豉的营养性。
蛋白酶活力作为制曲完成的指标,主要为发酵过程中分解大分子蛋白类物质提供准备,氨基态氮含量是发酵完成的指标,发酵过程是一系列的生化反应,如美拉德反应等,与豆豉的风味和营养相关。
一种富产γ-氨基丁酸的乳酸菌型豆豉的制作方法,包括:将黄豆依次清洗、浸泡、沥干、蒸煮后,接种菌粉进行制曲和发酵,获得豆豉;在制曲前,接种的菌粉为米曲霉和黑曲霉的混合菌粉,两者的质量比为1.5~4:1;在制曲后,接种含有植物乳杆菌(Lactobacillus plantarum)CGMCC NO.3782的菌液,再进行发酵。
该植物乳杆菌(Lactobacillus plantarum)CGMCC NO.3782已于2010年由刘佩从传统泡菜中分离得到,鉴定为植物乳杆菌,并命名为(Lactobacillus plantarum)lp15-2-1,并保藏于中国微生物菌种管理委员会普通微生物中心(CGMCC),保藏时间为2010年4月27日,保藏号为CGMCC NO.3782。该菌株的分离、纯化及鉴定方法已在中国专利文献201010251108,.X中公开。本发明不涉及该菌种的保藏。
进一步地,所述米曲霉为沪酿3.042,所述黑曲霉为As 3.350。
米曲霉作为酿造动力微生物,其产酶丰富,能够产生如蛋白酶、肽酶、淀粉酶、纤维素酶等,这些酶系对豆豉制作发挥着不同作用,其中蛋白酶是关键酶。米曲霉产中性蛋白酶的能力较强,产酸性蛋白酶的能力相对较弱;而豆豉的发酵过程是在中性和偏酸性的环境中完成的,需要酸性蛋白酶。
实验发现,黑曲霉的添加不仅不会影响豆豉的发酵,还可以弥补米曲霉的缺点,为整个豆豉曲提供酸性蛋白酶。其中,米曲霉和黑曲霉的配比为4:1时,制曲所产的蛋白酶活力最高。
实验还发现,植物乳杆菌(Lactobacillus plantarum)CGMCC NO.3782的添加还能够进一步促进豆豉发酵产生的氨基态氮含量,从而使豆豉中γ-氨基丁酸的含量进一步提高。
作为优选,以黄豆的质量计,所述菌粉的接种量为1~1.5%。
作为优选,以制曲后豆豉曲的质量计,所述菌液的接种量为1~2mL/kg,菌液中所述植物乳杆菌的浓度为107cfu/mL。
作为优选,所述浸泡的温度为25~35℃,时间为3~5h。
作为优选,所述蒸煮的温度为120~125℃,时间为15~25min。
霉菌的生长温度不宜过低,不利于微生物的生长及代谢;温度不宜过高,容易产生“烧曲”现象,不利于微生物生长,且易使酶失活。
霉菌生长需要一定量的水分,适宜的湿度能使原料保持较高的水分,并使微生物处于平衡状态,这样有利于霉菌的生长,增加产酶量;但是,湿度过大,易使培养箱内水分过高,可能妨碍霉菌与外界环境的物质交换,不利于微生物的生长,使酶活力下降。
故,作为优选,所述制曲的条件为:温度为30~35℃,相对湿度为75~80%,时间为36~60h。更优选,所述温度为30℃,相对湿度为75%,时间为48h。
豆豉发酵过程中,需要添加一定的食盐,这不仅有利于最终成品的风味品质,而且还与微生物生长有很大关系。高盐能够抑制微生物的生长以及蛋白酶活力,阻碍了蛋白质分解,从而氨基态氮含量下降,所以控制含盐量对于豆豉成品品质至关重要。
作为优选,制曲后,添加食盐和水,再进行发酵;其中,食盐的添加量为40~60g/kg。更优选,食盐的添加量为50g/kg。
豆豉发酵前期是大豆中的蛋白质在微生物分泌的酶的催化下发生的水解反应,所以必须有水参加。当含水量太低,不利于蛋白质水解成氨基态氮,保持较高的水分有利于蛋白质的分解;但是水分过高,豆豉呈现酱状或者糊状,不能够保持豆豉原有的固态颗粒。因此,控制含水量在一定范围内有利于豆豉发酵。
作为优选,所述水的添加量为400~600mL/kg。更优选,水的添加量为500mL/kg。
在豆豉发酵过程中,大分子物质如蛋白质在酶的催化下产生小分子的氨基态氮,温度过低不利于酶的催化反应,过高易使酶失活。
相对湿度与豆豉中的含水量相关,只有在合适的湿度下,豆豉和微生物才能保持较合适的水分,从而有利于豆豉发酵;湿度过低,豆豉内的水分会蒸发出来,这样不利于微生物的生长以及蛋白质水解成氨基态氮;湿度过高,豆豉含水量高,豆豉表面被大量水分包围,不利于内外界物质的交换。另外,发酵时间会影响豆豉成品的品质,比如风味和口感。
作为优选,所述发酵的条件为:温度为35~40℃,相对湿度为60~70%,时间为10~15d。更优选,温度为37℃,相对湿度为65%,时间为14d。
与现有技术相比,本发明具有以下有益效果:
(1)本发明方法采用米曲霉和黑曲霉的混合菌粉进行制曲,加入植物乳杆菌(Lactobacillus plantarum)CGMCC NO.3782菌液进行发酵,并配合适宜地制曲和发酵工艺,显著提高成曲蛋白酶活力、发酵产生的氨基态氮含量以及γ-氨基丁酸含量,获得了品质和风味更佳且更健康的豆豉成品。
(2)本发明方法制备工艺简单,大大缩短了发酵周期,降低了生产成本。
附图说明
图1为实施例1中不同米曲霉与黑曲霉菌粉配比对豆豉制曲蛋白酶活力的影响。
图2为实施例1中不同菌粉接种量对豆豉制曲蛋白酶活力的影响。
图3为实施例1中不同制曲温度对豆豉制曲蛋白酶活力的影响。
图4为实施例1中不同制曲湿度对豆豉制曲蛋白酶活力的影响。
图5为实施例1中不同制曲时间对豆豉制曲蛋白酶活力的影响。
图6为实施例2中比较两种豆豉发酵产氨基态氮的情况。
图7为实施例2中γ-氨基丁酸标准品液相色谱图。
图8为实施例2中γ-氨基丁酸标准曲线图。
图9为实施例2中乳酸菌型豆豉中γ-氨基丁酸液相色谱图。
具体实施方式
下列实施例中涉及的各指标测定方法如下:
1、蛋白酶活力的测定:GB/T 23527-2009;
2、氨基态氮含量的测定:
(1)样品的制备:称取5g左右样品,放入200mL烧杯中,加入50mL蒸馏水,用匀浆机打碎均匀,转入离心管中,在3500r/min的条件下离心15min,将上清液移入100mL容量瓶中,再加10mL蒸馏水于离心管沉淀中,再次离心,上清液倒入容量瓶中,此操作反复3次,最后用蒸馏水定容至100mL,混匀。
(2)样品的测定:吸取10mL样品液于200mL烧杯中,加入60mL蒸馏水,开动磁力搅拌器,用0.05mol/L的NaOH溶液滴定酸度计pH至8.2,加入10mL甲醛溶液混匀,再用0.05mol/L的NaOH滴定至9.2,记下pH从8.2到9.2消耗的NaOH体积V1;空白实验只需要将样品换成10mL蒸馏水,记下消耗的NaOH体积V2.。
氨基态氮含量:
3、γ-氨基丁酸(GABA)的测定
(1)试剂
0.2%KH2PO4:0.2g溶于100mL超纯水中,用0.45μm过滤,收集滤液。
样品溶液的制备:准确称取0.05-0.25g粉碎试样,用水定容至100mL,经超声溶解过后,用0.22μm滤膜过滤,收集滤液作为样品溶液。
0.4mol/L硼酸缓冲液:准确称取2.47g硼酸,加入约80mL水,用氢氧化钠调pH至10.2,用水定容至100mL,用0.45μm过滤,收集滤液。
衍生试剂的制备:称取0.01g邻苯二甲醛(OPA),用2.5mL乙腈溶解,加20μLβ-巯基乙醇,超声溶解。
(2)柱前衍生化
精密吸取50uL样品溶液及50μL衍生试剂,400uL硼酸缓冲液混合反应约2min后,加入500μL 0.2%KH2PO4终止反应,30秒后立即进样,进样量为20μL。
(3)色谱条件
流动相
A相:称取8.0g结晶乙酸钠,用水溶解定容至1000mL;然后加入220μL三乙胺,搅拌并滴加5%的醋酸调pH至7.20+0.02;最后加入5mL四氢呋喃,混合后过滤备用。
B相:称取8.0g结晶乙酸钠,用水溶解定容至1000mL;然后滴加2%的醋酸调pH至7.20±0.02;再按乙酸钠溶液:乙腈:甲醇=1:2:2(体积比)混合过滤后备用。
梯度洗脱表
柱温:40℃;流速:1.0mL/min;检测波长:338nm
(4)标准曲线
准确称取0.1gγ-氨基丁酸,用水溶解后定容至100mL,即为1.0mg/mL,用0.45μm过滤,收集滤液进行稀释,分别准确吸取0.1mg/mL、0.2mg/mL、0.4mg/mL、0.6mg/mL、0.9mg/mL浓度标准液,按上述方法进行色谱分析,以峰面积—标准液浓度作图,绘制标准曲线和回归方程,线性相关系数R为0.99以上。
(5)试样测定
称取10g豆豉,放入200mL烧杯中,加入50mL蒸馏水,用匀浆机打碎均匀,转入离心管中,在3500r/min的条件下离心15min,将上清液移入100mL容量瓶中,再加10mL蒸馏水于离心管沉淀中,再次离心,上清液倒入容量瓶中,此操作反复3次,最后用蒸馏水定容至100mL,混匀;吸取5mL样品溶液,加入5mL 0.1mol/L三氯乙酸,涡旋2min,然后在40℃水浴中提取1h,取1mL;离心分离(12000r/min、5min),取上清液50μL,吸取硼酸缓冲液400μL,OPA衍生剂50μL,混合反应1min后加入500μL 0.2%KH2PO4终止反应,用0.22μm滤膜过滤,30秒后立即进样,进样量为20μL,记录色谱峰的保留时间和峰面积,试样与标准溶液的衍生化处理至进样时间应保持一致。根据色谱峰的峰面积,以外标法计算相应的γ-氨基丁酸的浓度。
4、下列实施例的米曲霉为沪酿3.042,所述黑曲霉为As 3.350,植物乳杆菌为(Lactobacillus plantarum)CGMCC NO.3782。
实施例1
以蛋白酶活力为指标,对菌粉配比、接种量、制曲温度、相对湿度和制曲时间等因素进行评估。
1、菌粉配比:挑选饱满的原料大豆100g,用清水洗干净,然后加入300mL,30℃的水浸泡4h,沥干后,接入1g菌粉(接种量1.0%,w/w),其中米曲霉和菌粉配比设置为5:0、4:1、3:2、2:3,在温度为30℃、相对湿度75%的条件下,制曲60h后,测定蛋白酶活力。
由图1可知,当米曲霉和黑曲霉菌粉的配比为4:1时,制曲所产的蛋白酶活力最高。
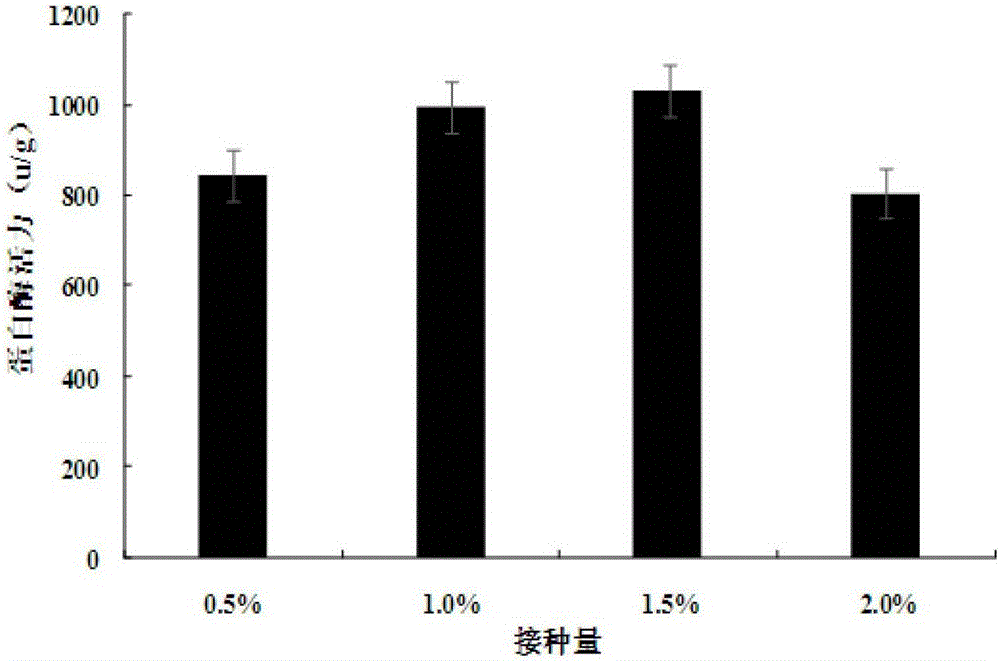
2、接种量:挑选饱满的原料大豆100g,用清水洗干净,然后加入300mL,30℃的水浸泡4h,沥干后,接入菌粉,其中米曲霉和黑曲霉菌粉配比为4:1,接种量设置(w/w)为2.0%、1.5%、1.0%、0.5%,在温度为30℃、相对湿度75%的条件下,制曲60h后,测定蛋白酶活力。
由图2可知,随着接种量的增加,蛋白酶活力逐渐增加,在接种量为1.5%达到最大,但当接种量进一步增加时,蛋白酶活力却反而下降,可能是因为接种量太大,微生物生长过多,产生的温度要高于其最适生长温度,以及受于可被利用的营养物质的限制。所以,确定1.5%的接种量为最佳接种量。
3、制曲温度:挑选饱满的原料大豆100g,用清水洗干净,然后加入300mL,30℃的水浸泡4h,沥干后,接入菌粉(接种量为1.5%,w/w),其中米曲霉和黑曲霉菌粉配比为4:1,在温度设置为25℃、30℃、35℃、37℃、40℃,相对湿度75%的条件下,制曲60h后,测定蛋白酶活力。
由图3可知,随着发酵温度逐渐升高,豆豉曲蛋白酶活力逐渐升高,在35℃时酶活达到最大,但随着温度进一步增加,酶活力急剧下降。
4、制曲相对湿度:挑选饱满的原料大豆100g,用清水洗干净,然后加入300mL,30℃的水浸泡4h,沥干后,接入菌粉(接种量为1.5%,w/w),其中米曲霉和黑曲霉菌粉配比为4:1,在温度为30℃、相对湿度设置为65%、70%、75%、80%和85%的条件下,制曲60h后,测定蛋白酶活力。
从图4可以看出,随着相对湿度的增加,蛋白酶活力先增加后又下降,在相对湿度为75%的酶活达到最大。
5、制曲时间:挑选饱满的原料大豆100g,用清水洗干净,然后加入300mL,30℃的水浸泡4h,沥干后,接入菌粉(接种量为1.5%,w/w),其中米曲霉和黑曲霉菌粉配比为4:1,在温度为30℃、相对湿度设置为75%的条件下,分别制曲12h、24h、36h、48h、60h和72h后,取样测定蛋白酶活力。
由图5可知,随着制曲时间的延长,蛋白酶活力呈现先增加后下降的趋势,在48h时达到最大。在48h之前,微生物在生长,从而酶活也逐渐增加;在48h时,霉菌生长得旺盛,产酶能力也达到最大,酶活也相应提高,而在48h后,可能受到可利用的营养物质的限制以及菌种产酶能力衰退的缘故,蛋白酶活力逐渐下降。
实施例2
通过实施例1的研究,获得最佳的豆豉制曲工艺。
具体步骤如下:
(1)取1kg饱满的黄豆颗粒,用清水清洗直至干净,加入3L的30℃温水浸泡4h后,沥干水分,放入121℃高压蒸煮锅内蒸煮20min,冷却至室温,获得煮熟的黄豆颗粒;
(2)向煮熟的黄豆颗粒中接入15g混合菌粉,其中米曲霉和黑曲霉菌粉的质量比为4:1,混合均匀,放入培养箱中制曲48h,温度为30℃,相对湿度为75%;
(3)制曲完成过后,添加食盐和无菌水,以质量计,每1kg的豆豉曲接种1mL含107cfu/mL植物乳杆菌(Lactobacillus plantarum)CGMCC NO.3782的菌液,并加入50g食盐和500mL的无菌水,将温度调到37℃,相对湿度调为65%,发酵12天,得到成品豆豉。
制曲完成后,蛋白酶活力最高可以达到1158u/g;发酵完成后,氨基态氮含量达到2.33g/100g,γ-氨基丁酸含量达到38mg/kg;成品豆豉呈黑褐色颗粒状,有浓浓的豆香味,口感柔软,有一定的咸味。
对比例1
一种豆豉的制作方法,具体步骤如下:
(1)取1kg饱满的黄豆颗粒,用清水清洗直至干净,加入3L的30℃温水浸泡4h后,沥干水分,放入121℃高压蒸煮锅内蒸煮20min,冷却至室温,获得煮熟的黄豆颗粒;
(2)向煮熟的黄豆颗粒中接入15g混合菌粉,其中米曲霉和黑曲霉菌粉的质量比为4:1,混合均匀,放入培养箱中制曲48h,温度为30℃,相对湿度为75%;
(3)制曲完成过后,添加食盐和无菌水,以质量计,每1kg的豆豉曲加入50g食盐和500mL的无菌水,将温度调到37℃,相对湿度调为65%,发酵12天,得到成品豆豉。
将实施例2和对比例1获得的豆豉进行氨基态氮含量的比较,结果如图6所示。
- 还没有人留言评论。精彩留言会获得点赞!