源自杆菌属微生物的还原剂及其用途的制作方法
本申请为专利申请201180023168.9(申请日:2011年5月9日,发明创造名称:源自杆菌属微生物的还原剂及其用途)的分案申请。
本发明涉及源自杆菌属微生物的还原剂及其用途。本发明的还原剂在改善食用肉或食用肉加工品的色调的目的方面特别有用。本申请主张于2010年5月12日申请的日本专利申请第2010-109779号的优选权,通过参照引用该专利申请的全部内容。
背景技术:
食用肉的颜色是消费者评价肉质时的重要因素。若为鲜红色,则判断是优质的食用肉,若为褐色,则被看作是不新鲜等,肉色对消费者对于食用肉的购买意愿、评价造成很大的影响。
而且,食用肉的色调反映肉中存在的肌红蛋白衍生物的比例。若此肌红蛋白被氧化,则成为高铁肌红蛋白,色调变化为褐色,成为使食用肉制品的经济价值显著下降的主要原因。
为了防止食用肉的褐变,在火腿、香肠等畜肉加工品中,一般使用硝酸盐、亚硝酸盐显色剂。但是,硝酸盐、亚硝酸盐由于具有引起高铁血红蛋白血症的急性毒性,所以使用量被限制成以残存亚硝酸根计成为70ppm以下。另外,亚硝酸被指出与仲胺反应而形成作为致癌性物质的亚硝胺的可能性。因此,从安全性的观点出发,进行了替代硝酸盐、亚硝酸盐显色剂的具有显色效果的物质、显色方法的探索。例如发现了通过添加棉子糖而防止褐变的方法(参照专利文献1)、通过添加金针菇提取物而防止褐变的方法(参照专利文献2)、利用蔬菜类中含有的成分而显色的方法(参照专利文献3)。但是,在专利文献1的方法或专利文献2的方法中显色效果不足,在专利文献3的方法中利用蔬菜类中含有的硝酸盐,安全性存在问题。
另一方面,还提出了通过将肌红蛋白中的铁置换为锌来形成肌红蛋白锌原卟啉ix络合物而维持食用肉的色调的方法(专利文献4)、利用亚铁螯合酶或酵母促进肌红蛋白锌原卟啉ix络合物的生成而保持食用肉的鲜红色的方法(专利文献5、6)。在这些方法中,无法作用于已经生成的高铁肌红蛋白,显色乃至色调维持效果有限。
专利文献
专利文献1:日本特开2003-18976号公报
专利文献2:日本特开2008-228702号公报
专利文献3:日本特开2009-165445号公报
专利文献4:日本特开2006-56908号公报
专利文献5:日本特开2005-87058号公报
专利文献6:日本特开2006-61016号公报
技术实现要素:
本发明以提供对食用肉或食用肉加工品的色调改善有效的还原剂及其用途(不使用亚硝酸盐等显色剂的色调改善方法等)为课题。
本发明人为了找出改善食用肉色调的物质而以杆菌属微生物为中心实施了筛选。筛选的结果确定了产生食用肉显色效果高的物质的微生物株。进一步进行研究的结果明确了被期待高有用性的该物质对高铁肌红蛋白显示还原活性。即,发现杆菌属微生物产生通过高铁肌红蛋白还原活性而促进食用肉显色的物质。该物质是对血红素显示还原作用的物质,不限于食用肉的显色,在血红素或血红素蛋白的还原有效乃至必要的其它用途方面也可利用。例如,在还原具有与高铁肌红蛋白类似的结构的高铁血红蛋白等的目的下可利用该物质。
进一步的研究结果判明了源自杆菌属微生物的上述物质(显示还原作用的物质)为二氢硫辛酰胺脱氢酶和硝基还原酶。
本发明是基于上述结果而完成的,其如下所示。
[1]一种还原剂,含有源自杆菌属微生物的血红素还原酶。
[2]根据[1]中记载的还原剂,其特征在于,所述血红素为高铁肌红蛋白的血红素。
[3]根据[1]中记载的还原剂,其特征在于,所述血红素为高铁血红蛋白的血红素。
[4]根据[1]~[3]中任一项记载的还原剂,其特征在于,由杆菌属微生物的菌体粉碎物构成。
[5]根据[1]~[4]中任一项记载的还原剂,其中,所述杆菌属微生物为选自枯草芽孢杆菌、解淀粉芽孢杆菌、纳豆菌、苏云金芽孢杆菌、及蕈状芽胞杆菌中的微生物。
[6]根据[1]中记载的还原剂,其中,所述血红素还原酶为二氢硫辛酰胺脱氢酶或硝基还原酶。
[7]根据[1]中记载的还原剂,其中,作为所述血红素还原酶,含有二氢硫辛酰胺脱氢酶和硝基还原酶。
[8]根据[6]或[7]中记载的还原剂,其中,所述二氢硫辛酰胺脱氢酶的氨基酸序列含有序列号3的氨基酸序列,所述硝基还原酶的氨基酸序列含有序列号12的氨基酸序列。
[9]根据[6]~[8]的任一项中记载的还原剂,其中,所述二氢硫辛酰胺脱氢酶和所述硝基还原酶为重组蛋白质。
[10]一种色调改善剂,由[1]~[9]中任一项记载的还原剂构成。
[11]一种色调改善剂,是将[1]~[9]中任一项记载的还原剂与显示将肌红蛋白的血红素基中的铁置换成锌的作用的物质组合而成的。
[12]根据[11]中记载的色调改善剂,其中,所述物质为亚铁螯合酶。
[13]根据[10]~[12]中任一项记载的色调改善剂,其中,所述色调改善剂用于改善食用肉或食用肉加工品的色调。
[14]一种食用肉或食用肉加工品用的色调改善剂,含有二氢硫辛酰胺脱氢酶和/或硝基还原酶。
[15]根据[10]~[14]中任一项记载的色调改善剂,其中,所述色调改善剂通过显色作用、显色促进作用和/或防褪色作用来改善色调。
[16]一种医药品,其特征在于,含有[1]~[9]中任一项记载的还原剂。
[17]根据[16]中记载的医药品,其中,所述医药品是口服给药制剂。
[18]根据[16]中记载的医药品,其中,所述医药品是非口服给药制剂。
[19]一种还原剂的制造方法,所述制造方法包括以下步骤(1)和(2):
(1)将产生血红素还原酶的杆菌属微生物在产生该酶的条件下培养的步骤;
(2)从培养产物回收所述酶的步骤。
[20]根据[19]中记载的制造方法,其中,所述步骤(2)由以下步骤构成:
(2-1)从培养产物收集菌体的步骤;
(2-2)制备菌体粉碎物的步骤。
[21]根据[19]或[20]中记载的制造方法,其特征在于,所述血红素为高铁肌红蛋白的血红素。
[22]根据[19]或[20]中记载的制造方法,其特征在于,所述血红素为高铁血红蛋白的血红素。
[23]根据[19]~[22]中任一项记载的制造方法,其中,所述杆菌属微生物为选自枯草芽孢杆菌、解淀粉芽孢杆菌、纳豆菌、苏云金芽孢杆菌、及蕈状芽胞杆菌中的微生物。
[24]一种色调改善方法,其特征在于,使[10]~[15]中任一项记载的色调改善剂作用于食用肉或食用肉加工品。
[25]一种色调改善方法,其特征在于,使选自枯草芽孢杆菌、解淀粉芽孢杆菌、纳豆菌、苏云金芽孢杆菌、及蕈状芽胞杆菌中的杆菌属微生物的菌体粉碎物作用于食用肉或食用肉加工品。
[26]一种使用了[1]~[9]中任一项所述的还原剂的预防或治疗方法,预防或治疗血液循环障碍、低氧症或血氧减少状态,伴有血液循环障碍、低氧症及血氧减少状态中的一种以上的病理乃至症状的疾病,或由血液循环障碍、低氧症及血氧减少状态中的一种以上的病理乃至症状所引起的疾病。
附图说明
[图1]示出将杆菌属菌体粉碎提取物或其加热处理物添加于猪腿肉冻干粉末中而成的溶液的吸收光谱的图。
[图2]示出将杆菌属菌体粉碎提取物添加于猪腿肉冻干粉末中而成的溶液在保存中的580nm下吸光度(a580)经时变化的图。
[图3]示出杆菌属菌体粉碎提取物冻干粉末中的高铁肌红蛋白还原酶活性的图。
[图4]示出高铁肌红蛋白还原酶纯化过程中的通过deae色谱法得到的溶出图和高铁肌红蛋白还原酶活性的图。
[图5]示出高铁肌红蛋白还原酶纯化过程中的通过羟基磷灰石色谱法得到的溶出图和高铁肌红蛋白还原酶活性的图。
[图6]示出高铁肌红蛋白还原酶纯化过程中的通过凝胶过滤色谱法得到的溶出图和高铁肌红蛋白还原酶活性的图。
[图7]示出以比活性高的凝胶过滤组分为试样的sds-page结果的图。
[图8]比较在各纯化阶段得到的试样的比活性的图。
[图9]示出使用了纯化酶(二氢硫辛酰胺脱氢酶:dld)的食用肉显色试验结果的图。对酶量不同的试样进行比较。
[图10]示出使用了纯化酶(dld)的食用肉显色试验结果的图。按照nadh的有无进行比较。
[图11]示出纯化酶(dld)的速率法分析结果(底物饱和曲线)的图。
[图12]示出纯化酶(dld)的速率法分析结果([s]/v~[s]标绘)的图。
[图13]示出纯化酶(dld)的最适ph的图。
[图14]示出纯化酶(dld)的ph稳定性的图。
[图15]示出纯化酶(dld)的最适温度的图。
[图16]示出纯化酶(dld)的热稳定性的图。
[图17]示出纯化酶(dld)对nadh和nadph的反应性的图。
[图18]示出各种阳离子对纯化酶(dld)活性所造成的影响的图。
[图19]示出重组dld(无his标签)的高铁肌红蛋白还原活性的图。
[图20]示出重组dld(有his标签)的高铁肌红蛋白还原活性的图。
[图21]示出使用了重组dld的食用肉显色试验结果的图。r值、g值和b值为,阴性对照(左)为178、104和102,纯化重组dld(右)为210、104和114。
[图22]示出使用了重组dld的食用肉显色试验结果的图。r值、g值和b值为,试样1为201、117和123,试样2为185、121和105,试样3为217、97和93,试样4为160、108和83,试样5为156、84和65。
[图23]示出使用了重组dld的食用肉显色试验结果的图。r值、g值和b值为,试样1为168、122和106,试样2为185、152和145,试样3为172、123和119,试样4为187、153和144,试样5为173、148和123。
[图24]示出对dld以外的食用肉显色酶的纯化过程中的通过苯基色谱法得到的溶出图和高铁肌红蛋白还原酶活性的图。
[图25]示出对dld以外的食用肉显色酶的纯化过程中的通过羟基磷灰石色谱法得到的溶出图和高铁肌红蛋白还原酶活性的图。
[图26]示出对dld以外的食用肉显色酶的纯化过程中的通过cu亲和色谱法得到的溶出图和高铁肌红蛋白还原酶活性的图。
[图27]示出以通过羟基磷灰石色谱法得到的组分和通过cu亲和色谱法得到的组分为试样的sds-page结果的图。
[图28]示出重组苹果酸脱氢酶(malatedehydrogenase:mdh)和重组硝基还原酶(putativenad(p)hnitroreductase:yodc)的活性的图。从左侧起依次为yodc/pet20b/bl21(de3plyss)(枯草芽孢杆菌)、yodc/pet20b/bl21(de3plyss)(纳豆菌)、pet20b/bl21(de3plyss)(空白载体)、mdh/pet20b/bl21(de3plyss)(枯草芽孢杆菌)、mdh/pet20b/bl21(de3plyss)(纳豆菌)。
[图29]示出以重组mdh和重组yodc为试样的sds-page的结果的图。从左侧起依次为标记物、mdh/pet20b/bl21(de3plyss)(枯草芽孢杆菌)、yodc/pet20b/bl21(de3plyss)(枯草芽孢杆菌)、pet20b/bl21(de3plyss)、mdh/pet20b/bl21(de3plyss)(纳豆菌)、yodc/pet20b/bl21(de3plyss)(纳豆菌)、标记物。
[图30]示出使用了经纯化的重组yodc和重组mdh的食用肉显色试验的结果的图。
[图31]示出重组yodc的最适ph的图。
[图32]示出重组yodc的ph稳定性的图。
[图33]示出重组yodc的最适温度的图。
[图34]示出重组yodc的热稳定性的图。
[图35]示出重组yodc对nadph的反应性的图。
[图36]示出各种阳离子对重组yodc活性所造成的影响的图。
[图37]比较示出dld和yodc对铁氰化钾的反应性的图。
[图38]比较示出dld和yodc对肌红蛋白的反应性的图。
具体实施方式
(用语)
在本说明书中所谓“血红素”指由铁原子和卟啉构成的络合物(铁卟啉络合物)。所谓“血红素蛋白”是含有血红素的蛋白质的统称。另外,所谓“血红素还原酶”是指对血红素中的铁原子显示还原活性的蛋白质。该活性的强度(程度)无特殊限定。典型地表示血红素还原酶还原血红素蛋白的高铁化合物的活性。在关注此活性的情况下,也可将血红素还原酶称为血红素蛋白还原酶。
在本说明书中所谓“高铁肌红蛋白还原酶”是指显示出还原作为肌红蛋白衍生物的高铁肌红蛋白的活性的蛋白质。该活性的强度(程度)无特殊限定。因此,即使其它的酶活性占优,只要显示出对高铁肌红蛋白的还原活性,就相当于本说明书中的“高铁肌红蛋白还原酶”。
在本说明书中所谓“色调改善剂”指可用于改善金属卟啉络合物与其形成有关的“色调”的物质或组合物。作为金属卟啉络合物,存在铜卟啉络合物、钴卟啉络合物、铁卟啉络合物等,但只要是该卟啉络合物中的金属能够被还原的状态下的络合物,就无特殊限制。作为优选的金属卟啉络合物,可列举出铁卟啉络合物,作为含有该铁卟啉络合物的组合物,可列举出血红素蛋白。作为富含血红素蛋白的组合物,可列举出食用肉或食用肉加工品。
本发明的色调改善剂通过显色作用、显色促进作用和/或防褪色作用而改善对象的色调。例如,本发明的色调改善剂可通过还原金属卟啉络合物中的金属而改善色调。或者,可通过防止由金属卟啉络合物构成的色素的氧化而维持该色素的色调,并且可改善色调。本发明的色调改善剂得到适用的优选对象为食用肉或食用肉加工品。即,在优选的一个实施方式中,本发明的色调改善剂被用于食用肉或食用肉加工品的显色、维持色调或防止褪色。应予说明,所谓“食用肉的显色”是指显现出食用肉或食用肉加工品所特有的红色色调。
1.源自杆菌(bacillus)属的还原剂
本发明的第1方面涉及还原剂。本发明的还原剂以杆菌属产生的血红素还原酶为有效成分。如下述实施例所示,由本发明人所实施的大规模筛选的结果是明确了作为杆菌属微生物的枯草芽孢杆菌(bacillussubtilis)、解淀粉芽孢杆菌(bacillusamiloliquefaciens)、纳豆菌(bacillusnatto)、苏云金芽孢杆菌(bacillusthuringiensis)及蕈状芽胞杆菌(bacillusmycoides)产生高铁肌红蛋白还原活性优异的多肽。基于此见解,在本发明优选的一个实施方式中,可使用这些微生物中的任一种产生的高铁肌红蛋白还原酶。应予说明,这些微生物例如可从公共的保藏机构(nbrc(独立行政法人制品评价技术基盘机构生物遗传资源部门)、jcm(理化学研究所生物资源中心)、atcc(americantypeculturecollection,美国标准菌库)等)获取。关于纳豆菌,已有市售,可容易地获取。另外也可从宫城野纳豆菌制造所获取。
就本发明的还原剂而言,除了有效成分(多肽)以外,还可含有赋形剂、缓冲剂、混悬剂、稳定剂、ph调节剂、保存剂、防腐剂、香料、增稠剂、油脂、光亮剂、粘结剂、粘结增强剂、乳化稳定剂、生理盐水等。作为赋形剂,可使用淀粉、糊精、麦芽糖、海藻糖、乳糖、d-葡萄糖、山梨醇、d-甘露醇、白糖、甘油等。作为缓冲剂,可使用磷酸盐、枸橼酸盐、乙酸盐等。作为稳定剂,可使用丙二醇、抗坏血酸等。作为ph调节剂,可使用衣康酸、琥珀酸、酒石酸、富马酸、枸橼酸、苹果酸、己二酸、葡萄糖酸、焦磷酸、乙酸、乳酸、α-酮戊二酸、植酸等有机酸或有机酸盐;碳酸等无机酸或无机酸盐;天冬氨酸、谷氨酸等酸性氨基酸;精氨酸、赖氨酸、组氨酸等碱性氨基酸等。作为保存剂,可使用苯酚、苯扎氯铵、苯甲醇、氯丁醇、尼泊金甲酯等。作为防腐剂,可使用乙醇、苯扎氯铵、对羟基苯甲酸、氯丁醇等。作为香料,可使用麝香、麝猫香、海狸香、龙涎香等动物性香料;茴芹精油、当归精油、依兰精油、鸢尾精油、茴香精油、橙精油、卡南加精油、香菜精油、小豆蔻精油、愈创木精油、枯茗精油、山胡椒精油、桂皮精油、肉桂精油、天竺葵精油、苦配巴精油、芫荽精油、紫苏精油、雪松精油、香茅精油、茉莉精油、姜草精油、杉树精油、留兰香精油、欧薄荷精油、大茴香精油、晚香玉精油、丁香精油、橙花精油、鹿蹄草精油、妥鲁香胶精油、广藿香精油、玫瑰精油、马丁香精油、柏树精油、丝柏精油、白檀精油、苦橙叶精油、月桂精油、岩石草精油、佛手柑精油、秘鲁香胶精油、紫檀精油、香樟精油、蜜桔精油、桉树精油、酸橙精油、薰衣草精油、沉香精油、柠檬草精油、柠檬精油、迷迭香精油、日本薄荷精油等植物性香料;其它合成香料等。作为增稠剂,可使用天然高分子或者淀粉系或纤维素系天然高分子衍生物等。作为天然高分子,例如可列举出褐藻糖胶、卡拉胶等海藻提取物,瓜尔胶等种子粘出物,阿拉伯胶等树脂样粘着物,或黄原胶等微生物产生的粘着物质等。作为淀粉系或纤维素系天然高分子衍生物,例如可列举出磷酸淀粉等淀粉系或甲基纤维素等纤维素系的天然高分子衍生物。作为油脂,例如可使用鳄梨油、亚麻籽油、杏仁油、茴香油、紫苏油、橄榄油、橙油、橘棘鲷鱼油、可可脂、母菊油、胡萝卜油、瓢果油、椰子油、芝麻油、米糠油、红花油、乳木果油、液态乳木果油、大豆油、山茶油、玉米油、菜籽油、桃仁油、蓖麻油、葵花籽油、葡萄籽油、棉籽油、花生油、甲鱼油、水貂油、卵黄油、棕榈油、棕榈仁油、木蜡、椰子油、牛油、猪油等。另外,也可使用对这些油脂进行氢化、分级、酯交换等处理而改性的油脂。作为光亮剂,可使用蜂蜡、棕榈腊、鲸蜡、羊毛脂、液体羊毛脂、还原羊毛脂、硬质羊毛脂、小烛树蜡、蒙旦蜡、虫胶蜡、米糠蜡、角鲨烯、角鲨烷、姥鲛烷等蜡类(植物性、动物性不限);液体石蜡、凡士林、石蜡、地蜡、纯地蜡、微晶蜡等矿物油。作为粘结剂,可使用大豆蛋白、卵蛋白、乳蛋白、血液蛋白、酪蛋白、淀粉、转谷氨酰胺酶等。作为粘结增强剂,可使用聚磷酸盐等。作为乳化稳定剂,可使用酪蛋白钠等。作为其它添加剂,还可含有月桂酸、肉豆蔻酸、棕榈酸、硬脂酸、山嵛酸、油酸、亚油酸、亚麻酸、二十二碳六烯酸、二十碳五烯酸、12-羟基硬脂酸、十一烯酸、妥尔油、羊毛脂脂肪酸等天然脂肪酸;异壬酸、己酸、2-乙基丁酸、异戊酸、2-甲基戊酸、2-乙基己酸、异戊酸等合成脂肪酸等的脂肪酸。
在一个实施方式中,本发明的还原剂由产生本发明所涉及的多肽的微生物的菌体粉碎物构成。即,该实施方式的还原剂含有规定的微生物的菌体粉碎物。可将菌体粉碎液(通常通过由微生物的培养、集菌和菌体粉碎构成的一系列工序获得)直接作为菌体粉碎物使用。另一方面,也可在将菌体粉碎液供于进一步的处理(纯化处理、冷冻处理、干燥处理、其它成分的添加等)后作为菌体粉碎物使用。
通过本发明人等的研究判明了源自杆菌属微生物的有效成分(显示还原作用,对改善食用肉的色调特别有效的物质)为二氢硫辛酰胺脱氢酶(dld)和硝基还原酶(yodc)(参照下述的实施例)。因此,作为本发明的一个实施方式,提供含有源自杆菌属微生物的二氢硫辛酰胺脱氢酶或硝基还原酶作为血红素还原酶的还原剂。在优选的一个实施方式中,含有二氢硫辛酰胺脱氢酶和硝基还原酶的两者。应予说明,将二氢硫辛酰胺脱氢酶的氨基酸序列表示为序列号3。同样将硝基还原酶的氨基酸序列表示为序列号12。
如上所述,由于确定了有效的血红素还原酶,并且确认了其氨基酸序列,所以可使用通过遗传工程学制备的酶。因此,在本发明的一个实施方式中使用通过遗传工程学制备的酶,即由重组蛋白构成的血红素还原酶。具体而言,提供以重组二氢硫辛酰胺脱氢酶和/或重组硝基还原酶为有效成分的还原剂。应予说明,所谓重组蛋白是指通过基因重组技术而人工制造的蛋白质。
2.还原剂的用途
本发明的第2方面涉及本发明的还原剂的用途。本发明所提供的用途大致分为色调的改善和其它用途。前者的用途,即作为色调改善剂的使用是特别重要的。金属卟啉络合物与其色调的形成有关的物质是利用本发明改善色调的对象。作为优选的对象,可列举出食用肉和食用肉加工品。食用肉的色调反映存在于肉中的肌红蛋白衍生物的比例。如上所述,本发明的还原剂以血红素还原酶(优选高铁肌红蛋白还原酶)为有效成分。因此,若使本发明的还原剂作用于食用肉,则食用肉中的高铁肌红蛋白被还原,生成还原型肌红蛋白。还原型肌红蛋白通过氧化被转化成显示鲜红色色调的氧合肌红蛋白。若使本发明的还原剂进行作用,则食用肉或食用肉加工品中的高铁肌红蛋白量降低,同时生成氧合肌红蛋白,结果色调得到改善。另外,可防止还原型肌红蛋白或氧合肌红蛋白的氧化,作为其结果,还可期待能够防止食用肉褪色的效果。这样,根据本发明的还原剂,不仅显色,而且可发挥维持色调,即防止褪色的效果。发挥防腿色效果时的作用对象为金属卟啉络合物,只要是该络合物中的金属能够被氧化的络合物,就无特殊限制。优选的金属卟啉络合物为铁卟啉络合物。因此,期待防腿色效果时的优选对象为含有铁卟啉络合物的血红素蛋白。最优选的对象为含有还原型肌红蛋白或氧合肌红蛋白以及上述2种肌红蛋白(还原型肌红蛋白、氧合肌红蛋白)中的任一种/或两者的食用肉或食用肉加工品。
在将本发明的还原剂用于改善食用肉或食用肉加工品的色调时(即使用本发明的还原剂作为色调改善剂的色调改善方法),应使用本发明的还原剂处理食用肉或食用肉加工品。处理条件原则上设为构成还原剂的肌红蛋白还原酶良好地发挥作用的条件(优选最适条件)即可。优选的处理条件可通过使用了作为处理对象的食用肉或食用肉加工品的预试验而容易地确定乃至设定。以下示出处理方法的具体实例(将菌体粉碎液用于改善食用肉的色调的情况)。首先,准备规定的微生物(产生高铁肌红蛋白还原酶的杆菌属微生物)的菌体粉碎液,将ph调整至5.5附近。这是为了重现肉中的ph。接着,于4℃下与食用肉接触。作为接触方法,通常有对于肉块注射混悬液进行滚揉、对于肉末混合混悬液等的方法。通过进行合适的接触方法,混悬液浸透食用肉整体。对于处理温度而言,虽然在40℃附近也可显色,但若考虑食用肉的品质,则优选在4℃或4℃附近进行。
作为处理对象的食用肉的种类无限制。如上所述,食用肉的色调反映存在于肉中的肌红蛋白衍生物的比例。本发明的还原剂对食用肉中的肌红蛋白衍生物的比例造成影响,促进显色。因此,可对全部含有肌红蛋白的食用肉或食用肉加工品应用本发明。具体而言,可将猪肉、牛肉、鸡肉等畜肉或它们的加工品,或者金枪鱼、鲣鱼、鲑鱼等鱼肉或它们的加工品作为处理对象。但是,呈红色的食用肉可以说是优选的处理对象。作为处理对象之一的食用肉加工食品只要是以食用肉为原料制造的食品就无特殊限定。作为食用肉加工品,例如可列举出生火腿、香肠、烤火腿。对于作为处理对象的食用肉或食用肉加工品的形状亦无特别限制。可根据用途适宜选择肉块、肉末等。
在本发明的一个实施方式中,将本发明的还原剂与显示将肌红蛋白的血红素基中的铁置换成锌的作用的物质(以下称“铁-锌置换物质”)合用。这样,若将本发明的还原剂与作用不同的物质合用,则色调可因复合效果而得到进一步改善。特别是也关系到良好的色调维持、防褪色。作为铁-锌置换物质,例如可使用亚铁螯合酶(详情参照日本特开2006-61016号公报)。亚铁螯合酶存在于动物组织(特别是内脏)、植物组织(蘑菇类、豆芽、豌豆等)、酵母(面包酵母、啤酒酵母、清酒酵母、葡萄酒酵母、烧酒酵母等)、细菌等中。可使用从这些天然物质提取的亚铁螯合酶。另外,由于线粒体组分中富含亚铁螯合酶,所以特别优选使用线粒体组分。作为铁-锌置换物质,也可使用酵母菌属酵母(啤酒酵母、面包酵母、清酒酵母、烧酒酵母等)(详情参照日本特开2005-87058号公报)。
该实施方式的特征在于将本发明的还原剂与铁-锌置换物质组合使用。代表性地以混合本发明的还原剂和铁-锌置换物而成的配合剂的方式,提供本发明的色调改善剂。另一方面,例如也能够以由本发明的还原剂(第1构成要素)和含有铁-锌置换物质的制剂(第2构成要素)构成的试剂盒的方式,提供本发明的色调改善剂。在此情况下,将处理对象(食用肉或食用肉加工品)用第1构成要素和第2构成要素同时或分别进行处理。这里的“同时”并非要求严密的同时性。因此,将两种要素混合后使用等在两种要素的使用无时间差的条件下实施的情况自不必说,使用一方后迅速使用另一方等在两种要素的使用无实质的时间差的条件下实施的情况也包含在这里的“同时”的概念中。
在将本发明的还原剂用于色调改善剂时,除了有效成分(多肽)和上述添加剂(赋形剂、缓冲剂、混悬剂、稳定剂、ph调节剂、保存剂、防腐剂、香料、增稠剂、油脂、光亮剂、粘结剂、粘结增强剂、乳化稳定剂、生理盐水等)以外,还可使用调味料、香辛料、掩蔽剂、软化剂等。作为调味料,可使用酱油、酱、醋、酒、料酒、盐、鲣鱼或昆布等的汤汁、肉提取物、蔬菜提取物等。作为香辛料,可使用胡椒、月桂、百里香、丁香、牛至、八角、花椒、鼠尾草、欧芹、肉豆蔻、芥末、姜、肉桂、罗勒、辣椒、迷迭香、留兰香、柠檬草、龙蒿、细叶芹、小豆蔻、枯茗、芫荽、莳萝、茴香、马郁兰、多香果等。作为掩蔽剂,可使用蔗糖、环糊精等糖类;丁香、多香果、月桂、肉桂、肉豆蔻等草本类等。作为软化剂,可使用蛋白酶、胰蛋白酶、糜蛋白酶、番木瓜蛋白酶、菠萝蛋白酶、无花果蛋白酶等蛋白分解酶等。
本发明的还原剂也可用于食用肉以外的领域。可以为了含有肌红蛋白以外的血红素蛋白(例如血红蛋白)的组合物的还原或抗氧化(包括防褪色)的目的而使用本发明的还原剂。
本发明的还原剂也可期待在血红蛋白浓度的测定、血红蛋白血症的治疗中的应用。即,本发明的还原剂也可用作试剂或医药品的有效成分。目前,作为血中血红蛋白浓度的测定方法,常用氰化高铁血红蛋白法。在该方法中,在使铁氰化钾和氰化钾的混合物作用于高铁血红蛋白而制成氰化高铁血红蛋白的基础上,利用比色定量法测定。若使用本发明的还原剂,则作为替代该方法的方法,可测定血中等的高铁血红蛋白量或总血红蛋白量。
高铁血红蛋白血症是因高铁血红蛋白由于某种原因在体内过量蓄积,导致使体内成为缺氧状态而发病的。作为对高铁血红蛋白血症的治疗方法,亚甲蓝的静脉注射被认为最有效。但是,在并发氰中毒的情况下由于会促进氰中毒而无法使用亚甲蓝。作为其它治疗方法,包括抗坏血酸的口服给药、静脉注射(也可与核黄素联合给药),但所有方法均效果不大。本发明的还原剂能够提供替代以往治疗方法的新的治疗策略。使用了本发明的还原剂的治疗方法也可对无法使用亚甲蓝的患者(并发氰中毒的人员等)应用。另外,亚甲蓝对葡萄糖-6-磷酸脱氢酶(g6pd)缺乏者无效。g6dp缺乏症之类的可见戊糖磷酸途径异常的患者对该方法不应答而必须接受紧急输血。
g6dp缺乏症是世界上最通常的损伤之一。美国黑人男性中实际上约10%患病。另外,确认非洲人和地中海沿岸居民中也有大量的患病者。因此,相当数量的受试者存在(氧化性)药物诱发性高铁血红蛋白血症的危险性。亚甲蓝本身对这样的患者给药无效(由于他们的g6pd缺乏症引起nadph不足的缘故),甚至存在反效果的可能性。本发明的还原剂还可期待对此类患者的效果。
本发明的还原剂能够发挥因心搏数、血压、心搏出量异常所致的心脏负荷的减轻以及各组织代谢的亢进等药理作用以及生理作用。含有本发明的还原剂的医药品例如可期待在各组织的需氧量高的生理条件下,例如剧烈的劳动、运动等环境下,作为改善生物体耐久力的耐久力改善剂的用途。此外,也可将本发明的医药品应用于心功能不全、心肌病、心肌炎、心肌梗塞、心包炎、心包心肌炎(perimyocarditis)、一过性缺血发作、冠状动脉性心脏病、具有左-右脉分流的先天性异常(vitia)、法乐氏四联症/五联症、艾森门格综合征、休克、末梢缺血、动脉阻塞性疾病(aod)、末梢aod(paod)、颈动脉狭窄、肾动脉狭窄、脑的微循环系统障碍(小动脉硬化)、脑内出血、脑的静脉血栓形成和颅内静脉窦血栓形成、血管发育不良、蛛网膜下腔出血、血管性痴呆、宾斯旺格(biswanger)病、动脉硬化性皮层下脑病、伴有栓塞的多发性皮质梗死、血管炎、糖尿病性视网膜病、由各种原因导致的贫血(anaemia)的预后(再生障碍性贫血、骨髓发育不良综合征、真性红细胞增多症、巨幼红细胞性贫血、缺铁性贫血、肾性贫血、球形红细胞症(sphaerocytosis)、溶血性(haemolytic)贫血等)、地中海贫血(thalassaemia)、异常血红蛋白病、葡萄糖-6-磷酸脱氢酶缺乏症、输血疾病、rh(rhesus)不相容性、疟疾、瓣膜成形(valvuloplasty)、急性出血后贫血、脾功能亢进综合征、肺纤维化、气肿、肺水肿(oedema):ards、irds或复发性肺气肿、热灼伤、心绞痛、冬眠等缺血性疾病等,血液循环障碍、低氧症或血氧减少状态的预防或治疗,或伴有这些病理乃至症状或由这些病理乃至症状所引起的疾病的预防或治疗。
为了将氧供给至缺血组织而防止缺血性细胞损伤(并且保护组织免受再灌注障碍),也可在缺血性事件发生前、发生过程中和/或发生后给予本发明的医药品。也可在给予本发明的医药品的同时给予血管活性氧运输体(例如基于血红蛋白的氧运输体)。由于因例如外科脉管重建(例如经皮冠状动脉脉管重建)、移植、急性心肌梗死、血管成形术(经皮冠状动脉血管成形术等)所引起的急性缺血以及随后的再灌注和释放自由基的缘故,可将本发明的医药品和血管活性载体(基于血红素蛋白的氧运输体等)与气态一氧化氮组合,或在应用气态一氧化氮后对哺乳动物给予本发明的医药品和血管活性载体,从而发挥所期望的治疗效果。通过本说明书中记载的方法所治疗的哺乳动物在治疗前可患有缺血性心脏病,也可患有急性缺血性病理(例如心肌梗塞、脑卒中或肾缺血),亦或脏器(脑、心脏、肾脏、肝脏、胃肠道等)可显示血管痉挛。
为了治疗作为包括在循环系统的一部分或整体中通过的红细胞流量降低、贫血和脑卒中的各种原因的结果所产生的脊椎动物内低氧组织,也可使用本发明的医药品。另外,为了防止脊椎动物体内组织缺氧的目的,也可预防性地使用本发明的医药品。进而,因治疗或预防由部分动脉堵塞或微循环中的部分阻断所产生的低氧症的目的,也可应用本发明的医药品。就血红蛋白的给药而言,可参考美国专利申请第08/409,337号说明书。
本发明的医药品的给药量、给药期间无特殊限制。可根据给药形态、年龄、体重、症状等适宜选择。
本发明的医药品的给药对象无限制。作为给药对象,除人以外,可列举出人以外的哺乳动物(包括宠物动物、家畜、实验动物。具体而言例如猴、小鼠、大鼠、豚鼠、仓鼠、猴、牛、猪、山羊、绵羊、马、鸡、羊、鲸、海豚、犬、猫等)。治疗对象在本发明的医药品给药前、给药过程中和/或给药后可以是正常血液量,也可以是血液量过多,亦或可以是血液量过少。
本发明的医药品的给药方式无特殊限制。可通过经口或非经口中的任一给药方法给药。本说明书中使用的通过“非经口”的给药无特殊限定,例如可列举出静脉内、肌肉内、动脉内、骨髓腔内、囊内、眼窝内、心脏内、皮内、腹腔内、经皮气管内、皮下、表皮下、关节内、包膜内、蛛网膜下、骨髓腔内及胸骨内注射以及注入。作为优选的给药方法,可采用静脉内注射。
作为适合经口给药的制剂的实例,例如可列举出片剂、胶囊剂、散剂、微粒剂、颗粒剂、液体制剂和糖浆剂。作为适合非经口给药的制剂,例如可列举出注射剂、栓剂、吸入剂、贴剂等。本发明的医药品可根据需要添加药理学、制剂学上可容许的添加剂来制造。作为药理学、制剂学上可容许的添加剂的实例,例如可列举出赋形剂、崩解剂乃至崩解助剂、粘结剂、润滑剂、包衣剂、色素、稀释剂、基质、溶解剂乃至助溶剂、等张剂、ph调节剂、稳定剂、抛射剂和粘合剂。
适合口服给药或非口服给药的制剂中可添加葡萄糖、乳糖、d-山梨醇、d-甘露醇、淀粉、高岭土、木糖醇、糊精、玉米淀粉、马铃薯淀粉、羟丙基纤维素或结晶纤维素等赋形剂;羧甲基纤维素、淀粉或羧甲基纤维素钙等崩解剂或崩解助剂;羟丙基纤维素、羟丙基甲基纤维素、聚乙烯吡咯烷酮或明胶等粘结剂;轻质无水硅酸、合成硅酸铝、硬脂酸、硬脂酸钙、硬脂酸镁或滑石粉等润滑剂;羟丙基甲基纤维素、白糖、聚乙二醇或氧化钛等包衣剂;凡士林、液体石蜡、聚乙二醇、明胶、高岭土、甘油、纯化水或硬化油脂等基质;氟利昂、乙醚或压缩气体等抛射剂;聚丙烯酸钠、聚乙烯醇、甲基纤维素、聚异丁烯、聚丁烯等粘合剂;棉布或塑料片等基布等的制剂用添加剂等。适合注射用的制剂中可添加注射用蒸馏水、生理盐水、丙二醇等水性或能够构成用时溶解型注射剂的溶解剂或助溶剂,葡萄糖、氯化钠、d-甘露醇、甘油等等张剂;有机酸(衣康酸、琥珀酸、酒石酸、富马酸、枸橼酸、苹果酸、己二酸、葡萄糖酸、焦磷酸、乳酸、α-酮戊二酸、植酸等)或这些有机酸的盐、无机酸(碳酸等)或这些无机酸的盐、酸性氨基酸(天冬氨酸、谷氨酸等)、碱性氨基酸(精氨酸、赖氨酸、组氨酸等)等ph调节剂;利多卡因等镇痛剂等添加剂。
本发明的医药品的典型作用对象之一是血红蛋白,但这里的血红蛋白无特殊限定。可以是天然(未修饰)的血红蛋白,通过基因操作修饰的血红蛋白,通过分子内或分子间交联、聚合或化学基团(例如聚烯烃氧化物、聚乙二醇、超氧化物歧化酶、或其它加成物)的加成等化学反应修饰的血红蛋白。本发明的医药品也可应用于上述血红蛋白以外的血红素蛋白。另外,还可应用于结构与上述血红素蛋白类似的金属卟啉络合物。
3.还原剂的制造方法
本发明的还一方面提供本发明的还原剂的制造方法。在本发明的制造方法中进行以下步骤:将产生血红素还原酶、优选高铁肌红蛋白还原酶的杆菌属微生物在产生该酶的条件下培养的步骤(步骤(1)),和从培养产物回收上述酶的步骤(步骤(2))。
作为步骤(1)的杆菌属微生物,可使用选自枯草芽孢杆菌、解淀粉芽孢杆菌、纳豆菌、苏云金芽孢杆菌、蕈状芽胞杆菌中的任一种微生物。培养方法和培养条件只要是可产生目标酶的方法和条件,就无特殊限定。即,可在产生显示血红素还原活性的多肽的条件下,适宜设定适合培养所使用的微生物的方法、培养条件。以下,作为培养条件例示出培养基、培养温度及培养时间。
作为培养基,采用所使用的微生物可生长的培养基。例如,可使用如下培养基:添加了阿拉伯糖、木糖、葡萄糖、果糖、半乳糖、蔗糖、龙胆二糖、可溶性淀粉、甘油、糊精、糖浆、有机酸等碳源,进而添加了硫酸铵、碳酸铵、磷酸铵、乙酸铵;或者可使用如下培养基:添加了玉米麸粉、大豆粉、酪蛋白氨基酸、咖啡渣、棉籽油渣、蛋白胨、酵母提取物、玉米浆、酪蛋白水解物、麦糠、肉汁等氮源,进而添加了钾盐、镁盐、钠盐、磷酸盐、锰盐、铁盐、锌盐等无机盐。为了促进所使用的微生物的生长,可在培养基中添加维生素、氨基酸等。培养基的ph调整至例如约3~8、优选约5~7左右,培养温度通常为约10~50℃、优选约25~35℃左右,在需氧条件下培养1~15日、优选3~7日左右。作为培养方法,例如可利用静置培养、振荡培养法、使用发酵罐的需氧深部培养法。
在以上条件下培养后,从培养产物回收目标酶(步骤(2))。代表性地在从培养产物收集菌体的操作(步骤(2-1))之后,制备菌体粉碎物(步骤(2-2))。菌体的收集可利用离心处理、过滤器过滤等。在使用固体培养基的情况等含有菌体以外的固体成分的情况下,可预先除去该固体成分。菌体粉碎物的制备可利用使用弗氏压碎器(frenchpress)或戴诺磨(dyno-mill)的机械粉碎处理、超声波处理、冷冻粉碎处理等。在之后进行的冷冻处理、干燥处理、冻干处理等之际发生菌体粉碎的情况下,也可不设置菌体粉碎专用的工序。所制备的菌体粉碎物可直接(即未实施特别的处理)或经追加处理后用作本发明的还原剂。这里的“追加处理”的实例是浓缩(利用超滤膜的浓缩等)、纯化(盐析、各种色谱法等)、添加其它成分、稀释及干燥。作为追加处理,也进行两种以上的处理。最终的形态可以为液体状,也可以为固体状(包括粉体状)。
实施例
为了找出改善食用肉色调的物质,以杆菌属微生物为中心实施了筛选。以下从根据筛选的结果中示出涉及被期待高有用性的微生物株的实验的结果。
1.枯草芽孢杆菌、解淀粉芽孢杆菌、纳豆菌、苏云金芽孢杆菌、蕈状芽胞杆菌的冻干粉末的制备
将10ml的如表1所示的液体培养基分注于试管中,于120℃下灭菌20分钟。作为预培养,分别在上述试管中接种1接种环的枯草芽孢杆菌(bacillussubtilisjcm1465株(=atcc6051株、iam12118株、ifo13719株))、解淀粉芽孢杆菌(bacillusamyloliquefaciensnbrc15535株(=atcc23350株))、纳豆菌(bacillusnatto)、苏云金芽孢杆菌(bacillusthuringiensisnbrc13865株(=atcc13366株))、蕈状芽胞杆菌(bacillusmycoidesiam1190株(=ifo3039株)),于30℃、300rpm下振荡培养1晚。
[表1]
接着,将100ml的如表1所示的液体培养基分注于300ml三角烧瓶中,于120℃下灭菌20分钟,作为主培养基。作为主培养,接种1ml的上述预培养液,于30℃、200rpm下振荡培养一晚。将主培养液于5000rpm下离心分离5分钟,得到菌体。将得到的菌体用30ml的20mm磷酸缓冲液(ph7.5)清洗1次,混悬于30ml的20mm磷酸缓冲液(ph7.5)中。将得到的混悬液于-40℃下冷冻24小时。接着,进行冻干(20℃、24小时),得到冻干粉末(菌体通过冻干处理被粉碎)。
2.食用肉显色试验1
将0.1g的上述冻干粉末用50μl的0.5m磷酸缓冲液(ph5.5)溶解。接着,将上述粉末溶解液、50μl的4%(w/v)肌红蛋白与2g的猪腿肉末混合,脱气密封,于4℃下放置17小时。从视觉上观察肉的红色变化(显色度)。作为对照试验,对未添加粉末溶解液的试样和将粉末溶解液煮沸处理10分钟而得的试样也进行同样的试验。将其结果示出于表2中。应予说明,将用粉状毕赤酵母(pichiafarinoseiam12223株(=ifo0465株、jcm1634株))的冻干粉末溶解液进行处理时的结果(仅未处理的数据)也一并示出。
[表2]
++:强显色,+:显色,-:未显色
如上所述,可见供试菌株(枯草芽孢杆菌、解淀粉芽孢杆菌、纳豆菌、苏云金芽孢杆菌、蕈状芽胞杆菌)的冻干粉末具有食用肉显色效果。枯草芽孢杆菌和纳豆菌的效果特别高。应予说明,对于将培养后的菌体用弗氏细胞压碎器粉碎得到的试样,也确认了同样的食用肉显色效果(数据未示出)。
3.食用肉的显色试验2
将10mg的上述冷冻粉末(枯草芽孢杆菌的菌体粉碎物)用100μl的0.5m磷酸缓冲液(ph5.5)溶解。向该溶解液中添加10mg的猪腿肉末冻干粉末、30μl的4%(w/v)肌红蛋白、30μl的0.2mnadh、400μl的灭菌水,于室温下放置30分钟。接着,将反应液于15000rpm下离心分离15分钟,回收上清。使用分光光度计测定得到的上清在700nm至400nm波长下的吸收光谱。作为对照试验,对于将粉末溶解液煮沸处理10分钟而得的试样,也进行同样的试验。将其结果示出于图1中。由结果可知,未处理试样在545nm和580nm有极大吸收,呈红色。
4.食用肉显色试验3
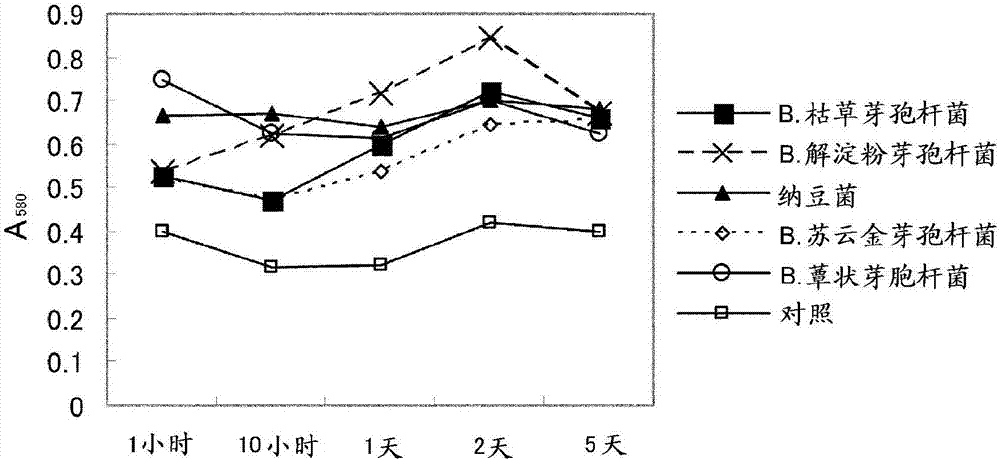
根据如3.所示的方法,使用在1.中制备的各种冻干粉末进行食用肉显色试验。作为对照,对未添加粉末溶解液的试样也进行同样的试验。将各种试样在580nm波长下的吸光度示出于图2中。可知经试验的所有试样在5日后均比对照显色强。
5.高铁肌红蛋白还原酶活性的测定方法
高铁肌红蛋白还原酶活性如下测定。首先,将在1.中制备的各种冻干粉末用水溶解成10mg/ml,制成酶溶液。接着向200μl的0.1m磷酸缓冲液(ph5.5)中添加100μl的0.1%(w/v)肌红蛋白和150μl的酶溶液,于30℃下预孵育5分钟。然后添加50μl的1mmnadh,测定5分钟内的406nm波长下的吸光度变化。活性以单位(u)表示。将在本条件下于1分钟内使相当于1μm的高铁肌红蛋白还原的酶量设为1u。应予说明,为了进行比较,对粉状毕赤酵母(pichiafarinoseiam12223株(=ifo0465株、jcm1634株))的冻干粉末也调查酶活性。
将测定结果示出于图3中。显示食用肉显色效果的冻干粉末均显示出高的高铁肌红蛋白还原酶活性。由该结果启示,供试菌株(枯草芽孢杆菌、解淀粉芽孢杆菌、纳豆菌、苏云金芽孢杆菌、蕈状芽胞杆菌)产生高铁肌红蛋白还原酶,以及显色效果是由该酶的作用产生的效果。
6.高铁肌红蛋白还原酶的纯化
高铁肌红蛋白还原酶如下纯化。将在1.中培养得到的枯草芽孢杆菌菌体用弗氏细胞压碎器粉碎离心后,将上清用硫酸铵盐析。在30%的饱和状态下进行处理,取上清,在70%的饱和状态下进行处理,离心后,回收沉淀物。使其溶于20mm的kpb(ph6.0)溶液中,将透析而得的成分作为硫酸铵盐析试样。
将5ml的得到的硫酸铵盐析试样提供给以下条件的deae色谱法(deae柱(hitraptmdeaeff(5ml),gehealthcare))。其结果是,蛋白收率为45.4%。
担体:deaehp(5ml)
进样:硫酸铵盐析试样(5ml)
bufa:20mmkpb(ph6)
bufb:20mmkpb(ph6),1mnacl
流速:5ml/分钟
分级:5ml
程序:(1)bufa清洗8cv,(2)bufb10%清洗8cv,(3)bufb梯度30%/25cv,(4)bufb100%8cv
将通过上述deae色谱法得到的溶出图和高铁肌红蛋白还原酶活性示出于图4中。应予说明,就活性而言,确认作为高铁肌红蛋白的极大吸收的a406减少。jiang在图4的组分中活性特别高的deaefr.no.61-63经以下条件的羟基磷灰石色谱法(羟基磷灰石柱(1×5cm)(typel20μm,bio-rad))分别纯化。通过羟基磷灰石色谱法得到的deaefr.no.61-63的蛋白收率为98.5%。
(羟基磷灰石色谱法条件)
担体:羟基磷灰石(5ml)
进样:deae纯化fr.no.61-63
bufa:5mmkpb,0.3mnacl(ph6)
bufb:400mmkpb,0.3mnacl(ph6)
流速:1ml/分钟
分级:4ml
程序:(1)bufa清洗7cv,(2)bufb梯度100%/20cv,(3)bufb100%10cv
将deaefr.no.61-63提供给羟基磷灰石色谱法而得到的溶出图和高铁肌红蛋白还原酶活性示出于图5中。将在图5中比活性特别高的hyapafr.no.19用20mmkpb(ph6)透析后,提供给以下条件的凝胶过滤色谱法(凝胶过滤柱(superdextm75,gehealthcare))。
(凝胶过滤色谱法条件)
担体:superdex200(120ml)
进样:hyapafr.no.19
bufa:20mmkpb(ph6)
流速:1ml/min
分级:5ml
将hyapafr.no.19提供给凝胶过滤色谱法而得到的溶出图和高铁肌红蛋白还原酶活性示出于图6中。进而,将在图6中比活性特别高的包括凝胶过滤fr.no.13-15的凝胶过滤fr.no.12-16提供给sds-page,确认条带(图7:凝胶过滤fr.no.12-16)。关于图7的凝胶过滤fr.no.13-15,得到单条带。
对于通过上述纯化工序(deae色谱法、羟基磷灰石色谱法、凝胶过滤色谱法)得到的各种组分,将比活性示出于图8中。deae.fr.no.61-63进行至凝胶过滤为止,比活性提高至约20.7倍。
7.高铁肌红蛋白还原酶的氨基酸序列的确定
对于通过图7的sds-page得到的单条带,转印于pdvf膜上,用丽春红试剂染色后,进行切出,用蛋白测序仪进行n末端氨基酸序列分析。结果发现n末端氨基酸序列为vvgdfpietdtlvig(序列号1)。进而,基于该氨基酸序列,从blast内的枯草芽孢杆菌数据库检索该基因。结果发现与编码二氢硫辛酰胺脱氢酶(dehydrolipoyldehydrogenase,以下记为dld)的pdhd(序列号2)具有100%的同源性。应予说明,将dld的氨基酸序列示出于序列号3。
8.利用dld的食用肉显色试验
对纯化过的dld进行食用肉显色试验。使用纯化过的dld的冷冻粉末试样,如下制备食用肉试样(表3),于4℃下保存一晚后进行比较(图9、图10)
[表3]
在图9中一并示出酶量不同的食用肉试样(食用肉试样1~4)。这样可知dld有助于改善食用肉的色调。图10是比较因nadh的有无导致的食用肉色调的图(从左侧起为无冷冻粉末(食用肉试样1)、有nadh(食用肉试样2)、无nadh(食用肉试样5))。确认即使无nadh,也可充分显色。认为是由于食用肉中含有足够的nadh的缘故。
9.dld的酶学性质
使用与本酶具有高亲和性的铁氰化钾作为底物,研究各种性质。首先确认dld的底物反应性。将酶添加量设定为15μl,使底物浓度(终浓度)达到0.025、0.05、0.075、0.1、0.15、0.2、0.3、0.4、0.5、0.6、0.7、0.8、1.0、1.25、1.5、1.75、2.0、2.5(mm),在30秒钟的测定时间下进行速率法分析(rateassay)(ph=6.0)。铁氰化钾的摩尔吸光系数为1.02×103(m-1·cm-1),速率(v)的单位使用μm/分。将结果示出于图11、图12中。由图11的底物饱和曲线上升来制作[s]/v~[s]标绘(图12),算出动力学参数(kineticparameter)(km=0.19(mm),vmax=26.2(μm/分))。作为比较,将与铁氰化钾的亲和性高的其它来源的黄递酶(diapholase)的km值示出于表4中。由表4可知,由枯草芽孢杆菌得到的dld对铁氰化钾的亲和性高于源自梭状芽孢杆菌(c.kluyveri)的dld。
[表4]
如下测定dld的最适ph。使用将0.5m的各种ph缓冲液(枸橼酸缓冲液(ph=3.0~6.0)、磷酸钾缓冲液(kpb)(ph=6.0~8.0)、tris-盐酸缓冲液(ph=8.0~10.0))50μl稀释10倍(50mm)而成的稀释液、将4mm铁氰化钾溶液稀释10倍(400μm)而成的稀释液50μl、50μl的酶试样、250μl的milliq水,于30℃下孵育5分钟后,添加100μl的1mmnadh溶液,确认a420下的吸光度变化。将结果示出于图13中。
接着,如下研究dld的ph稳定性。将20μl的酶试样、20mm的各种ph缓冲液(枸橼酸缓冲液(ph=3.0~6.0)、磷酸钾缓冲液(kpb)(ph=6.0~8.0)、tris-盐酸缓冲液(ph=8.0~10.0))180μl混合,放置30分钟,使之反应,将得到的反应物作为ph处理试液。将150μl的如此得到的ph处理试液、100μl的0.5m枸橼酸缓冲液(ph=6.0)、100μl的milliq水混合,在冰中保存一晚。向350μl的如此得到的保存液中添加50μl的4mm铁氰化钾,于30℃孵育5分钟后,添加100μl的1mmnadh溶液,每秒测定a420下的吸光度变化,测定30秒(应予说明,将未进行ph处理的试样设为活性100%)。将结果示出于图14中。虽然低ph侧的稳定性不足,但由于肉中的ph为ph5~6,所以认为即使在肉中也有足够的活性。
如下测定dld的最适温度。将50μl的0.5m枸橼酸缓冲液(ph6)、50μl的2mm铁氰化钾、100μl的milliq水和100μl的1mmnadh混合,向于各种温度下预孵育5分钟而得到的混合物中添加200μl的酶试样,测定5分钟内的a420下的吸光度变化,从而对反应进行确认。将结果示出于图15中。由此可以确认最适温度为40℃,于50℃下失活。
进而,对热稳定性进行如下测定。对预先将酶试样于各种温度(30℃、40℃、60℃)下处理30分钟而得的处理物进行冰冷却,制备处理试样。向30μl的此处理试样中加入50μl的0.5m枸橼酸缓冲液(ph6.0)、50μl的2mm铁氰化钾和270μl的milliq水,于30℃孵育5分钟后,添加100μl的1mmnadh溶液,每隔1秒测定30秒内的a420下的吸光度变化。通过图16的结果可以确认即使在60℃下仍有高的残存活性。
接着,对与nadh和nadph的反应性进行比较。将50μl的0.5mkpb(ph5.5)、100μl的纯化dld和100μl的0.1%mb混合后,用milliq水制成400μl,于30℃下预孵育5分钟。然后,添加50μl的1mmnadh或nadph,监测5分钟内的a406。在将nadh的相对活性设为100(%)的情况下的反应性如图17所示。可知dld相对于nadph的反应性低。
另外,验证金属盐(金属阳离子)对dld活性所造成的影响。将100μl的500mmkpb(ph5.5)、200μl的0.1%(=13.4μm)mb、150μl的纯化dld、10μl的100mm阳离子(cacl2、mgcl2、fecl3、sncl2、cuso4、fecl2、mnso4、cdcl2、zncl2、nacl、kcl、sds、edta)和100μl的1mmnadh,将向其中加入纯化水至达到1ml而得的混合物作为试样,求出相对活性。在ca+、mg2+和k+方面可见活性提高(图18)。
10.dld的大量表达系统
由枯草芽孢杆菌取得dld基因,为了用大肠杆菌构建大量表达系统而进行研究。
10-1.由枯草芽孢杆菌7417株开始的基因组提取
由枯草芽孢杆菌7417株开始的基因组提取如下进行。将枯草芽孢杆菌7417株接种于含有0.5%蛋白胨、1.0%酵母提取物、1.0%葡萄糖的液体培养基(ph6.5)中,于30℃、300rpm下振荡培养一晚。使用qiaquicktmgelextractiontestkit(qiagen公司制造)来从得到的培养物进行基因组dna的提取。
10-2.基于pcr的dld基因的扩增
基于pcr的dld基因扩增如下进行。将5μl的10×缓冲液、4μl的dtnp、1μl的枯草芽孢杆菌基因组、各5μl的以下10μm引物(2种)、0.1μl的ex.taq(dna聚合酶,takarabio公司制造)混合,向其中加入纯化水,制成50μl。应予说明,作为引物的组合,准备2种模式(模式1、模式2)。pcr反应通过2步进行。首先,作为步骤1,于98℃下进行30秒的热变性。接着,作为步骤2,将下列循环(热变性:98℃、10秒,退火:46℃、30秒,延伸反应:72℃、90秒)进行25次循环,得到pcr产物。
(引物的序列)
模式1
dld-nde1-fw:ggcgtaatcatatggtagtaggag(序列号4)
dld-bamh1-rv:gataggatccttattttacgatg(序列号5)
模式2
dld-ned1-fw:ggcgtaatcatatggtagtaggag(序列号6)
dld-bamh1-histag-rv:gataggatccttagtggtggtggtggtggtgttttacgatg(序列号7)
10-3.dld基因的ta克隆
接着,如下进行dld基因的ta克隆。向3μl的通过pcr得到的pcr产物中添加5μl的2×liation缓冲液、1μl的pgem-teasy载体、1μl的t4连接酶,于4℃下反应一晚后,将其全量添加于感受态细胞dh5α中,于42℃下实施30秒的热休克,冰冷却2分钟。向其中添加150μl的soc培养基,于37℃下孵育20分钟。进而,将全量用lb/amp培养板培养,得到菌落。
10-4.dld的转化
接着,将dld如下克隆于载体。使用genelutetm质粒小量提取试剂盒(genelutetmplasmidminiprepkit,sigma公司制造),对通过ta克隆而得到的培养物进行质粒提取。向得到的质粒提取物中添加10×缓冲液、ndei,于37℃下处理2小时。进而,向其中添加1μl的bamhi,于37℃下处理1小时,将得到的产物作为插入基因。另一方面,对于pet20b载体,也准备添加1μl的bamhi并于37℃下处理1小时而得的产物。为了确认基于his-标签有无的dld酶活性,分别如下所示制备试样(单位为μl),于16℃下孵育30分钟。然后,将全量添加于感受态细胞dh5α中,在冰上溶解1小时,对得到的产物实施热休克(42℃,30秒),添加soc培养基,于37℃孵育20分钟,铺板于lb/amp培养基上。
10-5.转化体的酶活性测定
如下进行如上得到的转化体的活性测定。取5个菌落的dld(+)his标签/pet20b/bl21和4个菌落的dld(-)his标签/pet20b/bl21,用lb/amp培养基于30℃下振荡培养一晚(预培养)。将60μl的此预培养液接种于3ml的lb/amp培养基,于37℃下振荡培养一晚(主培养)。一旦达到od600=0.4~0.5,则加入iptg,使终浓度达到0.1mm,于30℃下振荡培养4小时。收集如此得到的菌体,混悬于50mmtris-hcl(ph=7.0)中。将其用多珠摇床(multi-beadsshocker,安井器械公司制造)粉碎离心后,将上清作为试样。
如下进行酶反应(高铁肌红蛋白还原反应)。向50μl的通过上述方法得到的酶试样中添加0.5mkpb缓冲液(ph=5.5)、50μl的0.1%高铁肌红蛋白溶液,对其加入纯化水至达到225μl。然后,加入25μl的1mmnadh溶液,开始反应,确认10分钟内的a406下的吸光度变化。同时,对于蛋白量,也通过bradford法进行定量。将结果示出于图19、图20中。
图19是示出无his-标签的转化体的高铁肌红蛋白还原活性的图,图20是示出有his-标签的转化体的高铁肌红蛋白还原活性的图。为了进行比较,对pet20b的空白载体、iptg载体数据也进行了表示。与空白载体相比,均显示10倍以上的高铁肌红蛋白还原活性。另外,如将图19和图20进行比较可知,认为不受iptg的调控。
11.重组dld的食用肉显色活性
将通过上述方法得到的重组dld用珠粉碎,在以下条件下用ni-sepharose柱纯化,用20mmkpb(ph6)进行透析。以将其冻干而得的冻干物为试样,进行食用肉显色试验1、食用肉显色试验2。
(色谱法条件)
担体:nisepharose(25ml)
试样:粉碎物上清约20ml
bindbuf:20mmkpb、0.3mnacl(ph6)
elutebuf:20mmkpb、0.3mnacl、0.4m咪唑(ph6)
流速:进样:5ml/分钟,其它:10ml/分钟
分级:10ml
程序:(1)bindbuf清洗6cv,(2)elutebuf10%清洗10cv,(3)elutebuf100%/20cv梯度,(4)elutebuf清洗10cv
在食用肉显色试验1中,向2g的猪肉末中加入37.5μl的40mg/ml(4%)肌红蛋白(sigma公司制造)、37.5μl的0.5mkpb(ph=5.5)、37.5μl的20mmnadh、66mg的冷冻粉末品酶试样,于4℃下反应一晚。另外,为了进行比较,制备不含冷冻粉末的试样(阴性对照)。将结果示出于图21中。左侧为阴性对照,右侧为含有冷冻粉末的食用肉。不仅通过目测,还根据图像的rgb值验证色调的变化,但可知食用肉的色调因重组dld而更加泛红。
在食用肉显色试验2中,向2g的猪肉末中加入37.5μl的0.5mkpb(ph=5.5)、37.5μl的40mg/ml(4%)肌红蛋白(sigma公司制造)、37.5μl的20mmnadh、试样((1)仅纯化dld(60mg)、(2)仅食品添加剂级亚硝酸钠(0.4%(w/w)=8mg)、(3)纯化dld+亚硝酸钠((1)和(2))、(4)向(2)中加入葡萄糖酸锌(15mg)而得的试样、(5)无),于4℃下反应一晚(图22)。进而将,于65℃下对其进行85分钟的热处理而得的试样示出于图23中。对于上述图22、图23的试样,不仅通过目测,还基于图像的rgb值进行验证。
以下对图21中的无热处理的食用肉色调进行说明。在加入了dld的试样(试样(1)和试样(3))中可见良好的红色色调。特别是加入了dld和亚硝酸钠的试样(3)的色调良好。加入了亚硝酸钠和葡萄糖酸锌的试样(4)变为褐色。仅加入了亚硝酸钠的试样(2)可见与无添加的试样(5)同样的色调。
以下对图22中的热处理后的食用肉色调进行说明。在加入了亚硝酸钠的试样(试样(2)、试样(3)、试样(4))中可见良好的红色色调(白桃色)。特别是加入了dld和亚硝酸钠的试样(3),突出其红色,显示良好的色调。可见仅加入了dld的试样(1)若与无添加的试样(5)相比,则残留红色,但是若与试样(2)~试样(4)相比,则褐色大大加重。
12.食用肉显色酶的纯化
在源自枯草芽孢杆菌菌体的食用肉显色酶中,对dld以外的食用肉显色酶进行纯化。纯化工序以deae色谱的前半峰(图4的deae.fr.no.27-35)为起始材料,进行苯基色谱法、羟基磷石灰色谱法、cu亲和色谱法。
将10ml的deae前半部分(图4的deae.fr.no.27-35)提供给以下条件的苯基色谱法(苯基柱(hitraptmphenylhp(5ml),gehealthcare))。将通过上述苯基色谱法得到的溶出图和高铁肌红蛋白还原酶活性示出于图24中。在这些组分中,将活性特别高的phenyl.fr.no.26-31用5mmkpb(ph6)透析,提供给羟基磷石灰色谱法。
(苯基色谱法条件)
担体:phenylhp(5ml)
试样:deae前半fr.(100210)uf10ml
bufa:20mmkpb、30%饱和硫酸铵(ph6)
bufb:20mmkpb(ph6)
流速:5ml/分钟
分级:5ml
程序:(1)bufa清洗5cv,(2)bufb梯度100%/20cv,(3)bufb100%清洗5cv
将通过上述苯基色谱法得到的phenyl.fr.no.26-31提供给以下条件的羟基磷石灰色谱法。将通过上述羟基磷石灰色谱法得到的溶出图和高铁肌红蛋白还原酶活性示出于图25中。
(羟基磷石灰色谱法条件)
担体:羟基磷石灰(5ml)
进样:苯基纯化fr.no.26-31
bufa:5mmkpb、0.3mnacl(ph6)
bufb:400mmkpb、0.3mnacl(ph6)
流速:2ml/分钟
分级:5ml
程序:(1)bufa清洗5cv,(2)bufb梯度100%/25cv,(3)bufb100%6cv
在通过上述羟基磷石灰色谱法得到的组分中,将活性特别高的hyapafr.no.16用20mmkpb、0.3mnacl(ph6)透析,提供给以下条件的cu亲和色谱柱,进行cu亲和色谱法。将通过cu亲和色谱法得到的溶出图和高铁肌红蛋白还原酶活性示出于图26中。在通过cu亲和色谱法得到的这些组分中,对活性特别高的cu.fr.no.10、13进行sds-page。将结果示出于图27中。
(cu亲和色谱法条件)
担体:cu2+hp(1ml)
进样:hyapa-fr.16
bufa:20mmkpb、0.3mnacl(ph6)
bufb:20mmkpb、0.3mnacl、0.4m咪唑(ph6)
流速:1ml/分钟
分级:2ml
程序:(1)bufa清洗6cv,(2)bufb梯度10%/20cv,(3)bufb清洗10cv
图27是对通过上述羟基磷石灰色谱法得到的hyapafr.no.13-17和通过cu亲和色谱法得到的cu.fr.no.8-15进行sds-page而得的图。其中,由于在通过cu亲和色谱法得到的cu.fr.no.10中确认2个主条带,所以当通过上述方法进行n末端氨基酸序列分析时,分子量大的蛋白质为mgntrkkvsvi(序列号8),分子量小的蛋白质为mtntldvlka(序列号9)。当基于n末端氨基酸序列而进行分子量大的蛋白质的blast检索时,显示出与编码苹果酸脱氢酶(malatedehydrogenase:mdh)的mdh(序列号10)100%的同源性。另外,关于分子量小的蛋白质,显示出与编码推定nad(p)h硝基还原酶(putativenad(p)hnitroreductase:yodc)的yodc(序列号11)100%的同源性。应予说明,yodc的氨基酸序列如序列号12所示。对于cu.fr.no.13,由分子量推测与二氢硫辛酰胺脱氢酶相同。
16.食用肉显色酶(mdh、yodc)的大量表达系统的构建
从枯草芽孢杆菌和纳豆菌取得基因,构建mdh和yodc的大量表达系统。根据枯草芽孢杆菌和纳豆菌的遗传信息来制作引物,实施pcr,进行该基因的切出。将pet20b用于载体,将bl21(de3plyss)用于宿主,在各种酶的c末端加成6×his-标签,使之表达。表达确认培养如下进行。取各种酶(mdh或yodc)(+)his标签/pet20b/bl21的菌落,于30℃、300rpm下振荡培养一晚(预培养)。将2%当量的此预培养液接种于10ml的lb/amp培养基,一旦od达到约0.5~0.7,则加入iptg使终浓度达到0.5mm,于37℃、300rpm下振荡培养4小时(主培养)。收集如此得到的菌体,混悬于50mmtris-hcl(ph=7.0)中。在将其用珠粉碎并离心后,将上清作为试样。
对通过上述方法得到的试样进行活性确认。向150μl的酶试样中加入50μl的0.1%(w/w)高铁肌红蛋白、0.5mkpb(ph=5.5),向其中加入25μl的1mmnadh,开始反应,确认10分钟内的a406下的吸光度变化。根据图28,虽然可对yodc确认活性,但无法对mdh确认活性。因此,为了确认有无表达,通过sds-page确认条带(图29)。mdh和yodc均可在该尺寸确认深色条带。
17.纯化过的食用肉显色酶(mdh、yodc)的显色试验
将通过上述方法得到的重组yodc(枯草芽孢杆菌)和mdh(枯草芽孢杆菌)在下列条件下用ni-sepharose柱纯化,用20mmkpb(ph6)透析。将透析过的试样冻干,得到重组yodc和mdh的酶粉末。
(色谱法条件)
担体:nisepharose(25ml)
试样:粉碎物上清约20ml
bindbuf:20mmkpb、0.3mnacl(ph6)
elutebuf:20mmkpb、0.3mnacl、0.4m咪唑(ph6)
流速:进样:5ml/分钟,其它:10ml/分钟
组分:10ml
程序:(1)bindbuf清洗6cv,(2)elutebuf10%清洗10cv,(3)elutebuf100%/20cv梯度,(4)elutebuf清洗10cv
使用得到的酶粉末,如下进行食用肉显色试验。在食用肉显色试验中,向2g的猪肉末中加入37.5μl的40mg/ml(4%)肌红蛋白(sigma公司制造)、37.5μl的0.5mkpb(ph=5.5)、37.5μl的20mmnadh、试样((1)对照(无添加)、(2)yodc(16mg=20u)、(3)经煮沸的yodc、(4)mdh(16mg)、(5)经煮沸的mdh),于4℃下反应一晚。应予说明,为了通过热处理(100℃、30分钟)而确认失活,准备试样(3)和试样(5)。将结果示出于图30中。虽然在yodc中可确认食用肉显色效果,但对于mdh,完全未确认到食用肉显色效果。
18.yodc的酶学性质研究
研究yodc的酶学性质。与dld同样地调查最适ph(图31)、ph稳定性(图32)、最适温度(图33)、热稳定性(图34)、对nadph的反应性(图35)、金属盐(金属阳离子)对活性所造成的影响(图36)。对于最适ph而言,由于与dld同样地为ph6.0附近,所以认为在食用肉的应用方面没有障碍。另外,在宽泛的ph条件下稳定。即使考虑最适温度,从在20℃附近的低温条件下良好地发挥作用的方面出发,也可以说在食用肉的应用方面是优选的。在热稳定性试验中也可确认至40℃为止可维持活性。在辅酶特异性试验中,与使用nadh的情况相比,在使用nadph的情况下可得到良好的活性。对于金属阳离子而言,在加入mg、na或k的情况下可见酶活性的提高。此外,对底物反应性也进行验证。在与dld相同条件下,对于对铁氰化钾的反应性以及对肌红蛋白的反应性进行了调查。与dld的结果一并分别示出于图37、图38中。与dld相比,对铁氰化钾显示约2.6倍的反应性,对肌红蛋白显示约22倍的反应性。
产业上的可利用性
本发明的还原剂作为食用肉或食用肉加工品的色调改善剂特别有用。根据本发明的还原剂,由于可不使用亚硝酸盐等显色剂而使食用肉显色,所以使制造商品价值高的食用肉加工品成为可能。
本发明丝毫不受上述发明的实施方式和实施例的说明所限定。在不偏离专利请求范围的记载且本领域技术人员可容易想到的范围内的各种变型方式也包含于本发明中。
对于本说明书中明示的论文、公开专利公报和专利公报等内容,通过援引其全部内容而进行引用。
序列表自由文本
序列号4:人工序列的说明:引物dld-nde1-fw
序列号5:人工序列的说明:引物dld-bamh1-rv
序列号6:人工序列的说明:引物dld-nde1-fw
序列号7:人工序列的说明:引物dld-bamh1-his标签-rv
- 还没有人留言评论。精彩留言会获得点赞!