一种微生物食品抗氧化剂的制作方法与流程
本发明涉及一种微生物食品抗氧化剂的制作方法,属于食品技术领域。
背景技术:
脂肪类、油类和含脂食品在加热和长期贮存过程中会因氧化作用及被氧化过程中产生的过氧化物产物分解而发生变质,导致食品的营养价值和风味降低。因此,抑制食品氧化过程对食品生产和消费十分重要。
目前常见的抗氧化剂有人工合成和天然产物提取两大类,微生物源性抗氧化剂属于发酵物提取抗氧化剂,较传统人工合成的抗氧化剂而言,有着来源丰富、品质易控制、提取分离方便等诸多优势,是一种理想的食品抗氧化添加剂,但目前鲜见关于微生物源性抗氧化剂的研究。
植物源性抗氧化剂如茶多酚、人参皂苷、各种植物黄酮等具有多种自由基清除能力强、来源安全可靠、同时兼具其它如免疫调节等功能的特点,但存在原料来源有限,提取成本高、受气候、海拔、地域等多种因素影响而品质稳定性差的缺点。微生物源性抗氧化剂目前局限在某些菌种的抗氧化作用研究,复合抗氧化剂的研究非常罕见。
技术实现要素:
鉴于此,本发明提供一种微生物食品抗氧化剂的制作方法。
本发明采取的技术方案如下:
一种微生物食品抗氧化剂的制作方法,包括以下步骤:
s1:将枯草芽胞杆菌、乳酸杆菌和啤酒酵母菌分别在各自的培养基上30~37℃培养12~16h,所得培养物2~4℃保存备用;
s2:将步骤s1所得的枯草芽胞杆菌培养物按(2~5):100的重量比接种到灭菌后的发酵基料a中,30~37℃发酵培养5~10天,得发酵液,离心,灭菌,得发酵物a;
s3:将步骤s1所得的乳酸杆菌培养物和啤酒酵母菌培养物分别按(0.2~2):100的重量比接种到灭菌后的发酵基料b中,30~37℃发酵培养5~10天,得发酵液,离心,灭菌,得发酵物b;
s4:合并发酵物a和发酵物b,按体积比1:(2~3)加入石油醚,回流提取,抽滤,收集滤液,40~50℃减压浓缩2~3h,将浓缩后的样品于50~55℃条件下烘干0.5~1h,即得微生物食品抗氧化剂;
所述发酵基料a包括以下组份:薄荷、土豆、沙棘果、葡萄糖、大蒜提取物、豆粕和橘皮;
所述发酵基料b包括以下组份:葵花籽、土豆、鳄梨、葡萄糖、甘蓝、豆粕和橘皮。
优选的,所述步骤s2中,枯草芽胞杆菌培养物按3:100的重量比接种到灭菌后的发酵基料a中。
优选的,所述步骤s2中,发酵基料a由下述原料组成,按重量百分比计:薄荷0.1~0.2%、土豆2~3%、沙棘果0.1~2%、葡萄糖3~7%、大蒜提取物0.5~1.2%、豆粕1~3%和橘皮0.7~1%,余量为无菌水。
更优选的,所述步骤s2中,发酵基料a由下述原料组成,按重量百分比计:薄荷0.2%、土豆3%、沙棘果1.2%、葡萄糖5%、大蒜提取物1.0%、豆粕2%和橘皮1%,余量为无菌水。
优选的,所述大蒜提取物为:将大蒜去皮,捣成糊状,加入相等质量的无水乙醇浸提1h,离心,取上清液,减压浓缩至原体积的10%,即得。
优选的,步骤s3中,所得的乳酸杆菌培养物和啤酒酵母菌培养物分别按1:100的重量比接种到灭菌后的发酵基料b中。
优选的,所述步骤s3中,发酵基料b由下述原料组成,按重量百分比计:葵花籽1~2%、土豆2~3%、鳄梨0.7~1.5%、葡萄糖3~7%、甘蓝1.2~3.5%、豆粕2~3%和橘皮2~5%,余量为无菌水。
更优选的,所述步骤s3中,发酵基料b由下述原料组成,按重量百分比计:葵花籽1.2%、土豆2%、鳄梨1.0%、葡萄糖5%、甘蓝2.2%、豆粕2%和橘皮3%,余量为无菌水。
与现有技术相比,本发明的有益效果是:
1、本发明选用枯草芽胞杆菌、乳酸杆菌和啤酒酵母菌进行发酵培养,在发酵培养基中分别加入大蒜提取物、橘皮等成分,各成分不仅能为微生物提供必要的营养成分,而且具有协同作用,有效提高本发明产品的抗氧化性能。
2、本发明所得的微生物食品抗氧化剂原料易得、安全性高。
3、发酵产物提取纯化后得到的复合微生物食品抗氧化剂对脂质体有明显的抑制作用,浓度为125μg/ml时,对脂质过氧化的抑制率达到70%以上,质量浓度为500μg/ml时,抑制率可达到90%,再增加质量浓度时,抑制率最高可达98%。
4、采用本发明抗氧化剂处理后的食品,pov值、tbars值和羰基价均明显低于空白组、对比例样品组和vc组,说明本发明抗氧化剂具有显著的抗氧化作用,对食品有较强的防腐保鲜功能。
附图说明
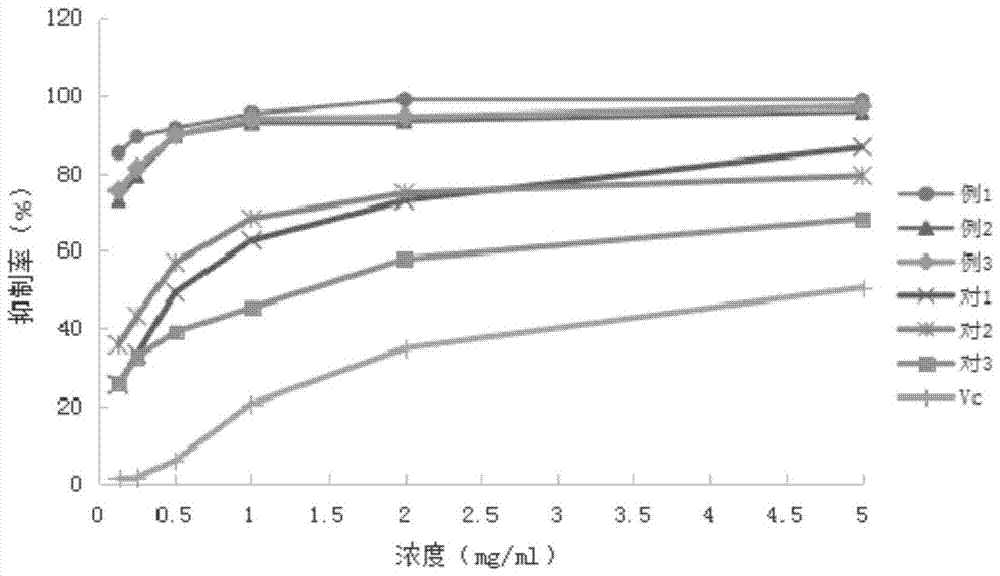
图1为抗脂质过氧化作用试验结果图;
图2为过氧化值(pov)测定结果图;
图3为硫代巴比妥酸值(tbars)测定结果图;
图4为羰基价测定结果图。
具体实施方式
下面通过具体实施方式对本发明作进一步详细说明。
本发明实施例所用的实验方法如无特殊说明,均为常规方法。
本发明实施例所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
实施例1
一种微生物食品抗氧化剂的制作方法,包括以下步骤:
s1:将枯草芽胞杆菌、乳酸杆菌和啤酒酵母菌分别在各自的溶菌肉汤培养基(接种量2%)上37℃培养12h,所得培养物2℃保存备用;
s2:将步骤s1所得的枯草芽胞杆菌培养物按3:100的重量比接种到灭菌后的发酵基料a中,37℃发酵培养10天,得发酵液,离心,灭菌,得发酵物a;
s3:将步骤s1所得的乳酸杆菌培养物和啤酒酵母菌培养物分别按1:100的重量比接种到灭菌后的发酵基料b中,37℃发酵培养10天,得发酵液,离心,灭菌,得发酵物b;
s4:合并发酵物a和发酵物b,按体积比1:3加入石油醚,回流提取,抽滤,收集滤液,50℃减压浓缩3h,将浓缩后的样品于55℃条件下烘干0.5h,即得微生物食品抗氧化剂;
发酵基料a由下述原料组成,按重量百分比计:薄荷0.2%、土豆3%、沙棘果1.2%、葡萄糖5%、大蒜提取物1.0%、豆粕2%和橘皮1%,余量为无菌水。
发酵基料b由下述原料组成,按重量百分比计:葵花籽1.2%、土豆2%、鳄梨1.0%、葡萄糖5%、甘蓝2.2%、豆粕2%和橘皮3%,余量为无菌水。
所述大蒜提取物为:将大蒜去皮,捣成糊状,加入相等质量的无水乙醇浸提1h,离心,取上清液,减压浓缩至原体积的10%,即得。
实施例2
一种微生物食品抗氧化剂的制作方法,包括以下步骤:
s1:将枯草芽胞杆菌、乳酸杆菌和啤酒酵母菌分别在各自的溶菌肉汤培养基(接种量2%)上30℃培养12h,所得培养物2℃保存备用;
s2:将步骤s1所得的枯草芽胞杆菌培养物按2:100的重量比接种到灭菌后的发酵基料a中,30℃发酵培养5天,得发酵液,离心,灭菌,得发酵物a;
s3:将步骤s1所得的乳酸杆菌培养物和啤酒酵母菌培养物分别按0.2:100的重量比接种到灭菌后的发酵基料b中,30℃发酵培养5天,得发酵液,离心,灭菌,得发酵物b;
s4:合并发酵物a和发酵物b,按体积比1:2加入石油醚,回流提取,抽滤,收集滤液,40℃减压浓缩2h,将浓缩后的样品于50℃条件下烘干0.5h,即得微生物食品抗氧化剂;
发酵基料a由下述原料组成,按重量百分比计:薄荷0.1%、土豆2%、沙棘果0.1%、葡萄糖3%、大蒜提取物0.5%、豆粕1%和橘皮0.7%,余量为无菌水。
发酵基料b由下述原料组成,按重量百分比计:葵花籽1%、土豆2%、鳄梨0.7%、葡萄糖3%、甘蓝1.2%、豆粕2%和橘皮2%,余量为无菌水。
所述大蒜提取物与实施例1相同。
实施例3
一种微生物食品抗氧化剂的制作方法,包括以下步骤:
s1:将枯草芽胞杆菌、乳酸杆菌和啤酒酵母菌分别在各自的溶菌肉汤培养基(接种量2%)上37℃培养16h,所得培养物4℃保存备用;
s2:将步骤s1所得的枯草芽胞杆菌培养物按5:100的重量比接种到灭菌后的发酵基料a中,37℃发酵培养10天,得发酵液,离心,灭菌,得发酵物a;
s3:将步骤s1所得的乳酸杆菌培养物和啤酒酵母菌培养物分别按2:100的重量比接种到灭菌后的发酵基料b中,37℃发酵培养10天,得发酵液,离心,灭菌,得发酵物b;
s4:合并发酵物a和发酵物b,按体积比1:3加入石油醚,回流提取,抽滤,收集滤液,50℃减压浓缩3h,将浓缩后的样品于55℃条件下烘干1h,即得微生物食品抗氧化剂;
发酵基料a由下述原料组成,按重量百分比计:薄荷0.2%、土豆3%、沙棘果2%、葡萄糖7%、大蒜提取物1.2%、豆粕3%和橘皮1%,余量为无菌水。
发酵基料b由下述原料组成,按重量百分比计:葵花籽2%、土豆3%、鳄梨1.5%、葡萄糖7%、甘蓝3.5%、豆粕3%和橘皮5%,余量为无菌水。
所述大蒜提取物与实施例1相同。
对比例1
一种微生物食品抗氧化剂的制作方法,与实施例1的区别在于,发酵基料a中不含大蒜提取物。
对比例2
一种微生物食品抗氧化剂的制作方法,与实施例1的区别在于,发酵基料b中不含葵花籽和橘皮。
对比例3
一种微生物食品抗氧化剂的制作方法,与实施例1的区别在于,未进行啤酒酵母发酵。
试验例1:抗脂质过氧化作用研究
脂质过氧化最终产物是丙二醛(mda),在较低ph和高温下,mda与硫代巴比妥酸(tba)反应生成粉红色物质,该物质在532nm下有特征吸收,通过对该物质的检测可以分析出样品对脂质过氧化的抑制作用。
试液的配制:
选定实施例样品、对比例样品和vc进行抗脂质过氧化作用研究。将待测样品分别配置成0.125、0.25、0.5、1、2、5mg/ml的溶液。
脂质体pbs(磷酸缓冲液)分散系:300mg卵磷脂溶解于30ml10mmol/lph7.4pbs(磷酸缓冲液),超声波处理,周围以冰水冷却,制得人工脂质体。
三氯乙酸(tca)-硫代巴比妥酸(tba)-盐酸(hcl)混合液:15gtca、0.37gtba、2.1ml浓盐酸依次加入100ml水中。
测定步骤:
分别于样品管中依次加入1ml脂质体分散系、1ml0.4mmol/l硫酸亚铁、1ml样品,混匀。避光于37℃水浴60min,加入2mltca-tba-hcl混合液,90~100℃水浴15min,迅速冷却,3000r/min离心l0min,取上清液在波长535nm处测定吸光度(as)。对照管以1ml重蒸水代替1ml样品,操作方法同样品管,可测得对照管的吸光度(ac),参比管中以1ml重蒸水代替1ml卵磷脂,抗坏血酸为阳性对照。
抑制率/%=(ac-as)/ac×100
式中:ac为对照吸光度;as为样品吸光度
测定结果见图1。
从图1可以看出,本发明抗氧化剂对脂质体有明显的抑制作用,抑制率随浓度的增加而增大。浓度为125μg/ml时,对脂质过氧化的抑制率达到70%以上,质量浓度为500μg/ml时,抑制率可达到90%,再增加质量浓度时,抑制率最高可达98%。
试验例2:牛肉丸抗氧化效果的研究
选定实施例样品、对比例样品和vc进行牛肉丸抗氧化效果的研究。测定牛肉丸在冻藏过程中过氧化物值(pov)、硫代巴比妥酸值(tbars)及羰基价的变化情况,以不添加任何抗氧化剂的处理组为空白。抗氧化剂在牛肉丸中的添加量为0.1%。
过氧化值(pov)测定:采用gb5009.277-2016《食品中过氧化值的测定》第一法滴定法。
硫代巴比妥酸值(tbars)测定:采用gb5009.181-2016《食品中丙二醛的测定》第二法分光光度法。
羰基价测定:采用gb5009.230-2016《食品中羰基价的测定》规定的方法。
测定结果见图2~4。
从图2~4可以看出,随着贮藏时间的延长,冷藏牛肉丸的pov值基本上呈递增的趋势,所有处理组的pov值显著均低于空白组,说明实施例样品、对比例样品和vc在牛肉丸中可以有效达到抗氧化效果。第5d、15d、20d时,实施例样品处理组的pov值分别为1.4~1.6g/100g、2.0~2.1g/100g、2.0~2.0g/100g,均显著低于空白组、对比例样品组和vc组。
随着贮藏时间的延长,各组tbars值均呈上升趋势,其中空白组上升速度最快。实施例样品处理组的tbars值上升极为平缓,且能显著低于空白组、对比例样品处理组和vc组,说明实施例样品处理组对tbars值起到很好的控制作用,对脂肪氧化的抑制作用较强。
随着贮藏时间的延长,牛肉丸的羰基价均呈逐渐上升的趋势,空白组的羰基价上升的最快。在第5d、15d和20d时,实施例样品处理组的羰基价最低,且显著低于空白组、对比例样品处理组和vc组。
综上,本发明抗氧化剂具有显著的抗氧化作用,对食品有较强的防腐保鲜功能。
以上内容是结合具体的实施方式对本发明所作的进一步详细说明,不能认定本发明的具体实施只局限于这些说明。对于本发明所属技术领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干简单推演或替换。
- 还没有人留言评论。精彩留言会获得点赞!