一种佛手果胶低聚糖及其制备与应用的制作方法
本发明涉及一种佛手果胶低聚糖及其制备与应用。
(二)
背景技术:
水果除了日常直接食用外还有大量被加工制成各种饮料、罐头、零食等,在加工的过程中往往会产生果渣、果皮、果核等废弃物,如果不能合理的利用就会造成大量的浪费和污染。天然果胶类物质是细胞壁的一种组成成分,它广泛存在于植物的果实、根、茎、叶中,伴随纤维素而存在,主要是起相邻细胞间粘连作用,使植物组织细胞能够黏结在一起。果胶结构最主要成分是被部分甲酯化的α-1,4-d-聚半乳糖醛酸单元组成的直链。果胶经水解后得到的短链低聚复合糖具有抑菌、抗氧化、降血压、降血脂、抗癌、免疫调节等功效,如魔芋低聚糖(张琳.魔芋低聚糖的制备及其性质研究[d].吉林大学,2013.)、柑橘果胶低聚糖(尹颖.低分子柑橘果胶的物理制备法研究及其抗癌活性的初步评价[d].浙江师范大学,2013.)、苹果果胶低聚糖(王江浪,许增巍,马惠玲,杨力.由苹果渣制备果胶低聚糖的工艺[j].农业工程学报,2009,25(s1):122-128.)。
佛手是香橼的变种之一,是不规则分枝的灌木或小乔木。佛手在中国广东丘陵平原开阔地带,四川的丘陵地带,中国长江以南各地都有栽种。南方各省区多栽培于庭院或果园中。广西、安徽、云南、福建等省区也有栽培出产。佛手中提取物质具有较高研究和利用价值,如佛手挥发油具有较好的抑菌活性(郭卫东,郑建树,邓刚,陈文荣,孙杰.佛手挥发油抑菌活性的研究[j].中国粮油学报,2009,24(08):103-107.),佛手黄酮也具有较高抗氧化和抗自由基活性(黄小梅,邓祥.川佛手黄酮类物质的分离纯化和抗氧化活性研究[j/ol].化学研究,2017(06):1-5[2017-12-26].https://doi.org/10.
14002/j.hxya.2017.06.011.)。
佛手低聚糖的研究相对较少,本发明采用酸提醇沉法从佛手加工废渣中提取佛手果胶,再利用果胶裂解酶酶解佛手果胶制备功能性佛手果胶低聚糖,也可以直接利用果胶裂解酶酶解佛手加工废渣制备功能性佛手果胶低聚糖,并通过离心、除单糖、脱色、膜分离、浓缩、干燥等步骤得到具有特殊功能的佛手果胶低聚糖产品,对其进行抑菌活性和抗氧化活性的实验验证。研究表明该方法制备的佛手果胶低聚糖在抑菌和抗氧化应用领域都具有较好的使用价值。
(三)
技术实现要素:
本发明目的是提供一种佛手果胶低聚糖及其制备方法与应用,本发明所述佛手果胶低聚糖具有抗氧化和抑菌能力,生产成本低、抑菌效果好、无毒副作用。
本发明采用的技术方案是:
本发明提供一种佛手果胶低聚糖,所述佛手果胶低聚糖按如下步骤制备:
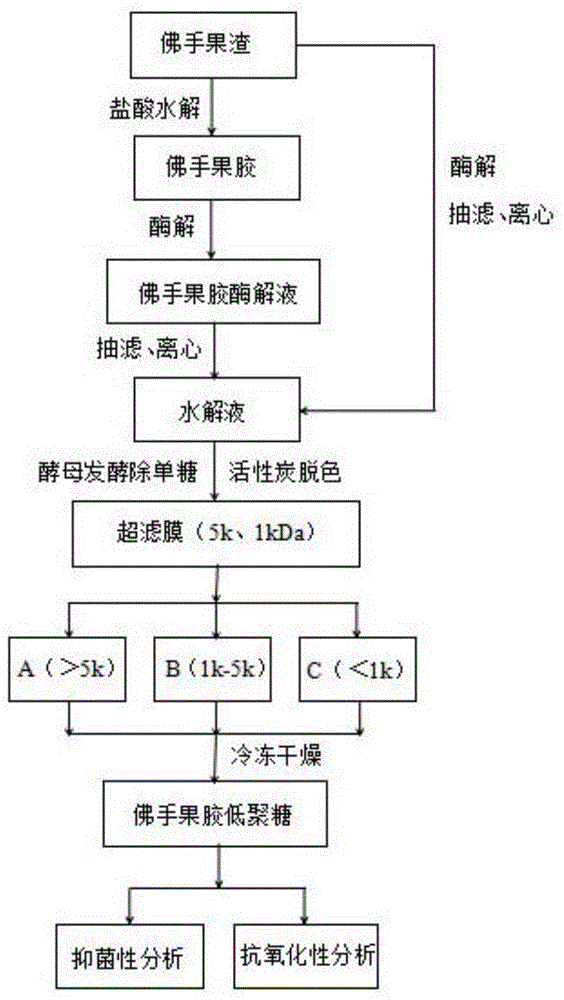
(1)将新鲜佛手全果榨汁后的果渣粉碎,加水煮沸(优选8-10min),过滤,取滤饼烘干,获得佛手渣;(2)将佛手渣用去离子水在70-90℃、ph值1.0-2.0条件下浸提(优选0.5-1.5h),抽滤,取滤液,获得果胶提取液;(3)向果胶提取液中加入乙醇水溶液,静置沉淀(优选1-3h),过滤,滤饼干燥(优选60℃),获得果胶;(4)将果胶溶于水中,加入果胶酶,在ph3.5-4.5,40-50℃条件下酶解完全(优选3-5h)后,煮沸灭酶(优选10min),获得酶解液;(5)将酶解液过滤,取上清液加入酵母,在25-40℃下发酵(优选12-36h),获得发酵液;(6)发酵液调ph值3.0-4.0,加入活性炭,于40-60℃下脱色(优选30-60min),离心(优选4℃,10000rpm离心10min),取上清液,减压浓缩(45℃)(优选浓缩至原体积的1/4),获得浓缩液;(7)将浓缩液用截留分子量为5kda的聚醚砜膜过滤,取滤液再用分子量为1kda的再生纤维素膜超滤分离,取截留液,冷冻干燥,获得佛手果胶低聚糖。
进一步,步骤(1)中水质量加入量为果渣质量的2倍。
进一步,步骤(2)中去离子水质量加入量为佛手渣质量的15-25倍。
进一步,步骤(3)中乙醇水溶液体积浓度为95%,所述乙醇水溶液加入量至乙醇体积终浓度为52%。
进一步,步骤(4)中果胶溶于去离子水制成0.1-0.3g/ml果胶溶液,所述果胶酶加入量终浓度为0.01-0.03u/ml。
进一步,步骤(5)酵母加入量以上清液体积计为10-30g/l,所述酵母为安琪高活性酵母(购于安琪酵母股份有限公司)。
进一步,步骤(6)活性炭加入量以上清液体积计为10g/l。
本发明还提供一种所述佛手果胶低聚糖在制备抗氧化剂中的应用。
本发明还提供一种所述佛手果胶低聚糖在制备抑菌剂中的应用。
本发明方法制备得到的佛手果胶低聚糖,其聚合度在3-25,平均分子量在800-5000之间,经高效液相色谱检测后得到聚合度在3-25间的佛手果胶低聚糖含量达59.4%-64.6%之间。佛手果胶低聚糖的得率7.28±0.7%,总糖含量64.3±2.1%,还原糖含量2.6±0.6%,多糖含量61.4±2.0%,蛋白含量2.17±0.3%。
本发明所用的原料是来自佛手加工企业的废弃物,是佛手全果经过机械压榨取汁后剩下的废弃果渣,具有果胶质含量高、原料成本低廉、成分相对简单的优点。本发明所述的果胶裂解酶由黑曲霉(aspergillusniger-wz003)经过发酵培养获得,发酵培养可以是液态发酵培养也可以是固态发酵培养,培养基为本领域常见适用于黑曲霉的培养基材料。
本发明的优点和产生的有益效果:
1)先采用醇沉分离得到果胶后再进行酶解制备,可以得到较为纯净的佛手果胶低聚糖,从而保证了产品的质量。
2)采用由黑曲霉(aspergillusniger-wz003)经过发酵培养获得的果胶裂解酶酶解制备佛手果胶低聚糖可以在裂解过程中产生不饱和双键,提高了果胶低聚糖的抗氧化生物活性。果胶低聚糖浓度为25mg/ml时,对dpph自由基清除率达到58.7%,对超氧自由基清除率达到23.1%。与采用普通果胶水解酶制备的果胶低聚糖抗氧化性能提高了36%。
3)使用冷冻干燥技术,在4℃下对样品进行直接冷冻干燥能较好的保留佛手果胶低聚糖原有的生物活性和样品的溶解性。
4)使用超滤膜分离技术,选取了截留分子量为5kda和1kda的超滤膜进行样品分离纯化,能简单高效地获得高抑菌活性分子量段的果胶低聚糖产品。
5)上述工艺制备的果胶低聚糖在实现较好的抑菌活性的同时还具有一定的抗氧化生物活性,产品安全无毒,在食品防腐、蔬果保鲜方面具有较高应用前景。
6)产品原料来自佛手加工废渣,提高资源的利用率,对绿色环保有一定价值。
(四)附图说明
图1为佛手果胶低聚糖的制备工艺流程图。
图2为佛手果胶低聚糖侧链单糖的组成和含量检测液相色谱分析图,a为单糖标准品液相分析图,b为佛手果胶低聚糖侧链单糖的组成液相色谱分析图。
图3为佛手果胶低聚糖和其他防腐剂抑菌效果对比图,a为佛手果胶低聚糖和乳酸链球菌素、苯甲酸钠抑菌效果对比图,b为佛手果胶低聚糖和山梨酸钾、空白缓冲液抑菌效果对比图。
图4为佛手果胶低聚糖浓度与清除dpph自由基性能的关系图,a为抗血坏酸浓度与清除dpph自由基性能的关系,b为佛手果胶低聚糖浓度与清除dpph自由基性能的关系。
图5为佛手果胶低聚糖浓度与清除超氧自由基性能的关系图,a为抗血坏酸浓度与清除超氧自由基性能的关系,b为佛手果胶低聚糖浓度与清除超氧自由基性能的关系。
(五)具体实施方式
下面结合具体实施例对本发明进行进一步描述,但本发明的保护范围并不仅限于此:
本发明所述佛手(学名:citrusmedical.var.sarcodactylisswingle):果实在成熟时各心皮分离,形成细长弯曲的果瓣,状如手指,故名佛手,别称佛手柑、五指橘、飞穰、蜜罗柑、五指香橼、五指柑,芸香目,芸香科,柑桔属,香橼种。
本发明室温是指25-30℃。
实施例1:果胶裂解酶
a)黑曲霉(aspergillusniger-wz003,已在cn101225121a公开)接种至斜面培养基,35℃培养20h,获得斜面菌种。斜面培养基:nano32.0g、k2pho41.0g、kcl0.5g、mgso40.5g、feso40.01g、蔗糖3.0g、琼脂20.0g、水1000ml,ph自然。121℃灭菌20min。
b)挑一环黑曲霉斜面菌种,接种至液态发酵培养基,发酵温度30℃、转速200r/min条件下培养48h,过滤,得到果胶裂解酶粗酶液,测得其中果胶裂解酶酶活为386.6u/ml。液态发酵培养基:麸皮62.0g、酵母膏15.0g、玉米粉40.0g、胡萝卜13.0g、caco310.0g,加水补足至1000ml,起始ph7.0,250ml三角瓶,装液量100ml,0.1mpa蒸汽压力灭菌20min,冷却后每瓶接入一环黑曲霉斜面菌种。
实施例2:
a)原料处理:将新鲜佛手全果经过榨汁加工后压榨得到的废渣粉碎,用2倍质量的水煮沸8min,过滤,烘干,获得佛手渣。
b)佛手果胶提取:将10g步骤a)获得的佛手渣溶于15倍质量的水中,调ph值1.0,70℃水浴0.5h,抽滤,取滤液,得到果胶提取液。
c)醇沉:向步骤b)果胶提取液中加入体积浓度95%乙醇水溶液至乙醇体积浓度为52%,室温放置1h,双层纱布过滤得到沉淀,重复提取醇沉三次,收集沉淀后60℃烘干,获得果胶。
d)酶解:用去离子水将步骤c)得到的果胶配成0.1g/ml的果胶溶液,然后加入终浓度0.01u/ml果胶酶,ph3.5,40℃条件下水解3h,酶解后煮沸10min灭酶活,获得酶解液。
e)酵母发酵除单糖:将步骤d)灭酶后的酶解液过滤,取上清液,每1l上清液加入10g安琪高活性酵母(购于安琪酵母股份有限公司),25℃发酵12h,获得发酵液。
f)活性炭除色素:将步骤e)的发酵液调ph值到3.0,以每1l发酵液加入10g活性炭(粉末,直径≦0.18mm),于60℃下活性炭脱色30min,4℃,10000rpm离心10min,取上清液。
g)浓缩:对步骤f)上清液减压浓缩(45℃)至原体积的1/4,获得浓缩液;
h)超滤分离:将步骤g)浓缩液先用截留分子量为5kda的聚醚砜膜过滤,收集滤液再用分子量为1kda的再生纤维素膜超滤分离,收集5kda和1kda之间截留液,获得果胶低聚糖溶液,4℃冷冻干燥,得到佛手果胶低聚糖0.724g。
i)分析检测:上述方法中佛手果胶低聚糖的提取得率为7.24%,采用苯酚-硫酸比色法测得总糖含量为62.2%,采用3,5-二硝基水杨酸法(dns法)测得还原糖含量为2.7%,多糖含量为59.5%,采用考马斯亮蓝法(bradford法)测得蛋白质含量为1.96%。多糖含量=总糖含量-还原糖含量。
实施例3:
a)原料处理:将佛手全果经过榨汁加工后压榨得到的废渣粉碎,用2倍质量的沸水煮沸9min,过滤,烘干,获得佛手渣。
b)佛手果胶提取:将10g佛手渣溶于20倍质量的水中,调ph值1.5,80℃水浴1.0h,抽滤,得到果胶提取液。
c)醇沉:向果胶提取液中加入体积浓度95%乙醇至乙醇体积浓度为52%,室温放置2h,双层纱布过滤得到沉淀,重复提取醇沉三次,收集沉淀后60℃烘干,获得果胶。
d)酶解:用去离子水将果胶配成0.2g/ml的果胶溶液,然后加入终浓度0.01u/ml果胶酶,ph4.0,45℃条件下水解4h,酶解后煮沸10min灭酶活,获得酶解液。
e)酵母发酵除单糖:酶解液过滤,取上清液,每1l上清液加入20g酵母(同实施例1),30℃发酵24h,获得发酵液。
f)活性炭除色素:发酵液调ph值到3.5,每1l发酵液加入10g活性炭(同实施例1),于50℃下活性炭脱色40min,10000rpm,4℃,离心10min,取上清液。
g)浓缩:上清液减压浓缩(45℃)至原体积的1/4,获得浓缩液;
h)超滤分离:将浓缩液先截留分子量为5kda的聚醚砜膜过滤,取滤液再用分子量为1kda的再生纤维素膜超滤分离,收集5kda和1kda之间截留液,获得果胶低聚糖溶液,4℃冷冻干燥,得到佛手果胶低聚糖0.658g。
i)分析检测:上述方法中佛手果胶低聚糖的提取得率为6.58%,采用苯酚-硫酸比色法测得总糖含量为65.3%,采用3,5-二硝基水杨酸法(dns法)测得还原糖含量为2.7%,多糖含量为62.6%,采用考马斯亮蓝法(bradford法)测得蛋白质含量为1.93%。多糖含量=总糖含量-还原糖含量。
实施例4:
a)原料处理:将佛手全果经过榨汁加工后压榨得到的废渣粉碎,用2倍质量的沸水煮沸10min,过滤,烘干,获得佛手渣。
b)佛手果胶提取:将10g佛手渣溶于25倍质量的水中,调ph值2.0,90℃水浴1.5h,抽滤得到果胶提取液。
c)醇沉:向果胶提取液中加入95%乙醇至乙醇体积浓度为52%,室温放置3h,双层纱布过滤得到沉淀,重复提取醇沉共三次,收集沉淀后60℃烘干,获得果胶。
d)酶解:用去离子水将果胶配成0.3g/ml的佛手果胶溶液,然后加入终浓度0.02u/ml果胶酶,ph4.5,50℃条件下水解5h,酶解后煮沸10min灭酶活,获得酶解液。
e)酵母发酵除单糖:酶解液过滤,取上清液,每1l上清液中加入30g酵母(同实施例1),35℃发酵36h,获得发酵液。
f)活性炭除色素:发酵液调ph值到4.0,每1l发酵液中加入10g活性炭(同实施例1),于40℃下活性炭脱色50min,10000rpm,4℃,离心10min,取上清液。
g)浓缩:上清液减压浓缩(45℃)至原体积的1/4,获得浓缩液;
h)超滤分离:将浓缩液先用截留分子量为5kda的聚醚砜膜过滤,取滤液再用分子量为1kda的再生纤维素膜超滤分离,收集5kda和1kda之间截留液,得到果胶低聚糖溶液,4℃冷冻干燥,得到佛手果胶低聚糖0.732g。
i)分析检测:上述方法中佛手果胶的提取得率为7.32%,采用苯酚-硫酸比色法测得总糖含量为65.3%,还原糖采用3,5-二硝基水杨酸法(dns法)测得含量为2.0%,多糖含量为63.3%,采用考马斯亮蓝法(bradford法)测得蛋白质含量为2.47%。多糖含量=总糖含量-还原糖含量。
实施例5:
a)原料处理:将佛手全果经过榨汁加工后压榨得到的废渣粉碎,用2倍质量的沸水煮沸10min,过滤,烘干,获得佛手渣。
b)佛手果胶提取:将10g佛手渣溶于25倍质量的水中,调ph值1.0,90℃水浴1.5h,抽滤,得到果胶提取液。
c)醇沉:向果胶提取液中加入95%乙醇至乙醇体积浓度为52%,室温放置3h,双层纱布过滤得到沉淀,重复提取醇沉共三次,收集沉淀后60℃烘干,获得果胶。
d)酶解:用去离子水将果胶配成0.2g/ml的佛手果胶溶液,然后加入终浓度0.02u/ml果胶酶,ph4.5,45℃条件下水解4h,酶解后煮沸10min灭酶活,获得酶解液。
e)酵母发酵除单糖:酶解液过滤,取上清液,每1l上清液加入30g酵母(同实施例1),40℃发酵24h,获得发酵液。
f)活性炭除色素:发酵液调ph值到4.0,每1l发酵液加入10g活性炭(同实施例1),于40℃下活性炭脱色60min,10000rpm,4℃,离心10min,取上清液。
g)浓缩:上清液减压浓缩(45℃)至原体积的1/4,获得浓缩液;
h)超滤分离:将浓缩液先用截留分子量为5kda的聚醚砜膜过滤,取滤液再用分子量为1kda的再生纤维素膜超滤分离,收集5kda和1kda之间截留液,得到果胶低聚糖溶液,4℃冷冻干燥,得到佛手果胶低聚糖0.788g。
i)分析检测:上述方法中佛手果胶的提取得率为7.88%,采用苯酚-硫酸比色法测得总糖含量为65.3%,还原糖采用3,5-二硝基水杨酸法(dns法)测得含量为2.1%,多糖含量为63.2%,采用考马斯亮蓝法(bradford法)测得蛋白质含量为1.87%。多糖含量=总糖含量-还原糖含量。
实施例6:
a)原料处理:将佛手全果经过榨汁加工后压榨得到的废渣粉碎,用2倍质量的沸水煮沸10min,过滤,烘干,获得佛手渣。
b)佛手果胶提取:将10g佛手渣溶于25倍质量的水中,调ph值1.0,90℃水浴1.5h,抽滤得到果胶提取液。
c)醇沉:向果胶提取液中加入95%乙醇至乙醇体积浓度为52%,室温放置3h,双层纱布过滤得到沉淀,重复提取醇沉共三次,收集后60℃烘干,获得果胶。
d)酶解:用去离子水将果胶配成0.2g/ml的佛手果胶溶液,然后加入终浓度0.03u/ml果胶酶,ph4.5,45℃条件下水解4h,酶解后煮沸10min灭酶活,获得酶解液。
e)酵母发酵除单糖:酶解液过滤,取上清液,每1l上清液加入30g酵母(同实施例1),40℃发酵24h,获得发酵液。
f)活性炭除色素:发酵液调ph值到3.5,每1l发酵液加入10g活性炭(同实施例1),于40℃下活性炭脱色50min,10000rpm,4℃,离心10min,取上清液。
g)浓缩:上清液减压浓缩(45℃)至原体积的1/4,获得浓缩液;
h)超滤分离:将浓缩液先用截留分子量为5kda的聚醚砜膜过滤,取滤液再用分子量为1kda的再生纤维素膜超滤分离,收集5kda和1kda之间截留液,得到果胶低聚糖溶液,4℃冷冻干燥,得到佛手果胶低聚糖0.798g。
i)分析检测:上述方法中佛手果胶的提取得率为7.98%,采用苯酚-硫酸比色法测得总糖含量为65.4%,采用3,5-二硝基水杨酸法(dns法)测得还原糖含量为3.2%,多糖含量为62.2%,采用考马斯亮蓝法(bradford法)测得蛋白质含量为2.13%。多糖含量=总糖含量-还原糖含量。
实施例7佛手果胶低聚糖单糖组成和含量分析
利用高效液相色谱对实施例6得到的佛手果胶低聚糖的单糖组成成分以及各单糖成分所占的比列情况进行了分析检测,采用symmetryc18柱,流动相为乙腈:醋酸铵(ph5.5)=20:80,流速为0.8ml/min,进样量10μl,在245nm处检测。结果如图2所示,表1列出了各单糖的比列情况。
表1:佛手果胶低聚糖单糖组成分析表
注:man代表d-甘露糖,xyl代表d-木糖,rha代表l-鼠李糖,glaa代表d-半乳糖醛酸,glu代表d-葡萄糖,gal代表d-半乳糖,ara代表l-阿拉伯糖。
对实施例2-5方法所制备佛手果胶低聚糖单糖组成分析结果表明,其单糖组成和各种类单糖所占的比例与实施例6基本一致。
实施例8:抑菌活性实验
实施例6制备的佛手果胶低聚糖与市售防腐剂抑菌活性的比较(杯碟法):将大肠杆菌(escherichiacoliatcc25922)、金黄色葡萄球菌(staphylococcusaureusatcc25925)、枯草芽孢杆菌(bacillussubtilisatcc6633)菌种在无菌条件下接种牛肉膏蛋白斜面培养基上。将斜面放置于37℃恒温培养箱内培养约2-3天;待菌落长好后重新接种到新的牛肉膏蛋白胨培养基(牛肉膏3.0g;蛋白胨10.0g;氯化钠10.0g;琼脂15.0-25.0g;水1000ml;ph7.0-8.0)上,在同样的条件下进行二次培养,时间基本保持与上一次培养相同。试验菌株经活化培养后,用无菌移液枪移取10ml无菌生理盐水至斜面试管内,在无菌操作条件下用接种环小心将菌苔洗下。倒入带有玻璃珠的烧瓶内,将菌悬液均匀打散。并用10倍稀释法将菌液稀释,采用平板计数法计数(见国标gb478912-1994),配制菌浓度为1×107-8cfu/ml的菌悬液。
将灭过菌的牛肉膏蛋白胨培养基倒入培养皿,待其冷却凝固。用无菌移液枪各吸取500μl菌悬液到平板上,涂布均匀;平稳等距离放置3个无菌牛津杯于培养基表面上,各移取200μl表2所列浓度的抑菌剂(分别用ph4.0的缓冲液配制而成)加入牛津杯,以相应的缓冲液作为对照。每种浓度重复做3次,最后将平皿放置于相应温度的培养箱培养,细菌37℃。2天后取出培养皿,将剩余药液吸出,测定抑菌圈的直径大小,取实验平均值,结果见表2和图3所示。结果表明,佛手果胶低聚糖对大肠杆菌、金黄色葡萄球菌和枯草芽孢杆菌的生长均具有显著的抑制作用,对枯草芽孢杆菌的抑制作用最大。它对三种细菌的抑制率分别为49.2%,46.9%和53.4%。与市售的化学及生物防腐剂相比,果胶低聚糖的抑菌效果不及同浓度的化学防腐剂但明显优于同浓度的生物防腐剂,因此作为一种天然的生物防腐剂,佛手果胶低聚糖具有很好的市场应用前景。
表2:佛手果胶低聚糖与市售食品防腐剂的抑菌活性比较
对实施例2-5所制备得到的佛手果胶低聚糖也分别进行了抑菌效果测定,结果与实施例6的佛手果胶低聚糖抑菌效果基本相同,相对误差在5%以内。
实施例9:抗氧化生物活性实验
1、清除dpph自由基
a、dpph溶液配制:称取dpph(1,1-二苯基-2-三硝基苯肼)10.0mg,加乙醇溶解,转移至100ml容量瓶中,加乙醇至刻度,摇匀,制成每1ml含dpph0.1mg的乙醇溶液,避光保存。
b、按照表3反应体系取浓度为5.0、10.0、15.0、20.0、25.0mg/ml实施例6制备的佛手果胶低聚糖水溶液、dpph溶液、0.01、0.02、0.03、0.04、0.05mg/ml抗坏血酸水溶液,置于25ml具塞比色管中,摇匀,25℃水浴30min,取出冷却至室温。以自身对照管为空白,在517nm波长下测定吸光度。分别得到自身吸收、空白对照、反应吸收,按公式计算清除率,结果见图4、表4和表5所示。
表3:反应体系
清除率=[ac-(ai-aj)]/ac×100%
其中ai为样品反应管测定结果;aj为自身吸收管测定结果;ac为空白对照管测定结果。
表4抗血坏酸浓度与清除dpph自由基性能的关系
表5佛手果胶低聚糖浓度与清除dpph自由基性能的关系
对实施例2-5所制备得到佛手果胶低聚糖分别进行清除dpph自由基性能研究,结果表明与实施例6的佛手果胶低聚糖相比,效果基本相同,相对误差在3%以内。
2、清除超氧自由基
a、邻苯三酚溶液配制:称取邻苯三酚12.6g,加超纯水溶解,转移至100ml容量瓶中,加超纯水至刻度,摇匀,制成1mmol/ml的邻苯三酚溶液。
b、移取1ml邻苯三酚溶液,加入ph8.2的tris-hcl溶液3.0ml,放于10ml容量瓶中,定容至10ml,反应体系的温度保持在25℃,在波长为320nm下对反应溶液的吸光度值进行测定,准确记录反应溶液的吸光度记为a1。
c、准确取0、5.0、10.0、15.0、20.0、25.0mg/ml浓度的实施例6制备的佛手果胶低聚糖水溶液、0.1、0.2、0.3、0.4、0.5mg/ml抗坏血酸水溶液各0.2ml,分别加入ph8.2的tris-hcl溶液3.0ml,混合均匀后向每个管中加入1ml邻苯三酚溶液,放于10ml容量瓶中,定容至10ml,反应体系的温度保持在25℃。在波长为320nm下对反应溶液的吸光度值进行测定,准确记录反应溶液的吸光度记为a2。按照公式计算超氧阴离子的清除率:清除率=(a1-a2)/a1×100%,结果见图5、表6和表7所示。
表6抗血坏酸浓度与清除超氧自由基性能的关系
表7佛手果胶低聚糖浓度与清除超氧自由基性能的关系
图4、图5中可以看出佛手果胶低聚糖在体外抗氧化系统中具有较强的抗氧化活性,并呈明显的浓度剂量依赖关系,浓度增大时可以使其抗氧化能力有明显提高。科学研究表明,癌症、衰老或其它疾病大都与过量自由基的产生有关联,因此具有抗氧化功能的活性物质对人类的健康有着重大的益处。佛手果胶低聚糖作为一种天然的抗氧化剂,在这方面也具有很好的应用推广优势。
对实施例2-5所制备得到的佛手果胶低聚糖分别进行清除超氧自由基性能研究,结果表明与实施例6制备的佛手果胶低聚糖相比,清除超氧自由基性能基本相同,相对误差小于3%。
- 还没有人留言评论。精彩留言会获得点赞!