抗真菌毒素组合物的制作方法
本发明涉及抗真菌毒素组合物。
真菌毒素是由各种微观真菌如霉菌(曲霉属、镰刀霉属、葡萄穗霉属、青霉属等)产生的毒素。这些是低分子量(<1,000道尔顿)的分子,通常在非水介质中是热稳定的。它们极难降解,即使消除了霉菌,也可能残留在食品中。
真菌毒素被认为是全世界粮食和畜牧业养殖的主要威胁之一,造成2至5%的动物生产力损失。
防止真菌毒素对原材料的污染可能包括使用抑制霉菌生长的杀真菌剂或对入侵具有抗性的植物进行基因选择。除了在存储过程中要小心(干燥、控制筒仓中的温度、湿度和氧合作用)之外,还需要注意以下事项:
-物理方法:清洗、干燥、磨碎、对豆荚或果仁进行手动或机械分类、对外壳和皮进行机械分离(这是基本的污染部位)、热冲击处理、烘烤等;
-化学方法:用氨处理花生油粉,用加压氨解毒非常适合处理通过船到达的花生油粉或其他含油植物;
-生物学方法,例如添加霉菌抑制剂(丙酸酯)或以未污染的谷物将污染的谷物稀释(汞合金或混合物)用于动物饲料(某些国家禁止)。
然而,基于当前的科学和技术知识,尽管对生产和存储技术进行了改进,但尚不知道如何完全防止霉菌发展。如果不使用副作用更大的手段,尤其是从生态角度来讲,还从健康角度考虑,就不可能做到这一点。结果,不能完全消除食品中真菌毒素的存在。在此,食品是指所有食物,包括原材料,用于人类的食物和用于动物的食物。这种存在也高度依赖于天气条件,因此根据年份而变化。
此外,此时,在不改变产品的营养价值的情况下,不可能在食品的制备中消除真菌毒素。
因此,唯一可能的预防手段是从食物链中消除“过度”污染的食物。在生产者(不可避免地认为标准太严格)和安全要求(总是认为标准太宽容)之间的反应中,将“过度”设置在适当的水平绝不是显而易见的。众所周知,需求水平越高,成本增加(通过非食品渠道进行测试,隔离,淘汰或回收等)越多,对健康的益处就越不明显(相对于较低但仍然有效的需求水平而言)。
在欧盟,有关真菌毒素的最新标准是由法规1881/2006和指令2002/32/ec制定的,法规1881/2006规定了食品中某些污染物的最高含量,指令2002/32/ec规定了动物饲料中的有害物质。
同时,越来越多地认为畜牧业,尤其是动物饲料业在确保在动物生产中以负责任的方式使用抗微生物剂方面可以发挥作用。决策者要求动物饲料生产商、农民、兽医和监管机构共同努力,确定最佳的饲养和卫生实践以及可行的替代方法,以减少在牲畜中使用抗生素并改善动物福祉。因此,与真菌毒素的抗争通过对抗与真菌毒素有关的病理,从而间接减少了用于治疗这些病理的抗微生物剂的数量,从而为这一领域项目做出了贡献。
因此,确实需要提供一种消除真菌毒素的方法。
在畜牧业中,存在多种减轻真菌毒素风险的现行实践,并且有几种方案可商购获得,例如粘合剂。
一些方案的选择性不够,因此它们可能会很快被所应用的食品基质饱和。同样,它们可以与目标真菌毒素以外的营养物质或化合物(特别是维生素或矿物质)相互作用。在这种情况下,这些营养素的生物利用度因此降低。
相反,另一些则选择性太强,并且只能提供对一种真菌毒素的解决方案。因此,有必要使用组合多种解决方案的策略来消除同一食品中存在的几种真菌毒素。
目前尚无关于市售方案对受低于规定水平的真菌毒素污染的食物品的功效的数据。
粘合剂尤其具有已知的缺点,即,即使被粘合,真菌毒素仍保留在食物中,并因此仍然存在于动物的消化系统中,并因此可能被所提出的方案解吸。粘合剂也可以释放积累的有毒化合物,例如重金属,二噁英等。
最后,在存在严重的真菌毒素污染的情况下,某些微生物的生长可能会发生改变甚至被抑制,从而延长了达到令人满意的去污染水平所需的时间。
因此,当前与真菌毒素作斗争的策略要求建立一套方案,以消除真菌毒素并解决这些缺点。
专利申请us2015306154是从现有技术中已知的,并且教导了使用芽孢杆菌属中的是细菌来对抗真菌毒素的作用。但是,该文献教导了某些经测试的真菌毒素的生物转化,并且似乎不能在所有真菌毒素上提供令人满意的结果。
因此,仍然需要提供新方法。
本发明的一个目的是解决这些缺点。
本发明的另一个目的是提出一种新的组合物,其能够确定地消除食品中所含的真菌毒素并因此改善动物健康。
因此,特别提出的是包含以下或基本由以下组成的组合物在分解至少一种真菌毒素中的体外或离体应用:
-nol01、nol02、nol03和nol04中的至少一种菌株,和/或
-它们的代谢物中的至少一种,
所述菌株保藏在cncm,编号分别为cncmi-4606、cncmi-5043、cncmi-4607和cncmi-4608。
本发明特别涉及含菌株nol01和/或至少一种其代谢物或基本由菌株nol01和/或至少一种其代谢物组成的组合物在分解至少一种真菌毒素中的体外或离体应用,所述菌株保藏在cncm,编号为cncmi-4606。
本发明特别涉及含菌株nol02和/或至少一种其代谢物或基本由菌株nol02和/或至少一种其代谢物组成的组合物在分解至少一种真菌毒素中的体外或离体应用,所述菌株保藏在cncm,编号为cncm1-5043。
本发明特别涉及含菌株nol04和/或至少一种其代谢物或基本由菌株nol04和/或至少一种其代谢物组成的组合物在分解至少一种真菌毒素中的体外或离体应用,所述菌株保藏在cncm,编号为cncmi-4608。
本发明特别涉及含菌株nol03和/或至少一种其代谢物或基本由菌株nol03和/或至少一种其代谢物组成的组合物在分解至少一种真菌毒素中的体外或离体应用,所述菌株保藏在cncm,编号为cncmi-4607。
本发明基于发明人的令人惊讶的观察,即枯草芽孢杆菌属的特定细菌菌株能够分解培养基中真菌产生的几种真菌毒素,但是不会产生这种分解产生的有毒残留物。发明人还观察到,该去污染在宽范围的ph、温度和真菌毒素浓度条件内以及在有氧和无氧条件下都是有效的。另外,在本发明中,使用菌株nol01、nol02、nol03和nol04中的至少一种,或者这些菌株的代谢产物,即细菌分泌的分子,例如酶,或这些菌株及其代谢物中的至少一种。
在本发明中,细菌菌株是指源自细菌菌落的连续子培养的所有个体(细菌)。
根据本发明的组合物中包含的代谢物是由所述至少一种上述细菌分泌的物质,尤其是酶。在本发明中,上述代谢物可以直接在枯草芽孢杆菌的菌株nol01、nol02、nol03和nol04的培养基中获得。
换句话说,菌株是细菌种属的一部分,与同一种属的其他细菌有细微但可识别的差异。菌株也定义为源自单一生物体或纯分离培养物的细菌群。同一种属的菌株在许多方面可能会彼此略有不同。
有利的是使用包含菌株nol03的上述组合物,其中,所述组合物包含所述菌株nol03和至少一种以下菌株,菌株nol03保藏在cncm,编号为cncmi-4607:
-菌株nol01,保藏在cncm,编号为cncmi-4606,
-菌株nol02,保藏在cncm,编号为cncmi-5043,和
-菌株nol04,保藏在cncm,编号为cncmi-4608。
菌株nol01、nol02、nol03和nol04中的至少一种用于分解真菌毒素。这意味着本发明涵盖了菌株的以下15种组合的应用:
-nol01,
-nol02,
-nol03,
-nol04,
-nol01和nol02,
-nol01和nol03,
-nol01和nol04,
-nol02和nol03,
-nol02和nol04,
-nol03和nol04,
-nol01、nol02和nol03,
-nol01、nol02和nol04,
-nol01、nol03和nol04,
一nol02、nol03和nol04,和
-nol01、nol02、nol03和nol04。
所有这些菌株根据“布达佩斯条约”均已保藏在巴黎巴斯德研究所的国家微生物保藏中心(cncm)。
本发明还涵盖了以下代谢物中的一种或多种的使用:
-菌株nol01的一种或多种代谢物,
-菌株nol02的一种或多种代谢物,
-菌株nol03的一种或多种代谢物,
-菌株nol04的一种或多种代谢物,
-菌株nol01的一种或多种代谢物和菌株nol02的一种或多种代谢物,
-菌株nol01的一种或多种代谢物和菌株nol03的一种或多种代谢物,
-菌株nol01的一种或多种代谢物和菌株nol04的一种或多种代谢物,
-菌株nol02的一种或多种代谢物和菌株nol03的一种或多种代谢物,
-菌株nol02的一种或多种代谢物和菌株nol04的一种或多种代谢物,
-菌株nol03的一种或多种代谢物和菌株nol04的一种或多种代谢物,
-菌株nol01的一种或多种代谢物和菌株nol02的一种或多种代谢物和菌株nol03的一种或多种代谢物,
-菌株nol01的一种或多种代谢物和菌株nol02的一种或多种代谢物和菌株nol04的一种或多种代谢物,
-菌株nol01的一种或多种代谢物和菌株nol03的一种或多种代谢物和菌株nol04的一种或多种代谢物,
-菌株nol02的一种或多种代谢物和菌株nol03的一种或多种代谢物和菌株nol04的一种或多种代谢物,和
-菌株nol01的一种或多种代谢物和菌株nol02的一种或多种代谢物和菌株nol03和菌株nol04的一种或多种代谢物.
如果考虑到菌株及其代谢物,则本发明涵盖以下80种组合:
[表1]
[表2]
met:代谢物
如上表所述,本发明因此涵盖许多组合物,所述菌株能够与其代谢物相关联。
在本发明中,分解指的是真菌毒素的破坏,也就是说,通过打断其全部或一些组成原子之间的共价键而破坏,使得分解的最终产物是不再或基本上不再具有其所源自的真菌毒素对动物的毒性的一个或几个其他分子。
根据本发明的组合物的优点在于,它一方面能够分解而不捕获真菌毒素,但是也能够分解几种不同性质的真菌毒素,也就是说,具有不同结构或化学式的真菌毒素。
在本发明中,体外和离体是指不在高等动物有机体(例如鸟类、哺乳动物或鱼)或人中发生的应用,但不排除对微生物、植物或真菌应用的可能。
有利地,本发明涉及在分解至少两种具有不同结构的真菌毒素中的上述应用。
本发明的组合物的目的是使得可以在单次使用中从确定的环境中消除并非一种真菌毒素,而是两种,甚至3、4、5、6、7、8或9,或10种以上具有不同结构或化学式的真菌毒素。
更有利的是,本发明涉及上述应用,其中,所述组合物包含104至1011个菌落,所述菌落基于每ml或g的组合物。
换句话说,在该有利的实施方式中,如果本发明的组合物为液体形式,则当该组合物包含至少两种菌株时,对于每种菌株,所述组合物将包含104至1011个芽孢杆菌菌落。
在本发明中,104至1011个菌落表示:约104、约5.104、约105、约5.105、约106、约5.106、约107、约5.107、约108、约5.108、约109、约5.109、约1010、约5.1010或约1011个菌落。
本领域技术人员容易知道如何确定细菌的数量,特别是通过手动计数(通过使用malassez计数室)或通过使用自动细胞计数器,或通过稀释,然后接种在琼脂上并计数菌落来确定细菌的数量。
更有利地,本发明涉及如前所定义的应用,其中枯草芽孢杆菌的细胞呈孢子形式和/或营养形式。
这意味着如果组合物包含单一菌株,则该菌株可以是孢子形式或营养形式,或孢子形式和营养形式的混合物。相反,如果组合物包含至少两种菌株,则这些菌株都可以都是孢子形式或营养形式,或者它们之一是营养形式,另一个是孢子形式,或者同时既是营养形式又是孢子形式。当组合物包含3或4种上述菌株时,也是这样。
有利地,本发明涉及上述应用,其中,所述真菌毒素由真菌产生,所述真菌属于由选自以下属的真菌组成的组:交链孢霉(alternaria)、曲霉(aspergillus)、比索科霉(byssochkamys)、头孢霉(claviceps)、镰刀霉(fusarium)、赤霉素(gibberella)、海球霉(halosarpheia)、青霉(penicillium)、茎点霉(phoma)、稻瘟霉(pyricularia)和黄萎病霉(verticillium)。
上述真菌无限制地能够产生真菌毒素,该真菌毒素可以被本发明的组合物分解,也就是说,被枯草芽孢杆菌的至少四个分离的菌株分解。本发明组合物相对于现有技术的优点之一是该组合物不限于一种真菌毒素,而是能够分解几乎所有或所有真菌毒素。
有利地,本发明涉及上述应用,其中,所述真菌毒素选自黄曲霉毒素b1、b2、m1、g1和g2,毒素t-2,毒素ht-2,脱氧雪腐镰刀菌烯醇(或雪腐镰刀菌烯醇),玉米赤霉烯酮,伏马菌素b1和赭曲霉毒素a。
黄曲霉毒素由18种结构相近的化合物(一个香豆素和3个呋喃的组合)组成。它们由黄曲霉、寄生曲霉和黑曲霉产生。最常见的包括afb1、afb2、afm1、afg1和afg2。
毒素t-2(3α,4β,8α)-12,13-环氧单端孢霉-9-烯-3,4,8,15-四醇)(4,15-二乙酸酯-8-(3-甲基丁酸酯)是单端孢霉烯家族的真菌毒素。对人和动物有毒。它特别是由镰孢镰刀菌(fusariumsporotrichioioides)、兰氏镰刀菌(fusariumlangsethiae)和梨孢镰刀菌(fusariumpoae)产生。
毒素ht-2是单端孢霉烯家族的真菌毒素。对人和动物有毒。它特别是由镰孢镰刀菌、兰氏镰刀菌和梨孢镰刀菌产生。
don(脱氧雪腐镰刀菌烯醇)是镰刀菌属(f.graminearum,f.culmorum,f.roseum等)的各种真菌污染物产生的,它们在开花时会污染小麦、大麦、燕麦或玉米甚至水稻的谷粒。
玉米赤霉烯酮是由土壤中的某些真菌,镰刀菌产生的真菌毒素,该菌可能在某些植物(特别是草)上定植,从而在其中引起疾病,即镰刀菌病。
伏马菌素是土壤中某些物种的真菌,镰刀菌(主要是f.verticillioides和f.proliferatum)释放的真菌毒素家族,该菌可以在某些植物(特别是草)上定植,从而在其中产生一种称为镰刀菌病的疾病。已知有多种变体,包括伏马菌素b,它的毒性很大,并且大多存在于玉米中。b型伏马菌素可引起猪肺水肿、造成马的致命性白质脑病,并且据推测,它也可能是导致人食道癌的原因。
赭曲霉毒素a是由几种真菌(青霉属和曲霉属)产生的真菌毒素,天然存在于许多植物产品中,例如谷物、咖啡豆、可可和干果。赭曲霉毒素a具有致癌性、肾毒性、致畸性、免疫毒性和潜在的神经毒性。它也与人类肾病有关。
本发明有利地涉及一种用于分解供动物食用的食物中所包含的真菌毒素的方法,该方法包括与包含或基本上由菌株nol01、nol02、nol03和nol04中的至少一种和至少一种其代谢物细菌分泌的分子,例如酶)组成的组合物接触放置的步骤,和可选的在所述枯草芽孢杆菌的菌株温育后失活,尤其是通过加热而失活的步骤,所述菌株分别以编号cncmi-4606、cncmi-5043、cncmi-4607和cncmi-4608保藏在cncm。
本发明进一步涉及对被至少一种真菌毒素污染的物、原料或饲料去污染的方法,所述方法包括将所述食品或饲料与组合物接触放置的步骤,所述组合物包含以下或基本由以下组成:
-菌株nol01、nol02、nol03和nol04中的至少一种,和/或
-至少一种其代谢物,
所述菌株保藏在cncm,编号分别为cncmi-4606、cncmi-5043、cncmi-4607和cncmi-4608。
该方法使得可以对食品进行消毒,特别是通过在适当条件下使被一种或多种真菌毒素污染的食物、原料或饲料暴露于上述组合物来进行。
因此,毒素在所述去污染结束时被分解,从而使所述食物、原料和饲料适合无风险食用。
有利地,本发明涉及上述方法,其中所述食物、原料或饲料被至少两种具有不同结构的真菌毒素污染。
在另一方面,本发明涉及包含以下或基本上由以下组成的组合物:
-菌株nol01、nol02、nol03和nol04中的至少一种,和/或
-至少一种其代谢物,
所述菌株保藏在cncm,编号分别为cncmi-4606、cncmi-5043、cncmi-4607和cncmi-4608,
所述组合物用于治疗患有与摄入至少一种真菌毒素有关的病理的动物,或预防所述病理。
由于具有分解真菌毒素的能力,上述组合物可以预防性地用于在摄入真菌毒素后产生的疾病或症状。同样地,本发明的组合物可以治疗性地施用于所述真菌毒素中毒的动物。
摄入真菌毒素后可能会产生多种作用,例如肝毒性、神经毒性、致突变性、致畸性、致癌性、免疫抑制性和/或对内分泌系统的破坏性。
包含在本发明的组合物中的细菌可以是孢子形成和/或营养形式。以这种形式,它们可以直接通过食物、饮用水或药物口服(经口)施用(通过注射器直接掺入动物的口中)。
更有利地,本发明涉及用于上述应用的组合物,其中该组合物包含每ml或每克组合物104至1011个细菌菌落。
有利的是,本发明涉及用于上述应用的上述组合物,其中所述病理与至少两种具有不同结构的真菌毒素的摄入有关。
通过阅读以下实施例和附图将更好地理解本发明。
附图说明
图1
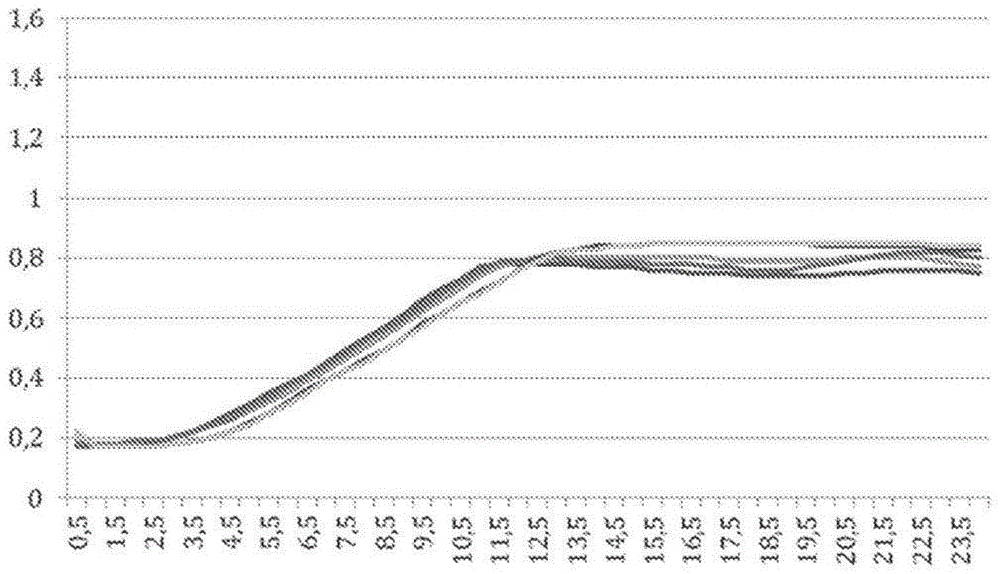
[图1]显示了作为培养基中不同浓度(0、0.1、0.5、1和10ppm)的zea的函数的nol01的生长的图。x轴显示以小时为单位的时间,y轴显示与细菌的生长相关的溶液的吸光度。
图2
[图2]显示了作为培养基中不同浓度(0、0.1、0.5、1和10ppm)的zea的函数的nol02的生长的图。x轴显示以小时为单位的时间,y轴显示与细菌的生长相关的溶液的吸光度。
图3
[图3]显示了作为培养基中不同浓度(0、0.1、0.5、1和10ppm)的zea的函数的nol03的生长的图。x轴显示以小时为单位的时间,y轴显示与细菌的生长相关的溶液的吸光度。
图4
[图4]显示了作为温度的函数(以摄氏度为单位),nol01(黑色)、nol02(白色)和nol03(灰色)对zea分解的百分数。
图5
[图5]显示了作为介质ph的函数,nol01(黑色)、nol02(白色)和nol03(灰色)对zea分解的百分数。
图6
[图6]显示的直方图显示不含zea毒素培养的细菌nol01(黑条)、nol02(深灰条)、nol03(浅灰条)和nol04(白色条),以及用1μg/ml的zea毒素培养的细菌nol01(带斜线的条)、nol02(带水平线的条)、nol03(带垂直线的条)和nol04(带点的条)的作为时间(0、16和72小时)函数的细菌数量(logcfu/ml)。
图7
[图7]是显示菌株nol01(菱形)、nol02(正方形)、nol03(三角形)和nol04(叉)的zea毒素随时间(小时)减少的百分比的图。
图8
[图8]显示了在zea存在下并且作为下述培养基的函数的本发明细菌nol01(深灰色)、nol02(浅灰色)和nol03(黑色)的生长图:富含tsb的培养基(方形点)、最小培养基mm(圆点)。x轴表示时间(小时),并且y轴表示与细菌的生长有关的溶液的吸光度(od600nm)。
实施例
实施例1-体外测试
发明人测试了细菌菌株nol01、nol02、nol03和nol04对zea(玉米赤霉烯酮)降低真菌毒素浓度的性质
1-毒素的存在对细胞生长的影响
用于此测试的zea毒素由sigma-aldrich(milan,italy)提供,其纯度大于99%。将毒素以1mg/ml的浓度溶于乙腈中,然后在带有0.2μm纤维素膜(rc/g)的滤管(labochemsciences.r.1.,italy)上过滤。将适量的标准zea溶液添加到tsb培养基中,以获得所需的最终浓度(1μg/ml)。在有氧条件下,以150rpm的速度搅拌,在存在或不存在1μg/ml的zea的情况下,于30℃在tsb培养基中培养不同的细菌层。
培养数据如图6所示。这些结果表明,菌株nol01、nol02、nol03和nol04也会发育,在浓度为1μg/ml培养基的zea存在下甚至更快。
接下来,测试了培养基中不同浓度的zea,并且结果显示在所有测试的zea浓度下,菌株nol01、nol02和nol03均等发育,如图1-3所示。
最后,还测试了不同的ph和温度条件。获得的结果表明,nol01、nol02和nol03在10℃、20℃和30℃(图4)以及ph5、7和8(图5)下具有降低的zea活性。
这些结果表明,本发明的枯草芽孢杆菌菌株具有在高浓度真菌毒素存在下发育的能力,并且在许多条件下,特别是在ph和温度下,保留了降低真菌毒素浓度的特性。
2-培养后毒素量的测量
在各种上述培养之后,发明人测试了毒素的存在。
为了测量毒素的量,发明人使用了dontesttm和zearalatesttm吸收试剂盒(vicam/waterscorporation,milford,ma,usa)。
将每种培养物的0.5ml上清液与1.5ml磷酸盐缓冲液(pbs)混合,并以每秒一滴的速度施加到相应的色谱柱上以使毒素解吸。接下来,将柱用5ml蒸馏水以相同速度洗涤。
然后将毒素用2ml甲醇洗脱,并将洗脱液在50℃干燥。接下来,将干燥产物转移到250μlh2o:meoh85∶15的混合物中,然后进行lc质谱分析。
为了检测zea毒素,发明人使用了agilent1100hplc系统装置。条件如下:
-分析柱:
-流动相:水+甲醇+乙腈50+25+25(v/v/v)isocratic;
-流速:0.800ml/min;
-保留时间:6.7min;
-荧光274nmλ(ex)和440nmλ(em)。
对于zea毒素获得的结果在下表和图3中显示:
[表3]
*3次独立研究获得的%平均值和标准差
这些结果表明,使用nol01、nol03和nol04在24小时后,zea几乎完全减少(超过94%),而对于nol02,其减少了超过50%。
为了证实这些结果,发明人对zea毒素重复了相同的实验。结果如下表所示:
[表4]
*3次独立研究获得的%平均值和标准差
由于值p大于0.05,因此结果被认为是可重复的。*:第一组测试,**:第二组测试。
3-对细菌的吸附试验
接下来,发明人测试了毒素是否吸附在细菌上。
为此,对在zea存在下24小时后的细菌培养物进行如下处理:
将细菌沉淀物转移到1ml乙腈:水(90:10;v/v)混合物中,并用涡旋剧烈搅拌混合物,最后在14,000g下离心20分钟。然后将得到的上清液在50℃下干燥,将干燥的残留物转移到1ml水:甲醇85∶15v/v混合物中,以通过以上详述的光谱进行分析。
下表中列出了zea解吸结果:
[表5]
*3次独立研究获得的%平均值和标准差
这些结果表明,鉴于解吸zea的量少,毒素要么被内在细菌内化,要么被所述细菌分解。
4-细菌分解的测试
为了测试细菌分解的假设,发明人检验了细菌中毒素的直接存在。
为此,从用1μg/ml的zea培养24小时的细菌中,将细菌沉淀物转移到1ml的乙腈∶水混合物(90∶10;v/v)中,并通过超声处理进行裂解。超声处理的条件如下:探头直径:3.175mm,频率:20khz,幅度:50%,超声处理:15秒,然后停止15秒(6次),超声时间:总计90秒(不计暂停时间),温度:4℃。
超声处理后,将样品在14,000g下离心20分钟。将获得的上清液随后在50℃下干燥,并将干燥的残余物转移至1ml水∶甲醇85∶15v/v混合物中,以通过在下文中详细描述的分光光度法进行分析。设备:
从不同沉淀中提取的zea结果如下:
[表6]
*3次独立研究获得的%平均值和标准差
这些结果表明,即使在裂解细菌时,也无法检测到zea,这意味着真菌毒素被细菌分解。
5-在无氧条件下培养
发明人还根据1-,但是在不存在氧气的情况下测试了细菌的生长条件。
接下来,根据上述方案,在这些条件下测量了zea真菌毒素的分解。
下表中提供了结果:
[表7]
*在1μg/ml真菌毒素存在下培养24小时后完成测试
**在3个标准差样本中获得的%平均值
这些结果表明,不管培养条件如何(有、无氧),细菌都能分解真菌毒素。
6-在最小培养基中培养
发明人还根据1-测试细菌生长条件,但是在最小培养基中,即贫化的非富集培养基(mm),不添加除真菌毒素提供的碳以外的碳,1l的培养基组成如下:
[表8
这些结果表明,本发明的枯草芽孢杆菌菌株具有在最小培养基mm中发育的能力,不过其生长水平低于在富培养基tsb中的生长水平。
遵循上述不同的培养方法,以及根据1-,但在mm培养基中存在20μg/ml的zea、在无氧条件下在mm培养基中存在1μg/ml的zea、在用no3再富集的最小培养基(mmn)中、和用no3和葡萄糖再富集的最小培养基(mmng)中进行的其他培养,发明人测试了在t=72h时根据2-的毒素的存在。
下表显示了对于zea毒素获得的结果:
[表9]
*3个样品获得的%的平均值
这些结果表明,在有氧条件下,无论最初的zea浓度如何,在最小培养基mm中获得的zea减少量都可与在富培养基tsb中观察到的减少量相提并论。
在无氧条件下,通过在以no3和葡萄糖再富集的最小培养基(mmng)中测试,本发明的三种菌株都实现了与富培养基tsb中相同的真菌毒素分解水平。在no3再富集的最小培养基(mmn)中,对nol03有相同的发现。
这些结果表明,不管培养基是什么(富培养基、最小培养基或在富集的最小培养基),根据本发明的细菌都能够分解真菌毒素,在富培养基和再富集的最小培养基中具有更大的功效。
7-zea以外的真菌毒素的减少
本发明人还根据1-但是在zea以外的真菌毒素的存在下进行了本发明的细菌培养,然后对于每种被测试的真菌毒素,在t=72小时使用合适的吸收试剂盒,根据2-测定了培养后毒素的量。
[表10]
*3个样品获得的%的平均值
这些结果显示,在有氧条件下,nol01对zea、ota和t-2的减少能力,对于后两种真菌毒素观察到的效果较低。同样,它们显示nol02和nol03减少zea、fb1和ota的能力,对于最后两种真菌毒素观察到的效果较低。
8-组合的nol01、nol02和nol03细菌的功效测试
本发明人还在zea、afb1和fb1的存在下,在富含培养基(tsb)或以no3和葡萄糖再富集的最小培养基(mmng)中,但含有1μg/ml的以等比例实施的本发明三种细菌nol01、nol02、nol03的接种物,根据1-进行了根据本发明的细菌培养。
[表11]
*3个样品获得的%的平均值
这些结果显示,无论是在富氧培养基(tsb)中的有氧条件下,还是在以no3和葡萄糖再富集的最小培养基(mmng)中的无氧条件下,组合的nol01、nol02和nol03细菌的减少zea真菌毒素的存在的能力。还注意到有在无氧条件下和mmng培养基中减少该池中afb1和fb1的能力,不过它减少更多。
9-抗zea代谢物功效的测定
发明人证实了在最小培养基(mm)中的有氧条件下和在以no3和葡萄糖再富集的最小培养基(mmng)中的无氧条件下,根据1-但对zea的代谢产物,本发明的菌株nol01、nol02和nol03减少真菌毒素的能力。
[表12]
*3次独立研究获得的%平均值和标准差
这些结果证实,不管培养条件(存在或不存在氧气、富培养基、再富集的最小培养基或最小培养基),根据本发明的细菌都能够分解zea及其代谢物。
实施例2-猪的体内测试
本发明人还在猪体内条件下测试了根据本发明的细菌,以证明其在动物中的功效。
1-程序
发明人在实验站中对64只断奶仔猪进行了21天的饲喂测试,分为2个测试,一个对zea测试,另一个对don测试(或每个测试32只仔猪)。
以下饮食用于这些测试中的每一个测试(或每种饮食8只仔猪):
(1)无添加剂的无污染食物,
(2)未污染食物+添加剂
(3)无添加剂的被污染的食物
(4)被污染的食物+添加剂
对于饮食(3)和(4),分配给动物的食物被人工污染,量为0.1mgzea/kg完全食物,水分含量为12%,或者根据欧洲委员会的2006/576/ec号推荐的欧洲条例推荐的最大含量。
对于don的测试,使用相同的4种饮食,对饮食(3)和(4)进行食物人工污染,量为0.9mgdon/kg完全食物,水分为12%。
在测试开始时就分析了真菌毒素的量,并确认了所分配食品的污染具有良好的均质性。
所添加的添加剂对应于以等比例实施的本发明的3个菌株nol01、nol2和nol3的组合。粉末状的这种添加剂被添加到经真菌毒素人工污染后分配给动物的食物中,和分配给动物之前的食物中,其添加量足以达到每kg食物109个细菌菌落。
每天仔猪每天分发约1.5千克食物。
将动物以每只代谢笼子1只动物分发以用于zea测试,并且以每圈1只动物分发以don进行测试。
为了避免在向断奶后过渡的过程中给动物施加压力,并使处于代谢笼中的动物适应zea的试验,在开始试验饮食前进行3周的适应期。
在3周的适应期结束时,测试开始并持续3周(21天)。
2-分析和动物技术参数
在整个测试过程中收集了以下样本:
-所有动物在第0、7、14和21天的血样,
-在第17天到第21天之间收集粪便和尿液,以进行zea测试,
-21天收集粪便,屠宰,以进行don的检测,
-在第21天收集组织样品:肝、肾、肌肉、生殖器官、肠道。
对于收集的样品,作为测试结束时收集的样品的优先级,进行了以下分析:
-检测从zea测试的动物收集的血浆、尿液和粪便中的zea及其代谢物α-玉米赤霉烯醇和β-玉米赤霉烯醇,
-检测从don测试的动物收集的血清中的don及其代谢产物。
对于两个测试,都记录了以下动物技术参数:体重、平均每日食物消耗、死亡率、发病率。对于zea的测试,还记录以下参数:外阴的尺寸和/或外阴的炎症程度,生殖器官的重量。
本发明不限于所描述的实施方式,并且其他实施方式对于本领域技术人员将显而易见。
pct/ro/134表
- 还没有人留言评论。精彩留言会获得点赞!