一种马尾藻多糖提取物及其制备方法和应用与流程
本发明属于生物
技术领域:
,涉及一种马尾藻多糖提取物及其制备方法和应用,具体涉及马尾藻多糖提取物、该马尾藻多糖提取物的制备方法以及该马尾藻多糖提取物在水产养殖中的应用。
背景技术:
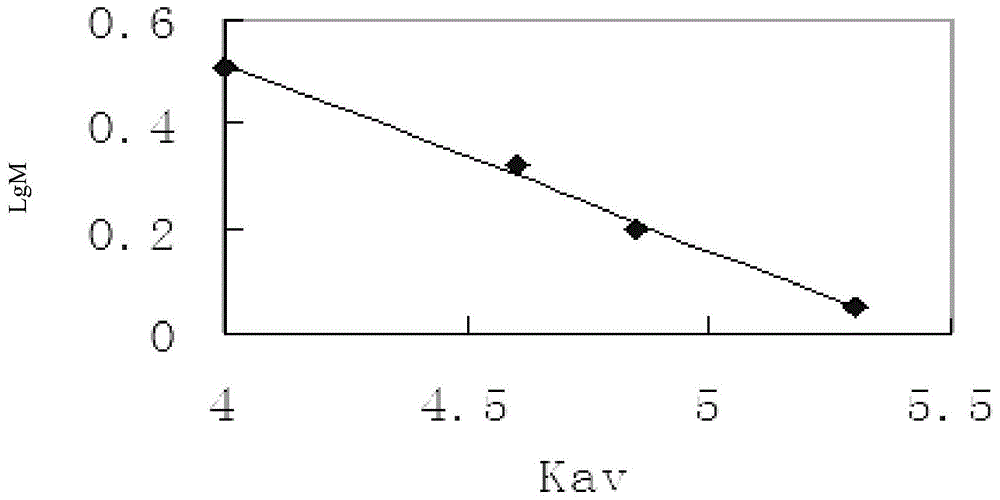
:广西是我国罗氏沼虾虾苗生产和供应的传统产区,也是我国罗氏沼虾养殖技术的发源地。广西罗氏沼虾的年产量占全国总产苗量的80%以上,作为单一品种在我国形成了蓬勃发展的产业。罗氏沼虾育苗和养殖所创造的高额利润曾经成为我国水产行业的一个奇迹。但是,随着集约化高产化养殖模式的推广,罗氏沼虾肌肉白浊病(又称白尾病,wtd)大量发生,该病的病原体是诺达病毒(mrnv),主要危害罗氏沼虾虾苗,患病虾苗出现肌肉白浊、白斑或白尾症状,导致病虾大量死亡,严重时死亡率可高达60%~100%,目前是罗氏沼虾育苗和养殖的主要疾病。由于引种混乱、新病原的出现、繁育技术滞后以及养殖环境的恶化等问题,导致了目前罗氏沼虾育苗成活率低、病害高发、苗种质量差,严重阻碍了广西罗氏沼虾养殖产业的健康发展。因此,推广利用既提高产品质量,又减少病害的中草药免疫增强剂防治水产养殖病害技术,是做罗氏沼虾病害防治工作的重中之重。技术实现要素:本发明的目的是提供一种马尾藻多糖提取物及其制备方法和应用。本发明提供了一种制备马尾藻多糖的方法,包括如下步骤:(1)马尾藻干燥并粉碎;(2)依次用水和ⅱ型ztc1+1天然澄清剂进行提取;(3)进行干燥,得到粗提物;(4)用胰蛋白酶处理,然后进行乙醇沉淀,然后在水中透析,然后进行干燥,得到粗多糖;(5)依次进行离子交换层析和分子筛层析,然后进行干燥,得到马尾藻多糖。本发明还提供了一种制备马尾藻多糖的方法,包括如下步骤:(1)马尾藻干燥并粉碎,得到马尾藻粉;(2)取马尾藻粉,加入水,进行提取,然后离心收集上清液;(3)取步骤(2)得到的上清液,进行常压蒸馏,得到粗提液;(4)取步骤(3)得到的粗提液,加入水,然后加入b溶液并反应,然后加入a溶液并反应,然后离心收集上清液;所述b溶液为含有ⅱ型ztc1+1天然澄清剂b组分的溶液;所述a溶液为含有ⅱ型ztc1+1天然澄清剂a组分的溶液;(5)取步骤(4)得到的上清液,加入乙醇溶液,静置,然后收集沉淀;(6)取步骤(5)得到的沉淀,依次用无水乙醇和无水丙酮洗涤,然后减压干燥至恒重,即为粗提物;(7)取步骤(6)得到的粗提物,溶解于水,然后加入胰蛋白酶并反应,然后加入乙醇并静置,然后收集上清液;(8)取步骤(7)得到的上清液,过滤,收集滤液;(9)将步骤(8)得到的滤液转移到透析袋中,在水中进行透析,然后冷冻干燥,得到粗多糖;(10)取步骤(9)得到的粗多糖,溶于水,得到上样液,然后进行离子交换层析,收集多糖峰对应的过柱后溶液,转移到透析袋中,在水中进行透析,然后冷冻干燥;(11)取步骤(10)的产物,溶于水,得到上样液,然后进行分子筛层析,收集目标峰对应的过柱后溶液,冷冻干燥,得到马尾藻多糖。本发明还提供了一种制备马尾藻粗提物的方法,包括如下步骤:(1)马尾藻干燥并粉碎;(2)依次用水和ⅱ型ztc1+1天然澄清剂进行提取;(3)进行干燥,得到粗提物。本发明还提供了一种制备马尾藻粗提物的方法,包括如下步骤:(1)马尾藻干燥并粉碎,得到马尾藻粉;(2)取马尾藻粉,加入水,进行提取,然后离心收集上清液;(3)取步骤(2)得到的上清液,进行常压蒸馏,得到粗提液;(4)取步骤(3)得到的粗提液,加入水,然后加入b溶液并反应,然后加入a溶液并反应,然后离心收集上清液;所述b溶液为含有ⅱ型ztc1+1天然澄清剂b组分的溶液;所述a溶液为含有ⅱ型ztc1+1天然澄清剂a组分的溶液;(5)取步骤(4)得到的上清液,加入乙醇溶液,静置,然后收集沉淀;(6)取步骤(5)得到的沉淀,依次用无水乙醇和无水丙酮洗涤,然后减压干燥至恒重,即为粗提物。本发明还提供了一种制备马尾藻粗多糖的方法,包括如下步骤:(1)马尾藻干燥并粉碎;(2)依次用水和ⅱ型ztc1+1天然澄清剂进行提取;(3)进行干燥,得到粗提物;(4)用胰蛋白酶处理,然后进行乙醇沉淀,然后在水中透析,然后进行干燥,得到粗多糖。本发明还提供了一种制备马尾藻粗多糖的方法,包括如下步骤:(1)马尾藻干燥并粉碎,得到马尾藻粉;(2)取马尾藻粉,加入水,进行提取,然后离心收集上清液;(3)取步骤(2)得到的上清液,进行常压蒸馏,得到粗提液;(4)取步骤(3)得到的粗提液,加入水,然后加入b溶液并反应,然后加入a溶液并反应,然后离心收集上清液;所述b溶液为含有ⅱ型ztc1+1天然澄清剂b组分的溶液;所述a溶液为含有ⅱ型ztc1+1天然澄清剂a组分的溶液;(5)取步骤(4)得到的上清液,加入乙醇溶液,静置,然后收集沉淀;(6)取步骤(5)得到的沉淀,依次用无水乙醇和无水丙酮洗涤,然后减压干燥至恒重,即为粗提物;(7)取步骤(6)得到的粗提物,溶解于水,然后加入胰蛋白酶并反应,然后加入乙醇并静置,然后收集上清液;(8)取步骤(7)得到的上清液,过滤,收集滤液;(9)将步骤(8)得到的滤液转移到透析袋中,在水中进行透析,然后冷冻干燥,得到粗多糖。所述步骤(1)具体可为:马尾藻干燥并粉碎,过100目筛,得到马尾藻粉。所述步骤(2)中:进行提取的条件具体可为70-90℃水浴中提取7-9h。所述步骤(2)中:进行提取的条件具体可为80℃水浴中提取8h。所述步骤(2)中:进行提取的过程中进行搅拌。所述搅拌具体可为60rpm搅拌。所述步骤(2)中:离心的条件具体可为1800-2200rpm离心5-15min。所述步骤(2)中:离心的条件具体可为2000rpm离心10min。步骤(2)中的马尾藻粉、步骤(2)中的水、步骤(3)中的粗提液的配比为:100g马尾藻粉:1800-2200ml水:300-500ml粗提液。步骤(2)中的马尾藻粉、步骤(2)中的水、步骤(3)中的粗提液的配比为:100g马尾藻粉:2000ml水:400ml粗提液。所述a溶液中,ⅱ型ztc1+1天然澄清剂a组分的浓度为0.5-1.5g/100ml。所述a溶液中,ⅱ型ztc1+1天然澄清剂a组分的浓度为1g/100ml。所述a溶液是将ⅱ型ztc1+1天然澄清剂a组分溶于水得到的。所述b溶液中,ⅱ型ztc1+1天然澄清剂b组分的浓度为0.5-1.5g/100ml。所述b溶液中,ⅱ型ztc1+1天然澄清剂b组分的浓度为1g/100ml。所述b溶液是将ⅱ型ztc1+1天然澄清剂b组分溶于1g/100ml乙酸水溶液得到的。所述步骤(4)中:加入b溶液并反应时,反应条件为50~80℃反应1.5-2.5小时。所述步骤(4)中:加入b溶液并反应时,反应条件具体为60℃反应2小时。所述步骤(4)中:加入b溶液并反应时,反应过程中进行搅拌。所述搅拌具体可为间隔时间搅拌,例如每30min搅动1次。所述步骤(4)中:加入a溶液并反应时,反应条件为50~80℃反应1.5-2.5小时。所述步骤(4)中:加入a溶液并反应时,反应条件具体为60℃反应2小时。所述步骤(4)中:加入a溶液并反应时,反应过程中进行搅拌。所述搅拌具体可为间隔时间搅拌,例如每1小时搅动1次。所述步骤(4)中:离心的条件具体可为3500-4500rpm离心3-7min。所述步骤(4)中:离心的条件具体可为4000rpm离心5min。步骤(4)中的粗提液、步骤(4)中的水、步骤(4)中的b溶液、步骤(4)中的a溶液的配比为:200ml粗提液:600-1000ml水:6-10mlb溶液:3-5mla溶液。步骤(4)中的粗提液、步骤(4)中的水、步骤(4)中的b溶液、步骤(4)中的a溶液的配比为:200ml粗提液:800ml水:8mlb溶液:4mla溶液。所述步骤(5)中:静置的条件具体可为2-4℃静置8-16小时。所述步骤(5)中:静置的条件具体可为2-4℃静置12小时。所述步骤(5)中:完成静置后,可采用普通滤纸过滤,以收集沉淀。所述步骤(5)中:乙醇溶液为乙醇水溶液。所述步骤(5)中:乙醇溶液为95%(体积比)乙醇溶液。步骤(5)中:上清液与乙醇溶液的配比为:1体积份上清液:3-5体积份乙醇溶液。步骤(5)中:上清液与乙醇溶液的配比为:1体积份上清液:4体积份乙醇溶液。所述步骤(6)中,减压干燥的条件具体可为:50℃、0.6mpa。所述步骤(7)中:加入胰蛋白酶并反应的反应条件为35-40℃反应20-40min。所述步骤(7)中:加入胰蛋白酶并反应的反应条件为37℃反应30min。所述步骤(7)中:静置的条件为2-4℃静置8-24小时。所述步骤(7)中:静置的条件为2-4℃静置12小时。所述步骤(7)中:乙醇为无水乙醇。步骤(7)中:粗提物、水、胰蛋白酶和乙醇的配比为:10g粗提物:80-120ml水:4-6g胰蛋白酶:20-30ml乙醇。步骤(7)中:粗提物、水、胰蛋白酶和乙醇的配比为:10g粗提物:100ml水:5g胰蛋白酶:25ml乙醇。所述步骤(7)中:所述胰蛋白酶的酶活规格为200-300.n.f.u/mg。所述步骤(7)中:所述胰蛋白酶的酶活规格为250.n.f.u/mg。所述步骤(8)中:过滤采用0.45μm滤膜。所述步骤(9)中:透析袋的截留分子量为14000道尔顿。所述步骤(10)中:5ml上样液中含有200mg粗多糖。所述步骤(10)中:柱子型号为b-024201),内径为16mm,高度为20cm;填充物为离子交换纤维素deae-cellulose32(de-32)。所述步骤(10)中:离子交换层析的洗脱过程为:①用水冲洗柱子;②将5ml上样液上样;③用2个柱体积的水平衡柱子;④采用流动相进行洗脱(流动相为a液或b液或a液和b液的混合液;流动相的流速为1ml/min),0min至40min、b液占流动相的体积份数由0%线性上升至66.7%,41min至60min、b液占流动相的体积份数由66.7%线性上升至100%,连续收集过柱后溶液(每3ml收集一管)。a液为水,b液为3mol/lnacl水溶液。所述步骤(10)中:收集多糖峰对应的过柱后溶液为收集第7管过柱后溶液。所述步骤(10)中:透析袋的截留分子量为14000道尔顿。所述步骤(11)中:0.5ml上样液中含有2mg产物。所述步骤(11)中:采用sephadexg-100柱(1cm×15cm)。所述步骤(11)中:分子筛层析的洗脱过程为:用水平衡,然后上样0.5ml上样液,然后用水洗脱(流速0.12ml/min),连续收集过柱后溶液(每3ml收集一管)。所述步骤(11)中:收集目标峰对应的过柱后溶液为收集第14管过柱后溶液。本发明还保护以上任一所述方法制备得到的马尾藻多糖。本发明还保护以上任一所述方法制备得到的马尾藻粗提物。本发明还保护以上任一所述方法制备得到的马尾藻粗多糖。本发明还保护所述马尾藻多糖、所述马尾藻粗提物或所述马尾藻粗多糖的应用,为如下(a)和/或(b)和/或(c)和/或(d):(a)制备水产动物饲料添加剂;(b)制备水产动物饲料;(c)制备水产动物免疫促进剂;(d)制备水产动物抗病毒制剂。本发明还保护一种产品,其活性成分为所述马尾藻多糖、所述马尾藻粗提物或所述马尾藻粗多糖;所述产品的功能为如下(e)和/或(f)和/或(g)和/或(h):(e)水产动物饲料添加剂;(f)水产动物饲料;(g)水产动物免疫促进剂;(h)水产动物抗病毒制剂。本发明还保护马尾藻多糖的应用,为如下(a)和/或(b)和/或(c)和/或(d):(a)制备水产动物饲料添加剂;(b)制备水产动物饲料;(c)制备水产动物免疫促进剂;(d)制备水产动物抗病毒制剂。以上任一所述病毒为诺达病毒。以上任一所述病毒为罗氏沼虾诺达病毒。以上任一所述马尾藻为半叶马尾藻。以上任一所述水产动物为虾。以上任一所述虾为罗氏沼虾。目前国内外对海藻多糖的提取和临床试验,主要是利用混合藻类作为原料来源进行提取或者将混合种属的藻类粉碎后直接使用,海藻多糖在提取技术方面一直难以攻克多糖提取难、提取率低和成本高的难题,并且提取物存在着质量不稳定、机体利用率低的特点。本发明采用马尾藻作为多糖提取的单一来源,保证了马尾藻多糖的纯度高、成分明确、质量稳定、机体利用率高的特性。本发明经过优化选择的方法,为海藻多糖的提取提供了一组经济实用、具有可操作性、提取率高、产品质量稳定的新途径,将本发明提取的马尾藻多糖作为免疫增强剂应用于罗氏沼虾养殖,取得了良好的免疫效果和养殖效果,为马尾藻提供了一个非常具有社会价值和经济价值的新用途,同时也为马尾藻多糖的生产开发和应用提供了有力理论依据。附图说明图1为标准葡聚糖的分子量标准曲线。图2为马尾藻多糖经sephadexg-100洗脱曲线。图3为精制马尾藻多糖的红外光图谱。图4为标准单糖的气相色谱图。图5为精制马尾藻多糖的气相色谱图。具体实施方式以下的实施例便于更好地理解本发明,但并不限定本发明。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的试验材料,如无特殊说明,均为自常规生化试剂商店购买得到的。以下实施例中的定量试验,均设置三次重复实验,结果取平均值。实施例中的马尾藻为采集自南海浅海海域的半叶马尾藻。罗氏沼虾:体长4.5±0.55cm,体重0.60±0.01g。提及罗氏沼虾诺达病毒(mrnv)的文献:两种检测罗氏沼虾诺达病毒方法的比较.安徽农学通报,2014(8):151-152。实施例2和实施例3中采用的马尾藻多糖是实施例1的步骤四制备的精制马尾藻多糖(用sp表示)。基础饲料组成(配方中的%均代表质量百分比):豆粕14%、鱼粉55%、面粉5.2%、虾粉7%、鱼油6.5%、麦麸2.3%、多维多矿4%、大豆磷酯6%。基础饲料,制成粒径为1.5mm的颗粒,即为饲料0。99.9质量份基础饲料与0.1质量份sp混匀,然后制成粒径为1.5mm的颗粒,即为饲料1。99.85质量份基础饲料与0.15质量份sp混匀,然后制成粒径为1.5mm的颗粒,即为饲料2。99.8质量份基础饲料与0.2质量份sp混匀,然后制成粒径为1.5mm的颗粒,即为饲料3。试验数据用国际权威统计分析软件thesassystemforwindowsv8处理。p<0.05表示差异显著;p<0.01表示差异极显著。实施例1、马尾藻多糖的制备和鉴定一、制备粗提液1、马尾藻晒干后粉碎,过100目筛,得到马尾藻粉。2、取100g马尾藻粉,加入2000ml蒸馏水,置于80℃水浴中提取8h(60rpm搅拌),然后2000rpm离心10min,收集上清液。3、取步骤2得到的全部上清液,常压蒸馏至体积为400ml,即为粗提液。二、制备粗提物ⅱ型ztc1+1天然澄清剂a组分(简称a组分):郑州富太化工有限公司,67-03-8。ⅱ型ztc1+1天然澄清剂b组分(简称b组分):郑州富太化工有限公司,67-03-8。将a组分溶于蒸馏水,使其浓度为1g/100ml,即为a溶液。将b组分溶于1g/100ml乙酸水溶液,使其浓度为1g/100ml,即为b溶液。1、取200ml步骤一制备的粗提液,加800ml水。2、60℃(实际应用中,50~80℃均可)进行如下操作:完成步骤1后,先加入8mlb溶液孵育2h(每30min搅动1次),然后加入4mla溶液孵育2h(1h后搅动1次)。3、完成步骤2后,4000rpm离心5min,收集上清液。4、取1体积份步骤3得到的上清液,加入4体积份95%(体积比)乙醇水溶液,2-4℃静置12小时,然后用普通滤纸过滤,收集沉淀。5、取步骤4得到的沉淀,先用无水乙醇洗涤3次,再用无水丙酮洗涤三次,然后进行减压干燥(50℃、0.6mpa)至恒重,即为马尾藻粗提物。三、制备粗多糖1、取10g步骤二制备的马尾藻粗提物,溶解于100ml蒸馏水,加入5g胰蛋白酶,37℃反应30min,然后加入25ml无水乙醇,2-4℃静置12小时,收集上清液。胰蛋白酶(酶活为250.n.f.u/mg):北京索莱宝科技有限公司,货号t8150。2、取步骤1得到的上清液,用0.45μm滤膜过滤,收集滤液。3、将步骤2得到的滤液转移到透析袋(截留分子量为14000道尔顿)中,将透析袋置于蒸馏水中透析48h,然后收集透析袋中的液相,真空冷冻干燥,得到粗多糖。四、制备马尾藻多糖1、采用离子交换层析进行纯化。将步骤三得到的粗多糖溶于蒸馏水,得到上样液。5ml上样液中含有200mg粗多糖。柱子型号为b-024201(上海垒固仪器有限公司),内径为16mm,高度为20cm;填充物为离子交换纤维素deae-cellulose32(de-32)。a液为蒸馏水,b液为3mol/lnacl水溶液。步骤:①用蒸馏水冲洗柱子;②将5ml上样液上样;③用2个柱体积的蒸馏水平衡柱子;④采用流动相进行洗脱(流动相为a液或b液或a液和b液的混合液;流动相的流速为1ml/min),0min至40min、b液占流动相的体积份数由0%线性上升至66.7%,41min至60min、b液占流动相的体积份数由66.7%线性上升至100%,连续收集过柱后溶液(每3ml收集一管)。用苯酚-硫酸法检测多糖峰,最终选择收集的第7管过柱后溶液。取收集的第7管过柱后溶液,转移到透析袋(截留分子量为14000道尔顿)中,将透析袋置于蒸馏水中透析48h,然后收集透析袋中的液相,真空冷冻干燥。2、采用分子筛层析进行纯化将步骤1得到的产物溶于蒸馏水,得到上样液。0.5ml上样液中含有2mg产物。sephadexg-100柱(1cm×15cm),用蒸馏水平衡,然后上样0.5ml上样液,然后用蒸馏水洗脱(流速0.12ml/min),连续收集过柱后溶液(每3ml收集一管)。标准葡聚糖的分子量标准曲线见图1。标准糖:dextrant-l0,t-40,t-70,t-200,蓝葡聚糖2000及glucose。ve=a-blgm,kav=k1-k2lgm,kav=(ve-vo)/(vt-v0);其中a、b、k1和k2为常数,vo为柱的死体积(用蓝葡聚糖2000测得),vt为柱的总体积(用glucose测得)。测得已知分子量的标准多糖的洗脱体积ve,计算其kav,即可作出kav-igm的标准曲线。以标准葡聚糖分子量(y)以10为底的对数值为纵坐标,相应的洗脱体积(x)为横坐标,得到标准曲线图,相关方程:y=-0.3578x+1.947,其中r2=0.9954。从方程中可以看出,标准葡聚糖的分子量与其相应的洗脱体积呈负相关的关系,即分子量越大,洗脱体积就越小。图2为马尾藻多糖经sephadexg-100洗脱曲线,目标峰值位于第14管。根据标准葡聚糖分子量曲线图对应的方程计算马尾藻多糖的分子量,为52308。收集的第14管过柱后溶液进行真空冷冻干燥,得到的干粉即为精制马尾藻多糖。图3为精制马尾藻多糖的红外光图谱。3600~3200cm-1出现的宽且强的峰是o-h和n-h的伸缩振动,是糖类共有的,存在分子间和分子内氢键。2940cm-1的一组峰是糖类的c-h伸缩振动峰,是马尾藻多糖中甲基的吸收峰,1200~1400cm-1的一组峰是c-h的变角振动,它们是糖类的特征峰。1200~1400cm-1间比较大的一组吸收峰是由两种c-o伸缩振动所引起,其中一种属于c-o-h,另一种是糖环的c-o-c。923cm-1和770cm-1处的吸收峰是吡喃糖环非对称伸缩振动和对称振动所引起的c-o-c骨架振动。1600~1650cm-1的一组吸峰是ch3conh-酰胺特征。843cm-1是吡喃糖α-型c-h变角振动的特征峰。这些吸收峰和振动方式都是多糖的振动特征峰。图4为标准单糖的气相色谱图(依次为如下单糖:鼠李糖、木糖、甘露糖、葡萄糖、半乳糖、果糖)。图5是精制马尾藻多糖的气相色谱图。将sp气相色谱出峰时间和标准单糖对比,表明sp中至少包括鼠李糖、木糖、甘露糖、葡萄糖、半乳糖和果糖。实施例2、马尾藻多糖对罗氏沼虾免疫调节作用一、分组养殖320尾罗氏沼虾,随机分为四组,每组80尾,饲养于150×80×60cm的水族箱内。整个试验为30天,即试验第1天至试验第30天。对照组:投喂饲料0,每天上午和下午各投料一次,常温养殖30d。试验组1:投喂饲料1,每天上午和下午各投料一次,常温养殖30d。试验组2:投喂饲料2,每天上午和下午各投料一次,常温养殖30d。试验组3:投喂饲料3,每天上午和下午各投料一次,常温养殖30d。养殖过程中,每周测量虾体重,根据虾体重调整投料量,每次投料质量为虾体重的5%。二、sp对罗氏沼虾平均增重率的影响第一次投喂24小时前称虾初始体质量(w0),最后一次投喂24小时后称虾体质量(w1),计算平均增重率(t)。称重前24h停止投料。试验结束后统计成活率。t=w1-w0。饲料系数(fcr)=饲料消耗总质量/(w1-w0)。结果见表1。与对照组相比:试验组1的罗氏沼虾的平均增重率差异显著(p<0.05),成活率极显著提高(p<0.01),饲料系数极显著降低(p<0.01);试验组2的罗氏沼虾的平均增重率和成活率极显著提高,饲料系数极显著降低(p<0.01);试验组3的罗氏沼虾的成活率显著提高,平均增重率差异极显著(p<0.01)。表1sp对罗氏沼虾平均增重率的影响测定指标/组别对照组试验组1试验组2试验组3平均增重率(%)40.34±3.1146.27±3.54*54.08±3.11**51.20±4.28**成活率60.58±1.3769.24±2.45**71.42±2.07**65.60±1.25*饲料系数1.30±0.0011.26±0.001**1.26±0.002**1.27±0.002注:与对照组相比较*p<0.05和**p<0.01三、sp对罗氏沼虾相关免疫指标的影响试验的第30d,每组随机抽取罗氏沼虾30尾,用1ml注射器、5号针头自虾的头胸甲后插入心脏取血淋巴液0.3ml,3000rpm离心10min,取上清液,用于溶菌酶、sod、po和acp的活力测定。溶菌酶测定试剂盒(a050)、acp测定试剂盒(a060)、sod测定试剂盒(a001)和po测定试剂盒(a110)均为南京建成生物工程研究所的产品。sp对罗氏沼虾免疫相关酶活性的影响结果见表2。由表2可知,与对照组相比较,在饲料中添加0.1%的sp,能显著提高溶菌酶和po的活性(p<0.05);添加0.15%的sp,能显著提高溶菌酶活性(p<0.05)并极显著提高po和sod活性(p<0.01);添加0.2%的sp,能极显著提高溶菌酶和po活性(p<0.01),并显著提高sod和acp活性(p<0.05)。表2sp对罗氏沼虾溶菌酶、po、acp、sod活力的影响组别溶菌酶(u/ml)po(u/ml)sod(u/ml)acp(u/ml)对照组0.040±0.01580.089±45.3600.261±0.1150.39±30.116试验组10.175±0.122*220.467±215.376*0.296±0.1330.63±46.595试验组20.180±0.376*321.367±219.416**0.463±0.189**0.68±45.270试验组30.210±0.076**262.830±203.081**0.365±0.152*0.73±42.950*注:与对照组相比较,*p<0.05和**p<0.01;实施例3、sp对罗氏沼虾抗感染保护作用罗氏沼虾,随机分为四组,每组250尾,饲养于150×80×60cm的水族箱内。整个试验为30天,即试验第1天至试验第30天。养殖过程中,每周测量虾体重,根据虾体重调整投料量,每次投料质量为虾体重的5%。对照组:每天上午和下午各投料一次,常温养殖30d;试验第2天下午投料采用含罗氏沼虾诺达病毒的饲料0(诺达病毒剂量为100tcid50),其他投料均采用饲料0。试验组1:每天上午和下午各投料一次,常温养殖30d;试验第2天下午投料采用含罗氏沼虾诺达病毒的饲料1(诺达病毒剂量为100tcid50),其他投料均采用饲料1。试验组2:每天上午和下午各投料一次,常温养殖30d;试验第2天下午投料采用含罗氏沼虾诺达病毒的饲料2(诺达病毒剂量为100tcid50),其他投料均采用饲料2。试验组3:每天上午和下午各投料一次,常温养殖30d;试验第2天下午投料采用含罗氏沼虾诺达病毒的饲料3(诺达病毒剂量为100tcid50),其他投料均采用饲料3。试验第31天,统计死亡率,计算免疫保护率。免疫保护率=1-死亡率。结果见表3。由表3可见,在饲料中添加0.1%、0.15%、0.2%的sp,均能明显地提高罗氏沼虾对mrnv的抗感染率,其中以0.20%的sp组的保护率最高。表3sp对罗氏沼虾的抗感染保护作用组别攻毒尾数死亡尾数死亡率(%)免疫保护率(%)对照组25019778.821.2试验组125015662.437.6试验组225015361.238.8试验组325015060.040.0当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1