一种利用酿酒酵母生物降解棒曲霉素的方法与流程
本发明涉及利用酿酒酵母生物降解棒曲霉素的方法,属于生物技术领域。
背景技术:
棒曲霉素(patulin,pat),又称展青霉素,是一种主要由青霉属(penicillium)、曲霉属(aspergillus)和丝衣霉属(byssochlamys)等多种真菌产生的聚酮类次生代谢产物,在酸性条件下非常稳定,由于其对人体产生极大危害,能够致畸、致癌和致突变,且具有影响生育、免疫、遗传、神经系统的性质,受到世界各国的广泛关注。苹果及其制品是棒曲霉素的主要污染源,因而这类制品中棒曲霉素的含量被认为是评价其食品安全品质的重要指标。世界各权威机构对苹果制品中棒曲霉素的含量进行了较为相似的规定,其中,欧盟委员会的标准最为严格,即苹果汁等液体制品应低于50μg/kg、苹果酱等固体制品应低于25μg/kg、婴儿食品类应低于10μg/kg。我国的国家标准gb2761-2017中规定苹果等制品中棒曲霉素含量均不得高于50μg/kg。
目前,控制棒曲霉素的策略包括两方面,一是从源头抑制扩展青霉的侵染来减少棒曲霉素的产生,二是降低或去除已经存在于食品中的棒曲霉素。前者可以通过调控水果及制品的贮藏条件(低温贮藏和气调贮藏等)或喷洒化学杀菌剂等得到控制。由于化学杀菌剂会导致农药残留、耐药菌株产生和环境污染等问题,欧美等许多发达国家已对此进行严格的规定,限制杀菌剂在果蔬保鲜中的应用。针对已经产生的棒曲霉素,常用的脱毒方法主要有物理法和化学法,物理法包括人工拣选和清洗、澄清处理及加热加压处理、物理吸附剂处理、微波处理、辐照处理或超声处理等;化学法主要是使用臭氧、添加多酚或植物提取物等降解水果及其制品中的棒曲霉素。这些物理或化学的方法在加工中存在脱毒不彻底、操作繁琐、技术成本过高、安全性未知或导致营养物质流失等缺陷,难以满足消费者对于绿色、安全、营养价值高且无添加产品的需求。
技术实现要素:
本发明针对上述问题,提出了一种利用酿酒酵母(saccharomycescerevisiae)s288c菌株的发酵过程以实现棒曲霉素在液体培养基中的高效降解。
本发明利用酿酒酵母生物降解棒曲霉素,对控制食品中棒曲霉素的污染有良好的应用前景。
技术方案
一种利用酿酒酵母降解棒曲霉素的方法:将酿酒酵母菌株(saccharomycescerevisiae)s288c置于培养基中培养后,加入棒曲霉素后静置发酵,产生可溶性胞内酶,进而降解所述棒曲霉素。
进一步,所述的酿酒酵母菌株(saccharomycescerevisiae)s288c,购自美国典型培养物保藏中心(americantypeculturecollection,atcc),菌株编号为204508。
进一步,所述的酿酒酵母在培养基中培养的细胞浓度约为1.1~1.3×106cfu/ml。
进一步,所述的培养基为minimalmedium培养基,其配方为:蔗糖10.0g/l、磷酸氢二钾2.5g/l、磷酸二氢钾2.5g/l、磷酸氢二铵1.0g/l、七水硫酸镁0.2g/l、七水硫酸亚铁0.01g/l、一水硫酸锰0.007g/l,ph自然,121℃灭菌20min。
进一步,所述的降解温度为28~30℃。
进一步,所述的降解时间为96~120h。
进一步,所述的棒曲霉素的浓度为4.0~5.0mg/l。
一种可降解棒曲霉素的酿酒酵母可溶性胞内酶,是经棒曲霉素刺激酿酒酵母菌株(saccharomycescerevisiae)s288c时产生的。
进一步,所述的酿酒酵母可溶性胞内酶的制备方法为:取酿酒酵母发酵液,于4℃、8,000×g离心10min后收集菌体,该菌体经无菌水洗涤后重悬于tris-hcl(20mm,ph7.5),超声波破碎30min,破壁后经4℃、8,000×g离心10min,获得上清液,即可获得细胞裂解物(可溶性胞内酶)。
本发明中棒曲霉素储备液的制备方法为:从-20℃取出棒曲霉素(约10mg),待解冻到室温,称取装样瓶质量并记录,加入乙酸乙酯溶解样品后转移到10ml容量瓶定容,然后分装到10个进样品(棕色)并用氮气吹干备用,在通风橱中吹干装样瓶后再次称量其质量并记录,根据公式(1)算出制备浓度为1000mg/l的棒曲霉素储备液所需的无菌ddh2o(ph4,用1%冰醋酸调节)体积,
v=(m1-m0)/n(1)
其中,v为需要向棕色瓶中加入的无菌ddh2o(ph4,用1%冰醋酸调节)的体积,m0和m1分别表示溶解前棒曲霉素装样瓶的质量,n表示分装的进样瓶数量。储备液放于4℃备用。
本发明中可溶性胞内酶对棒曲霉素的降解,其酶反应体系为:tris-hcl(20mm,ph7.5)缓冲液中加入细胞裂解物(可溶性胞内酶),再加入棒曲霉素溶液(终浓度为10mg/l),混匀后经uhplc检测不同反应时间棒曲霉素浓度,对照组加入的细胞裂解物(可溶性胞内酶)需经95℃热灭活10min。
有益效果
本发明通过利用酿酒酵母菌株生物降解棒曲霉素,在72h后有约90%的棒曲霉素被降解,96h后4.2mg/l的棒曲霉素被完全降解,实现了棒曲霉素的高效降解。
此外,在本发明的降解过程中,经棒曲霉素的刺激,产生了酿酒酵母可溶性胞内酶,在与棒曲霉素反应1h后,可降解约67%的棒曲霉素,最多反应8h,10mg/l的棒曲霉素可被完全降解,因此在降解过程中发挥了决定性的作用,对控制食品中棒曲霉素的污染有良好的应用前景。
附图说明
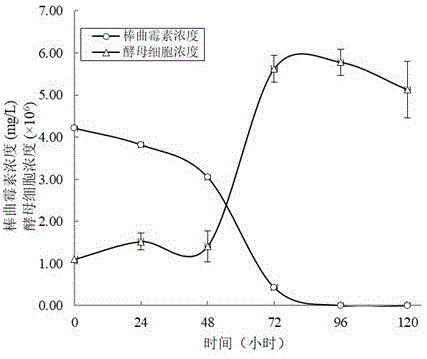
图1酿酒酵母(saccharomycescerevisiae)s288c对棒曲霉素的降解作用;
○表示棒曲霉素的浓度;δ表示酿酒酵母菌体浓度。
图2酿酒酵母可溶性胞内酶对棒曲霉素的降解效果;
a、b、c、d、e分别表示未失活的可溶性胞内酶在各个时间段内对棒曲霉素的降解程度,相同字母表示无显著性差异(显著性水平:0.05);a、b、c、d、e、f分别表示已失活的可溶性胞内酶在各个时间段内对棒曲霉素的降解程度。
具体实施方式:
实施例1:酿酒酵母生物降解4.2mg/l棒曲霉素
1)酿酒酵母菌株的活化和培养:
从-80℃的冰箱中取出保存的酿酒酵母(saccharomycescerevisiae)s288c甘油管,划线接种到土豆葡萄糖固体培养基(potatodextroseagar,pda),倒置于28~30℃培养3d。待菌落长出后,取一个单菌落接种至100mlmm培养基中,加酒塞于28~30℃静置培养3d,待酵母浓度达到1.1~1.3×107cfu/ml。
mm培养基的配方为:蔗糖10.0g/l、磷酸氢二钾2.5g/l、磷酸二氢钾2.5g/l、磷酸氢二铵1.0g/l、七水硫酸镁0.2g/l、七水硫酸亚铁0.01g/l、一水硫酸锰0.007g/l,ph自然,121℃灭菌20min。
2)棒曲霉素储备液的制备方法
从-20℃取出棒曲霉素(约10mg),待解冻到室温,称取装样瓶质量并记录,加入乙酸乙酯溶解样品后转移到10ml容量瓶定容,然后分装到10个进样瓶(棕色)并用氮气吹干备用,在通风橱中吹干装样瓶后再次称量其质量并记录,根据公式(1)算出制备浓度为1000mg/l的棒曲霉素储备液所需的无菌ddh2o(ph4,用1%冰醋酸调节)体积,
v=(m1-m0)/n(1)
其中,v(ml)为需要向棕色瓶中加入的无菌ddh2o(ph4,用1%冰醋酸调节)的体积,m0和m1分别表示溶解前棒曲霉素装样瓶的质量,n表示分装的进样瓶数量。储备液放于4℃备用。
3)酿酒酵母生物降解棒曲霉素的方法:
按照10%的接种量,将酿酒酵母培养液接种至100ml新鲜的mm液体培养基中(细胞浓度约为1.1~1.3×106cfu/ml),加酒塞于28~30℃静置发酵,96h后可以完全降解4.2mg/l棒曲霉素,实验重复三次,结果取平均值。
实验结果如图1所述。从实验结果可知:酿酒酵母的发酵过程可完全降解初始浓度约为4.2mg/l的棒曲霉素。棒曲霉素加入培养基的24h~48h抑制了酿酒酵母的生长,经确定,在此过程中,通过棒曲霉素的刺激,产生了酿酒酵母可溶性胞内酶,菌株适应后呈对数生长,在72h有约90%的棒曲霉素被降解。
实施例2:酿酒酵母生物降解5.0mg/l棒曲霉素
1)酿酒酵母菌株的活化和培养:
从-80℃的冰箱中取出保存的酿酒酵母(saccharomycescerevisiae)s288c甘油管,划线接种到土豆葡萄糖固体培养基(potatodextroseagar,pda),倒置于28~30℃培养3d。待菌落长出后,取一个单菌落接种至100mlmm培养基中,加酒塞于28~30℃静置培养3d,待酵母浓度达到1.1~1.3×107cfu/ml。
mm培养基的配方为:蔗糖10.0g/l、磷酸氢二钾2.5g/l、磷酸二氢钾2.5g/l、磷酸氢二铵1.0g/l、七水硫酸镁0.2g/l、七水硫酸亚铁0.01g/l、一水硫酸锰0.007g/l,ph自然,121℃灭菌20min。
2)棒曲霉素储备液的制备方法
从-20℃取出棒曲霉素(约10mg),待解冻到室温,称取装样瓶质量并记录,加入乙酸乙酯溶解样品后转移到10ml容量瓶定容,然后分装到10个进样瓶(棕色)并用氮气吹干备用,在通风橱中吹干装样瓶后再次称量其质量并记录,根据公式(1)算出制备浓度为1000mg/l的棒曲霉素储备液所需的无菌ddh2o(ph4,用1%冰醋酸调节)体积,
v=(m1-m0)/n(1)
其中,v(ml)为需要向棕色瓶中加入的无菌ddh2o(ph4,用1%冰醋酸调节)的体积,m0和m1分别表示溶解前棒曲霉素装样瓶的质量,n表示分装的进样瓶数量。储备液放于4℃备用。
3)酿酒酵母生物降解棒曲霉素的方法:
按照10%的接种量,将酿酒酵母培养液接种至100ml新鲜的mm液体培养基中(细胞浓度约为1.1~1.3×106cfu/ml),加酒塞于28~30℃静置发酵,110h后可以完全降解5.0mg/l棒曲霉素,实验重复三次,结果取平均值。
从实验结果可知:酿酒酵母的发酵过程可完全降解初始浓度约为5.0mg/l的棒曲霉素。棒曲霉素加入培养基的24h~48h抑制了酿酒酵母的生长,经确定,在此过程中,通过棒曲霉素的刺激,产生了酿酒酵母可溶性胞内酶,菌株适应后呈对数生长,在90h有约90%的棒曲霉素被降解。
实施例3:酿酒酵母生物降解4.5mg/l棒曲霉素
1)酿酒酵母菌株的活化和培养:
从-80℃的冰箱中取出保存的酿酒酵母(saccharomycescerevisiae)s288c甘油管,划线接种到土豆葡萄糖固体培养基(potatodextroseagar,pda),倒置于28~30℃培养3d。待菌落长出后,取一个单菌落接种至100mlmm培养基中,加酒塞于28~30℃静置培养3d,待酵母浓度达到1.1~1.3×107cfu/ml。
mm培养基的配方为:蔗糖10.0g/l、磷酸氢二钾2.5g/l、磷酸二氢钾2.5g/l、磷酸氢二铵1.0g/l、七水硫酸镁0.2g/l、七水硫酸亚铁0.01g/l、一水硫酸锰0.007g/l,ph自然,121℃灭菌20min。
2)棒曲霉素储备液的制备方法
从-20℃取出棒曲霉素(约10mg),待解冻到室温,称取装样瓶质量并记录,加入乙酸乙酯溶解样品后转移到10ml容量瓶定容,然后分装到10个进样瓶(棕色)并用氮气吹干备用,在通风橱中吹干装样瓶后再次称量其质量并记录,根据公式(1)算出制备浓度为1000mg/l的棒曲霉素储备液所需的无菌ddh2o(ph4,用1%冰醋酸调节)体积,
v=(m1-m0)/n(1)
其中,v(ml)为需要向棕色瓶中加入的无菌ddh2o(ph4,用1%冰醋酸调节)的体积,m0和m1分别表示溶解前棒曲霉素装样瓶的质量,n表示分装的进样瓶数量。储备液放于4℃备用。
3)酿酒酵母生物降解棒曲霉素的方法:
按照10%的接种量,将酿酒酵母培养液接种至100ml新鲜的mm液体培养基中(细胞浓度约为1.1~1.3×106cfu/ml),加酒塞于28~30℃静置发酵,100h后可以完全降解4.5mg/l棒曲霉素,实验重复三次,结果取平均值。
从实验结果可知:酿酒酵母的发酵过程可完全降解初始浓度约为4.5mg/l的棒曲霉素。棒曲霉素加入培养基的24h~48h抑制了酿酒酵母的生长,经确定,在此过程中,通过棒曲霉素的刺激,产生了酿酒酵母可溶性胞内酶,菌株适应后呈对数生长,在83h有约90%的棒曲霉素被降解。
实施例4:酿酒酵母可溶性胞内酶对棒曲霉素的降解
取酿酒酵母发酵液,于4℃、8,000×g离心10min后收集菌体,该菌体经无菌水洗涤后重悬于tris-hcl(20mm,ph7.5),超声波破碎30min,破壁后经4℃、8,000×g离心10min,从获得的上清液中提取细胞裂解物(可溶性胞内酶)。
细胞裂解物(可溶性胞内酶)对棒曲霉素的降解的酶反应体系为:tris-hcl(20mm,ph7.5)缓冲液中加入细胞裂解物(可溶性胞内酶),再加入棒曲霉素溶液(终浓度为10mg/l),混匀后经hplc检测不同反应时间棒曲霉素浓度,对照组加入的细胞裂解物(可溶性胞内酶)需经95℃热灭活10min,实验重复三次,结果取平均值。
实验结果如图2所述。其中a、b、c、d、e分别表示未失活的可溶性胞内酶在各个时间段内对棒曲霉素的降解程度,相同字母表示无显著性差异(显著性水平:0.05);a、b、c、d、e、f分别表示已失活的可溶性胞内酶在各个时间段内对棒曲霉素的降解程度。从实验结果可知:可溶性胞内酶在与棒曲霉素反应1h后,可降解约67%的棒曲霉素,反应8h或更长时间,棒曲霉素被完全降解。相比之下,灭活的胞内酶丢失大部分降解能力。因此,可溶性胞内酶对酿酒酵母生物降解棒曲霉素起到了决定性的作用。
- 还没有人留言评论。精彩留言会获得点赞!