一种益生菌脂质体及其制备方法与流程
本发明属于食品加工领域,涉及一种益生菌脂质体及其制备方法。
背景技术:
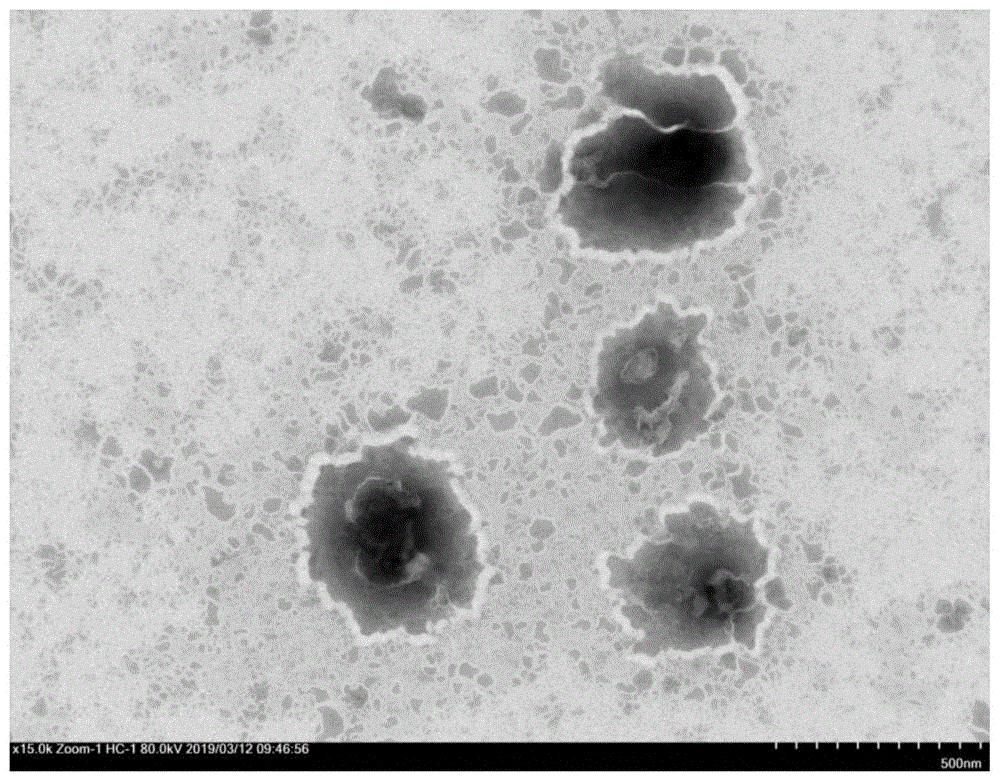
:益生菌是指人体肠道环境中对机体健康有益的活的微生物。常见的益生菌有双歧杆菌、乳杆菌、链球菌、肠球菌等乳酸菌类,还包括一些芽孢杆菌、酵母菌、丙酸杆菌等一些非乳酸菌类。研究表明,益生菌与宿主健康密切相关,它具有促进营养物质的消化吸收、提高机体免疫力、维持肠道菌群平衡、提高机体抗氧化能力、抑制肠道炎症、降低血清胆固醇和保护肠道粘膜屏障等多种功能。近年来,市面上关于益生菌的功能性产品越来越多,包括酸奶、活性乳酸菌饮料、乳酸菌冻干粉冲剂等,其中以酸奶和活性乳酸菌饮料最为常见。理论上来说,摄入酸奶或活性乳酸菌饮料可以为机体提供益生菌,促进肠道健康。然而,益生菌要在人体内发挥相应的益生作用需要满足以下两个条件:(1)以活的状态在特定部位发挥作用;(2)定植在肠道中的益生菌数量充足。目前市面上的益生菌产品,在加工、运输、储存以及消化吸收等过程中,会因为环境的改变而使益生菌失活,真正能够以活的状态定植在肠道内的益生菌数量不足以发挥其益生的作用。脂质体具有保护药物活性、减少药物毒副作用、提高药物利用率等优点,被认为是最有前景和最成熟的纳米靶向给药载体。用脂质体包封益生菌可以使其避开不利环境,保护其免受胃酸的侵蚀,减少益生菌的失活,提高其在肠道中的存活率和定植数量,从而真正发挥其益生的效果。目前,有关益生菌脂质体的制备,国内外尚未见相关的专利报道。技术实现要素:为解决现有技术中存在的上述问题,本发明的目的在于提供一种益生菌脂质体及其制备方法。为了实现上述目的,本发明提供了如下技术方案。本发明提供了一种益生菌脂质体,所述益生菌脂质体的粒径为(143.87±10.58)~(161.53±11.62)nm,多分散系数为(0.531±0.101)~(0.635±0.067),zeta电位为(-13.15±0.87)~(-15.07±1.21)mv,益生菌脂质体中益生菌的包封率为40~57.14%。本发明还提供一种制备所述益生菌脂质体的方法,包括如下步骤:(1)用三氯甲烷溶解大豆卵磷脂和胆固醇,形成混合溶液1,然后除去混合溶液1中的三氯甲烷,得到脂质薄膜;(2)配制磷酸盐缓冲溶液;(3)将益生菌溶于磷酸盐缓冲溶液,形成混合溶液2,并预热;(4)将步骤(3)中的预热后的混合溶液2加入到脂质薄膜中,形成脂质体混悬液;(5)将脂质体混悬液超声、过滤并水化,得到所述益生菌脂质体。优选地,胆固醇和大豆卵磷脂的质量比为(2~3):(14~16);益生菌和大豆卵磷脂的质量比为1:(6~12);胆固醇与三氯甲烷的质量体积比为2~6mg/ml。优选地,步骤(2)中的磷酸盐缓冲溶液与步骤(1)中的三氯甲烷的体积比为2:(1~3)。优选地,步骤(2)中的磷酸盐缓冲溶液的质量分数为0.40~0.45%。优选地,步骤(2)中所述磷酸盐缓冲溶液由超纯水配制,磷酸盐缓冲溶液的ph为7.0~7.5。优选地,步骤(3)中益生菌在磷酸盐缓冲溶液的浓度为1~2mg/ml。优选地,步骤(1)中,除去三氯甲烷的方法为将混合溶液1置于旋转蒸发仪上减压旋蒸,真空箱中干燥,减压旋蒸的温度为40~50℃,减压旋蒸的时间为30~60min,减压旋蒸的转速为50~150rpm。优选地,步骤(3)中混合溶液2的预热温度为40~50℃。优选地,步骤(5)中,超声功率为200~250w,超声时间为5~25min,水化温度为40~50℃,水化时间为115~125min。优选地,步骤(1)中胆固醇和大豆卵磷脂的质量比为1:(6~8)。和现有技术相比,本发明具有以下有益效果和优点:(1)本发明针对益生菌在人体消化过程中易失活的问题,通过薄膜水化法利用大豆卵磷脂和胆固醇包封益生菌制备益生菌脂质体,保护被包封的益生菌免受胃酸等环境的影响,提高益生菌在人体内的稳定性和活性,增加其在肠道中的存活率和定植数量,从而真正发挥其益生的效果。(2)本发明制备的益生菌脂质体的平均粒径为(143.87±10.58)~(161.53±11.62)nm,而常规的脂质体的平均粒径普遍在160nm以上,说明本发明提供的薄膜水化法制备的益生菌脂质体粒径较小,本发明制备的益生菌脂质体的多分散系数为(0.531±0.101)~(0.635±0.067),zeta电位为(-13.15±0.87)~(-15.07±1.21)mv,说明本发明的益生菌脂质体的体系稳定。附图说明图1a和图1b为实施例2制得的益生菌脂质体的透射电镜图;图2为实施例2制得的益生菌脂质体的粒径分布图;图3为实施例2制得的益生菌脂质体的zeta电位图;图4为不同药脂比(益生菌与大豆卵磷脂的质量比)对益生菌脂质体包封率的影响;图5为不同胆脂比(胆固醇与大豆卵磷脂的质量比)对益生菌脂质体包封率的影响;图6为不同药物浓度(益生菌在磷酸盐缓冲溶液中的浓度)对益生菌脂质体包封率的影响;图7为不同水化温度对益生菌脂质体包封率的影响;图8为不同水化时间对益生菌脂质体包封率的影响;图9为不同超声功率对益生菌脂质体包封率的影响;图10为不同超声时间对益生菌脂质体包封率的影响。具体实施方式下面将更详细地描述本发明的优选实施方式,但不被这里阐述的实施方式所限制。实施例1:(1)用万分之一天平称取制作脂质体所需的大豆卵磷脂140mg,胆固醇23mg,置于旋蒸瓶中;(2)再量取5ml三氯甲烷加入到旋蒸瓶中,震荡使大豆卵磷脂和胆固醇充分溶解,形成澄清透明的混合溶液1;(3)将装有混合溶液1的旋蒸瓶置于45℃,150rmp的旋转蒸发仪上减压旋蒸30min,除去三氯甲烷,在瓶壁上形成一层均匀透明的薄膜,再将旋蒸瓶置于真空干燥箱中干燥12h,除去残留的三氯甲烷;(4)用超纯水配制ph=7.0,质量分数为0.40%的磷酸盐缓冲溶液;(5)分别取10ml磷酸盐缓冲溶液和17.5mg益生菌冻干粉置于离心管中,充分混匀,得混合溶液2,预热至40℃;(6)将上述预热后的混合溶液2加入(3)中制备的有脂质薄膜的旋蒸瓶中,使脂质薄膜与磷酸盐缓冲液充分混匀,形成脂质体混悬液;(7)将脂质体混悬液置于超声功率220w的超声仪中超声10min,并置于40℃水浴锅中水化115min,即得益生菌脂质体。实施例1制备的脂质体的平均粒径为154.63±8.59nm,多分散系数为0.531±0.101,zeta电位为-13.15±0.87mv,包封率为51.37%。实施例2:(1)用万分之一天平称取制作脂质体所需的大豆卵磷脂150mg,胆固醇25mg,置于旋蒸瓶中;(2)再量取8ml三氯甲烷加入到旋蒸瓶中,震荡使大豆卵磷脂和胆固醇充分溶解,形成澄清透明的混合溶液1;(3)将装有上述混合溶液1的旋蒸瓶置于45℃,100rmp的旋转蒸发仪上减压旋蒸40min,除去三氯甲烷,在瓶壁上形成一层均匀透明的薄膜,再将旋蒸瓶置于真空干燥箱中干燥12h,除去残留的三氯甲烷;(4)用超纯水配制ph=7.2,质量分数为0.42%的磷酸盐缓冲溶液;(5)分别取10ml磷酸盐缓冲溶液和15mg益生菌冻干粉置于离心管中,充分混匀,得混合溶液2,预热至50℃;(6)将上述预热后的混合溶液2加入(3)中制备的有脂质薄膜的旋蒸瓶中,使脂质薄膜与磷酸盐缓冲液充分混匀,形成脂质体混悬液;(7)将上述脂质体混悬液置于超声功率200w的超声仪中超声15min,并置于50℃水浴锅中水化120min,即得益生菌脂质体。实施例2制备的益生菌脂质体的平均粒径为143.87±10.58nm,多分散系数为0.620±0.053,zeta电位为-15.07±1.21mv,包封率为57.14%。实施例3:(1)用万分之一天平称取制作脂质体所需的大豆卵磷脂160mg,胆固醇20mg,置于旋蒸瓶中;(2)再量取10ml三氯甲烷加入到旋蒸瓶中,震荡使大豆卵磷脂和胆固醇充分溶解,形成澄清透明的混合溶液1;(3)将装有上述混合溶液1的旋蒸瓶置于50℃,50rmp的旋转蒸发仪上减压旋蒸60min,除去三氯甲烷,在瓶壁上形成一层均匀透明的薄膜,再将旋蒸瓶置于真空干燥箱中干燥12h,除去残留的三氯甲烷;(4)用超纯水配制ph=7.5,质量分数为0.45%的磷酸盐缓冲溶液;(5)分别取10ml磷酸盐缓冲溶液和14mg益生菌冻干粉置于离心管中,充分混匀,得混合溶液2,预热至45℃;(6)将上述预热后的混合溶液2加入(3)中制备的有脂质薄膜的旋蒸瓶中,使脂质薄膜与磷酸盐缓冲液充分混匀,形成脂质体混悬液;(7)将上述脂质体混悬液置于超声功率250w的超声仪中超声20min,并置于45℃水浴锅中水化125min,即得益生菌脂质体。实施例3制备的益生菌脂质体的平均粒径为161.53±11.62nm,多分散系数为0.635±0.067,zeta电位为-14.73±1.13mv,包封率为53.12%。图1a和图1b为本发明实施例2制得的益生菌脂质体的透射电镜图,由图1a和图1b可知,本实施例制得的益生菌脂质体颗粒近似球状,大小均一,分布均匀,脂质球之间无粘连和聚集。图2为本发明实施例2制得的益生菌脂质体的粒径分布图,由图2可知,本实施例制得的益生菌脂质体的粒径在80~250nm之间,平均粒径为143.87±10.58nm。图3为本发明实施例2制得的益生菌脂质体的zeta电位图,由图3可知,本实施例制得的益生菌脂质体的zeta电位为-15.07±1.21mv。益生菌脂质体单因素优化实验脂质体作为一层保护膜可以保护被包封的益生菌免受外界环境的影响,从而提高其活性和稳定性,以益生菌的包封率为指标,采用本发明提供的方法制备益生菌脂质体,分别改变药脂比(益生菌与卵磷脂的质量比)、胆脂比(胆固醇与卵磷脂的质量比)、药物浓度(益生菌在磷酸盐缓冲溶液中的浓度)*、水化温度、水化时间、超声功率、超声时间这7个因素,对益生菌脂质体制备效果进行比较。表1为单因素实验的因素和水平的参数设置,图4至图10为实验结果。表1单因素实验的因素和水平的参数设置因素l1l2l3l4l5药脂比1:61:81:101:121:14胆脂比1:21:41:61:81:10药物浓度(mg/ml)0.511.522.5水化温度(℃)30405060水化时间(min)6090120150180超声功率(w)100150200250300超声时间(min)510152025根据图4至图10给出的实验结果优选出:益生菌:卵磷脂:胆固醇质量比为1:10:1.7、药物浓度1.5mg/ml、水化温度50℃、水化时间120min、超声功率200w、超声时间15min的脂质体制备实验条件,包封率达57.14%。测试结果表明,本发明制得的益生菌脂质体的粒径为(143.87±10.58)~(161.53±11.62)nm,多分散系数为(0.531±0.101)~(0.635±0.067),zeta电位为(-13.15±0.87)~(-15.07±1.21)mv,益生菌脂质体中益生菌的包封率为40~57.14%。说明本发明提供的薄膜水化法制备的益生菌脂质体粒径较小、体系稳定。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1