一种减少苜蓿青贮中叶绿素分解的方法与流程
技术领域:
本发明涉及青贮饲料技术领域,具体涉及一种减少苜蓿青贮中叶绿素分解的方法。
背景技术:
:
在制作青贮饲料时,常用的无机酸添加剂有盐酸、硫酸和磷酸。1970年由德国人a.n.bnptaheh提出混酸(硫酸、盐酸)作为防腐剂在青贮中使用,可以有效抑制蛋白分解和植物细胞的呼吸作用。工业副产品盐酸虽为强酸,但不含砷、氯烃等有害成分,但在低浓度的情况下是可以作为青贮防腐剂,且对动物机体无不良影响,还可以提高植物蛋白的摄入量。经过6%混酸处理后的苜蓿青贮饲喂肉牛时发现,酸处理组的瘤胃内纯蛋白比对照组提高21%,蛋白利用率提高14%,氨化物降低21%。经过4.5%混酸处理后的红三叶青贮饲喂后育肥猪时发现,在日粮中加入0.66-1.5kg的青贮可满足育肥猪能量需要量的15%-20%和蛋白需要量的10-15%。有研究表明,无机酸的酸化效果要好于有机酸,且价格低廉。张志登等在混合无机酸处理对玉米秸秆青贮发酵品质影响的研究中发现,添加混酸(硫酸、盐酸)可以显著降低青贮的ph值,抑制有害微生物的繁殖,降低粗纤维、氨态氮含量。
苜蓿青贮中叶绿素不仅影响苜蓿青贮发酵品质的感官评分,而且是苜蓿青贮饲料中的重要功能性成分,具有造血、提供维生素、解毒、抗病和抗氧化等功能,其在反刍动物体内转化植烷酸后,可以调节胰岛素和促进脂肪酸酸化作用。发酵品质良好的苜蓿青贮保持与青绿苜蓿原料相近的颜色,然而青贮过程中叶绿素降解代谢规律不清楚。
技术实现要素:
:
本发明旨在提出一种减少苜蓿青贮中叶绿素分解的方法。本申请详细描述混合酸处理苜蓿青贮过程中叶绿素降解规律、相关降解酶活性的动态变化,揭示苜蓿青贮过程中叶绿素降解代谢规律。通过本方法在青贮过程中叶绿素a和叶绿素b随着发酵时间的延长呈逐渐下降趋势,添加ma可以减缓苜蓿青贮后期的叶绿素损失。
本发明的技术方案是:一种减少苜蓿青贮中叶绿素分解的方法,包括以下步骤:苜蓿原料于避光通风处晾至半干,含水量50%左右,切碎至2-3cm,用1mol/l硫酸和2mol/l盐酸按体积比1:4混合进行制备混合酸,混合酸的添加量8%(质量百分比计),处理好样品后,分别称取200g装入规格为16×25cm黑色聚乙烯袋中,真空机密封包装,于室温避光环境下进行小规模发酵,分别在0、1、3、5、7、15、22、39、46、53、60、67、74天开封,每个时间开封3袋。
本发明具有如下有益效果:(1)添加ma可以改善苜蓿青贮的发酵品质,提高体外干物质降解率。(2)在青贮过程中叶绿素a和叶绿素b随着发酵时间的延长呈逐渐下降趋势,添加ma可以减缓苜蓿青贮后期的叶绿素损失。(3)添加混合酸使苜蓿青贮中三种重要叶绿素代谢酶chlase、pph和pao的活性呈现初期先上升后期下降的趋势,这导致了苜蓿青贮中叶绿素前期迅速分解后期趋于缓慢的降解代谢规律,但苜蓿发酵后期ma表现出对叶绿素降解的抑制效果还需进一步试验验证。
附图说明:
附图1是本发明的技术路线示意图。
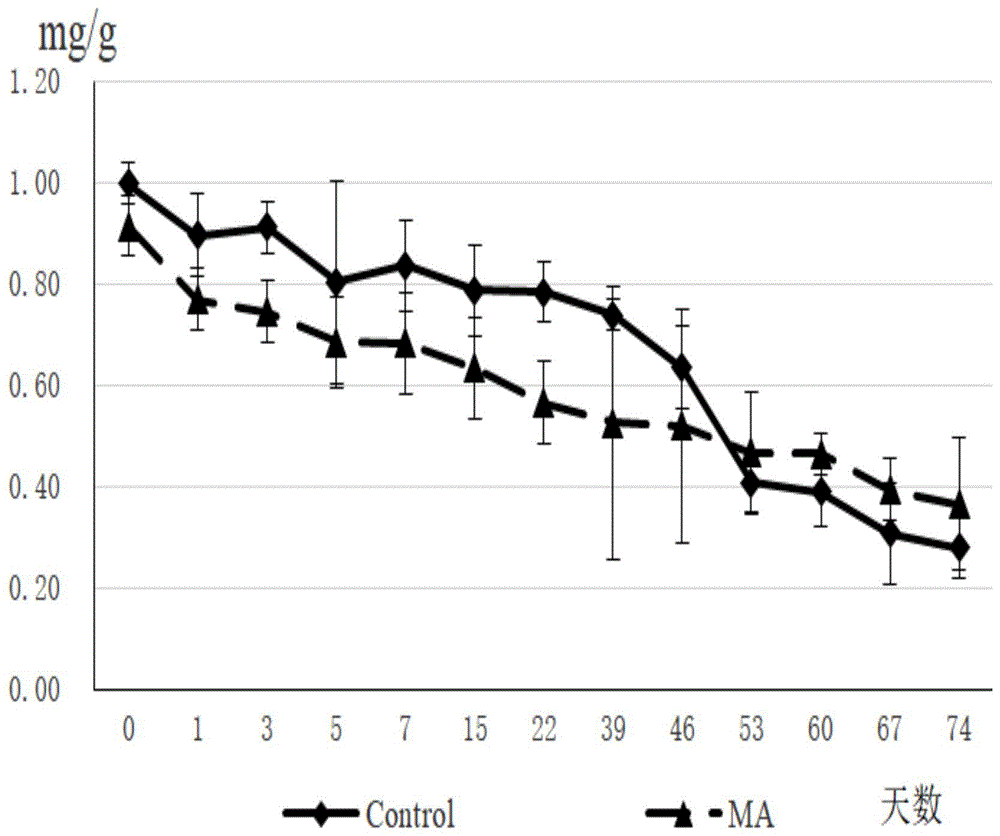
附图2叶绿素a含量在苜蓿青贮过程中的动态变化图。
附图3叶绿素b含量在苜蓿青贮过程中的动态变化图。
附图4chlase活性含量在苜蓿青贮过程中的动态变化图。
附图5pph活性含量在苜蓿青贮过程中的动态变化图。
附图6pao活性含量在苜蓿青贮过程中的动态变化图。
具体实施方式:
下面结合实验对本发明作进一步说明:
一种减少苜蓿青贮中叶绿素分解的方法包括以下步骤:苜蓿原料于避光通风处晾至半干,含水量50%左右,切碎至2-3cm,用不同浓度的硫酸和不同浓度的盐酸按一定体积比混合进行制备混合酸,在苜蓿加入一定量的混合酸,处理好样品后,分别称取200g装入规格为16×25cm黑色聚乙烯袋中,真空机密封包装,于室温避光环境下进行小规模发酵,分别在0、1、3、5、7、15、22、39、46、53、60、67、74天开封,每个时间开封3袋。
本申请针对硫酸与盐酸的不同浓度、混合酸添加量及硫酸和盐酸体积比对苜蓿发酵品质的影响(40日),通过前期试验筛选出了最佳酸浓度和添加量及体积比:
分别配制摩尔浓度为1.0m和2.0m的硫酸和盐酸溶液,分别以浓度为2%、4%、6%、8%和10%单独添加,筛选出最佳浓度和添加量;苜蓿切碎长度为2-3cm,含水量为50%,2种酸分别与苜蓿样品充分混匀后,分别称取200g装入规格为16×25cm透明聚乙烯袋中,真空密封包装,于室温环境下进行密封贮藏40日。具体添加处理方法如下表a所示,结果见表b:
表a硫酸和盐酸的添加量对木苜蓿发酵品质的影响处理方法:
表b的结果显示,综合考虑苜蓿青贮中的ph和乳酸含量,硫酸和盐酸的浓度分别为1m和2m,添加量分别为4%和8%的处理苜蓿发酵品质最好。另外,我们也分别配制了0.5m和2.5m的硫酸和盐酸溶液,0.5m的添加量大时才有效果,其最佳效果时硫酸或盐酸的有效含量恰好与1m的硫酸和2m的盐酸的量相当,因此,为了避免2种酸有效量的重复,我们没有列入表b。
表b硫酸和盐酸的添加量对木苜蓿发酵品质的影响
根据以上的确定的硫酸1m和盐酸2m的浓度和添加量8%,研究添加不同比例的硫酸和盐酸对苜蓿青贮品质的影响,苜蓿材料及其青贮调制方法同上。表c是2种酸的混合比例方法,结果见表d:
表c硫酸和盐酸的混合比例对木苜蓿发酵品质的影响处理方法:
表d的结果显示,综合考虑苜蓿青贮中的ph和乳酸含量,硫酸和盐酸的浓度分别为1mol/l和2mol/l,2种酸的比例为1:4的处理苜蓿发酵品质最好。
表d硫酸与盐酸的不同浓度及其比例对苜蓿发酵品质的影响
由上述实验确定:减少苜蓿青贮中叶绿素分解的方法包括以下步骤:苜蓿原料于避光通风处晾至半干,含水量50%左右,切碎至2-3cm,用1mol/l硫酸和2mol/l盐酸按体积比1:4混合进行制备混合酸,混合酸的添加量8%(质量百分比计),处理好样品后,分别称取200g装入规格为16×25cm黑色聚乙烯袋中,真空机密封包装,于室温避光环境下进行小规模发酵,分别在0、1、3、5、7、15、22、39、46、53、60、67、74天开封进行实验。
试验采用两因素试验设计,分为2个处理组(每个处理50个重复,防止破损对试验造成影响),处理组包括对照组(无添加,control)和混酸处理组(ma代表混合酸,添加量8%),添加量为鲜物质基础。
一、酸处理及对照组苜蓿青贮随着发酵时间的延长感官品质、一般化学成分、有机酸、氨态氮、微生物组成和体外瘤胃发酵的变化,评价发酵品质的高低。
1、感官品质评定方法:
根据青贮质量评定标准的说明,苜蓿青贮开封后对其颜色、气味、质地以及有无霉变这四个方面进行品质评定。
2、一般化学成分分析:
测定项目包括干物质(dm)、有机物(om)、粗脂肪(ee)、粗蛋白(cp)、酸性洗涤纤维(adf)、中性洗涤纤维(ndf)、总氮(tn)含量。将开封后的一部分样品放入电热恒温鼓风干燥箱中,在65℃条件下烘至恒重,由此得出自由水含量。用微型植物粉碎机将恒重后样品粉碎并过1mm筛,进行一般化学成分分析,
om、ee、cp和tn的测定分别用(aoac)中的方法934.01、976.05、920.39进行,ndf与adf利用vansoest方法进行测定。
3、有机酸测定:
称取开封后的样品20g置于聚乙烯袋中,加入180ml灭菌蒸馏水,用均质器拍打90s,制成青贮浸提液。用快速定性滤纸过滤,并测定其滤液的ph值。所获得的滤液取1.5ml经12000r·min-1离心5min,用0.22μm微孔滤膜过滤后,采用高效气相色谱进行乳酸(la)、乙酸(aa)、丙酸(pa)、丁酸(ba)含量分析。
色谱条件为:汽化室参数为载气氮气(n2),分流比40︰1,进样量0.4μl,温度220℃;色谱柱参数为hp-innowax毛细管色谱柱恒流模式,流量2.0ml/min,平均线速度38cm/s;柱温箱参数为程序升温120℃保持3min,然后以10℃/min上升至180℃保持1min;检测器参数为氢气(h2)流量40ml/min,空气流量450ml/min,柱流量+尾吹气流量45ml/min,火焰离子检测器(fid)温度250℃。
4、氨态氮的测定:
根据冯宗慈[108]的方法测定氨态氮(nh3-n)。采用分光光度计法,首先配制标准液:(1)准确称量0.955g氯化铵溶解于0.2mol/l盐酸溶液,定容至250ml,作为a液。(2)取a液25ml用蒸馏水稀释定容至250ml,作为b液。(3)依次取b液0、1、2、4、6ml分别置于50ml容量瓶中,再依次加入10、9、8、6、4ml蒸馏水,再加入0.2mol/l盐酸定容至50ml,此为5个标准液。c液:准确称量0.2g亚硝基铁氰化钠溶解于250ml14%水杨酸钠溶液中混匀备用。d液:将5ml次氯酸钠溶液于250ml0.3mol/l氢氧化钠溶液中混匀备用。
计算与比色:(1)依次量取5个标准液0.8ml,分别置于20ml玻璃塞具试管内,各管中再依次加入c液4ml和d液4ml,摇匀后静置10min,用0.5cm的石英比色皿在700nm波长下测得5个标准液的od值,对照组为不含氮标准液,由此导出回归方程式。(2)样品处理:取20ml青贮浸提滤液在3500r/min离心10min。取4ml上清液置于20ml试管内,再加入16ml0.2mol/l盐酸,此为处理液。量取0.8ml处理液于10ml试管中,再加入c液4ml和d液4ml,摇匀后静置10min,测得od值。
5、微生物组成:
将mrs、blb、na、pda培养基划定1×10-1倍、1×10-3倍、1×10-5倍3个培养区域,其中cca和na(耐热)培养基划定1×10-1倍和1×10-2倍2个培养区域。用无菌水将青贮浸提液进行梯度稀释,连续稀释为1×10-1倍液、1×10-2倍液、1×10-3倍液、1×10-4及1×10-5倍液。用移液枪移取稀释液20μl,按照培养基中预先划分好的区域将稀释液滴入培养基中,并用涂菌棒均匀涂开。将1×10-1和1×10-2稀释液水浴加热(75℃,15min),快速冷却后涂cca、na(耐热)培养基。其中mrs、cca置于厌氧培养箱(37℃)培养,其余置于恒温培养箱(37℃),培养48h后取出进行菌落数计数。
6、体外瘤胃发酵:
使用两头安装永久性瘤胃瘘管的雄性大尾寒羊,体重为37±5kg(黑龙江八一农垦大学动物饲养实验室),在早晨饲喂后2h从瘤胃瘘管抽取瘤胃液(所使用的所有工具必须提前预热至39℃),用纱布过滤,通入co2保持厌氧环境,并以人工唾液:瘤胃夜为4:1比例均匀混合。人工唾液按照mcdougll’sbuffer方法[109](氯化钾0.57g/l、碳酸氢钠9.80g/l、氯化钙0.04g/l、十二水磷酸氢二钠9.30g/l、氯化镁0.06g/l、氯化钠0.47g/l、l-半胱氨酸盐酸盐0.25g/l、刃天青钠盐0.01g/l)进行配置,ph值为6.9。准确称取开封后粉碎的青贮0.50g(干物质基础)装入容量为125ml的血清瓶,注入50ml混合培养液,迅速封好瓶口,置于39℃,100r/min的空气浴振荡器,培养48h。
培养结束后将血清瓶放入冰水中停止发酵,将头皮针插入血清瓶橡胶封口,通过与之相连的100ml玻璃注射器并记录产气量。用已恒重的快速定性滤纸过滤培养液并测定ph值,将过滤好的培养液残渣放入电热恒温鼓风干燥箱中102℃烘至恒重,由此计算出干物质降解率。
取10ml经快速定性滤纸过滤后的培养液于离心管中,高速冷冻离心机2200r·min-1离心5min,上清液移出备用。取出上清液1ml,加等量的10%偏磷酸溶液(偏磷酸溶解于1mol/l硫酸溶液,10%w/v),充分混合(除蛋白)。再经高速冷冻离心机6000r·min-1离心30min,得上清液。上清液取0.5ml,加入20mmol/l丁烯酸标准品0.5ml充分混合。混合液的丁烯酸浓度为10mmol/l(与标准液浓度相同)。再将混合液中加入纯磷酸0.01ml充分混合(调整为酸性),将混合后的溶液4℃放置12h。放置后的液体,经高速冷冻离心机6000r·min-1离心30min,取上清液,再用0.45μm微孔滤膜过滤后,用高效气相色谱仪分析aa、pa、ba含量(色谱条件同上),nh3-n测定方法同上。
7、试验结果:
(1)感官品质
表1酸处理对苜蓿青贮感官品质的影响
由表1可知:苜蓿在青贮过程中随着发酵时间的延长逐渐由绿色变为黄褐色,且ma组的苜蓿青贮最先出现褪绿趋势,ma组的酸香味浓于control组,经过发酵处理后的青贮饲料质地柔软,水分适宜,茎叶分明,无霉变。
(2)一般化学成分
表2酸处理对苜蓿青贮一般化学成分的影响
注:同列数据肩标字母不同表示差异显著(p<0.05)。dm(drymatter),表示干物质基础。
由表2可知:苜蓿青贮中dm含量随着发酵天数的延长差异不显著(p>0.05),cp、om、adf和ndf含量随着发酵天数的延长显著下降(p<0.05),ee含量随着发酵天数的延长显著上升(p<0.05);ma组的dm、ee、om和ndf含量与control组相比差异不显著(p>0.05),cp含量差异显著高于control组(p<0.05),adf含量差异显著低于control组;在发酵天数和处理的相互作用下,dm含量差异不显著(p>0.05),cp、ee、om、adf和ndf含量差异显著(p<0.05)。
(3)有机酸及nh3-n/tn
表3酸处理对苜蓿青贮有机酸及nh3-n/tn的影响
注:同列数据肩标字母不同表示差异显著(p<0.05)。nd(notdetected),表示没有检测到菌落。“-”,表示未统计。fm(freshmatter),表示鲜物质基础。
由表3可知:苜蓿青贮中ph值随着发酵天数的延长显著下降(p<0.05),nh3-n/tn、la和aa含量随着发酵天数的延长显著上升(p<0.05);ma组的aa含量与control组相比差异不显著(p>0.05),ph值、nh3-n/tn显著低于control组(p<0.05),la含量显著高于control组(p<0.05);在发酵天数和处理的相互作用下,ph值、nh3-n/tn、la和aa含量差异显著(p<0.05);未检出pa和ba。
(4)微生物组成
表4酸处理对苜蓿青贮微生物组成的影响
注:同列数据肩标字母不同表示差异显著(p<0.05)。nd(notdetected),表示没有检测到菌落。“-”,表示未统计。fm(freshmatter),表示鲜物质基础。
由表4可知:苜蓿青贮中lab数量随着发酵天数的延长显著上升(p<0.05),bacilli、coliform、aerobic和yeasts数量随着发酵天数的延长显著下降(p<0.05);ma组的lab和bacilli数量与control组相比差异不显著(p>0.05),coliform、aerobic和yeasts数量显著低于control组(p<0.05);在发酵天数和处理的相互作用下,lab、bacilli、coliform、aerobic和yeasts数量差异显著(p<0.05);未检出clostridium和molds。
(5)体外瘤胃发酵
表5酸处理对苜蓿青贮体外瘤胃消化干物质降解率的影响
注:同列数据肩标字母不同表示差异显著(p<0.05)。dm(drymatter),表示干物质基础。
由表5可知:苜蓿青贮体外消化的ph值随着发酵天数的延长显著下降(p<0.05),产气量和干物质降解率随着发酵天数的延长显著上升(p<0.05);ma组的ph值与control组相比差异不显著(p>0.05),产气量和干物质降解率显著高于control组(p<0.05);在发酵天数和处理的相互作用下,ph值、产气量和干物质降解率差异显著(p<0.05)。
表6酸处理对苜蓿青贮体外消化vfa的影响
注:同列数据肩标字母不同表示差异显著(p<0.05)。
由表6可知:苜蓿青贮体外消化的aa、pa和ba含量随着发酵天数的延长显著上升(p<0.05),nh3-n含量随着发酵天数的延长显著下降(p<0.05);ma组的aa、pa和ba显著高于control组(p<0.05),nh3-n含量显著低于control组(p<0.05);在发酵天数和处理的相互作用下,aa、pa、ba和nh3-n含量差异显著(p<0.05)。
8、结论
在苜蓿青贮中添加混合酸可以在一定程度上保护cp不被降解为nh3-n,降低adf和ndf含量,提高挥发性脂肪酸含量和体外发酵干物质降解率。青贮发酵的初期不需要la累积就可以快速下降ph值,可以有效抑制有害微生物的生长繁殖,减少不必要的发酵损失。综上所述,ma组的发酵品质优于control组。
二、酸处理及对照组苜蓿青贮过程中随着发酵时间的延长叶绿素a、叶绿素b的含量变化,解析苜蓿青贮过程中叶绿素含量的动态变化规律。以及酸处理对苜蓿青贮叶绿素相关降解酶的影响。
试验设计同上,
1、叶绿素含量测定:
参考闫震[134]等的方法,叶绿素a和叶绿素b含量的测定采用分光光度计法,提取溶液为丙酮:乙醇(1:1;v/v)。称取2g左右的样品放入1.5ml的离心管内,加入少许的碳酸钙和二氧化硅,再加入适量的提取液,用组织研磨器研磨至组织发白。用快速定性滤纸过滤并定容至25ml,混匀。用分光光度计分别测得665nm和649nm吸光度下的od值。
计算公式如下:
叶绿素a=(12.72×a1-2.59×a2)×v/1000×m
叶绿素b=(22.88×a1-4.67×a2)×v/1000×ma1=665od值;a2=649od值;v=液体体积(ml);m=样品质量(g)
2、试验结果
表7酸处理对苜蓿青贮叶绿素的影响苜蓿青贮
注:同列数据肩标字母不同表示差异显著(p<0.05)。
由表7可知:苜蓿青贮中叶绿素a、叶绿素b含量随着发酵天数的延长显著降低(p<0.05);ma组的叶绿素a、叶绿素b含量显著低于control组(p<0.05);在发酵天数和处理的相互作用下,叶绿素a、叶绿素b含量差异显著(p<0.05)。
图2为叶绿素a含量在苜蓿青贮过程中的动态变化图,由图2可以看出,随着苜蓿青贮发酵天数延长,叶绿素a呈逐渐下降的趋势。ma组的叶绿素a在发酵初期快速下降,在发酵的前53d,ma组叶绿素a一直低于control组,但在发酵53d后,ma组的叶绿素a高于control组。
图3为叶绿素b含量在苜蓿青贮过程中的动态变化图。由图3可以看出,随着苜蓿青贮发酵天数延长,叶绿素b呈逐渐下降的趋势。ma组的叶绿素b在发酵初期快速下降,在整个发酵过程中一直低于control组。
3、结论:
ma组的叶绿素b在青贮过程中降解速度呈现持续下降并低于control组的趋势,叶绿素a在呈现发酵前期快速下降但发酵后期下降速度逐渐缓慢的趋势,并在53d至发酵结束高于control组,说明ma的添加可以在一定程度上延缓叶绿素a的降解速度。
4、酸处理对苜蓿青贮叶绿素相关降解酶的影响试验结果见表8:
表8酸处理对苜蓿青贮叶绿素相关降解酶的影响
注:同列数据肩标字母不同表示差异显著(p<0.05)。
由表8可知:苜蓿青贮中chlase和pph活性含量随着发酵天数的延长显著上升(p<0.05),pao活性含量随着发酵天数的延长差异不显著(p>0.05);ma组的chlase活性含量显著高于control组(p<0.05),pph和pao活性含量与control组相比差异不显著(p>0.05);在发酵天数和处理的相互作用下,chlase、pph和pao活性含量差异显著(p<0.05)。
由图4可以看出,control组的chlase活性含量随着发酵天数的延长逐渐上升,ma组则呈先上升后下降的趋势,但下降幅度不大。ma组的chlase在发酵的0-5d活性含量快速上升,并且显著高于control组,在5-46d略高于control组。峰值出现在39d,在53d后直至发酵结束ma组的叶chlase活性含量低于control组。
由图5可以看出,随着苜蓿青贮发酵时间的延长,pph活性含量呈先上升后下降的趋势。ma组的pph活性含量在发酵的0-22d快速上升并显著高于control组,在22-39d与control组持平,但在39d后直至发酵结束ma组的pph活性含量低于control组。
由图6可以看出,control组的pao活性含量随着发酵天数的延长逐渐上升,ma组的pao活性含量在0-5d时快速上升,并且显著高于control组,在5d后直至发酵结束ma组的pao活性含量低于control组。
5、结论:chlase、pph和pao的活性含量在苜蓿青贮过程中呈先上升后下降的趋势,ma组的chlase、pph和pao的活性含量,分别在53d、46d和7d前高于control组,之后低于control组。所以在苜蓿青贮中添加ma,在发酵前期会提高酶活性含量,但在发酵后期有抑制效果。
上述实验表明:
(1)苜蓿在青贮过程中逐渐由绿色变为黄褐色,且ma组的苜蓿青贮最先出现褪绿趋势,ma组的酸香味浓于control组,两个处理组均表现出质地柔软,茎叶分明,且水分适宜,无霉变;随着发酵时间的延长,ma组的一般化学成分中cp、adf、有机酸中la、体外瘤胃发酵中aa、pa、ba、产气量、干物质降解率显著高于control组(p<0.05);ph值、nh3-n/tn、微生物组成中coliform、aerobic、yeasts、体外瘤胃发酵中nh3-n显著低于control组(p<0.05);一般化学成分中dm、ee、om、ndf、有机酸中aa、微生物组成中lab、bacillic与control组相比差异不显著(p>0.05)。
(2)随着发酵天数的延长,两个处理组的叶绿素a、b含量呈逐渐下降趋势;在发酵的0-53d,ma组叶绿素a一直低于control组,但在53d后直至发酵结束,ma组的叶绿素a含量高于control组;ma组的叶绿素b含量在发酵初期快速下降,在整个发酵过程中显著低于control组(p<0.05)。
(3)ma组的chlase活性含量在发酵的0-5d快速上升并显著高于control组(p<0.05),在5-39d略高于control组,但在39d后直至发酵结束ma组的chlase活性含量低于control组;ma组的pph活性含量在发酵的0-22d快速上升并显著高于control组(p<0.05),在22-39d与control组持平,但在39d后直至发酵结束ma组的pph活性含量低于control组;ma组的pao活性含量在0-5d时快速上升并显著高于control组(p<0.05),在5d后直至发酵结束ma组的pao活性含量低于control组。
综上所述,添加ma可以有效改善苜蓿青贮发酵品质,在发酵30d后抑制叶绿素相关降解酶的活性,从而减少了叶绿素下降分解。
- 还没有人留言评论。精彩留言会获得点赞!