AKK益生菌在制备防治中暑药物、食品或保健品中的应用的制作方法
akk益生菌在制备防治中暑药物、食品或保健品中的应用
技术领域
1.本发明涉及益生菌技术领域,尤其是涉及akk益生菌在制备防治中暑药物、食品或保健品中的应用。
背景技术:
2.中暑是人在气温高、湿度大的环境中进行高强度的训练或重体力劳动时,发生体温调节障碍,水、电解质平衡失调,心血管和中枢神经系统功能紊乱为主要表现的一种症候群。肠粘膜屏障功能受损、通透性增加,导致细菌及内毒素血症,引起系统性炎症反应(sirs)和多器官功能不全(mods)。近来最新的研究分析其可能机制为:机体发热、腹泻等使肠道细菌发生变化,肠道屏障破坏,肠源性内毒素进入循环增加,产生炎症因子,成为中暑、特别是劳累型中暑发生的重要诱因,而干预此机制、保护肠屏障则可减缓和阻断中暑发生和进展。
3.人体肠道内栖居着大量的细菌,其总数达到10
13-10
14
个,其基因总数约为人体基因数量的数百倍,重约1.5kg,是机体不可缺少的“微生物器官”,对人体生命活动产生重要影响。温度改变可以显著影响肠道菌群,肠道微环境平衡被打破,导致菌群失衡。肠道菌群失调可增加中暑风险。
4.akk菌是健康人群中肠道存在的一种厌氧菌,在肠道中的丰度通常占1%-3%。目前,关于akk益生菌的相关研究大部分集中在肥胖、2型糖尿病等代谢性疾病,或是精神和心理疾病上,尚未发现其与中暑相关的研究。
技术实现要素:
5.本发明的目的在于提供akk益生菌在制备防治中暑药物、食品或保健品中的应用,该akk益生菌能够通过保护肠屏障、降低血中内毒素含量来防治中暑,因此可以用于防治中暑的药物、食品或保健品中,为防治中暑提供了新的、有效的生物治疗手段。
6.本发明提供akk益生菌在制备防治中暑药物、食品或保健品中的应用。
7.本发明的akk益生菌为akkermansia muciniphila菌(即嗜黏蛋白阿克曼氏菌,简称akk菌,菌种编号为atcc baa-835),可通过常规方式购自美国菌种保藏中心。
8.本发明对akk益生菌的具体应用形式不作严格限制;具体地,所述akk益生菌可以为akk活菌或akk灭活菌,优选为akk灭活菌,更优选为akk巴氏灭活菌。相对于akk活菌,akk灭活菌的优点包括:易于保存、不受消化液影响、减少因肠屏障受损造成活菌入血的可能,因此具有更广泛的应用性。
9.本发明对akk益生菌的灭活方式不作严格限制,可以采用本领域的常规灭活方式,例如巴氏灭菌等。具体地,所述akk灭活菌可以通过在60-70℃下对akk活菌加热25-35min灭活得到。
10.在本发明中,所述akk益生菌是通过保护肠屏障和/或降低血中内毒素含量来防治中暑的;对akk益生菌的具体用量不作严格限制,只要能够达到上述防治中暑的效果即可,
所述akk益生菌的用量例如可以为10
10-10
12
cfu。
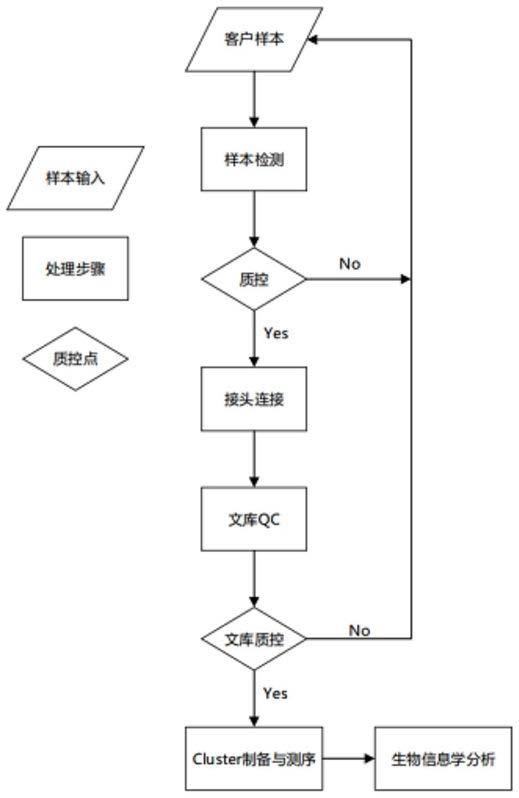
11.本明还提供一种防治中暑的固体饮料,包括akk益生菌;进一步地,所述akk益生菌为akk活菌或akk灭活菌,优选为akk灭活菌,更优选为akk巴氏灭活菌。
12.在本发明的固体饮料中,akk益生菌的含量可以为0.8-1.3g;进一步地,所述akk益生菌的菌数可以为10
10-10
12
cfu/g。更具体地,akk活菌或其巴氏灭活菌的添加方式列举如下:1)akk活菌1g(菌数10
10-10
12
cfu/g);2)akk灭活菌1g(菌数10
10-10
12
cfu/g);3)akk灭活菌1.2g(菌数10
10-10
12
cfu/g)。
13.本发明的固体饮料还可以包括益生元,所述益生元可以选自低聚果糖和菊粉中的至少一种。对固体饮料中益生元的含量不作严格限制,益生元的含量可以为4.5-5.5g,优选为5g。更具体地,益生元的添加方式列举如下:1)低聚果糖3g,菊粉2g;2)低聚果糖2g,菊粉3g。
14.本发明的固体饮料还可以包括电解质,所述电解质包括钠25-75mg和钾60-180mg;对所述钠和钾的来源不作严格限制,其中:所述钠的来源可以为枸橼酸钠或氯化钠,所述钾的来源可以为枸橼酸钾或氯化钾。更具体地,电解质的添加方式列举如下:1)钠:25-75mg(柠檬酸钠:0.11-0.32g或氯化钠0.064-0.192g);2)钾:60-180mg(柠檬酸钾:0.17-0.51g或氯化钾0.12-0.35g)。
15.本发明的固体饮料还可以包括调味剂,所述调味剂可以包括风味剂和/或甜味剂;其中,所述风味剂可以为柠檬味或苹果味的风味剂,所述甜味剂可以为阿斯巴甜。
16.本发明的固体饮料以akk活菌或其巴氏灭活菌作为主要原料,其对中暑的肠屏障有保护作用,可以降低内毒素血症,起到防治中暑的作用;以低聚果糖和/或菊粉作为益生元,其几乎不能被消化,在结肠被有益微生物利用生成短链脂肪酸等,可被akk菌利用并促进增殖;钠和钾可提供机体丢失的电解质。在本发明的固体饮料,akk活菌或其灭活菌能够在固体饮料中稳定存在,在用温水溶解时为均匀液体,形成一种奶油状结构,提供光滑的口感和风味。
17.本发明还提供上述固体饮料的制备方法,包括:将akk益生菌制成冻干粉。
18.进一步地,本发明的制备方法还包括:
19.将益生元、电解质和调味剂烘干、过筛后与akk益生菌的冻干粉混合均匀,随后真空包装。
20.本发明的akk益生菌能够通过保护肠屏障、降低血中内毒素含量来防治中暑,因此可以用于防治中暑的药物、食品或保健品中,为防治中暑提供了新的、有效的生物治疗手段。
附图说明
21.为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
22.图1为实施例2粪便细菌测序工作流程图;
23.图2为实施例2中暑组和健康对照组肠道akk含量水平的差异;其中,control为健
康对照组,heat为中暑组,与对照组相比,**p《0.01;
24.图3为实施例2中暑组和健康对照组血浆d-乳酸含量水平的差异;其中,c为健康对照组,h为中暑组,与对照组相比,*p《0.05;
25.图4为实施例2中暑组和健康对照组血清fabp2含量水平的差异;其中,c为健康对照组,h为中暑组,与对照组相比,**p《0.01;
26.图5为实施例3中不同组大鼠血液中d-乳酸含量的比较;其中:c为正常对照组;h为中暑组;a为akk活菌+中暑组;u为akk灭活菌+中暑;与正常对照组相比,*p《0.05,**p《0.01;与中暑组相比,
#
p《0.05,
##
p《0.01;
27.图6为实施例3中各组大鼠结肠的病理结构改变(he染色)
×
400;其中:control为正常对照组;heat为中暑组;akk为akk活菌+中暑组;amuc为akk灭活菌+中暑组;ileums为回肠;colons为结肠;
28.图7为实施例3中各组大鼠紧密连接超微结构
×
20000;其中,c为正常对照组;h为中暑组;a为akk活菌+中暑组;u为akk灭活菌+中暑组;
29.图8为实施例4中不同组大鼠血液中内毒素含量的比较;其中:c为常温对照组;h为中暑组;a为akk活菌+中暑组;u为akk灭活菌+中暑组;与正常对照组相比,*p《0.05,**p《0.01;与中暑组相比,
#
p《0.05,
##
p《0.01。
具体实施方式
30.应该指出,以下详细说明都是例示性的,旨在对本技术提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本技术所属技术领域的普通技术人员通常理解的相同含义。
31.需要注意的是,这里所使用的术语仅是为了描述具体实施方式,而非意图限制根据本技术的示例性实施方式。如在这里所使用的,除非上下文另外明确指出,否则单数形式也包括复数形式,此外,还应当理解的是,当在本说明中使用术语“包含”和/或“包括”时,其指明存在特征、步骤、操作、器件、组件和/或它们的组合。
32.下面将结合实施例对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
33.实施例1akk活菌及其灭活菌的制备
34.一、akk菌培养
35.将akk标准菌(attc baa-835)进行复苏,加入含5%去纤维羊血的mrs肉汤培养基(bd 211825)中,培养于密封培养罐,于37℃下培养18-24小时,得到akk菌培养液。
36.二、离心
37.取上述培养得到的akk菌培养液,于6000g下离心10min,弃去上清,收集akk菌体沉淀。
38.三、获得akk活菌
39.将上述akk菌体沉淀用pbs稀释,反复离心,至其中无红细胞残留,菌液即为akk活菌;用比色法测量细菌浓度,计算个数。
40.四、制备akk灭活菌:
41.将沉淀的akk菌液密封,于70℃水浴30min灭活,降至室温,即制得akk灭活菌;备用。
42.实施例2中暑患者肠道akk菌的变化
43.一、检测粪便中的肠道菌群
44.1.1病例一般情况
45.入组中暑患者28例,健康对照14例,均为男性,年龄分别为27.8
±
6.5和25.3
±
5.4岁。采集中暑患者入院24h内的粪便,对照组不特别限制时间。因6例患者24h内未收集到粪便,所以粪便标本22例。
46.1.2粪便dna提取和miseq 16s amplicon测序
47.如图1所示,采用常规方法进行粪便细菌测序;其中包括:
48.①
通过粪便dna提取试剂盒提取粪便总dna;
49.②
粪便dna测序,比对其细菌片段并定量。
50.1.3血清样本釆集及预处理
51.所有研究对象均在早晨空腹8:30前抽取静脉空腹血5ml。于常温下静置30min后离心处理(4000r/min,10min),分离血清分装,置于-80℃冰箱内冻存,待所有标本收集完毕后,一次性测试。
52.1.4结果
53.统计方法:肠道菌群测定的数据分别在门、纲、目、科、属、种分类等级检验两组样品间微生物群落丰度的差异,使用软件metastats(http://metastats.cbcb.umd.edu/)(默认)或者r软件(秩和检验,fisher’s精确检验,卡方检验,t检验,方差检验)进行组间显著性差异分析。p值校正通过r(v 3.0.3)包中的p.adjust进行,校正方法为“bh”(即benjamini-chochberg)。其余统计分析时采用独立样本检验,即先用f检验进行方差齐性检验,如方差齐,使用t检验比较显著性水平;如方差不齐,使用独立样本mann-whitney u检验进行比较,相关性使用spearman方法分析。所用统计描述和统计分析均在spss21.0统计包上进行,以p《0.05为统计学有显著性差异指标。
54.1.5属和种水平上的菌群差异
55.属水平上,共41个有统计学差异(p<0.05)。中暑组和健康对照组肠道akk含量水平的差异见图2;由图2可知,与健康对照组相比,中暑患者肠道akk菌明显下降(p《0.01)。
56.中暑组和健康人间在种水平上有统计学差异的菌株有14种,大多是报道较少的。比较常见的为lactobacillus_fermentum(p=0.0292)和lactobacillus_sp._dcy75(p=0.001),均为乳酸杆菌,在健康对照组菌明显高于重症中暑组,是消化道、阴道的正常共生菌,能利用可发酵碳水化合物产生大量乳酸,对致病菌的繁殖有抑制作用,广泛存在于人体的肠道中,有非常重要的作用,对炎症状态下肠道屏障的修复机制,促进紧密连接蛋白的表达,降低了促炎细胞因子的表达,减轻肠道炎症。
57.二、肠黏膜的损伤指标d-乳酸的变化
58.2.1血浆d-乳酸测定方法
59.①
溶解试剂:
60.d-乳酸tate enzyme mix:使用0.22ml的d-乳酸tate assay buffer溶解,上下颠
倒混匀;
61.d-乳酸tate substrate mix:加入0.22ml的d-乳酸tate assay buffer溶解,完全地混合均匀;
62.②
d-乳酸标准品:
63.加入d-乳酸tate assay buffer稀释,将100mm稀释至100倍,得到1mm标准品d-乳酸溶液;
64.③
标准品孔:分别取0μl、2μl、4μl、6μl、8μl、10μl d-乳酸标准品溶液加入到96孔酶标板的孔中,并加入相应的d-乳酸tate assay buffer,每孔定容至50μl;
65.④
样品孔:将样品用d-乳酸tate assay buffer稀释至10倍,取50μl加入孔中;
66.⑤
取以下物质混匀:46μld-乳酸tate assay buffer、2μld-乳酸tate substrate mix、2μld-乳酸tate enzyme mix,总量50μl,加入每孔;
67.⑥
室温孵育30min,于450nm处检测;
68.⑦
标准曲线制作并计算样品的d-乳酸浓度。
69.2.2结果
70.血中d-乳酸水平是肠粘膜屏障破坏的敏感指标;肠黏膜受损,d-乳酸从肠道入血,d-乳酸浓度可反映肠黏膜受损程度。中暑组和健康对照组血浆d-乳酸含量水平的差异见图3;由图3可知,对照组血的d-乳酸含量为13.32
±
1.26mmol/l,中暑患者血含量为15.93
±
4.36mmol/l,p=0.035;中暑患者水平明显高于健康对照组,说明肠粘膜损伤。
71.三、肠粘膜损伤指标血fabp2含量水平
72.3.1血fabp2测定方法
73.fabp2检测采用双抗体夹心elisa法,具体步骤如下:
74.①
加样:样品稀释2倍,将待测品孔每孔各加入待测样品100ul;
75.②
将反应板充分混匀后室温孵育2.5h;
76.③
将反应液弃去;
77.④
洗板:每个孔加入300μl洗涤液将反应板充分洗涤4次;
78.⑤
将每个孔中加入100μl的酶标抗体工作液biotinylated human fabp
2 detection antibody,室温孵育1h,轻轻摇动;
79.⑥
弃去反应液,洗板4次;
80.⑦
每个孔中加入100μl的1x hrp-streptavidin solution,轻摇室温孵育30min;
81.⑧
每个孔中加入50μl终止液混匀;
82.⑨
在450nm处测吸光值,根据od值在标准曲线上求出相应fabp2含量。
83.3.2结果
84.中暑组和健康对照组血清fabp2含量水平的差异见图4;由图4可知,对照组的血清fabp2水平含量为410.0
±
123.6pg/ml(n=14),中暑患者水平含量为883.8
±
204.6pg/ml(n=28),p=0.000;说明中暑患者的肠粘膜绒毛受损,导致fabp2释放入血。
85.四、属水平上fabp2、d-乳酸与akk菌的相关性
86.为了更好地了解菌种丰度变化与肠道通透性之间的关系,分别将fabp2和d-乳酸与2组间有差异的菌进行相关性研究。
87.spearman分析发现,fabp2与akk菌呈负相关性(r=-0.353,p=0.034),说明akk菌
减少伴随肠粘膜损伤;同样,d-乳酸与akk菌也呈负相关性(r=-0.504,p=0.002),说明akk菌减少与肠粘膜屏障破坏相关。
88.实施例3akk活菌和akk灭活菌对中暑大鼠肠屏障的保护作用
89.一、大鼠的处理和制备中暑模型
90.将大鼠随机分为4组(即a组-d组),采用实施例1制备的akk活菌和akk灭活菌分别进行以下灌胃处理:
91.(a)常温对照组:生理盐水1ml/kg;
92.(b)中暑对照组:生理盐水1ml/kg;
93.(c)akk活菌+中暑组:用量为4
×
109cfu(溶于1ml生盐水)/kg;
94.(d)akk灭活菌+中暑组:akk灭活菌4
×
109cfu(溶于1ml生盐水)/kg。b、c、d组动物均按照以上药物灌胃6周后制备中暑模型。
95.大鼠用10%水合氯醛(0.2ml/100g)麻醉,分离股动脉并置管,通过加压生理盐水管道与多功能监护仪相连接。同时将电极置入大鼠直肠内约5-6cm,另一端也与多功能监护仪相连接。两者实时监测血压和直肠温度。将动物放置于高温气候室内,调节条件为:温度:37℃、湿度:60%。以平均动脉压下降到60mm hg作为中暑开始的标志。预实验结果显示,达到中暑起点的时间平均为240
±
3.8min(n=6),因此,后续实验的动物的暴露时间定为240min,达到后将大鼠移到室温下(26℃)复温,使用冷水冲洗10min,使体温快速下降。
96.中暑模型成功后24h,麻醉、开腹后分别于门静脉取血,室温静置30min,1200rpm离心10min,取上清,置于-80℃储存,备用。
97.二、akk菌降低血中d-乳酸浓度
98.不同组大鼠血液中d-乳酸含量的比较见图5;由图5可知,正常对照组的d-乳酸浓度较低,中暑后d-乳酸浓度明显升高,而akk活菌和akk灭活菌预处理均可以降低d-乳酸的血浓度,说明对肠黏膜有保护作用。
99.三、akk菌保护肠道上皮正常结构
100.各组大鼠结肠的病理结构改变见图6;小肠(ileums)和结肠(colons)病理标本显示:与正常对照组相比,中暑组黏膜有较严重的上皮细胞脱落现象,上皮细胞排列紊乱,小肠绒毛刷状缘中断、不连续;akk活菌组黏膜组织可见充血及轻度水肿,上皮细胞排列整齐;akk灭活组菌与正常较接近,绒毛均较正常、上皮细胞排列仍然较整齐,仅有较轻微的细胞脱落现象。
101.四、akk菌保护肠上皮紧密连接超微结构
102.使用透射电镜观察各组肠上皮的超微结构,结果见图7。由图7可以观察到,正常对照组大鼠的相邻肠上皮细胞间的紧密连接较长、结构完整、密度较高、连接致密,细胞的胞膜表面微绒毛排列整齐。中暑组上皮细胞膜表面微绒毛稀疏、断裂,紧密连接分开、呈“开放状态”,连接疏松。akk和akk灭活菌组细胞间的紧密连接超微结构较完整、密度下降不明显。
103.实施例4akk菌减低大鼠内毒素浓度
104.一、方法
105.原理:鲎试剂为鲎科动物东方鲎的血液变形细胞溶解物的冷冻干燥品,鲎试剂中含有c因子、b因子、凝固酶原、凝固蛋白原等。在适宜的条件下(温度,ph值及无干扰物质),细菌内毒素激活c因子,引起一系列酶促反应,激活凝固酶原形成凝固酶,凝固酶分解人工
合成的显色基质,使其分解为多肽和黄色的对硝基苯胺(pna,λmax=405nm)。在一定时间内,pna的生成量与细菌内毒素浓度成正相关,据此,可以定量供试品的内毒素浓度。
106.同时,对硝基苯胺(pna)也可用偶氮化试剂染成玫瑰红色(λmax=545nm),避免了供试品本身的颜色对405nm处吸收峰的干扰。
107.血浆的制备:全血血浆制备(无热原注射器(不含抗凝剂)采集的血液):吸取配套的血液抗凝剂1ml于无热原试管中,用无热原注射器准确抽取血1ml注入试管中,和抗凝剂混匀,置于冰水中,加盖,迅速低温离心10min(1000转/min),吸出上清液(富含血小板血浆或血清),制成二倍稀释液备用。取上述二倍稀释液0.2ml,加入血液处理剂ⅱ0.8ml,混匀,制成十倍稀释液备用。
108.实验操作步骤如下:
109.1、细菌内毒素标准溶液配制
110.标准曲线所采用的内毒素浓度可以为0.01,0.025,0.05,0.1eu/ml或0.1,0.25,0.5,1.0eu/ml浓度梯度。根据预实验选择适宜的标准曲线。配制好的内毒素标准溶液应在4小时内用完。
111.2、操作步骤
112.①
取无热原试管,加入100μl细菌内毒素检查用水、内毒素标准溶液,或供试品。
113.②
再加入100μl鲎试剂溶液,混匀,37℃温育t1分钟。
114.③
温育结束,加入100μl显色基质溶液,混匀,37℃温育t 2分钟。
115.④
温育结束,加入500μl偶氮化试剂1溶液,混匀,加入500μl偶氮化试剂2溶液。
116.⑤
混匀加入500μl偶氮化试剂3溶液,混匀,静置5分钟,于545nm波长处读取吸光度值。
117.二、结果
118.中暑可引起肠道菌群失调导致炎症发生,改变肠道黏膜渗透性,引起内毒素血症,继而引起全身器官功能不全。如图8所示,与正常对照组相比,中暑后内毒素水平明显升高;akk活菌和akk灭活菌处理后中暑后的内毒素水平都显著低于中暑对照组,提示这两者预处理可以减少内毒素入血,对肠黏膜屏障都有保护作用。
119.以上结果表明,经过巴氏消毒后的akk灭活菌,仍然能介导不弱于akk菌对肠道屏障的益生功能,其机制可能为巴氏杀菌虽然能使细菌整体失活,但对于功能性膜蛋白没有影响,能在杀菌温度下保持稳定。因此,akk活菌及其灭活菌能有效保护中暑动物的肠屏障,降低血中内毒素;可以用于防治中暑的药物、食品或保健品中,并提供了新的有效的生物治疗手段。
120.实施例5制备防治中暑的固体饮料
121.本实施例的防治中暑的固体饮料,主要由以下质量份的组分组成:
122.实施例1制备的akk活菌或其巴氏灭活菌0.8-1.3g(菌数10
10-10
12
cfu/g),低聚果糖和/或菊粉总量4.5-5.5g,钠25-75mg,钾60-180mg,风味剂(柠檬味、苹果味等)和甜味剂(阿斯巴甜等)适量。
123.配比内容如下:
124.akk活菌或其巴氏灭活菌0.8-1.3g(菌数10
10-10
12
cfu/g),以如下方式之一添加:
125.1)akk活菌1g(菌数10
10-10
12
cfu/g);
126.2)akk灭活菌1g(菌数10
10-10
12
cfu/g);
127.3)akk灭活菌1.2g(菌数10
10-10
12
cfu/g);
128.低聚果糖和/或菊粉总量4.5-5.5g,以如下方式之一添加:
129.1)低聚果糖3g,菊粉2g;
130.2)低聚果糖2g,菊粉3g;
131.钠来源可为枸橼酸钠或氯化钠,钾来源可为枸橼酸钾或氯化钾,可以采用如下方式之一添加:
132.1)钠:25-75mg(柠檬酸钠:0.11-0.32g或氯化钠0.064-0.192g);
133.2)钾:60-180mg(柠檬酸钾:0.17-0.51g或氯化钾0.12-0.35g)。
134.本实施例的防治中暑的固体饮料主要成分为akk菌或其巴氏灭活菌,低聚果糖或菊粉为益生元,几乎不能被消化,在结肠被有益微生物利用生成短链脂肪酸等,可被akk菌利用并促进增殖。钠和钾可提供机体丢失的电解质。本发明制得的akk菌或其灭活菌在固体饮料中可稳定存在,能用温水溶解为均匀液体,形成一种奶油状结构,提供光滑的口感和风味。
135.本实施例的防治中暑的固体饮料,生产步骤如下:
136.1)akk菌或其巴氏灭活菌计数,离心,加入液氮,瞬间降温后得到冻干粉,按照细菌数量称取相应重量;
137.2)将低聚果糖或菊粉、钠和钾制剂的各个原料烘干,并过40目筛;
138.3)将过筛后的各原料在混料器中混合均匀;
139.4)在无菌条件下,将混合均匀的原料组合进行铝箔袋真空包装;
140.5)抽样检测,保证菌数≥10
10
cfu,且其他物性指标均合格。
141.本实施例的固体饮料的服用量为1-3次/天,可用于高温环境下高危人群的预防,如老年人和户外作业、训练和运动人员。
142.最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1