含母乳低聚糖提高免疫力的婴幼儿配方奶粉及其制备方法与流程
本发明主要是关于一种含有hmo提高免疫力的婴儿配方奶粉及其制备方法,具体是指一种包含母乳低聚糖(humanmilkoligosaccharides,简称hmos)及益生菌特别是乳双歧杆菌(bifidobacteriumlactis)的婴儿配方粉及其制备方法与应用。
背景技术:
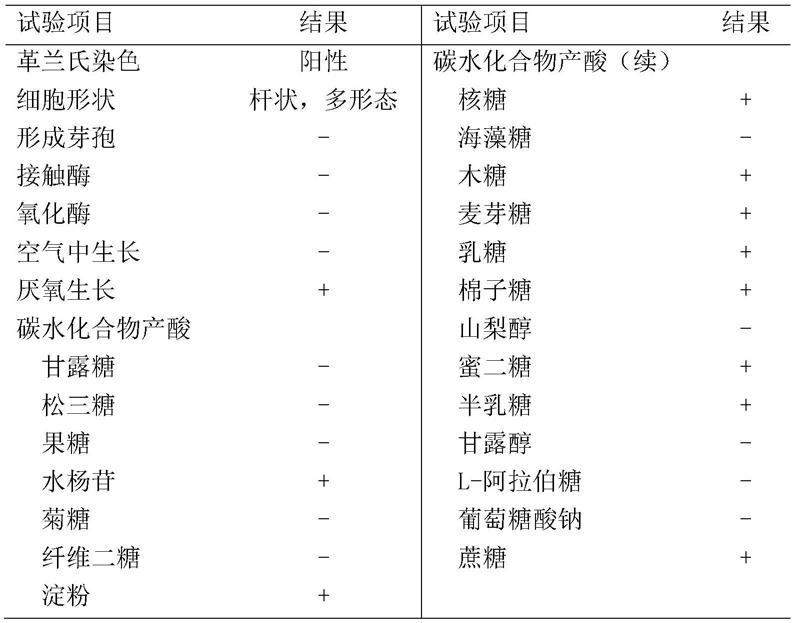
:在上个千年,已有医学文献记载,未经母乳喂养的婴儿有较高的疾病率和死亡率。母乳不仅为婴儿提供所需营养,母乳中的活性成分更为婴儿的肠道发育和免疫力完善提供保障。母乳喂养的婴儿与配方奶喂养的婴儿相比,肠道菌群中有益菌的相对丰度更高,特别是双歧杆菌和乳酸菌。母乳通过菌群的传递,加上母乳低聚糖和母乳中的细胞因子等活性成分,为新生儿建立起健康的肠道菌群。婴儿每天通过母乳摄入107-108个细菌,包括乳酸菌和双歧杆菌。这些菌通过母乳直接传递给婴儿,部分可在婴儿肠道定植,促进生命早期肠道菌群的建立。婴儿肠道菌群的建立,对其肠道的发育,以及对健康和免疫系统有着短期,甚至终生的影响。母乳低聚糖(humanmilkoligosaccharides,简称hmos)属于母乳中除乳糖和脂肪外,含量第三丰富的物质。其总含量在泌乳期的各个阶段有变化,在成熟乳中大约是12-14g/l,而初乳中大约是20-24g/l。每一种母乳低聚糖的结构在还原端都有一个乳糖,大部分以聚乳糖胺作为结构主链,并在链端含有岩藻糖、唾液酸或二者均有。hmos的存在与含量存在个体差异,并与哺乳母亲的路易斯分泌型组成有关。由于婴幼儿配方粉的原料通常是牛乳,而牛乳中通常不含或含有很少这类低聚糖物质,hmos便成为了婴幼儿配方粉想要更加接近母乳成分所必须跨越的一道鸿沟。上世纪90年代,在大部分母乳中均含有的hmo,2-岩藻糖基乳糖(2’-fl)被发现可有效地减轻大肠杆菌中稳定毒素的毒性;到了2003年,该低聚糖被报道可抑制弯曲空肠杆菌的附着和感染。随后,母乳低聚糖的三大主要功能被逐步报道和发现:(1)抑制特定病菌的附着和感染;(2)作为益生元,促进肠道共生系统里面细菌的生长;(3)直接减缓粘膜在有毒刺激下的炎症反应。使用了2’-fl的首个临床干预试验证实了在低卡路里配方中加入这个特定成分不仅安全还可以让配方奶喂养的婴儿生长速率与母乳喂养的婴儿具有可比性。2’-fl也被用作成年人的营养补充剂,缓解肠道应激性综合症或炎症性肠病,或被用作益生元维持肠道菌群平衡。肠道菌群是人体肠道微生态系统的重要组成物质,对人类健康有重要作用,如可提供必需营养素,生成维生素k,辅助消化过程与促进血管生成和肠道神经作用。益生元与益生菌被视为改善机体健康的微生态管理工具,可改变、调节和重组已经存在的肠道菌群。目前在婴幼儿配方粉、辅食及营养补充剂领域,需要有缓解婴幼儿肠道不适及提升自身免疫能力的解决方案。同时,在3岁以上儿童、青少年及成人领域,也需要维持肠道菌群平衡,调节免疫能力。技术实现要素:本发明的一个目的在于提供一种母乳化婴幼儿配方奶粉。本发明的另一个目的在于提供一种母乳化婴幼儿配方奶粉的制备方法。本发明的另一个目的在于提供一种母乳化婴幼儿配方奶粉的应用。本案发明人在研究中发现,乳双歧杆菌(bifidobacteriumlactis)与母乳低聚糖的组合,对于提高胃肠道免疫能力具有协同作用。从而,一方面,本发明提供了一种母乳化婴幼儿配方奶粉,其包括乳双歧杆菌(bifidobacteriumlactis)及母乳低聚糖。根据本发明的具体实施方案,本发明的母乳化婴幼儿配方奶粉中,所述乳双歧杆菌包括乳双歧杆菌(bifidobacteriumlactis)hn019菌株、和/或保藏编号cgmccno.15650的乳双歧杆菌(bifidobacteriumlactis)。乳双歧杆菌(bifidobacteriumlactis)hn019菌株为商业化菌株,可由杜邦丹尼斯克公司提供。保藏编号为cgmccno.15650的乳双歧杆菌亦命名为乳双歧杆菌bl-99。该菌株具有耐胃酸性能,在ph2.5的胃酸液中处理30min时活菌存活率62%以上,处理2小时活菌存活率61%以上。本发明提供的乳双歧杆菌bl-99还具有耐肠液性能,在ph6.8的小肠液中处理2小时活菌存活率70%以上。小鼠实验表明该菌株无口服急性毒性,无抗生素耐受,安全可以用于食品加工。该菌株已于2018年04月26日保藏于中国微生物菌种保藏管理委员会普通微生物中心(cgmcc)(地址:北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所),分类命名:乳双歧杆菌(bifidobacteriumlactis);保藏编号为cgmccno.15650。根据本发明的具体实施方案,本发明的组合物中,所述母乳低聚糖包括2’-岩藻糖基乳糖、3’-岩藻糖基乳糖、乳糖-n-四糖、3’-唾液酸基乳糖、6’-唾液酸基乳糖中的一种或多种。根据本发明的具体实施方案,本发明的组合物中,所述母乳低聚糖包括重量比例(0-10):(4-8):(3-6):(1-4):(0-1)的2’-岩藻糖基乳糖、3’-岩藻糖基乳糖、乳糖-n-四糖、3’-唾液酸基乳糖、6’-唾液酸基乳糖。根据本发明的具体实施方案,本发明的组合物中,所述母乳低聚糖包括重量百分比(0-53%):(21%-44%):(16%-32%):(5%-22%):(0-5%)的2’-岩藻糖基乳糖、3’-岩藻糖基乳糖、乳糖-n-四糖、3’-唾液酸基乳糖、6’-唾液酸基乳糖。所述重量百分比是以母乳低聚糖的总量为100%计。根据本发明的具体实施方案,本发明的母乳化婴幼儿配方奶粉,可以是婴儿配方奶粉,也可以是幼儿配方奶粉。根据本发明的一些优选具体实施方案,本发明的母乳化婴幼儿配方奶粉中,所述乳双歧杆菌的添加量为1×103cfu/g~1×1012cfu/g,优选为1×106cfu/g~1×1010cfu/g。根据本发明的一些优选具体实施方案,本发明的母乳化婴幼儿配方奶粉中,母乳低聚糖的应用量为0.5%~1.5%。根据本发明的具体实施方案,本发明的母乳化婴幼儿配方奶粉中,除所述乳酸杆菌及母乳低聚糖外,还可包括婴幼儿配方奶粉的常规组分。根据本发明的一些优选具体实施方案,本发明的母乳化婴幼儿配方奶粉,基于1000重量份的母乳化婴幼儿配方奶粉,其原料中除包括母乳低聚糖及乳双歧杆菌外,还包括:生牛乳890~3800重量份、乳糖0~480重量份、脱盐乳清粉0~540重量份、乳清蛋白粉wpc80%0~80重量份、乳清蛋白粉wpc34%0~120重量份、结构油脂opo0~170重量份、高油酸葵花籽油0~150重量份、玉米油0~50重量份、低芥酸菜籽油0~50重量份、大豆油0~80重量份、β-酪蛋白0~23重量份、大豆磷脂1~2.5重量份、低聚果糖粉0~30重量份、低聚半乳糖浆0~90重量份、复配维生素1~5重量份、氯化胆碱0~3重量份、矿物质一0~2重量份、矿物质二1~9重量份;其中,矿物质一包括铜、铁、碘元素,矿物质二包括钙、磷元素;还可选择性包括以下成分中的一种或多种:肌醇0.20~2.04重量份、牛磺酸0~0.65重量份、左旋肉碱0.06~0.5重量份、dha3~18重量份、ara3~18重量份。上述配方中,生牛乳的蛋白质和脂肪可用全脂乳粉和/或脱脂乳粉替代;乳清蛋白粉wpc80和乳清蛋白粉wpc34可由α-乳白蛋白部分替代。本发明配方中的复配维生素、各种矿物质可以采用符合国家标准的营养成分的复合营养素组合物,按照不同配方使用不同添加量,具体添加方式可以参照所属领域的常规操作进行。优选地,本发明的配方奶粉根据需要若添加复合营养素可选择性采用下述复配营养素成分中的任一或任意组合(每克含量;各指标按添加范围的中间值计算量;基本不存在所有指标含量同时最大的情况):维生素a:1300~4000μgre;维生素d:24~60μg;维生素e:13~41mgα-te维生素k1:200~550μg;维生素b1:2600~6500μg;维生素b2:600~3000μg维生素b6:1200~4000μg;维生素b12:2~14.0μg;烟酰胺:12000~30000μg叶酸:300~653μg;泛酸:8750~16230μg;生物素:56~150μg;钠:30~400mg钾:63~400mg;铜:2200~5540μg;镁:133~400mg;铁:23~95mg;锌:25~52mg钙:110~300mg;磷:75~200mg;碘:200~1592μg。根据本发明的一些优选具体实施方案,本发明的母乳化婴幼儿配方奶粉中还包括动物双歧杆菌,所述动物双歧杆菌的添加量为2×106cfu/g~2×1012cfu/g,优选为2×106cfu/g~2×1010cfu/g。另一方面,本发明还提供了一种制备所述的母乳化婴幼儿配方奶粉的方法,该方法采用湿法或干法生产工艺,将母乳低聚糖及乳双歧杆菌与配方中的其他原料混合,制备所述母乳化婴幼儿配方奶粉。具体地,湿法工艺通常包括:配料—湿法(hmo及益生菌)—均质—浓缩杀菌—喷雾干燥—成品。干法生产工艺通常包括:配料—预热—均质—浓缩杀菌—喷雾干燥—干混(hmo及益生菌)—成品。另一方面,本发明还提供了所述的母乳化婴幼儿配方奶粉在作为具有提高胃肠道免疫能力功效的食品中的应用。根据本发明的具体实施方案,本发明的母乳化婴幼儿配方奶粉在作为具有提高胃肠道免疫能力功效的食品中的应用中,所述提高胃肠道免疫能力包括:在肠道系统中抵御致病菌侵入,和/或维持肠道屏蔽功能。根据本发明的具体实施方案,本发明的母乳化婴幼儿配方奶粉在作为具有提高胃肠道免疫能力功效的食品中的应用中,所述提高胃肠道免疫能力包括:降低肠道细胞释放炎症因子il-8和/或ip-10。根据本发明的含有母乳低聚糖特别是2’-岩藻糖基乳糖(2’-fl)及益生菌特别是乳双歧杆菌的母乳化婴幼儿配方奶粉,能够调节婴幼儿肠道的免疫能力,抵御外界病菌侵入或在3岁以上幼儿和成人中,发挥协同作用;调节免疫能力,抵御病菌侵入的作用通过抗粘附测试、肠道屏障完整性测试、炎症因子释放测试、受试物质对致病菌epec存活率影响测试验证。附图说明图1显示母乳低聚糖2’-fl和母乳低聚糖混合物对受试致病菌epec存活率影响。图2显示乳双歧杆菌hn019与bl-99菌株对受试致病菌epec存活率影响。图3显示乳双歧杆菌hn019与母乳低聚糖2’-fl组合或与母乳低聚糖混合物的组合对受试致病菌epec存活率影响。图4显示乳双歧杆菌bl-99与母乳低聚糖2’-fl组合或与母乳低聚糖混合物的组合对受试致病菌epec存活率影响。图5a显示乳双歧杆菌hn019(108)与母乳低聚糖2’-fl(5g/l)组合对致病菌epec作用于肠道细胞caco-2的粘附实验结果;图5b显示106浓度的乳双歧杆菌hn019与2g/l母乳低聚糖2’-fl组合对受试致病菌epec存活率影响。图6a显示乳双歧杆菌bl-99(108)与母乳低聚糖2’-fl(5g/l)组合对致病菌epec作用于肠道细胞caco-2的粘附实验结果;图6b显示另一批次的实验中乳双歧杆菌bl-99(108)与2’-fl(5g/l)形成的组合物对于抑制大肠杆菌epec粘附到caco-2细胞的实验结果。图7a显示乳双歧杆菌hn019(108)与母乳低聚糖2’-fl(5g/l)的组合对肠道屏障的影响;图7b显示106浓度的乳双歧杆菌hn019与不同浓度的母乳低聚糖2’-fl组合对etec侵袭条件下,跨膜电阻teer的影响。图8显示106浓度的乳双歧杆菌bl-99与5g/l母乳低聚糖2’-fl组合对etec侵袭条件下,跨膜电阻teer的影响。图9显示在未加入大肠杆菌共培养时,乳双歧杆菌hn019与母乳低聚糖2’-fl组合对肠道细胞分泌炎症因子il-8的影响。图10显示在未加入大肠杆菌共培养时,乳双歧杆菌hn019与母乳低聚糖2’-fl组合对肠道细胞分泌炎症因子ip-10的影响。图11显示在加入大肠杆菌共培养时,乳双歧杆菌hn019与母乳低聚糖2’-fl组合对肠道细胞分泌炎症因子il-8的影响。图12显示在加入大肠杆菌共培养时,乳双歧杆菌hn019与母乳低聚糖2’-fl组合对肠道细胞分泌炎症因子ip-10的影响。图13显示106浓度的乳双歧杆菌hn019与不同浓度母乳低聚糖2’-fl组合对致病菌etec侵袭条件下,肠道细胞caco-2释放炎症因子il-8的影响。图14a显示乳双歧杆菌hn019(108)与母乳低聚糖混合物a的组合对致病菌epec作用于肠道细胞caco-2的粘附实验结果;图14b展示了不同浓度的乳双歧杆菌hn019与不同比例的hmo混合物形成的组合物对于抑制大肠杆菌epec粘附到caco-2细胞的实验结果。图15a显示乳双歧杆菌bl-99(108)与母乳低聚糖混合物b的组合对致病菌epec作用于肠道细胞caco-2的粘附实验结果;图15b展示了不同浓度的乳双歧杆菌bl-99与不同比例的hmo混合物形成的组合物对于抑制大肠杆菌epec粘附到caco-2细胞的实验结果。图16a显示乳双歧杆菌hn019(108)与母乳低聚糖混合物a的组合对肠道屏障的影响;图16b展示了单独的益生菌hn019(108)与不同比例的hmo组合物a、b和f在暴露于大肠杆菌etech10407的情况下,对于跨膜电阻teer的影响;图16c显示单独的益生菌hn019(106)与hmo组合物a在暴露于大肠杆菌etech10407的情况下,对于跨膜电阻teer的影响。图17展示了单独的益生菌bl-99(108)与不同比例的hmo组合物a、b和f在暴露于大肠杆菌etech10407的情况下,对于跨膜电阻teer的影响图18a和图18b显示在未加入大肠杆菌共培养时,乳双歧杆菌hn019与母乳低聚糖混合物的组合对肠道细胞分泌炎症因子il-8与ip-10的影响。图19a和图19b显示在加入大肠杆菌共培养时,乳双歧杆菌hn019与母乳低聚糖混合物的组合对肠道细胞分泌炎症因子il-8与ip-10的影响。专利程序的微生物保存:本发明的乳双歧杆菌bl-99:保藏日期:2018年04月26日;保藏单位:中国微生物菌种保藏管理委员会普通微生物中心(cgmcc);保藏单位地址:北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所保藏编号:cgmccno.15650;分类命名:乳双歧杆菌(bifidobacteriumlactis)。具体实施方式为了对本发明的技术特征、目的和有益效果有更加清楚的理解,现结合具体实例及附图对本发明的技术方案进行以下详细说明,应理解这些实例仅用于说明本发明而不用于限制本发明的范围。除非另外专门定义,本文使用的所有技术和科学术语都与相关领域普通技术人员的通常理解具有相同的含义。本案发明人通过具体的实验证明了本发明的益生菌益生元组合物在调节胃肠道免疫能力方面具有协同作用。各实施例及对照所用实验方法及受试物情况如下:1.实验准备步骤1.1培养基配置与受试益生元的储存和配置含有益生元和益生菌的培养基在每次实验当天于无菌环境中新鲜配置,并预热到37℃。受试的益生元/hmos被储存在干燥避光的室温环境中。实验中使用的浓度为5g/l。1.2益生菌培养、生长曲线绘制与活性鉴别益生菌粉在实验前以冷冻干燥的状态送到实验室。益生菌被接种到mrs-琼脂平板上,取单独的菌株群落用于16srdna鉴定,且用来制备甘油原液(储存在-80℃)。在每次实验前,从甘油原液中取出益生菌并在mrs平板上于37℃接种,在静止态下收获,并在实验前用mem培养基冲洗。在益生菌受试前,用荧光激活细胞分拣系统测量益生菌活性与细胞数。实验中使用的益生菌浓度为1×108cfu/ml。在37℃厌氧条件下培养乳双歧杆菌,在实验前绘制生长曲线。在收到益生菌原料并在所有实验开始前,用流式细胞仪测试益生菌株的活性。16s测序被用来测定菌株身份。在益生菌具体各项实验的受试前,用荧光激活细胞分拣系统测量益生菌活性与细胞数。1.2.1乳双歧杆菌bl-99本发明的乳双歧杆菌bl-99是自婴儿肠道中分离得到的。该菌株已于2018年04月26日保藏于中国微生物菌种保藏管理委员会普通微生物中心(cgmcc)(地址:北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所),分类命名:乳双歧杆菌(bifidobacteriumlactis);保藏编号为cgmccno.15650。1.2.1.1乳双歧杆菌bl-99的分类学特征理化试验结果:1.2.1.2乳双歧杆菌bl-99的人工胃液、肠液耐受性双歧杆菌为通常不抗酸的菌属。本实施例中,测试了本发明的乳双歧杆菌bl-99的人工胃液、肠液耐受性,同时以目前领域中公认耐酸性能极好、可以通过胃肠道存活的乳双歧杆菌作为对比。测试方法:将乳双歧杆菌bl-99菌株于mrs液体培养基中37℃培养16小时后,于4℃、2500rpm下离心10min,收集菌体。将待测菌株分别在人工胃液、人工小肠液中培养,37℃处理0、30min、2h后进行活菌计数分析,以存活率评价菌株的耐酸及耐肠液性能。存活率=(处理后的活菌数/0时刻活菌数)×100%。菌株在人工胃酸(ph2.5)中的存活率检测结果如表1所示,bb-12在人工胃酸(ph2.5)中处理30min时活菌存活率7.04%,处理2小时活菌存活率仅1.64%;而本发明的乳双歧杆菌bl-99在人工胃酸(ph2.5)中处理30min时活菌存活率62.60%,处理2小时活菌存活率61.83%。表明本发明的乳双歧杆菌bl-99具有优异的耐胃酸能力,能较为顺利地通过胃到达肠道发挥益生作用。表1菌株在人工胃酸(ph2.5)中的存活率菌株在人工小肠液(ph6.8)中的存活率检测结果参见表2。数据显示,bb-12在人工小肠液(ph6.8)中处理2小时活菌存活率仅28.95%;而本发明的乳双歧杆菌bl-99在人工胃酸(ph2.5)中处理2小时活菌存活率70.23%。表明本发明的乳双歧杆菌bl-99具有优异的耐肠液能力,可以在肠道内存活并定殖。表2菌株在人工小肠液(ph6.8)中的存活率1.2.1.3乳双歧杆菌bl-99的的毒力实验及安全性检测将本发明的乳双歧杆菌bl-99接种于bbl液体培养基中,36±1℃厌氧培养48±2小时,计数培养液中乳双歧杆菌bl-99活菌数为3.7×108cfu/ml,将培养物的原液和5倍浓缩液,经口以20.0ml/kgbw给受试小鼠连续灌胃3天,观察7天。试验设培养基原液和5倍浓缩液对照组。试验结果表明:乳双歧杆菌bl-99的bbl培养物原液和5倍浓缩液组与各自对照组相比,对小鼠体重增长的影响无统计学意义(p>0.05),同时未观察到受试小鼠有毒性反应或死亡。采用sn/t1944-2007《动物及其制品中细菌耐药性的测定》方法,评估乳双歧杆菌bl-99的抗生素敏感性能。评价结果显示,乳双歧杆菌bl-99对氨苄西林ampicillin、青霉素gpenicilling、红霉素erythromycin、氯霉素chloramphenicol、克林霉素clindamycin、万古霉素vancomycin和四环素tetracycline等敏感。符合欧洲食品安全委员会(europeanfoodsafetyauthority)对食用细菌耐药性评价规范中的要求。乳双歧杆菌bl-99不含外源抗生素耐药基因,食用安全。1.2.2乳双歧杆菌hn019hn019菌株由杜邦丹尼斯克公司提供。1.3不同组合益生元和益生菌的配制组合中受试益生元浓度为5g/l;受试益生菌数量为1×108cfu/ml。第一轮测试:五个组合益生元:2’-fl:3-fl:lnt:3-sl:6-sl=10:4:3:1:1第二轮测试:五个组合益生元比例及所占百分比如下表3和表4所示。表3比例2’-fl3-fllnt3-sl6-sl组合物a104311组合物b104320组合物c96320组合物d08640组合物f12.55.754.251.51表4百分比%2’-fl3-fllnt3-sl6-sl组合物a53211655组合物b532116100组合物c453015100组合物d04432220组合物f502317641.4caco-2细胞培养从dsmz(德国不伦瑞克)公司购得人结肠肿瘤细胞系(caco-2),并在有5%co2,37℃一定湿度条件下培养。第40-44代caco-2细胞被用于实验。mem培养基中加入了20%(体积/体积)的胎牛血清(fbs),1%的非必需氨基酸,1%的glutamax,1%的丙酮酸钠,添加或未添加1%的青霉素-链霉素溶液,以及50g/ml的庆大霉素(所有均从荷兰布雷达的invitrogen公司购得)。细胞在t75培养瓶中长到80%丰度,用胰蛋白酶消化处理获取。1.5致病菌etec和epec的培养用bhi-b培养基(美国纽约默克公司)培养etec细胞株h10407(atcc35401)。在37℃厌氧条件下过夜培养后,致病菌在感染前被再次培养,以达到对数中期。离心收集细胞,冲洗并在实验前用pbs再悬浮。epec血清型o119株在冷冻干燥条件下从dsmz处购得(dsm8699)。用bhi-b培养基(美国纽约默克公司)培养菌株。在37℃厌氧条件下过夜培养后,致病菌在感染前被再次培养,以达到对数中期。离心收集细胞,冲洗并在实验前用pbs再悬浮。1.6数据分析如有可能,用三次重复(有时候可用六次重复)来进行每个单独测试的统计分析。抗粘附数据用log10转化。对于log10转化后的抗粘附数据和表皮信号传导数据用one-wayanova来进行统计分析。用dunnett’sposthoc测试来鉴定与阴性对照或者用大肠杆菌刺激条件下的统计差异。在跨膜电阻teer测试中,阴性对照与受试组之间在每个时间点的统计学差异用two-wayanova以及dunnett’sposthoc测试进行分析。在炎症因子il-8和ip-10的测试中,进行了one-wayanova统计分析,并用dunnett’sposthoc测试进行显著性分析。用星号表示显著性差异:*代表p<0.05,**代表p<0.01,***代表p<0.001,****代表p<0.0001。p<0.05被认为有显著性差异。标星号的组别与未标星号的组别有显著统计学差异,差异程度视星号的个数而异。因dunnett’sposthoc测试用了anovamsresidual用作差异的pooled评估,且用了修改的显著性数值用来调整比较的数目,所以同样的结果在一个图表中可能显著,而另一个图表中可能不显著。2.具体实验步骤2.1抗粘附测试在24孔板上培养caco-2细胞。在试验当天,用预热的pbs冲洗caco-2细胞。受试物质被以三倍平行重复加到caco-2细胞中。用受试物质培养细胞1小时。接着加入致病菌大肠杆菌,以感染倍数(moi)50:1加入(最终浓度为107cfu/ml),与受试物质在37℃共培养1小时。作为阴性对照,caco-2细胞在培养基中仅与致病菌一起培养。因被报道为可减少致病菌吸附,1mm氧化锌(zno)被用作阳性对照。在培养后,冲洗并裂解caco-2细胞,然后致病菌被接种在琼脂上。在37℃琼脂平板上培养过夜后,数细菌的cfu菌落数以衡量致病菌吸附。数生长中的大肠杆菌菌落数并记录为cfu/ml。与抗粘附测试平行的,将大肠杆菌(终浓度为)107cfu/ml添加到1ml受试的组合五种,并在37℃共培养1小时以测量活性。培养后,从每个样品离心收集大肠杆菌,再悬浮于pbs中,并在琼脂平板上接种。在37℃琼脂平板上培养过夜后,数细菌的cfu菌落数以衡量致病菌吸附。数生长中的大肠杆菌菌落数并记录为cfu/ml。2.2肠道屏障完整性测试理想的小肠上皮屏障功能是保护宿主免受致病菌侵入和/或致病菌来源毒素的先决条件。在此研究中,体外的屏障完整性通过测定肠道细胞层的跨表皮的电阻(teer)体现。食物成分可能具有保护感染后肠道屏障功能下降的功能(减轻感染后teer的下降)。为了研究益生元和益生菌对于感染的作用,测定了teer在大肠杆菌感染前和感染后随时间变化的情况。caco-2细胞被接种到transwell聚碳酸酯细胞培养插入物中,平均孔径为0.4um,面积为0.33cm2直至完全分化(±1000ω)。用世界精准仪器购入的evom2表皮伏特测量器测量跨上皮细胞电阻(teer)以衡量屏障完整性。在测试当天,细胞被冲洗,并在37℃下用不含抗生素和血清,但含有受试物质的培养基中培养1小时。紧接着加入大肠杆菌到受试物质之上(感染倍数moi为200:1),并培养6小时。在实验开始前(t=-1),受试物质暴露1小时后及添加致病菌前(t=0),并在致病菌接触后1小时、2小时、3小时、4小时和6小时分别测定teer。在与致病菌接触后单独条件下的teer值与其各自在t=0时的teer值相关,且被表述成δteer(ω.cm2)。阴性对照(只加入大肠杆菌)与未接触致病菌或受试物质的阳性对照也在实验组别中。所有条件重复测定三次,一些对照组被重复测定6次。2.3炎症因子释放测试益生元和益生菌能具有免疫调节(促进或者抗炎症)作用,能增加对于感染的抵抗力或者促进肠道健康。益生元益生菌的免疫调节作用可在存在或不存在促炎症刺激的情况下,测定小肠上皮细胞的细胞因子/趋化因子产生来衡量。用大肠杆菌菌株刺激caco-2细胞并测定上清液中il-8和ip-10的产生,可筛选益生元和益生菌对于趋化因子/细胞因子的产生的影响。il-8对于紧急的自身免疫反应很重要,可以导致中性粒细胞的聚集。ip-10在免疫的二级应答中很重要。它可以吸引单核细胞和巨噬细胞,也包括th1细胞,这些对于清除感染有重要作用。促炎症的益生元和益生菌可以增加il-8和/或ip-10的生成,而抗炎症的益生元和益生菌可以减少il-8和/或ip-10的生成。将caco-2细胞在96孔板养到适合的丰度。在实验最初,用不含抗生素的培养基冲洗细胞一次。将单层细胞与受试物质在37℃下用不含抗生素的培养基中共培养1小时,重复三次。加入大肠杆菌刺激细胞(moi200:1)。在1小时培养后,单层细胞与致病菌共培养,并用含有受试物质和50g/ml庆大霉素的培养液冲洗和培养过夜。作为空白对照,只用了培养液而没用大肠杆菌刺激。用大肠杆菌刺激但没用受试物质的培养液被用作大肠杆菌应答的对照。此外,作为caco-2细胞应答的对照,用含有rectnfα(10ng/ml)以及recifnγ(5ng/ml)(均从英国阿宾顿的r&dsystems购入)的混合物培养液刺激细胞。刺激24小时候收集上清液并储存于-20℃。按照生产商的使用指导,用bio-plex试剂盒(美国加州biorad公司)测试il-8和ip-10。3.受试物质对致病菌epec存活率影响测试为验证致病菌吸附的减少是否与致病菌活性有关,在益生元和益生菌培养后也检测了致病菌活性。参见图1-图4所示,与其他受试益生菌或益生元类似,加入受试物质hn019或2’-fl后,或二者的组合后,未显著影响大肠杆菌epec0119菌的存活率;与其他受试益生菌或益生元类似,bl-99或2’-fl,未显著影响epec0119菌的存活率;而二者的组合略微降低了epec0119菌的存活率。加入受试物质hn019或hmo混合物后,未显著影响大肠杆菌epec0119菌的存活率;加入二者的组合物b,略降低了大肠杆菌的存活率;加入受试物质bl-99或hmo混合物后,或二者的组合后,未显著影响大肠杆菌epec0119菌的存活率。实施例1:乳双歧杆菌与母乳低聚糖2’-fl对胃肠道免疫力的影响1.乳双歧杆菌hn019与母乳低聚糖2’-fl组合对致病菌epec于肠道粘附实验结果实验前准备步骤以及具体实验方法请见前述段落。乳双歧杆菌hn019有正常的生长曲线。通过常见致腹泻菌株epeco119研究了益生菌和益生元组合物阻止致病菌吸附到小肠上皮细胞的保护作用。结果参见图5a所示,单独的母乳低聚糖2’-fl(5g/l)对于致病菌大肠杆菌o119对肠道细胞caco-2的粘附作用与阴性对照相比无显著差异,而阳性对照氧化锌可显著的降低致病菌对肠道细胞的吸附(p<0.0001)。单独的益生菌hn019(108)对于致病菌大肠杆菌o119对肠道细胞caco-2的粘附作用与阴性对照相比无显著差异。但当益生元2’-fl与益生菌一同作为处理组受试物质,二者显著降低了致病菌epec0119吸附到肠道细胞(p<0.01)。显示当二者形成组合物,具有协同效应。图5b显示106浓度的乳双歧杆菌hn019与2g/l母乳低聚糖2’-fl组合对受试致病菌epec存活率影响,实验结果数据(均值±标准误差,重复三次测量)如表5所示。与阴性对照组相比,106的益生菌组显著降低了epec粘附到肠道细胞表面(p<0.05),而106的益生菌与2-fl形成的组合物也显著降低了epec粘附到肠道细胞表面(p<0.05)。表52.乳双歧杆菌bl-99与母乳低聚糖2’-fl组合对致病菌epec于肠道粘附实验结果实验前准备步骤以及具体实验方法请见前述段落。受试乳双歧杆菌bl-99有正常的生长曲线。通过常见致腹泻菌株(epeco119)研究了益生菌和益生元组合物阻止致病菌吸附到小肠上皮细胞的保护作用。结果参见图6a所示,单独的母乳低聚糖2’-fl(5g/l)对于致病菌大肠杆菌o119对肠道细胞caco-2的粘附作用与阴性对照相比无显著差异,而阳性对照氧化锌可显著的降低致病菌对肠道细胞的吸附(p<0.0001)。单独的益生菌bl-99(108)对于致病菌大肠杆菌o119对肠道细胞caco-2的粘附作用与阴性对照相比无显著差异。但当益生元2’-fl与益生菌一同作为处理组受试物质,二者显著降低了致病菌epec0119吸附到肠道细胞(p<0.001)。显示当二者形成组合物,具有协同效应。图6b展示了另一批次的实验中乳双歧杆菌bl-99(108)与2’-fl(5g/l)形成的组合物对于抑制大肠杆菌epec粘附到caco-2细胞的实验结果,实验结果数据(均值±标准误差,重复三次测量)如表6所示。与阴性对照组相比,2-fl(5g/l)组显著降低了epec粘附到肠道细胞表面(p<0.05),而108的益生菌与2-fl(5g/l)形成的组合物降低了epec粘附到肠道细胞表面,且效果更显著(p<0.01)。表63.hn019+2’-fl跨膜电阻测试实验前准备步骤以及具体实验方法请见前述段落。受试乳双歧杆菌hn019有正常的生长曲线。结果参见图7a所示,在不同的时间点测试了受试物质对于跨膜电阻的影响,单独的母乳低聚糖2’-fl(5g/l)对于跨膜电阻teer的下降基本无作用,与阴性对照组接近,而益生菌hn019(108)可在多个时间点,于一定程度上有提升跨膜电阻teer值的趋势;且在加入母乳低聚糖2’-fl后,该提升效果在t=4和t=5两个时间点更显著,体现了益生元与益生菌组合的协同效应。图7b显示106浓度的乳双歧杆菌hn019与不同浓度的母乳低聚糖2’-fl组合对etec侵袭条件下,跨膜电阻teer的影响,实验结果数据(均值±标准误差,重复三次测量)如表7所示。hn019与2-fl(5g/l)的组合物相较于单独的益生菌,在多个时间点,有提升teer值的趋势。且在t=2时,hn019(106)+2fl(5g/l)显著的比单独的hn019(106)要高(p<0.05)。表74.bl-99+2’-fl跨膜电阻测试实验前准备步骤以及具体实验方法请见前述段落。受试乳双歧杆菌bl-99有正常的生长曲线。实验结果(均值±标准误差,重复三次测量)见表8;如图8所示,bl-99(106)与2-fl(5g/l)的组合物相较于单独的益生菌,在多个时间点,有提升teer值的趋势。表85.hn019与母乳低聚糖2’-fl组合对肠道细胞分泌炎症因子il-8与ip-10的影响实验前准备步骤以及具体实验方法请见前述段落。受试乳双歧杆菌hn019有正常的生长曲线。结果参见图9、图10、图11和图12所示,在未与致病菌etec共培养的情况下,乳双歧杆菌hn019(108),及其与母乳低聚糖2’-fl(5g/l)的组合与致病菌etec相比,其释放il-8和ip-10因子的水平都显著低于etec。而当培养的体系中同时存在致病菌etec和受试物质时,hn019,以及hn019和2’-fl的组合物未影响il-8的释放,但均能显著的降低ip-10的释放。说明hn019+2’-fl的营养组合物对于炎症因子的释放有一定调控作用。图13显示106浓度的乳双歧杆菌hn019与不同浓度母乳低聚糖2’-fl组合对致病菌etec侵袭条件下,肠道细胞caco-2释放炎症因子il-8的影响,实验结果数据(均值±标准误差,重复三次测量)如表9所示。如图13所示,hn019与2’-fl形成的组合物,有降低il-8的趋势。表9实施例2:乳双歧杆菌与母乳低聚糖混合物的组合对胃肠道免疫力的影响1.hn019与母乳低聚糖混合物的组合对致病菌epec于肠道粘附实验结果实验前准备步骤以及具体实验方法请见前述段落。受试乳双歧杆菌hn019有正常的生长曲线。通过常见致腹泻菌株(epeco119)研究了益生菌和益生元组合物阻止致病菌吸附到小肠上皮细胞的保护作用。结果参见图14a所示,单独的母乳低聚糖组合物a对于致病菌大肠杆菌o119对肠道细胞caco-2的粘附作用与阴性对照相比无显著差异,而阳性对照氧化锌可显著的降低致病菌对肠道细胞的吸附(p<0.0001)。单独的益生菌hn019(108)对于致病菌大肠杆菌o119对肠道细胞caco-2的粘附作用与阴性对照相比无显著差异。但当益生元即母乳低聚糖组合物a,与益生菌一同作为处理组受试物质,二者显著降低了致病菌epec0119吸附到肠道细胞(p<0.05)。图14b展示了另一批次的实验中不同浓度的乳双歧杆菌hn019与不同比例的hmo混合物形成的组合物对于抑制大肠杆菌epec粘附到caco-2细胞的实验结果,实验结果数据(均值±标准误差,重复三次测量如表10所示。由于组数较多,分成了两次不同的实验测定。用dunnett’sposthoc测试对阴性对照与受试组进行比较后,发现在实验1中,106浓度下的hn019与组合物a的混合物比阴性对照显著更低(p<0.05)。在实验2中,108浓度下的hn019显著降低了致病菌粘附(p<0.0001),组合物a也显著降低了致病菌吸附(p<0.0001),108浓度下的hn019与组合物a的混合物也显著地降低了致病菌粘附(p<0.0001);组合物b显著降低了致病菌吸附(p<0.01),108浓度下的hn019与组合物b的混合物更加显著地降低了致病菌粘附(p<0.0001),体现了协同效应;108浓度下的hn019与组合物f的混合物也显著地降低了致病菌粘附(p<0.0001)。表102.bl-99与母乳低聚糖混合物的组合对致病菌epec于肠道粘附实验结果实验前准备步骤及具体实验方法请见前述段落。受试乳双歧杆菌bl-99有正常的生长曲线。通过常见致腹泻菌株(epeco119)研究了益生菌和益生元组合物阻止致病菌吸附到小肠上皮细胞的保护作用。结果参见图15a所示,单独的母乳低聚糖组合物b对于致病菌大肠杆菌o119对肠道细胞caco-2的粘附作用与阴性对照相比无显著差异,而阳性对照氧化锌可显著的降低致病菌对肠道细胞的吸附(p<0.0001)。单独的益生菌bl-99(108)对于致病菌大肠杆菌o119对肠道细胞caco-2的粘附作用与阴性对照相比无显著差异。但当益生元即母乳低聚糖组合物b,与益生菌一同作为处理组受试物质,二者显著降低了致病菌epec0119吸附到肠道细胞(p<0.05)。图15b展示了另一批次的实验中不同浓度的乳双歧杆菌bl-99与不同比例的hmo混合物形成的组合物对于抑制大肠杆菌epec粘附到caco-2细胞的实验结果,实验结果数据(均值±标准误差,重复三次测量)如表11所示。由于组数较多,分成了两次不同的实验测定。用dunnett’sposthoc测试对阴性对照与受试组进行比较后,发现在实验1中,106浓度下的bl-99与组合物a的组合物比阴性对照显著更低(p<0.05),108浓度下的益生菌bl-99与hmo组合物c的混合物有降低epec粘附的趋势。在实验2中,108浓度下的bl-99显著降低了致病菌粘附(p<0.01),组合物a也显著降低了致病菌粘附(p<0.01),而108浓度下的bl-99与组合物a的混合物更加显著地降低了致病菌粘附(p<0.0001),体现了协同效应;108浓度下的bl-99与组合物b的混合物显著地降低了致病菌粘附(p<0.001),体现了协同效应;组合物f也显著降低了致病菌粘附(p<0.01),而108浓度下的bl-99与组合物f的混合物更加显著地降低了致病菌粘附(p<0.001),体现了协同效应。表113.hn019与母乳低聚糖混合物的组合对跨膜电阻(teer)影响的实验结果实验前准备步骤以及具体实验方法请见前述段落。受试乳双歧杆菌hn019有正常的生长曲线。结果参见图16a所示,在不同的时间点测试了受试物质对于跨膜电阻的影响,单独的母乳低聚糖组合a或益生菌hn019(108)对于跨膜电阻teer的下降基本无作用,与阴性对照组接近,而益生菌hn019与母乳低聚糖混合物a的组合,可在多个时间点,于一定程度上有提升跨膜电阻teer值使其更接近空白组的趋势。图16b展示了另一批次的实验中单独的益生菌hn019(108)与不同比例的hmo组合物a、b和f在暴露于大肠杆菌etech10407的情况下,对于跨膜电阻teer的影响,实验结果数据(均值±标准误差,重复三次测量)如表12所示。在t=1时,hn019(108)+组合物a显著提升了肠道屏障性,与阴性对照有显著区别(p<0.05)。在t=2时,hn019(108)提升了肠道屏障性,与阴性对照有显著区别(p<0.01);hn019(108)+组合物a也提升了肠道屏障性,与阴性对照有显著区别(p<0.01);hn019(108)+组合物f提升了肠道屏障性,与阴性对照有显著区别(p<0.05)。在t=4时,hn019(108)提升了肠道屏障性,与阴性对照有显著区别(p<0.05),而hn019(108)+组合物a更加显著地提升了肠道屏障性,与阴性对照有显著区别(p<0.01),体现了协同效应;hn019(108)+组合物f提升了肠道屏障性,与阴性对照有显著区别(p<0.05)。在t=6时,hn019(108)+组合物a提升了肠道屏障性,与阴性对照有显著区别(p<0.01),体现了协同效应;hn019(108)+组合物f也提升了肠道屏障性,与阴性对照有显著区别(p<0.01),体现了协同效应。另外用two-wayanova及dunnett’sposthoc测试对单独的益生菌hn019(108)以及不同益生菌和hmo的组合物间进行统计分析,发现在t=6时,hn019(108)+组合物a(p<0.05)以及hn019(108)+组合物f(p<0.01)均与单独的益生菌hn019(108)有显著性差异,体现出协同效应。表12图16c展示了单独的益生菌hn019(106)与hmo组合物a在暴露于大肠杆菌etech10407的情况下,对于跨膜电阻teer的影响,实验结果数据(均值±标准误差,重复三次测量)如表13所示。在t=2时,hn019(106)+组合物a与阴性对照相比有显著提升(p<0.05),体现了协同效应;在t=4时,hn019(106)+组合物a与单独的益生菌hn019(106)相比有显著提升(p<0.05),体现了协同效应。表134.bl-99与母乳低聚糖混合物的组合对跨膜电阻(teer)影响的实验结果实验前准备步骤以及具体实验方法请见前述段落。受试乳双歧杆菌bl-99有正常的生长曲线。图17展示了单独的益生菌bl-99(108)与不同比例的hmo组合物a、b和f在暴露于大肠杆菌etech10407的情况下,对于跨膜电阻teer的影响,实验结果数据(均值±标准误差,重复三次测量)如表14所示。在t=6时,bl-99(108)+组合物a显著提升了肠道屏障性,与阴性对照有显著区别(p<0.05),体现了协同效应。在t=4时,bl-99(108)+组合物b显著提升了肠道屏障性,与阴性对照有显著区别(p<0.05),体现了协同效应。在t=4时,以及bl-99(108)+组合物a均显著提升了肠道屏障性,与阴性对照有显著区别(p<0.05)。表145.hn019与母乳低聚糖混合物的组合对肠道细胞分泌炎症因子il-8与ip-10的影响实验前准备步骤以及具体实验方法请见前述段落。受试乳双歧杆菌hn019有正常的生长曲线。结果参见图18a、图18b、图19a、图19b所示,在未与致病菌etec共培养的情况下,乳双歧杆菌hn019,及其与母乳低聚糖2’-fl的组合与致病菌etec相比,其释放il-8和ip-10因子的水平都显著低于etec。且hn019与hmo混合物c和d的组合物在il-8的释放上,呈现一定协同效应。而当培养的体系中同时存在致病菌etec和受试物质时,hn019,以及hn019和hmo混合物c的组合物未影响il-8的释放,但hn019和hmo混合物d的组合物显著降低了il-8的释放,呈现协同效应;此外hn019,及其与hmo混合物c或d的组合物均能显著的降低ip-10的释放。说明hn019+hmo混合物的营养组合物对于炎症因子的释放有一定调控作用。实施例3、含有hmo及益生菌的母乳化婴儿配方奶粉母乳化婴儿配方奶粉1(制备1000公斤):生牛乳1100千克、乳糖330千克、乳清蛋白粉wpc80%50千克、脱盐乳清粉170千克、高油酸葵花籽油120千克、大豆油85千克、玉米油15千克、大豆磷脂2千克、低聚半乳糖浆40千克,复配维生素18千克。将上述原料混合均匀后,经巴氏杀菌、均质、蒸发浓缩、喷雾干燥成粉状半成品,再将dha10千克、ara8千克、乳铁蛋白0.45千克、含2’-岩藻糖基乳糖(2’-fl)的hmos8.3千克、乳双歧杆菌4.5×106cfu/g(0.15千克)、动物双歧杆菌4.5×106cfu/g与上述奶粉经过干混机混合,混合均匀后的奶粉充氮包装即得成品。经检测,该成品中2’-fl含量为1.1g/l。母乳化婴儿配方奶粉2(制备1000公斤):生牛乳2700千克、乳糖160千克、乳清蛋白粉wpc34%70千克、脱盐乳清粉270千克、高油酸葵花籽油90千克、大豆油55千克、玉米油25千克、大豆磷脂2千克、低聚半乳糖浆38千克,复配维生素9千克。将上述原料混合均匀后,经巴氏杀菌、均质、蒸发浓缩、喷雾干燥成粉状半成品,再将dha12千克、ara10千克、乳铁蛋白0.45千克、2’-岩藻糖基乳糖(2’-fl)7千克、乳双歧杆菌4.5×106cfu/g(0.15千克)、动物双歧杆菌4.5×106cfu/g与上述奶粉经过干混机混合,混合均匀后的奶粉充氮包装即得成品。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1