稳定的蛋白质制剂的制作方法
稳定的蛋白质制剂
1.相关申请的交叉引用
2.本技术请求于2019年2月26日递交的美国临时申请62/810,891的优先权的权益,其全部内容通过引用并入本文。
技术领域
3.本文描述了稳定且抗蛋白质沉淀的具有7以下的ph的稳定的蛋白质溶液,以及制备此类稳定的蛋白质溶液的方法和它们在饮料或饮料添加剂中的用途。
背景技术:
4.对富含蛋白质的食品和富含蛋白质的素食(vegetarian)和素食产品(vegan product)的需求日益增长。特别地,对包含植物蛋白和其它非动物蛋白的富含蛋白质的饮料和饮料添加剂的需求日益增长。然而,由于此类蛋白质在ph为7以下时的溶解度有限,因此,在溶液中,特别是在饮料常用的ph为7以下的溶液中配制此类蛋白质是困难的。因此,需要在ph为7以下时稳定且抗蛋白质沉淀的蛋白质溶液。
技术实现要素:
5.本文提供稳定的蛋白质溶液,其包含(i)蛋白质;(ii)稳定剂;和(iii)蛋白质脱酰胺酶,其中所述溶液具有约3.5至约7.0的ph,并且是稳定且抗蛋白质沉淀的。在一些实施方式中,所述溶液包含(i)基于所述溶液的体积,约0.1%至约30%w/v的蛋白质;(ii)基于所述溶液的体积,约0.001%至约5%w/v的稳定剂;以及(iii)约0.5u至约50u的蛋白质脱酰胺酶活力,或基于所述溶液中蛋白质的重量,约0.1%至约10%w/w的蛋白质脱酰胺酶。在一些实施方式中,所述溶液包含(i)基于所述溶液的体积,约0.1%至约30%w/v的蛋白质;(ii)基于所述溶液的体积,约0.001%至约1%w/v的稳定剂;以及(iii)约5u至约50u的蛋白质脱酰胺酶活力,或基于所述溶液中蛋白质的重量,约1%至约10%w/w的蛋白质脱酰胺酶。在一些实施方式中,基于所述溶液的体积,所述溶液包含约5%至约15%w/v的蛋白质。在一些实施方式中,基于所述溶液的体积,所述溶液包含约0.02%至约0.5%w/v的稳定剂。在一些实施方式中,基于所述溶液中蛋白质的重量,所述溶液包含约1%w/w至约5%w/w的蛋白质脱酰胺酶。
6.在一些实施方式中,所述蛋白质包含选自以下的一种或多种:植物蛋白(比如大豆、豌豆、扁豆、鹰嘴豆、豆荚、大麻、大米、坚果、小麦和麸质蛋白,包括花生蛋白和杏仁蛋白),乳制品蛋白(比如乳清蛋白),和昆虫蛋白(比如蟋蟀、蝼蛄、蚕、西米蠕虫(sago worm)、蚱蜢、蝎子、龙虱、水虫(waterbug)、蚯蚓、粉虱和蜘蛛蛋白质中的一种或多种)。
7.在一些实施方式中,所述稳定剂包含以下的一种或多种:树胶(gum)、多糖和胶原蛋白,比如黄原胶、结冷胶、角叉菜胶、肉桂胶、刺槐豆胶、刺云实胶(tara gum)、车前子胶、明胶、罗望子胶、阿拉伯树胶、海藻酸盐、海藻酸丙二醇酯、果胶、半乳甘露聚糖(瓜尔豆胶)、支链淀粉、甲基纤维素(mc)、羧甲基纤维素(cmc)以及他们的任意衍生物或组合中的一种或
多种。
8.在一些实施方式中,所述蛋白质脱酰胺酶使蛋白质的天冬酰胺和/或谷氨酰胺残基的酰氨基脱酰胺,如,为蛋白质谷氨酰胺酶脱酰胺酶或蛋白质天冬酰胺酶脱酰胺酶。在一些实施方式中,所述蛋白质脱酰胺酶由选自金黄杆菌属(chryseobacterium)、黄杆菌属(flavobacterium)、短稳杆菌属(enpedobacter)、鞘氨醇杆菌属(sphingobacterium)、浅黄金杆菌属(aureobacterium)、香味菌属(myroides)、噬纤维菌目(cytophagales)、放线菌属(actinomycetes)和黄杆菌科(flavobacteriaceae)的细菌产生。在一些实施方式中,蛋白质脱酰胺酶由青霉菌属(penicillium)微生物产生。在一些实施方式中,所述蛋白质脱酰胺酶为protein glutaminase amano500(pga 500),其为一种蛋白质谷氨酰胺酶脱酰胺酶。在一些实施方式中,所述蛋白质脱酰胺酶包括seq id no:1的氨基酸序列(其为蛋白质谷氨酰胺酶脱酰胺酶),或包含与seq id no:1具有至少75%、至少80%、至少85%、至少90%、至少95%、至少97%、至少98%或至少99%的同一性并具有蛋白质脱酰胺酶活力的序列。在一些实施方式中,所述蛋白质脱酰胺酶包含seq id no:1的变体氨基酸序列,其在seq id no:1的氨基酸残基35、38
‑
43、45、46、49、79
‑
84、103
‑
106、117、142、143、146、166或185处具有一个或多个取代或缺失。在一些实施方式中,所述蛋白质脱酰胺酶包含seq id no:1的变体氨基酸序列,所述变体氨基酸序列与seq id no:1具有至少75%、至少80%、至少85%、至少90%、至少95%、至少97%、至少98%或至少99%的同一性,在seq id no:1的氨基酸残基35、38
‑
43、45、46、49、79
‑
84、103
‑
106、117、142、143、146、166或185处具有一个或多个取代或缺失,并具有蛋白质脱酰胺酶活力。
9.在一些实施方式中,所述溶液具有约4.0至约7.0或约4.0至约5.0的ph。
10.在一些实施方式中,在4℃下储存选自7天、14天、21天、1个月、2个月和6个月,包括3个月、4个月、5个月、6个月、7个月、8个月、9个月、10个月和12个月的时间段后,所述溶液是稳定且抗可见的蛋白质沉淀的。
11.在一些实施方式中,所述溶液被配制成供人或动物食用的饮料或饮料添加剂。
12.还提供了供人或动物食用的饮料或饮料添加剂,其包含本文所述的稳定的蛋白质溶液。在一些实施方式中,所述饮料或饮料添加剂选自营养饮料、运动饮料、功能性蛋白质饮料、乳饮料、乳冰沙、水果饮料、水果冰沙、咖啡饮料、茶饮料、植物奶、乳奶精(dairy creamer)和植脂末(non
‑
dairy creamer)。在一些实施方式中,所述饮料或饮料添加剂包含酸性汁液或果汁或者酸性汁液或果汁浓缩物中的一种或多种。在一些实施方式中,所述饮料或饮料添加剂包含蔬菜汁或蔬菜浓缩物中的一种或多种。在一些实施方式中,所述饮料或饮料添加剂包含酸性水果或蔬菜汁或者酸性水果或蔬菜汁浓缩物中的一种或多种。
13.还提供了制备本文所述的稳定的蛋白质溶液或本文所述的饮料或饮料添加剂的方法,所述方法包括(a)将蛋白质脱酰胺酶添加至包含蛋白质和稳定剂的溶液中以获得混合物;(b)温育所述混合物;和(c)使所述混合物酸化以获得具有约3.5至约7.0的ph的溶液。在一些实施方式中,所述溶液通过将(i)包含蛋白质的溶液和(ii)包含稳定剂的溶液混合来制备。在一些实施方式中,进行所述温育直至酶反应达到所需的完成水平,可选地所述完成水平由溶液中游离铵离子的浓度确定。在一些实施方式中,所述温育为在约30℃至约70℃的温度下进行约0.5小时至约48小时,可选地在搅拌下,可选地在约3.0至约8.0的ph下进行。在一些实施方式中,所述温育为在约40℃至约60℃的温度下进行约3小时至约24小时,
可选地在搅拌下,可选地在约5.0至约8.0的ph下进行。在一些实施方式中,所述酸化包括添加酸性汁液或汁液浓缩物。在一些实施方式中,所述蛋白质脱酰胺酶为protein glutaminase amano 500(pga 500)和/或具有本文所述的seq id no:1的氨基酸序列或其变体,以及所述温育为在50℃下进行3小时。
14.在一些实施方式中,所述方法进一步包括使所述溶液接受约85℃的热处理约10分钟。在一些实施方式中,所述方法进一步包括使所述溶液接受选自均质化、巴氏灭菌和灭菌中的一种或多种处理。在一些实施方式中,所述均质化在约2000psi至约20000psi,包括约2000psi至约2500psi的压力下进行。在一些实施方式中,所述巴氏灭菌采用在约100℃下进行约10秒至约20秒的高温短时(htst)巴氏灭菌,在约120℃下进行约1秒至约3秒的超高温(uht)巴氏灭菌,或在约75℃至约85℃下进行约10分钟至约20分钟的低温长时(ltlt)巴氏灭菌来进行。在一些实施方式中,所述灭菌使用高压(高气压(hyperbaric))灭菌来进行。
附图说明
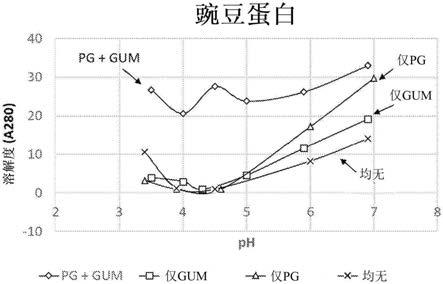
15.图1示出了含有(i)蛋白质谷氨酰胺酶脱酰胺酶和树胶;(ii)蛋白质谷氨酰胺酶脱酰胺酶;(iii)树胶;和(iv)不含有蛋白质谷氨酰胺酶脱酰胺酶且不含有树胶的豌豆蛋白制剂的随ph变化的吸光度。
16.图2示出了含有(i)蛋白质谷氨酰胺酶脱酰胺酶和树胶;(ii)蛋白质谷氨酰胺酶脱酰胺酶;(iii)树胶;和(iv)不含有蛋白质谷氨酰胺酶脱酰胺酶且不含有树胶的大豆蛋白制剂的随ph变化的吸光度。
17.图3示出了含有(i)蛋白质谷氨酰胺酶脱酰胺酶和树胶;(ii)蛋白质谷氨酰胺酶脱酰胺酶;(iii)树胶;和(iv)不含有蛋白质谷氨酰胺酶脱酰胺酶且不含有树胶的大麻蛋白制剂的随ph变化的吸光度。
18.图4示出了含有(i)蛋白质谷氨酰胺酶脱酰胺酶和树胶;(ii)蛋白质谷氨酰胺酶脱酰胺酶;(iii)树胶;和(iv)不含有蛋白质谷氨酰胺酶脱酰胺酶且不含有树胶的花生蛋白制剂的随ph变化的吸光度。
19.图5示出了含有(i)蛋白质谷氨酰胺酶脱酰胺酶和树胶;(ii)蛋白质谷氨酰胺酶脱酰胺酶;(iii)树胶;和(iv)不含有蛋白质谷氨酰胺酶脱酰胺酶且不含有树胶的蟋蟀蛋白制剂的随ph变化的吸光度。
20.图6示出了含有(i)蛋白质谷氨酰胺酶脱酰胺酶和树胶;和(ii)仅树胶(不含有蛋白质谷氨酰胺酶脱酰胺酶)的均质化的豌豆蛋白制剂的吸光度。
21.图7示出了含有(i)蛋白质谷氨酰胺酶脱酰胺酶和树胶;和(ii)仅树胶(不含有蛋白质谷氨酰胺酶脱酰胺酶)的含汁液浓缩物的均质化的大豆蛋白制剂的吸光度。
22.图8示出了含有(i)蛋白质谷氨酰胺酶脱酰胺酶和树胶;和(ii)仅树胶(不含有蛋白质谷氨酰胺酶脱酰胺酶)的含汁液浓缩物的均质化的花生蛋白制剂的吸光度。
具体实施方式
23.定义
24.除非另有定义,本文使用的技术和科学术语具有本发明所属的术领域的普通技术人员通常理解的含义。本文参考了对本领域普通技术人员已知的各种方法。本领域普通技
术人员已知的任何合适的材料和/或方法均可用于实施本发明。然而,仅对具体的材料和方法进行了描述。除非另有说明,否则在以下描述和实施例中用作参考的材料、试剂等等可从商业来源获得。
25.如本文所用,单数形式的“一个”、“一种”和“所述”指代单数和复数两者,除非明确说明仅指代单数。
26.如本文所用,术语“约”是指数字或范围不限于所列的精确数字或范围,而是涵盖围绕所记载的数字或范围的如本领域普通技术人员将根据使用该数字或范围的上下文所理解的数值。除非从上下文或本领域的惯例中另有明显说明,否则“约”意指具体术语的多至加或减10%。
27.本文描述了稳定的蛋白质溶液,其包含蛋白质、稳定剂和蛋白质脱酰胺酶,其中所述蛋白质溶液具有约3.5至约7.0的ph,并且是稳定且抗蛋白质沉淀的。本文还描述了包含此类溶液的饮料和饮料添加剂。本文还描述了制备此类稳定的蛋白质溶液的方法和制备包含所述稳定的蛋白质溶液的饮料或饮料添加剂的方法。
28.如本文所用,“稳定且抗蛋白质沉淀的”意指无可见的蛋白质沉淀。在一些实施方式中,通过评估在约280nm处的吸光度来证实无可见的沉淀,其中增加的吸光度与溶解的蛋白质和缺乏沉淀相关。对于具有本文所述蛋白质浓度的溶液(无沉淀),在约280nm处的典型吸光度在约8至50mg蛋白质/ml的范围内。
29.本文所述的稳定的蛋白质溶液解决了在ph为7以下(该ph为饮料和饮料添加剂的常用ph)的溶液中配制蛋白质的问题。例如,许多饮料,包括功能性饮料和运动饮料,含有来自水果和/或蔬菜的汁液,或汁液香精,并且具有7以下的ph,比如约7至约3.5的ph。当将蛋白质配制到这种饮料中时,它们具有自溶液中沉淀的趋势,从而导致沉降。不受理论的束缚,相信这种沉淀是由于饮料的ph接近蛋白质的等电点,这导致了蛋白质的不稳定及其沉淀和沉降。除了消费者不可接受外,蛋白质的沉淀还限制了风味(flavor)掩蔽的选择和其它制剂的选择。本文所述溶液在酸性ph下的稳定性允许将蛋白质溶液与酸性汁液(比如果汁)一起配制。如以下实施例所阐释的,本文所述的溶液即使在酸性ph下也是稳定且抗沉淀的。因此,本文所述的溶液允许在酸性汁液(比如果汁)中或与其一起配制蛋白质溶液,从而,比如提供含蛋白质的果汁基或水果风味或果汁风味的饮料或饮料添加剂。
30.本文所述的稳定蛋白质溶液采用蛋白质脱酰胺酶和稳定剂的独特组合来解决该问题。虽然以前已经使用了蛋白酶,但是它们的使用受到由底物蛋白的酶降解产生的具有不想要的风味的化合物的形成的限制。虽然以前已经使用了某些树胶稳定剂和乳化剂,但是它们仅在高浓度(如2
‑
5%w/v)下有效,而这些高浓度会产生其它不希望的作用,比如凝固、分层和甚至沉淀。此外,在这些高浓度下的稳定剂的使用导致最终产品具有消费者不喜欢的高粘度。相反,本文所述的溶液具有用于或作为饮料和饮料添加剂的可接受的粘度性质,比如粘度为约10至约250mpa
·
s。(作为参考,牛奶具有约2
‑
3mpa
·
s的粘度,大多数植物油具有约40
‑
50mpa
·
s的粘度,以及巧克力酱可具有280mpa
·
s的粘度)。
31.不受理论的束缚,相信本文所述的蛋白质脱酰胺酶能使蛋白质中的氨基酸残基,比如谷氨酰胺和/或天冬酰胺残基脱酰胺,从而增加蛋白质的负电荷,降低蛋白质的等电点,以及增加其在酸性ph值下的溶解度。结果,改善了在酸性ph下的蛋白质溶解度。同样不受理论的束缚,本文所述的一些蛋白质脱酰胺酶通过使蛋白质脱酰胺化而不破坏肽键,比
如通过使蛋白质中的氨基酸残基的酰胺基脱酰胺,包括将蛋白质中的谷氨酰胺残基转化为谷氨酸和/或将蛋白质中的天冬酰胺残基转化为天冬氨酸,来提高蛋白质的溶解度且不产生不想要的风味化合物。
32.虽然单独的酶处理可以在一定程度上提高蛋白质的溶解度,但需要进一步的配制方法来提供在延长的时间段内在7以下的ph下(比如超出对消费者饮料和饮料添加剂产品而言典型的储存条件)稳定且抗蛋白质沉淀的溶液。因此,本文所述的溶液包括稳定剂,其进一步促进蛋白质溶液的稳定性,并允许制备具有约3.5至约7的ph的溶液,在冷藏条件下的延长的时间段内,比如在4℃储存7天、14天、21天、1个月、2个月、3个月、4个月、5个月、6个月、7个月、8个月、9个月、10个月和12个月,诸如4个月或8个月的时间段,所述溶液是稳定且抗蛋白质沉淀的。与以前描述的制剂不同,本文所述的溶液仅需要相对少量的稳定剂,使得本文所述的稳定剂的使用不会破坏溶液的物理化学性质或导致消费者不可接受的结果,例如凝固、分层、沉淀或高粘度。
33.如以下实施例所阐释的,本文所述的溶液可接受均质化,并在均质化后表现出抗蛋白质沉淀的稳定性。因此,虽然均质化过程可能导致蛋白质
‑
蛋白质相互作用的改变,但是配制在本文所述的溶液中的蛋白质即使在均质化之后也可以保留在溶液中。
34.如上所述,根据具体的实施方式,提供稳定的蛋白质溶液,其包含(i)蛋白质;(ii)稳定剂;和(iii)蛋白质脱酰胺酶,其中所述溶液具有约3.5至约7.0的ph,并且是稳定且抗蛋白质沉淀的。下面将更详细地讨论具体的方面和具体的实施方式。
35.蛋白质
36.如本文所述的可被配制的蛋白质不限于,但受到关注的实施方式包括适于人或动物食用的蛋白质,包括适于人或动物食用的动物、植物、乳制品和昆虫蛋白。在一些实施方式中,本文所述的溶液包含一种或多种选自植物蛋白、乳制品蛋白和昆虫蛋白的蛋白质。
37.合适的植物蛋白的实例包括、但不限于大豆、豌豆、扁豆、鹰嘴豆、豆荚、大麻、大米、坚果、小麦和麸质蛋白。在一些实施方式中,植物蛋白选自大豆、豌豆、扁豆、鹰嘴豆、豆荚、大麻、大米、坚果、小麦和麸质蛋白中的一种或多种。在一些实施方式中,坚果为花生、杏仁或榛子。在一些实施方式中,所述蛋白质包含豌豆蛋白。在一些实施方式中,所述蛋白包含大豆蛋白。在一些实施方式中,所述蛋白包含花生蛋白。在一些实施方式中,所述蛋白包含大麻蛋白。
38.合适的乳制品蛋白的实例包括、但不限于乳清蛋白。在一些实施方式中,所述蛋白包含乳清蛋白。
39.合适的昆虫蛋白的实例包括、但不限于蟋蟀、蝼蛄、蚕、西米蠕虫(sago worm)、蚱蜢、蝎子、龙虱、水虫(waterbug)、蚯蚓、粉虱和蜘蛛蛋白。在一些实施方式中,所述蛋白质包含选自蟋蟀、蝼蛄、蚕、西米蠕虫(sago worm)、蚱蜢、蝎子、龙虱、水虫(waterbug)、蚯蚓、粉虱和蜘蛛蛋白中的一种或多种的昆虫蛋白。在一些实施方式中,所述蛋白质包含蟋蟀蛋白。
40.稳定剂
41.如上所述,本文所述的溶液包含稳定剂。合适的稳定剂的实例包括、但不限于亲水胶体(树胶)、多糖和胶原蛋白。在一些实施方式中,所述稳定剂包含树胶、多糖和胶原蛋白中的一种或多种。在一些实施方式中,所述稳定剂包含黄原胶、结冷胶、角叉菜胶、肉桂胶、刺槐豆胶、刺云实胶(tara gum)、车前子胶、明胶、罗望子胶、阿拉伯树胶、海藻酸盐、海藻酸
丙二醇酯、果胶、半乳甘露聚糖(瓜尔豆胶)、支链淀粉、羧甲基纤维素(cmc)、甲基纤维素(mc)以及他们的任意衍生物或组合中的一种或多种。在一些具体的实施方式中,所述稳定剂选自黄原胶、结冷胶、角叉菜胶、刺云实胶(tara gum)、果胶、海藻酸盐和cmc。在一些实施方式中,所述稳定剂包含结冷胶。在一些实施方式中,所述稳定剂包含角叉菜胶。在一些实施方式中,所述稳定剂包含果胶(pectin gum)。在一些实施方式中,所述稳定剂包含黄原胶。如以下实施例中所述的,不同的稳定剂在不同的ph范围内或在不同的ph下可能更有效。因此,稳定剂的选择可以在某些方面由最终产品的ph来指导。
42.蛋白质脱酰胺酶
43.如上所述,本文所述的溶液包含蛋白质脱酰胺酶。如本文所用,“蛋白质脱酰胺酶”是一种使蛋白质管的氨基酸残基的酰胺基脱酰胺的酶。在一些实施方式中,所述蛋白质脱酰胺酶使蛋白质的天冬酰胺和/或谷氨酰胺残基的酰胺基脱酰胺。在一些实施方式中,所述蛋白质脱酰胺酶使蛋白质的谷氨酰胺残基的酰胺基脱酰胺。在一些实施方式中,所述蛋白质脱酰胺酶使蛋白质的天冬酰胺残基的酰胺基脱酰胺。合适的蛋白质脱酰胺酶的实例包括美国专利no.6,756,221、美国专利no.6,251,651、美国专利no.7,462,477和美国专利no.8,735,131中描述的那些,这些专利的全部内容,特别是其中公开的蛋白质脱酰胺酶,通过引用并入本文。
44.在一些实施方式中,所述蛋白质脱酰胺酶由选自金黄杆菌属(chryseobacterium)、黄杆菌属(flavobacterium)、短稳杆菌属(enpedobacter)、鞘氨醇杆菌属(sphingobacterium)、浅黄金杆菌属(aureobacterium)、香味菌属(myroides)、噬纤维菌目(cytophagales)、放线菌属(actinomycetes)和黄杆菌科(flavobacteriaceae)的细菌产生,或由青霉菌属(penicillium)微生物产生。在一些实施方式中,所述蛋白质脱酰胺酶由选自金黄杆菌属的细菌产生。在一些实施方式中,所述蛋白质脱酰胺酶由来自黄杆菌属的细菌产生。在一些实施方式中,所述蛋白质脱酰胺酶由来自短稳杆菌属(enpedobacter)的细菌产生。在一些实施方式中,所述蛋白质脱酰胺酶由来自鞘氨醇杆菌属的细菌产生。在一些实施方式中,所述蛋白质脱酰胺酶由来自浅黄金杆菌属的细菌产生。在一些实施方式中,所述蛋白质脱酰胺酶由来自香味菌属的细菌产生。在一些实施方式中,所述蛋白质脱酰胺酶由来自噬纤维菌目的细菌产生。在一些实施方式中,所述蛋白质脱酰胺酶由来自放线菌属的细菌产生。在一些实施方式中,所述蛋白质脱酰胺酶由来自黄杆菌科的细菌产生。
45.在一些实施方式中,所述蛋白质脱酰胺酶为蛋白质谷氨酰胺酶脱酰胺酶protein glutaminase amano 500(pga 500),其可自amano enzyme商购获得。
46.在一些实施方式中,所述蛋白质脱酰胺酶具有或包含seq id no:1的氨基酸序列(其为蛋白质谷氨酰胺酶脱酰胺酶),或与seq id no:1具有至少75%、至少80%、至少85%、至少90%、至少95%、至少97%、至少98%或至少99%的同一性并具有蛋白质脱酰胺酶活力的序列。所述蛋白质脱酰胺酶活力的程度没有特别限定,只要能够展现出蛋白质脱酰胺酶的功能即可,但优选与具有seq id no:1的氨基酸序列的酶相当或更高。在一些实施方式中,所述蛋白质脱酰胺酶包含seq id no:1的变体氨基酸序列,其在seq id no:1的氨基酸残基35、38
‑
43、45、46、49、79
‑
84、103
‑
106、117、142、143、146、166或185处具有一个或多个取代或缺失。在一些实施方式中,所述蛋白质脱酰胺酶包含seq id no:1的变体氨基酸序列,其与seq id no:1具有至少75%、至少80%、至少85%、至少90%、至少95%、至少97%、
至少98%或至少99%的同一性,在seq id no:1的氨基酸残基35、38
‑
43、45、46、49、79
‑
84、103
‑
106、117、142、143、146、166或185处具有一个或多个取代或缺失,并具有蛋白质脱酰胺酶活力。在一些实施方式中,所述蛋白质脱酰胺酶具有或包含seq id no:1的序列的变体氨基酸序列,其在seq id no:1的氨基酸残基39、40、41、43、79
‑
82、142、143、146、166或185处具有一个或多个取代或缺失,比如,如美国专利no.8,735,131所述的,在seq id no:1的氨基酸残基35、38、40
‑
43、45、46、49、80
‑
84、103
‑
106或117处具有一个或多个取代或缺失。在一些实施方式中,所述蛋白质脱酰胺酶具有或包含seq id no:1的变体氨基酸序列,如美国专利no.8,735,131所述,其在seq id no:1的氨基酸残基82或84处具有一个或多个取代或缺失。在一些实施方式中,所述蛋白质脱酰胺酶具有或包含seq id no:1的变体氨基酸序列,如美国专利no.8,735,131所述,比如在seq id no:1的氨基酸残基82处的取代,比如在seq id no:1的氨基酸残基82处的丝氨酸取代和/或在seq id no:1的氨基酸残基84处的取代,比如在seq id no:1的氨基酸残基84处的天冬氨酸取代。
47.稳定的蛋白质溶液
48.如上所述,在一些实施方式中,本文所述的稳定的蛋白质溶液包含:
49.(i)基于所述溶液的体积,约0.1%至约30%w/v的蛋白质;
50.(ii)基于所述溶液的体积,约0.001%至约5%w/v,包括约0.001%至约1%w/v的稳定剂;以及
51.(iii)约0.5u至约50u的蛋白质脱酰胺酶活力,或基于所述溶液中蛋白质的重量,约0.1%至约10%w/w,包括约1%至约10%w/w的蛋白质脱酰胺酶,其中可以根据以下实施例16的分析来确定蛋白质脱酰胺酶活力。
52.因此,在一些实施方式中,所述溶液包含,基于所述溶液的体积(如所述溶液的终体积),约0.1%至约30%w/v的蛋白质,或约0.5至约30%w/w,或约5至约25%w/w,或约10至约20%w/w。在一些实施方式中,所述溶液包含,基于所述溶液的体积,约1%至约15%w/v的蛋白质。在一些实施方式中,所述溶液包含,基于所述溶液的体积,约5%至约15%w/v的蛋白质。在一些实施方式中,所述溶液包含,基于所述溶液的体积,约1%、约2%、约3%、约4%、约5%、约6%、约7%、约8%、约9%、约10%、约11%、约12%、约13%、约14%、约15%、约20%、约25%或约30%w/v的蛋白质,包括基于所述溶液的体积,1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、20%、25%或30%w/v的蛋白质。
53.在一些实施方式中,所述溶液包含,基于所述溶液的体积,约0.001%至约5%w/v的稳定剂,包括基于所述溶液的体积,约0.001%至约1.5%、约0.001%至约2%、约0.001%至约3%和约0.001%至约4%w/v的稳定剂。在一些实施方式中,所述溶液包含,基于所述溶液的体积,约0.001%至约1%w/v的稳定剂,比如,基于所述溶液的体积,约0.01%至约1%、约0.01%至约0.5%和约0.02%至约0.5%w/v的稳定剂。在一些实施方式中,所述溶液包含,基于所述溶液的体积,约0.02%、约0.03%、约0.04%、约0.05%、约0.06%、约0.07%、约0.08%、约0.09%、约0.1%、约0.2%、约0.3%、约0.4%、约0.5%w/v的稳定剂,包括0.02%、0.03%、0.04%、0.05%、0.06%、0.07%、0.08%、0.09%、0.1%、0.15%、0.2%、0.25%、0.3%、0.35%、0.4%、0.45%或0.5%w/v的稳定剂。在一些实施方式中,所述溶液包含,基于所述溶液的体积,约0.01%、约0.02%、约0.03%、约0.04%、约0.05%、约0.06%、约0.07%、约0.08%、约0.09%、约0.1%、约0.2%、约0.3%、约0.4%、约0.5%、约
0.6%、约0.7%、约0.8%、约0.9%、约1.0%、约1.5%、约2%、约3%、约4%或约5%w/v的稳定剂,包括0.02%、0.03%、0.04%、0.05%、0.06%、0.07%、0.08%、0.09%、0.1%、0.15%、0.2%、0.25%、0.3%、0.35%、0.4%、0.45%、0.5%、0.6%、0.7%、0.8%、0.9%、1.0%、1.5%、2%、3%、4%和5%w/v的稳定剂。在一些实施方式,所使用的相对少量的稳定剂产生一种溶液,其具有为饮料和饮料添加剂的消费者可接受的粘度,比如约10至约250mpa
·
s的粘度。
54.在一些实施方式中,所述溶液包含,基于所述溶液中蛋白质的重量,约0.1%至约10%w/w的蛋白质脱酰胺酶,包括,基于所述溶液中蛋白质的重量,约0.1%w/w至约1.0%w/w、约0.5%至约1.0%w/w、约0.1%w/w、约0.2%w/w、约0.3%w/w、约0.4%w/w、约0.5%w/w或约0.6%w/w,约0.7%w/w、约0.8%w/w或约0.9%w/w。在一些实施方式中,所述溶液包含,基于所述溶液中蛋白质的重量,约1%至约10%w/w的蛋白质脱酰胺酶。在一些实施方式中,所述溶液包含,基于所述溶液中蛋白质的重量,约1%w/w至约5%w/w的蛋白质脱酰胺酶,比如约1%w/w、约2%w/w、约3%w/w、约4%w/w或约5%w/w的蛋白质脱酰胺酶,包括1%、2%、3%、4%、5%、6%、7%、8%、9%或10%。
55.在一些实施方式中,所述溶液包含约0.5u至约50u的蛋白质脱酰胺酶活力,包括约0.5至约5.0u、约2.5至约5.0u、约0.5u、约1.0u、约2.0u、约2.5u、约3.0u、约4.0u或约5.0u。在一些实施方式中,所述溶液包含约5u至约50u的蛋白质脱酰胺酶活力。在一些实施方式中,所述溶液包含约5u至约25u的蛋白质脱酰胺酶活力,比如约5u、约10u、约15u、约20u或约25u的蛋白质脱酰胺酶活力,包括5u、10u、15u、20u、25u、30u、35u、40u、45u或50u。可以按照以下实施例16中所述的来确定蛋白质脱酰胺酶活力。
56.在一些实施方式中,所述溶液(或包含本文所述的溶液的饮料或饮料添加剂)具有约3.5至约7,包括3.5至7,比如约3.5至约5.5,包括3.5至5.5的ph。在一些实施方式中,所述溶液(或包含本文所述的溶液的饮料或饮料添加剂)具有约4.0至约5.0,包括4.0至5.0的ph。在一些实施方式中,所述溶液(或包含本文所述的溶液的饮料或饮料添加剂)具有约4.0至约7.0,包括4.0至7.0的ph,比如约3.5、约4.0、约4.5、约5.0、约5.5、约6.0、约6.5或约7.0,包括3.5、4.0、4.5、5.0、5.5、6.0、6.5或7.0的ph。
57.在一些实施方式中,所述溶液(或包含本文所述的溶液的饮料或饮料添加剂)的粘度为约10至约250mpa
·
s,包括10至250mpa
·
s。在一些实施方式中,所述溶液(或包含本文所述的溶液的饮料或饮料添加剂)的粘度为约10、约20、约30、约40、约50、约60、约70、约80、约90、约100、约110、约120、约130约140、约150、约160、约170、约180、约190、约200、约210、约220、约230、约240或约250mpa
·
s,包括10、20、30、40、50、60、70、80、90、100、100、120、130、140、150、160、170、180、190、200、210、220、230、240或250mpa
·
s。粘度可以在室温(~20℃)下使用采用转子s61(spindle s61)的ametek brookfield粘度计来测量。
58.在一些实施方式中,在4℃下储存选自7天、14天、21天、1个月、2个月和6个月的时间段后,所述溶液(或包含本文所述的溶液的饮料或饮料添加剂)是稳定且抗可见的蛋白质沉淀的。在一些实施方式中,在4℃下储存选自7天、14天、21天、1个月、2个月、3个月、4个月、5个月、6个月、7个月、8个月、9个月、10个月、12个月,比如4个月或8个月的时间段后,所述溶液是稳定且抗可见的蛋白质沉淀的。在一些实施方式中,在4℃下储存7天后,所述溶液(或包含本文所述的溶液的饮料或饮料添加剂)是稳定且抗可见的蛋白质沉淀的。在一些实施
方式中,在4℃下储存14天后,所述溶液(或包含本文所述的溶液的饮料或饮料添加剂)是稳定且抗可见的蛋白质沉淀的。在一些实施方式中,在4℃下储存21天后,所述溶液(或包含本文所述的溶液的饮料或饮料添加剂)是稳定且抗可见的蛋白质沉淀的。在一些实施方式中,在4℃下储存1个月后,所述溶液(或包含本文所述的溶液的饮料或饮料添加剂)是稳定且抗可见的蛋白质沉淀的。在一些实施方式中,在4℃下储存2个月后,所述溶液(或包含本文所述的溶液的饮料或饮料添加剂)是稳定且抗可见的蛋白质沉淀的。在一些实施方式中,在4℃下储存4个月后,所述溶液(或包含本文所述的溶液的饮料或饮料添加剂)是稳定且抗可见的蛋白质沉淀的。在一些实施方式中,在4℃下储存6个月后,所述溶液(或包含本文所述的溶液的饮料或饮料添加剂)是稳定且抗可见的蛋白质沉淀的。在一些实施方式中,在4℃下储存8个月后,所述溶液(或包含本文所述的溶液的饮料或饮料添加剂)是稳定且抗可见的蛋白质沉淀的。如上所述和在以下实施例中所阐释的,还可以通过测量在280nm处的吸光度来评估抗沉淀的稳定性,其中较高的吸光度与溶解的蛋白质相关,因此降低或无沉淀。
59.饮料或饮料添加剂
60.可以将本文所述的蛋白质溶液配制成供人或动物食用的饮料或饮料添加剂,或可将其用于制备供人或动物食用的饮料或饮料添加剂。饮料或饮料添加剂的实例包括、但不限于,营养饮料、运动饮料、功能性蛋白质饮料、乳饮料、乳冰沙、水果饮料、水果冰沙、咖啡饮料、茶饮料、植物奶、乳奶精(dairy creamer)和植脂末(non
‑
dairy creamer)。在一些实施方式中,所述饮料或饮料添加剂选自营养饮料、运动饮料、功能性蛋白质饮料、乳饮料、乳冰沙、水果饮料、水果冰沙、咖啡饮料、茶饮料、植物奶、乳奶精和植脂末。所述饮料或饮料添加剂可进一步包含果汁、维生素和增味剂中的一种或多种。
61.如上所述,在一些实施方式中,所述饮料或饮料添加剂包含一种或多种酸性汁液,比如一种或多种果汁或蔬菜汁,包括果汁和蔬菜汁的混合物,包括酸性果汁和/或酸性蔬菜汁。此类汁液的实例包括苹果汁、樱桃汁、蔓越莓汁、葡萄汁、菠萝汁、石榴汁、葡萄柚汁、番石榴汁、蜜汁、酸橙汁、柠檬汁、黑莓汁、橙汁、菠萝汁、覆盆子汁、香蕉泥、杏汁、桃汁、巴西莓果泥、巴西莓汁、猕猴桃汁、甘蔗汁、草莓汁、西瓜汁、百香果汁、芹菜汁、胡萝卜汁、马铃薯汁、甜菜汁、欧芹汁、番茄汁、西洋菜汁和萝卜汁。如上所述,本发明的在酸性ph下稳定且抗沉淀的蛋白质溶液允许在果汁和/或蔬菜汁中或与其一起配制蛋白质溶液,从而,比如提供含有蛋白质的果汁基和/或蔬菜基,或水果和/或蔬菜,或果汁和/或蔬菜汁风味的饮料或饮料添加剂。
62.制备方法
63.本文还描述了制备本文所述的稳定的蛋白质溶液的方法,和制备饮料和饮料添加剂的方法。所述方法可以包括(a)将蛋白质脱酰胺酶添加至包含蛋白质和稳定剂的溶液中以获得混合物;(b)温育所述混合物;和(c)使所述混合物酸化以获得具有约3.5至约7.0的ph的溶液。在一些实施方式中,所述溶液通过将(i)包含蛋白质的溶液和(ii)包含稳定剂的溶液混合来制备。所述方法可包括提供包含蛋白质和稳定剂的混合物,和将蛋白质脱酰胺酶添加至所述混合物中并温育所述混合物。在一些实施方式中,进行所述温育直至酶反应达到所需的完成水平,可选地所述完成水平由溶液中游离铵离子的浓度确定。所述方法通常可包括将包含蛋白质的溶液与包含稳定剂的溶液混合以提供包含所述蛋白质和稳定剂的混合物,和将蛋白质脱酰胺酶添加至所述混合物中并温育所述混合物。所述混合和添加
可以以任意顺序进行。在一些实施方式中,所述混合在添加所述酶之前完成。
64.所述方法还可以包括将溶液的ph调节至约3.5至约7.0的ph,比如通过使溶液酸化至约3.5至约7.0的ph。在一些实施方式中,使溶液酸化包括添加酸性汁液或汁液浓缩物,比如酸性果汁或酸性果汁浓缩物和/或酸性蔬菜汁或酸性蔬菜汁浓缩物。在一些实施方式中,通过超过一种的酸化试剂使溶液酸化,比如,例如酸性添加剂和酸性汁液或汁液浓缩物。在一些实施方式中,基于其它目的添加酸化试剂,比如对溶液调味或增强其营养或营养品含量,并且酸性的ph是由为此目的添加的酸化试剂的量决定的。
65.温育条件可以是任何适于所使用的具体蛋白质脱酰胺酶的温育条件,比如所述酶具有活力的任何温度和ph以及达到所需脱酰胺水平所需要的任何时间段。在一些实施方式中,脱酰胺反应的进展通过,比如测量溶液中游离铵离子的浓度来监测。例如,当溶液中游离铵离子的浓度达到特定水平时,可以认为反应完全。对于具有本文所述蛋白质含量的溶液,当溶液中游离铵离子的浓度达到,基于溶液的体积,约0.002%至约0.07%w/v,包括约0.002%、约0.003%、约0.004%、约0.005%、约0.006%、约0.007%、约0.008%、约0.009%、约0.01%、约0.02%、约0.04%、约0.05%、约0.06%、或约0.07%w/v、或0.002%、0.003%、0.004%、0.005%、0.006%、0.007%、0.008%、0.009%、0.01%、0.02%、0.03%、0.04%、0.05%、0.06%或0.07%w/v时,可以认为反应完全。温育条件可以包括搅拌。搅拌可以是缓慢的(如约150至约250rpm)或快速的(如约3,000至约5,000rpm)。在一些实施方式中,所述搅拌以约150至约250rpm的搅拌范围采用摇床进行。在一些实施方式中,所述搅拌以约3,000至约5,000rpm的搅拌范围采用摇床进行。
66.温育步骤可以在约3.0至约8.0的ph下,以约30℃至约70℃的温度进行约0.5小时至约48小时的时间段。一般而言,温育会在约5.0至约8.0的ph下,以约40℃至约60℃的温度进行约3小时至约24小时的时间段。在一些实施方式中,所述温育在约30℃、约35℃、约40℃、约45℃、约50℃、约55℃、约60℃、约65℃或约70℃的温度下进行。在一些实施方式中,所述温育进行约0.5小时、约1小时、约2小时、约3小时、约4小时、约5小时、约6小时、约7小时、约8小时、约9小时、约10小时、约11小时、约12小时、约13小时、约14小时、约15小时、约16小时、约17小时、约18小时、约19小时、约20小时、约21小时、约22小时、约23小时、约24小时、约48小时。在一些实施方式中,所述温育在约3、约3.5、约4、约4.5、约5.0、约5.5、约6.0、约6.5、约7.0、约7.5或约8.0的ph下进行。
67.在一些实施方式中,蛋白质脱酰胺酶为protein glutaminase amano 500(pga 500)以及温育为在约5.0至约8.0的ph下,在50℃下进行3小时。在一些实施方式中,蛋白质脱酰胺酶具有或包含seq id no:1的氨基酸序列,以及温育为在约5.0至约8.0的ph下,在50℃下进行3小时。在一些实施方式中,蛋白质脱酰胺酶为本文所述的seq id no:1的变体,以及温育为在约5.0至约8.0的ph下,在50℃下进行3小时。
68.所述溶液可接受一种或多种另外的处理步骤,比如一种或多种增味或营养成分的添加、热处理、均质化、过滤、巴氏灭菌和灭菌中的一种或多种。
69.在一些实施方式中,所述方法还包括使溶液接受热处理,比如约75℃至约95℃的热处理约5分钟至约20分钟。在一些实施方式中,在约75℃、约80℃、约85℃、约90℃或约95℃下进行热处理约5分钟、10分钟、15分钟或约20分钟。在一些实施方式中,在约85℃下进行热处理约10分钟。
70.在一些实施方式中,所述方法还包括使溶液接受均质化。在一些实施方式中,均质化在约2,000psi至约20,000psi,比如约2,000psi至约2,500psi的压力下进行。在一些实施方式中,均质化在约2,000psi、约5,000psi、约10,000psi、约15,000psi或约20,000psi的压力下进行。在一些实施方式中,均质化在约2,000psi、约2,500psi、约3,000psi、约3,500psi、约4,000psi、约4,500psi或约5,000psi的压力下进行。
71.在一些实施方式中,所述方法进一步包括使溶液接受巴氏灭菌。在一些实施方式中,巴氏灭菌采用高温短时(htst)巴氏灭菌、超高温(uht)巴氏灭菌、低温长时(ltlt)巴氏灭菌来进行。在一些实施方式中,巴氏灭菌采用高温短时(htst)巴氏灭菌来进行。在一些实施方式中,巴氏灭菌采用在约90℃至约110℃进行约5秒至约30秒的高温短时(htst)巴氏灭菌来进行。在一些实施方式中,巴氏灭菌采用在约100℃进行约10秒至约20秒的高温短时(htst)巴氏灭菌来进行。在一些实施方式中,巴氏灭菌采用超高温(uht)巴氏灭菌来进行。在一些实施方式中,巴氏灭菌采用在约110℃至约130℃进行约1秒至约10秒的超高温(uht)巴氏灭菌来进行。在一些实施方式中,巴氏灭菌采用在约120℃下进行约1秒至约3秒的超高温(uht)巴氏灭菌来进行。在一些实施方式中,巴氏灭菌采用低温长时(ltlt)巴氏灭菌来进行。在一些实施方式中,巴氏灭菌采用在约65℃至约95℃进行约5分钟至约30分钟的低温长时(ltlt)巴氏灭菌来进行。在一些实施方式中,巴氏灭菌采用在约75℃至约85℃下进行约10分钟至约20分钟的低温长时(ltlt)巴氏灭菌来进行。
72.在一些实施方式中,所述方法进一步包括使溶液接受灭菌。在一些实施方式中,灭菌使用高压(高气压(hyperbaric))灭菌来进行。
73.如本文所述的制备饮料或饮料添加剂的方法可包括将本文所述的稳定的蛋白质溶液添加至饮料或饮料添加剂组合物中,或将本文所述的溶液配制为饮料或饮料添加剂。例如,可以将本文所述的稳定的蛋白质溶液以在饮料或饮料添加剂中提供所需量的蛋白质的量添加至预先配制的营养饮料、运动饮料、功能性蛋白质饮料、乳饮料、乳冰沙、水果饮料、水果冰沙、咖啡饮料、茶饮料、植物奶、乳奶精(dairy creamer)或植脂末(non
‑
dairy creamer)。可选地,可以将本文所述的稳定的蛋白质溶液配制成如包含所述饮料和饮料添加剂的其它组分和所需量的蛋白质的营养饮料、运动饮料、功能性蛋白质饮料、乳饮料、乳冰沙、水果饮料、水果冰沙、咖啡饮料、茶饮料、植物奶、乳奶精(dairy creamer)或植脂末(non
‑
dairy creamer)。
74.在一些实施方式中,最终溶液、饮料或饮料添加剂具有,基于溶液中蛋白质的重量,多达约30%w/w,包括约30%w/w的蛋白质含量。在一些实施方式中,最终溶液、饮料或饮料添加剂具有,基于溶液中蛋白质的重量,约0.5至约30%w/w,包括0.5至30%w/w,或约5至约25%w/w,或约10至约20%w/w的蛋白质含量。在一些实施方式中,最终溶液、饮料或饮料添加剂具有,基于溶液中蛋白质的重量,约0.5%、约1%、约2%、约3%、约4%、约5%、约6%、约7%、约8%、约9%、约10%、约11%、约12%、约13%、约14%、约15%、约16%、约17%、约18%、约19%、约20%、约21%、约22%、约23%、约24%、约25%、约26%、约27%、约28%、约29%或约30%w/w的蛋白质含量。
75.在任何实施方式中,所述饮料或饮料添加剂可进一步包含一种或多种典型地存在于此类饮料或饮料添加剂中的组分,包括一种或多种水果或蔬菜汁液、维生素、营养补充剂、增味剂、着色剂和防腐剂。在一些实施方式中,所述饮料或饮料添加剂包含一种或多种
酸性汁液或一种或多种水果或蔬菜汁液,包括一种或多种酸性果汁,包括选自苹果汁、樱桃汁、蔓越莓汁、葡萄汁、菠萝汁、石榴汁、葡萄柚汁、番石榴汁、蜜汁、酸橙汁、柠檬汁、黑莓汁、橙汁、菠萝汁、覆盆子汁、香蕉泥、杏汁、桃汁、巴西莓果泥、巴西莓汁、猕猴桃汁、甘蔗汁、草莓汁、西瓜汁、百香果汁、芹菜汁、胡萝卜汁、马铃薯汁、甜菜汁、欧芹汁、番茄汁、西洋菜汁和萝卜汁中的一种或多种。
76.包括以下具体实例作为本文所述组合物和方法的说明。这些实例绝不旨在限制本发明的范围。对于本发明所属领域的技术人员而言,本发明的其他方面将是显而易见的。
77.实施例
78.实施例1:豌豆蛋白溶液(制剂1
‑
4)
79.如下表所示,采用和不采用结冷胶(gellan hs ngmo,一种来自tic gums的高酰基结冷胶)作为稳定剂,和采用和不采用pga500(amano enzyme inc.)作为蛋白质脱酰胺酶,用粉末形式的豌豆蛋白分离物(now foods)作为蛋白质制备豌豆蛋白溶液。
80.例如,制备10%(w/v)的豌豆蛋白水溶液,并将其与0.2%(w/v)的结冷胶水溶液混合,以得到具有3%(w/v)豌豆蛋白和0.03
‑
0.05%(w/v)结冷胶的水性溶液。对于含有pga 500的溶液,以2%(w/w)的蛋白质的量添加酶,并在50℃下温育3小时。对于不含pga 500的制剂,将溶液加热至50℃而不温育。将溶液用柠檬酸酸化至4.0
‑
4.5的ph,然后在85℃下接受热处理10分钟。其它制剂通过类似的方法制备。
81.将所得溶液在实验室vwr冰箱中于4℃下储存,并在24小时和72小时后通过(i)目测检查,(2)以280nm处的吸光度测量上清液的可溶性蛋白含量,(3)采用粘度计(ametek brookfield)测量粘度,和(4)测量ph来评估。结果列于下表。
[0082][0083]
结果表明,如与分离外观相对的分散外观和更高的吸光度(反映更多的溶解的蛋白质)所示的,在约4.5的ph下,根据本发明的制剂(包含pga 500和树胶)(制剂2)是稳定且抗蛋白质沉淀的。
[0084]
实施例2:大豆蛋白溶液(制剂5
‑
12)
[0085]
如下表所示,采用和不采用结冷胶(来自tic gums的gellan hs ngmo)作为稳定剂,和采用和不采用pga 500(amano enzyme inc.)作为蛋白质脱酰胺酶,用粉末形式的大豆蛋白分离物(now foods)作为蛋白质制备大豆蛋白溶液。
[0086]
例如,制备10%(w/v)的大豆蛋白水溶液,并将其与0.2%(w/v)的结冷胶水溶液混合,以得到具有3%(w/v)大豆蛋白和0.10%(w/v)结冷胶的水性溶液。对于含有pga 500的
制剂,以2%(w/w)的蛋白质的量添加酶,并在50℃下温育3小时。对于不含pga 500的制剂,将溶液加热至50℃而不温育。将溶液用柠檬酸酸化至4.0
‑
4.6的ph,然后在85℃下接受热处理10分钟。其它制剂通过类似的方法制备。
[0087]
将所得溶液在实验室vwr冰箱中于4℃下储存,并如上文实施例1中所述的进行评估。结果列于下表。
[0088][0089]
结果表明,如与分离外观相对的分散外观和更高的吸光度所示的,在酸性ph(约4.0至4.5)下,根据本发明的制剂(包含pga 500和树胶)(制剂6和10)是稳定且抗蛋白质沉淀的。
[0090]
实施例3:花生蛋白溶液(制剂13
‑
16)
[0091]
如下表所示,采用和不采用结冷胶(来自tic gums的gellan hs ngmo)作为稳定剂,和采用和不采用pga 500(amano enzyme inc.)作为蛋白质脱酰胺酶,用花生蛋白粉末(tru
‑
nut company)作为蛋白质制备花生蛋白溶液。
[0092]
例如,制备10%(w/v)的花生蛋白水溶液,并将其与0.2%(w/v)的结冷胶水溶液混合,以得到具有3%(w/v)花生蛋白和0.02%(w/v)结冷胶的水性溶液。对于含有pga 500的制剂,以2%(w/w)的蛋白质的量添加酶,并在50℃下温育3小时。对于不含pga 500的制剂,将溶液加热至50℃而不温育。将溶液用柠檬酸酸化至4.0
‑
4.5的ph,然后在85℃下接受热处理10分钟。其它制剂通过类似的方法制备。
[0093]
将所得溶液在实验室vwr冰箱中于4℃下储存,并如上文实施例1中所述的进行评估。结果列于下表。
[0094][0095]
结果表明,如与其它制剂相比更高的吸光度(反映更多的溶解的蛋白质)所示的,在酸性ph(约4.0)下,根据本发明的制剂(包含pga500和树胶)(制剂14)是更稳定且抗蛋白质沉淀的。所观察到的较小沉积物可能是由于花生蛋白的性质和处理条件没有针对花生蛋白进行优化的事实。
[0096]
实施例4:蟋蟀蛋白溶液(制剂17
‑
24)
[0097]
如下表所示,采用和不采用结冷胶(来自tic gums的gellan hs ngmo)作为稳定剂,和采用和不采用pga500(amano enzyme inc.)作为蛋白质脱酰胺酶,用含有68%(w/w)的蟋蟀蛋白的蟋蟀粉(lithic)制备蟋蟀蛋白溶液。
[0098]
例如,制备10%(w/v)的蟋蟀粉水溶液,并将其与0.2%(w/v)的结冷胶水溶液混合,以得到具有3%(w/v)蟋蟀粉和0.03%(w/v)结冷胶的水性溶液。对于含有pga 500的溶液,以2%(w/w)的蛋白质的量添加酶,并在50℃下温育3小时。对于不含pga 500的制剂,将溶液加热至50℃而不温育。将溶液用柠檬酸酸化至4.0
‑
4.5的ph,然后在85℃下接受热处理10分钟。其它制剂通过类似的方法制备。
[0099]
将所得溶液在实验室vwr冰箱中于4℃下储存,并如上文实施例1中所述的进行评估。结果列于下表。
[0100][0101]
结果表明,如与其它制剂相比更高的吸光度值(反映更多的溶解的蛋白质)所示的,在酸性ph(约4.0至约4.5)下,根据本发明的制剂(包含pga500和树胶)(制剂18和22)是更稳定且抗蛋白质沉淀的。由于制剂17至20是在ph 4.5左右(具有一些测量误差)配制的,
而制剂21至24是在ph 4.0左右配制的,因此与制剂18(ph 4.5)相比,制剂22(ph4.0)中的较低ph解释了在制剂22中观察到的更低的吸光度和粘度,因为较低的ph导致悬浮液中的蛋白质较少。
[0102]
实施例5:大麻蛋白溶液(制剂25
‑
28)
[0103]
如下表所示,采用和不采用角叉菜胶(来自tic gums的750)作为稳定剂,和采用和不采用pga 500(amano enzyme inc.)作为蛋白质脱酰胺酶,用大麻蛋白粉末(nutiva)制备大麻蛋白溶液。
[0104]
例如,制备10%(w/v)的大麻蛋白水溶液,并将其与1.0%(w/v)的角叉菜胶水溶液混合,以得到具有3%(w/v)大麻蛋白和0.5%(w/v)角叉菜胶的水性溶液。对于含有pga 500的溶液,以2%(w/w)的蛋白质的量添加酶,并在50℃下温育3小时。对于不含pga500的制剂,将溶液加热至50℃而不温育。将溶液用柠檬酸酸化至4.0
‑
4.5的ph,然后在85℃下接受热处理10分钟。其它制剂通过类似的方法制备。
[0105]
将所得溶液在实验室vwr冰箱中于4℃下储存,并如上文实施例1中所述的进行评估。结果列于下表。
[0106][0107]
结果表明,如与分离外观相对的分散外观和更高的吸光度值(反映更多的溶解的蛋白质)所示的,在酸性ph(约4.5)下,根据本发明的制剂(包含pga500和树胶)(制剂26)是稳定且抗蛋白质沉淀的。
[0108]
实施例6:具有3.5至7.0的ph的豌豆蛋白溶液(制剂29
‑
37)
[0109]
如下表所示,采用和不采用树胶作为稳定剂,和采用和不采用pga500(amano enzyme inc.)作为蛋白质脱酰胺酶,用粉末形式的豌豆蛋白分离物(now foods)作为蛋白质制备豌豆蛋白溶液。使用以下来自tic gums的树胶:结冷胶(gellan hs ngmo)、果胶(pectin 1694 powder)、羧甲基纤维素(cmc,cmc 2500 powder)、海藻酸盐(hg
‑
400 powder)和刺云实胶(tictara gum 100)。
[0110]
例如,制备10%(w/v)的豌豆蛋白水溶液,并将其与树胶水溶液混合,以得到具有3%(w/v)豌豆蛋白和下表中所示的树胶浓度(%w/v)的水性溶液。对于含有pga500的溶液(下表中的“a”制剂),以2%(w/w)的蛋白质的量添加酶,并在50℃下温育3小时。对于不含pga 500的制剂(下表中的“b”制剂),将溶液加热至50℃而不温育。将溶液用柠檬酸酸化至
3.5至7的ph(如下表所示),然后在85℃下接受热处理10分钟。其它制剂通过类似的方法制备。
[0111]
将所得溶液在实验室vwr冰箱中于4℃下储存,在24小时后通过以下项目来初步评估,然后在长达2个月内定期通过以下项目评估:(i)目测检查,(ii)以280nm处的吸光度测量上清液的可溶性蛋白含量,和(iii)测量ph。结果列于下表并示于图1中。
[0112][0113]
酶*=蛋白质谷氨酰胺酶脱酰胺酶pga500。
[0114][0115]
酶*=蛋白质谷氨酰胺酶脱酰胺酶pga500。
[0116]
结果表明,如与分离外观相对的分散外观和更高的吸光度(反映更多的溶解的蛋白质)所示的,根据本发明的制剂(包含pga 500和树胶)(制剂29a
‑
37a)在约3.5至约7的ph下是稳定且抗蛋白质沉淀的。另一方面,在低于约4.0的ph下不含蛋白质脱酰胺酶的制剂稳定性较差。
[0117]
实施例7:具有3.5至7.0的ph的大豆蛋白溶液(制剂38
‑
45)
[0118]
采用粉末形式的大豆蛋白分离物(now foods)作为蛋白质,如实施例6中所述的制备并评估大豆蛋白溶液。结果列于下表并示于图2中。
[0119][0120][0121]
结果表明,如与分离外观相对的分散外观和更高的吸光度(反映更多的溶解的蛋白质)所示的,根据本发明的制剂(包含pga 500和树胶)(制剂38a
‑
45a)在约3.5至约7的ph范围内是稳定且抗蛋白质沉淀的。相比而言,其它制剂(包含树胶但不含pga 500)在低于5.2的ph下是不稳定且抗蛋白质沉淀的(参见ph 4.4至3.5所示的结果)。
[0122]
实施例8:具有3.5至6.5的ph的大麻蛋白溶液(制剂46
‑
52)
[0123]
采用大麻蛋白粉末(nutiva)作为蛋白质,如实施例6中所述的制备并评估大麻蛋白溶液。结果列于下表并示于图3中。
[0124]
[0125][0126]
结果表明,如分散外观和更高的吸光度(反映更多的溶解的蛋白质)所示的,根据本发明的制剂(包含pga 500和树胶)(制剂46a
‑
52a)在约3.5至约7的ph范围内是更稳定且抗蛋白质沉淀的。
[0127]
实施例9:具有3.5至7.0的ph的花生蛋白溶液(制剂53
‑
59)
[0128]
采用花生蛋白粉末(tru
‑
nut company)作为蛋白质,和黄原胶(来自tic gums的xanthan ec ngmo),如实施例6中所述的制备并评估花生蛋白溶液。结果列于下表并示于图4中。
[0129][0130][0131]
结果表明,如分散外观和更高的吸光度(反映更多的溶解的蛋白质)所示的,根据
本发明的制剂(包含pga 500和树胶)(制剂53a
‑
59a)在约3.5至约7的ph范围内是稳定且抗蛋白质沉淀的,而其它制剂,特别是在酸性更强的ph值下,稳定性较差。
[0132]
实施例10:具有3.5至7.0的ph的蟋蟀蛋白溶液(制剂60
‑
67)
[0133]
采用含有68%(w/w)的蟋蟀蛋白的蟋蟀粉(lithic),如实施例6中所述相同的方式制备并评估蟋蟀蛋白溶液。结果列于下表并示于图5中。
[0134][0135][0136]
结果表明,如分散外观和更高的吸光度(反映更多的溶解的蛋白质)所示的,根据本发明的制剂(包含pga500和树胶)(制剂60a
‑
67a)在约3.5至约7的ph范围内是稳定且抗蛋白质沉淀的。在制剂62a中观察到了沉积物,这可能是因为在ph为5.1下所用的结冷胶的特定量不足以完全防止的蛋白质沉降。其它制剂中的大多数,特别是在酸性更强的ph值(如低于约4.5)下,稳定性较差。然而,不希望受理论的束缚,所使用的蟋蟀蛋白可以是非纯蟋蟀蛋白,而是包含杂质(包括非蛋白杂质)的。
[0137]
实施例11:采用均质化的豌豆蛋白溶液(制剂68
‑
71)
[0138]
如下表所示,采用和不采用树胶(结冷胶:gellan hs ngmo;果胶:pectin 1694powder;均来自tic gums)作为稳定剂,和采用和不采用pga500(amano enzyme inc.)作为蛋白质脱酰胺酶,用粉末形式的豌豆蛋白分离物(now foods)作为蛋白质制备豌豆蛋白溶液。
[0139]
例如,通过在水中水合0.075%(w/w)结冷胶和0.45%(w/w)果胶来制备溶液。加入豌豆蛋白以得到如下表所示的具有不同含量的豌豆蛋白的豌豆蛋白溶液。对于含有pga 500的制剂,以0.67%~1.8%(w/w)的蛋白质的量添加酶并在50℃下温育3小时。对于不含pga 500的制剂,将溶液加热至50℃而不温育。为了酸化,使用1m(摩尔)柠檬酸以获得指定
的ph。使酸化的溶液以2,000~2,500psi接受均质化,并随后在85℃下接受热处理10分钟。其它制剂通过类似的方法制备。
[0140]
根据实施例16测定蛋白质脱酰胺酶的活力。
[0141]
将所得溶液在实验室vwr冰箱中于4℃下储存,并如上文实施例6所述的进行评估。结果列于下表并示于图6中。
[0142][0143]
u/300ml sol=每300ml溶液的单位(酶活力)。
[0144]
结果表明,如分散外观和更高的吸光度(反映更多的溶解的蛋白质)所示的,在酸性ph(约4.0至约4.5)下,根据本发明的制剂(包含pga500和树胶)(制剂68b
‑
71b)是稳定且抗蛋白质沉淀的。这些结果表明,用本文公开的配方获得的改善的稳定性即使在均质化后仍旧得到保持。
[0145]
实施例12:采用均质化和汁液浓缩物的大豆蛋白溶液(制剂72
‑
74)
[0146]
如下表所示,采用和不采用树胶(结冷胶:gellan hs ngmo;果胶:pectin 1694powder;均来自tic gums)作为稳定剂,和采用和不采用pga 500(amano enzyme inc.)作为蛋白质脱酰胺酶,用粉末形式的大豆蛋白分离物(now foods)作为蛋白质制备大豆蛋白溶液。
[0147]
例如,通过在水中水合0.06%或0.075%(w/w)结冷胶和0.45%(w/w)果胶来制备溶液。加入大豆蛋白分离物以得到如下表所示的具有不同含量的大豆蛋白的大豆蛋白溶液。对于含有pga500的制剂,以0.67%~2.4%(w/w)的蛋白质的量添加酶,并在50℃下温育3小时。对于不含pga 500的制剂,将溶液加热至50℃而不温育。为了酸化,以1:2w/w的比率加入草莓汁浓缩物(来自old orchard的65白利糖度(brix)的100%汁液浆果混合浓缩物)。使酸化的溶液以2,000~2,500psi接受均质化,并随后在85℃下接受热处理10分钟。其它制剂通过类似的方法制备。根据实施例16测定蛋白质脱酰胺酶的活力。
[0148]
将所得溶液在实验室vwr冰箱中于4℃下储存,并如上文实施例6所述的进行评估。结果列于下表并示于图7中。
[0149][0150]
结果表明,如分散外观和更高的吸光度(反映更多的溶解的蛋白质)所示的,在酸性ph(约4.0至约4.5)下,根据本发明的制剂(包含pga500和树胶)(制剂72b
‑
74b)是稳定且抗蛋白质沉淀的。这些结果表明,用本文公开的配方获得的改善的稳定性即使在均质化后仍旧得到保持。
[0151]
实施例13:采用均质化和汁液浓缩物的花生蛋白溶液(制剂75
‑
77)
[0152]
如下表所示,采用和不采用树胶(结冷胶:gellan hs ngmo;果胶:pectin 1694powder;均来自tic gums)作为稳定剂,和采用和不采用pga 500(amano enzyme inc.)作为蛋白质脱酰胺酶,采用花生蛋白粉末(tru
‑
nut company)作为蛋白质制备花生蛋白溶液。
[0153]
例如,通过在水中水合如下表所示的含量的结冷胶和果胶来制备溶液。加入花生蛋白以得到如下表所示的具有不同含量的花生蛋白的花生蛋白溶液。对于含有pga 500的制剂,以0.67%~3.6%(w/w)的蛋白质的量添加酶,并在50℃下温育3小时。对于不含pga 500的制剂,将溶液加热至50℃而不温育。为了酸化,以1:2w/w的比率加入草莓汁浓缩物(来自old orchard的65白利糖度的100%汁液浆果混合浓缩物)。使酸化的溶液以2,000~2,500psi接受均质化,并随后在85℃下接受热处理10分钟。其它制剂通过类似的方法制备。根据实施例16测定蛋白质脱酰胺酶的活力。
[0154]
将所得溶液在实验室vwr冰箱中于4℃下储存,并如上文实施例6所述的进行评估。结果列于下表并示于图8中。
[0155][0156]
结果表明,如分散外观和更高的吸光度(反映更多的溶解的蛋白质)所示的,在酸性ph(约4.0至约4.5)下,根据本发明的制剂(包含pga500和树胶)(制剂75b
‑
77b)是稳定且抗蛋白质沉淀的。这些结果表明,用本文公开的配方获得的改善的稳定性即使在均质化后仍旧得到保持。
[0157]
实施例14:采用均质化的杏仁蛋白溶液(制剂78
‑
79)
[0158]
如下表所示,采用和不采用树胶(结冷胶:gellan hs ngmo;果胶:pectin 1694powder;均来自tic gums)作为稳定剂,和采用和不采用pga 500(amano enzyme inc.)作为蛋白质脱酰胺酶,用杏仁蛋白粉末(noosh brands)作为蛋白质制备杏仁蛋白溶液。
[0159]
例如,通过在水中水合0.06%(w/w)结冷胶或0.45%(w/w)果胶来制备溶液。加入杏仁蛋白以得到具有3%(w/w)杏仁蛋白的杏仁溶液。对于含有pga 500的制剂,以3.3%(w/w)的蛋白质的量添加酶,并在50℃下温育3小时。对于不含pga 500的制剂,将溶液加热至50℃而不温育。为了酸化,以1:2w/w的比率加入草莓汁浓缩物(来自old orchard的65白利糖度的100%汁液浆果混合浓缩物)。使酸化的溶液以2,000~2,500psi接受均质化,并随后在85℃下接受热处理10分钟。根据实施例16测定蛋白质脱酰胺酶的活力。
[0160]
将所得溶液在实验室vwr冰箱中于4℃下储存,并如上文实施例6所述的进行评估。结果列于下表。
[0161][0162]
结果表明,如分散外观和更高的吸光度(反映更多的溶解的蛋白质)所示的,在酸性ph(约4.0)下,根据本发明的制剂(包含pga 500和树胶)(制剂78b
‑
79b)是稳定且抗蛋白质沉淀的。这些结果表明,用本文公开的配方获得的改善的稳定性即使在均质化后仍旧得到保持。
[0163]
结果表明,与显示分离且较低吸光度值(较少的溶解的蛋白质)的不含pga500但包含树胶的对比制剂(制剂78a和79a)相比,如更高的吸光度值(更多的溶解的蛋白质)和无沉淀或沉积物所示的,在约4.0至约4.2的ph下,具有树胶的pga 500制剂(制剂78b和79b)均是稳定的。这些结果表明,由pga 500和树胶的组合中观察到的稳定性即使在均质化后仍旧得到保持。
[0164]
实施例15:长期稳定性研究
[0165]
长期稳定性研究如下进行。将如下所述的制剂在经认证的工业中试工厂中混合和无菌包装,以生产工业巴氏灭菌和稳定的产品,并在冷藏条件下(4℃)储存长达6个月。这些产品会是稳定且抗蛋白质沉淀的。
[0166][0167]
例如,可以采用以下程序制备工业巴氏灭菌的制剂:
[0168]
1、称取果胶、结冷胶、水和豌豆蛋白。
[0169]
2、在高剪切条件下将树胶和水混合。
[0170]
3、通过加热并保持在85℃使溶液中的树胶活化。
[0171]
4、将树胶水溶液转移到100l桶(vat)中,加入蛋白质。
[0172]
5、向桶中加入酶,搅拌均匀。将溶液转移到容器中以在50℃下温育3小时。
[0173]
6、称取汁液浓缩物和食用色素。
[0174]
7、将溶液重新倒入100l桶中,并加入汁液浓缩物和食用色素。
[0175]
8、当适当混合时,将混合物加入到超高温(uht;如在约120℃下约1秒至约3秒)/高温短时系统(htst,如在约100℃下约10秒至约20秒)中进行巴氏灭菌。
[0176]
9、将巴氏灭菌后的产品送入均质机以在2000psi下均质化。
[0177]
10、在无菌环境中将产品装瓶并封盖,转移到盒子中保存。
[0178]
截止目前的稳定性研究表明在4℃下储存25周后,上述蛋白质脱酰胺酶制剂是稳定的。
[0179]
实施例16:蛋白质脱酰胺酶活力分析
[0180]
蛋白质脱酰胺酶的活力可以通过以下方法测定,其参照蛋白质谷氨酰胺酶脱酰胺活力进行说明。采用合适的蛋白质天冬酰胺酶脱酰胺底物(如z
‑
asn
‑
gly),对蛋白质天冬酰胺酶脱酰胺活力进行类似的分析。
[0181]
通过向1ml含有30mm z gln
‑
gly(蛋白质谷氨酰胺酶脱酰胺活力分析的底物)的0.2m的磷酸盐缓冲液(ph 6.5)中加入0.1ml含有蛋白质脱酰胺酶的水性溶液并在37℃下温育10分钟来制备测试溶液。通过加入1ml的0.4m三氯乙酸(tca)溶液来结束反应。通过向包含1ml的含有30mm z gln
‑
gly(蛋白质谷氨酰胺酶脱酰胺活力分析的底物)的0.2m的磷酸盐缓冲液(ph 6.5)和1ml的0.4m三氯乙酸(tca)溶液的溶液中加入0.1ml的含有蛋白质脱酰胺酶的水性溶液并在37℃下温育10分钟来制备空白溶液。采用ammonia test wako(由wako pure chemical industries,ltd.制造)来测量测试溶液中反应产生的氨的量,其中使用用氨标准溶液(氯化铵)绘制的氨浓度与吸光度(630nm)的校准曲线来确定氨浓度。可以按照如下计算蛋白质脱酰胺酶的活力(1单位=每分钟产生1μmol氨所需的酶的量):
[0182]
酶活力(u/ml)=
[0183]
(反应溶液中氨浓度(mg/l))x(1/17.03)x(2.1/0.1)x(1/10)x df
[0184]
其中:
[0185]
17.03为氨的分子量;
[0186]
2.1为上述方案中酶反应体系的液体体积(ml);
[0187]
0.1为上述方案中酶溶液的体积(ml);
[0188]
10为上述方案的反应时间(min);和
[0189]
df为酶溶液的稀释率。
[0190]
总而言之,这些实施例表明,可以如本文所述为来自多种来源的多种蛋白质制备稳定的蛋白质溶液,并且此类蛋白质溶液在酸性ph下,包括用果汁浓缩物酸化的制剂,是稳定且抗蛋白质沉淀的。实施例还表明,如本文所述配制的蛋白质溶液在均质化后是稳定的。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1