含有棒状杆菌属菌株及其培养物的用于预防、治疗或改善胃肠道疾病的组合物的制作方法
本申请涉及一种含有棒状杆菌属菌株、其培养产物及苏氨酸的用于预防、治疗或改善胃病的组合物。
背景技术:
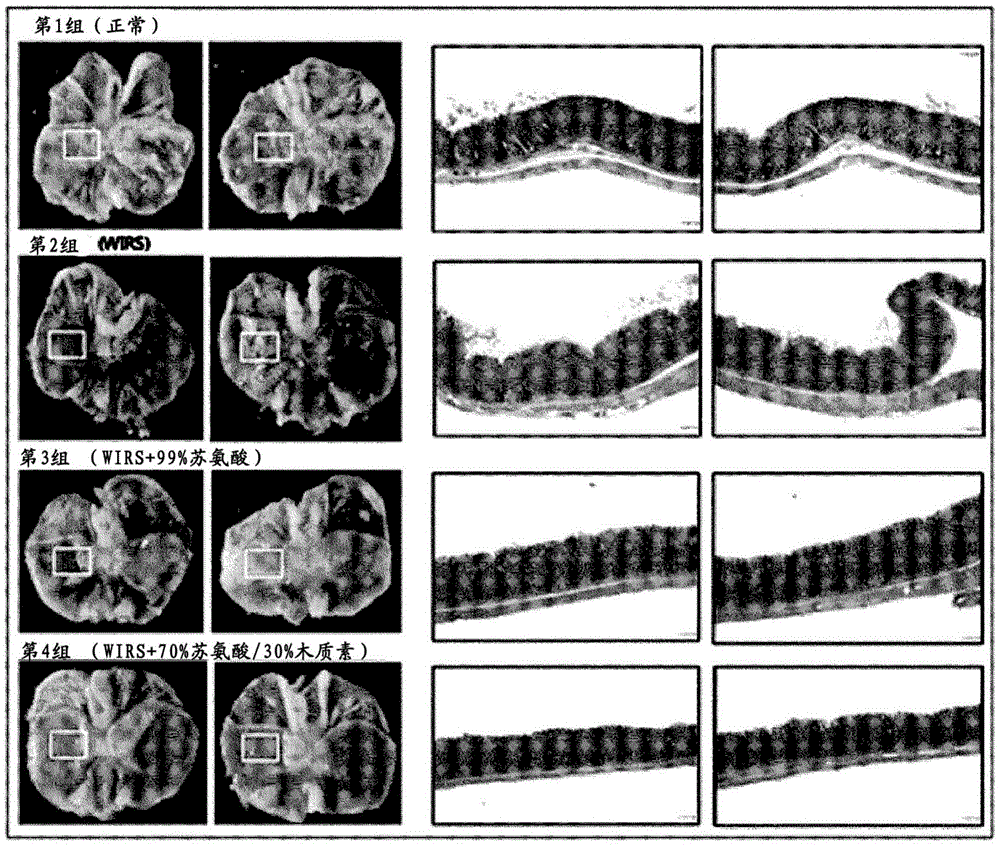
胃病变中胃溃疡所占发病率最高,且在全世界范围内的所有品种中均为常见的。胃溃疡的发病率正随着家畜行业的发展而有所提高,且结合由于食欲降低所致的生长速度下降,在动物福祉方面正在为预防出现呈伴随疼痛的症状形式的胃病变做出更大努力。苏氨酸(Thr)为由黏蛋白组成的主要氨基酸(aminoacid;AA),该黏蛋白为一种肠道上皮的保护物质。黏蛋白蛋白促进蛋白质吸收,且同时保护消化器官免受诸如胃液的强酸性消化液的侵害,且在维持肠健康方面起重要作用。已报告,饲料中的苏氨酸治疗通过在猪崽中帮助黏蛋白合成而实际上改善肠道健康(非专利文献1)。饲料或食品用苏氨酸的制造使通过微生物发酵法产生的,且主要使用的微生物种类则包括大肠杆菌(E.coli)及谷氨酸棒状杆菌(Corynebacteriumglutamicum/C.glutamicum)等。尽管产生相同AA,但此两种菌株分别划分为革兰氏阴性细菌及革兰氏阳性细菌。革兰氏阴性细菌及革兰氏阳性细菌两者的细胞壁由肽聚糖(peptidoglycan;PG)构成。然而,在革兰氏阴性细菌的情况下,除PG以外,亦另外存在由脂蛋白及蛋白质组成的脂多糖(lipopolysaccharide;LPS)层,且作为脂质A,在此LPS层中亦存在体细胞抗原(O抗原),其为有毒的。因此,在医药行业中,必需移除具有有害生物活性的非经肠药物中的内源性毒素,所述有害生物活性诸如发热性、致死性、施瓦茨曼反应性(Schwartzmanreactivity)、佐剂活性及巨噬细胞活化(非专利文献2)。最近,归因于饲料添加剂的经济有效性,通过简化(或省略)高纯化方法产生呈颗粒类型的用于饲料的氨基酸必然地将用于以热杀灭形式发酵的细菌混合成产物。若干研究已显示代表性革兰氏阳性细菌的热杀灭细菌,乳酸菌伴随强耐酸性及耐热性而具有环境稳定性,且因为可呈高浓度而易于处理,且用作在肠道中定居的有益菌的食品,且由此加强乳酸菌所特有的免疫增强活性(非专利文献3)。针对此背景,本申请人已尝试研发出一种在预防及治疗胃病方面具有功效的药物组合物,且因此已证实一种包含棒状杆菌属菌株、其培养产物及苏氨酸的组合物在预防、治疗及改善胃病方面有效,由此完成本申请。[非专利文献](非专利文献1)LawG.(2000)Threoninerequirementandtheeffectofthreonineongutmucincharacteristicsinpigletsreceivingintragastricnutrition.MasterthesisofuniversityofAlberta.1-143。(非专利文献2)MiyamotoT.,OkonoS.及KasaiN(2009)InactivationofEscherichiacoliendotoxinbysofthydrothermalprocessing.AppliedandEnvironmentalMicrobiology,75(15),5058-5063。(非专利文献3)LeeI.H.(2018)Latesttrendsurroundinganimalantimicrobialagentsandalternatives.Pig&Consulting,4,70-73。技术实现要素:[技术问题]本申请提供一种用于预防或改善胃病的饲料组合物,其包含棒状杆菌属菌株、其培养产物及苏氨酸。本申请提供一种用于预防或治疗胃病的药物组合物,其包含棒状杆菌属菌株、其培养产物及苏氨酸。本申请提供一种用于预防或改善胃病的食品组合物,其包含棒状杆菌属菌株、其培养产物及苏氨酸。本申请提供一种对抗幽门螺杆菌(Helicobacterpylori)的抗微生物组合物,其包含棒状杆菌属菌株、其培养产物及苏氨酸。[技术方案]一个方面可提供一种用于预防、改善或治疗胃病的组合物,其包含棒状杆菌属菌株、其培养产物及苏氨酸。在本申请中,“预防(prevention)”可以指通过施用根据一个实例的组合物来抑制或推迟疾病出现的所有操作,且“治疗(treatment)”可以指通过施用根据一个实例的组合物来改善或有利地改变疑似及发病个体的症状的所有操作,且“改善(improvement)”可以指至少通过施用根据一个实例的组合物降低与治疗疾病的病状相关的参数,例如症状的严重程度的所有操作。疾病可以指胃病。一个方面可提供一种用于预防或改善胃病的饲料组合物,其包含棒状杆菌属菌株、其培养产物及苏氨酸。在本申请中,“棒状杆菌属(Corynebacteriumsp./Corynesp.)菌株”可包含所有棒状杆菌属菌株。棒状杆菌属菌株可为例如谷氨酸棒状杆菌、产氨棒状杆菌(Corynebacteriumammoniagenes)、生乳棒状杆菌(Corynebacteriumcrudilactis)、沙漠棒状杆菌(Corynebacteriumdeserti)、有效棒状杆菌(Corynebacteriumefficiens)、帚石南棒状杆菌(Corynebacteriumcallunae)、停滞棒状杆菌(Corynebacteriumstationis)、单一棒状杆菌(Corynebacteriumsingulare)、耐盐棒状杆菌(Corynebacteriumhalotolerans)、纹带棒状杆菌(Corynebacteriumstriatum)、花粉棒状杆菌(Corynebacteriumpollutisoli)、亚胺棒状杆菌(Corynebacteriumimitans)、龟板棒状杆菌(Corynebacteriumtestudinoris)及/或微黄棒状杆菌(Corynebacteriumflavescens),且更具体地,其可为谷氨酸棒状杆菌、产氨棒状杆菌或其组合(谷氨酸棒状杆菌及产氨棒状杆菌)。在一个实例中,棒状杆菌属菌株可具有产苏氨酸性。在本申请中,具有产苏氨酸性(havingtheproductivityofthreonine)指当相应微生物在培养基中培养时,展现产生且积聚微生物及/或培养基中的苏氨酸的能力。当根据一个实例的用于预防、改善或治疗胃病的组合物包含谷氨酸棒状杆菌时,(i)预防、改善或治疗胃病的功效及/或(ii)抗幽门螺杆菌功效可优于包含除谷氨酸棒状杆菌外的任何其他种类的棒状杆菌属菌株(例如,有效棒状杆菌)的组合物。当根据一个实例的用于预防、改善或治疗胃病的组合物包含产氨棒状杆菌时,(i)预防、改善或治疗胃病的功效及/或(ii)抗幽门螺杆菌功效可优于包含除产氨棒状杆菌外的任何其他种类的棒状杆菌属菌株(例如,有效棒状杆菌)的组合物。当根据一个实例的用于预防、改善或治疗胃病的组合物包含谷氨酸棒状杆菌及产氨棒状杆菌时,(i)预防、改善或治疗胃病的功效及/或(ii)抗幽门螺杆菌功效可优于包含除谷氨酸棒状杆菌及产氨棒状杆菌外的任何其他种类的棒状杆菌属菌株(例如,有效棒状杆菌)的组合物。在一个实例中,组合物的极佳抗幽门螺杆菌功效可以指对抗幽门螺杆菌菌株的抗微生物活性为极佳的或预防感染幽门螺杆菌的细胞(例如胃黏膜细胞)的细胞凋亡的活性为极佳的。棒状杆菌属菌株可以指在培养溶液中移除培养基的经浓缩微生物细胞,且其可通过离心及/或过滤过程以仅自培养产物回收经浓缩微生物细胞。在一个实例中,棒状杆菌属菌株可以热杀灭细菌形式包含在内。在本申请中,“热杀灭(heatkilledbacteria)”为活细菌的相反概念,其指通过热处理经由发酵获得的活细菌及代谢物来阻止细菌生长的形式,及其类似形式。热杀灭细菌可包含抗微生物物质,诸如细胞质、细胞壁、细菌素等;多糖及/或有机酸等。相较于包含活细胞的组合物,根据一个实例的包含热杀灭细菌的组合物可具有选自由如下的(1)至(6)组成的组中的至少一种特性。(1)极佳耐酸性;(2)极佳耐热性;(2)在高浓度下浓缩的可能性;(4)极佳稳定性;(5)容易处置及储存;及(6)用作肠道有益菌的饲料的可能性。棒状杆菌属菌株可通过廷得耳(Tyndall)及/或热处理来杀灭。在一个实例中,对棒状杆菌属菌株及其培养产物进行灭菌的培养溶液包含菌株的热杀灭细菌。举例而言,热处理可在60至130℃的温度下进行3至30分钟。另外,热处理可通过超高温灭菌、高压灭菌及/或一次至10次的热空气干燥来进行。超高温灭菌可在110℃至130℃的温度下进行3.0秒至10.0秒,且举例而言,其可在100℃下进行1.0秒至10秒两次,且在121℃下进行1.0秒至10.0秒一次,且高压灭菌可在120至125℃或121℃下进行10分钟至30分钟、15分钟至25分钟或20分钟,且可在60至70℃的温度下进行热空气干燥。在一个具体实例中,证实包含棒状杆菌属菌株的热杀灭细菌、棒状杆菌属菌株的培养产物及苏氨酸的组合物具有极佳的(i)预防或治疗胃病的功效及/或(ii)体外及/或体内的抗幽门螺杆菌功效。根据一个实例的组合物可包含浓度为20至40OD(波长560至565nm)、25至35OD(波长560至565nm)或30OD(波长560至565nm)的棒状杆菌属菌株(或菌株的热杀灭细菌)。根据一个实例的组合物可包含1至100g/L、5至100g/L、10至100g/L、15至100g/L、20至100g/L、21至100g/L、1至80g/L、5至80g/L、10至80g/L、15至80g/L、20至80g/L、21至80g/L、1至60g/L、5至60g/L、10至60g/L、15至60g/L、20至60g/L、21至60g/L、1至50g/L、5至50g/L、10至50g/L、15至50g/L、20至50g/L、21至50g/L、1至30g/L、5至30g/L、10至30g/L、15至30g/L、20至30g/L、21至30g/L、1至25g/L、5至25g/L、10至25g/L、15至25g/L、20至25g/L或21至25g/L的浓度为20至40OD(波长560至565nm)、25至35OD(波长560至565nm)或30OD(波长560至565nm)的棒状杆菌属菌株(或菌株的热杀灭细菌)。根据一个实例的组合物可包含浓度为以下的棒状杆菌属菌株(或菌株的热杀灭细菌):1至100g/L、5至100g/L、10至100g/L、15至100g/L、20至100g/L、21至100g/L、1至80g/L、5至80g/L、10至80g/L、15至80g/L、20至80g/L、21至80g/L、1至60g/L、5至60g/L、10至60g/L、15至60g/L、20至60g/L、21至60g/L、1至50g/L、5至50g/L、10至50g/L、15至50g/L、20至50g/L、21至50g/L、1至30g/L、5至30g/L、10至30g/L、15至30g/L、20至30g/L、21至30g/L、1至25g/L、5至25g/L、10至25g/L、15至25g/L、20至25g/L或21至25g/L。根据一个实例的组合物可包含量为以下的棒状杆菌属菌株(或菌株的热杀灭细菌):0.1至10重量%、0.1至8重量%、0.1至5重量%、0.1至4重量%、0.1至3.5重量%、0.1至3重量%、0.1至1重量%、1至10重量%、1至8重量%、1至5重量%、1至4重量%、1至3.5重量%、1至3重量%、2至10重量%、2至8重量%、2至5重量%、2至4重量%、2至3.5重量%、2至3重量%、3至10重量%、3至8重量%、3至5重量%、3至4重量%、3至3.5重量%、3.5至10重量%、3.5至8重量%、3.5至5重量%或3.5至4重量%。在一个实例中,棒状杆菌属菌株可包含于菌株的培养产物中。“培养产物(culturedproduct)”指在培养棒状杆菌属菌株之后获得的产物,且可包含发酵产物。在一个实例中,培养产物可为棒状杆菌属菌株在培养基中培养的发酵产物。“发酵产物(fermentedproduct)”指使用微生物对有机物质进行酶促或代谢分解的产物。在本申请中,“发酵(fermentation)”可以指除破坏反应以外的包括使用微生物对有机物质进行酶促或代谢分解的所有活动或过程。培养产物(或发酵产物)可为棒状杆菌属菌株的总培养产物、其稀释溶液、浓缩物、干燥物质、冻干物、裂解物及/或级分等,且浓缩物可通过离心或蒸发培养产物获得,且干燥物质可通过使用干燥剂干燥培养产物等获得,且冻干物可通过使用冻干器冻干培养产物等获得,且裂解物可通过物理或超音波处理菌株或培养产物来获得,且级分可通过将培养产物、裂解物等施用于离心方法、层析法等来获得。培养产物或发酵产物可呈固相(固态,例如干物质)、液相(液体)或流化床,但不限于此。在一个实例中,培养产物可以指通过培养棒状杆菌属菌株一定时间而获得的包含经培养菌株、其代谢物及/或残余养分等的所有培养基。在一个实例中,培养产物可以指除其中在培养基中培养棒状杆菌属菌株的发酵产物中的菌株(微生物细胞)及/或苏氨酸外的其他组分。在一个实例中,培养产物可为其中移除或未移除棒状杆菌属菌株的产物。在一个实例中,培养产物可为其中自培养溶液移除菌株的培养溶液(或培养产物),在该培养溶液中,棒状杆菌属菌株在培养基中培养。其中移除菌株的培养溶液(或培养产物)可为游离细胞培养溶液(或培养产物)或包含热杀灭细菌的培养溶液,且例如可为其中通过离心(离心上清液)及过滤移除菌株的滤液及/或包含热杀灭细菌的培养溶液(或培养溶液的干燥物质)。根据一个实例的组合物可包含量为以下的培养产物(或发酵产物):1至80重量%、5至80重量%、10至80重量%、15至80重量%、20至80重量%、23至80重量%、25至80重量%、1至60重量%、5至60重量%、10至60重量%、15至60重量%、20至60重量%、23至60重量%、25至60重量%、1至50重量%、5至50重量%、10至50重量%、15至50重量%、20至50重量%、23至50重量%、25至50重量%、1至40重量%、5至40重量%、10至40重量%、15至40重量%、20至40重量%、23至40重量%、25至40重量%、1至30重量%、5至30重量%、10至30重量%、15至30重量%、20至30重量%、23至30重量%、25至30重量%、1至25重量%、5至25重量%、10至25重量%、15至25重量%、20至25重量%或23至25重量%。根据一个实例,与包含含量在上述范围外的培养产物的组合物相比,包含在上述范围内的培养产物的组合物可具有极佳的(i)预防或治疗胃病的功效及/或(ii)抗幽门螺杆菌功效。培养产物可包含棒状杆菌属菌株,且可包含具有以下含量的培养产物中的棒状杆菌属菌株:0.1至10重量%、0.1至8重量%、0.1至5重量%、0.1至4重量%、0.1至3.5重量%、0.1至3重量%、0.1至1重量%、1至10重量%、1至8重量%、1至5重量%、1至4重量%、1至3.5重量%、1至3重量%、2至10重量%、2至8重量%、2至5重量%、2至4重量%、2至3.5重量%、2至3重量%、3至10重量%、3至8重量%、3至5重量%、3至4重量%、3至3.5重量%、3.5至10重量%、3.5至8重量%、3.5至5重量%或3.5至4重量%。在一个实例中,棒状杆菌属菌株及其培养产物可为包含通过热处理(或灭菌(例如,高压灭菌或热空气干燥))培养产物获得的棒状杆菌属菌株的热杀灭细菌的培养产物,该培养产物通过在培养基中培养棒状杆菌属菌株一定时间来制备。在本申请中,“培养物(culture)”指在人工适当调整的环境条件下使微生物生长及发育的一系列操作。培养物可使用本领域中已知的任何培养条件及培养方法。举例而言,培养可在已知分批培养方法、连续培养方法、分批进料培养方法、分批法或分批进料或重复分批进料方法中连续进行。随后,可使用碱性化合物(例如氢氧化钠、氢氧化钾或氨)或酸性化合物(例如磷酸或硫酸)将培养条件调节至适当pH(例如pH5至9、pH6至8或pH6.8),但不限于此。在一个实例中,可使用诸如脂肪酸聚二醇酯的消泡剂抑制气泡形成,及/或可通过将氧气或含氧气体混合物引入至培养产物中来维持有氧条件。在一个实例中,培养温度可为20至45℃、25至40℃、30至40℃、30至35℃或35至40℃,且培养条件可为100至500rpm、150至300rpm、150至250rpm或200rpm,且培养时间(时段)可为1至160小时、10至100小时、12至72小时、24至72小时、30至60小时、40至50小时、45至50小时或48小时。培养时段可继续直至以所需收率获得有益物质(例如,L-苏氨酸、苏氨酸)。在一个实例中,培养物可在上述范围内的培养温度下进行持续上述范围内的培养时间。用于培养的培养基应以适当方式满足特定菌株的条件,且本领域技术人员可根据已知含量适当地对其进行使用。根据一个实例,用于培养棒状杆菌属菌株的培养基可参考已知文献(例如,ManualofMethodsforGeneralBacteriology.AmericanSocietyforBacteriology.WashingtonD.C.,USA,1981),但不限于此。为了培养棒状杆菌属菌株,特定菌株的存活需求可通过在含有适当碳源、氮源、氨基酸、维生素等的常用培养基中在厌氧条件下调节温度、pH等以适当方式来满足。作为待用于培养基中的碳源,糖类及碳水化合物(例如葡萄糖、蔗糖、乳糖、果糖、麦芽糖、甘二糖、淀粉及纤维素)、油及脂肪(例如大豆油、葵花籽油、花生油及椰子油)、脂肪酸(例如棕榈酸、硬脂酸及亚麻油酸)、醇(例如丙三醇及乙醇)及有机酸(例如乙酸)等可单独使用或组合使用,但不限于此。作为氮源,含氮有机化合物(例如:蛋白胨、酵母提取物、肉汁、麦芽提取物、玉米浆、黄豆粕及尿素)或无机化合物(例如:硫酸铵、氯化铵、磷酸铵、碳酸铵及硝酸铵)等可单独使用或组合使用,但不限于此。作为磷酸盐源,磷酸二氢钾、磷酸氢二钾、与其对应的含氮盐等可单独使用或组合使用,但不限于此。另外,培养基可含有生长所需的其他金属盐(例如硫酸镁或硫酸铁)及/或包含主要生长物质,诸如氨基酸及维生素,但不限于此。在一个实例中,培养基可为用于产生苏氨酸的培养基(例如,第435号培养基)且棒状杆菌属菌株及其培养产物可为其中棒状杆菌属菌株在用于产生苏氨酸的培养基中培养的培养产物,且苏氨酸可释放至培养基中或包含于细胞中。在一个实例中,棒状杆菌属菌株及/或其(棒状杆菌属菌株)培养产物可包含苏氨酸。在一个实例中,棒状杆菌属菌株及/或其培养产物可不包含苏氨酸。在本申请中,“苏氨酸(threonine;Thr)”为羟基-α-氨基酸且为并非身体中产生的必需氨基酸中的一种,指具有HO2CCH(NH2)CH(OH)CH3的化学式的氨基酸。苏氨酸可为光学异构体L型(L-型苏氨酸(L-苏氨酸、L-Thr))、D型或其组合。苏氨酸为必需氨基酸,且由黏蛋白(一种肠道上皮的保护物质)组成,且当其不足时,其可能引起生长停止及体重减轻。根据一个实例,当棒状杆菌属菌株、其培养产物及/或苏氨酸混合时,可展示协同极佳的(i)预防或治疗胃病的功效及/或(ii)抗幽门螺杆菌功效。根据一个实例的组合物可包含50至90重量%、50至85重量%、50至80重量%、50至75重量%、50至70重量%、55至90重量%、55至85重量%、55至80重量%、55至75重量%、55至70重量%、60至90重量%、60至85重量%、60至80重量%、60至75重量%、60至70重量%、65至90重量%、65至85重量%、65至80重量%、65至75重量%、65至70重量%、70至90重量%、70至85重量%、70至80重量%、70至75重量%或70重量%苏氨酸。与包含含量在上述范围外的苏氨酸的组合物相比,包含在上述范围中的苏氨酸的组合物可具有极佳的(i)预防或治疗胃病的功效及/或(ii)抗幽门螺杆菌功效。苏氨酸可为可商购的或可使用提取法、发酵法、酶方法及/或合成法等产生。举例而言,其可通过使用棒状型菌株获得包含苏氨酸的发酵产物,且随后将其纯化,或经由苏氨酸生物合成路径合成,及/或化学合成来获得。在根据一个实例的组合物中,苏氨酸可(1)包含于棒状杆菌属菌株及/或其培养产物中,或(2)进一步以不包含于棒状杆菌属菌株及/或其培养产物中的形式包含在内,或(3)其组合(例如,包含于组合物中的棒状杆菌属菌株及其培养产物包含苏氨酸且另外进一步包含苏氨酸)。包含于根据一个实例的组合物中的苏氨酸可(1)包含于棒状杆菌属菌株、其培养产物或其两者(菌株及培养产物)中;或(2)分别添加;或(3)可包含于棒状杆菌属菌株、其培养产物或其两者(菌株及培养产物)中且另外(分别)添加至其中。除了包含于菌株及/或培养产物中的苏氨酸以外,分别添加苏氨酸可以指进一步添加经纯化的苏氨酸。苏氨酸可呈粉末及/或颗粒的形式。颗粒型苏氨酸可具有100至1000μm或200至1000μm的粒径。根据一个实例的组合物可包含0.1至5重量份的棒状杆菌属菌株、10至90重量份的培养产物及10至80重量份的苏氨酸。具体地,可包含0.2至5重量份的菌株、12至88重量份的培养产物及10.5至78重量份的苏氨酸;0.3至5重量份的菌株、13至87重量份的培养产物及11至77重量份的苏氨酸;0.4至5重量份的菌株、14至86重量份的培养产物及11.5至76重量份的苏氨酸;0.5至5重量份的菌株、15至85重量份的培养产物及12至75重量份的苏氨酸;0.6至5重量份的菌株、16至84重量份的培养产物及12.5至74重量份的苏氨酸;0.7至5重量份的菌株、17至83重量份的培养产物及13至73重量份的苏氨酸;0.8至5重量份的菌株、18至82重量份的培养产物及13.5至72重量份的苏氨酸;0.9至5重量份的菌株、19至81重量份的培养产物及14至71重量份的苏氨酸;0.9至4重量份的菌株、20至80重量份的培养产物及14至70重量份的苏氨酸;1至4重量份的菌株、21至79重量份的培养产物及14至69重量份的苏氨酸或1至3重量份的菌株、22至78重量份的培养产物及14至68重量份的苏氨酸。在根据一个实例的组合物中,菌株及其培养产物与苏氨酸的重量比(菌株及其培养产物的重量:苏氨酸的重量)可为1:0.1至1:10、1:0.1至1:5、1:0.1至1:3、1:0.2至1:10、1:0.2至1:5、1:0.2至1:3、1:0.5至1:10、1:0.5至1:5、1:0.5至1:3、1:1至1:10、1:1至1:5、1:1至1:3、1:3至1:10、1:3至1:5或1:3。根据一个实例的组合物可进一步包含木质素磺酸盐。当根据一个实例的组合物进一步包含木质素磺酸盐时,(i)预防或治疗胃病的功效及/或(ii)抗幽门螺杆菌功效可变为极佳的。根据一个实例的组合物可进一步包含木质素磺酸盐以调节苏氨酸含量。根据一个实例,组合物可包含0.1至50重量%、0.1至30重量%、0.1至25重量%、0.1至20重量%、0.1至15重量%、0.1至10重量%、0.1至7重量%、1至50重量%、1至30重量%、1至25重量%、1至20重量%、1至15重量%、1至10重量%、1至7重量%、3至50重量%、3至30重量%、3至25重量%、3至20重量%、3至15重量%、3至10重量%、3至7重量%、5至50重量%、5至30重量%、5至25重量%、5至20重量%、5至15重量%、5至10重量%、5至7重量%、6.5至50重量%、6.5至30重量%、6.5至25重量%、6.5至20重量%、6.5至15重量%、6.5至10重量%或6.5至7重量%的木质素磺酸钙。在一个实例中,组合物可包含呈干燥形式的棒状杆菌属菌株及其培养产物(例如“棒状杆菌属菌株及其培养产物”的干燥物质)。干燥物质可通过干燥棒状杆菌属菌株及其培养产物来制备,且干燥物质可包含苏氨酸。在一个实例中,干燥可通过至少一种选自由以下组成的组的方法进行:真空干燥、热空气干燥、冻干、环境空气干燥、薄膜干燥及/或真空干燥。在一个实例中,组合物可包含呈干燥形式的棒状杆菌属菌株、其培养产物及苏氨酸(例如,包含苏氨酸的“棒状杆菌属菌株及其培养产物”的干燥物质)。根据一个实例的组合物的制剂可呈于油或液态介质中的乳液、悬浮液或溶液形式,或呈萃取物、粉末、颗粒、锭剂、胶囊或凝胶(例如水凝胶)形式,且可进一步包含分散剂或稳定剂。根据一个具体实例的组合物可通过干燥棒状杆菌属菌株及其培养产物(发酵产物)及苏氨酸制备,棒状杆菌属菌株(例如,热杀灭细菌中的菌株)及除苏氨酸及菌株以外的培养产物的组分可包含于此组合物中。在一个实例中,通过干燥棒状杆菌属菌株及其培养产物所制备的根据一个实例的组合物可呈颗粒形式,且相比于呈粉末形式的经纯化的苏氨酸,此可具有极佳的(i)预防或治疗胃病的功效及/或(ii)抗幽门螺杆菌功效。在本申请中,“颗粒(granule)”指粉末聚集以形成大30至150倍的粒子的状态,且“粒化(granulation)”可以指通过处理过程等来诱导原材料呈颗粒。在一个实例中,在对包含棒状杆菌属菌株、其培养产物及/或苏氨酸的组合物进行干燥的过程中,组合物可展现颗粒形式。在一个实例中,胃病可由幽门螺杆菌感染引起。在一个实例中,胃病可为选自由以下组成的组中的至少一种:胃炎、胃溃疡、十二指肠溃疡、消化性溃疡及胃癌。胃炎指其中引起胃内壁炎症的病况,且胃溃疡可随引起黏膜损伤的攻击因子与保护胃及肠道中的黏膜的防御因子的平衡破坏而出现。可视为胃溃疡的病因的攻击因子包括:胃酸、各种消化酶、胆汁、所采用的药物、乙醇、幽门螺杆菌的感染、服用非类固醇消炎药、吸烟等。当根据一个实例的组合物用作饲料组合物时,可制备呈将根据一个实例的组合物添加至市售饲料组合物中的形式的饲料组合物。其中可使用根据一个实例的组合物的饲料较佳为粉末或团粒制剂(pelletformulation)或液体制剂,但不限于此。另外,添加至饲料中的本申请的组合物的添加量不需要任何特定限制。在本申请中,“饲料(feed)”可以指动物食用、消化或适用于其的任何天然或人工设定的饮食、餐食等或餐食组分。饲料的种类不受特别限制,且可使用本领域中常用的饲料。饲料的非限制性实例可包括:植物饲料,诸如谷粒、根、食品加工副产品、藻类、纤维、医药副产品、脂肪及油、淀粉、皮或谷粒副产品等;及动物饲料,诸如蛋白质、无机物、脂肪及油、矿物质、脂肪及油、单细胞蛋白质、动物性浮游生物或食品等。其可单独或以两种或更多种的组合形式使用。可供应包含根据一个实例的组合物的饲料的受试者(动物)不受特定限制,但可为哺乳动物、鱼类、甲壳类动物及/或贝壳类动物,且例如可为猪、牛、马、山羊、鹿、绵羊、鸡、鸭、鹅、火鸡、狗、猫、兔或鱼。饲料组合物可进一步包含赋形剂、稀释剂或添加剂。饲料组合物可包含有效促进动物生长的组分、营养组分、营养补充剂、改良保存稳定性的组分、包衣材料组分、用于预防疾病的氨基酸制剂、维生素制剂、酶制剂、非蛋白氮化合物、硅酸盐制剂、缓冲液、萃取剂、益生菌;酶,诸如淀粉酶、脂肪酶等;维生素,诸如L-抗坏血酸、胆碱氯化物、肌醇等;矿物质,诸如氯化钾、柠檬酸铁、氧化镁、磷酸盐等;氨基酸,诸如赖氨酸、丙氨酸、甲硫氨酸等;有机酸,诸如反丁烯二酸、丁酸、乳酸等或其盐;抗氧化剂,诸如维生素C、维生素E等;霉菌抑制剂,诸如丙酸钙等;乳化剂,诸如卵磷脂、丙三醇脂肪酸酯等;及/或颜料等以及组分。尽管未在上文描述,但在一个实例中,饲料组合物可进一步包含可由本领域技术人员预期的范围内的其他养分。其他方面可提供一种用于预防或治疗胃病的药物组合物,其包含棒状杆菌属菌株、其培养产物及苏氨酸。根据一个实例的用于预防或治疗的药物组合物中所包含的棒状杆菌属菌株、其培养产物、苏氨酸及/或胃病如针对用于预防或改善胃病的饲料组合物所述。根据一个实例的药物组合物可进一步包含常用于药物组合物的制备的适当载体、赋形剂或稀释剂。具体地,药物组合物可通过根据各常见方法配制成口服制剂形式使用,诸如粉末、颗粒、片剂、胶囊、悬浮液、乳液、糖浆、气雾剂等,外部施用物、栓剂及灭菌注射溶液。药物组合物中所包含的载体、赋形剂及稀释剂可包括乳糖、右旋糖、蔗糖、山梨糖醇、甘露糖醇、木糖醇、赤藻糖醇、麦芽糖醇、淀粉、阿拉伯胶、海藻酸盐、明胶、磷酸钙、硅酸钙、纤维素、甲基纤维素、微晶纤维素、聚乙烯吡咯啶酮、水、甲基羟基苯甲酸酯、丙基羟基苯甲酸酯、滑石、硬脂酸镁及矿物油。当配制时,其使用稀释剂或赋形剂,诸如填充剂、增补剂、黏合剂、湿润剂、崩解剂、表面活性剂等来制备。用于经口施用的固体制剂包括片剂、丸剂、粉末、颗粒、胶囊等,且此等固体制剂通过将至少一种赋形剂,例如淀粉、碳酸钙、蔗糖或乳糖、明胶等混合至组合物来制备。另外,除简单赋形剂的外,润滑剂诸如硬脂酸镁及滑石。用于经口施用的液体制剂包括悬浮液、口服液体、乳液、糖浆等,且除常用的简单稀释剂、水及液体石蜡以外,可包含各种赋形剂,例如湿润剂、甜味剂、空气清新剂、防腐剂等。用于非经肠施用的制剂包括灭菌水溶液、非水性溶剂、悬浮液、乳液、冻干制剂及栓剂。作为非水性溶剂及悬浮液,可使用丙二醇、聚乙二醇、植物油(诸如橄榄油)、可注射酯(诸如油酸乙酯)等。作为栓剂的基底化合物,可使用栓剂、合成脂肪酸酯(witepsol)、聚乙二醇、吐温61、可可脂、月桂酸、甘油明胶等。根据一个实例的药物组合物可以药学上有效量施用,且在本申请中,“药学上有效量(pharmaceuticallyeffectiveamount)”指足以在适用于医学治疗或预防的合理的受益/风险比下治疗或预防疾病的量,且有效剂量水平可根据包括以下的因素确定:疾病严重程度、药物活性、患者年龄、体重、健康状况、性别、患者对药物的敏感性、所用本申请的组合物的施用时间、施用途径及释放速率、治疗期、与所用本申请的组合物组合或同时使用的药物及医学领域中已知的其他因素。根据一个实例的药物组合物可作为单独治疗剂施用,或与其他治疗剂组合施用,且可与常规治疗剂顺序或同时施用。另外,其可单独或多次施用。考虑所有因素,施用能够以最小量获得最大功效而无副作用的量是重要的。根据一个实例的药物组合物的剂量可为哺乳动物每天约0.0001至100mg/kg,具体地,0.001至10mg/kg。本申请的药物组合物的施用频率可一天施用一次或通过分开剂量施用若干次,但并非特别限于此。在任何方面中,剂量不限制本申请的范围。根据一个实例的药物组合物在施用方法中不受限制,只要其可达至目标组织即可。举例而言,包括关节内注射、经口施用、动脉内注射、静脉内注射或经皮注射等。另外,药物组合物可通过能够将活性物质递送至目标细胞的任何装置施用。其他方面可提供一种用于预防或改善胃病的食品组合物,其包含棒状杆菌属菌株、其培养产物及苏氨酸。用于预防或治疗胃病的食品组合物中所包含的棒状杆菌属菌株、其培养产物、苏氨酸及/或胃病如针对用于预防或改善胃病的饲料组合物所述。食品包括肉类、香肠、面包、巧克力、糖、点心、糖果、披萨饼、拉面、其他面条、胶状物、包括冰淇淋的乳制品、各种汤、饮品、茶、饮料、酒精饮品、维生素复合物、健康功能性食品及健康食品等,且包括常见含义中的所有食品。健康功能食品为与用于特殊健康用途的食品(FoSHU)相同的术语,且指除营养供应以外,具有较高医学及医疗功效的食品,其经处理以便有效地展示身体调节功能。在本文中,“功能(的)(function(al))”指获得对健康用途的有用功效,诸如调节养分或对人体的结构及功能的生理功效。本申请的食品可通过本领域中常用的方法制备,且当制备时,其可通过添加原材料及常用的组分制备。另外,食品的制剂可不受限制地制备,只要其为准入作为食品的制剂即可。本申请的食品组合物可以制剂的各种形式制备,且不同于一般药物,其具有在长时间服用药物时无可能出现的副作用的优势,且具有极佳便携性,且因此,本发明的食品可用作增强胃溃疡的预防或改善的补充物。健康食品指相比于一般食品具有主动健康维持或增强的功效的食品,且健康补充食品指用于健康补充目的的食品。在一些情况下,健康功能性食品、健康食品及健康补充食品的术语可互换使用。特别地,健康功能性食品为其中将根据一个实例的组合物添加至食品材料的食品,诸如饮品、茶、香辛料、胶状物、糖果等;或制备为胶囊、粉末、悬浮液等的食品;且指其在摄取时对健康具有特定功效,但不同于一般药物,其具有在使用食品作为原料服用药物时不会发生副作用的优势。可在日常基础上摄取根据一个实例的食品组合物,且因此可预期对预防或改善胃病具有较高功效,且因此其可极其有效地进行使用。食品组合物可进一步包含生理学上可接受的载体,且载体的种类不受特别限制,且可使用本领域中常用的任何载体。另外,食品组合物可包含其他组分,其可改善通常用于食品组合物中的气味、味道、视觉等。举例而言,可包含维生素A、维生素C、维生素D、维生素E、维生素B1、维生素B2、维生素B6、B12、烟酸、生物素、叶酸、泛酸等。此外,可包含矿物质,诸如锌(Zn)、铁(Fe)、钙(Ca)、铬(Cr)、镁(Mg)、锰(Mn)、铜(Cu)、铬(Cr)等。此外,可包含氨基酸,诸如赖氨酸、色氨酸、半胱氨酸、缬氨酸等。另外,食品组合物可包含食品添加剂,诸如防腐剂(山梨酸钾、苯甲酸钠、水杨酸、去氢乙酸钠等)、消毒剂(漂白粉末及更高级漂白粉末、次氯酸钠等)、抗氧化剂(丁基羟基茴香醚(BHA)、丁基羟基甲苯(BHT)等)、着色剂(焦油色素等)、着色剂(亚硝酸钠、亚硝酸钠等)、漂白剂(亚硫酸钠)、调味料(MSG,谷氨酸钠等)、甜味剂(甘素、环磺酸盐、邻磺酰苯甲酰亚胺、钠等)、调味剂(香草精、内酯等)、膨胀剂(明矾、D-酒石酸氢钾等)、强化剂、乳化剂、增稠剂(糊状物)、包衣剂、胶基、泡沫抑制剂、溶剂、促进剂等。添加剂可视食品的种类而选择且以适当量使用。根据一个实例的组合物本身可添加或与其他食品或食品组分一起使用,且可根据常见方法适当使用。活性成分的混合量可视其使用的目的(预防、健康或治疗性治疗)而适当地确定。一般而言,当制备食品或饮品时,本申请的食品组合物可以按食品或饮品计50重量份或更小,具体地,20重量份或更小的量添加。然而,当长期服用时,出于健康及卫生的目的,可包含小于上述范围的含量,且由于在安全方面不存在问题,因此活性成分可以在上述范围内的量使用。作为食品组合物的一个实例,其可用作健康饮品组合物,且在此情况下,与普通饮品相同,亦可含有其他组分,诸如各种调味剂或天然碳水化合物等。前述天然碳水化合物可为单糖,诸如葡萄糖及果糖;双糖,诸如麦芽糖及蔗糖;多糖,诸如糊精及环糊精;糖醇,诸如木糖醇、山梨糖醇、赤藻糖醇等。作为甜味剂,可使用天然甜味剂,诸如索马甜(thaumatin)及甜菊萃取物;合成甜味剂,诸如糖精及阿斯巴甜等。天然碳水化合物的比率可通常为每100mL本申请的健康饮品组合物约0.01至0.04g,具体为约0.02至0.03g。另外,健康饮品组合物可含有各种营养物、维生素、电解液、调味剂、着色剂、果胶酸、果胶酸盐、海藻酸、海藻酸盐、有机酸、保护性胶体增稠剂、pH调节剂、稳定剂、防腐剂、甘油、酒精或碳酸盐剂等。此外,可含有用于制备天然果汁、果汁饮品或植物饮品的果肉。此等组分可独立地或组合地使用。此等添加剂的比率并不非常重要,但通常在每100重量份本申请的健康饮品组合物0.01至0.1重量份范围内选择该比率。根据一个实例的食品组合物可包含于各种重量%中,只要其可展现预防或改善胃病的功效即可,但举例而言,以食品组合物的总重量计,可包含0.00001至100重量%、0.01至80重量%或10至50重量%的量的根据一个实例的组合物。根据一个实例,包含棒状杆菌属菌株、其培养产物及苏氨酸的组合物可通过抑制幽门螺杆菌(H.pylori)增殖及抑制由幽门螺杆菌诱发的炎症、氧化应激、血管生长及/或细胞凋亡来预防、治疗或改善胃病(例如胃溃疡)。根据一个实例,包含棒状杆菌属菌株、其培养产物及苏氨酸的组合物可通过促进黏液合成及释放、促进组织再生、抑制胃黏膜损伤、促进组织再生、抑制氧化应激、抑制胃黏膜细胞凋亡及/或抑制炎症来预防、治疗或改善胃病。在根据一个实例的组合物中,根据是否含有棒状杆菌属菌株;棒状杆菌属菌株是否包含为热杀灭细菌;棒状杆菌属菌株的种类;培养产物的存在或不存在;苏氨酸的存在或不存在;及/或棒状杆菌属菌株、其培养产物及苏氨酸的组合,证实在以下方面存在差异:(i)预防或治疗胃病的功效及/或(ii)抗幽门螺杆菌功效,且据证实,根据一个实例的组合物展现最佳。其他方面可提供用于预防、改善或治疗胃病的方法,其包括向受试者(患者)施用用于预防、改善或治疗胃病的组合物(饲料组合物、食品组合物或药物组合物)。饲料组合物、食品组合物、药物组合物及胃病如上文所描述。根据一个实例,用于预防、改善或治疗胃病的方法可进一步包含在施用之前确定(选择)需要预防、改善或治疗胃病的受试者(患者)。在本申请中,“受试者(subject)”可以指具有或处于罹患胃病风险下的包括人类的所有动物。预防或治疗胃病的方法所施用的目标受试者可为患有或处于罹患胃病风险下的包括人类的哺乳动物,且例如可为猪、牛、马、山羊、驯鹿、绵羊、鸡、鸭、鹅、火鸡、狗、猫及/或。在本申请中,“施用(administration)”指通过任何适当方法将用于预防、改善或治疗胃病的组合物引入目标受试者,且作为施用途径,其可经由可到达目标组织的各种口服或非经肠(例如,静脉内、皮下、肌肉内、腹膜内或局部施加)途径施用。用于预防、改善或治疗的方法可以(药学上)有效剂量施用根据一个实例的饲料组合物、食品组合物或药物组合物。适当的总日使用量可通过在正确医学测定范围内的治疗测定,且可施用一次或若干次。然而,特定受试者(患者)的特定治疗有效剂量可根据各种因素而以不同方式施用,该等因素包括特定组合物、受试者(患者)的年龄、体重、一般健康状况、性别及饮食、组合物的施用时间、施用途径及分泌速率、治疗期及待与特定组合物一起使用或同时使用的药物,及制药领域中熟知的类似因素,以及待获得的反应物的种类及程度,及在一些情况中是否使用其他试剂。其他方面可提供一种对抗幽门螺杆菌的抗微生物组合物,其包含棒状杆菌属菌株、其培养产物及苏氨酸。包含于对抗幽门螺杆菌的抗微生物组合物中的棒状杆菌属菌株、其培养产物、苏氨酸及/或胃病如针对用于预防或治疗胃病的药物组合物所述。当根据一个实例组合棒状杆菌属菌株、其培养产物及苏氨酸时,对抗幽门螺杆菌的抗微生物功效可为协同极佳的。其他方面可提供一种用于预防、改善或治疗胃病的组合物,其包含棒状杆菌属菌株、其培养产物及苏氨酸,且菌株及培养产物可包含苏氨酸。其他方面可提供一种用于制备用于预防、改善或治疗胃病的包含棒状杆菌属菌株及其培养产物(发酵产物)的活性成分的组合物,且棒状杆菌属菌株或其培养产物(发酵产物)可包含或含有苏氨酸。用于制备用于预防、改善或治疗胃病的活性成分的组合物可包含以总组合物计0.1至5重量份的棒状杆菌属菌株、10至90重量份的发酵产物及10至80重量份的苏氨酸。具体地,其可包含以总组合物计0.2至5重量份的菌株、12至88重量份的发酵产物及10.5至78重量份的苏氨酸;0.3至5重量份的菌株、13至87重量份的发酵产物及11至77重量份的苏氨酸;0.4至5重量份的菌株、14至86重量份的发酵产物及11.5至76重量份的苏氨酸;0.5至5重量份的菌株、15至85重量份的发酵产物及12至75重量份的苏氨酸;0.6至5重量份的菌株、16至84重量份的发酵产物及12.5至74重量份的苏氨酸;0.7至5重量份的菌株、17至83重量份的发酵产物及13至73重量份的苏氨酸;0.8至5重量份的菌株、18至82重量份的发酵产物及13.5至72重量份的苏氨酸;0.9至5重量份的菌株、19至81重量份的发酵产物及14至71重量份的苏氨酸;0.9至4重量份的菌株、20至80重量份的发酵产物及14至70重量份的苏氨酸;1至4重量份的菌株、21至79重量份的发酵产物及14至69重量份的苏氨酸;1至3重量份的菌株、22至78重量份的发酵产物及14至68重量份的苏氨酸,但不限于此。用于制备用于预防或治疗胃病的活性成分的组合物可进一步包含木质素磺酸钙,以调节苏氨酸含量。木质素磺酸钙可以以下量包含在内:以组合物的总重量计,0.1至50重量%、0.1至30重量%、0.1至25重量%、0.1至20重量%、0.1至15重量%、0.1至10重量%、0.1至7重量%、1至50重量%、1至30重量%、1至25重量%、1至20重量%、1至15重量%、1至10重量%、1至7重量%、3至50重量%、3至30重量%、3至25重量%、3至20重量%、3至15重量%、3至10重量%、3至7重量%、5至50重量%、5至30重量%、5至25重量%、5至20重量%、5至15重量%、5至10重量%、5至7重量%、6.5至50重量%、6.5至30重量%、6.5至25重量%、6.5至20重量%、6.5至15重量%、6.5至10重量%、6.5至7重量%、0.1至18重量%、0.1至16重量%、0.1至14重量%、0.1至13重量%、0.1至12重量%、0.1至11重量%、0.1至9重量%、0.1至8重量%或0.1至7重量%,但不限于此,且可添加而不加以限制,使得组合物中的苏氨酸达至所需含量。其他方面可提供一种用于预防或治疗胃病的药物组合物,其包含用于制备用于预防或治疗胃病的活性成分的组合物。其他方面可提供一种用于预防或改善胃病的食品组合物,其包含用于制备用于预防或治疗胃病的活性成分的组合物。其他方面可提供一种用于预防或改善胃病的饲料组合物,其包含用于制备用于预防或治疗胃病的活性成分的组合物。其他方面提供一种治疗胃病的制剂,其包含用于制备用于预防或治疗胃病的活性成分的颗粒组合物,该颗粒组合物包含棒状杆菌属菌株及其培养产物(发酵产物)作为活性成分。棒状杆菌属菌株及其发酵产物、胃病、预防、改善以及治疗如上文所描述。在本申请中,“制剂(formulation)”是指加以处理以便方便制备、保存或使用,且通过主要物理操作充分展现治疗功效,该等物理操作例如粉碎、混合、捏合、浸出(冲泡)或蒸发等,而不改变药物的性质,且另外,由此制成的产物亦称为医药制剂(chemicalunabridgeddictionary,2001.5.20.,Sehwaeditorialdepartment)。当加以调配以制备制剂时,所用添加剂,亦即填充剂、增补剂、黏合剂、湿润剂、崩解剂、稀释剂或赋形剂如上文所描述,且用于经口施用的固体制剂及包含于其中的添加剂、用于经口施用的液体制剂及包含于其中的添加剂或用于非经肠施用的制剂及添加至其中的添加剂如上文所描述。制剂可为固体制剂、液体制剂及流化床制剂,但不限于此,且可施用但不限于展现预防、治疗及改善胃溃疡的功效的任何制剂。制剂如上文所描述。其他方面可提供一种用于制备具有以下的活性成分的方法:(1)预防、改善或治疗胃病的功效;及/或(2)对抗幽门螺杆菌的抗微生物功效,其包含干燥棒状杆菌属菌株及其培养产物。棒状杆菌属菌株及其培养产物如上文所描述。在一个实例中,干燥可通过至少一种选自由以下组成的组的方法进行:真空干燥、热空气干燥、冻干、环境空气干燥、薄膜干燥及/或真空干燥。在一个实例中,干燥可干燥其中将苏氨酸分别添加至棒状杆菌属菌株及其培养产物中的组合物。在一个实例中,用于制备活性成分的方法可进一步包含将苏氨酸分别添加至干燥之后所制备的干燥物质中。[有益效果]根据本申请的组合物在细胞实验中的抗幽门螺杆菌功效及动物实验中改善胃溃疡、胃黏液合成等的功效方面被证实为极佳的,且因此其可适用作预防或治疗胃病的药物组合物或用于预防或改善胃病的食品或饲料组合物。附图说明图1示出了第1组至第8组的对抗幽门螺杆菌的抗微生物活性。图2a至图2c示出了当使用幽门螺杆菌菌株处理以100MOI感染6小时的第1组至第8组的RGM1细胞时,量测炎症介质的表达的结果。具体地,图2a示出了根据经幽门螺杆菌菌株感染的RGM1细胞中的第1组至第8组的处理的Cox-2mRNA表达变化,且图2b示出了根据经幽门螺杆菌菌株感染的RGM1细胞中的第1组至第8组的处理的iNOS的蛋白质表达变化,且图2c示出了根据经幽门螺杆菌菌株感染的RGM1细胞中的第1组至第8组的处理的磷酸化NF-κBp65蛋白质表达变化。使用GAPDH及β-肌动蛋白分别作为mRNA及蛋白质的内部对照。在图2a至图6b中,N(自左侧起的第一列)表示阴性对照组(未经幽门螺杆菌处理的RGM1细胞),且H.p(自左侧起的第二列)表示阳性对照组(经幽门螺杆菌感染的RGM1细胞),且第1组至第8组表示其中第1组至第8组的组合物对经幽门螺杆菌感染的RGM1细胞进行处理的细胞中的结果。图3a示出了根据经幽门螺杆菌感染的RGM1细胞中的第1组至第8组的处理的氧化应激相关蛋白(HIF-1a)的表达变化。将β-肌动蛋白用作内部对照组。图3b示出了根据经幽门螺杆菌感染的RGM1细胞中的第1组至第8组的处理的测量细胞内活性氧的浓度变化的结果(DCF增加及减少结果)。图4a示出了根据经幽门螺杆菌感染的RGM1细胞中的第1组至第8组的处理的HO-1mRNA的表达变化,且图4b示出了根据经幽门螺杆菌感染的RGM1细胞中的第1组至第8组的处理的GST(pi)及HO-1蛋白表达变化。使用GAPDH及β-肌动蛋白作为内部对照组。图5示出了根据经幽门螺杆菌感染的RGM1细胞中的第1组至第8组的处理的细胞凋亡抑制功效。具体地,图5a示出了根据经幽门螺杆菌感染的RGM1细胞中的第1组至第8组的处理的Bax及Bcl-2蛋白质的表达变化,且将β-肌动蛋白用作内部对照组。图5b示出了根据经幽门螺杆菌感染的RGM1细胞中的第1组至第8组的处理的细胞凋亡变化(TUNEL染色结果)。图6示出了根据经幽门螺杆菌感染的RGM1细胞中的第1组至第8组的处理的血管生成及黏膜增殖生长因子的变化的结果。图6a示出了根据经幽门螺杆菌感染的RGM1细胞中的第1组至第8组的处理的TGF-β及VEGF蛋白的表达变化,且将β-肌动蛋白用作内部对照组。图6b示出了根据经幽门螺杆菌感染的RGM1细胞中的第1组至第8组的处理的β-连环蛋白蛋白质的表达变化,且将核纤层蛋白B用作内部对照组。在图7a至图10中,第1-4组指表5的动物实验组1-4。图7示出了在WIRS动物模型实验组中通过施用根据一个实例的组合物的应激相关的黏膜疾病(stress-relatedmucosaldisease;SRMD)改善功效。具体地,图7a示出了各实验组的胃的病理照片,且右侧的呈两条线的照片以×40放大率指示。图7b示出了通过在WIRS动物模型实验组中施用根据一个实例的组合物的(A)总体损伤指数(左上图),(B)炎症;病理性评分(右上图),(C)溃疡/糜烂;病理性评分(左下图),(D)再生;病理性评分(右下图)。图8示出了通过在WIRS动物模型实验组中施用根据一个实例的组合物的炎症、血管生成及信号传导的变化。(A)图8a示出了在动物实验组1-4中的iNOS、TNF-α及IFN-γmRNA的表达变化,且图8b示出了在动物实验组1-4中的PDGFmRNA的表达变化,且图8c示出了在动物实验组1-4中的p-IκBα蛋白质的表达变化,且图8d示出了在动物实验组1-4中的p-ERK及p-JNK蛋白质的变化。使用GAPDH及β-肌动蛋白分别作为mRNA及蛋白质的内部对照组。图9示出了通过在WIRS动物模型实验组中施用根据一个实例的组合物的细胞凋亡及细胞周期的变化的结果。具体地,图9a为示出了动物实验组1-4中的胃黏膜的SRMD区域中的细胞凋亡水平的TUNEL分析的结果,且图9b示出了PARP-1、Bcl-2、Bax、裂解的半胱天冬酶-8及裂解的半胱天冬酶-3的蛋白质表达变化,且图9c示出了CDK4及细胞周期蛋白D1的蛋白质表达变化。将β-肌动蛋白用作内部对照组。图10示出了动物实验组1-4的胃组织中的黏蛋白含量。图11示出了WIRS大鼠胃的病理性照片,其中施用包含各种重量%的苏氨酸的样品。图11的样品1至5的组合物及含量11揭示于表4中。具体实施方式在下文中,将通过实例详细地描述以帮助理解本申请。然而,以下实例说明本申请的内容,且本申请的范围不限于以下实例。提供本申请的实例以向所属领域中具有通常知识者更完整地描述本申请。实施例1.含棒状杆菌属菌株的组合物及细胞感染实施例1-1.含棒状杆菌属菌株的组合物制备为了验证抗幽门螺杆菌的功效差异、抑制细胞凋亡及含有棒状杆菌属菌株的菌株组合物的细胞保护以及棒状杆菌属菌株之间的功效,制备第1组至第8组的组合物。自CJCheilJedangBIOR&DCenter(Blossompark)提供谷氨酸棒状杆菌(Corynebacteriumglutamicum/C.glutamicum)、产氨棒状杆菌(Corynebacteriumammoniagenes/C.ammoniagenes)及有效棒状杆菌(Corynebacteriumefficiens/C.efficiens)的野生型菌株且使用,且将菌株接种至肉汤(broth)中以分别产生苏氨酸,且在200rpm下在35℃下培养48小时。用于产生苏氨酸的肉汤的组分及含量揭示于下表1中。[表1]组分浓度(每公升)葡萄糖70gKH2PO41g(NH4)2SO430gMgSO4·7H2O1gFeSO4·7H2O200mgMnSO4·4H2O100mg生物素1mg酵母提取物2.5g泛酸钙1mg盐酸硫胺素1mg碳酸钙30gpH6.8第1组包含发酵肉汤的上清液,其中已通过离心发酵肉汤移除微生物细胞,该发酵肉汤通过在以上条件下培养谷氨酸棒状杆菌制备,且第2组为包含浓度为100g/L的苏氨酸的缓冲液(Tris-HCl)。第3组至第5组通过离心发酵肉汤来制备,该发酵肉汤通过在以上条件下培养菌株以收集微生物细胞且将所收集的微生物细胞悬浮于缓冲液(Tris-HCl)中制备。第6组至第8组为其中各菌株在上述条件下培养的发酵肉汤,且包含各菌株及各菌株已在培养基中培养的培养产物(以表2中的“发酵肉汤的上清液”形式揭示)。第3组至第8组的组合物包含浓度为30OD(波长562nm)的各菌株,且包含菌株作为经由高压釜的热杀灭细菌。第1组至第8组均包含苏氨酸,且存在包含各菌株(包含于热杀灭细菌形式中)或培养产物中的苏氨酸的组,且因此,进一步添加苏氨酸(经由CJBIO菌株产生的苏氨酸;纯度>99%)以使得通过测量菌株及/或培养产物中的苏氨酸含量,第1组至第8组中的最终苏氨酸浓度为100g/L。各组的组分揭示于下表2中。在表2中,第1组及第6组的“发酵肉汤的上清液”指在通过在以上条件下培养“谷氨酸棒状杆菌属菌株”制备的培养产物中移除微生物细胞,且第7组及第8组的发酵肉汤的上清液指在通过在以上条件下培养“产氨棒状杆菌属菌株”及“有效棒状杆菌属菌株”制备的培养产物中移除微生物细胞。[表2]组组合物中的组分第1组苏氨酸+发酵肉汤的上清液第2组苏氨酸第3组苏氨酸+谷氨酸棒状杆菌第4组苏氨酸+产氨棒状杆菌第5组苏氨酸+有效棒状杆菌第6组苏氨酸+谷氨酸棒状杆菌+发酵肉汤的上清液第7组苏氨酸+产氨棒状杆菌+发酵肉汤的上清液第8组苏氨酸+有效棒状杆菌+发酵肉汤的上清液以下实施例2至7及图1至图6b中所揭示的第1组至第8组指表2的第1组至第8组。实施例1-2.大鼠胃黏膜细胞系培养在37℃细胞培养箱(95%空气,5%CO2)中,将正常大鼠的胃黏膜细胞系,RGM1细胞在HamF12混合培养基及包含10%胎牛血清的DMEM(杜氏改良必需培养基)中培养。RGM1细胞系通过JapanTsukubaUniversity的ProfessorMatsui建立,且在同意之后使用。实施例1-3.幽门螺杆菌菌株及细胞感染幽门螺杆菌(Helicobacterpylori/H.pylori)菌株(细胞毒素相关基因A[CagA]+菌株,NCTC11637)购自ATCC(美国菌种保藏中心(AmericanTypeCultureCollection),Rockville,MD)。幽门螺杆菌菌株在10%CO2条件下震荡培养,直至其在添加有5%小牛血清及抗生素的布氏肉汤(Brucellabroth)中呈1×108CFU/ml(OD600=1)。将RGM1细胞用幽门螺杆菌菌株以100:1的感染倍率(multiplicityofinfection;MOI)(下文中,100MOI)感染6小时。实施例2.含有棒状杆菌属菌株的组合物的抗螺杆菌功效的体外测试在血液琼脂盘中使用盘式扩散分析来量测幽门螺杆菌的生长抑制功效,亦即抗幽门螺杆菌功效。具体地,将TrypticaseTM大豆琼脂(TrypticaseTMSoyAgar;TSA)40g/L溶解于纯化水中且接着高压处理(121℃,20分钟)。冷却至约50℃之后,添加5%绵羊血液,且随后添加抗生素[三甲氧苄啶(5mg/L)、多黏菌素B(2500U/L)、万古霉素(10mg/L)]。将培养基在灭菌盘中等分为20至25ml,且接着储存在4℃下。将200μl幽门螺杆菌菌株溶液等分且涂铺于所制备的血液琼脂盘上,且将实施例1-1中所制备的第1组至第8组中的40μl各组合物吸收至各圆盘纸中,且在37℃的CO2培养箱中培养48小时,且随后测量盘中的透明区域的直径且展示于图1中(图中未呈现第1组的结果)。在图1中,“未经处理”指未由幽门螺杆菌感染的RGM1细胞。如图1中所示,证实第6组及第7组具有显著的抗螺杆菌活性,因为相比于未经处理的组,在第6组及第7组中,透明区域的直径数值显著较高。另外,将产生待用于以下实验中的第1-8组的适当浓度。其中实施例1-1中所制备的第1组至第8组的组合物稀释为1/4、1/40或1/100的稀释溶液以40μl分别经幽门螺杆菌处理,且测量细胞存活率。如在1/4的稀释浓度下,许多组中展示有0.5或更小的存活率,且在1/100的稀释浓度下,各组之间不存在明显结果差异,其中将与第1组相比展示显著结果差异的1/40的稀释溶液用于以下实验中。实施例3.含有棒状杆菌属菌株的组合物对炎症介质及转录其的NF-κB的变化的测试作为实施例1-3的方法,分别用40μl的经1/40稀释的第1组至第8组的组合物处理受幽门螺杆菌(100MOI)感染的RGM1细胞6小时。随后,在其中处理组合物的RGM1细胞中,经由反转录PCR(ReversetranscriptionPCR;RT-PCR)分析确认炎症介质,Cox-2mRNA的表达量,且结果显示于图2a中。特别地,使用TRIzol(GibcoBRL,Rockville,MD)提取RNA,且使用莫罗尼(moloney)鼠类白血病病毒逆转录酶(PerkinElmer,Morrisville,NC)将所提取的RNA合成为cDNA。用于PCR分析的各引物的核酸序列展示于下表3中,且使用甘油醛3-磷酸脱氢酶(glyceraldehyde3-phosphatedehydrogenase;GAPDH)作为内标。[表3]另外,在其中处理组合物的RGM1细胞中,经由蛋白质印迹分析证实iNOS蛋白质及转录其的NF-κBp65磷酸化的表达量的增加及减少,且结果展示于图2b及图2c中。特别地,通过处理组合物培养的细胞用磷酸盐缓冲盐水(phosphatebufferedsaline;PBS)溶液洗涤,且随后用细胞裂解缓冲液(150mMNaCl、0.5%TritonX-100、50mMtris-HCl,pH7.4、25mMNaF、20mM乙二醇-双(βN'-四乙酸、1mM二硫苏糖醇、1mMNa3VO4、蛋白酶抑制剂混合物片剂[Boehringer,Manneim,Germany])溶解以制备蛋白质裂解物。在通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodiumdodecylsulfate-polyacrylamidegelelectrophoresis;SDS-PAGE)对其进行电泳之后,将未折叠的蛋白质转移至PVDF膜(GelmanSciences,AnnArbor,MI)以分别使其与初级抗体及二级抗体反应,且接着使用化学发光系统对其进行分析。如图2a中所示,与正常RGM1细胞(N)相比,在受幽门螺杆菌(H.p)感染的RGM1细胞中,Cox-2mRNA显著增加,且通过添加第6组的组合物,Cox-2因幽门螺杆菌感染而增加的mRNA表达减少最显著。如图2b及图2c中所示,iNOS蛋白质表达及转录其的NF-κBp65的磷酸化通过幽门螺杆菌感染显著增加,但通过添加第6组的组合物,iNOS蛋白质表达及转录其的NF-κBp65的磷酸化降低最显著。由结果可见,根据一个实施例的组合物调节由螺状杆菌菌株介导的路径的炎症。实施例4.含有棒状杆菌属菌株的组合物对弱化氧化应激的功效的体外测试作为实施例1-3的方法,分别用40μl的经1/40稀释的第1组至第8组的组合物处理受幽门螺杆菌(100MOI)感染的RGM1细胞6小时。随后,通过与实施例3类似的方法进行蛋白质印迹法,且测量氧化应激相关的HIF-1α的表达量变化,且结果显示于图3a中。如图3a中所示,HIF-1a因幽门螺杆菌感染而显著增加,且HIF-1a表达在第6组及第7组中显著降低。另外,为测量细胞内反应性氧的浓度变化,用共焦成像器分析利用DCF-DA探针的DCF增强反应。当过氧化物存在于细胞中且展现绿色荧光时,通过活性氧(reactiveoxygenspecies;ROS)氧化非荧光物质2',7'-二氯化荧光黄二乙酸酯(2',7'-dichlorofluoresceindiacetate;DCF-DA),且因此可通过特定波长下的荧光强度对活性氧的量进行直接定量。特别地,将5×105个细胞/孔的RGM-1细胞(未经幽门螺杆菌处理的RGM1细胞;或受幽门螺杆菌(100MOI)感染的RGM1细胞(实施例1-3))等分至24孔盘中,且分别在37℃培养箱(95%空气,5%CO2)中培养过夜,且随后处理第1组至第8组的组合物持续一定时间。用DMEM洗涤细胞,且随后向培养基中添加10μg/ml2',7'-二氯荧光素二乙酸酯(DCF-DA;Sigma-Aldrich公司,StLouis,MO)且将其在培养箱中培育30分钟。在培养之后,观测用4℃的PBS洗涤的细胞且用荧光显微镜拍照,且结果展示于图3b中。如图3b中所示,证实在经幽门螺杆菌感染之后增加DCF-DA的荧光强度在第1、3、6及8处理组中统计学上显著降低(P<0.05),且在第6组处理组中,降低程度最大(P<0.01)。由此可见,根据一个实施例的组合物可立即解决由幽门螺杆菌菌株引起的氧化应激或低氧反应。实施例5.含有棒状杆菌属菌株的组合物对幽门螺杆菌相关的抗氧化介导细胞保护功效的体外测试作为实施例1-3的方法,分别用40μl的经1/40稀释的第1组至第8组的组合物处理受幽门螺杆菌(100MOI)感染的RGM1细胞6小时。接着,通过根据实施例3的方法(PCR)分析抗氧化功能的HO-1,代表性细胞保护因子的mRNA表达变化,且展示于图4a中,且类似于根据实施例3的方法(蛋白质印迹分析)分析HO-1及谷胱甘肽-S-转移酶(π)(glutathione-s-transferase(pi);GST)蛋白质表达变化且展示于图4b中。因此,如图4a及图4b,在对照组中,在幽门螺杆菌感染之后观测到HO-1mRNA及蛋白的显著减少,且在第6组至第8组处理组中,HO-1表达减少显著增加,且其中,在第6组处理组中,HO-1表达增加最显著。另外,如图中4b所示,在第6组及第7组中,GST(π)表达显著减少,且其中,在第6组处理组中,GST(π)表达减少最显著。由此可见,根据一个实施例的组合物呈现抗氧化作用,且细胞保护功效主要基于幽门螺杆菌菌株的HO-1反应。实施例6.含有棒状杆菌属菌株的组合物对幽门螺杆菌相关的细胞凋亡抑制功效的体外测试作为实施例1-3的方法,分别用40μl的经1/40稀释的第1组至第8组的组合物处理受幽门螺杆菌(100MOI)感染的RGM1细胞6小时。随后,通过类似于实施例3的方法,通过蛋白质印迹法确认Bcl-2及Bax的表达,且结果显示于图5a中,且通过TUNEL染色分析细胞凋亡,且结果展示于图5b中。具体地,通过1×105个细胞/腔室将细胞等分至Lab-Tek腔室载玻片上且接着在37℃培养箱(95%空气,5%CO2)中培养来进行TUNEL染色。随后,在处理各试剂一定时间之后,使用细胞凋亡检测试剂盒(OncogeneResearchProducts,Cambridge,MA)通过制造商的实验方法进行。将培养溶液移除且用PBS溶液洗涤3次,且随后添加4%多聚甲醛(paraformaldehyde;PFA),且将其在室温下固定20分钟。在再次用PBS洗涤两次之后,在4℃下处理0.1%TritonX-1005分钟,且阻挡光,且随后使其与通过混合末端脱氧核苷酰转移酶(terminaldeoxynucleotidyltransferase;TdT)与核苷酸混合物制成的溶液在37℃下反应60分钟。在用PBS洗涤之后,用荧光显微镜观测细胞凋亡。如图5a中所示,Bcl-2的表达减少及Bax的表达增加可在受幽门螺杆菌(H.p)感染的细胞中观测到,且可证实显著增加的Bax表达减少,且减少的Bcl-2表达在第6组至第8组处理组中增加,且其中在第6组处理组中,功效最佳。已知幽门螺杆菌感染通过细胞凋亡的显著增加而诱发黏膜损伤及溃疡,且如图5b中所示,由于TUNEL染色,通过幽门螺杆菌感染观测到细胞凋亡的统计学上显著增加(P<0.01),但在第6组至第8组处理组中,细胞凋亡显著减少,且其中,在第6组处理组中,细胞凋亡大部分减少。实施例7.通过含有棒状杆菌属菌株的组合物对幽门螺杆菌相关的细胞生长、血管生长及增殖因子的变化的体外测试作为实施例1-3的方法,分别用40μl的经1/40稀释的第1组至第8组的组合物处理受幽门螺杆菌(100MOI)感染的RGM1细胞6小时。接着,通过类似于实施例3的方法,通过蛋白质印迹法分析TGF-β及VEGF的变化,且结果显示于图6a中。因此,如图6a中所示,通过幽门螺杆菌感染增加的TGF-β及VEGF促进无差别黏膜增殖或癌性炎症,但在第6组至第8组处理组中,TGF-β及VEGF的表达显著降低,且具体地,在第6组处理组中,TGF-β及VEGF的表达大部分减少。由此,显示出根据一个实施例的组合物可缓解由幽门螺杆菌感染所致的所有炎症或癌变的结果。另外,通过蛋白质印迹法,利用经幽门螺杆菌感染的细胞中的核级分证实β-连环蛋白的核转移,且结果展示于图6b中。如图6b中所示,证实通过幽门螺杆菌感染增加的β-连环蛋白的核转移可通过处理第6组显著抑制。通过经由T测试的方法以统计方式验证实施例1至7的所有实验值,且p<0.05或更大定义为统计显著的。实施例8.制备包含苏氨酸的样品将通过接种谷氨酸棒状杆菌野生型菌株(CJCheilJedangBIOR&DCenter(Blossompark))至肉汤以产生苏氨酸(表1)且在35℃及200rpm的条件下培养48小时来制备的发酵肉汤纯化且使其结晶以制备样品1。样品1包含99重量%或更大的呈粉末形式的纯化苏氨酸。将通过在培养基中培养谷氨酸棒状杆菌以产生苏氨酸来获得的发酵肉汤(包含谷氨酸棒状杆菌)直接干燥(在60℃至70℃下热空气干燥)以制备样品2。另外,将木质素磺酸钙(Aladdinindustrial公司,Shanghai,China)添加至通过在以上条件下以各种含量培养谷氨酸棒状杆菌所获得的发酵肉汤,且对其中添加木质素磺酸钙的发酵肉汤(包含谷氨酸棒状杆菌)进行干燥(在60至70℃下热空气干燥)以制备样品3至5。样品2至5包含经由热空气干燥而呈热杀灭细菌形式的谷氨酸棒状杆菌。以粒度为约200至1000μm的颗粒形式制备样品2至5。样品1至5的组分及含量揭示于表4中。在表4中,苏氨酸(重量%)、木质素磺酸钙(重量%)及发酵产物(包含谷氨酸棒状杆菌微生物细胞)的其他组分(重量%)指通过干燥发酵肉汤制备的干燥物质中的重量%,且干燥物质中的发酵产物包含谷氨酸棒状杆菌属菌株。另外,发酵产物中所包含的谷氨酸棒状杆菌菌株的含量揭示于表4中。[表4]1当干燥发酵产物中微生物细胞的含量时的转化的值实施例9.应激相关黏膜疾病(SRMD)的浸水束缚应激(Waterimmersion-restraintstress;WIRS)模型制备总计110只SD大鼠购自CharlesRiver(Osaka,Japan)且储存于动物设施中。在经授权动物设施中根据AAALAC国际动物照护政策(AAALACInternationalAnimalCarePolicies)处理实验动物。动物在暴露于WIRS之前禁食24小时,且水为自由取用。将各组的10只大鼠置放于用于WIRS的笼中且浸没于水中6小时。在WIRS处理之前8小时向大鼠经口施用实施例8中所制备的样品1至样品5,以使得施用相同量的苏氨酸(0.15重量%/饮食),且在施用WIRS6小时之后,处死动物且取出并切开胃且移出内容物,对胃的内表面拍照且将照片展示于图11中。如图11中所示,由于通过肉眼观测大鼠的胃组织,可证实在WIRS诱导组中(图11中的第二列)引起胃出血,且胃出血的程度以样品1<样品5<样品4<样品3或样品2的顺序降低(胃溃疡的极佳治疗功效)。另一方面,如下表5中所指示,通过分成4个动物实验组进行以下实验。将其分成其中经口施用盐水溶液之后未作处理的未经处理组(阳性对照组,动物实验组1);其中施用WIRS6小时的WIRS组(阴性对照组,动物实验组2);及动物实验组,其中在WIRS处理前8小时,分别以30mg/kg体重经口处理含有0.15重量%的样品1(实施例8中制备)的饲料(动物实验组3)及含有0.21重量%的样品3(实施例8中制备)的饲料(动物实验组4)。动物实验组3及4的饲料中的L-苏氨酸(L-Thr)的含量同等地设定为0.15重量%/饮食。[表5]在WIRS6小时之后,用高剂量麻醉剂(硫喷妥钠,50mg/kg)处死所有实验动物(大鼠)。以下实施例10至12中所揭示的动物实验组1-4指表5及图7a至图10中的动物实验组1-4,第1-4组指表5的动物实验组1-4。实施例10.SRMD(应激相关的黏膜疾病)改善功效的测试将实施例9中处死的大鼠的胃切开且沿较大曲线打开,且随后用冷PBS溶液洗涤。在通过放大照片测定糜烂或溃疡的数目及尺寸之后,解剖一半用于结构观测。将切开的胃铺展于塑料薄片上,且以10%福尔马林缓冲液固定4小时且用于产生石蜡组织切片,且将另一半储存于液氮槽中进行分子生物观测。另外,通过混合相同动物实验组储存黏膜组织匀浆物。使用显微镜通过裸眼且在对照组及各实验组(动物实验组1至4)中观测胃样品(图7a),计算总体损伤指数、炎症;病理性评分、溃疡/糜烂;病理性评分、再生;病理性评分且展示于图7b中。如图7a中所示,在动物实验组2的所有大鼠中展示SRMD,诸如糜烂、出血及溃疡的显著出现,但在动物实验组3及动物实验组4中,SRMD得到显著改善。如图7b中所示,在动物实验组3及4中,总体损伤指数、炎症;病理性评分、溃疡/糜烂;病理性评分、再生;病理性评分显著改善(p<0.05),且特别地,动物实验组4的总体损伤指数及再生显著低于动物实验组3;相比于动物实验组3,病理性评分显著改善。实施例11.抗炎功效的测试由于SRMD在生理学上与缺血性再灌注损伤相关,因此在动物实验组1至4中,测量包括血小板衍生生长因子(platelet-derivedgrowthfactor;PDGF)的血管生成生长因子的mRNA表达及炎症介质的mRNA表达、iNOS、TNF-α、IFN-γ及PDGF,且结果显示于图8a及图8b中。具体地,全部RNA使用RNeasyMini试剂盒(QiagenKorea,Seoul,Korea)提取。用于测量炎性细胞因子及介质的表达的引物显示于下表6中。使用10×反应缓冲液(PromegaKorea,Seoul,Korea)、1.5mM/LMgCl2、200mM/L三磷酸脱氧核苷酸(deoxynucleotidetriphosphate;dNTP)、各引物1mM/L及TaqDNA聚合酶(Promega)2.5单位,使用Perkin-ElmerGeneAmpPCR系统2400分析扩增。各循环由以下构成:在95℃下变性1分钟,在55℃下退火45分钟及在72℃下扩增45秒。[表6]另外,在动物实验组1-4中的每一个中,测量p-IκBα、p-ERK及p-JNK的蛋白质含量且展示于图8c及图8d中。具体地,为了进行蛋白质印迹法以测量蛋白质含量,将收集的胃黏膜在含有2mM乙二胺四乙酸(ethylenediaminetetraaceticacid;EDTA)、0.5mM乙二醇四乙酸(ethyleneglycoltetraaceticacid;EGTA)、300mM蔗糖及2mM苯甲基磺酰基氟(phenylmethylsulfonylfluoride;PMSF)的冰冷20mMTris-HCl缓冲液(pH7.5)中通过组织匀浆器均质化。在8%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)凝胶中进行30μg蛋白质电泳之后,使用半干式转移系统(Hoefer,Holliston,MA,USA)将其转移至聚偏二氟乙烯(polyvinylidenefluoride;PVDF)膜中。通过与5%脱脂奶粉一起培育来阻断非特异性结合。将膜与初级抗体的500倍稀释溶液一起在4℃下恒温培育过夜,且随后与1:1000稀释的辣根过氧化酶(horseradishperoxidase;HRP)结合的二级抗体一起培育。使用ECL检测试剂盒(AmershamBiosciencesKorea,Seoul,Korea)检测免疫复合物且自动照射X射线膜。用于蛋白质印迹法的抗体如下。β-肌动蛋白、氧化氮合酶((nitricoxidesynthase;iNOS)、环加氧酶(cyclooxygenase;COX-2)、磷-JNK(phosphor-JNK;P-JNK)、磷-ERK(phosphor-ERK;P-ERK)、B细胞淋巴瘤2(B-celllymphoma2;Bcl-2)、B细胞淋巴瘤-2-相关的X-蛋白质(B-celllymphoma-2-associatedX-protein;Bax)及细胞周期蛋白D1抗体购自SantaCruzBiotechnology(SantaCruz,CA)。κBα的磷酸化抑制剂(phosphorylatedinhibitorofkappaBalpha;p-IκBα)、磷酸化信号转导子及转录活化子3(phosphorylatedsignaltransducerandactivatoroftranscription3;p-STAT3)、聚(ADP-核糖)聚合酶(poly(ADP-ribose)polymerase;PARP)、细胞周期蛋白依赖性激酶4(cyclin-dependentkinase4;CDK4)及细胞周期蛋白依赖性激酶2(cyclindependentkinase2;CDK2)购自CellSignalingTechnology(Beverly,MA)。血红素加氧酶-1(hemeoxygenase-1;HO-1)抗体购自EnzolifeSciences(Farmingdale,NY)。如图8a中所示,在动物实验组2(WIRD诱发的SRMD)中,iNOS、TNF-α及干扰素γ(interferongamma;IFN-γ)的mRNA表达显著增加,但在动物实验组3或动物实验组4中,增加的炎症介质(iNOS、TNF-α、IFN-γ)的表达显著减少(P<0.01或P<0.05,图8a),且特别地,相比于动物实验组3,在动物实验组4中的TNF-α及IFN-γ的表达显著减少(P<0.05,图8a)。如图8b中所示,在动物实验组2中血管生成生长因子,PDGF的表达显著增加,但其在动物实验组3或动物实验组4中显著降低(P<0.01,图8b),且特别地,在动物实验组4中,降低程度较高。如图8c中所示,作为测量蛋白质含量下p-IκBα的表达的结果,p-IκBα的表达通过WIRS在动物实验组2中显著减少,且p-IκBα表达的减少与NF-κB的转录活化相关。同时,减少的p-IκBα的表达显著增加(P<0.01,图8c),且相比于动物实验组3,p-IκBα的表达在动物实验组4中显著增加(P<0.01,图8c),且p-IκBα的表达增加诱导NF-kB氧化还原抑制。另一方面,关于与缺血及炎症相关的信号传导,如图8d中所示,在动物实验组2中,展示p-ERK及p-JNK活化,且在动物实验组4中,信号传导均不活化,但在动物实验组3中,其部分不活化(P<0.01)。实施例12.测试胃黏膜保护功效因为引起糜烂或溃疡的SRMD展示细胞凋亡在相应区域中增加,所以根据动物实验组测量胃黏膜上的细胞凋亡。具体地,使用TdTFragELDNA片段化检测试剂盒(OncogeneResearchProducts,Cambridge,MA)及末端脱氧核苷酸转移酶介导的缺口末端标记(Terminaldeoxynucleotidyltransferase-mediatednickendlabeling;TUNEL)方法可视化细胞凋亡。为了通过发现细胞凋亡以较大数量出现在各实验组中的区域(凋亡热点)来测量细胞凋亡指数(apoptoticindex;AI),将TUNEL免疫染色切片(末端脱氧核苷酸转移酶介导的dUTP缺口末端标记(TUNEL)-免疫染色切片)扩大100倍且进行扫描。接着,在400个视野中对TUNEL阳性细胞的数目进行计数以记录AI。通过在包括糜烂性或溃疡病变的片段中随机选择至少5个热点来测定平均系数,且结果展示于图9a中,且通过总细胞数目的平均百分比指示结果。如图9a中所示,相比于动物实验组1,细胞凋亡在动物实验组2中显著增加,且相比于动物实验组2,在动物实验组3及动物实验组4中增加的细胞凋亡程度显著减少(P<0.01,图9a),且相比于动物实验组3,其在动物实验组4中以显著更低含量观测到(P<0.01,图9a)。为验证TUNEL结果,对于防止凋亡的蛋白质Bcl-2及诱导细胞凋亡的裂解的PARP、Bax、裂解的半胱天冬酶-8及裂解的半胱天冬酶-3的表达,通过实施例11的方法进行蛋白质印迹分析,且结果展示于图9b中。如图9b中所示,在动物实验组2中,PARP分裂、Bax、裂解的半胱天冬酶-8及裂解的半胱天冬酶-3的表达显著增加,且增加的PARP分裂、Bax、裂解的半胱天冬酶-8及裂解的半胱天冬酶-3表达在动物实验组3及4中显著减少,且相比于动物实验组3,特别地,其在动物实验组4中被观测到呈显著较低含量。另一方面,在动物实验组4中,Bcl-2,防止细胞凋亡的蛋白质的表达显著增加(图9b)。通过根据实施例11的方法在蛋白质含量下确认CDK4及细胞周期相关基因,细胞周期蛋白D1的活性,且结果显示于图9c中。如图9c中所示,在动物实验组2中CDK4及细胞周期蛋白D1的表达显著增加(P<0.01),且在动物实验组3及4中增加的CDK4及细胞周期蛋白D1的表达显著减少。特别地,相比于动物实验组3,在动物实验组4中的CDK4及细胞周期蛋白D1的表达显著更低(图9c,P<0.01到0.05)。在动物实验组1至4的胃组织中,通过PAS染色确认黏蛋白含量,且结果展示于图10中。如图10中所示,在动物实验组2中观测到胃黏蛋白呈显著较低含量(P<0.01),且胃黏黏膜的表达在动物实验组3及4中得到显著保留,且黏膜的表达在动物实验组4中显著高于动物实验3(P<0.01)。根据以上结果可见,黏膜完整性受WIRS威胁,但此威胁通过根据一个实施例预处理组合物(样品)来缓解。实施例8至11的结果由平均值±SD表示。通过单因素方差分析(one-wayanalysisofvariance;ANOVA)来分析数据,且各组之间的统计显著性通过邓肯氏多重范围测试(Duncan'smultiplerangetest)测定。统计显著性会聚于P<0.05。根据以上描述,本申请所属领域中的技术人员将理解,本申请可以其他特定形式实施而不改变其技术精神或基本特征。就此而言,应理解,上文所描述的实施例在所有方面中为例示性而非限制性。本申请的范围应解释为以下权利要求书的含义及范围,而非以上实施方式,且来源于等效概念的所有修改或经修改形式均包括于本申请的范围中。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1