一种郁金多糖在调控益生菌增殖方面的应用
1.本发明涉及多糖技术领域,特别是涉及一种郁金多糖在调控益生菌增殖方面的应用。
背景技术:
2.肠道菌群失调可能会影响人体大脑、骨骼以及心血管健康,从而引发阿尔兹海默症、骨质疏松和心血管疾病,而益生元可以通过调节肠道菌群在一定程度上预防甚至治疗这些症状。多糖为一种结构复杂,具有多种生物学活性的一类天然产物,且具有来源广泛、毒副作用小的优点,因而备受研究者的重视。
3.郁金,为姜科植物,是以植物块根入药的中药材,其内含有多种天然的活性成分,比如:多糖和蛋白质,对于郁金多糖的提取纯化都有相关报道,但是没有关于郁金多糖在调控益生菌增殖方面的相关报道。
技术实现要素:
4.本发明的目的是提供一种郁金多糖在调控益生菌增殖方面的应用,以解决上述现有技术存在的问题,通过预冷和冷冻的方式提高郁金多糖的纯化度,并以此作为益生元药物和/或保健品的活性成分,可调控益生菌增殖,促进益生菌的繁殖和代谢,进而利于降低产生肠道失调以及由于肠道失调所引起的相关疾病的几率。
5.为实现上述目的,本发明提供了如下方案:
6.本发明提供一种郁金多糖在益生元药物或保健食品中作为活性成分调控益生菌增殖中的应用,所述益生菌包括短乳杆菌、植物乳杆菌、德氏乳杆菌保加利亚亚种和嗜热链球菌。
7.优选的是,所述郁金多糖的制备方法包括以下步骤:
8.将郁金在沸水中煮提,过滤,得到煮提液;
9.将所得煮提液用乙醇溶液沉淀,得到多糖沉淀;
10.将所得多糖沉淀进行冷冻干燥,得到郁金多糖。
11.优选的是,所述郁金与18~20倍水混合后,煮沸,并且保持沸水煮提20~30min。
12.优选的是,所述煮提液与乙醇的体积比为1:2~3,所述乙醇的质量分数为60%。
13.优选的是,所述冷冻的条件为:温度为-20℃冻融10~12h。
14.优选的是,在郁金进行煮提之前还包括预冷和粉碎的过程,所述预冷为将郁金在-4℃~0℃预冷1~2h,然后将其粉碎成颗粒状。
15.优选的是,所述郁金多糖调控益生菌增殖的质量浓度为0.5%-1%。
16.本发明公开了以下技术效果:
17.本发明通过先于-4℃~0℃预冷郁金,可以降低细胞活力和代谢能力,并且由于温度的迅速下降和持续的预冷过程,会导致细胞间隙以及细胞内的水分部分结冰,形成冰晶造成细胞的机械损伤,然后再加上粉碎过程,可以促进细胞的充分破坏,增加郁金多糖的释
放。之后结合沸水煮提和乙醇沉淀的方式,去除杂质析出多糖沉淀,再经冷冻干燥去除表面溶剂得到干燥的郁金多糖,备用。通过此方法得到的郁金多糖纯度高,并且将其直接与益生菌混合培养,发现郁金多糖可以明显促进短乳杆菌、植物乳杆菌、德氏乳杆菌保加利亚亚种和嗜热链球菌的生长增殖,并且在多糖浓度为1%时,促进益生菌增殖的效果最佳。因此,本发明通过体外培养方式研究了郁金多糖对四种益生菌的增殖影响,为郁金多糖在益生元药物、保健品中的应用提供参考依据。
附图说明
18.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
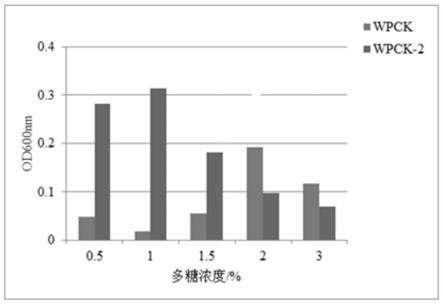
19.图1为纯化前和纯化后的郁金多糖对短乳杆菌的增殖作用;wpck:纯化前的郁金多糖;wpck-2:纯化后的郁金多糖;
20.图2为纯化前和纯化后的郁金多糖对植物乳杆菌的增殖作用;wpck:纯化前的郁金多糖;wpck-2:纯化后的郁金多糖;
21.图3为纯化前和纯化后的郁金多糖对德氏乳杆菌保加利亚亚种的增殖作用;wpck:纯化前的郁金多糖;wpck-2:纯化后的郁金多糖;
22.图4为纯化前和纯化后的郁金多糖对嗜热乳杆菌的增殖作用;wpck:纯化前的郁金多糖;wpck-2:纯化后的郁金多糖;
23.图5为郁金多糖对短乳杆菌生长速率的影响;wpck:纯化前的郁金多糖;wpck-2:纯化后的郁金多糖;
24.图6为郁金多糖对植物乳杆菌生长速率的影响;wpck:纯化前的郁金多糖;wpck-2:纯化后的郁金多糖;
25.图7为郁金多糖对德氏乳杆菌保加利亚亚种生长速率的影响;wpck:纯化前的郁金多糖;wpck-2:纯化后的郁金多糖;
26.图8为郁金多糖对嗜热乳杆菌生长速率的影响;wpck:纯化前的郁金多糖;wpck-2:纯化后的郁金多糖;
27.图9为郁金多糖对短乳杆菌培养用培养基ph值的影响;wpck:纯化前的郁金多糖;wpck-2:纯化后的郁金多糖;
28.图10为郁金多糖对植物乳杆菌培养用培养基ph值的影响;wpck:纯化前的郁金多糖;wpck-2:纯化后的郁金多糖;
29.图11为郁金多糖对德氏乳杆菌保加利亚亚种培养用培养基ph值的影响;wpck:纯化前的郁金多糖;wpck-2:纯化后的郁金多糖;
30.图12为郁金多糖对嗜热乳杆菌培养用培养基ph值的影响;wpck:纯化前的郁金多糖;wpck-2:纯化后的郁金多糖。
具体实施方式
31.现详细说明本发明的多种示例性实施方式,该详细说明不应认为是对本发明的限
制,而应理解为是对本发明的某些方面、特性和实施方案的更详细的描述。
32.应理解本发明中所述的术语仅仅是为描述特别的实施方式,并非用于限制本发明。另外,对于本发明中的数值范围,应理解为还具体公开了该范围的上限和下限之间的每个中间值。在任何陈述值或陈述范围内的中间值以及任何其他陈述值或在所述范围内的中间值之间的每个较小的范围也包括在本发明内。这些较小范围的上限和下限可独立地包括或排除在范围内。
33.除非另有说明,否则本文使用的所有技术和科学术语具有本发明所述领域的常规技术人员通常理解的相同含义。虽然本发明仅描述了优选的方法和材料,但是在本发明的实施或测试中也可以使用与本文所述相似或等同的任何方法和材料。本说明书中提到的所有文献通过引用并入,用以公开和描述与所述文献相关的方法和/或材料。在与任何并入的文献冲突时,以本说明书的内容为准。
34.在不背离本发明的范围或精神的情况下,可对本发明说明书的具体实施方式做多种改进和变化,这对本领域技术人员而言是显而易见的。由本发明的说明书得到的其他实施方式对技术人员而言是显而易见的。本技术说明书和实施例仅是示例性的。
35.关于本文中所使用的“包含”、“包括”、“具有”、“含有”等等,均为开放性的用语,即意指包含但不限于。
36.实施例1郁金多糖的提取、纯化
37.取桂郁金先放置于-4℃下预冷1h,然后粉碎成颗粒状(80目);
38.取粉碎的桂郁金颗粒与18倍体积的纯蒸水混合,煮沸,并且保持沸水煮提20min,过滤,得到第一过滤液;再将过滤得到的滤渣,用同样方法煮提,过滤,得到第二过滤液,合并第一过滤液和第二过滤液,得到煮提液;
39.将所得煮提液与质量分数为60%的乙醇按照体积比1:2混合,静置,待大量沉淀析出,收集得到多糖沉淀;将所得的多糖沉淀在-20℃冻融10h,得到郁金多糖。
40.实施例2郁金多糖的提取、纯化
41.取桂郁金先放置于-4℃下预冷1.5h,然后粉碎成颗粒状(80目);
42.取粉碎的桂郁金颗粒与19倍体积的纯蒸水混合,煮沸,并且保持沸水煮提25min,过滤,得到第一过滤液;再将过滤得到的滤渣,用同样方法煮提,过滤,得到第二过滤液,合并第一过滤液和第二过滤液,得到煮提液;
43.将所得煮提液与质量分数为60%的乙醇按照体积比1:2.5混合,静置,待大量沉淀析出,收集得到多糖沉淀;将所得的多糖沉淀在-20℃冻融13h,得到郁金多糖。
44.实施例3郁金多糖的提取、纯化
45.取桂郁金先放置于-4℃下预冷2h,然后粉碎成颗粒状(80目);
46.取粉碎的桂郁金颗粒与20倍体积的纯蒸水混合,煮沸,并且保持沸水煮提30min,过滤,得到第一过滤液;再将过滤得到的滤渣,用同样方法煮提,过滤,得到第二过滤液,合并第一过滤液和第二过滤液,得到煮提液;
47.将所得煮提液与质量分数为60%的乙醇按照体积比1:3混合,静置,待大量沉淀析出,收集得到多糖沉淀;将所得的多糖沉淀在-20℃冻融15h,得到郁金多糖。
48.以下将以实施例1纯化前和纯化后的多糖进行对益生菌增殖方面的影响的相关试验,其中,纯化前的多糖即所得的煮提液,将煮提液40℃烘干至去除大部分的水分后,-20℃
冷冻干燥10h,得到纯化前郁金多糖。
49.以下试验例所用短乳杆菌、植物乳杆菌、德氏乳杆菌保加利亚亚种和嗜热链球菌四种益生菌的培养基以及培养方法等如下所示:
50.(1)活化四种益生菌所用基础培养基:将mrs培养基加蒸馏水至1000ml煮沸至完全溶解,调节ph=6.5,121℃下高温灭菌20min。实验培养基将葡萄糖替换为一定浓度的多糖样品。
51.四种益生菌培养基成分
[0052][0053]
(2)菌种活化:配制100ml mrs培养基,121℃灭菌20min,取200μl甘油保存的菌液接种于对应培养基中于37℃条件下培养48h,活化三次,培养液备用。
[0054]
试验1纯化前和纯化后的郁金多糖对四种益生菌增殖的调节作用
[0055]
用质量浓度分别为0%、0.5%、1%、1.5%、2%、3%(培养基体积为3.5ml)的纯化前和纯化后郁金多糖样品代替葡萄糖,然后分别接种1%充分活化的短乳杆菌、植物乳杆菌、德氏乳杆菌保加利亚亚种和嗜热链球菌中,37℃培养48h后检测od
600nm
和ph值,做三个平行试验。同时确定最佳多糖浓度。
[0056]
本实验研究了不同浓度的纯化前、后的郁金多糖对短乳杆菌、植物乳杆菌、德氏乳杆菌保加利亚亚种和嗜热链球菌生长增殖的影响。结果如图1-4所示,显示纯化前和纯化后的郁金多糖对于以上四种益生菌的生长繁殖均具有一定的促进作用,且培养基中添加的郁金多糖浓度不同,对益生菌的促生长效果也不同。在多糖浓度为1%~2%时,纯化前郁金多糖促进短乳杆菌、植物乳杆菌和德氏乳杆菌保加利亚亚种三种菌株增殖的效果随多糖浓度的增加而增强,当多糖浓度≥2%时,促进益生菌增殖的效果有所下降;在多糖浓度为0.5%~1%时,同等浓度下纯化后的郁金多糖对四种菌株的均具有促生长作用,且要大于纯化前的郁金多糖,在浓度为2%~3%时,作用效果没有纯化前明显。因此,纯化前、后的郁金多糖对四种益生菌的促增殖最佳质量浓度分别为2%和1%。
[0057]
试验2纯化前和纯化后的郁金多糖对四种益生菌生长曲线的影响
[0058]
通过上述试验1方法筛选促进四种菌种增殖的最佳质量浓度,选用最佳浓度的多糖样品(培养基体积为5ml),分别接种在1%活化后的四种菌悬液中,37℃培养,前24小时内间隔2小时、后24小时间隔6小时取100μl发酵液分别测定od
600nm
值,每隔6小时测定一次发酵液ph值,每组3个重复,以fos作为阳性对照。以时间为横坐标,od
600nm
值和ph值为纵坐标,绘制微生物生长曲线和微生物产酸曲线。
[0059]
由图5-8可知,纯化前和纯化后的郁金多糖对四种益生菌均具有一定的促生长作用。说明这四种益生菌的生长进入稳定期。以上实验结果表明,wpck和wpck-2均对益生菌的生长起促进作用。
[0060]
试验3纯化前和纯化后的郁金多糖对四种益生菌培养基ph值的影响
[0061]
操作方法与上述试验2(四种益生菌生长曲线测定)方法一致,分别在不同时间段取培养基检测ph值。益生菌的生长繁殖过程中通常会产生酸性代谢物,进而引起培养基ph值的变化。因此,探究桂郁金多糖对上述四种益生菌菌株产酸能力的影响。
[0062]
结果如图9-12所示,接种了这四种益生菌的培养基在添加纯化前和纯化后的郁金多糖后,培养基ph值会随着培养时间的增加而有所降低,说明上述四种益生菌菌株均可以利用纯化前和纯化后的郁金多糖,并作为碳源来促进自身的生长繁殖,产生了酸性代谢物。进一步证明,纯化前和纯化后的郁金多糖可以促进四种益生菌的增殖。
[0063]
以上所述的实施例仅是对本发明的优选方式进行描述,并非对本发明的范围进行限定,在不脱离本发明设计精神的前提下,本领域普通技术人员对本发明的技术方案做出的各种变形和改进,均应落入本发明权利要求书确定的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1