一种基于电子辐照的人参保鲜的方法
1.本发明属于食品保鲜技术领域,具体涉及一种利用电子辐射技术的人参保鲜的方法。
背景技术:
2.中国是人参种植大国,开展人参采后生理与保鲜技术研究对人参产业发展意义重大。和其它中药材相比,国内、外人参采后生理与保鲜技术的研究相对滞后,主要集中在上世纪八九十年代。到目前为止,人参保鲜技术尚未广泛应用。因此,需加大人参采后生理与保鲜技术研究的广度和深度。鲜人参消费对产品质量要求较高,农药残留和重金属含量不能超标,我国的自然资源优势为提供鲜人参增加了优势,大力发展鲜参制品产业,市场前景广阔,但同时由于地域广阔,鲜参采收后,贮藏和运输到南方市场受到一定的局限,南方居民几乎无法食到新鲜的人参,因此,限制了鲜参的全年各地供应,进而抑制了鲜人参产业化发展。目前,国内、外关于人参的保鲜技术主要集中在气调贮藏、辐照保鲜、超高压保鲜、冷冻贮藏和生物保鲜剂贮藏等方面,然而,随着多领域发展,贮藏保鲜技术也正在由单一方法向复合方法方向转化。因此,随着科技的进步和食品工业快速发展,人们定能找到更高效,更安全同时经济的人参保鲜贮藏技术,为人们提供更安全,更新鲜的人参产品。
技术实现要素:
3.本发明的目的是为了提供一种有效的人参保鲜的方法。
4.本发明提供了一种基于电子辐照的人参保鲜的方法,所述方法是将人参进行电子辐射处理,然后放置于冷库贮藏。
5.进一步地限定,所述电子辐射的吸收剂量为2.0-4.0kgy。
6.进一步地限定,所述电子辐射的吸收剂量为2.0kgy。
7.进一步地限定,所述电子辐射处理处理的时间为40-60s。
8.本发明提供了一种减少人参总皂苷含量的损失的方法,所述方法是将人参进行电子辐射处理,然后放置于冷库贮藏。
9.本发明提供了一种提高人参总多糖含量的方法,所述方法是将人参进行电子辐射处理,然后放置于冷库贮藏。
10.本发明提供了一种提高人参中酶活力的方法,所述方法是将人参进行电子辐射处理,然后放置于冷库贮藏。
11.进一步地限定,所述电子辐射的吸收剂量为2.0-4.0kgy。
12.进一步地限定,所述电子辐射处理处理的时间为40-60s。
13.本发明提供了上述的方法获得的人参。
14.有益效果:采用60co-γ辐照与电子束辐照两种方式,辐照剂量均为2kgy和4kgy,对鲜人参进行辐照处理后,分别于60d和120d时对鲜人参取样进行品质评价。结果表明,在整个贮藏期间,大多数单体皂苷的含量随辐照剂量的增加而减少,60co-γ辐照与电子束辐
照的鲜人参总皂苷含量均随辐照剂量的增加减少,辐照和未辐照鲜人参样品中核苷类成分含量存在显著差异(p《0.05)。贮藏时间为120d时,2kgy的电子束辐照处理的鲜人参腐烂率最低,总皂苷含量最高,电子束辐照剂量为4kgy时,鲜人参贮藏后总多糖含量显著增加(p《0.05),总多糖的含量最高。4kgy的60co-γ辐照后sod活力显著增加(p《0.05),60co-γ辐照和电子束辐照剂量达4kgy时,对鲜人参中的氨基酸含量造成影响,大多数氨基酸含量随辐照剂量的增加而降低。整体看来,较低的辐照剂量和低温相结合是延长鲜人参贮藏时间的有效条件。
附图说明
15.图1人参总皂苷标准曲线,其中,横坐标是浓度,纵坐标是od值;
16.图2为不同辐照方式对鲜人参总皂苷含量的影响,其中,a-b相同上标字母表示贮藏后与贮藏前相比无显著性差异,否则有显著性差异(p《0.05);a-b相同上标字母表示同一贮藏时间内与对照相比无显著性差异,否则有显著性差异(p《0.05);x-y相同上标字母代表组内无无显著性差异,否则有显著性差异(p《0.05);
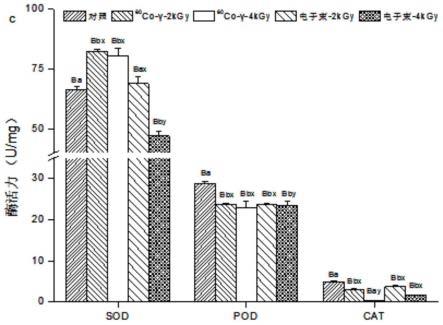
17.图3为人参皂苷混合对照品(a)及人参样品(b)的uplc图;
18.图4为人参总多糖标准曲线,其中,横坐标是浓度,纵坐标是od值;
19.图5为不同辐照方式对鲜人参总多糖含量的影响,其中,a-b相同上标字母表示贮藏后与贮藏前相比无显著性差异,否则有显著性差异(p《0.05);a-b相同上标字母表示同一贮藏时间内与对照相比无显著性差异,否则有显著性差异(p《0.05);x-y相同上标字母代表组内无无显著性差异,否则有显著性差异(p《0.05);
20.图6为氨基酸混合对照品(a)及人参样品(b)图,其中,1:天冬氨酸;2:苏氨酸;3:色氨酸;4:谷氨酸;5:脯氨酸;6:甘氨酸;7:丙氨酸;8:半胱氨酸;9:val;10:甲硫氨酸;11:异亮氨酸;12:亮氨酸;13:酪氨酸;14:苯丙氨酸;15:赖氨酸;16:组氨酸;17:精氨酸;
21.图7为不同辐照方式对鲜人参sod、pod和cat酶活力的影响;
22.图8为核苷类成分对照品(a)及人参样品(b)的uplc图,其中,1-胞嘧啶;2-尿嘧啶;3-腺嘌呤;4-鸟嘌呤;5-次黄嘌呤;6-2,6-黄嘌呤;7-尿苷;8-胸腺嘧啶;9-肌苷;10-鸟苷;11-腺苷;12-2
′‑
脱氧鸟苷;13-β-胸苷;
23.图9为表5人参单体皂苷含量;
24.图10为表6人参氨基酸含量;
25.图11为表8鲜人参中核苷类成分含量。
具体实施例
26.实验材料:供试鲜人参(6年生)采自吉林省抚松市人参种植基地,将收获的鲜人参按照大小、形状、外观进行分类筛选,置于室温预冷24h,选择无病、无伤的鲜人参用纸箱包装进行辐照处理。
27.实验仪器:本实验所用仪器见表1。
28.表1主要实验仪器
[0029][0030]
实验试剂:本实验所用试剂见表2。
[0031]
表2主要试剂
[0032][0033][0034]
实施例1.一种基于电子辐照的人参保鲜的方法
[0035]
将纸箱包装的供试鲜人参,分别在吉林省长春市中长春中科英华高技术股份有限公司的电子加速器中电子束辐照处理,设定吸收剂量均为2.0和4.0kgy,处理40-60s。
[0036]
用直径5mm的丙氨酸剂量计进行实际剂量测定,电子束辐照的实际吸收剂量分别是1.90kgy和3.92kgy。辐照后置于2℃冷库贮藏,分别在60d和120d时取样检测。
[0037]
对比例1.
[0038]
将纸箱包装的供试鲜人参,分别在吉林省长春市中核同辐有限公司的
60
co-γ辐照器,设定吸收剂量均为2.0和4.0kgy,处理40-60s。
[0039]
用直径5mm的丙氨酸剂量计进行实际剂量测定,电子束辐照的实际吸收剂量分别是1.90kgy和3.92kgy。辐照后置于2℃冷库贮藏,分别在60d和120d时取样检测。
[0040]
利用以下实验验证实验效果:
[0041]
1.腐烂率的测定
[0042]
贮藏期间,鲜人参的腐烂率计算公式如下:
[0043]
[0044]
结果:微生物可导致食品变质,从田间采收到消费者食用过程中都可能发生微生物污染。在贮藏过程中,病原微生物和腐败微生物的生长繁殖均会影响鲜人参的感官和内部品质。不同辐照方式对鲜人参腐烂率的影响不同(见表3),贮藏60d后,辐照后的人参外观形态好,表面无霉菌,电子束辐照的鲜人参未发生腐败。贮藏时间为120d时,经过辐照的鲜人参的腐烂率明显低于未辐照的鲜人参(p《0.05),其中当电子束辐照剂量为2kgy时,鲜人参的腐烂率最低(1.09%)。原因可能是当辐照剂量高时,很容易改变细胞的排列,导致细胞破裂,引起细胞衰变
[50]
。结果表明,从长期贮藏鲜人参来看,电子束辐照比
60
co-γ辐照保鲜效果更好。
[0045]
表3鲜人参腐烂率
[0046][0047]
ei,电子束辐照;
a-b
上标含相同字母表示与对照相比无显著性差异,否则有显著性差异;
x-y
上标含相同字母表示组内无显著性差异,否则具有显著性差。
[0048]
2.人参总皂苷的测定
[0049]
总皂苷含量测定采用硫酸-香草醛比色法。准确称取0.5g人参粉末(过60目筛)加入15ml水饱和正丁醇溶液,50℃超声提取30min,离心后取上清液,向上清液中加入20ml蒸馏水,静置30min后离心取上清液,用甲醇定容至50ml,得总皂苷提取液。取其中200μl在80℃蒸干,向其中加入0.5ml 8%香草醛和5ml 72%浓硫酸溶液进行显色,60℃水浴10min后冷水浴10min,544nm处测定吸光度值,以人参皂苷re为标准品,做标准曲线,计算总皂苷含量。
[0050]
结果:总皂苷标准曲线如图1所示。不同辐照方式对鲜人参中人参总皂苷含量的影响如图2所示。从图中可以看出,辐照之后的鲜人参总皂苷含量随辐照剂量的增加而减少,同时经60co-γ辐照与电子束辐照后的鲜人参中总皂苷含量存在明显区别。整个贮藏期间,总皂苷含量均为电子束辐照组》对照组》60co-γ辐照组,其中电子束辐照剂量为2kgy时,总皂苷含量最高,贮藏60d和120d后含量分别为4.13%和3.81%,与贮藏前相比无显著性差异(p》0.05),60co-γ辐照剂量为4kgy时总皂苷含量最低,贮藏60d和120d后含量分别为3.16%和3.12%,显著低于贮藏前(p《0.05)。结果表明,利用电子束辐照有利于避免贮藏过程中人参皂苷的损失,且剂量越低损失越少。
[0051]
3.人参单体皂苷含量测定
[0052]
(1)供试品溶液的配制
[0053]
将鲜人参烘干后粉碎,过60目筛。准确称取人参粉末0.5g,加入25ml甲醇超声提取两次,每次30min,离心后取上清液,混合两次上清液,40℃旋蒸后用甲醇定容至5ml,过0.22μm水系针头过滤器,上机备用。
[0054]
(2)对照品溶液的配制
[0055]
分别精密称取适量rg1、re、rf、rh1、rg2、rb1、rc、rb2、rb3和rd对照品,加入甲醇溶
解并定容至5ml制成混合对照品溶液,各对照品质量浓度分别为1.01、1.05、1.08、1.00、1.00、0.99、1.00、1.00、1.01和1.05mg
·
ml-1
。逐级稀释,得到一系列不同质量浓度的10种混合对照品溶液,置于4℃的冰箱内,临用前经0.22μm微孔滤膜滤过至进样瓶,供分析用。
[0056]
(3)色谱条件
[0057]
色谱柱:h-class c18(2.1
×
50,1.7μm);柱温:35℃;检测波长:203nm;流速:0.4ml
·
min-1
;流动相:超纯水(a)-乙腈(b)梯度洗脱。洗脱程序为0
–
6.8min,86
–
81%a;6.8
–
17.75min,81
–
60%a。
[0058]
(4)方法学考察
[0059]
线性关系考察:精密吸取“1.2.4.2”列浓度混合对照品溶液各3μl,在“1.2.4.3”项下色谱条件下测定,以对照品的峰面积(y)对相应的质量浓度(x)进行线性回归,得回归方程,然后逐级稀释混合对照品溶液,按信噪比s/n=3计算检出限,按s/n=10计算定量限。
[0060]
精密度试验:取混合对照品溶液,每次进样3μl,连续进样6次,测定人参皂苷rg1、re、rf、rh1、rg2、rb1、rc、rb2、rb3和rd的峰面积,其rsd分别为0.04%,0.05%,0.05%,0.06%,0.10%,0.11%,0.12%,0.12%,0.07%和0.10%。
[0061]
重复性试验:取6份贮藏前的对照样品,精密称定,按“1.2.4.1”项下方法制备供试品溶液,分别进样3μl,测定峰面积。计算9种人参皂苷质量分数的rsd,分别为2.30%,1.40%,0.30%,0.15%,3.70%,1.90%,1.30%,0.40%和1.60%。
[0062]
稳定性试验:取贮藏前的对照样品,按“1.2.4.3”项下色谱条件分别于0,2,4,6,8,10,12和24h进样3μl,测定对各成分峰面积,计算rsd值。结果表明,9种人参皂苷质量分数的rsd值分别是0.07%,0.20%,1.01%,0.73%,0.45%,1.43%,0.66%,1.72%,1.11%,0.99%。
[0063]
结果:uplc对不同贮藏介质中的鲜人参样品进行分析,其典型色谱图如图3所示。每种化合物的校准曲线、lod和loq的方程如表4所示,人参单体皂苷含量如表5所示。
[0064]
表4人参单体皂苷的回归方程、检出限和定量限
[0065][0066]
结果表明,贮藏60d后,9种单体皂苷的总量范围在14.26-17.61mg
·
g-1
,贮藏120d后,总含量为15.07-17.69mg
·
g-1
,辐照之后的鲜人参中单体皂苷总含量较高,电子束辐照后的鲜人参单体皂苷总量较60co-γ辐照的鲜人参高。贮藏后未经辐照的鲜人参9种单体皂苷的总含量低于贮藏前。人参皂苷rf、rb2和rd含量随贮藏时间的延长而显著减少(p《0.05)。人参皂苷rf和rb3含量随辐照剂量的增加而减少,当辐照剂量为2kgy时,rg1和rf在经辐照的鲜人参中较对照中含量高,但当辐照剂量为4kgy时,结果恰好相反,这表明较高的辐照剂量可能会影响人参皂苷rg1和rf含量。贮藏期间,人参皂苷rc和rb2的含量随辐照剂量的增加而增加,贮藏120d时,除60co-γ辐照剂量为2kgy的鲜人参样品,rc、rb2和rd的含
量均在辐照组中较高,而贮藏60d后除60co-γ辐照剂量为4kgy的鲜人参中人参皂苷rb1在对照中较高,在其它处理中的含量均高于对照,但贮藏120d后,辐照组人参皂苷rb1含量比对照中高,结果表明受到辐照之后的鲜人参皂苷rb1随着贮藏时间的延长含量减少更快。人参皂苷rd的含量在电子束辐照之后的鲜人参中含量更高,贮藏60d后人参皂苷re含量在对照组中含量最高,为2.65mg
·
g-1
,而贮藏120d后,在电子束辐照剂量为4kgy的鲜人参中含量最少为2.20mg
·
g-1
,其它处理组中人参皂苷re含量基本不变。表5人参单体皂苷含量如图9所示。
[0067]
4.人参总多糖含量测定:准确称取人参粉末(过60目筛)0.5g,加入10ml蒸馏水后50℃超声提取30min,离心后取上清液,再加入蒸馏水提取第二次,合并两次提取液,加入无水乙醇30ml,4℃静置过夜;将过夜后的沉淀离心,弃去上清液,向沉淀中加入40ml蒸馏水50℃超声溶解后,定容至50ml;将溶液稀释10倍后取1ml,向其中加入0.5ml 6%苯酚溶液,2.5ml浓硫酸,在490nm处测定吸光度值,以葡萄糖为标准品,做标准曲线,计算总多糖含量。
[0068]
结果:标准曲线如图4所示,贮藏后人参总多糖含量如图5所示。结果表明,高剂量辐照后的鲜人参总多糖含量明显高于低剂量辐照后的鲜人参(p《0.05),总多糖含量随辐照剂量的增加而增加,电子束辐照组》对照组》60co-γ辐照组。人参总多糖在电子束辐照剂量为4kgy时含量最高,贮藏60d和120d后含量分别为3.98%和4.00%,在60co-γ辐照剂量为2kgy时多糖含量最低,贮藏60d和120d后含量分别为1.84%和1.87%。与贮藏前相比,贮藏120d后对照组中人参总多糖含量显著减少(34.01%),而剂量为4kgy电子束辐照组中鲜人参总多糖含量较贮藏前显著增加(p《0.05),原因可能是辐照为贮藏过程中多糖的积累提供了一定的条件,电子束辐照有助于鲜人参中的寡糖或淀粉分解,使多糖含量增加。
[0069]
5.氨基酸含量的测定
[0070]
准确称取人参粉末(过60目筛)0.5g,置于35ml水解管中;向其中加入20ml 6mol
·
l-1
hcl溶液,拧紧螺旋塞密封;超声10min,于恒温干燥箱中110℃水解22h,水解结束冷却至室温;每管取800μl至小试管中,70℃真空干燥挥干溶剂后用0.02mol
·
l-1
hcl定容至2ml,涡旋使充分溶解;0.22μm水系针头过滤器过滤至样品瓶,上机备用。
[0071]
结果:采用氨基酸分析仪对鲜人参进行分析,其典型色谱图如图6所示。17种氨基酸含量如表6所示。结果表明,大多数氨基酸的含量在对照组中低于辐照组,但是贮藏60d时对照组中氨基酸总含量高于辐照组,是由于对照组中精氨酸含量显著高于辐照组所致(p《0.05);不同辐照剂量之间的鲜人参氨基酸含量也存在一定的差异,除精氨酸外大部分氨基酸含量随辐照剂量的增加而减少。4kgy的辐照剂量对鲜人参贮藏后氨基酸含量影响较大,这与joong-ho kwon过去的报道一致:当60co-γ辐照剂量达到5kgy时会引起人参中含s氨基酸明显减少。与对照相比,辐照后的鲜人参中不同氨基酸增多的程度不同,可能是由于辐照过程中能量的变化导致较强的物理、化学和生物效应,进而使人参中某些不稳定的蛋白质分解为不同氨基酸。表6人参氨基酸含量如图10所示。
[0072]
6.酶活力测定
[0073]
sod活性的测定:准确称取人参组织重量按重量(g):体积(ml)=1:4的比例加入4倍体积的匀浆介质(0.1mol
·
l-1
ph 7.0~7.4磷酸盐缓冲液),冰水浴条件下,机械匀浆,制备成20%匀浆液,4000r
·
min-1
离心10min,取上清液再用匀浆介质稀释成1%匀浆液,按照南京建成试剂盒说明,在测定管和对照管长分别加入不同试剂后用涡旋混匀器充分混匀,
置37℃恒温水浴40min,加入显色剂,混匀后于波长550nm处测定吸光度值。计算公式:
[0074][0075]
pod活性的测定:准确称取人参组织重量按重量(g):体积(ml)=1:9的比例加入9倍体积的匀浆介质(0.1mol
·
l-1
ph 7.0~7.4磷酸盐缓冲液),冰水浴条件下,机械匀浆,制备成10%匀浆液,4000r
·
min-1
离心10min,取上清液按照南京建成试剂盒说明,在420nm处测定吸光度值。计算公式:
[0076][0077]
cat活性的测定:准确称取人参组织重量按重量(g):体积(ml)=1:9的比例加入9倍体积的匀浆介质(0.1mol
·
l-1
ph 7.0~7.4磷酸盐缓冲液),冰水浴条件下,机械匀浆,制备成10%匀浆液,4000r
·
min-1
离心10min,取上清液按照南京建成试剂盒说明,于波长405nm处测定吸光度值。计算公式:
[0078][0079]
结果:sod、pod和cat是人参中的重要的氧化还原酶类,能代表其抗氧化与抗衰老能力。贮藏后鲜人参中这三种酶活力结果如图7所示。结果表明,当贮藏时间为60d时,这三种酶的活力在对照组中更高,sod和pod酶活力随辐照剂量的增加而降低,60co-γ辐照后的鲜人参酶活力较电子束辐照的鲜人参高。贮藏60d时,对照组酶活力最高,sod、pod和cat酶活力分别为581u
·
mg-1
、57.37u
·
mg-1
和26.68u
·
mg-1
;贮藏于剂量为4kgy的电子束辐照的鲜人参中酶活力最低,三种酶活力分别为377u
·
mg-1
、39.58u
·
mg-1
和3.3u
·
mg-1
。与60co-γ辐照相比,电子束辐照具有电子束集中,能量利用率高,辐照吸收剂量高的特点,能够影响水和小分子物质,辐照后分解产生更多h、oh和其他自由基,这些自由基与酶活力密切相关,发生交联反应,从而抑制酶活力。
[0080]
随着贮藏时间的延长,酶活力随之降低,但贮藏120d后,除4kgy辐照剂量的电子束组,其它辐照处理的鲜人参的sod酶活力均高于对照,这说明sod酶活力在未辐照人参中下降的最明显。根据这三种酶活力的不同,可以推测辐照能够影响鲜人参的酶活力,辐照剂量为4kgy时尤为突出,同电子束辐照相比,60co-γ辐照对酶活力的影响相对较小。
[0081]
7.核苷及碱基含量的测定
[0082]
(1)供试品溶液的配制
[0083]
准确称取0.2g人参粉末,置于5ml试管中,用蒸馏水定容至4ml,超声辅助萃取30min,8000r
·
min-1
离心10min,取适量上清液过0.22μm水系针头过滤器过滤至样品瓶,上机备用。
[0084]
(2)对照品溶液的配制
[0085]
分别精密称取适量胞嘧啶、尿嘧啶、腺嘌呤、鸟嘌呤、次黄嘌呤、黄嘌呤、尿苷、胸腺嘧啶、肌苷、鸟苷、腺苷、2'-脱氧鸟苷、β-胸苷对照品,加蒸馏水溶解并制成质量浓度分别为540、540、600、500、490、520、550、550、570、510、560、520和610μg
·
ml-1
的对照品贮备液。取各对照品贮备液2ml,加蒸馏水定容至50ml制成混合对照品溶液,各对照品质量浓度分别为21.60、21.60、24.00、20.00、19.60、20.80、22.00、22.00、22.80、20.40、22.40、20.80和
24.40μg
·
ml-1
。逐级稀释,得到一系列不同质量浓度的13种混合对照品溶液,置于4℃的冰箱内,临用前经0.22μm微孔滤膜滤过至进样瓶,供分析用。
[0086]
(3)色谱条件
[0087]
色谱柱:acquity uplc h-class t3(2.1
×
100mm id,1.8μm);检测波长:260nm;流速:0.3ml
·
min-1
;流动相:0.01%甲酸水(a)-乙腈(b)梯度洗脱。洗脱程序为1~8min,0~8%b,8~9min,8%~15%b,9~10.5min,15%b,10.5~11min,15%~0%b,11~15min,0%b。
[0088]
(4)方法学考察
[0089]
线性关系考察:精密吸取“1.2.8.2”列浓度混合对照品溶液各3μl,在“1.2.8.3”项下色谱条件下测定,以对照品的峰面积(y)对相应的质量浓度(x)进行线性回归,得回归方程,然后逐级稀释混合对照品溶液,按信噪比s/n=3计算检出限,按s/n=10计算定量限。
[0090]
精密度试验:取混合对照品溶液,每次进样3μl,连续进样6次,测定胞嘧啶、尿嘧啶、腺嘌呤、鸟嘌呤、次黄嘌呤、黄嘌呤、尿苷、胸腺嘧啶、肌苷、鸟苷、腺苷、2'-脱氧鸟苷、β-胸苷的峰面积,其rsd分别为0.03%,0.07%,0.05%,0.16%,0.11%,0.21%,0.22%,0.22%,0.07%,0.10%,0.05%,0.09%和0.25%。
[0091]
重复性试验:取6份贮藏前对照样品,精密称定,按“1.8.2.1”项下方法制备供试品溶液,分别进样3μl,测定峰面积。计算13种核苷类成分质量分数的rsd,分别为1.04%,1.25%,0.40%,1.45%,1.55%,1.17%,0.99%,1.21%,1.42%,1.94%,1.68%,0.98%和1.55%。
[0092]
稳定性试验:取贮藏前对照样品的供试样品溶液,按“1.8.2.3”项下色谱条件分别于0,2,4,6,8,10,12和24h进样3μl,测定对各成分峰面积,计算rsd值。13种核苷类成分质量分数的rsd值分别是0.08%,0.21%,1.03%,0.83%,0.45%,1.53%,0.64%,1.72%,1.11%,0.99%,1.22%,0.03%和0.88%。
[0093]
结果:核苷类成分是细胞维持生命的重要物质,也是补益类中药的物质基础。有研究发现人参中的核苷类成分在调节免疫反应中可以发挥重要作用。本实验通过超高效液相色谱检测出13种核苷类成分的含量,混合对照品色谱图及人参样品色谱图见图8,每种化合物的校准曲线、lod和loq的方程见表7,人参中核苷类成分含量差异如表8所示。
[0094]
结果表明,贮藏60d时,对照组中核苷类成分总含量最高(466.72μg
·
g-1
),辐照组中核苷类成分的含量均显著低于对照组(p《0.05),总含量随辐照剂量的增加而减少,贮藏120d时,60co-γ辐照剂量为4kgy时鲜人参中核苷类成分总含量最高(914.52μg
·
g-1
),且辐照组中随辐照剂量的增加而增加。随着贮藏时间的延长,对照组与辐照组的总含量均增加。说明辐照影响核苷类成分的含量,且在贮藏期间可能引起某些物质转化为核苷。表8鲜人参中核苷类成分含量如图11所示。
[0095]
表7核苷类成分的回归方程、检出限和定量限
[0096]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1