茯苓多糖EGC组合物在抑制胃肠道精氨嘧啶形成中的应用
茯苓多糖egc组合物在抑制胃肠道精氨嘧啶形成中的应用
技术领域
1.本发明属于保健食品或药品领域,涉及茯苓多糖egc组合物在抑制胃肠道精氨嘧啶形成中的应用。
背景技术:
2.食品中的还原糖与氨基酸或蛋白质在常温或加热时会发生一系列复杂的反应,即美拉德反应,精氨嘧啶是其中一种美拉德反应产物,含有一个精氨酸残基。与赖氨酸形成羧甲基赖氨酸类似,精氨酸也可形成相应的羧甲基精氨酸。人体过量摄入可能会引起癌症及慢性疾病的发生。可以通过抑制精氨嘧啶的形成来降低人体动脉粥样硬化、视网膜病变、神经衰退性疾病及糖尿病等各种慢性疾病风险。
3.茯苓多糖是茯苓主要活性成分之一,来源广泛。其具有抗肿瘤、抗炎、保肝、调节机体免疫力等药理作用,广泛应用于食品、医药及保健品等领域。茯苓多糖可以通过抑制自由基过氧化反应,降低脂质过氧化作用,减少脂褐质形成发挥延缓衰老的作用。实验证明,改性后的羧甲基化茯苓多糖与未经修饰改性的茯苓多糖相比,生物活性大大提高,具有良好的开发价值与应用前景。
4.表没食子儿茶素((-)-epigallocatechin,egc)是一种多酚化合物,为白色粉末,天然存在于山茶科植物茶的干叶中,是绿茶提取物中生理活性物质的主体。用于分析含量鉴定,药理活性筛选,具有广泛的生物活性;还可以有效清除人体内自由基,具有防紫外线辐射、减肥、预防糖尿病、缓解帕金森氏症等作用。
技术实现要素:
5.本发明的目的在于提供茯苓多糖egc组合物在抑制胃肠道精氨嘧啶形成中的应用。
6.本发明的目的通过下述技术方案实现:
7.本发明发现茯苓多糖、egc在胃肠道中能抑制精氨嘧啶形成,茯苓多糖与egc组合使用后能显著提升胃肠道中抑制精氨嘧啶形成的效果,且两者组合的抗氧化能力显著强于单独的茯苓多糖或egc。基于该发现,茯苓多糖与egc或含茯苓多糖与egc的组合物具有抑制胃肠道精氨嘧啶形成的应用。茯苓多糖与egc或含茯苓多糖与egc的组合物具有制备抗氧化的保健食品或药品的应用。
8.进一步的,茯苓多糖与egc或含茯苓多糖与egc的组合物具有制备抑制精氨嘧啶形成或制备治疗、延缓或改善精氨嘧啶相关疾病的保健食品或药品的应用。所述的精氨嘧啶相关疾病包括糖尿病、阿尔茨海默病、动脉粥样硬化等疾病。
9.一种抑制精氨嘧啶形成或抗氧化或治疗、延缓或改善精氨嘧啶相关疾病的保健食品或药品,包含茯苓多糖和egc。
10.在一些实施方案中,所述的茯苓多糖为羧甲基化茯苓多糖。
11.本发明的有益效果在于茯苓多糖egc组合物比单独的茯苓多糖或者egc具有更强
的抗氧化能力,并且在胃肠道抑制精氨嘧啶生成的效果更显著。
12.本发明的茯苓多糖egc组合物在胃肠道表现出显著的抗精氨嘧啶生成作用和极强的自由基清除能力,在抗氧化、抗衰老、抗糖尿病等领域具有广泛的应用前景。
附图说明
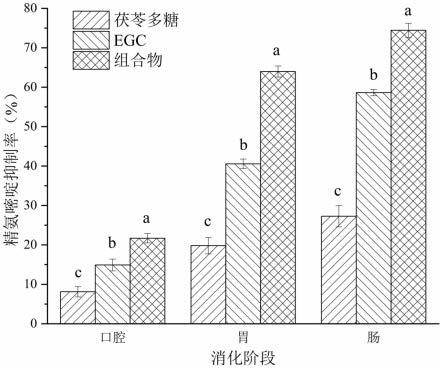
13.图1是胃肠消化阶段不同样品的精氨嘧啶抑制率。
14.图2是不同样品的hrsa自由基清除率。
15.图1-2中,a-c不同字母表示差异有统计学意义(p《0.05)。
具体实施方式
16.以下实施例用于进一步说明本发明,但不应理解为对本发明的限制。若未特别指明,实施例中所用的技术手段为本领域技术人员所熟知的常规手段。
17.下述实施例中所使用的茯苓多糖为羧甲基化茯苓多糖,其通过下述方法制备得到:将茯苓粉加入到石油醚(固液比1:5)中于60℃水浴中加热回流脱脂12h,收集残渣,并将溶剂挥干。再加入80%乙醇(固液比1:5)于50℃下,磁力搅拌30min,离心(4000rpm,10min),收集残渣,此过程重复几次,直至上清液无色,旋蒸将无水乙醇蒸出,得脱脂茯苓粉末。将其置于烧杯中,加入少量蒸馏水,搅拌使其充分混匀,以1:50固液比于80℃水浴中浸提1h,过程中多次搅拌,并对残渣重复水提一次,离心以去除水溶性物质,收集残渣。以1:50固液比例加入0.6mol/l氢氧化钠溶液,于4℃下静置提取8h。离心得上清液,并用10%的醋酸溶液中和至ph=6,以大量蒸馏水、无水乙醇、丙酮洗涤胶状沉淀反复脱盐后冷冻干燥得到碱溶性茯苓多糖粗品。称取3g碱溶性茯苓多糖粗品置三口烧瓶中,加入100ml异丙醇和40ml20%naoh的混合溶液,冰浴搅拌3h使其分散均匀。室温下,取24g一氯乙酸溶于100ml异丙醇中,再与40ml 20%naoh溶液相混合。通过常压滴液漏斗将混合液缓慢滴加入反应体系中,搅拌反应3h,将反应液升温至60℃继续搅拌30min。另取24g一氯乙酸、40ml 20%naoh溶液和100ml异丙醇相混合,加入60℃反应体系中继续反应1h,终止反应,冷却至室温,以1.0mol/l hcl溶液调节ph至7.0,旋蒸回收异丙醇,剩余反应液用再生纤维素透析袋(mw cut-off 7000)蒸馏水透析4天,旋转蒸发浓缩透析液,脱蛋白,90%以上乙醇沉淀过夜,离心收集沉淀,经冷冻干燥得白色粉末状羧甲基化茯苓多糖。
18.下述实施例中所使用的egc购于成都德思特生物技术有限公司。
19.下述实施例中所配制的相关溶液,如未说明均为用水配制。
20.实施例1:精氨嘧啶生成抑制剂筛选
21.(1)在4ml人工唾液(simulated salivary fluid,ssf,配制方法见表1)储备液中分别加入egc、茯苓多糖、茯苓多糖egc组合物(茯苓多糖egc质量比1∶1),终浓度保持在0.3g/l。再加入25μl 0.3mol/l的cacl2、加超纯水补至5ml。加入200mg牛血清白蛋白(bovine serum albumin,bsa)、11.36μl 8.8mol/l的乙二醛(glyoxal,go),建立牛血清白蛋白-乙二醛模型。混匀2分钟,作为口腔组。对照组不含egc、茯苓多糖、茯苓多糖egc组合物。
22.表1模拟消化液原液的制备
23.成分ssf(mmol/l)sgf(mmol/l)sif(mmol/l)
kcl15.16.96.8kh2po43.70.90.8nahco313.62585nacl—47.238.4mgcl2(h2o)60.150.10.33(nh4)2co30.060.5—
24.(2)在步骤(1)中加入3.75ml人工胃液(simulated gastric fluid,sgf,配制方法见表1)储备液,用0.1mol/l hcl溶液调ph值至2.0。然后加入0.25ml胃蛋白酶(80000u/ml)、2.5μl 0.3mol/l的cacl2,最后加超纯水补至10ml,在37℃恒温振荡箱内进行消化2h,作为胃消化组。
25.(3)在步骤(2)中加入5.5ml人工肠液(simulated intestinal fluid,sif,配制方法见表1)储备液,然后加入2.5ml胰酶(800u/ml)、1.25ml新鲜猪胆盐(160mmol/l)、20μl 0.3m cacl2,用naoh(1mol/l)调ph值至中性灭酶。用超纯水补至20ml,置于37℃恒温振荡箱内进行消化2h,消化结束后煮沸灭酶,作为肠消化组。
26.(4)采用bsa-go模型,用日立f-4700荧光分光光度计在激发波长(λex)=335nm和发射波长(λem)=400nm处的荧光强度测定样品不同阶段精氨嘧啶的含量。
27.精氨嘧啶抑制率(%)=(1-a
样
/a
对照
)
×
100%。
28.结果见图1。图1为胃肠消化阶段的精氨嘧啶抑制率图,横坐标代表消化阶段,纵坐标代表精氨嘧啶抑制率。在胃阶段和肠阶段,茯苓多糖和egc都可以抑制精氨嘧啶生成,但茯苓多糖和egc的精氨嘧啶抑制率均弱于茯苓多糖egc组合物,说明在胃肠消化阶段茯苓多糖egc两者在抑制精氨嘧啶生成上有协同作用。
29.实施例2:羟自由基(hydroxyl radical-scavenging activity,hrsa)清除率
30.方法如下:
31.(1)1.5ml用水稀释2倍后的上述肠消化组样品溶液中加入1.5ml 9mmol/l feso4溶液、1.5ml 9mmol/l水杨酸-乙醇溶液、1.5ml 8.8mmol/l h2o2(a
x
组)。
32.(2)1.5ml h2o中加入1.5ml 9mmol/l feso4溶液、1.5ml 9mmol/l水杨酸-乙醇溶液、1.5ml 8.8mmol/l h2o2(a0组)。
33.(3)1.5ml用水稀释2倍后的样品中加入1.5ml 9mmol/l feso4溶液、1.5ml 9mmol/l水杨酸-乙醇溶液、1.5ml h2o(a
x0
组)。
34.(4)步骤(1)、(2)、(3)各组溶液混匀后分别在37℃下反应10min。
35.(5)用酶标仪测定各组反应液在波长510nm处的吸光值,用h2o调零。
36.hrsa清除率(%)=[a
0-(a
x-a
x0
)]/a0×
100%。
[0037]
结果如图2所示,羧甲基化结构修饰后的茯苓多糖的hrsa自由基清除能力为25.60%,egc的hrsa自由基清除率为67.21%,茯苓多糖egc组合物的hrsa自由基清除率为95.82%。该组合物的hrsa自由基清除能力强于egc和茯苓多糖的hrsa自由基清除能力,说明egc和茯苓多糖在清除hrsa自由基方面具有协同作用。
[0038]
以上所述仅表达了本技术的具体实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本技术技术方案构思的前提下,还可以做出若干变形和改进,这些都属于本技术的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1