一种组合物及其应用、利用组合物构建的类无菌小鼠模型的制作方法
1.本技术涉及小鼠模型构建的技术领域,具体公开了一种组合物及其应用、利用组合物构建的类无菌小鼠模型。
背景技术:
2.研究表明,人体诸多疾病的发生与人体肠道中菌群结构紊乱密切相关。人体肠道中定植了大量细菌,其基因总数约为人体基因数的150倍,称为人体“第二脑”。目前,常利用粪菌移植对人体肠道菌群结构紊乱所引起的疾病进行探究和治疗,例如对复发性艰难梭菌感染、肥胖、代谢综合征和自闭症等疾病的治疗已初见成效。
3.在进行粪菌移植的探究中,通常会用到动物模型。其中,小鼠模型是应用最广泛的动物模型之一。最常使用的小鼠模型有以下三种类型:无特定病原体(specific pathogen free,spf)小鼠模型、无菌小鼠(germ-free animal,gf animal)模型和类无菌小鼠模型。其中,spf小鼠模型一般指无传染病的健康小鼠,但spf小鼠模型会携带非特定的微生物和寄生虫,故spf小鼠模型存在定植抗性,即原始的肠道菌群对外源细菌定植存在抵抗。而无菌小鼠模型不携带包括细菌、病毒、真菌和寄生虫等任何外源生命形式,但是无菌小鼠模型的构建不仅需要消耗较高的成本,同时还对构建时的环境条件也有较高的要求;且由于无菌小鼠模型为基因缺陷型小鼠,故无菌小鼠模型的繁育率较低,生命力较差,死亡率较高,甚至某些无菌小鼠模型无法饲养与繁殖;某些无菌小鼠模型还可能存在先天免疫与神经缺陷,从而导致相关疾病的研究结果不可靠。相比之下,类无菌小鼠模型的构建更加经济、方便,从而更加容易获得,且往往类无菌小鼠模型的研究结果与无菌小鼠模型的研究结果相一致,是更加理想的小鼠模型。
4.相关技术中通常利用抗生素处理spf小鼠一段时间来构建类无菌小鼠模型。所用的抗生素一般是四联抗生素,包括万古霉素、青霉素、甲硝唑和新霉素。然而,利用上述方法处理后,所构建的类无菌小鼠的饲料消耗量和饮水消耗量明显下降,表明经过上述方法的处理,会导致类无菌小鼠的食欲降低,从而影响类无菌小鼠的健康状态。
技术实现要素:
5.为了提高所构建的类无菌小鼠的食欲,本技术提供一种组合物及其应用、利用组合物构建的类无菌小鼠模型。
6.第一方面,本技术提供的一种组合物,采用如下的技术方案:一种组合物,所述组合物包含以下重量份的组分:抗生素10-15份;茶多酚4-8份;茯苓多糖8-13份。
7.本技术中采用抗生素、茶多酚、茯苓多糖联合使用的组合物用于构建类无菌小鼠模型,小鼠对饮用水和饲料的消耗量明显提高,说明利用本技术提供的组合物能够有效提高类无菌小鼠的食欲。且利用上述组合物构建的类无菌小鼠体重增加,说明利用该组合物能够有效改善类无菌小鼠体内的肠道环境,促进类无菌小鼠肠道的消化功能。
8.通过试验结果可知,当使用茶多酚和抗生素或者使用茯苓多糖和抗生素处理小鼠时,对小鼠食欲和消化功能的提高程度很小。而当使用抗生素、茶多酚和茯苓多糖的组合物处理小鼠时,能够明显提高类无菌小鼠的食欲和消化功能。因此,本技术提供的组合物选择抗生素、茶多酚和茯苓多糖一起处理小鼠,构建类无菌小鼠模型。
9.经过试验分析可知,在构建类无菌小鼠模型的过程中,将组合物中各组分的添加量控制在上述范围内,可以有效提高类无菌小鼠的饮用水消耗量、饲料消耗量和体重。因此,本技术提供的组合物可以改善类无菌小鼠模型的食欲和消化功能。
10.进一步地,所述组合物包含以下重量份的组分:抗生素11-13.2份;茶多酚4.4-6.8份;茯苓多糖9.2-11.6份。
11.在一个具体的实施方式中,所述抗生素的添加量可以是10份、11份、12份、13.2份、15份。
12.在一些具体的实施方式中,所述抗生素的添加量可以是10-11份、11-12份、12-13.2份、13.2-15份。
13.在一个具体的实施方式中,所述茶多酚的添加量可以是4份、4.4份、6份、6.8份、8份。
14.在一些具体的实施方式中,所述茶多酚的添加量可以是4-4.4份、4.4-6份、6-6.8份、6.8-8份。
15.在一个具体的实施方式中,所述茯苓多糖的添加量可以是8份、9.2份、10份、11.6份、13份。
16.在一些具体的实施方式中,所述茯苓多糖的添加量可以是8-9.2份、9.2-10份、10-11.6份、11.6-13份。
17.通过试验结果可知,在构建类无菌小鼠模型的过程中,将组合物中各组分的添加量控制在上述范围内,可以进一步提高类无菌小鼠的饮用水消耗量、饲料消耗量和体重。因此,本技术提供的组合物可以进一步改善类无菌小鼠模型的食欲和消化功能。
18.进一步地,所述抗生素选自伊维菌素和庆大霉素。
19.在一个具体的实施方式中,所述抗生素可以是伊维菌素。
20.在一个具体的实施方式中,所述抗生素可以是庆大霉素。
21.在一个具体的实施方式中,所述抗生素可以是伊维菌素和庆大霉素。
22.通过试验结果可知,当抗生素为伊维菌素或庆大霉素时类无菌小鼠的饮用水消耗量、饲料消耗量和体重,远小于当抗生素为伊维菌素和庆大霉素复合使用时类无菌小鼠的相应特征。因此,本技术中的抗生素选择伊维菌素和庆大霉素复合使用。
23.进一步地,所述抗生素包括伊维菌素和庆大霉素,所述伊维菌素和所述庆大霉素的重量比为1:(0.5-3)。
24.在一个具体的实施方式中,所述伊维菌素和所述庆大霉素的重量比可以为1:0.5、1:1、1:3。
25.在一些具体的实施方式中,所述伊维菌素和所述庆大霉素的重量比可以为1:(0.5-1)、1:(1-3)。
26.通过试验结果可知,将伊维菌素和庆大霉素的重量比控制在上述范围内,能够有效提高所构建的类无菌小鼠的饮用水消耗量、饲料消耗量和体重。因此,本技术将抗生素中
伊维菌素和庆大霉素的重量比控制在上述范围内,能够更进一步改善类无菌小鼠的食欲和消化功能。
27.第二方面,本技术还提供了上述组合物在构建类无菌小鼠模型方面的应用。
28.第三方面,本技术还提供了一种类无菌小鼠模型,该类无菌小鼠模型是利用上述组合物构建获得的。
29.第四方面,本技术还提供了上述类无菌小鼠模型的构建方法,采用如下的技术方案:一种类无菌小鼠模型的构建方法,具体包括以下步骤:将所述组合物溶解在灭菌饮用水中对小鼠进行灌胃,即得所述类无菌小鼠模型。
30.进一步地,所述构建方法中,所述组合物的灌胃量为每天每克小鼠灌胃0.8-1.2mg;灌胃周期为2-3周。
31.进一步地,所述小鼠为spf级小鼠。
32.优选地,所述小鼠为6周龄spf级雄性野生型c57bl/6小鼠。
33.进一步地,所述小鼠饲养在ivc中,饲养环境为昼夜各半循环照明,湿度控制在40%-60%,温度控制在24
±
2.0℃,饲养期间小鼠可自由获得饲料和水。
34.本技术采用的技术方案中,利用抗生素、茶多酚、茯苓多糖的组合物来构建类无菌小鼠模型,构建过程中所用到的原材料、设备和环境要求较低,降低了试验成本。另外,类无菌小鼠模型的外观状态、发育状况和生理变化均与spf级小鼠无显著性差异,类无菌小鼠近似健康小鼠,有利于类无菌小鼠的后续研究应用。
35.通过试验结果可知,利用抗生素、茶多酚、茯苓多糖的组合物构建的类无菌小鼠模型,类无菌小鼠肠道内大部分的微生物菌群被清除。另外,类无菌小鼠模型的盲肠存在明显的扩张现象,符合类无菌小鼠的相关表现,表明类无菌小鼠模型构建成功。
36.第五方面,本技术构建的类无菌小鼠模型可以用于粪菌移植研究。
37.综上所述,本技术的技术方案具有以下效果:本技术中提供的抗生素、茶多酚以及茯苓多糖的组合物用于构建类无菌小鼠模型,可以提高类无菌小鼠的饮用水消耗量、饲料消耗量和体重,从而能够改善类无菌小鼠模型的食欲和消化功能。
38.本技术采用的技术方案中,利用抗生素、茶多酚、茯苓多糖的组合物处理小鼠,清除了类无菌小鼠大部分的肠道微生物,盲肠明显扩张,从而成功构建了类无菌小鼠模型。
附图说明
39.图1为实施例3构建的类无菌小鼠模型和对照组提供的小鼠的粪菌检测结果对比图(a图为对照组提供的小鼠的粪菌检测的试验结果;b图为实施例3构建的类无菌小鼠模型的粪菌检测的试验结果)。
40.图2为实施例3构建的类无菌小鼠模型和对照组提供的小鼠的肠道外观对比图(a图为对照组提供的小鼠的肠道外观图;b图为实施例3构建的类无菌小鼠模型的肠道外观图)。
41.图3为实施例3构建的类无菌小鼠模型和对照组提供的小鼠的盲肠扩张对比图(a图为对照组提供的小鼠的盲肠扩张图;b图为实施例3构建的类无菌小鼠模型的盲肠扩张
图)。
具体实施方式
42.本技术提供了一种组合物,包含以下重量份的组分:抗生素10-15份;茶多酚4-8份;茯苓多糖8-13份。进一步地,该组合物包含以下重量份的组分:抗生素11-13.2份;茶多酚4.4-6.8份;茯苓多糖9.2-11.6份。
43.其中,抗生素选自伊维菌素和庆大霉素。当抗生素为伊维菌素和庆大霉素时,伊维菌素和庆大霉素的重量比为1:(0.5-3)。
44.本技术还提供了上述组合物在构建类无菌小鼠模型方面的应用。具体的,本技术提供了利用上述组合物构建的类无菌小鼠模型。
45.该类无菌小鼠模型的构建方法,具体包括以下步骤:将组合物溶解在灭菌饮用水中对小鼠进行灌胃,即得类无菌小鼠模型。组合物的灌胃量为每天每克小鼠灌胃0.8-1.2mg;灌胃周期为2-3周。
46.在构建类无菌小鼠模型期间,小鼠饲养在ivc中,环境为昼夜各半循环照明,湿度控制在40%-60%,温度控制在24
±
2.0℃,饲养期间小鼠可自由获得食物和水。
47.其中,所用的小鼠为spf级小鼠。
48.具体的,所用的小鼠为6周龄spf级雄性野生型c57bl/6小鼠,来自斯贝福(北京)生物技术有限公司。
49.本技术构建的类无菌小鼠模型可以用于粪菌移植研究。
50.以下结合制备例1-39、实施例1-21、对比例1-18、附图1-3以及性能检测试验对本技术作进一步详细描述,这些实施例不能理解为限制本技术所要求保护的范围。
51.制备例制备例1-7制备例1-7分别提供了一种组合物。
52.上述各制备例的不同之处在于:茯苓多糖的添加量,具体如表1所示。
53.上述各制备例的制备方法如下:按照表1所示的各组分添加量,将伊维菌素、庆大霉素、茶多酚和茯苓多糖混合,制得组合物。
54.表1 制备例1-7中茯苓多糖的添加量
制备例8-13制备例8-13分别提供了一种组合物。
55.上述各制备例与制备例3的不同之处在于:茶多酚的添加量,具体如表2所示。
56.表2 制备例3、制备例8-13中茶多酚的添加量制备例14-19制备例14-19分别提供了一种组合物。
57.上述各制备例与制备例3的不同之处在于:抗生素的添加量,具体如表3所示。
58.表3 制备例3、制备例14-19中抗生素的添加量
制备例20-25制备例20-25分别提供了一种组合物。
59.上述各制备例与制备例3的不同之处在于:抗生素中伊维菌素和庆大霉素的重量比,具体如表4所示。
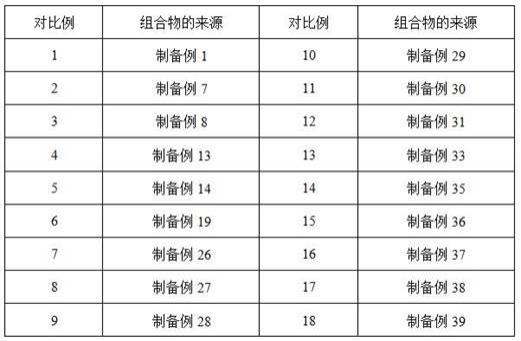
60.表4 制备例3、制备例20-25抗生素中伊维菌素和庆大霉素的比例制备例26-31制备例26-31分别提供了一种组合物。
61.上述各制备例与制备例3的不同之处在于:组合物中组分的种类,具体如表5所示。
62.表5 制备例3、制备例26-31组合物中组分的种类
制备例32-39制备例32-39分别提供了一种组合物。
63.上述各制备例与制备例3、20、23的不同之处在于:组合物中组分的种类,具体如表6所示。
64.表6 制备例3、20、23、32-39组合物中组分的种类
实施例
65.实施例1-21实施例1-21分别提供了一种类无菌小鼠模型。
66.上述各实施例的不同之处在于:类无菌小鼠模型的构建方法中所用的组合物的类型。具体如表7所示。
67.上述类无菌小鼠模型的构建方法,具体包括如下步骤:(1)制备组合物溶液:称取7g组合物加入到50ml灭菌饮用水中,充分溶解,制得组合物溶液。组合物溶液中组合物的浓度为140mg/ml。
68.(2)灌胃:取步骤(1)制得的组合物溶液0.2ml对6周龄spf级雄性野生型c57bl/6小鼠灌胃,小鼠体重为27
±
0.5g,每天灌胃1次,连续灌胃3周,即制得类无菌小鼠模型。
69.组合物的灌胃量为每天每克小鼠灌胃1.04mg。
70.饲养期间,小鼠饲养在ivc中,环境为昼夜各半循环照明,湿度控制在50%,温度控制在24
±
2.0℃,饲养期间小鼠可自由获得食物和水。
71.表7 实施例1-21中组合物的来源
对比例对比例1-18对比例1-18分别提供了一种小鼠模型。
72.上述各对比例的不同之处在于:小鼠模型的构建方法中所用的组合物的类型。具体如表8所示。其余步骤均与实施例3相同。
73.表8 对比例1-18中组合物的来源性能检测试验一、饲料消耗量、饮用水消耗量以及体重变化的监控结果
以实施例1-21提供的类无菌小鼠模型、对比例1-18提供的小鼠模型为检测对象,在各实施例和各对比例提供的构建方法构建期间,每隔3天记录spf小鼠的饮用水消耗量、饲料消耗量以及spf小鼠的体重变化情况。
74.同时,利用0.2ml灭菌饮用水对6周龄spf级雄性野生型c57bl/6小鼠灌胃,每天灌胃1次,连续灌胃3周,获得经过上述处理的小鼠作为对照组。以对照组的小鼠作为检测对象,按照上述方式在灌胃期间记录小鼠上述维度的变化情况。
75.试验结果分别如表9、表10、表11所示。
76.表9 每只小鼠每隔3天的平均每天饮用水消耗量
表10 每只小鼠每隔3天的平均每天饲料消耗量
表11 每只小鼠每隔3天的体重变化
结合表9、表10、表11,通过对比实施例1-21与对比例1-18的检测结果可知,利用本技术提供的组合物能够有效提高小鼠对饮用水和饲料的消耗量,说明利用本技术提供的组合物能够提高所构建的类无菌小鼠的食欲。利用上述组合物构建的类无菌小鼠体重增加,说明利用该组合物能够有效改善小鼠体内的肠道环境,促进小鼠肠道的消化功能。与对照组相比,对比例7单独使用抗生素处理小鼠时,小鼠在初期会出现体重下降的情况。相比之后,利用本技术提供的组合物构建的类无菌小鼠在初期不会出现体重下降的情况。
77.通过对比例10-12与对照组的检测结果可知,当单独使用茶多酚、单独使用茯苓多糖或者两者一起使用处理小鼠时,相对于对照组小鼠的饮用水消耗量、饲料消耗量和体重均略有所增加。说明单独使用茶多酚、单独使用茯苓多糖或者两者一起使用处理小鼠,对小鼠食欲和消化功能的改善程度较小。
78.通过对比例7-9与实施例3的检测结果可知,当使用茶多酚和抗生素或者使用茯苓多糖和抗生素处理小鼠时,小鼠相对于实施例3提供的类无菌小鼠对饮用水和饲料的消耗量均明显较低,说明使用茶多酚和抗生素或者使用茯苓多糖和抗生素一起处理小鼠时,对小鼠食欲的提高程度较小。相对于对比例7,使用茶多酚和抗生素或者使用茯苓多糖和抗生素一起处理小鼠时,对小鼠体重的提高程度较小。因此,本技术提供的组合物选择茶多酚、茯苓多糖与抗生素一起处理小鼠,构建类无菌小鼠模型。
79.通过对比实施例3、对比例15-18可知,相对于对比例7,当选择银耳多糖或香菇多糖与抗生素、茶多酚一起处理小鼠,或者当选择苹果多酚或葡萄多酚与抗生素、茯苓多糖一起处理小鼠,小鼠食欲和体重略有提高,而选择使用茯苓多糖、茶多酚和抗生素一起处理小鼠时,小鼠食欲和体重明显提高。因此,本技术选择茯苓多糖和茶多酚与抗生素作为组合物。
80.通过对比实施例3、实施例20-21以及对比例13-14的检测结果可知,单独使用万古霉素或青霉素处理小鼠,均会较大程度地导致小鼠食欲和体重降低。当选择万古霉素或青霉素与茶多酚、茯苓多糖一起处理小鼠,小鼠食欲和体重较对比例13-14的检测结果略有提高,而与实施例3的检测结果相比,实施例20-21构建的类无菌小鼠的饮用水消耗量、饲料消耗量和体重均较低。因此,本技术抗生素选自伊维菌素和庆大霉素。
81.同时,通过对比实施例3、实施例14-15的检测结果可知,当抗生素为伊维菌素或庆大霉素时类无菌小鼠的饮用水消耗量、饲料消耗量和体重,远小于当抗生素为伊维菌素和庆大霉素复合使用时类无菌小鼠的相应特征。因此,本技术选择抗生素为伊维菌素和庆大霉素复合使用。
82.通过对比实施例3、10-13、对比例5-6的检测结果,可知本技术提供的组合物中将抗生素的添加量控制在10-15份,能够有效提高所构建的类无菌小鼠的饮用水消耗量、饲料消耗量和体重。因此,将组合物中抗生素的添加量控制在上述范围内,能够有效改善所构建的类无菌小鼠的食欲和消化功能。进一步地,当组合物中抗生素的添加量小于11份时类无菌小鼠的饮用水消耗量、饲料消耗量和体重,小于当抗生素的添加量为11-13.2份时类无菌小鼠的相应特征,而当组合物中抗生素的添加量大于13.2份时类无菌小鼠的饮用水消耗量、饲料消耗量和体重,与抗生素的添加量为13.2份时的相应特征相差不大。因此,进一步将组合物中抗生素的添加量控制在11-13.2份。
83.通过对比实施例1-5、对比例1-2的检测结果,可知本技术提供的组合物中将茯苓多糖的添加量控制在8-13份,能够有效提高所构建的类无菌小鼠的饮用水消耗量、饲料消耗量和体重。因此,将组合物中茯苓多糖的添加量控制在上述范围内,能够有效改善所构建的类无菌小鼠的食欲和消化功能。进一步地,当组合物中茯苓多糖的添加量小于9.2份时类无菌小鼠的饮用水消耗量、饲料消耗量和体重,小于当茯苓多糖的添加量为9.2-11.6份时类无菌小鼠的相应特征,而当组合物中茯苓多糖的添加量大于11.6份时类无菌小鼠的饮用水消耗量、饲料消耗量和体重,与茯苓多糖的添加量为11.6份时的相应特征。因此,进一步将组合物中茯苓多糖的添加量控制在9.2-11.6份。
84.通过对比实施例3、6-9、对比例3-4的检测结果,可知本技术提供的组合物中将茶多酚的添加量控制在4-8份,能够有效提高所构建的类无菌小鼠的饮用水消耗量、饲料消耗量和体重。因此,将组合物中茶多酚的添加量控制在上述范围内,能够有效改善所构建的类无菌小鼠的食欲和消化功能。进一步地,当组合物中茶多酚的添加量小于4.4份时类无菌小鼠的饮用水消耗量、饲料消耗量和体重,小于当茶多酚的添加量为4.4-6.8份时类无菌小鼠的相应特征;而当组合物中茶多酚的添加量大于6.8份时类无菌小鼠的饮用水消耗量、饲料消耗量和体重,与茶多酚的添加量为6.8份时小鼠的相应特征相差不大。因此,进一步将组合物中茶多酚的添加量控制在4.4-6.8份。
85.通过对比实施例3、实施例16-19的检测结果可知,当抗生素选择伊维菌素和庆大霉素一起使用时,当伊维菌素和庆大霉素的重量比为1:0.2或1:4时类无菌小鼠的饮用水消耗量、饲料消耗量和体重,均小于当伊维菌素和庆大霉素的重量比控制在1:(0.5-3)时类无菌小鼠的相应特征。而将伊维菌素和庆大霉素的重量比控制在1:(0.5-3),能够有效提高所构建的类无菌小鼠的饮用水消耗量、饲料消耗量和体重。因此,将抗生素中伊维菌素和庆大霉素的重量比控制在1:(0.5-3)范围内。
86.二、粪菌检测与盲肠外观检测以实施例3提供的类无菌小鼠模型以及上述“一、饲料消耗量、饮用水消耗量以及体重变化的监控结果”中的对照组为检测对象,进行下列检测。检测的方法具体如下:(1)粪菌检测:采集小鼠的新鲜粪便制作粪菌涂片并染色观察,首先收集小鼠新鲜粪便于无菌ep管中,每10mg粪便加入无菌生理盐水100μl,静置15min后匀浆,随后1000r/min,4℃下离心5min,收集上清液,混匀后抽取10μl,滴于载玻片上,革兰氏染色后制作粪菌涂片并观察。
87.检测结果如图1所示。
88.图1为实施例3构建的类无菌小鼠模型和对照组提供的小鼠的粪菌检测结果对比
图。其中,a图为对照组提供的小鼠的粪菌检测的试验结果;b图为实施例3构建的类无菌小鼠模型的粪菌检测的试验结果。
89.由图1可知,对照组提供的小鼠的粪菌图片中微生物数量较多,而实施例3构建的类无菌小鼠模型的粪菌图片中微生物数量很少,表明在构建类无菌小鼠模型的过程中,经过抗生素、茶多酚、茯苓多糖的组合物处理后,类无菌小鼠模型肠道内大部分的微生物菌群被清除。
90.结合性能检测试验一,实施例3构建的类无菌小鼠的食欲和体重均得到提高,因此,本技术提供的抗生素、茶多酚、茯苓多糖的组合物能够调整小鼠肠道内的菌群结构,在清除小鼠肠道内大部分微生物菌群的同时,可以保护肠道内的有益菌。因此,本技术提供的组合物能够改善小鼠体内的肠道环境,促进小鼠肠道的消化功能,从而提高所构建的类无菌小鼠的食欲和体重。
91.(2)盲肠检测:解剖小鼠,观察小鼠的肠道外观及盲肠扩张情况。
92.检测结果分别如图2、图3所示。
93.图2为实施例3构建的类无菌小鼠模型和对照组提供的小鼠的肠道外观对比图。其中,a图为对照组提供的小鼠的肠道外观图;b图为实施例3构建的类无菌小鼠模型的肠道外观图。
94.图3为实施例3构建的类无菌小鼠模型和对照组提供的小鼠的盲肠扩张对比图。其中,a图为对照组提供的小鼠的盲肠扩张图;b图为实施例3构建的类无菌小鼠模型的盲肠扩张图。
95.由图2和图3可知,对照组提供的小鼠与实施例3构建的类无菌小鼠的肠道均存在盲肠扩张的现象。且相比于对照组的小鼠,实施例3构建的类无菌小鼠的盲肠表现出更为明显的扩张。
96.基于上述,在构建类无菌小鼠模型的过程中,经过抗生素、茶多酚与茯苓多糖的组合物处理后,小鼠肠道内微生物菌群大部分被清除,盲肠存在明显的扩张现象,符合类无菌小鼠的相关表现,表明类无菌小鼠模型构建成功。
97.虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1