一种同时负载多极性功能因子的海藻酸盐基微凝珠及其制备方法和应用
1.本发明属于食品、医药、生物、化学等领域应用的海藻酸盐基凝胶珠及其制备方法,具体涉及一种同时负载多种功能因子的海藻酸盐基微凝珠及其制备方法。
背景技术:
2.能够调节人体机能的物质被称为功能因子,天然食品中富含多种功能因子,这些功能因子除了发挥各自不同的生理活性以外,共存时还会有协同促进人体吸收和健康的作用。对于加工食品而言,人们越来越期望能够通过特定的加工工艺实现天然食品中功能因子的存在模式,因此同时负载多极性功能因子的食品体系更能受到消费者青睐而具有更高的应用价值。为了实现在加工食品中添加多种功能因子,通常需要借助针对功能因子的传递体系对其进行保护和递送。另一方面,随着消费者对食品口感、美观程度以及营养价值的需求逐渐提高,市场功能性产品形式愈发丰富,已摆脱传统片剂、胶囊、口服液和粉剂等单一食用形式,然而如何构建同时负载不同极性功能因子的体系并进一步拓展产品食用形式与消费场景是目前行业面临的挑战。
3.海藻酸盐作为天然来源的多糖常被运用于功能因子负载体系的构建。海藻酸盐可以通过简单的滴加法形成粒径为毫米级的海藻酸盐微凝珠,作为新型功能性食品载体具有很好的应用潜力:能够使消费者体感化功能因子的摄入过程,适用范围广,如可用于饮料、凝胶、乳品和糕点装饰等。中国发明专利cn112293693a、cn103110153a和cn110200075a已经介绍了以海藻酸盐和果蔬汁和茶饮等为主要原料制备了具有良好营养价值的微凝珠,但以上专利技术主要集中在与现有食品体系复配,其中海藻酸盐凝胶仅包含单一水相,无法满足负载多极性功能因子的需求,且单一的海藻酸盐微凝珠还具有孔隙度大、包埋效果不理想等缺陷。如何改善并扩大海藻酸盐微凝珠作为功能因子传递体系的应用成为一个需要解决的问题。
4.双凝胶是一种同时包含结构化的水相和油相的双相体系,能够同时负载并保护多极性功能因子,并改善单一凝胶体系的性质,相比于其它双相体系(如乳液凝胶)具有更低的油浸出量,并且制备工艺简单。黄娟等制备了多重乳液-海藻酸钙水凝胶球实现了不同极性功能因子的负载(黄娟,蒋萍福,解文静,陈健初,施建强,扈晓佳.多重乳液-海藻酸钙水凝胶球的制备及对不同极性营养元素的传递[j].日用化学工业,2021,51(09):865-873.),但制备过程中需要采用“两步法”制备多重乳液,且工艺复杂。由于多重乳液包含两个界面,体系具有高不稳定性,因此需要同时添加两种以上的乳化剂,使得该发明组分也非常复杂,实际应用存在很大难度。与此报道类似,sun等(sun r,xia q.in vitro digestion behavior of(w1/o/w2)double emulsions incorporated in alginate hydrogel beads:microstructure,lipolysis,and release[j].food hydrocolloids,2020,107:105950)构建了多重乳液-海藻酸水凝胶球,也存在同样的问题。上述两个报告涉及的体系包含水凝胶和油凝胶,但是基于多重乳液,体系更为复杂。目前,基于油凝胶和水凝胶简单混合的双凝
胶的发明非常有限,中国发明专利cn114191381a、cn114304283a通过均质混合油凝胶和水凝胶提供一种品质稳定并且生产工艺简单的食品级双凝胶,属于大块凝胶,主要作为塑性脂肪替代品的应用。上述两个发明尽管提到了双凝胶可以应用于不同功能因子的负载,但未报道功能因子包埋的实际效果。因此,在现有技术中暂未见利用海藻酸盐制备稳定性较好、粒径为毫米级别的双凝胶体系并用于同时负载多极性功能因子的报道。
技术实现要素:
[0005]
针对现有技术和产品的不足之处,本发明所要解决的技术问题是,一是解决现有单一相微凝珠包埋率不佳、稳定性不高等问题,提供一种微结构可调控性强、稳定性强、形式新颖、品质良好应用范围广的微凝珠;二是实现了多种功能因子的同时负载,提供了一种同时负载多极性功能因子的海藻酸盐基微凝珠;三是提供一种同时负载多极性功能因子的海藻酸盐基微凝珠的制备方法,具有工艺简单操作方便、尽量降低乳化剂用量、成本低廉的优点;四是提供一种同时负载多极性功能因子的海藻酸盐基微凝珠的应用方法,拓展了现有双凝胶与功能性食品的应用形式与领域,实现多元功能性以丰富食品营养功能,在保健食品领域具有巨大的应用潜力。
[0006]
为实现上述目的,本发明提供以下技术方案:
[0007]
本发明首先提供了一种改善单一相体系包埋率并实现同时负载多极性功能因子的海藻酸盐基微凝珠,所述微凝珠中包括多个结构相,所述微凝珠结构包括内相和外相两部分,第一部分为内相结构,为至少负载脂溶性功能因子和油凝胶剂的部分,第二部分为外相结构,为至少负载水溶性功能因子和海藻酸盐或海藻酸盐复配物的部分,以及微凝珠结构中还包括交联剂和少量乳化剂组分,且所述微凝珠的直径为0.5-15mm,0.5-5mm,5-10mm,10-15mm,优选为1.5-2.5mm。
[0008]
进一步,所述微凝珠的硬度为:0.1-20n,0.5-15n,1-10n,2.5-5n。
[0009]
进一步,所述微凝珠制备完成后放置于蒸馏水中一天的溶胀率为:100%-200%,110%-180%,130%-160%,140%-150%。
[0010]
外相结构水溶性功能因子包括:抗坏血酸、硫胺素、核黄素、叶酸、泛酸、茶多酚、咖啡因、花青素、γ-氨基丁酸中的至少一种。
[0011]
外相结构中水溶性功能因子的浓度为低于其在水相中溶解度的任意浓度。
[0012]
进一步,所述的内相部分还包括可食用的液态油脂。
[0013]
进一步,所述食用的液态油脂包括:玉米油、花生油、椰子油、大豆油、菜籽油、油茶籽油、亚麻籽油、橄榄油、芝麻油、葡萄籽油中的至少一种。
[0014]
内相结构中油凝胶剂包括:单硬脂酸甘油酯、蜂蜡、乙基纤维素、卵磷脂中的至少一种。
[0015]
内相结构中的油凝胶剂的质量百分数为:2%-20%,5%-15%,8%-10%。
[0016]
内相结构中脂溶性功能因子包括:姜黄素、叶黄素、番茄红素、β-胡萝卜素、白藜芦醇、维生素a、维生素d、维生素e、dha、epa中至少一种。
[0017]
内相结构中脂溶性功能因子的浓度为低于其在油相中溶解度的任意浓度。
[0018]
进一步,所述乳化剂,包括:吐温-20、吐温80、吐温60、乳清分离蛋白、变性淀粉、酪蛋白酸钠中的至少一种。
[0019]
进一步,所述乳化剂的质量百分比为:0.1%-5%,0.5%-4%,2%-3%。
[0020]
本发明还涉及所述同时负载多极性功能因子的海藻酸盐基微凝珠的制备方法,包括以下步骤:
[0021]
(1)制备外相部分:将海藻酸盐或海藻酸盐复配物、乳化剂与水溶性功能因子于去离子水中搅拌均匀,备用;
[0022]
(2)制备内相部分:将油凝胶剂、脂溶性功能因子于可食用液态油脂中搅拌均匀,随后放置于低温环境中冷却,备用;
[0023]
(3)将步骤(2)制备获得的内相部分缓慢加入步骤(1)制备获得的外相部分中,并搅拌均匀,获得包含水溶性和脂溶性功能因子的混合溶液;
[0024]
(4)将步骤(3)获得的混合溶液均匀滴加入交联剂中,使得混合溶液形成胶体状微凝珠,过滤即可获得负载多极性功能因子的海藻酸盐基微凝珠。
[0025]
进一步,步骤(1)海藻酸盐包括海藻酸钠、海藻酸钾、海藻酸铵中的一种或几种。
[0026]
进一步,步骤(1)外相部分中海藻酸盐或海藻酸盐复配物的质量浓度为0.5-2.5%,优选为1-2%。
[0027]
进一步,步骤(1)海藻酸盐复配物包括海藻酸盐与卡拉胶、魔芋胶、壳聚糖、琼脂、明胶、结冷胶、黄原胶中的一种或几种复配获得。
[0028]
进一步,步骤(2)搅拌过程中还可以同时包括促进脂溶性功能因子溶解的步骤,包括加热、超声、涡旋震荡中的一种或几种。
[0029]
进一步,步骤(2)获得的内相部分属于凝胶,更进一步属于油凝胶。
[0030]
进一步,步骤(3)获得的包含水溶性和脂溶性功能因子的混合液中,内相部分占总混合液的质量浓度为5-50%,7-45%,9-40%,12-35%,15-30%,优选为10-30%。
[0031]
进一步,步骤(4)中滴加的交联剂为钙盐溶液,所述钙盐包括乳酸钙、氯化钙、葡萄酸钙的一种或多种,钙盐的质量浓度为3-5%,滴加的设备可以是本领域常规的自动化滴加设备,或半自动化,或手动滴加设备。
[0032]
步骤(4)所述均匀滴加的速率为0.05-0.25ml/s,0.07-0.20ml/s,0.10-0.17ml/s,优选为0.15-0.20ml/s。
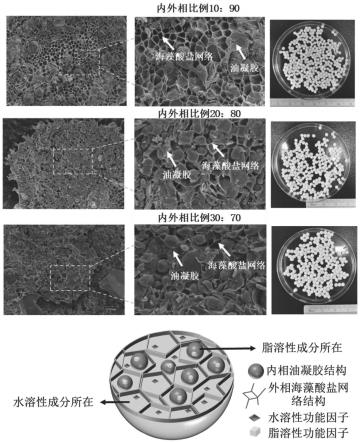
[0033]
步骤(4)中交联时间为20-60min,优选为30-60min。
[0034]
步骤(4)中采用的锐孔-凝固浴法是最简单和使用最广泛的制备微凝珠的技术,将含有海藻酸盐的溶液通过注射工具滴加入含有钙盐的凝固浴中快速形成微凝珠,具有工艺简单方便操作成本低廉等优势。
[0035]
步骤(4)由于搅拌后获得的体系中外相为水相,当接触钙盐溶液时,钙离子与海藻酸盐立刻生成海藻酸钙凝胶,油凝胶的机械特性有效缓解外部水凝胶网络形成过程中的收缩,减少体系中水溶性和脂溶性功能因子因收缩造成的损失,提升了体系包埋率和营养价值。
[0036]
本发明还涉及同时负载多极性功能因子的海藻酸盐基微凝珠的应用,具体地在食品领域中作为营养增强剂、食品添加剂、风味赋予组分、提升食品咀嚼口感组分,微凝珠的使用方式可以为直接添加到食品中,或作为食品伴侣单独包装。
[0037]
进一步,所述食品包括瓶装水、糕点、面包、液体乳及乳制品、酒及含酒精饮料、非酒精饮料和茶饮料、冷冻饮品、糖果等。
[0038]
与现有技术相比,本发明的有益效果如下:
[0039]
(1)本发明通过构建同时含油水两相的双凝胶,改善单一海藻酸盐微凝珠包埋物质有限以及包埋率低的不足,实现多极性功能因子的同时负载,拓展海藻酸盐凝胶体系的应用;
[0040]
(2)本发明采用结构化的油水两相以双凝胶的形式对不同极性的功能因子进行负载递送,两种极性的功能因子分别分布在微凝珠内外两相中,结构化的两相能够有效抵御外界不利环境的影响,有效保护功能因子;
[0041]
(3)本发明海藻酸盐直接与水溶性功能因子混合,成分、工艺步骤简单,便于生产与调控,成本较低,可实现全程自动化操作,制造的微凝珠区别于传统大块状的双凝胶形式,微凝珠粒径为毫米级,咀嚼和吞咽困难人群也能够食用,并且能够应用到多种现有食品中提高营养价值,具有丰富的消费场景。
附图说明
[0042]
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据提供的附图获得其他的附图。
[0043]
图1为实施例1制备得到的海藻酸盐基微凝珠的微观结构示意图与其冷冻扫描电子显微镜分析图;
[0044]
图2为实施例1与对照例1制备得到的海藻酸盐基微凝珠的质构特性分析图;
[0045]
图3为实施例1制备得到的海藻酸盐基微凝珠经干燥后在3wt.%nacl溶液中溶胀特性分析图;
[0046]
图4为实施例1与对照例1制备得到的海藻酸盐基微凝珠对水溶性功能因子egcg和脂溶性功能因子姜黄素的包埋率分析图;
[0047]
图5为实施例1部分应用场景示意图。
具体实施方式
[0048]
为使本领域人员详细了解本发明的生产工艺和技术效果,通过下面结合具体的生产实施例和附图对本发明作进一步详细的描述,但本发明的实施方式不限于此。
[0049]
在没有特别说明的情况下,对搅拌的转速和时间没有特别的限定,搅拌至本领域技术人员了解的均匀即可。
[0050]
在没有特别说明的情况下,室温表示25
±
2℃。
[0051]
根据本发明所述的方案,本发明提供以下一些优选的具体实施方式。
[0052]
实施例1不同内外相比例的海藻酸盐基微凝珠的制备
[0053]
本实施例提供了5种不同内外相比例的海藻酸盐基微凝珠
[0054]
1、制备方法
[0055]
(1)制备外相部分:将海藻酸钠(占外相1.0%,w/w)、水溶性功能因子表没食子儿茶素没食子酸酯((-)-epigallocatechin gallate,egcg)(占外相0.2%,w/w)、吐温-20(占整体0.5%,w/w)均匀溶解于去离子水中,备用;
[0056]
(2)制备内相部分:将单硬脂酸甘油酯(占内相10.0%,w/w)与脂溶性功能因子姜黄素(占内相0.2%,w/w)分散于玉米油中,并加热至80℃,随后放置于4℃环境中冷却0.5h,之后放置室温中平衡30min;
[0057]
(3)按照内外相以10:90、15:85、20:80、25:75、30:70的比例,将步骤(2)制备获得的内相部分缓慢加入步骤(1)制备获得的外相部分中,并搅拌均匀,获得包含水溶性和脂溶性功能因子的混合溶液;
[0058]
(4)将步骤(3)获得的混合溶液通过蠕动泵经内径为0.7mm的滴加设备以0.15ml/s的滴加速度滴入氯化钙溶液(3%,w/w)中,滴加高度为10cm,交联30min形成微凝珠,随后过滤并用蒸馏水洗涤得到所述负载多极性功能因子的海藻酸盐基微凝珠。
[0059]
2、样品测试
[0060]
(1)横截面微观结构
[0061]
1)方法
[0062]
将微凝珠样品放置于样品台的圆孔内,随后将样品台投入到液氮雪泥中,待液面完全停止沸腾后,转移至冷冻制样传输系统的对接台上,加少量液氮至雪泥中,抽真空12s后将样品台封闭在冷冻传输系统的转移仓内,快速对接至制备腔内,-130℃断裂样品。待制备腔真空降至1
×
10-2
pa后,-75℃升华40min,然后以12ma的电流溅射80s,最后送入扫描电镜进行观察。
[0063]
2)结果
[0064]
图1为本实施例按照不同内外相比例制备得到的海藻酸盐基微凝珠的横截面的冷冻扫描电子显微镜图。其中,蜂窝状网络结构为外相水相中海藻酸钙网络结构,填充的球状物质为内相油凝胶。从图1中可以看出随着油相含量的增加,球状油滴越发不规则,水相网络结构清晰度降低,结构粗糙程度增加。
[0065]
(2)粒径分析
[0066]
1)方法
[0067]
样品的粒径采用软件imagej进行分析统计,球形度的计算公式如下:
[0068]
球形度=2d
min
/(d
min
+d
max
);
[0069]
其中d
max
和d
min
分别为微凝珠最大与最小的直径,至少从每组实施例选择50颗样品进行统计计算。结果见表1。
[0070]
2)结果
[0071]
表1实施例1中制备的微凝珠粒径以及球形度
[0072][0073]
注:同列字母不同表示差异显著(p《0.05)。
[0074]
由表1可知,随着内相(油凝胶)添加量的增加微凝珠粒径逐渐增加。当内外相比例从10∶90增加到30∶70时,粒径从0.207
±
0.014cm增加到0.224
±
0.017cm。结果表明油凝胶具有一定的机械特性能够缓解海藻酸钠与钙离子形成凝胶网络结构时体系的脱水收缩。此外,各个浓度之间球型度均在0.95左右,表明样品球型度均良好。
[0075]
(3)质构性质
[0076]
1)方法
[0077]
使用ct3质构分析仪对球型度较好的单个海藻酸盐基微凝珠进行压缩。将微凝珠珠粒放置于平坦的台面上,选用柱形探头ta/0.5。在室温下以0.5mm/s的速度进行压缩测试,触发点负载为0.05n,形变量设置为30%,探头在压缩后立即返回其原始位置,硬度等指标可由软件直接得到。弹性模量依据赫兹理论确定,计算公式如下:
[0078][0079]
其中r0是微凝珠珠的半径,e是弹性模量,h是位移,ν是泊松比,f是施加的力。先将压缩力(f)与位移(h)
3/2
作图。泊松比ν假定为0.5。随后可以通过f-h
3/2
图中斜率确定微凝珠的杨氏模量。测试结果如图2所示。
[0080]
3)结果
[0081]
图2为本实施例按照不同内外相比例制备得到的海藻酸盐基微凝珠的质构特性,随着内相油凝胶含量的进一步增加,微凝珠的弹性模量出现了显著降低(p《0.05)。
[0082]
(4)溶胀特性
[0083]
1)方法
[0084]
通过热风干燥至微凝珠衡重的方式干燥样品,随后将已知重量的干燥样品放入15ml nacl溶液(3%,w/w)中,并让其在室温下溶胀。每隔固定时间取出微凝珠,用滤纸吸干除去表明水并称重。记录数据,直到规定时间为止,溶胀比的计算公式如下:
[0085][0086]
其中w0是样品的初始质量(g),w1是在体系溶胀一段时间后样品的质量(g)。
[0087]
2)结果
[0088]
图3为本实施例按照不同内外相比例制备得到的海藻酸盐基微凝珠在nacl溶液(3%,w/w)下随着时间的溶胀情况,结果表明,微凝珠的溶胀率随着内相油凝胶含量的增加而下降,并且油凝胶含量相对较高(25:75和30:70)在100-200min之间出现了溶胀率拐点,说明随着溶胀时间的延长出现了结构的溃解。
[0089]
(5)功能因子的包埋率
[0090]
1)方法
[0091]
微凝珠中的功能因子含量测定方法为:分别准确称取0.5g本实施例按照不同内外相比例制备得到的海藻酸盐基微凝珠,加入3ml 0.1mph6.8的磷酸盐缓冲液,静置1h后进行涡旋震荡2min,随后加入3ml三氯甲烷并涡旋震荡2min,随后于10000rpm离心5min,分别收集上层水相和下层有机相,实验过程注意避光。利用紫外可见分光光度计分别在功能因子对应最大吸收波长处测定其吸光度,并根据标准曲线计算样品中的姜黄素和egcg含量,功
能因子包埋率的计算公式如下:
[0092][0093]
2)结果
[0094]
图4为本实施例按照不同内外相比例制备得到的海藻酸盐基微凝珠中不同功能因子的包埋率。本实施例中制备的微凝珠实现了水溶性和脂溶性功能因子的双载,具体的负载效果和体系中内外相比例有关。此外不同内外相比例制备得到的海藻酸盐基微凝珠在37℃条件下储存7天后,其姜黄素和egcg保留率均大于初始值的50%,有效提高了功能因子的稳定性。
[0095]
由本实施例的前述结果可知,可以通过调整微凝珠的微结构,即改变内外相比例以及内相油滴的填充作用等调控微凝珠的粒径、溶胀特性、功能因子包埋率,可以满足不同的应用要求。
[0096]
实施例2一种负载egcg和β-胡萝卜素的海藻酸盐基微凝珠
[0097]
1、制备方法
[0098]
(1)制备外相部分:将海藻酸钠(占外相1.0%,w/w)、水溶性功能因子egcg(占外相0.2%,w/w)、吐温-20(占外相与内相整体0.5%,w/w)均匀溶解于去离子水中,备用;
[0099]
(2)制备内相部分:将单硬脂酸甘油酯(占内相10.0%,w/w)与脂溶性功能因子β-胡萝卜素(占内相0.5%,w/w)分散于玉米油中,并加热至80℃,随后放置于4℃环境中冷却0.5h,之后放置室温中平衡30min;
[0100]
(3)按照内外相以20:80的比例,将步骤(2)制备获得的内相部分缓慢加入步骤(1)制备获得的外相部分中,并搅拌均匀,获得包含水溶性和脂溶性功能因子的混合溶液;
[0101]
(4)将步骤(3)获得的混合溶液通过蠕动泵经内径为0.7mm的滴加设备以0.15ml/s的滴加速度滴入氯化钙溶液(3%,w/w)中,滴加高度为10cm,交联30min形成微凝珠,随后过滤并用蒸馏水洗涤得到所述负载多极性功能因子的海藻酸盐基微凝珠。
[0102]
2、样品测试
[0103]
样品测试方法除功能因子包埋率与负载量的测定方法外与实施例1中一致。β-胡萝卜素包埋率的测定方法为准确称取0.5g本实施例得到的海藻酸盐基微凝珠,加入3ml 0.1mph6.8的磷酸盐缓冲液,静置1h后进行涡旋震荡2min,随后加入3ml正己烷并涡旋震荡2min,随后于10000rpm离心5min,收集有机相,实验过程注意避光。利用紫外可见分光光度计在功能因子对应最大吸收波长处测定其吸光度,并根据标准曲线计算样品中β-胡萝卜素的含量,功能因子的包埋率和负载量的计算公式分别如下:
[0104][0105][0106]
实施例2制备得到的样品粒径为0.192
±
0.013mm,硬度为0.22
±
0.02n,egcg的包埋率为42.8
±
1.4%,负载量为0.68
±
0.02mg/g,β-胡萝卜素包埋率为52.2
±
2.8%,负载量为0.52
±
0.03mg/g。
[0107]
实施例3一种负载egcg和姜黄素的海藻酸盐-卡拉胶复配微凝珠
[0108]
1、制备方法
[0109]
(1)制备外相部分:将海藻酸钠(占外相0.8%,w/w)、卡拉胶(占外相0.2%,w/w)、水溶性功能因子egcg(占外相0.2%,w/w)、吐温-20(占外相与内相整体0.5%,w/w)均匀溶解于去离子水中,备用;
[0110]
(2)制备内相部分:将单硬脂酸甘油酯(占内相10.0%,w/w)与脂溶性功能因子姜黄素(占内相0.2%,w/w)分散于玉米油中,并加热至80℃,随后放置于4℃环境中冷却0.5h,之后放置室温中平衡30min;
[0111]
(3)按照内外相以20:80的比例,将步骤(2)制备获得的内相部分缓慢加入步骤(1)制备获得的外相部分中,并搅拌均匀,获得包含水溶性和脂溶性功能因子的混合溶液;
[0112]
(4)将步骤(3)获得的混合溶液通过蠕动泵经内径为0.7mm的滴加设备以0.15ml/s的滴加速度滴入氯化钙溶液(3%,w/w)中,滴加高度为10cm,交联30min形成微凝珠,随后过滤并用蒸馏水洗涤得到所述负载多极性功能因子的海藻酸盐基微凝珠。
[0113]
2、样品测试
[0114]
样品测试方法与实施例1中一致,其中负载量计算方式与实施例2一致。实施例3制备得到的样品粒径为0.203
±
0.016mm,硬度为0.23
±
0.01n,egcg的包埋率为45.1
±
1.5%,负载量为0.72
±
0.02mg/g,姜黄素包埋率为85.5
±
2.9%,负载量为0.34
±
0.01mg/g。
[0115]
实施例4一种负载egcg和姜黄素的海藻酸盐微凝珠
[0116]
1、制备方法
[0117]
(1)制备外相部分∶将海藻酸钠(占外相1.0%,w/w)、水溶性功能因子egcg(占外相0.2%,w/w)、吐温-20(占外相与内相整体0.5%,w/w)均匀溶解于去离子水中,备用;
[0118]
(2)制备内相部分:将蜂蜡(占内相10.0%,w/w)与脂溶性功能因子姜黄素(占内相0.2%,w/w)分散于玉米油中,并加热至80℃,随后放置于4℃环境中冷却0.5h,之后放置室温中平衡30min;
[0119]
(3)按照内外相以20:80的比例,将步骤(2)制备获得的内相部分缓慢加入步骤(1)制备获得的外相部分中,并搅拌均匀,获得包含水溶性和脂溶性功能因子的混合溶液;
[0120]
(4)将步骤(3)获得的混合溶液通过蠕动泵经内径为0.7mm的滴加设备以0.15ml/s的滴加速度滴入氯化钙溶液(3%,w/w)中,滴加高度为10cm,交联30min形成微凝珠,随后过滤并用蒸馏水洗涤得到所述负载多极性功能因子的海藻酸盐基微凝珠。
[0121]
2、样品测试
[0122]
样品测试方法与实施例1中一致,其中负载量计算方式与实施例2一致。实施例4制备得到的样品粒径为0.208
±
0.013mm,硬度为0.22
±
0.03n,egcg的包埋率为38.5
±
2.3%,负载量为0.62
±
0.04mg/g,姜黄素包埋率为77.1
±
0.3%,负载量为0.31
±
0.00mg/g。
[0123]
实施例5一种负载维生素c和姜黄素的海藻酸盐微凝珠
[0124]
1、制备方法
[0125]
(1)制备外相部分:将海藻酸钠(占外相1.0%,w/w)、水溶性功能因子维生素c(占外相0.2%,w/w)、吐温-20(占外相与内相整体0.5%,w/w)均匀溶解于去离子水中,备用;
[0126]
(2)制备内相部分:将单甘酯(占内相10.0%,w/w)与脂溶性功能因子姜黄素(占内相0.2%,w/w)分散于玉米油中,并加热至80℃,随后放置于4℃环境中冷却0.5h,之后放置
室温中平衡30min;
[0127]
(3)按照内外相以20∶80的比例,将步骤(2)制备获得的内相部分缓慢加入步骤(1)制备获得的外相部分中,并搅拌均匀,获得包含水溶性和脂溶性功能因子的混合溶液;
[0128]
(4)将步骤(3)获得的混合溶液通过蠕动泵经内径为0.7mm的滴加设备以0.15ml/s的滴加速度滴入氯化钙溶液(3%,w/w)中,滴加高度为10cm,交联30min形成微凝珠,随后过滤并用蒸馏水洗涤得到所述负载多极性功能因子的海藻酸盐基微凝珠。
[0129]
2、样品测试
[0130]
样品测试方法除功能因子包埋率和负载量的测定方法外与实施例1中一致。维生素c包埋率的测试方法为:准确称取0.5g本实施例得到的海藻酸盐基微凝珠,加入3ml 0.1mph 6.8的磷酸盐缓冲液,静置1h后进行涡旋震荡2min,随后加入3ml氯仿并涡旋震荡2min,随后于10000rpm离心5min,收集上层水相,实验过程注意避光。利用紫外可见分光光度计在功能因子对应最大吸收波长处的测定其吸光度,并根据标准曲线计算样品中维生素c的含量,维生素c包埋率的计算公式如下:
[0131][0132][0133]
实施例5制备得到的样品粒径为0.200
±
0.014mm,硬度为0.21
±
0.02n,维生素c的包埋效果不佳,包埋率仅为0.7
±
0.1%,负载量为0.028
±
0.00mg/g,姜黄素包埋率为60.8
±
2.2%,负载量为0.24
±
0.01mg/g。
[0134]
对比例1一种单相负载egcg的海藻酸盐微凝珠
[0135]
1、制备方法
[0136]
将海藻酸钠(1.0%,w/w)和水溶性功能因子儿茶素(0.2%,w/w)均匀溶解于去离子水中,通过蠕动泵经内径为0.7mm的滴加设备以0.15ml/s的滴加速度滴入氯化钙溶液(3%,w/w)中,滴加高度为10cm,交联30min形成海藻酸盐微凝珠,随后过滤并用蒸馏水洗涤得到单相负载水溶性功能因子的海藻酸盐微凝珠。
[0137]
2、样品测试
[0138]
样品测试方法与实施例1中一致。溶胀率测试方法为:将已知重量的刚制备获得的样品放入蒸馏水中,并让其在室温下溶胀24h,随后取出微凝珠,用滤纸吸干除去表明水并称,溶胀率的计算公式如下:
[0139][0140]
其中m0是样品的初始质量(g),m1是在体系溶胀24h后样品的质量(g)。
[0141]
对比例1制备得到样品粒径为,硬度与弹性模量分别为0.26
±
0.03n和0.80
±
0.05mpa,egcg的包埋率为5.4
±
2.4%。于去离子水中贮藏一天后体系的溶胀率约为70%。由以上实施例中egcg包埋率结果可知,双凝胶体系的构建显著提升了体系对水溶性功能因子的包埋率,并且实现了对脂溶性功能因子的负载。结合图2可知,相比于低油凝胶添加量的基于双凝胶的海藻酸盐微凝珠体系(内外相比例为10:90),单一海藻酸盐微凝珠质构特
性较差,质构特性与摄入后消费者获得的感官体验密切相关。溶胀率结果可知,单一海藻酸盐微凝珠在贮藏过程中出现明显的失水现象,失水过程中会造成大量负载功能因子的损失,添加油相后体系的溶胀率均大于100%。可见,相比于单一的海藻酸盐微凝珠,本发明中含油凝胶的微凝珠能够同时提高产品的营养价值和口感特性。
[0142]
图5为实施例1的部分应用场景示意图,可见微凝珠可以用于多种食品中,提高食品健康属性。
[0143]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1