一种改善南美白对虾虾糜凝胶品质的方法
1.本发明属于食品加工技术领域,具体涉及到一种改善南美白对虾虾糜凝胶品质的方法。
背景技术:
2.南美白对虾(vannamei)原产于南美太平洋沿岸的水域,因其含有丰富的蛋白质、多不饱和脂肪酸、其他有用物质和鲜美的风味而深受世界各地消费者的喜爱,特别是在南亚和中国。中国曾于20世纪80年代末引进南美白对虾,并于90年代初期人工繁殖成功。2000年以后开始大规模进行养殖。目前南美白对虾已成为中国虾类养殖的主要对象之一。根据我国2020年水产年鉴显示,南美白对虾已经是除了小龙虾以外最高产量的虾类水产品种。
3.冷冻鱼糜是将鱼肉经过采肉、漂洗、脱水,然后添加一定量的糖类或者能够抑制蛋白质变性的添加物,促使其能够在较长时间内保存于低温条件下,冷冻鱼糜贮藏时间长、流通区域广,是研发和生产产品的中间素材。鱼糜制品由冷冻鱼糜加工而成,在其中加入食盐等辅料,然后斩拌,再成型、加热,制作成有弹性的产品,如鱼丸、鱼糕、蟹棒等。虾糜和虾糜制品就是以虾肉作为原料,参照鱼糜和鱼糜制品的加工制作方法制作而成的产品。如火锅虾滑。
4.虾糜蛋白质组成和蛋白质结构和鱼糜存在很大差异,和其自身拥有很高的内源性蛋白酶活性,使得虾糜的保藏及其制品的加工面临很大的困难。按照传统的鱼糜制品制作方法,人们难以生产出质量与鱼糜和鱼糜制品相当的虾糜及虾糜制品。
技术实现要素:
5.本部分的目的在于概述本发明的实施例的一些方面以及简要介绍一些较佳实施例。在本部分以及本技术的说明书摘要和发明名称中可能会做些简化或省略以避免使本部分、说明书摘要和发明名称的目的模糊,而这种简化或省略不能用于限制本发明的范围。
6.鉴于上述和/或现有技术中存在的问题,提出了本发明。
7.本发明的其中一个目的是提供一种改善南美白对虾虾糜凝胶品质的方法,使用的凝胶改良剂可以显著改善虾糜的凝胶特性,使虾糜凝胶具有良好的凝胶品质和质构,提高消费者的喜爱度。
8.为解决上述技术问题,本发明提供了如下技术方案:一种改善南美白对虾虾糜凝胶品质的方法,包括,
9.获得南美白对虾的虾糜;
10.向虾糜中加入凝胶改良剂进行混合斩拌;
11.其中,所述凝胶改良剂由l-精氨酸和微生物转谷氨酰胺酶配置而成。
12.作为本发明改善南美白对虾虾糜凝胶品质的方法的一种优选方案,其中:所述l-精氨酸添加量为虾糜总质量的0.3~0.5%,微生物转谷氨酰胺酶添加量为虾糜总质量的0.3~0.5%。
13.作为本发明改善南美白对虾虾糜凝胶品质的方法的一种优选方案,其中:所述进行混合斩拌,斩拌温度为0~4℃,斩拌时间为3~8min。
14.作为本发明改善南美白对虾虾糜凝胶品质的方法的一种优选方案,其中:所述向虾糜中加入凝胶改良剂,用0~4℃纯净水调整虾糜的水分含量至78~80%,再将入凝胶改良剂。
15.作为本发明改善南美白对虾虾糜凝胶品质的方法的一种优选方案,其中:所述获得南美白对虾的虾糜,将鲜活的南美白对虾去头、去壳处理,将虾仁用冷水进行清洗,在低温冰浴下进行空斩,向空斩好的虾糜中加入漂洗液漂洗,漂洗完成后进行脱水处理,得到虾糜。
16.作为本发明改善南美白对虾虾糜凝胶品质的方法的一种优选方案,其中:所述将鲜活的南美白对虾去头、去壳处理,将鲜活的南美白对虾放入-18~-20℃环境中冷冻20~40分钟制其猝死,后在0~4℃的低温环境中去头、去壳处理。
17.作为本发明改善南美白对虾虾糜凝胶品质的方法的一种优选方案,其中:所述南美白对虾选择7~10克重。
18.作为本发明改善南美白对虾虾糜凝胶品质的方法的一种优选方案,其中:所述将虾仁用冷水进行清洗,水温为0~4℃。
19.作为本发明改善南美白对虾虾糜凝胶品质的方法的一种优选方案,其中:所述在低温冰浴下进行空斩,斩拌温度为0~4℃,斩拌时间为3~8min。
20.作为本发明改善南美白对虾虾糜凝胶品质的方法的一种优选方案,其中:所述向空斩好的虾糜中加入漂洗液漂洗,漂洗液质量为虾糜质量的2~4倍,所述漂洗液由三分之一的冰和三分之二的水的冰水混合物组成,并含有0.3~0.5%的氯化钠和0.2~0.4%柠檬酸钠。
21.与现有技术相比,本发明具有如下有益效果:
22.本发明使用的凝胶改良剂可以显著改善虾糜的凝胶特性,使虾糜凝胶具有良好的凝胶品质和质构,提高消费者的喜爱度。
附图说明
23.为了更清楚地说明本发明实施例的技术方案,下面将对实施例描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其它的附图。其中:
24.图1为实施例1中不同原料预处理方式和不同漂洗次数对虾糜盐溶性蛋白含量和水溶性蛋白含量的影响示意图;图中不同字母不同组的a-d值表示有显著差异(p《0.05)。
25.图2为实施例2中不同温度下和不同漂洗次数虾糜中内源性蛋白酶总活性示意图;图中不同字母不同组的a-h值表示有显著差异(p《0.05)。
26.图3为实施例3中几种不同处理虾糜的电泳测定示意图;图中,a1=去头虾虾糜,a2=整虾虾糜,a3=去头虾虾糜(漂洗),a4=整虾虾糜(漂洗),b1=去头虾虾糜(4℃冷藏后),b2=整虾虾糜(4℃冷藏后),b3=去头虾虾糜(漂洗、4℃冷藏后),b4=整虾虾糜(漂洗、4℃冷藏后)。
27.图4为实施例6中虾糜凝胶tca可溶性肽测定示意图;图中不同字母不同组的a-d值表示有显著差异(p《0.05)。
28.图5为实施例7中虾糜凝胶微观结构示意图;图中(a)为去头虾糜凝胶,(b)为整虾虾糜凝胶,(c)为去头虾糜凝胶(漂洗一次),(d)为整虾虾糜凝胶(漂洗一次)。
29.图6为实施例8中不同氯化钠替代物对虾糜凝胶强度影响示意图;图中不同字母不同组的a-g值表示有显著差异(p《0.05)。
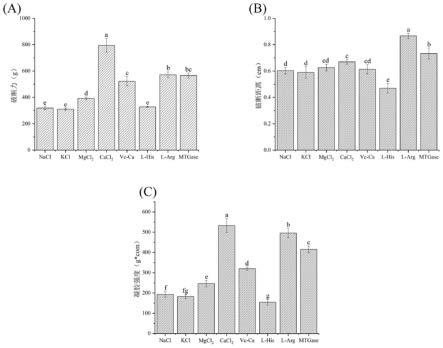
30.图7为实施例9中不同凝胶改良剂对虾糜凝胶强度影响示意图;其中(a)为破断力,(b)为破断距离,(c)为凝胶强度;图中不同字母不同组的a-m值表示有显著差异(p《0.05)。
31.图8为实施例10中不同凝胶改良剂对虾糜质构影响示意图;其中(a)为硬度,(b)为咀嚼性,(c)为弹性,(d)为凝聚力;图中不同字母不同组的a-m值表示有显著差异(p《0.05)。
32.图9为实施例11中不同凝胶改良剂对虾糜凝胶中的化学键作用力影响示意图;其中,n:添加1%nacl的虾糜凝胶。n-a(1-3):添加0.5%nacl,再分别添加0.5%,1.5%,2.5%l-arg的虾糜凝胶。n-t:添加1%nacl和0.75%mtgase的虾糜凝胶。n-t-a(1-3):添加0.5%nacl和0.75%mtgase,再分别添加0.5%,1.5%和2.5%l-arg的虾糜凝胶;图中不同字母不同组的a-g值表示有显著差异(p《0.05)。
33.图10为实施例12中不同凝胶改良剂对虾糜凝胶的微观结构影响示意图;其中,n:添加1%nacl的虾糜凝胶。n-a(1-3):添加0.5%nacl,再分别添加0.5%,1.5%,2.5%l-arg的虾糜凝胶。n-t:添加1%nacl和0.75%mtgase的虾糜凝胶。n-t-a(1-3):添加0.5%nacl和0.75%mtgase,再分别添加0.5%,1.5%和2.5%l-arg的虾糜凝胶。
34.图11为实施例13中不同凝胶改良剂对虾糜凝胶中的蛋白质二级结构含量影响示意图;其中,n:添加1%nacl的虾糜凝胶。n-a(1-3):添加0.5%nacl,再分别添加0.5%,1.5%,2.5%l-arg的虾糜凝胶。n-t:添加1%nacl和0.75%mtgase的虾糜凝胶。n-t-a(1-3):添加0.5%nacl和0.75%mtgase,再分别添加0.5%,1.5%和2.5%l-arg的虾糜凝胶;图中不同字母不同组的a-f值表示有显著差异(p《0.05)。
35.图12为实施例14中不同凝胶改良剂对虾糜凝胶的蛋白质电泳图;其中,n:添加1%nacl的虾糜凝胶。n-a(1-3):添加0.5%nacl,再分别添加0.5%,1.5%,2.5%l-arg的虾糜凝胶。n-t:添加1%nacl和0.75%mtgase的虾糜凝胶。n-t-a(1-3):添加0.5%nacl和0.75%mtgase,再分别添加0.5%,1.5%和2.5%l-arg的虾糜凝胶。
具体实施方式
36.为使本发明的上述目的、特征和优点能够更加明显易懂,下面结合说明书实施例对本发明的具体实施方式做详细的说明。
37.在下面的描述中阐述了很多具体细节以便于充分理解本发明,但是本发明还可以采用其他不同于在此描述的其它方式来实施,本领域技术人员可以在不违背本发明内涵的情况下做类似推广,因此本发明不受下面公开的具体实施例的限制。
38.其次,此处所称的“一个实施例”或“实施例”是指可包含于本发明至少一个实现方式中的特定特征、结构或特性。在本说明书中不同地方出现的“在一个实施例中”并非均指同一个实施例,也不是单独的或选择性的与其他实施例互相排斥的实施例。
39.实施例1
40.试验步骤:
41.(1)将冷冻猝死后的南美白对虾进行去头等预处理,分为去头和不去头的两组。去头组南美白对虾在头身连接处用清水简单清洗;然后将两组虾用采肉机采肉,将虾肉用食品加工器在不高于4℃的冰浴下空斩5min;分别将空斩后的虾糜进行:不漂洗,漂洗1,2,3次等处理。
42.性能测试:
43.水溶性蛋白:取虾肉糜样品,加入低盐酸缓冲液,25℃恒温振荡提取4h,经离心后,参照国标gb 5009.5-2016《食品安全国家标准食品中蛋白质的测定》测定虾糜中水溶性蛋白含量;
44.取虾糜加入低盐离子缓冲液,用高速分散器匀浆,然后用高速冷冻离心机在离心,取沉淀加高盐离子缓冲液,充分匀浆后置于4℃环境中静置1h,然后用用高速冷冻离心机离心。上清液即为盐溶性蛋白溶液,然后参照国标gb5009.5-2016《食品安全国家标准食品中蛋白质的测定》测定虾糜中盐溶性蛋白含量。
45.测试结果如图1所示。由图1可见,去头虾虾糜相较于整虾虾糜有着更高的盐溶性蛋白,更低的水溶性蛋白。在第一次漂洗后,两组虾糜的盐溶性蛋白含量都有较大幅度的上升,水溶性蛋白有较大幅度的下降。在第二次漂洗后,整虾虾糜的盐溶性蛋白任然显著上升,两组虾糜的水溶性蛋白有着显著性下降。而第三次漂洗后,两组虾糜的盐溶性蛋白均有一定程度的下降,可能是过多的漂洗会让部分盐溶性蛋白发生物理损失。
46.实施例2
47.采用与实施例1相同的试验步骤。并进行如下性能测试。
48.取一定量虾糜,加入3倍体积的磷酸盐缓冲液(ph为7.6)然后均质,置于冰浴中,用磁力搅拌器连续搅拌30min后,于4℃离心后,上清液即为虾肉粗酶液。移取粗酶液加入蒸馏水和反应缓冲液,先放入各温度(30℃,45℃,60℃,75℃,90℃)保温10min再加入血红蛋白溶液于各温度恒温水浴反应15min,然后加入质量分数50%tca溶液1ml终止反应,4℃离心后,上清液中肽的含量用福林酚法测定。一个酶活单位(u)定义为各温度下每毫克水溶性蛋白每分钟水解酪蛋白并释放1nmol酪氨酸的量。每组样品做3个平行样。粗酶液中的水溶蛋白含量由双缩脲法确定,结果如图2所示。
49.图2(a)中可见在相同处理的情况下整虾虾糜的内源性总蛋白酶活几乎是不含头虾糜的3倍,在60℃前,两组虾糜内源性总蛋白酶活随着温度上升而上升,60℃后,整虾虾糜的内源性总蛋白酶开始下降,到90℃时内源性总蛋白酶活性已经比30℃时要低。但是去头虾虾糜60℃至75℃总蛋白酶活几乎不变,75℃以后才开始下降。所以在虾糜凝胶的热加工过程中,整虾虾糜具有较高的内源性总蛋白酶活性,可能会对其蛋白有降解作用。图2(b)中可见在漂洗后,两组虾糜中的内源性总蛋白酶活性均有一定程度的下降,且整虾虾糜的下降幅度更大。说明漂洗能够除去虾糜中的内源性蛋白酶,且漂洗液中的柠檬酸钠蛋白酶抑制剂也能够同时对组织蛋白酶进行抑制。
50.实施例3
51.采用与实施例1相同的试验步骤。并进行如下性能测试。
52.取虾糜加入5%sds溶液,均质后85℃水浴1h。然后10000r/min冷冻离心20min,取上清液用双缩脲法测蛋白浓度。调整上清液蛋白至适宜浓度,等体积加入上样缓冲液煮沸
5min以使蛋白质变性。然后对样品进行电泳测试。结果如图3所示。
53.两组新鲜虾糜的电泳情况存在明显差异。整虾虾糜的肌原纤维蛋白重链(mhc)和肌动蛋白(actin)的条带强度较弱。在漂洗之后,两组新鲜虾糜的各条带强度均发生一定程度的增强,表明漂洗除去了一些污染物和内源性蛋白酶,使得肌原纤维蛋白蛋白的含量上升和蛋白质降解速率下降。在4℃冷藏后,两组虾糜之间存在更大的差异,可以看的整虾虾糜的mhc条带完全消失,actin条带得到了一小部分的保留,说明整虾虾糜中蛋白酶活性在4℃贮藏期间任然较高。
54.实施例4
55.试验步骤:
56.(1)将冷冻猝死后的南美白对虾进行去头等预处理,分为去头和不去头的两组。去头组南美白对虾在头身连接处用清水简单清洗。然后将两组虾用采肉机采肉,将虾肉用食品加工器在不高于4℃的冰浴下空斩5min。分别将空斩后的虾糜进行:不漂洗,漂洗1,2,3次等处理。
57.(2)将漂洗处理完成后的虾糜水分含量调整至78%,加入3%氯化钠后用食品加工器在不高于4℃的冰浴下盐斩5min,将盐斩后的虾糜装入塑料离心管在冷冻离心机在4℃下3000r/min离心5min;将装有虾糜的离心管放入40℃恒温水浴1小时,然后立刻放入90℃恒温水浴30min;获得的虾糜凝胶放入4℃冷藏室中冷却。
58.性能测试:
59.虾糜凝胶被切成15mm*15mm的圆柱体,利用ta.xt.plus texture analyzer对其全质构进行分析。选择p/35金属探头,测定参数设定为:测试前速度1mm/s,测试速度1mm/s,测试后速度1mm/s,下压距离10mm,触发力5g。测试结果如表1所示。
60.表1
[0061][0062][0063]
注:不同字母不同组的a-f值表示有显著差异(p《0.05)。
[0064]
由表1可知,两组虾糜制成的虾糜凝胶全质构(tpa)指标存在显著差异。无头虾糜凝胶的各种tpa均远高于整虾虾糜凝胶。在前两次漂洗后,两组虾糜凝胶的整体质量均得到了不同程度的提升,且两次漂洗后的样品质构特性最优。是由于漂洗除去了部分内源性蛋
白酶,漂洗液中的柠檬酸钠也能够同时降低组织蛋白酶活性。但在漂洗次数下整虾虾糜凝胶的质构特性均差于无头虾糜凝胶。由于第三次漂洗后,盐溶性蛋白可能会发生一定的物理损失,所以使得虾糜凝胶的tpa指标略微下降。
[0065]
实施例5
[0066]
采用与实施例4相同的试验步骤。并进行如下性能测试。
[0067]
糜凝胶被切成15mm*15mm的圆柱体,利用ta.xt.plus texture analyzer对其破断力(g),破断距离(mm),和凝胶强度(g
·
mm)进行分析。选择p/25s金属球形探头,测定参数设定为:测试前速度1mm/s,测试速度1mm/s,测试后速度1mm/s下压距离10mm,触发力5g。测试结果如表2所示。
[0068]
表2
[0069][0070]
注:不同字母不同组的a-f值表示有显著差异(p《0.05)。
[0071]
由表2可知,两组虾糜凝胶的凝胶强度变化规律和其tpa指标变化规律一致。相同处理的下,去头虾糜凝胶凝胶强度均高于整虾虾糜凝胶,且两组虾糜在第二次漂洗后所制成的虾糜凝胶均有着最高的凝胶强度。
[0072]
实施例6
[0073]
采用与实施例4相同的试验步骤。并进行如下性能测试。
[0074]
称取虾糜凝胶于试管中,加入27ml 5%的tca溶液,均质60s后于4℃下静置1h。将溶液在4℃下冷冻离心5min,取上清液用福林酚法测定tca-可溶性肽含量,结果用umol tyrosine/10g muscle表示,结果如图4所示。
[0075]
tca可溶性肽含量降低,这代表着mhc拥有更大的聚合度。图4中可见,整虾虾糜凝胶的tca可溶性肽含量远高于无头虾糜凝胶,这说明了整虾虾糜中内源性蛋白酶对其蛋白质的降解破坏作用使得其mhc聚合度下降。第一次漂洗后两组虾糜凝胶的tca可溶性肽含量均下降,但漂洗效果随着漂洗次数增加而减弱。无头虾糜凝胶tca可溶性肽在第二次漂洗后差异不显著,整虾虾糜凝胶在第三次漂洗后差异不显著。
[0076]
实施例7
[0077]
采用与实施例4相同的试验步骤。并进行如下性能测试。
[0078]
将虾糜凝胶用刀片切成均匀的2mm左右厚的薄片,4℃下用2.5%戊二醛(0.1mol/l ph 7.2磷酸盐缓冲液配置)固定过夜。用0.1mol/l ph 7.2磷酸盐缓冲液冲洗5次,并依次用50%的乙醇、70%的乙醇、80%的乙醇和90%的乙醇脱水15min,最后用纯乙醇溶液将鱼糜凝胶脱水两次每次20min。将样品冷冻干燥,冻干的样品固定在在青铜圆板上并进行喷金处理。在扫描电子显微镜(hitachi)下用3千伏的加速电压观察样品,结果如图5所示。
[0079]
观察到不同预处理的虾糜凝胶之间的微观结构存在明显差异。无头虾糜凝胶表面结构略粗糙,有一些小孔,但没有明显的裂纹。整虾虾糜凝胶的表面更不平整,呈花椰菜状,并观察到一些巨大的空洞和裂缝,表现出极其松散的结构,这与其较差的凝胶结构相对应。这些结果表明,在整虾虾糜中内源性蛋白酶在热诱导凝胶过程中引发了明显的凝胶劣化现象。虾头中的内源性蛋白酶对肌原纤维蛋白重链(mhc)有很强的降解作用,这在电泳测定中得到证实。结果,mhc的聚合度降低,导致形成具有较大孔隙和裂缝的粗网络结构,表明凝胶质量较差。第一次漂洗后,整虾虾糜凝胶的凝胶结构明显更致密,孔数和孔径均小于未漂洗整虾虾糜制成的凝胶。漂洗后,无头虾糜凝胶的凝胶结构变得更加平坦和致密,没有明显的孔洞。
[0080]
实施例8
[0081]
试验步骤:
[0082]
(1)将冷冻猝死后的南美白对虾进行去头等预处理。去头南美白对虾在头身连接处用清水简单清洗。然后用采肉机采肉,将虾肉用食品加工器在不高于4℃的冰浴下空斩5min。分别将空斩后的虾糜进行漂洗2次处理。
[0083]
(2)将漂洗处理完成后的虾糜,用4℃纯净水调整水分含量至78%。
[0084]
(3)将调整好水分后的虾糜分别与1.5%氯化钠(nacl)、1.90%氯化钾(kcl)、0.81%氯化镁(mgcl2)、0.945%氯化钙(cacl2)、3.645%抗坏血酸钙(vc-ca)、3.975%l-组氨酸(l-his)、4.47%l-精氨酸(l-arg)和1.5%nacl以及1%微生物转谷氨酰胺酶(mtgase)混合(每组添加剂具有相同离子强度),然后用食品加工器在不高于4℃的冰浴下混合斩5min。将混合斩后的虾糜装入的塑料离心管在冷冻离心机在4℃下3000r/min离心5min;将装有虾糜的离心管放入40℃恒温水浴1小时,然后立刻放入90℃恒温水浴30min。获得的虾糜凝胶放入4℃冷藏室中冷却。
[0085]
性能测试:
[0086]
糜凝胶被切成15mm*15mm的圆柱体,利用ta.xt.plus texture analyzer对其破断力(g),破断距离(mm),和凝胶强度(g
·
mm)进行分析。选择p/25s金属球形探头,测定参数设定为:测试前速度1mm/s,测试速度1mm/s,测试后速度1mm/s下压距离10mm,触发力5g。
[0087]
测试结果如图6所示,可以看出,cacl2组,l-arg组和mtgase组虾糜凝胶的凝胶强度较高且显著高于nacl组和其他组。说明cacl2,l-arg和mtgase能增强虾糜中肌原纤维蛋白之间的交联,显著改善虾糜的凝胶网络结构,从而提高虾糜凝胶的凝胶强度。但根据食品添加剂使用标准(gb2760-2014),cacl2不能在冷冻鱼糜中添加,所以我们选择l-arg和mtgase作为凝胶改良剂的成分进行进一步探究和研发。
[0088]
实施例9
[0089]
试验步骤:
arg和mtgase联合处理导致在虾糜蛋白的交联中产生一些分子量大于270kda的蛋白质。
[0116]
实施例15
[0117]
采用与实施例9相同的试验步骤。并进行如下性能测试。
[0118]
将虾糜凝胶切成15mm
·
15mm的圆柱体,用聚乙烯保鲜膜包裹并放入核磁管中,然后将管插入分析仪。在测量期间设置参数:等待时间(tw)=3500ms,时间回波(we)=0.300ms,回波数(nech)=2500,扫描数(ns)=4。
[0119]
虾糜凝胶的横向弛豫时间(t2)和低场核磁峰面积分别如表3和表4所示。
[0120]
表3
[0121][0122]
表4
[0123][0124]
[0125]
由表3和表4可以看出,水的自旋-自旋弛豫时间(t2)越小,水与物质的结合越紧密。t2b和t21分别代表结合水和固定水,它们与大分子紧密结合。t22代表部分固定的水,分布在蛋白质的网络结构中,而t23代表自由水,位于蛋白质网络结构之外。不难发现,随着mtgase的加入和l-arg的增加,t2b出现在n-a3、n-t和n-t-a(1-3)中。此外,随着l-arg浓度的增加,样品n-t-a(1-3)中的t2b降低,a2b显着升高(p《0.05),样品中的a21随着l-arg浓度的增加呈上升趋势。这些结果表明l-arg和mtgase都促进了虾糜凝胶中蛋白质和水的结合。
[0126]
本发明南美白对虾虾糜的加工原料选用预先去头的南美白对虾进行采肉制作,经过实验测定发现,用去头虾作原料采肉所制作的虾糜相较于整虾采肉所制作的虾糜有着较高的盐溶性蛋白,较低的水溶性蛋白和较低的内源性蛋白酶活性。能够减少内源性蛋白酶在虾糜的制作和保藏过程中对虾糜中蛋白质的降解作用,所以此虾糜有着更好的加工和保藏性质。
[0127]
用去头虾虾糜所制作的制品,有着更好的微观结构和更高的凝胶强度,硬度,弹性和咀嚼性等感官品质更容易被消费者所接受,有利于制作高质量南美白对虾虾糜。
[0128]
本发明使用的漂洗工艺漂洗两次即可显著提升虾糜品质;漂洗可以去除虾糜中的有色杂质、污渍血液、腥味物质、部分的脂肪、水溶性蛋白、内源酶等,从而浓缩肌原纤维蛋白,得到白色无腥无臭、凝胶特性较好的虾糜。
[0129]
本发明使用的凝胶改良剂可以显著改善虾糜的凝胶特性,使虾糜凝胶具有良好的凝胶品质和质构,提高消费者的喜爱度。
[0130]
应说明的是,以上实施例仅用以说明本发明的技术方案而非限制,尽管参照较佳实施例对本发明进行了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的精神和范围,其均应涵盖在本发明的权利要求范围当中。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1