一种基于微生物菌群丰度及多样性的淡豆豉发酵工艺
1.本发明属于医药技术领域,具体地说,涉及一种基于微生物菌群丰度及多样性的淡豆豉发酵工艺。
背景技术:
2.淡豆豉为豆科大豆属植物黑豆的成熟种子的发酵加工品,其性味苦寒,具有解表,除烦,宣郁,解毒之等功效,治疗伤寒热病,寒热,头痛,烦躁,胸闷、抑郁症、高血脂、糖尿病和冠心病等疾病。《中国药典》2020年版中对淡豆豉的制备方法要求较简略,没有明确规定发酵温度、发酵湿度、黑豆处理方法和蒸制时间等发酵工艺参数。淡豆豉是天然微生物发酵的药食同源物质,存在于空气、黑豆、桑叶、青蒿和加工器具中的多种微生物共同参与了发酵过程,在淡豆豉特殊的工艺影响下,形成复杂的微生物体系。然而,自然环境中的微生物种类繁多,地区环境及气候的改变也会引起菌群的变化,使参与淡豆豉发酵过程的微生物菌群也有所差异。此外,企业生产淡豆豉时,主要凭个人经验进行操作,药工一般根据经验判断好煮豆时的软硬程度、加入材料的比例和掌控发酵的程度,即仅通过外观性状的主观判断确定淡豆豉发酵程度。因此市场上销售的淡豆豉发酵程度相差较大,质量良莠不齐、伪劣混杂,直接影响临床用药的安全性和有效性。
技术实现要素:
3.本发明的目的是提供一种基于微生物菌群丰度及多样性的淡豆豉发酵工艺,发酵方法操作简单,成本低廉,适于工业化生产。
4.为了实现上述目的,本发明采用的技术方案如下:
5.本发明的第一方面提供了一种基于微生物菌群丰度及多样性的淡豆豉发酵工艺,包括以下步骤:
6.第一步,浸润:将黑豆用水浸泡0~12h(优选为1、2、3、4、5、6、7、8、9h);
7.所述黑豆洗净,无尘土,成熟充分,颗粒饱满,无虫蛀霉变;黑豆选自绿心黑豆或黄心黑豆;
8.第二步,提取:取青蒿、桑叶饮片,按质量比1:1,两者总质量为黑豆的4~6(优选为5)倍,加入青蒿和桑叶总质量的6~10(优选为7、8、9)倍水,煎煮1~2h(优选为1h);将煎液用三层纱布过滤,获得煎液和药渣;
9.第三步,浸泡:将第一步的黑豆放入第二步的煎液中,浸泡1~19h(优选为5、8、12、14、16、18h);浸泡时的吸收率为20%~100%;
10.第四步,蒸制:将第三步获得的黑豆蒸煮1~2h(优选为1h),取出稍晾;
11.第五步,发酵:将第四步获得的黑豆放入玻璃器皿中,盖上1~3cm(优选为2cm)厚的第二步获得的药渣,温度为20~35℃的条件下发酵5~6日,将发酵过的黑豆取出,除去药渣,洗净,晾干表面水分,再盖上1~3cm厚的第二步获得的药渣,温度为20~35℃的条件下继续发酵10~20日,获得淡豆豉。
12.第六步,菌落检测:提取淡豆豉dna后,采用16s rdna扩增子测序,利用保守区设计通用引物进行pcr扩增,然后对高变区进行测序分析和菌种鉴定。
13.所述第六步具体包括以下步骤:基因组dna的提取和pcr扩增采用ctab或sds方法对样本的基因组dna进行提取,之后利用琼脂糖凝胶电泳检测dna的纯度和浓度,取pcr产物使用2%浓度的琼脂糖凝胶进行电泳检测,使用truseq dna pcr-free sampe preparation kit建库试剂盒进行文库构建,构建好的文库经过qubit和q-pcr以稀释后的基因组dna为模板,根据测序区域的选择,使用带barcode的特异引物,new england biolabs公司的电泳检测pcr产物,对目的条带使用qiagen公司提供的胶回收试剂盒回收产物,用phusion high-fidelity pcr master mix with gc buffer和高效高保真酶进行pcr,确保扩增效率和准确性。
14.所述pcr产物的混样和纯化:在25μl pcr产物中加入0.6倍体积的磁珠,充分震荡使其悬浮后将其放在磁力架上吸附5min,吸出上清液,随后加入30μl 0.6倍的磁珠洗涤液,充分震荡使其悬浮后将其放在磁力架上吸附5min,吸出上清液,再加入90μl 70%乙醇,将其反向放置在磁力架上,使磁珠吸附到pcr管的另外一面,充分吸附后吸出上清液,然后将pcr管在55℃烘箱中放置5min,使乙醇完全挥发后,加入30μl elution buffer溶液进行洗脱,将pcr管放在吸附架上充分吸附5min,转移上清液至干净的1.5ml离心管中,备用。
15.所述文库构建和上机测序:应用qubit 3.0dna检测试剂盒精确定量已回收的dna,每个样品dna量取10ng于离心管中,使用无菌水稀释样本至1ng/μl定量,文库合格后,使用novaseq6000进行上机测序。
16.数据分析:基于有效数据进行otus(operational taxonomic units)聚类和物种分类分析,采用illuminanova测序平台测序,构建pcr-free文库,然后进行双末端(paired-end)测序,以97%的一致性(identity)将序列聚类成为otus(operational taxonomic units),共得到577个otus,然后对otus序列与silva138数据库进行物种注释,注释结果中,共有392(67.94%)个otu注释到属水平,根据otus聚类结果,对每个otu的代表序列做物种注释,得到对应的物种信息和基于物种的丰度分布情况,再进行多样性分析和统计检验。
17.所述淡豆豉中微生物菌群顺序数(sequences number)为5500时,物种丰富度(observed species number)为50~335,淡豆豉的微生物菌群丰度(abundance)为0.03~0.63。
18.由于采用上述技术方案,本发明具有以下优点和有益效果:
19.本发明从微生物菌群丰度及多样性的角度优化淡豆豉的发酵工艺,包括发酵温度、蒸制时间、水浸时间和药浸时间等影响因素,发酵方法操作简单,成本低廉,采用16s rdna基因测序技术确定淡豆豉中微生物菌群的丰度和多样性,精准控制发酵程度,避免了由于发酵异常导致的伪劣淡豆豉的产生,从根源上改善淡豆豉药材市场多伪品劣品的情况。同时,微生物菌群结构和组成对淡豆豉中活性成分存在有利影响,提高了淡豆豉的药用价值。
20.本发明的方法改进之处在于:淡豆豉的发酵过程与微生物菌群丰度和多样性有关。为改善市场上销售的淡豆豉因发酵程度差异导致的质量问题,本发明通过测定淡豆豉中的微生物菌群丰度和多样性来确定合理的发酵工艺。目前,关于淡豆豉中微生物菌群对发酵工艺影响的报道较少。究其原因是大多数天然微生物菌群都不能通过传统的分离培养
方法进行分离,这对于天然微生物菌群定性定量分析,探索微生物菌群丰度和多样性是严重的阻碍。16srdna基因测序技术可以有效地解决这一问题。16s rdna是核糖体的rna的一个亚基,16s rdna就是编码该亚基的基因。16s rdna有多个保守区,通过这些保守区可以设计出对细菌特异性的通用引物来扩增所有细菌的16s rdna片段,再通过16s rdna可变区的差异可区分菌种。16s rdna扩增子测序(16s rdnaamplicon sequencing)是通过对样本中微生物菌群的特定区域的扩增产物进行测序,比对数据库来获得物种分类信息,进而研究样本中微生物菌群结构和组成。16s rdna基因测序技术可以克服传统分离培养的弱点,实现对样品中的微生物菌群的定性定量分析。采用16s rdna基因测序技术,确定淡豆豉中微生物菌群结构和组成能准确判断淡豆豉的发酵程度,为淡豆豉的质量评价提供依据。
21.本发明的优点是:1.采用16s rdna基因测序技术确定淡豆豉中微生物菌群的丰度和多样性,共筛选到了5个主要门包括厚壁菌门(firmicutes)、蓝细菌门(cyanobacteria)、变形菌门(proteobacteria)、拟杆菌门(bacteroidota)和放线菌门(actinobacteriota),占淡豆豉发酵过程中微生物菌群的90%以上,精准控制了自然发酵时的菌种,更准确可靠;2.通过控制发酵温度、水浸时间、煎煮时间和浸泡时间4个影响因素(淡豆豉最佳发酵工艺为发酵温度30℃,水浸时间为5h,蒸制时间为1h,药浸时间为16h),增加了微生物菌群的发酵底物,改善微生物菌群丰度及多样性,使淡豆豉的药用价值升高;3.增加对未经过二次发酵与经过二次发酵的淡豆豉化学成分的比较,相同发酵条件下,未经过二次发酵的淡豆豉丰度平均值,0.1~0.3,经过二次发酵的淡豆豉丰度平均值0.3~0.6,验证了《中国药典》2020年版对淡豆豉制法规定的合理性。
附图说明
22.图1为淡豆豉的物种进化树示意图。
23.图2中上图为各批次淡豆豉在门水平上的物种相对丰度柱形示意图,下图为各组淡豆豉在门水平上的物种相对丰度柱形示意图。
24.图3为α多样性分析示意图,上图为绘制稀释曲线(rarefaction curve)示意图,下图为等级聚类曲线(rank abundance)示意图。
25.图4为β多样性分析示意图,以weighted unifrac和unweighted unifrac距离绘制的heatmap表示。
26.图5为采用metastat分析方法的组间物种差异分析图。
具体实施方式
27.为了更清楚地说明本发明,下面结合优选实施例对本发明做进一步的说明。本领域技术人员应当理解,下面所具体描述的内容是说明性的而非限制性的,不应以此限制本发明的保护范围。
28.实施例1
29.一种基于微生物菌群丰度及多样性的淡豆豉发酵工艺,包括以下步骤:
30.第一步,浸润:将绿心黑豆用水浸泡5h;所述黑豆洗净,无尘土,成熟充分,颗粒饱满,无虫蛀霉变;
31.第二步,提取:取青蒿、桑叶饮片,按质量比1:1,两者总质量为黑豆的5倍,并量取
青蒿和桑叶总质量的8倍水,一同倒入提取器皿中,煎煮1h;将煎液用三层纱布过滤,备用;
32.第三步,浸泡:将第一步的黑豆放入第二步的煎液中,浸泡16h;浸泡时的吸收率为100%,浸泡时将未臌胀的黑豆丢弃;
33.第四步,蒸制:将第三步获得的黑豆蒸煮1h,取出稍晾;
34.第五步,发酵:将第四步获得的黑豆放入玻璃器皿中,盖上2cm厚的第二步获得的药渣,温度为30℃的条件下在稳定培养箱中发酵5日,将发酵过的黑豆取出,除去药渣,洗净,晾干表面水分,再盖上2cm厚的第二步获得的药渣,温度为30℃的条件下在稳定培养箱中继续发酵15日,取出,以上方法平行制备3批,获得c组(c1、c2和c3)淡豆豉。
35.第六步,菌落检测:提取淡豆豉dna后,采用16s rdna扩增子测序,利用保守区设计通用引物进行pcr扩增,然后对高变区进行测序分析和菌种鉴定。
36.所述第六步具体包括以下步骤:基因组dna的提取和pcr扩增采用ctab或sds方法对样本的基因组dna进行提取,之后利用琼脂糖凝胶电泳检测dna的纯度和浓度,取pcr产物使用2%浓度的琼脂糖凝胶进行电泳检测,使用truseq dna pcr-free sampe preparation kit建库试剂盒进行文库构建,构建好的文库经过qubit和q-pcr以稀释后的基因组dna为模板,根据测序区域的选择,使用带barcode的特异引物,new england biolabs公司的电泳检测pcr产物,对目的条带使用qiagen公司提供的胶回收试剂盒回收产物,用phusion high-fidelity pcr master mix with gc buffer和高效高保真酶进行pcr,确保扩增效率和准确性。
37.所述pcr产物的混样和纯化:在25μlpcr产物中加入0.6倍体积的磁珠,充分震荡使其悬浮后将其放在磁力架上吸附5min,吸出上清液,随后加入30μl 0.6倍的磁珠洗涤液,充分震荡使其悬浮后将其放在磁力架上吸附5min,吸出上清液,再加入90μl 70%乙醇,将其反向放置在磁力架上,使磁珠吸附到pcr管的另外一面,充分吸附后吸出上清液,然后将pcr管在55℃烘箱中放置5min,使乙醇完全挥发后,加入30μl elution buffer溶液进行洗脱,将pcr管放在吸附架上充分吸附5min,转移上清液至干净的1.5ml离心管中,备用。
38.所述文库构建和上机测序:应用qubit 3.0dna检测试剂盒精确定量已回收的dna,每个样品dna量取10ng于离心管中,使用无菌水稀释样本至1ng/μl定量,文库合格后,使用novaseq6000进行上机测序。
39.数据分析:基于有效数据进行otus(operational taxonomic units)聚类和物种分类分析,采用illumina nova测序平台测序,构建pcr-free文库,然后进行双末端(paired-end)测序,以97%的一致性(identity)将序列聚类成为otus(operational taxonomic units),共得到577个otus,然后对otus序列与silva138数据库进行物种注释,注释结果中,共有392(67.94%)个otu注释到属水平,根据otus聚类结果,对每个otu的代表序列做物种注释,得到对应的物种信息和基于物种的丰度分布情况,再进行多样性分析和统计检验。
40.采用α多样性分析建立绘制稀释曲线和等级聚类曲线,c组(c1、c2和c3)淡豆豉的物种丰富度与其他样本无显著性差异,淡豆豉中微生物菌群顺序数(sequences number)为5500时,物种丰富度(observed species number)为70~97,通过metastat分析方法得到c组(c1、c2和c3)淡豆豉的微生物菌群丰度(abundance)为0.3~0.6。
41.实施例2
42.一种基于微生物菌群丰度及多样性的淡豆豉发酵工艺,包括以下步骤:
43.第一步,浸润:绿心黑豆未经过水浸泡;所述黑豆洗净,无尘土,成熟充分,颗粒饱满,无虫蛀霉变;
44.第二步,提取:取青蒿、桑叶饮片,按质量比1:1,两者总质量为黑豆的5倍,并量取青蒿和桑叶总质量的8倍水,一同倒入提取器皿中,煎煮1.5h;将煎液用三层纱布过滤,备用;
45.第三步,浸泡:将第一步的黑豆放入第二步的煎液中,浸泡1.5h;浸泡时的吸收率为20%,浸泡时将未臌胀的黑豆丢弃;
46.第四步,蒸制:将第三步获得的黑豆蒸煮2h,取出稍晾;
47.第五步,发酵:将第四步获得的黑豆放入玻璃器皿中,盖上2cm厚的第二步获得的药渣,温度为30℃的条件下在稳定培养箱中发酵5日,将发酵过的黑豆取出,除去药渣,洗净,晾干表面水分,再盖上2cm厚的第二步获得的药渣,温度为30℃的条件下在稳定培养箱中继续发酵15日,取出,获得b3号淡豆豉。
48.第六步,菌落检测:提取淡豆豉dna后,采用16s rdna扩增子测序,利用保守区设计通用引物进行pcr扩增,然后对高变区进行测序分析和菌种鉴定。
49.具体的方法步骤与实施例1相同。
50.采用α多样性分析建立绘制稀释曲线和等级聚类曲线,b3号淡豆豉的物种丰富度与其他样本无显著性差异,淡豆豉中微生物菌群顺序数(sequences number)为5500时,物种丰富度(observed species number)为105,通过metastat分析方法得到b3号淡豆豉的微生物菌群丰度(abundance)为0.19。
51.实施例3
52.第五步,发酵:将第四步获得的黑豆放入玻璃器皿中,盖上2cm厚的第二步获得的药渣,温度为20℃的条件下在稳定培养箱中发酵5日,将发酵过的黑豆取出,除去药渣,洗净,晾干表面水分,再盖上2cm厚的第二步获得的药渣,温度为20℃的条件下在稳定培养箱中继续发酵15日,取出,获得b1号淡豆豉。
53.其他具体的方法步骤与实施例2相同。
54.采用α多样性分析建立绘制稀释曲线和等级聚类曲线,b1号淡豆豉的物种丰富度与其他样本无显著性差异,淡豆豉中微生物菌群顺序数(sequences number)为5500时,物种丰富度(observed species number)为105,通过metastat分析方法得到b1号淡豆豉的微生物菌群丰度(abundance)为0.24。
55.实施例4
56.第五步,发酵:将第四步获得的黑豆放入玻璃器皿中,盖上2cm厚的第二步获得的药渣,温度为25℃的条件下在稳定培养箱中发酵5日,将发酵过的黑豆取出,除去药渣,洗净,晾干表面水分,再盖上2cm厚的第二步获得的药渣,温度为25℃的条件下在稳定培养箱中继续发酵15日,取出,获得b2号淡豆豉。
57.其他具体的方法步骤与实施例2相同。
58.采用α多样性分析建立绘制稀释曲线和等级聚类曲线,b2号淡豆豉的物种丰富度与其他样本无显著性差异,淡豆豉中微生物菌群顺序数(sequences number)为5500时,物种丰富度(observed species number)为107,通过metastat分析方法得到b2号淡豆豉的微
生物菌群丰度(abundance)为0.14。
59.实施例5
60.第五步,发酵:将第四步获得的黑豆放入玻璃器皿中,盖上2cm厚的第二步获得的药渣,温度为35℃的条件下在稳定培养箱中发酵5日,将发酵过的黑豆取出,除去药渣,洗净,晾干表面水分,再盖上2cm厚的第二步获得的药渣,温度为35℃的条件下在稳定培养箱中继续发酵15日,取出,获得b4号淡豆豉。
61.其他具体的方法步骤与实施例2相同。
62.采用α多样性分析建立绘制稀释曲线和等级聚类曲线,b4号淡豆豉的物种丰富度与其他样本无显著性差异,淡豆豉中微生物菌群顺序数(sequences number)为5500时,物种丰富度(observed species number)为78,通过metastat分析方法得到b4号淡豆豉的微生物菌群丰度(abundance)为0.22。
63.对比例1
64.一种基于微生物菌群丰度及多样性的淡豆豉发酵工艺,包括以下步骤:
65.第一步,浸润:绿心黑豆无需浸泡;所述黑豆洗净,无尘土,成熟充分,颗粒饱满,无虫蛀霉变;
66.第二步,提取:取青蒿、桑叶饮片,按质量比1:1,两者总质量为黑豆的5倍,并量取青蒿和桑叶总质量的8倍水,一同倒入提取器皿中,煎煮1h;将煎液用三层纱布过滤,备用;
67.第三步,浸泡:将第一步的黑豆放入第二步的煎液中,浸泡3h;浸泡时的吸收率为50%,浸泡时将未臌胀的黑豆丢弃;
68.第四步,蒸制:将第三步获得的黑豆蒸煮1h,取出稍晾;
69.第五步,发酵:将第四步获得的黑豆放入玻璃器皿中,无需覆盖第二步获得的药渣,温度为30℃的条件下在稳定培养箱中发酵5日,将发酵过的黑豆取出,除去药渣,洗净,晾干表面水分,无需覆盖第二步获得的药渣,温度为30℃的条件下在稳定培养箱中继续发酵15日,取出,以上方法平行制备3批,获得a组(a1、a2和a3)淡豆豉。
70.第六步,菌落检测:提取淡豆豉dna后,采用16s rdna扩增子测序,利用保守区设计通用引物进行pcr扩增,然后对高变区进行测序分析和菌种鉴定。
71.具体的方法步骤与实施例1相同。
72.采用α多样性分析建立绘制稀释曲线和等级聚类曲线,a组(a1、a2和a3)淡豆豉的物种丰富度与其他样本无显著性差异,淡豆豉中微生物菌群顺序数(sequences number)为5500时,物种丰富度(observed species number)为80~102,通过metastat分析方法得到a组(a1、a2和a3)淡豆豉的微生物菌群丰度(abundance)为0.05~0.11。
73.对比例2
74.一种基于微生物菌群丰度及多样性的淡豆豉发酵工艺,包括以下步骤:
75.第一步,浸润:绿心黑豆无需浸泡;所述黑豆洗净,无尘土,成熟充分,颗粒饱满,无虫蛀霉变;
76.第二步,提取:取青蒿、桑叶饮片,按质量比1:1,两者总质量为黑豆的5倍,并量取青蒿和桑叶总质量的8倍水,一同倒入提取器皿中,煎煮1h;将煎液用三层纱布过滤,备用;
77.第三步,浸泡:将第一步的黑豆放入第二步的煎液中,浸泡3h;浸泡时的吸收率为50%,浸泡时将未臌胀的黑豆丢弃;
78.第四步,蒸制:将第三步获得的黑豆蒸煮1h,取出稍晾;
79.第五步,发酵:将第四步获得的黑豆放入玻璃器皿中,盖上2cm厚的第二步获得的药渣,温度为30℃的条件下在稳定培养箱中发酵5日,将发酵过的黑豆取出,除去药渣,洗净,晾干表面水分,取出,以上方法平行制备3批,获得a组(a1、a2和a3)淡豆豉。
80.第六步,菌落检测:提取淡豆豉dna后,采用16s rdna扩增子测序,利用保守区设计通用引物进行pcr扩增,然后对高变区进行测序分析和菌种鉴定。
81.具体的方法步骤与实施例1相同。
82.采用α多样性分析建立绘制稀释曲线和等级聚类曲线,a组(a1、a2和a3)淡豆豉的物种丰富度与其他样本无显著性差异,淡豆豉中微生物菌群顺序数(sequences number)为5500时,物种丰富度(observed species number)为48~102,通过metastat分析方法得到a组(a1、a2和a3)淡豆豉的微生物菌群丰度(abundance)为0.05~0.63。
83.对比例3
84.一种基于微生物菌群丰度及多样性的淡豆豉发酵工艺,包括以下步骤:
85.第一步,浸润:绿心黑豆无需浸泡;所述黑豆洗净,无尘土,成熟充分,颗粒饱满,无虫蛀霉变;
86.第二步,提取:取青蒿、桑叶饮片,按质量比1:1,两者总质量为黑豆的5倍,并量取青蒿和桑叶总质量的8倍水,一同倒入提取器皿中,煎煮1.5h;将煎液用三层纱布过滤,备用;
87.第三步,浸泡:将第一步的黑豆放入第二步的煎液中,浸泡1.5h;浸泡时的吸收率为20%,浸泡时将未臌胀的黑豆丢弃;
88.第四步,蒸制:将第三步获得的黑豆蒸煮2h,取出稍晾;
89.第五步,发酵:将第四步获得的黑豆放入玻璃器皿中,盖上2cm厚的第二步获得的药渣,温度为30℃的条件下在稳定培养箱中发酵5日,将发酵过的黑豆取出,除去药渣,洗净,晾干表面水分,获得b4号淡豆豉。
90.第六步,菌落检测:提取淡豆豉dna后,采用16s rdna扩增子测序,利用保守区设计通用引物进行pcr扩增,然后对高变区进行测序分析和菌种鉴定。
91.具体的方法步骤与实施例1相同。
92.采用α多样性分析建立绘制稀释曲线和等级聚类曲线,b4号淡豆豉的物种丰富度与其他样本无显著性差异,淡豆豉中微生物菌群顺序数(sequences number)为5500时,b组(b1、b2、b3和b4)observed species number均值为75,b4号物种丰富度(observed species number)为335,且外观性状表明,该批次淡豆豉已发霉,黑毛遍布,无法入药。通过metastat分析方法得到b4号淡豆豉的微生物菌群丰度(abundance)为0.13。
93.对比例4
94.第五步,发酵:将第四步获得的黑豆放入玻璃器皿中,盖上2cm厚的第二步获得的药渣,温度为20℃条件下在稳定培养箱中发酵5日,将发酵过的黑豆取出,除去药渣,洗净,晾干表面水分,获得b1号淡豆豉。
95.其他具体的方法步骤与对比例3相同。
96.采用α多样性分析建立绘制稀释曲线和等级聚类曲线,b1号淡豆豉的物种丰富度与其他样本无显著性差异,淡豆豉中微生物菌群顺序数(sequences number)为5500时,物
种丰富度(observed species number)为101,通过metastat分析方法得到b1号淡豆豉的微生物菌群丰度(abundance)为0.13。
97.对比例5
98.第五步,发酵:将第四步获得的黑豆放入玻璃器皿中,盖上2cm厚的第二步获得的药渣,温度为25℃条件下在稳定培养箱中发酵5日,将发酵过的黑豆取出,除去药渣,洗净,晾干表面水分,获得b2号淡豆豉。
99.其他具体的方法步骤与对比例3相同。
100.采用α多样性分析建立绘制稀释曲线和等级聚类曲线,b2号淡豆豉的物种丰富度与其他样本无显著性差异,淡豆豉中微生物菌群顺序数(sequences number)为5500时,物种丰富度(observed species number)为103,通过metastat分析方法得到b2号淡豆豉的微生物菌群丰度(abundance)为0.12。
101.对比例6
102.第五步,发酵:将第四步获得的黑豆放入玻璃器皿中,盖上2cm厚的第二步获得的药渣,温度为30℃条件下在稳定培养箱中发酵5日,将发酵过的黑豆取出,除去药渣,洗净,晾干表面水分,获得b3号淡豆豉。
103.其他具体的方法步骤与对比例3相同。
104.采用α多样性分析建立绘制稀释曲线和等级聚类曲线,b3号淡豆豉的物种丰富度与其他样本无显著性差异,淡豆豉中微生物菌群顺序数(sequences number)为5500时,物种丰富度(observed species number)为77,通过metastat分析方法得到b3号淡豆豉的微生物菌群丰度(abundance)为0.03。
105.对比例7
106.一种基于微生物菌群丰度及多样性的淡豆豉发酵工艺,包括以下步骤:
107.第一步,浸润:绿心黑豆无需浸泡;所述黑豆洗净,无尘土,成熟充分,颗粒饱满,无虫蛀霉变;
108.第二步,提取:取青蒿、桑叶饮片,按质量比1:1,两者总质量为黑豆的5倍,并量取青蒿和桑叶总质量的8倍水,一同倒入提取器皿中,煎煮1h;将煎液用三层纱布过滤,备用;
109.第三步,浸泡:将第一步的黑豆放入第二步的煎液中,浸泡16h;浸泡时的吸收率为100%,浸泡时将未臌胀的黑豆丢弃;
110.第四步,蒸制:将第三步获得的黑豆蒸煮1h,取出稍晾;
111.第五步,发酵:将第四步获得的黑豆放入玻璃器皿中,盖上2cm厚的第二步获得的药渣,温度为30℃条件下在稳定培养箱中发酵5日,将发酵过的黑豆取出,除去药渣,洗净,晾干表面水分,获得c组(c1、c2和c3)淡豆豉。
112.第六步,菌落检测:提取淡豆豉dna后,采用16s rdna扩增子测序,利用保守区设计通用引物进行pcr扩增,然后对高变区进行测序分析和菌种鉴定。
113.具体的方法步骤与实施例1相同。
114.采用α多样性分析建立绘制稀释曲线和等级聚类曲线,c组(c1、c2和c3)淡豆豉的物种丰富度与其他样本无显著性差异,淡豆豉中微生物菌群顺序数(sequences number)为5500时,c组(c1、c2和c3)observed species number为80~120,通过metastat分析方法得到c组(c1、c2和c3)淡豆豉的微生物菌群丰度(abundance)为0.04~0.3。
115.实施例2~5与实施例1相比,实施例2~5第一步无需浸泡,结果分析可知,物种丰富度无显著性差异,微生物菌群丰度实施例1高于实施例2~5。
116.对比例1与实施例1相比,对比例1第一步无需浸泡,两次发酵均无需覆盖第二步获得的药渣,结果分析可知,物种丰富度无显著性差异,淡豆豉的微生物菌群丰度显著小于实施例1的淡豆豉的微生物菌群丰度。
117.对比例2与实施例1相比,对比例2第一步无需浸泡,第五步无需二次发酵,第三步浸泡3h,结果分析可知,对比例2各样品间物种丰富度差异较大,表明发酵过程不稳定,微生物菌群丰度实施例1高于对比例2。
118.对比例3~6与实施例1相比,对比例3~6第一步无需浸泡,第五步无需二次发酵,第三步浸泡1.5h,第四步蒸制2h,结果分析可知,对比例3~6各样品间物种丰富度具有显著性差异,表明发酵过程不稳定,微生物菌群丰度实施例1高于对比例3~6。
119.对比例7与实施例1相比,对比例7第一步无需浸泡,第五步无需二次发酵,结果分析可知,物种丰富度无显著性差异,微生物菌群丰度实施例1高于对比例7。
120.对比例由于无二次发酵过程或无覆盖药渣,发酵温度过高,药浸时间短等因素,结果分析可知,对比例各样品间物种丰富度有显著性差异,可知发酵过程不稳定,且微生物菌群丰度普遍低于实施例,表明对比例技术效果比发明的实施例差。
121.表1为淡豆豉样品信息,a、b和c为未经2次发酵的淡豆豉半成品,a、b和c是与前者相对应的经过2次发酵的淡豆豉成品,a1表示a组淡豆豉半成品1号样品,a1表示a组淡豆豉成品1号样品。
122.表1淡豆豉样品信息
[0123][0124]
图1为淡豆豉的物种进化树示意图,共得到11个门水平的菌种。
[0125]
图2中上图为各批次淡豆豉在门水平上的物种相对丰度柱形示意图,下图为各组淡豆豉在门水平上的物种相对丰度柱形示意图,以各个水平丰度含量top5的物种进行桑基图分析,上图a1样品和下图a组菌群由下至上依次为厚壁菌门(firmicutes),蓝细菌门(cyanobacteria),变形菌门(proteobacteria),拟杆菌门(bacteroidota),放线菌门(actinobacteriota)和其他菌门(others)。
[0126]
图3为α多样性分析示意图,上图为绘制稀释曲线(rarefaction curve)示意图,下图为等级聚类曲线(rank abundance)示意图,稀释曲线间接反映样本中物种的丰富程度,
趋向平坦时,说明测序数据量渐进合理。通过以上说明样品物种分布较均匀,b4物种丰富度与其他样本具有显著性差异,通过对比外观性状,发现这批淡豆豉已发霉,黑毛遍布,无法入药,与b4相对应的b4与其他淡豆豉样品的物种丰富度和外观性状相似,说明经过二次发酵后,物种丰富度回调,恢复到正常水平。
[0127]
图4为β多样性分析示意图,以weighted unifrac和unweighted unifrac距离绘制的heatmap表示。选用weighted unifrac距离(上图)和unweighted unifrac距离(下图)来衡量两样本间的相异系数,数值越大,表明两样本在物种多样性方面存在的差异越大。a2、a3、a3和b4的差异度与其他各批次淡豆豉相比较大,说明a、b和a组微生物菌群差异大,样品相似度大,发酵工艺不稳定,不适用于批量生产。
[0128]
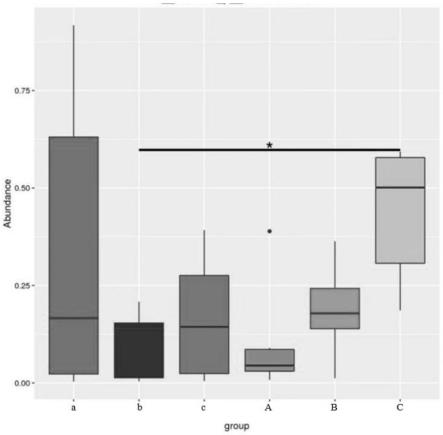
图5为采用metastat分析方法的组间物种差异分析图。6组淡豆豉成品中c组(c1、c2和c3)的丰度最高,且与其他组具有显著性差异,说明c组淡豆豉发酵工艺最优。
[0129]
结论:本发明采用16s rdna基因测序技术,从微生物菌群丰度及多样性的角度优化淡豆豉的发酵工艺,发酵方法操作简单,成本低廉,精准控制了发酵程度,避免了由于发酵异常导致的伪劣淡豆豉的产生。
[0130]
淡豆豉半成品(a、b、c组)与淡豆豉成品(a、b、c组)相比,淡豆豉中微生物菌群顺序数(sequences number)为5500时,成品的observed species number高于半成品的observed species number,通过metastat分析方法得到成品淡豆豉的微生物菌群丰度(abundance)高于半成品的微生物菌群丰度(abundance),说明经二次发酵后,物种丰富度和微生物菌群丰度变好。淡豆豉成品(a、b、c组)中,通过metastat分析方法得到成品淡豆豉的微生物菌群丰度(abundance)在煎药时间1h,药浸时间16h,蒸制时间1h,水浸时间5h时微生物菌群丰度(abundance)最好,说明本发酵工艺条件下淡豆豉质量最优。
[0131]
结果表明,实施例1的效果与其他相比效果最优,即淡豆豉的最佳工艺为:第一步的浸润时间为5h,第二步的青蒿、桑叶饮片的质量比1:1,青蒿和桑叶总质量是黑豆质量的5倍,水是青蒿和桑叶总质量的8倍,煎煮1h,第三步的浸泡时间16h;第四步的蒸制时间为1h,第五步的最佳工艺:黑豆上的药渣厚度为2cm,温度为30℃的条件下发酵5日;黑豆上的药渣厚度为2cm,温度为30℃的条件下继续发酵15日。
[0132]
以上所述仅是本发明的较佳实施例而已,并非对本发明作任何形式上的限制,虽然本发明已以较佳实施例揭露如上,然而并非用以限定本发明,任何熟悉本专利的技术人员在不脱离本发明技术方案范围内,当可利用上述提示的技术内容作出些许更动或修饰为等同变化的等效实施例,但凡是未脱离本发明技术方案的内容,依据本发明的技术实质对以上实施例所作的任何简单修改、等同变化与修饰,均仍属于本发明方案的范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1