纳米凝胶的制备方法
1.本发明涉及食品纳米凝胶技术和亲水化合物包埋技术领域,特别涉及一种纳米凝胶的制备方法。
背景技术:
2.近年来,由于天然生物活性物质具有抗氧化、抗炎、抗癌等功效,对人体的健康具有重要的作用,同时也具有重要的生物学意义,但是生物活性物质在利用过程中容易受到环境因素(温度、光照、ph和盐离子浓度)的影响而丧失其功能特性,例如:单独的egcg(表没食子儿茶素没食子酸酯)在利用过程中因其易被氧化使其生物活性降低,失去了原有的功效,限制了其应用范围,同时也限制了其在食品行业中的发展(colloids and surfaces b:biointerfaces,doi:10.1016/j.colsurfb.2020.110802);除此之外,花色苷在加工、生产、储存和消化过程中容易受到环境变化的影响,这极大地限制了它作为一种功能性食品成分的使用(international journal of biological macromolecules,dio:10.10dio:10.1016/j.ijbiomac.2022.05.166)。
3.为了较好利用生物活性物质的优点,同时较大程度的保持它们结构的稳定性,研究者常常利用天然高分子形成的纳米凝胶通过包埋递送技术来保持其抗氧化活性和稳定性。其中,天然高分子由于其可降解性和生物相容性,一直是生物活性物质载体材料的研究热点;除此之外,以天然蛋白质和多糖自组装超分子体系作为食品载体方法简便,反应条件温和,并且无任何有毒表面活性剂、交联剂;同时制备的纳米凝胶粒径较小(小于200nm),比表面积大,分散均匀,具有较高的包封率和负载量,具有潜在的应用价值,受到了研究者的青睐。但是,例如:柴少虎用壳聚糖醋酸和石蜡为材料,通过戊二醛交联,制备了负载egcg的壳聚糖微球,但是该方法的缺陷是使用了有毒的交联剂,使egcg的生物可及性大大降低。
技术实现要素:
4.本发明的主要目的是提出一种纳米凝胶的制备方法,旨在制备一种能够包埋递送生物活性物质,避免化学方法使用有毒的交联剂,导致其生物活性降低以及生物安全性等问题。
5.为实现上述目的,本发明提出一种纳米凝胶的制备方法,所述纳米凝胶用于包埋递送生物活性物质,所述纳米凝胶的制备方法包括以下步骤:
6.s10、将蛋白质和衍生化多糖加入水中,搅拌均匀,得蛋白质-衍生化多糖复合物;
7.s20、将所述蛋白质-衍生化多糖复合物加热,得蛋白质-衍生化多糖纳米凝胶;
8.s30、将生物活性物质加入蛋白质-衍生化多糖纳米凝胶中,避光搅拌,得纳米凝胶。
9.可选地,在步骤s10中,
10.所述蛋白质包括溶菌酶;和/或,
11.所述衍生化多糖包括羧甲基淀粉、羧甲基纤维素、羧甲基壳聚糖、羧甲基甲壳素和
羧甲基葡聚糖中的至少一种。
12.可选地,在步骤s10中,
13.所述衍生化多糖的取代度为0.1~1.5;和/或,
14.所述搅拌时间为1~2h;和/或,
15.所述蛋白质和衍生化多糖的质量之比为5:(1~12)。
16.可选地,在步骤s20中,所述加热时间为15~120min。
17.可选地,在步骤s30中,所述生物活性物质包括表没食子儿茶素没食子酸酯、花色苷、花青素和茶多酚中的至少一种;和/或,
18.所述搅拌时间为1~2h。
19.可选地,在步骤s30中,每克所述蛋白质-衍生化多糖纳米凝胶对应的生物活性物质的质量为0.4~2mg。
20.可选地,步骤s30包括:
21.s31、将生物活性物质溶解到酸性缓冲液中,得生物活性物质溶液;
22.s32、将所述生物活性物质溶液加入蛋白质-衍生化多糖纳米凝胶中,避光搅拌,得纳米凝胶。
23.可选地,在步骤s31中,所述生物活性物质溶液中,生物活性物质的浓度为0.05~2.00mg/ml。
24.可选地,在步骤s32中,每克所述蛋白质-衍生化多糖纳米凝胶对应的所述生物活性物质溶液的体积为1~10ml。
25.可选地,所述纳米凝胶的粒径小于200nm。
26.本发明提供的技术方案中,将蛋白质和衍生化多糖通过物理方法制备得到蛋白质-衍生化多糖复合物,再通过进一步加热形成了蛋白质-衍生化多糖纳米凝胶,然后把生物活性物质包埋在溶菌酶-衍生化多糖纳米凝胶中,得到了包埋递送生物活性物质的溶菌酶-衍生化多糖纳米凝胶。该制备过程利用了蛋白质和衍生化多糖的静电相互作用和氢键作用,为物理方法,避免了化学方法使用有毒的交联剂,导致其生物活性降低以及生物安全性等问题,为保持生物活性物质的稳定性,提高其生物利用度提供了一个新的途径。此外,利用纳米凝胶在经过胃肠道环境中的缓释性能,使其在特定的环境中释放被包埋的生物活性物质,避免了生物活性物质在经过胃肠道环境中容易被分解的缺点,保持了生物活性物质的稳定性,同时也提高了生物活性物质的可及性。
附图说明
27.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅为本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
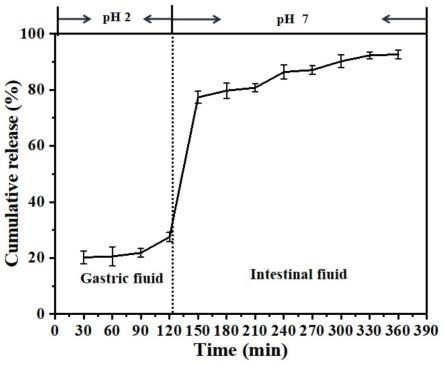
28.图1为本发明实施例1的纳米凝胶在模拟胃肠条件下的释放示意图;
29.图2为本发明实施例溶菌酶与不同取代度的羧甲基淀粉在不同比例下制备的复合物的浊度变化图;
30.图3为本发明实施例溶菌酶与不同取代度的羧甲基淀粉在不同比例下制备的复合
物的电位变化图;
31.图4为本发明实施例溶菌酶与不同取代度的羧甲基淀粉在不同比例下制备的复合物的粒径变化图;
32.图5为本发明实施例制备的溶菌酶-羧甲基淀粉纳米凝胶在不同加热时间的粒径和pdi变化图;
33.图6为本发明实施例制备的包埋egcg的溶菌酶-羧甲基淀粉纳米凝胶在不同egcg添加量的包埋率和负载率变化图。
34.本发明目的的实现、功能特点及优点将结合实施例及附图,做进一步说明。
具体实施方式
35.为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
36.需要说明的是,实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。另外,全文中出现的“和/或”的含义,包括三个并列的方案,以“a和/或b”为例,包括a方案、或b方案、或a和b同时满足的方案。此外,各个实施例之间的技术方案可以相互结合,但是必须是以本领域普通技术人员能够实现为基础,当技术方案的结合出现相互矛盾或无法实现时应当认为这种技术方案的结合不存在,也不在本发明要求的保护范围之内。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
37.为了较好利用生物活性物质的优点,同时较大程度的保持它们结构的稳定性,研究者常常利用天然高分子形成的纳米凝胶通过包埋递送技术来保持其抗氧化活性和稳定性。其中,天然高分子由于其可降解性和生物相容性,一直是生物活性物质载体材料的研究热点;除此之外,以天然蛋白质和多糖自组装超分子体系作为食品载体方法简便,反应条件温和,并且无任何有毒表面活性剂、交联剂;同时制备的纳米凝胶粒径较小(小于200nm),比表面积大,分散均匀,具有较高的包封率和负载量,具有潜在的应用价值,受到了研究者的青睐。但是,例如:柴少虎用壳聚糖醋酸和石蜡为材料,通过戊二醛交联,制备了负载egcg的壳聚糖微球,但是该方法的缺陷是使用了有毒的交联剂,使egcg的生物可及性大大降低。
38.鉴于此,本发明提出的一种纳米凝胶的制备方法,旨在制备一种能够包埋递送生物活性物质,避免化学方法使用有毒的交联剂,导致其生物活性降低以及生物安全性等问题。
39.为实现上述目的,本发明提出纳米凝胶的制备方法,所述纳米凝胶用于包埋递送生物活性物质,所述纳米凝胶的制备方法包括以下步骤:
40.s10、将蛋白质和衍生化多糖加入水中,搅拌均匀,得蛋白质-衍生化多糖复合物。
41.在本步骤中,本发明不限制所述蛋白质的种类,优选地,所述蛋白质包括溶菌酶,溶菌酶是很稳定的蛋白质,有较强的抗热性,是来源广,价格低廉、生物相容性好的天然高分子材料。
42.本发明也不限制所述衍生化多糖的种类,只要是带负电荷的水溶性多糖衍生物均可,优选地,所述衍生化多糖包括羧甲基淀粉、羧甲基纤维素、羧甲基壳聚糖、羧甲基甲壳素和羧甲基葡聚糖中的至少一种。采用上述衍生化多糖中的至少一种,更易和溶菌酶通过静电相互作用和氢键作用结合,稳定性强。
43.优选地,所述衍生化多糖的取代度为0.1~1.5,例如0.1、0.3、0.5、1.0、1.2、1.5等,上述取代度下,使得衍生化多糖更易和溶菌酶通过静电相互作用和氢键作用结合,稳定性强。
44.优选地,所述搅拌时间为1~2h,搅拌可以在高速磁力搅拌下进行,如此,使得蛋白质和衍生化多糖充分混合并结合。
45.优选地,所述蛋白质和衍生化多糖的质量之比为5:(1~12),上述配比下,蛋白质-衍生化多糖复合物更加稳定。
46.此外,本发明不限制所述蛋白质-衍生化多糖复合物中蛋白质的浓度,在本发明实施例中,所述蛋白质的浓度是1
×
103mg/ml,稳定性强。
47.此外,在制备衍生化多糖的水溶液时,可以将衍生化多糖加入水中,在室温下搅拌2-4h使其充分溶解,是得到的衍生化多糖的水溶液不易分层,更加稳定。
48.s20、将所述蛋白质-衍生化多糖复合物加热,得蛋白质-衍生化多糖纳米凝胶。
49.对于加热温度,本发明也不作限制,只要能形成纳米凝胶均可,在本发明实施例中,加热温度为80℃,采用水浴加热,制备条件温和,使得蛋白质-衍生化多糖纳米凝胶稳定性强。
50.可选地,在步骤s20中,所述加热时间为15~120min,如此,制得的蛋白质-衍生化多糖纳米凝胶粒径小,比表面积大,分散好,均一稳定。
51.s30、将生物活性物质加入蛋白质-衍生化多糖纳米凝胶中,避光搅拌,得纳米凝胶。
52.本技术不限制生物活性物质的种类,本领域技术人员可以根据自身需要,选择相应的生物活性物质进行包埋,生物活性物质是可溶的,优选地,所述生物活性物质包括表没食子儿茶素没食子酸酯、花色苷、花青素和茶多酚中的至少一种,上述天然生物活性物质具有抗氧化、抗炎、抗癌等功效,对人体的健康具有重要的作用,同时也具有重要的生物学意义,将上述生物活性物质包埋到蛋白质-衍生化多糖纳米凝胶中,有利于进一步发挥其作用。
53.优选地,所述搅拌时间为1~2h。上述搅拌时间下,有利于生物活性物质充分包埋到蛋白质-衍生化多糖纳米凝胶中,形成纳米凝胶。
54.优选地,在步骤s30中,每克所述蛋白质-衍生化多糖纳米凝胶对应的生物活性物质的质量为0.4~2mg。上述比例,有利于生物活性物质充分包埋到蛋白质-衍生化多糖纳米凝胶中,形成纳米凝胶。
55.优选地,步骤s30包括:
56.s31、将生物活性物质溶解到酸性缓冲液中,得生物活性物质溶液。
57.优选地,在步骤s31中,所述生物活性物质溶液中,生物活性物质的浓度为0.05~2.00mg/ml。有利于生物活性物质充分包埋到蛋白质-衍生化多糖纳米凝胶中,形成纳米凝胶。
58.s32、将所述生物活性物质溶液加入蛋白质-衍生化多糖纳米凝胶中,避光搅拌,得纳米凝胶。
59.可选地,在步骤s32中,每克所述蛋白质-衍生化多糖纳米凝胶对应的所述生物活性物质溶液的体积为1~10ml。有利于生物活性物质充分包埋到蛋白质-衍生化多糖纳米凝胶中,形成纳米凝胶。
60.优选地,所述纳米凝胶的粒径小于200nm。上述粒径下,使得纳米凝胶具有较高的包埋率和负载量,同时保持了生物活性物质的稳定性,也提高了其生物利用度。
61.本发明提供的技术方案中,将蛋白质和衍生化多糖通过物理方法制备得到蛋白质-衍生化多糖复合物,再通过进一步加热形成了蛋白质-衍生化多糖纳米凝胶,然后把生物活性物质包埋在溶菌酶-衍生化多糖纳米凝胶中,得到了包埋递送生物活性物质的溶菌酶-衍生化多糖纳米凝胶。该制备过程利用了蛋白质和衍生化多糖的静电相互作用和氢键作用,为物理方法,避免了化学方法使用有毒的交联剂,导致其生物活性降低以及生物安全性等问题,为保持生物活性物质的稳定性,提高其生物利用度提供了一个新的途径。此外,利用纳米凝胶在经过胃肠道环境中的缓释性能,使其在特定的环境中释放被包埋的生物活性物质,避免了生物活性物质在经过胃肠道环境中容易被分解的缺点,保持了生物活性物质的稳定性,同时也提高了生物活性物质的可及性。
62.本发明提出的纳米凝胶的制备方法,所使用的原料是天然高分子蛋白质和多糖,来源广泛、天然无毒、具有良好的生物相容性和降解性,是一种优良的构建载体原料;所制备得到的蛋白质-衍生化多糖纳米凝胶是通过物理方法(静电相互作用和氢键作用),未使用有毒的化学交联剂,绿色环保、生物安全性高、属于食品级的载体材料;所制备得到的蛋白质-衍生化多糖纳米凝胶粒径小(小于200nm)、分散性好、稳定均一;所制备得到的蛋白质-衍生化多糖纳米凝胶成本低廉、方法简单、适用于工业化生产;将生物活性物质包埋在蛋白质-衍生化多糖纳米凝胶中,具有较高的包埋率和负载量,同时保持了生物活性物质的稳定性,也提高了其生物利用度。
63.以下结合具体实施例及附图对本发明的技术方案作进一步详细说明,应当理解,以下实施例仅仅用以解释本发明,并不用于限定本发明。
64.实施例1
65.包埋egcg的溶菌酶-羧甲基淀粉纳米凝胶的制备方法,步骤如下:
66.首先将溶菌酶与羧甲基淀粉(ds=0.8)溶解在超纯水中,然后在磁力搅拌台上室温搅拌2h使其充分溶解,固定溶菌酶的浓度1
×
103mg/ml,通过调节羧甲基淀粉的比例,使溶菌酶与羧甲基淀粉的质量比为5:1,并继续搅拌30-60min使混合体系稳定均匀,将形成的复合物在80℃的水浴中加热15min,即可得到溶菌酶-羧甲基淀粉纳米凝胶。将egcg溶解在酸性缓冲溶液中,配置浓度(0.05mg/ml),取其固定量加入到溶菌酶-羧甲基淀粉纳米凝胶中,在磁力搅拌台上避光搅拌1h。设置egcg的添加量(1ml),将egcg加入到固定量的溶菌酶-羧甲基淀粉纳米凝胶中,然后在磁力搅拌台避光搅拌1h,即可得到包埋egcg的溶菌酶-羧甲基淀粉纳米凝胶。
67.将包埋egcg的溶菌酶-羧甲基淀粉纳米凝胶先与模拟的胃液混合,释放1-2小时后,再与模拟的肠液混合,释放2-4小时,绘制包埋egcg的溶菌酶-羧甲基淀粉纳米凝胶在胃肠环境中的释放曲线,得图1。
68.由图1可以看出,本技术实施例制得的包埋egcg的溶菌酶-羧甲基淀粉纳米凝胶,在胃中释放的较少,在肠液中达到了缓慢释放的效果。
69.实施例2
70.包埋花色苷的溶菌酶-羧甲基淀粉纳米凝胶的制备方法,步骤如下:
71.首先将溶菌酶与羧甲基淀粉(ds=1.5)溶解在超纯水中,然后在磁力搅拌台上室温搅拌4h使其充分溶解,固定溶菌酶的浓度1
×
103mg/ml,通过调节羧甲基淀粉的比例,使溶菌酶与羧甲基淀粉的质量比为5:12,并继续搅拌30-60min使混合体系稳定均匀,将形成的复合物在80℃的水浴中加热120min,即可得到溶菌酶-羧甲基淀粉纳米凝胶。将花色苷溶解在酸性缓冲溶液中,配置浓度(2.00mg/ml),取其固定量加入到溶菌酶-羧甲基淀粉纳米凝胶中,在磁力搅拌台上避光搅拌2h。花色苷的添加量(10ml),将花色苷加入到固定量的溶菌酶-羧甲基淀粉纳米凝胶中,然后在磁力搅拌台避光搅拌2h,即可得到包埋花色苷的溶菌酶-羧甲基淀粉纳米凝胶。
72.实施例3
73.包埋花色苷的溶菌酶-羧甲基壳聚糖纳米凝胶的制备方法,步骤如下:
74.首先将溶菌酶与羧甲基壳聚糖(ds=0.5)溶解在超纯水中,然后在磁力搅拌台上室温搅拌3h使其充分溶解,固定溶菌酶的浓度1
×
103mg/ml,通过调节羧甲基壳聚糖的比例,使溶菌酶与羧甲基壳聚糖的质量比为5:2,并继续搅拌30-60min使混合体系稳定均匀,将形成的复合物在80℃的水浴中加热不同时间梯度30min,即可得到溶菌酶-羧甲基壳聚糖纳米凝胶。将花色苷溶解在酸性缓冲溶液中,配置的浓度(1.00mg/ml),取其固定量加入到溶菌酶-羧甲基壳聚糖纳米凝胶中,在磁力搅拌台上避光搅拌1h。设置花色苷的添加量(5ml),将花色苷加入到固定量的溶菌酶-羧甲基壳聚糖纳米凝胶中,然后在磁力搅拌台避光搅拌1h,即可得到包埋花色苷的溶菌酶-羧甲基壳聚糖纳米凝胶。
75.实施例4
76.包埋茶多酚的溶菌酶-羧甲基葡聚糖纳米凝胶的制备方法,步骤如下:
77.首先将溶菌酶与羧甲基葡聚糖(ds=0.8)溶解在超纯水中,然后在磁力搅拌台上室温搅拌4h使其充分溶解,固定溶菌酶的浓度1
×
103mg/ml,通过调节羧甲基葡聚糖的比例,使溶菌酶与羧甲基葡聚糖的质量比为5:3,并继续搅拌30-60min使混合体系稳定均匀,将形成的复合物在80℃的水浴中加热45min,即可得到溶菌酶-羧甲基葡聚糖纳米凝胶。将茶多酚溶解在酸性缓冲溶液中,配置浓度(1.5mg/ml),取其固定量加入到溶菌酶-羧甲基葡聚糖纳米凝胶中,在磁力搅拌台上避光搅拌1.5h。茶多酚的添加量(8ml),将茶多酚加入到固定量的溶菌酶-羧甲基葡聚糖纳米凝胶中,然后在磁力搅拌台避光搅拌1h,即可得到包埋茶多酚的溶菌酶-羧甲基葡聚糖纳米凝胶。
78.实施例5
79.包埋茶多酚的溶菌酶-羧甲基纤维素纳米凝胶的制备方法,步骤如下:
80.首先将溶菌酶与羧甲基纤维素(ds=1)溶解在超纯水中,然后在磁力搅拌台上室温搅拌2h使其充分溶解,固定溶菌酶的浓度1
×
103mg/ml,通过调节羧甲基纤维素的比例,使溶菌酶与羧甲基纤维素的质量比为5:5,并继续搅拌30-60min使混合体系稳定均匀,将形成的复合物在80℃的水浴中加热100min,即可得到溶菌酶-羧甲基纤维素纳米凝胶。将茶多酚溶解在酸性缓冲溶液中,配置浓度(0.80mg/ml),取其固定量加入到溶菌酶-羧甲基纤维
素纳米凝胶中,在磁力搅拌台上避光搅拌2h。茶多酚的添加量(9ml),将茶多酚加入到固定量的溶菌酶-羧甲基纤维素纳米凝胶中,然后在磁力搅拌台避光搅拌2h,即可得到包埋茶多酚的溶菌酶-羧甲基纤维素纳米凝胶。
81.实施例6
82.包埋egcg的溶菌酶-羧甲基葡聚糖纳米凝胶的制备方法,步骤如下:
83.首先将溶菌酶与羧甲基葡聚糖(ds=0.9)溶解在超纯水中,然后在磁力搅拌台上室温搅拌3h使其充分溶解,固定溶菌酶的浓度1
×
103mg/ml,通过调节羧甲基葡聚糖的比例,使溶菌酶与羧甲基葡聚糖的质量比为5:10,并继续搅拌30-60min使混合体系稳定均匀,将形成的复合物在80℃的水浴中加热不同时间梯度30min,即可得到溶菌酶-羧甲基葡聚糖纳米凝胶。将egcg溶解在酸性缓冲溶液中,配置浓度(1.50mg/ml),取其固定量加入到溶菌酶-羧甲基葡聚糖纳米凝胶中,在磁力搅拌台上避光搅拌2h。egcg的添加量(4ml),将egcg加入到固定量的溶菌酶-羧甲基葡聚糖纳米凝胶中,然后在磁力搅拌台避光搅拌1h,即可得到包埋egcg的溶菌酶-羧甲基葡聚糖纳米凝胶。
84.实施例7
85.包埋egcg的溶菌酶-羧甲基壳聚糖纳米凝胶的制备方法,步骤如下:
86.首先将溶菌酶与羧甲基壳聚糖(ds=0.3)溶解在超纯水中,然后在磁力搅拌台上室温搅拌3h使其充分溶解,固定溶菌酶的浓度1
×
103mg/ml,通过调节羧甲基壳聚糖的比例,使溶菌酶与羧甲基壳聚糖的质量比为5:6,取一定量的溶菌酶逐渐加入到高速磁力搅拌的羧甲基壳聚糖溶液中,并继续搅拌30-60min使混合体系稳定均匀,将形成的复合物在80℃的水浴中加热不同时间梯度65min,即可得到溶菌酶-羧甲基壳聚糖纳米凝胶。将egcg溶解在酸性缓冲溶液中,配置的浓度(1.00mg/ml),取其固定量加入到溶菌酶-羧甲基壳聚糖纳米凝胶中,在磁力搅拌台上避光搅拌1.5h。egcg的添加量(6ml),将egcg加入到固定量的溶菌酶-羧甲基壳聚糖纳米凝胶中,然后在磁力搅拌台避光搅拌1.5h,即可得到包埋egcg的溶菌酶-羧甲基壳聚糖纳米凝胶。
87.实施例8
88.包埋egcg的溶菌酶-羧甲基纤维素纳米凝胶的制备方法,步骤如下:
89.首先将溶菌酶与羧甲基纤维素(ds=1.2)溶解在超纯水中,然后在磁力搅拌台上室温搅拌4h使其充分溶解,固定溶菌酶的浓度1
×
103mg/ml,通过调节羧甲基纤维素的比例,使溶菌酶与羧甲基纤维素的质量比为5:11,并继续搅拌30-60min使混合体系稳定均匀,将形成的复合物在80℃的水浴中加热100min,即可得到溶菌酶-羧甲基纤维素纳米凝胶。将egcg溶解在酸性缓冲溶液中,配置浓度(1.20mg/ml),取其固定量加入到溶菌酶-羧甲基纤维素纳米凝胶中,在磁力搅拌台上避光搅拌2h。egcg的添加量(8ml),将egcg加入到固定量的溶菌酶-羧甲基纤维素纳米凝胶中,然后在磁力搅拌台避光搅拌1h,即可得到包埋egcg的溶菌酶-羧甲基纤维素纳米凝胶。
90.以溶菌酶和羧甲基淀粉的比例为横坐标,蛋白质-衍生化多糖复合物的浊度(1-t%)为纵坐标,作不同的羧甲基淀粉取代度下的图,得图2,可以看出,在本发明范围内的不同取代度下和原料配比下,均可形成均一、稳定的溶菌酶-羧甲基淀粉复合物。
91.以溶菌酶和羧甲基淀粉的比例为横坐标,蛋白质-衍生化多糖复合物的电位(zeta potential)为纵坐标,作不同的羧甲基淀粉取代度下的图,得图3,可以看出,在本发明范围
内的不同取代度下和原料配比下,均可形成均一、稳定的溶菌酶-羧甲基淀粉复合物。
92.以溶菌酶和羧甲基淀粉的比例为横坐标,蛋白质-衍生化多糖复合物的粒径(particle size)为纵坐标,作不同的羧甲基淀粉取代度下的图,得图4,可以看出,在本发明范围内的不同取代度下和原料配比下,均可形成均一、稳定的溶菌酶-羧甲基淀粉复合物。
93.以加热时间为横坐标,纳米凝胶的粒径(particle size)和pdi(聚合物分散性指数)为纵坐标,作图,得图5,可以看出,在本发明实施例加热时间范围内,均可形成粒径小(小于200nm)的纳米凝胶,且纳米凝胶的分散性好。
94.以表没食子儿茶素没食子酸酯(egcg)的加入量(每克所述蛋白质-衍生化多糖纳米凝胶对应的egcg的质量)为横坐标,包埋率(encapsulation effciency)和负载率(loading capacity)为纵坐标,作图,得图6,可以看出,在本发明范围内的egcg的加入量,egcg的包埋率和负载率较高,包埋率接近80%。
95.综上,本发明提出的纳米凝胶的制备方法,利用了蛋白质和衍生化多糖的静电相互作用和氢键作用,为物理方法,避免了化学方法使用有毒的交联剂,导致其生物活性降低以及生物安全性等问题,为保持生物活性物质的稳定性,提高其生物利用度提供了一个新的途径。此外,利用纳米凝胶在经过胃肠道环境中的缓释性能,使其在特定的环境中释放被包埋的生物活性物质,避免了生物活性物质在经过胃肠道环境中容易被分解的缺点,保持了生物活性物质的稳定性,同时也提高了生物活性物质的可及性。
96.以上所述仅为本发明的优选实施例,并非因此限制本发明的专利范围,凡是在本发明的发明构思下,利用本发明说明书内容所作的等效结构变换,或直接/间接运用在其他相关的技术领域均包括在本发明的专利保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1