一种耐高温肠溶缓释的包衣复合益生菌微丸及其制备方法与流程
1.本发明属于微生物包衣微丸制备工艺技术领域,具体涉及一种耐高温肠溶缓释的包衣复合益生菌微丸及其制备方法。
背景技术:
[0002][0003]
如何在提高产品的安全性与品质的同时降低成本,成为畜禽养殖者及饲料加工企业在新形势面临的一大考验。这同时使饲料添加剂的选择和应用成为关键。因此,在畜禽饲料可以采用含有益生菌的生态制剂替换抗生素作为饲料添加剂,有望解决抗生素残留和动物耐药等问题,对畜牧业发展有着不可估量的作用。
[0004]
现有用作饲料添加剂的微生态制剂往往不仅含有一种或同属的几种益生菌,而是包含来自不同种或属的多种益生菌的混合益生菌制剂。目前,《饲料添加剂品种目录》2013版中允许添加的微生物菌种共35种,以芽孢杆菌和乳酸菌为代表的微生态制剂,具有保持动物肠道微生物平衡、防止疾病、促进生长、提高饲料转化率、改善畜禽饲养环境等功效,日益成为各大饲料加工企业和畜禽养殖业关注的焦点。
[0005]
由于乳酸菌多为厌氧菌或兼性厌氧菌,在生长过程中,不形成芽孢,抗性较差,在液体条件下难以长期保存,而且也不利于运输、储藏和使用。乳酸菌制剂必须通过胃环境以大量的存活菌到达肠道并定植于肠黏膜上才能发挥其生理作用,但由于胃酸、胆汁酸等的杀菌作用,乳酸菌制剂的活菌数在此过程中会大幅度下降。因此,如何使乳酸菌制剂到达动物肠道后仍能大量(≥107)存活,并进一步在肠道中萌发、增殖以及分泌代谢产物已成为越来越关注的问题。
[0006]
利用基因工程方法提高乳酸菌的耐高温(≥70℃)和耐高湿(≥20%)等性能是解决问题的方法之一,并取得一定的进展。然而,此种办法有一定的限制:1、耐高温等性能和菌种发酵效率不可兼得;2、耐高温等性能、生理生化特性和代谢产物及其在动物体内生物活性不可兼得;3、转基因菌种的安全性得不到保证。而且,欧洲对进口转基因饲用益生菌在注册、验证、使用上要求及其严格,导致把转基因耐高温乳酸菌销售到欧洲市场难度非常大。
[0007]
所以,如何采用非转基因方法提高乳酸菌的以上性能成为本技术饲用益生菌复合制剂所要解决的关键技术问题。
技术实现要素:
[0008]
为了解决现有技术中存在的问题,本发明的目的在于提供一种耐高温肠溶缓释的包衣复合益生菌微丸及其制备方法。本发明制得的耐高温肠溶缓释的包衣复合益生菌微丸通过添加的复合保护和特殊的包衣材料,能够有效的对益生菌起到保护作用,可以提高益生菌的生理生化性能,比如耐高温、耐酸、耐胆盐性能,使其在饲料高温制粒过程中存活率大大提高,在动物体内可以抗酸过胃,只在肠道中释放,并萌发芽孢形成营养体,并迅速生
长繁殖,发挥生物学功能;同时,采用包衣技术更有利于其在常温下相对长时间的储存。
[0009]
本发明的技术方案是:
[0010]
一种耐高温肠溶缓释的包衣复合益生菌微丸,,包括丸芯和包衣材料,所述丸芯包含质量比为1:0.1~0.2的益生菌干菌粉和复合保护剂;所述包衣材料包含质量比为18~22:0.5~2:0.5~2:1~5的乙基纤维素、羟丙基甲基纤维素、邻苯二甲酸聚乙烯醇酯和硬脂酸钙。
[0011]
进一步地,所述包衣材料包含质量比为20:1:1:3的乙基纤维素、羟丙基甲基纤维素、邻苯二甲酸聚乙烯醇酯和硬脂酸钙。
[0012]
本发明中采用的包衣材料中,由乙基纤维素、羟丙基甲基纤维素、邻苯二甲酸聚乙烯醇酯和硬脂酸钙按照特定比例组成,添加的乙基纤维素不溶于水,易溶于有机溶剂,成膜性能好,衣膜具有半渗透性是渗透泵式控释水不溶型薄膜衣材料;添加的羟丙基甲基纤维素(hpmc),膜性能好,所成的膜透明、坚韧,生产时不容易粘连,尤其是对于易吸潮、质变的复合益生菌,用此做断绝层可大大提高其不变性,而且可作为复合益生菌定位释放的辅料,将上述组分与邻苯二甲酸聚乙烯醇酯(pvap)和硬脂酸钙共同作为本发明的包衣材料联合使用,能在丸芯外层均匀地形成质地致密的防水膜,可以有效保护丸芯中的益生菌的活性不会受到外界环境的伤害,有效延长益生菌微丸在常温下的储存时间;同时,还可以有效提高益生菌微丸的耐胃酸性能,在动物体内可以抗酸过胃,只在肠道中释放,并萌发芽孢形成营养体,并迅速生长繁殖,发挥生物学功能。
[0013]
进一步地,所述复合保护剂为海藻糖、蔗糖、海藻酸钙按质量比0.3~2:0.5~3:0.5~2组成。
[0014]
更进一步地,所述复合保护剂为海藻糖、蔗糖、海藻酸钙按质量比1:1:1组成。
[0015]
本发明制得的复合益生菌微丸的丸芯中除了益生菌干菌粉外,还添加了复合保护剂,其成分为海藻糖、蔗糖和海藻酸钙。海藻糖是一种典型应激代谢物,能够在高温、高寒、高渗透压及干燥失水等恶劣环境条件下在细胞表面形成独特的保护膜,有效地保护生物分子结构不被破坏,从而维持生命体的生命过程和生物特征。本发明通过添加的由海藻糖、蔗糖、海藻酸钙按特定比例组成的复合保护剂,应用于本发明丸芯的制备过程中,可以形成容纳益生菌的“支架”,作为益生菌的保护层,有助于在烘干过程中稳定益生菌的纤维素膜免受高温影响,同时还能够保护益生菌的细胞完整性,帮助保护益生菌免受恶劣环境的破坏,有助于保护益生菌在到达肠道之前不被胃酸分解,从而可以大幅度提高丸芯内益生菌的稳定性,及耐高温、耐酸、耐胆盐等性能。
[0016]
进一步地,本发明提供的耐高温肠溶缓释的包衣复合益生菌微丸,所述益生菌干菌粉为复合乳酸菌粉、凝结芽孢杆菌粉、复合芽孢杆菌粉中的一种。
[0017]
更进一步地,所述复合乳酸菌粉为肠球菌和植物乳杆菌的混合菌粉,按照活菌数1:10的比例组成,所述复合乳酸菌粉的活菌总数≥550
×
108cfu/g;
[0018]
所述凝结芽孢杆菌粉的活菌数≥5
×
108cfu/g;
[0019]
所述复合芽孢杆菌粉为丁酸梭菌、地衣芽孢杆菌和枯草芽孢杆菌的混合菌粉,按照活菌数1:2:2的比例组成,所述复合芽孢杆菌粉的活菌总数≥25
×
108cfu/g。
[0020]
另外,本发明还提供了一种耐高温肠溶缓释的包衣复合益生菌微丸的制备方法,包括如下步骤:
[0021]
s1、制粒:
[0022]
(1)丸芯的制备:
[0023]
将益生菌干菌粉与复合保护剂混合均匀后投入离心式制丸机的离心转盘上,启动风机和转盘,同时喷入去离子水,形成蓬松沙砾状颗粒,当颗粒粒径达到0.2~0.6mm,提高转盘转速至400~500rpm,有利于将松散的丸芯滚圆,然后降低喷液速度至250~300rpm,使颗粒继续保持湿润状态下滚圆,停止喷液;
[0024]
所述益生菌干菌粉、复合保护剂和去离子水的质量比为1:0.1~0.2:0.66~0.72。
[0025]
(2)烘干过筛:
[0026]
降低转盘的转速至150~250rpm,使步骤s1(1)中所得的物料维持流动状态,打开加热装置,烘干,过筛,即得丸芯;
[0027]
s2、包衣:
[0028]
(1)包衣液的制备:将去离子水加入到质量浓度为95%乙醇中形成混合液,并搅拌均匀,向其中加入包衣材料中的乙基纤维素、羟丙基甲基纤维素、邻苯二甲酸聚乙烯醇酯和硬脂酸钙,继续搅拌,过滤,将过筛后的包衣液保持搅拌状态,制得包衣液待用;
[0029]
(2)包衣:先将流化床预热,然后将步骤s1制得的丸芯投入流化床中,启动风机和加热系统,喷入包衣液;
[0030]
(3)烘干过筛:待喷完包衣液后,降低风流量,保持对流状态,使得干燥空气流烘干包衣颗粒,至水分含量<7%,过筛,得到包衣膜厚度为4~8%的复合益生菌微丸。
[0031]
进一步地,所述步骤s1(1)中启动风机和转盘时的转速为250~300rpm,喷入去离子水,所述喷水量与益生菌干菌粉和复合保护剂之和的质量比为3:5,喷水速度为4~8g/min,当颗粒粒径达到0.2~0.6mm时,提高转盘转速为400~500rpm,降低喷液速度为1~3g/min;
[0032]
所述步骤s1(2)中,降低转盘转速至250~300rpm,所述加热装置设置为36~37℃,烘干时间为5~10min。
[0033]
进一步地,所述步骤s2(1)中,所述质量浓度为95%的乙醇和去离子水的质量比为7.4:1;所述包衣材料,乙基纤维素、羟丙基甲基纤维素、邻苯二甲酸聚乙烯醇酯和硬脂酸钙的质量比为20:1:1:3;所述的所述乙醇和去离子水的混合液与包衣材料的质量比为1:2.4~2.5;
[0034]
所述步骤s2(1)中,加入包衣材料后进行搅拌30min,然后用60目筛网过滤。
[0035]
进一步地,步骤s2(2)中,所述流化床的预热时间为10min,所述风机的出风流量为3~10m3/s,出风温度为33~37℃,包衣液喷液的速度为4~10g/min。
[0036]
进一步地,所述步骤s2(3)中的烘干时的出风流量为5~10m3/s;所述步骤s2(3)中制得的复合益生菌微丸的粒径为0.25~0.5mm的颗粒占总质量的70%,粒径为0.6~0.8mm的颗粒占30%;所述步骤s2(3)中制得的复合益生菌微丸的包衣膜厚度为4~8%,该百分比为乙基纤维素质量占丸芯质量总和的百分比。
[0037]
与现有技术相比,本发明提供的耐高温肠溶缓释的包衣复合益生菌微丸具有以下优势:
[0038]
本发明制得的耐高温肠溶缓释的包衣复合益生菌微丸通过添加的复合保护和特殊的包衣材料,能够有效的对益生菌起到保护作用,可以提高益生菌的生理生化性能,比如
耐高温、耐酸、耐胆盐性能,使其在饲料高温制粒过程中存活率大大提高,在动物体内可以抗酸过胃,只在肠道中释放,并萌发芽孢形成营养体,并迅速生长繁殖,发挥生物学功能;同时,还能够有效提高制得的益生菌微丸在常温下的储存时间。
附图说明
[0039]
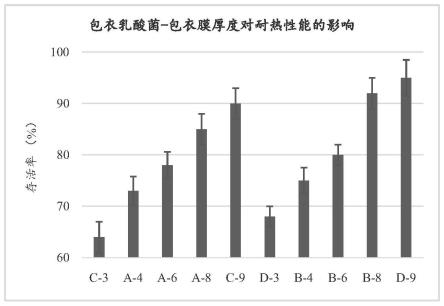
图1为试验例一中,丸芯中干菌粉与保护剂用量比分别为1:0.1和1:0.2时,不同包衣厚度的复合乳酸菌微丸热处理(85℃-5mins)后的存活率(%);
[0040]
图2为试验例一中,包衣厚度为4%时,丸芯中不同得干菌粉与保护剂用量比对复合乳酸菌微丸耐热性能(85℃-5mins)的影响;
[0041]
图3为试验例一中,包衣厚度为4%,干菌粉与保护剂用量比分别为1:0.1和1:0.2时,不同的保护剂和包衣材料对复合乳酸菌微丸耐热性能(85℃-5mins)的影响;
[0042]
图4为试验例一中,丸芯中干菌粉与保护剂用量比分别为1:0.1和1:0.2时,不同包衣厚度(3~9%)的复合乳酸菌微丸酸处理(ph2.5-1hr)后的存活率(%);
[0043]
图5为试验例一中,包衣厚度为4%时,丸芯中不同的干菌粉与保护剂用量比对复合乳酸菌微丸耐酸性能(ph2.5-1hr)的影响;
[0044]
图6为试验例一中,包衣厚度为4%,干菌粉与保护剂用量比分别为1:0.1和1:0.2时,不同的保护剂和包衣材料对复合乳酸菌微丸耐酸性能(ph2.5-1hr)的影响;
[0045]
图7为试验例一中,丸芯中干菌粉与保护剂用量比分别为1:0.1和1:0.2时,不同包衣厚度(3~9%)的复合乳酸菌微丸胆盐处理(0.3%-1hr)后存活率(%);
[0046]
图8为试验例一中,包衣厚度为4%时,丸芯中不同的干菌粉与保护剂用量比对复合乳酸菌微丸耐胆盐性能(0.3%-1hr)的影响;
[0047]
图9为试验例一中,包衣厚度为4%,干菌粉与保护剂用量比分别为1:0.1和1:0.2时,不同的保护剂和包衣材料对复合乳酸菌微丸耐胆盐性能(0.3%-1hr)的影响;
[0048]
图10为试验例一中,丸芯中干菌粉与保护剂用量比分别为1:0.1和1:0.2时,不同包衣厚度(3~9%)的复合乳酸菌微丸常温(≤30℃)保存的稳定性能;
[0049]
图11为试验例一中,包衣厚度为4%时,丸芯中不同的干菌粉与保护剂用量比对复合乳酸菌微丸常温(≤30℃)保存稳定性能的影响;
[0050]
图12为试验例一中,包衣厚度为4%,干菌粉与保护剂用量比分别为1:0.1和1:0.2时,不同的保护剂和包衣材料对复合乳酸菌微丸常温(≤30℃)保存稳定性能的影响;
[0051]
图13为试验例一中,丸芯中干菌粉与保护剂用量比分别为1:0.1和1:0.2时,不同包衣厚度(3~9%)的复合乳酸菌微丸的缓释性能;
[0052]
图14为试验例一中,包衣厚度为4%时,丸芯中不同的干菌粉与保护剂用量比对复合乳酸菌微丸缓释性能的影响;
[0053]
图15为试验例一中,包衣厚度为4%,干菌粉与保护剂用量比分别为1:0.1和1:0.2时,不同的保护剂和包衣材料对复合乳酸菌微丸缓释性能的影响;
[0054]
图16为试验例二中,丸芯中干菌粉与保护剂用量比分别为1:0.1和1:0.2时,不同包衣厚度(3~9%)的凝结芽孢杆菌微丸,在酸性(ph2.5)条件下,热处理(85℃-5mins)后的存活率;
[0055]
图17为试验例二中,包衣厚度为4%时,丸芯中不同的干菌粉与保护剂用量对凝结
芽孢杆菌微丸在酸性(ph2.5)条件下耐热性能(85℃-5mins)的影响;
[0056]
图18为试验例二中包衣厚度为4%,干菌粉与保护剂用量分别为1:0.1和1:0.2时,不同的丸芯中保护剂和包衣材料对凝结芽孢杆菌微丸在酸性(ph2.5)条件下耐热性能(85℃-5mins)的影响;
[0057]
图19为试验例二中,丸芯中干菌粉与保护剂用量比分别为1:0.1和1:0.2时,不同包衣厚度(3~9%)的凝结芽孢杆菌微丸的缓释性能;
[0058]
图20为试验例二中,包衣厚度为4%时,丸芯中不同的干菌粉与保护剂用量比对凝结芽孢杆菌微丸缓释性能的影响;
[0059]
图21为试验例二中,包衣厚度为4%,干菌粉与保护剂用量比分别为1:0.1和1:0.2时,不同的保护剂和包衣材料对凝结芽孢杆菌微丸缓释性能的影响;
[0060]
图22为试验例三中,丸芯中干菌粉与保护剂用量比分别为1:0.1和1:0.2时,不同包衣厚度(3~9%)的复合芽孢杆菌微丸的缓释性能;
[0061]
图23为试验例三中,包衣厚度为4%时,丸芯中不同的干菌粉与保护剂用量比对复合芽孢杆菌微丸缓释性能的影响;
[0062]
图24为试验例三中,包衣厚度为4%,干菌粉与保护剂用量比分别为1:0.1和1:0.2时,不同的保护剂和包衣材料对复合芽孢杆菌微丸缓释性能的影响。
具体实施方式
[0063]
以下通过具体实施方式的描述对本发明作进一步说明,但这并非是对本发明的限制,本领域技术人员根据本发明的基本思想,可以做出各种修改或改进,但是只要不脱离本发明的基本思想,均在本发明的保护范围之内。
[0064]
以下实施例和对比例中,未作特别说明的试剂为常规试剂,均可在常规试剂生产销售公司购买。
[0065]
实施例1耐高温肠溶缓释的包衣复合益生菌微丸及其制备方法
[0066]
所述的耐高温肠溶缓释的包衣复合益生菌微丸,包括丸芯和包衣材料;
[0067]
所述丸芯由益生菌干菌粉和复合保护剂组成,所述复合保护剂为海藻糖、蔗糖和海藻酸钙按质量比1:1:1组成;所述包衣材料由乙基纤维素、羟丙基甲基纤维素、邻苯二甲酸聚乙烯醇酯和硬脂酸钙按质量比20:1:1:3组成。
[0068]
所述益生菌干菌粉分别为复合乳酸菌粉或者凝结芽孢杆菌粉或者复合芽孢杆菌粉。
[0069]
所述益生菌干菌粉为复合乳酸菌粉,所述复合乳酸菌粉为肠球菌和植物乳杆菌按照活菌数1:10的比例组成,所述乳酸菌总数≥550
×
108cfu/g;
[0070]
所述益生菌干菌粉为凝结芽孢杆菌粉,活菌数≥5
×
108cfu/g;
[0071]
所述益生菌干菌粉为复合芽孢杆菌粉,所述复合芽孢杆菌粉为丁酸梭菌、地衣芽孢杆菌和枯草芽孢杆菌按照活菌数1:2:2的比例组成,所述芽孢杆菌总数≥25
×
108cfu/g。
[0072]
下面以生产100kg包衣膜厚度分别为4%、6%和8%(该百分比为乙基纤维素质量占丸芯质量总和的百分比)的复合益生菌微丸为实施例,按丸芯中干菌粉与保护剂不同质量比(1:0.1和1:0.2)分为a和b两组,分别制备包衣复合乳酸菌微丸、包衣凝结芽孢杆菌微丸和包衣复合芽孢杆菌微丸,在表1和表2中列举了每组各类原料的配比和用量。
[0073]
表1原料配方a组(干菌粉:保护剂=1:0.1,包衣膜厚度4~8%)
[0074][0075]
表2原料配方b组(干菌粉:保护剂=1:0.2,包衣膜厚度4~8%)
[0076][0077][0078]
所述的耐高温肠溶缓释的包衣复合益生菌微丸的制备方法,包括如下步骤:s1、制粒:
[0079]
(1)丸芯的制备:
[0080]
将益生菌粉与复合保护剂混合均匀后投入离心式制丸机的离心转盘上,启动风机和转盘,所述转盘转速为300rpm,同时喷入去离子水,喷水速度为6g/min(所述喷水量与益
生菌干菌粉和复合保护剂之和的质量比为3:5),形成蓬松沙砾状颗粒,当颗粒达粒径达到0.2~0.6mm时,提高转盘转速至450rpm,并降低喷液速度为2g/min,使颗粒保持湿润状态下滚圆,停止喷液;
[0081]
(2)烘干过筛:
[0082]
再次降低转盘的转速至280rpm,使步骤s1(1)中所得的物料维持流动状态,打开加热装置,在36~37℃下烘干10min,过筛,即得丸芯;
[0083]
s2、包衣:
[0084]
(1)包衣液的制备:
[0085]
将去离子水加入到质量浓度为95%乙醇中形成混合液(所述乙醇溶液和水的质量比为7.4:1),并搅拌均匀,将乙基纤维素、羟丙基甲基纤维素、邻苯二甲酸聚乙烯醇酯和硬脂酸钙依次按20:1:1:3的质量比加入到乙醇和水的混合液中,继续搅拌30min,然后用60目筛网过滤,将过筛后的包衣液保持搅拌状态,制得包衣液待用。
[0086]
(2)包衣:
[0087]
先将流化床预热10min,然后将步骤s1制得的丸芯投入流化床中,启动风机和加热系统,此时,出风量为8m3/s,出风温度为35℃,并以8g/min的喷液速度喷入包衣液。
[0088]
(3)烘干过筛:
[0089]
待喷完包衣液后,降低风流量至5m3/s,保持对流状态,使得干燥空气流烘干包衣颗粒,至水分含量<7%,过筛,分别得到包衣膜厚度为4~8%的包衣复合乳酸菌微丸、包衣凝结芽孢杆菌微丸、包衣复合芽孢杆菌微丸。所述步骤s2(3)中制得的复合益生菌微丸的粒径为0.25~0.5mm的颗粒占总质量的70%,粒径为0.6~0.8mm的颗粒占30%。
[0090]
所述制粒及包衣过程中的还涉及到的其他工艺参数如表3所示:
[0091]
表3
[0092]
风机频率:30hz进风温度:33~37℃物料温度:26~34℃出风温度:25~36℃导流筒与底板距离:1.5cm喷枪嘴孔径:1.2mm输液硅胶管内径:3mm喷液雾化器压:1.2~1.5mpa蠕动泵转速:6~12r/m
[0093]
所述烘干工艺参数如表4所示:
[0094]
表4
[0095]
风机频率:26~28hz进风温度:36~37℃烘干时间:1~10min
[0096]
对比例1耐高温肠溶缓释的包衣复合益生菌微丸及其制备方法
[0097]
与实施例1相比,对比例1的区别在于,所述c组和d组包衣复合益生菌粉微丸包衣膜厚度分别为3%和9%,其他参数和操作与实施例1相同,具体组分含量如表5和表6所示。
[0098]
表5原料配方c(干菌粉:保护剂=1:0.1,包衣膜厚度3%和9%)
[0099][0099][0100]
表6原料配方d(干菌粉:保护剂=1:0.2,包衣膜厚度3%和9%)
[0101][0102]
对比例2耐高温肠溶缓释的包衣复合益生菌微丸及其制备方法
[0103]
与实施例1相比,对比例2的区别在于,所述e组和f组包衣复合益生菌粉微丸的丸芯中,干菌粉和保护剂的质量比分别为1:0.05和1:0.3,包衣膜厚度均为4%,其他参数和操作与实施例1相同,具体组分含量如表7所示。
[0104]
表7原料配方e、f组(干菌粉:保护剂=1:0.05和1:0.3,包衣膜厚度4%)
[0105][0106]
对比例3耐高温肠溶缓释的包衣复合益生菌微丸及其制备方法
[0107]
与实施例1相比,对比例3的区别在于,所述g组和h组包衣复合益生菌粉微丸的包衣膜中,所述包衣膜主要材料组合更换为(肠溶缓释型)丙烯酸树脂ⅱ、丙烯酸树脂ⅲ、聚乙二醇和柠檬酸三乙酯,质量比为20:1:1:3,包衣膜厚度均为4%(以丙烯酸树脂ⅱ质量占丸芯粉状物质质量总和的百分比表示),其他参数和操作与实施例1相同,具体组分含量如表8所示。
[0108]
表8原料配方g和h(干菌粉:保护剂=1:0.1和1:0.2,包衣膜厚度4%)
[0109][0110]
[0111]
试验例一、本发明制得的耐高温肠溶缓释的包衣复合乳酸菌微丸的性能检测1.试验对象:本发明实施例1制得的包衣复合乳酸菌微丸a-4、a-6、a-8、b-4、b-6和b-8;对比例1制得包衣复合乳酸菌微丸c-3、c-9、d-3、d-9;对比例2制得包衣复合乳酸菌微丸e-4和f-4;对比例3制得包衣复合乳酸菌微丸g-4和h-4。
[0112]
2.检测方法:
[0113]
(1)耐高温性能检测
[0114]
分别取本发明实施例1、对比例1、2、3制得的包衣复合乳酸菌微丸各10g,等量分成两份,一份置于室温试管内不进行热处理;另一份置于已预热至85℃的试管内,放入85℃烘箱进行5min的热处理。热处理完成后,把试管放入冷水浴中冷却至室温。
[0115]
配置mrs液体培养基(ph6.5):蛋白胨10.0g/l、牛肉膏粉5.0g/l、酵母膏粉4.0g/l、葡萄糖20.0g/l、吐温-80 1.0g/l、七水磷酸氢二钾2.0g/l、醋酸钠
·
3h2o 5.0g/l、柠檬酸三铵2.0g/l、七水硫酸镁0.2g/l、四水硫酸锰0.05g/l和琼脂粉15.0g/l,进行灭菌(121℃,15min),灭菌后冷却待用。取适量热处理后和未经热处理的微丸置于250ml具塞锥形瓶中,分别加入100ml mrs液体培养基(ph6.5),磁力搅拌直至将微丸颗粒完全粉碎成粉末,置恒温(37℃)培养箱中厌氧培养3小时,最后用平板计数法(48小时)测定其活菌数th和t
nh
。
[0116]
包衣复合乳酸菌微丸耐热性能(%)=(th/t
nh
)
×
100%。th是热处理后微丸中的活菌数,t
nh
是未经热处理微丸中的活菌数。每组计数需要三组平行,试验结果如图1、2和3所示。
[0117]
(2)耐酸性能检测
[0118]
配置mrs液体培养基(ph6.5)(如上所示),用2mol/l的hcl溶液将mrs液体培养基ph调至2.5作为酸性液体培养基,进行灭菌(121℃,15min),灭菌后冷却待用。
[0119]
分别取本发明实施例1、对比例1、2和3制得的包衣复合乳酸菌微丸各10g等量分成二份,一份置于250ml具塞锥形瓶内,加入100ml未酸化mrs液体培养基(ph6.5),磁力搅拌直至将微丸颗粒完全粉碎成粉末后,置恒温(37℃)培养箱中厌氧培养3小时,用平板计数法(48小时)测定其活菌数t
na
;另一份装入小尼龙袋(400目)中,密封尼龙袋后,置于250ml具塞锥形瓶内,加入100ml酸性液体培养基,置恒温(37℃)培养箱中酸处理1小时,取出尼龙袋,用100ml未酸化mrs液体培养基(ph6.5)将尼龙袋里的微丸洗入新的250ml具塞锥形瓶中,磁力搅拌至颗粒完全粉碎成粉末,置恒温(37℃)培养箱中厌氧培养3小时,用平板计数法(48小时)测定其活菌数ta。
[0120]
包衣复合乳酸菌微丸的耐酸性能(%)=(ta/t
na
)
×
100%。ta是酸处理后微丸中的活菌数,t
na
是未经酸处理的微丸中的活菌数。每组计数需要三组平行,试验结果如图4、5和6所示。
[0121]
(3)耐胆盐性能检测
[0122]
配置mrs液体培养基(ph6.5)(如上所示),将0.3%(w/v)猪胆盐加入mrs液体培养基中作为胆盐液体培养基,进行灭菌(121℃,15min),灭菌后冷却待用。
[0123]
分别取本发明实施例1、对比例1、2、和3制得的包衣复合乳酸菌微丸各10g等量分成两份,一份置于250ml具塞锥形瓶内,加入100ml不含胆盐mrs液体培养基(ph6.5),磁力搅拌直至将微丸颗粒完全粉碎成粉末后,置恒温(37℃)培养箱中厌氧培养3小时,用平板计数法(48小时)测定其活菌数t
nb
;另一份装入小尼龙袋(400目)中,密封尼龙袋后,置于250ml具
塞锥形瓶内,加入100ml胆盐液体培养基,置恒温(37℃)培养箱中胆盐处理1小时,取出两个尼龙袋,用100ml不含胆盐mrs液体培养基(ph6.5)将尼龙袋里的微丸洗入新的250ml具塞锥形瓶中,磁力搅拌至颗粒完全粉碎成粉末,置恒温(37℃)培养箱中厌氧培养3小时,用平板计数法(48小时)测定其活菌数tb。
[0124]
包衣复合乳酸菌耐胆盐性能(%)=(tb/t
nb
)
×
100%。tb是胆盐处理后微丸中的活菌数,t
nb
是未经胆盐处理后微丸中的活菌数。每组计数需要三组平行,试验结果如图7、8和9所示。
[0125]
(4)稳定性能检测
[0126]
配置mrs液体培养基(ph6.5)(如上所示),进行灭菌(121℃,15min),灭菌后冷却待用。
[0127]
将适量新鲜制备和储存在室温条件下1、3和6个月的本发明实施例1、对比例1、2、和3制得的包衣复合乳酸菌微丸各10g,分别置于四个250ml具塞锥形瓶内,各自加入100ml mrs液体培养基(ph6.5),磁力搅拌直至将微丸颗粒完全粉碎成粉末后,置于恒温(37℃)培养箱中厌氧培养3小时,用平板计数法(48小时)测定其活菌数t0和t
1~6
。
[0128]
包衣复合乳酸菌稳定性(%)=(t
1~6
/t0)
×
100%。储存不同时间后微丸中的活菌数t
1~6
,新鲜制备微丸中的活菌数t0。每组计数需要三组平行,试验结果如图10、11和12所示。
[0129]
(5)缓释性能检测
[0130]
配置mrs液体培养基(ph6.5)(如上所示),进行灭菌(121℃,15min),灭菌后冷却待用。
[0131]
分别取本发明实施例1、对比例1、2、和3制得的包衣复合乳酸菌微丸各10g等量分成四份,分别置于四个250ml具塞锥形瓶内,加入100ml mrs液体培养基(ph6.5),其中一份磁力搅拌直至将微丸颗粒完全粉碎成粉末后,置于恒温(37℃)培养箱中厌氧培养3小时,用平板计数法(48小时)测定其活菌数t
cr
;另外三份分别置于恒温(37℃)培养箱中厌氧培养1、2和3小时,用平板计数法(48小时)测定其活菌数t
r1~3
。
[0132]
包衣复合乳酸菌释放率(%)=(t
r1~3
/t
cr
)
×
100%。(中性条件下)微丸在不同时间段释放于液体培养基中的活菌数t
r1~3
,(中性条件下)微丸完全释放于液体培养基中的活菌数t
cr
。每组计数需要三组平行,试验结果如图13、14和15所示。
[0133]
从图1~15中可以看出:本发明制得的包衣复合乳酸菌微丸的包膜厚度与其抗逆性能和稳定性能成正向线性关系,当包衣厚度达到4%以上,实施组a和b的耐热、耐酸、耐胆盐性能大大提高,70%以上的活菌得以存活,同时储存稳定性能良好,6个月后,仍有80%以上的活菌得以存活(图1、4、7和10);包衣复合乳酸菌微丸是缓释剂型,包衣厚度与释放性能成反向线性关系,当包衣厚度≤8%时,在中性(模拟肠道)条件下,3小时后,90%以上活菌基本得以释放,而当包衣厚度》8%时,释放性能降低,在同样条件下,3小时后,仍有15%左右的活菌不能释放(图13);在包衣膜厚度相同的情况下,丸芯中干菌粉/保护剂的质量比越小,即海藻糖+蔗糖+海藻酸钙含量越高,其微丸抗逆性能和稳定性有提高的趋势,但释放性能有所下降,如实施组,当中干菌粉/保护剂的质量比的范围在5~10倍时,其综合性能(抗逆性能、稳定性和释放性能)最佳(图2、5、8、11和14)。
[0134]
如果微丸包衣厚度为4%,丸芯中干菌粉和保护剂的材质和质量比与实施组一致,
但包衣膜主要材料组合改为(肠溶缓释型)丙烯酸树脂ⅱ、丙烯酸树脂ⅲ、聚乙二醇和柠檬酸三乙酯(质量比为20:1:1:3),其微丸的抗逆性和稳定性不如实施组中同等包衣厚度的微丸;同时,其微丸释放得更快,在中性(模拟肠道)条件下,2小时后,90%以上活菌基本得以释放,缓释效果没有实施组中同等包衣厚度的微丸好(图3、6和9)。
[0135]
试验例二、本发明制得的耐高温肠溶缓释的包衣凝结芽孢杆菌微丸的性能检测1.试验对象:本发明实施例1制得的包衣凝结芽孢杆菌微丸a-4、a-6、a-8、b-4、b-6、b-8;对比例1制得包衣复合芽孢杆菌微丸c-3、c-9、d-3、d-9;对比例2制得包衣复合芽孢杆菌微丸e-4和f-4;对比例3制得包衣复合芽孢杆菌微丸g-4和h-4。
[0136]
2.检测方法:
[0137]
(1)(酸性条件下)耐高温性能检测
[0138]
配置mrs-caco3液体培养基(ph5.7):酪蛋白酶消化物10.0g/l、牛肉膏粉10g/l、酵母膏粉4.0g/l、柠檬酸三铵2.0g/l、乙酸钠5.0g/l、七水硫酸镁0.2g/l、四水硫酸锰0.05g/l、七水磷酸氢二钾2.0g/l、葡萄糖20.0g/l、吐温-80 1.08g/l、碳酸钙2.5g/l、琼脂20g/l,用2mol/l的hcl溶液将mrs-caco3液体培养基ph调至2.5作为酸性液体培养基,进行灭菌(121℃,15min),灭菌后冷却待用。
[0139]
分别取本发明实施例1、对比例1、2和3制得的包衣凝结芽孢杆菌微丸各10g,等量分成两份,一份装入小尼龙袋(400目)中,密封尼龙袋后,置于250ml具塞锥形瓶内,加入100ml酸性液体培养基,置于室温5min,取出尼龙袋,用100ml mrs-caco3液体培养基(ph5.7)将尼龙袋里的微丸洗入新的250ml具塞锥形瓶中,磁力搅拌至颗粒完全粉碎成粉末,置恒温(37℃)培养箱中厌氧培养3小时,用平板计数法(48小时)测定其活菌数t
anh
;另一份装入小尼龙袋(400目)中,密封尼龙袋后,置于250ml具塞锥形瓶内,加入100ml酸性液体培养基,放入85℃烘箱进行5min的热处理,取出尼龙袋,用100ml mrs-caco3液体培养基(ph5.7)将尼龙袋里的微丸洗入新的250ml具塞锥形瓶中,磁力搅拌至颗粒完全粉碎成粉末,置恒温(37℃)培养箱中厌氧培养3小时,用平板计数法(48小时)测定其活菌数t
ah
。
[0140]
包衣凝结芽孢杆菌(酸性条件下)耐热性能(%)=(t
ha
/t
hna
)
×
100%。t
ah
是(酸性条件下)热处理后微丸中的活菌数,t
anh
是(酸性条件下)未经热处理微丸中的活菌数。每组计数需要三组平行,试验结果如图16、17和18。
[0141]
(2)缓释性能检测
[0142]
检测方法与测定包衣复合乳酸菌微丸的缓释性能相同。每组计数需要三组平行,试验结果如图19、20和21。
[0143]
从图16~21中可以看出:本发明制得的包衣凝结芽孢杆菌的包膜厚度与其抗逆性能成正向线性关系,当包衣厚度达到4%以上,实施组a和b的耐热性能大大提高,70%以上的活菌得以存活(图16);包衣凝结芽孢杆菌微丸是缓释剂型,包衣厚度与释放性能成反向线性关系,当包衣厚度≤8%时,在中性(模拟肠道)条件下,3小时后,90%以上活菌基本得以释放,而当包衣厚度》8%时,释放性能降低,在同样条件下,3小时后,仍有15%左右的活菌不能释放(图19);在包衣膜厚度相同的情况下,丸芯中干菌粉/保护剂的质量比越小,即海藻糖+蔗糖+海藻酸钙含量越高,其微丸耐热性能有提高的趋势,但释放性能有所下降。如实施组,当中干菌粉/保护剂的质量比的范围在5~10倍时,其综合性能(耐热和缓释性能)最佳(图17和20)。
[0144]
如果微丸包衣厚度为4%,丸芯中干菌粉和保护剂的材质和质量比与实施组一致,但包衣膜主要材料组合改为(肠溶缓释型)丙烯酸树脂ⅱ、丙烯酸树脂ⅲ、聚乙二醇和柠檬酸三乙酯(质量比为20:1:1:3),其微丸的耐热性能不如实施组中同等包衣厚度的微丸(图18);同时,其微丸释放得更快,在中性(模拟肠道)条件下,2小时后,90%以上活菌基本得以释放,缓释效果没有实施组中同等包衣厚度的微丸好(图21)。
[0145]
试验例三、本发明制得的耐高温肠溶缓释的包衣复合芽孢杆菌微丸的性能检测1.试验对象:本发明实施例1制得的包衣复合芽孢杆菌微丸a-4、a-6、a-8、b-4、b-6、b-8;对比例1制得包衣复合芽孢杆菌微丸c-3、c-9、d-3、d-9;对比例2制得包衣复合芽孢杆菌微丸e-4和f-4;对比例3制得包衣复合芽孢杆菌微丸g-4和h-4。
[0146]
2.检测方法:
[0147]
(1)缓释性能检测
[0148]
方法与测定包衣复合乳酸菌微丸的缓释性能相同。每组计数需要三组平行,试验结果如图22、23和24。
[0149]
从图22~24中可以看出:本发明制得的包衣复合芽孢杆菌微丸是缓释剂型,包衣厚度与释放性能成反向线性关系,当包衣厚度≤8%时,在中性(模拟肠道)条件下,3小时后,90%以上活菌基本得以释放,而当包衣厚度》8%时,释放性能降低,在同样条件下,3小时后,仍有15%左右的活菌不能释放(图22)。在包衣膜厚度相同的情况下,丸芯中干菌粉/保护剂的质量比越小,即海藻糖+蔗糖+海藻酸钙含量越高,其微丸的释放性能就越低。如实施组,当中干菌粉/保护剂的质量比的范围在5~10倍时,其缓释性能最佳(图23)。
[0150]
如果微丸包衣厚度为4%,丸芯中干菌粉和保护剂的材质和质量比与实施组一致,但包衣膜主要材料组合改为(肠溶缓释型)丙烯酸树脂ⅱ、丙烯酸树脂ⅲ、聚乙二醇和柠檬酸三乙酯(质量比为20:1:1:3),其微丸释放得更快,在中性(模拟肠道)条件下,2小时后,90%以上活菌基本得以释放,缓释效果没有实施组中同等包衣厚度的微丸好(图24)。
[0151]
综上所述,包衣复合乳酸菌微丸、包衣凝结芽孢杆菌微丸和包衣复合芽孢杆菌微丸是缓释剂型,同时以上三种包衣微丸的抗逆性能与其包衣膜厚度成正向线性关系,即膜越厚,抗逆性能越好,而其释放性能与其包衣膜厚度成反向线性关系,即膜越厚,释放性能越差;当包衣厚度在4%~8%范围内,干菌粉/保护剂(海藻糖+蔗糖+海藻酸钙)质量比在5~10倍范围内时,综合性能最佳:耐热、耐酸、耐胆盐性能大大提高,并能保证70%以上的活菌得以存活,同时3小时后释放度能保证在95%以上。乳酸菌制丸包衣后耐高温、耐酸、耐胆碱和稳定性能得到了极大的提高,可以过胃,在肠道缓慢释放定植;凝结芽孢杆菌制丸包衣后在酸性(ph2.5)条件下耐热性能得到了很大提高,解决了饲料中加入大量酸化剂时凝结芽孢杆菌不耐热的问题;同时芽孢杆菌制丸包衣后可以在肠道中缓慢释放定植,改善了饲料中芽孢杆菌的利用率。
[0152]
上述实施例仅例示性说明本发明的原理及其功效,而非用于限制本发明。任何熟悉此技术的人士皆可在不违背本发明的精神及范畴下,对上述实施例进行修饰或改变。因此,举凡所属技术领域中具有通常知识者在未脱离本发明所揭示的精神与技术思想下所完成的一切等效修饰或改变,仍应由本发明的权利要求所涵盖。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1