一种抑制肿瘤的药物组合物的制作方法
本发明涉及一种药物制剂,特别涉及一种由人参皂苷Rh2和替莫唑胺为药物活性成分的复方药物制剂。
背景技术:
:
替莫唑胺(temodozomide,TMZ)为一种已经上市的抗肿瘤药物,化学名为3,4-二氢-3-甲基-4-氧代咪唑并[5,1-d]-1,2,3,5-四嗪-8-酰胺,结构式如下:
替莫唑胺主要用于治疗成人顽固性多形性成胶质细胞瘤及复发或进展性的多形性胶质母细胞瘤或间变性星形细胞瘤,它能够显著提高肿瘤患者的生存率,可透过血脑屏障,其抗肿瘤的主要机制为DNA甲基化及错配修复的失败产生的细胞毒作用,但抑瘤谱窄,存在耐药性,会产生不良反应。
人参皂苷Rh2(ginsenoside Rh2,G-Rh2)【别名】20(S)-人参皂苷Rh2,【化学名】原人参二醇-3-氧-B-D-吡喃葡萄糖苷,是从人参中提取的天然活性成分之一,属于脂溶性小分子物质,1983年,北川勋首次从朝鲜红参中分离出20(S)-人参皂苷-Rh2。现在已经证实人参皂苷Rh2具有诱导癌细胞凋亡,分化及调控细胞周期的抗癌活性,抑制癌细胞增殖和转移的作用。通过实践已经证实,Rh2可以通过诱导分化或凋亡,抑制多种肿瘤细胞的增殖和生长,并证明对正常细胞毒性作用甚低。具有非器官特异性的广谱抗肿瘤作用。
目前,TMZ与20(S)-G-Rh2联合用药方案的抗肿瘤作用的研究尚未见报道。本发明通过体内、体外对联合用药的抗肿瘤作用的实验,发现将20(S)-G-Rh2与TMZ联合,在体内、体外对肿瘤细胞的抗肿瘤作用优良,并在一定剂量范围内有协同增效作用,为此,本发明提供一种有效、新型的中西药联合治疗肿瘤方案,为临床合理用药提供理 论依据。
技术实现要素:
:
本发明提供一种抑制肿瘤的药物组合物,
所述组合物由两种药物活性成分人参皂苷Rh2和替莫唑胺组成。
所述人参皂苷Rh2和替莫唑胺对肿瘤细胞具有协同抑制的作用。
其中人参皂苷Rh2与替莫唑胺的重量比为1:0.25~8。
根据本发明的实施方式之一,所述人参皂苷Rh2与替莫唑胺的重量比优选为1:1~2。
本发明优选的人参皂苷Rh2与替莫唑胺的重量比对脑胶质瘤细胞有显著的协同抑制作用。
进一步地,在脑胶质瘤的协同抑制过程中,当人参皂苷Rh2浓度一定时,随着替莫唑胺浓度的增加,协同作用逐步减弱。
根据本发明的另一实施方式,所述人参皂苷Rh2与替莫唑胺的重量比优选为1:0.25~2,对宫颈癌具有协同抑制作用。
进一步地,当所述替莫唑胺浓度一定时,随着人参皂苷Rh2浓度的增加,抑瘤率逐步增强。
本发明的药物组合物,其制备方法为,将人参皂苷Rh2和替莫唑胺两种药物按比例混合均匀即可。两种药物均为现有技术,可以从市场上购买得到。也可以根据现有技术文献制备。
本发明的药物组合物,在使用时可以根据需要制备成药物制剂形式,如口服制剂形式,注射剂形式,阴道或肛门栓剂形式等,优选注射剂形式。
本发明的药物组合物在制备成药物制剂时,根据需要可以加入要学上可接受的载体。
本发明的药物制剂,根据需要可以含有药物可接受的载体,其中人参皂苷Rh2和替莫唑胺作为药物活性成分,其在制剂中所占重量百分比可以是0.1-99.9%,其余为药物可接受的载体。本发明的药物制剂,以单位剂量形式存在,所述单位剂量形式是指制剂的单位,如片剂的每片,胶囊的每粒胶囊,口服液的每瓶,颗粒剂每袋,注射剂的每支等。
本发明的药物制剂可以是任何可药用的剂型,这些剂型包括:片剂、糖衣片剂、薄膜衣片剂、肠溶衣片剂、胶囊剂、硬胶囊剂、软胶囊剂、口服液、口含剂、颗粒剂、冲剂、丸剂、散剂、膏剂、丹剂、混悬剂、粉剂、溶液剂、注射剂、栓剂、软膏剂、 硬膏剂、霜剂、喷雾剂、滴剂、滴丸剂、贴剂。
本发明的药物制剂,其口服给药的制剂可含有常用的赋形剂,诸如粘合剂、填充剂、稀释剂、压片剂、润滑剂、崩解剂、着色剂、调味剂和湿润剂,必要时可对片剂进行包衣。
适用的填充剂包括纤维素、甘露糖醇、乳糖和其它类似的填充剂。适宜的崩解剂包括淀粉、聚乙烯吡咯烷酮和淀粉衍生物,例如羟基乙酸淀粉钠。适宜的润滑剂包括,例如硬脂酸镁。适宜的药物可接受的湿润剂包括十二烷基硫酸钠。
可通过混合,填充,压片等常用的方法制备固体口服组合物。进行反复混合可使活性物质分布在整个使用大量填充剂的那些组合物中。
口服液体制剂的形式例如可以是水性或油性悬浮液、溶液、乳剂、糖浆剂或酏剂,或者可以是一种在使用前可用水或其它适宜的载体复配的干燥产品。这种液体制剂可含有常规的添加剂,诸如悬浮剂,例如山梨醇、糖浆、甲基纤维素、明胶、羟乙基纤维素、羧甲基纤维素、硬脂酸铝凝胶或氢化食用脂肪,乳化剂,例如卵磷脂、脱水山梨醇一油酸酯或阿拉伯胶;非水性载体(它们可以包括食用油),例如杏仁油、分馏椰子油、诸如甘油的酯的油性酯、丙二醇或乙醇;防腐剂,例如对羟基苯甲酯或对羟基苯甲酸丙酯或山梨酸,并且如果需要,可含有常规的香味剂或着色剂。
对于注射剂,制备的液体单位剂型含有本发明的活性物质和无菌载体。根据载体和浓度,可以将此化合物悬浮或者溶解。溶液的制备通常是通过将活性物质溶解在一种载体中,在将其装入一种适宜的小瓶或安瓿前过滤消毒,然后密封。辅料例如一种局部麻醉剂、防腐剂和缓冲剂也可以溶解在这种载体中。为了提高其稳定性,可在装入小瓶以后将这种组合物冰冻,并在真空下将水除去。
本发明的药物制剂,在制备成药剂时可选择性的加入适合的药物可接受的载体,所述药物可接受的载体选自:甘露醇、山梨醇、焦亚硫酸钠、亚硫酸氢钠、硫代硫酸钠、盐酸半胱氨酸、巯基乙酸、蛋氨酸、维生素C、EDTA二钠、EDTA钙钠,一价碱金属的碳酸盐、醋酸盐、磷酸盐或其水溶液、盐酸、醋酸、硫酸、磷酸、氨基酸、氯化钠、氯化钾、乳酸钠、木糖醇、麦芽糖、葡萄糖、果糖、右旋糖苷、甘氨酸、淀粉、蔗糖、乳糖、甘露糖醇、硅衍生物、纤维素及其衍生物、藻酸盐、明胶、聚乙烯吡咯烷酮、甘油、土温80、琼脂、碳酸钙、碳酸氢钙、表面活性剂、聚乙二醇、环糊精、β-环糊精、磷脂类材料、高岭土、滑石粉、硬脂酸钙、硬脂酸镁等。
本发明的药物制剂在使用时根据病人的情况确定用法用量,可每日服三次,每次 1-20剂,如:1-20袋或粒或片,每剂1mg-1000mg。
在本发明中,发明人通过研究发现:
(1)20(S)-G-Rh2与TMZ联合体外对两种肿瘤细胞增殖的抑制在本发明所提供的剂量范围内具有协同增效的作用。并且对于脑胶质瘤SHG-44、宫颈癌Hela细胞,联合用药的相互作用与药物的浓度有相关性。
(2)20(S)-G-Rh2与TMZ联合对肿瘤体内抑瘤作用研究显示:20(S)-G-Rh2可增强TMZ对宫颈癌Hela裸鼠移植瘤生长的抑制作用。对于Hela裸鼠移植瘤,TMZ组、20(S)-G-Rh2单药组抑瘤率随浓度的增加而增大;联合用药组中,当TMZ浓度一定时,联合用药的抑瘤率随20(S)-G-Rh2的浓度增加而升高。说明高剂量20(S)-G-Rh2可增强TMZ对Hela移植瘤生长的抑制作用。
证明在本发明所述剂量范围内,20(S)-人参皂苷-Rh2与替莫唑胺联合用药对脑胶质瘤和宫颈癌具有协同的抑制作用,其效果高于两药疗效的单纯相加。
本发明所述的制药用途是通过以下实验证明的:
【实验内容】
实验一20(S)-G-Rh2联合TMZ对肿瘤细胞增殖的影响(体外实验)
1.仪器和材料
1.1细胞株
人脑胶质瘤SHG-44、宫颈癌Hela均购于协和医科大学基础医学细胞中心
1.2主要仪器
1.3主要试剂
2.实验方法
2.1药物配制
20(S)-G-Rh2用无血清培养基溶解,配制成1mg·mL-1,-20℃保存,临用前用RPMI1640培养基(无血清)稀释到所需要的浓度。
TMZ临用前用RPMI1640培养基(无血清)配制,0.22μm过滤器除菌,现配现用。
2.2细胞培养
脑胶质瘤细胞SHG-44、宫颈癌细胞Hela经复苏接种于含10%胎牛血清、青霉素100mg·L-1和链霉素100mg·L-1及RPMI1640培养基,在37℃、5%CO2、饱和湿度100%的培养箱中培养。细胞呈单层生长,达80%左右融合时,用含0.25%胰酶和0.02%EDTA消化液消化后离心,重悬于完全培养基中继续培养。
2.320(S)-G-Rh2联合TMZ对肿瘤细胞增殖的影响(MTT法)
取对数生长期细胞,消化计数后以l×103个·孔-1(SHG-44细胞)、1.5×103个·孔 -1(BGC-823和Hela细胞)的密度接种细胞于96孔细胞培养板中。24h后加入不同浓度的药物处理TMZ(分别加入0、5、10、20μg·mL-1)和20(S)-G-Rh2(在TMZ的基础上加入0、2.5、5、10、20μg·mL-1),对照组和加药组至少3个平行孔。SHG-44细胞48h、BGC-823和Hela细胞72h后加入用无酚红的PRMI1640配制的5mg·mL-1MTT溶液,每孔加入20μL,37℃避光温育4h。吸出上清液,加入100μL DMSO,振荡5min,使结晶物充分溶解。用酶标仪在570nm处测定每个孔的吸光度(A),重复3次实验。以如下方法计算抑制率:
抑制率(%)=(1-(加药组细胞的A值-加药组本底A值)/(对照组细胞的A值-对照组本底A值))×100%
加药组本底A值为完全培养基加相对应的药物加MTT,无细胞;对照组本底A值完全培养基加MTT,无细胞。
2.4药物相互作用分析
采用金正均概率和法对20(S)-G-Rh2与TMZ联合用药对肿瘤细胞增殖抑制的协同作用进行评价。
Q值=ER+T/(ER+ET-ER*ET)
ER、ET、ER+T分别表示单独加入20(S)-G-Rh2、TMZ及联合应用对细胞增殖抑制百分率;Q值<0.55,为明显拮抗(--);Q值0.85-0.55为拮抗(-);Q值0.85-1.15为单纯相加(#);Q值>1.15为协同(+);Q值>2.0为显著性协同(++)。
3.结果与讨论
3.1联合用药对人源性脑胶质瘤SHG-44细胞增殖的抑制作用
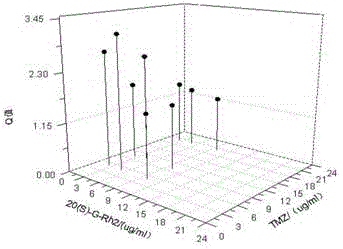
不同浓度的20(S)-G-Rh2、TMZ单独或联合作用于体外培养的SHG-44细胞的抑制作用见表1-1。由表1-1可知,20(S)-G-Rh2、TMZ对SHG-44细胞的增殖有一定的抑制作用。选取小于IC50的浓度作为联合用药浓度。由表1-2可知,20(S)-G-Rh2选取的浓度为2.5、5、10μg·mL-1;TMZ的浓度为5、10、20μg·mL-1。2.5-10μg·mL-1三个浓度20(S)-G-Rh2分别与不同浓度的TMZ联合作用时,20(S)-G-Rh2可增强TMZ对SHG-44细胞增殖的抑制作用,其联合指数Q值均高于1.15,表现出协同作用,尤以5μg·mL-120(S)-G-Rh2与5μg·mL-1TMZ联合最佳,联合指数Q值高达3.12,表现出显著性的协同作用。从图1和表1-1可以看出,20(S)-G-Rh2联合TMZ对人源性脑胶质瘤SHG-44细胞增殖的影响与浓度呈现出较好的相关性,20(S)-G-Rh2浓度一定时,TMZ随着浓度增加协同作用逐步减弱,可能是因为20(S)-G-Rh2的浓度过大。
表1‐1 20(S)‐G‐Rh2联合TMZ对脑胶质瘤SHG‐44细胞增殖的抑制作用
注:Q值<0.55,为明显拮抗(‐‐);Q值0.85‐0.55为拮抗(‐);Q值0.85‐1.15为单纯相加(#);Q值>1.15为协同(+);Q值>2.0为显著性协同(++)
3.2联合用药对人源性宫颈癌Hela细胞增殖的抑制作用
不同浓度的20(S)‐G‐Rh2、TMZ单独或者联合应用作用于Hela细胞增殖的抑制作用见表1‐2和图2。选取单独用药时,选取小于IC50的浓度作为联合用药浓度。由表1‐2可知,20(S)‐G‐Rh2的浓度为2.5、5、10μg·mL‐1;TMZ的浓度为5、10、20μg·mL‐1。联合用药组中,10μg·mL‐120(S)‐G‐Rh2分别与10、20μg·mL‐1的TMZ联合,其抑制率显著高于单独用药,抑制率为57.49%±3.43%、46.99%±15.49%,联合指数Q值分别为1.89和1.21,呈现协同作用。
从图表可以看出,20(S)‐G‐Rh2联合TMZ对人源性宫颈癌Hela细胞增殖的影响与浓度呈现出较好的相关性,当TMZ浓度一定时,20(S)‐G‐Rh2在2.5‐10μg·mL‐1浓度范围内,随着浓度增加抑制率逐渐增加,联合用药的相互作用也由拮抗作用逐步转变为协同作用。可能由于TMZ的浓度较低,导致联合用药产生拮抗作用,随着浓度的增加转为协同作用逐渐明显。
表1‐2 20(S)‐G‐Rh2联合TMZ对人源性宫颈癌细胞Hela的增殖的抑制作用
注:Q值<0.55,为明显拮抗(‐‐);Q值0.85‐0.55为拮抗(‐);Q值0.85‐1.15为单纯相加(#);Q值>1.15为协同(+);Q值>2.0为显著性协同(++)
实验二20(S)-G-Rh2联合TMZ对宫颈癌Hela裸鼠皮下移植瘤生长的影响(体内实验)
1仪器和材料
1.1动物及细胞株
人源性宫颈癌Hela细胞购于协和医科大学基础医学细胞中心;BALB/c(nu/nu),♀,6-8w,20±2g,110只,购于北京华阜康生物科技股份有限公司
1.2药物和试剂
1.3实验仪器
2实验方法
2.1宫颈癌Hela细胞株的培养
宫颈癌Hela细胞株经复苏接种于含10%胎牛血清、青霉素100mg·L-1和链霉素100mg·L-1及RPMI1640培养基,在37℃、5%CO2、饱和湿度100%的培养箱中培养,Hanks换液,按传代的方法每隔2-3天传代1次,传代时用含0.25%胰酶和0.02%EDTA消化 液消化后离心,重悬于无血清培养基中,用于构建移植瘤模型。
2.2动物模型建立及分组
选择6-8周、体重为18-22g的雌性BALB/c裸鼠,将悬浮细胞用一次性注射器将细胞悬液注射至裸鼠右侧腋窝。待瘤块长至1cm直径时,将肿瘤在裸鼠体内传代,即将肿瘤其在生盐水中剪成1×1×1mm3大小的瘤块。用套管针将瘤块移植到裸鼠右侧腋窝传代,用酒精棉消毒伤口。传3-4代后,取瘤块瘤块传到实验裸鼠靠近右腋窝的背上。正常饲养10天,测量肿瘤体积,按体积随机分7组,每组8只裸鼠。在分组后当日灌胃给药,对照组给予生理盐水;给药组见表2-1,周期为6周,0.4ml/只/天。
表2‐1 20(S)‐G‐Rh2联合TMZ对Hela移植瘤生长抑制作用的给药剂量表
实验期间,每隔7天用游标卡尺测量肿瘤瘤块的长径a与短径b,并记录动物体重;观察裸鼠活动等变化情况。根据公式v=ab2/2计算瘤块的体积,绘制肿瘤生长曲线,同时绘制动物体重变化曲线。处死裸鼠后,取肿瘤组织、脾脏称重,计算抑瘤率和脾脏指数。通过抑瘤率计算联合指数Q值。
脾脏指数=脾脏重量(mg)/体重(g)
抑瘤率(%)=(1‐(治疗组裸鼠瘤重/未治疗组裸鼠肿瘤瘤重))×100%
用给药组与模型组肿瘤相对体积计算相对肿瘤增殖率(T/C):
T/C%=TRTV/CRTV*100%;RTV=Vt/V0
(TRTV:治疗组RTV;CRTV:阴性对照组RTV;V0为分笼给药时测量所得肿瘤体积,Vt为末次给药时肿瘤体积)。
2.3统计学处理
用SPSS10.0软件完成统计学处理,实验数据以均数±标准差即(x±s)表示,组间分析比较采用t检验,P<0.05表示差异有统计学意义。
3结果与讨论
3.1成瘤及给药后情况
本实验共接种100只裸鼠(均为雌性),成瘤89只,成瘤率89%,平均生长潜伏期为11天;当肿瘤细胞移植第11天,动物体内瘤块直径平均达6‐7mm,体积达到100‐200mm3时,按瘤块体积大小分组,分组后各组肿瘤平均体积无明显差异(P>0.05),见表2‐2。收集皮下移植瘤标本时可观察到:瘤体外观呈黄白色,表面有血管生长分布,瘤组织质韧且硬。高剂量TMZ治疗组裸鼠在给药后期均出现摄食减少,皮肤干燥,活动减少。
表2‐2 Hela移植瘤分组数据
*P<0.05,有显著性差异
3.2联合用药对裸鼠移植瘤生长的影响
给药期间各观测点的裸鼠移植瘤体积值与给药组前的体积值进行比较,可得到实验各组的移植瘤相对肿瘤增殖率(T/C%)见表2‐3,各组肿瘤生长曲线见图3。
从移植瘤体积观察,模型组在饲养35‐42天内,移植瘤体积略缩小;20(S)‐G‐Rh2低剂量组、TMZ低剂量组和20(S)‐G‐Rh2低剂量+TMZ低剂量联合用药组的移植瘤体积均大于模型组,并且T/C%大于100%,而这三个剂量组的抑瘤率分别为11.31%,12.97%,6.21%,均对移植瘤有一定抑制作用。结合抑瘤率,说明20(S)‐G‐Rh2低剂量组、TMZ低剂量组并不刺激Hela移植瘤的生长,其T/C%大于100%原因可能是由于裸鼠之间存 在着个体差异,同时移植瘤体积的测量在体测量,存在一定的人为因素的误差。联合用药组中,当TMZ浓度一定时,随着20(S)‐G‐Rh2浓度的增加,对Hela移植瘤生长的抑制作用逐渐增强。
由表2‐3、2‐4,图3可知,在裸鼠Hela宫颈癌移植瘤动物模型中,各给药组均对Hela移植瘤的生长有抑制作用,单药组的抑瘤率随着各浓度的增加而增强。而联合用药组,当TMZ浓度一定时,抑瘤率随20(S)‐G‐Rh2的浓度的增加而增强。其中20(S)‐G‐Rh2高剂量组、TMZ低剂量组和20(S)‐G‐Rh2高剂量+TMZ低剂量组的抑瘤率为26.11%、12.97%、49.43%,Q值为1.38,联合用药的相互作用表现为协同。说明20(S)‐G‐Rh2可以增强TMZ低剂量组对移植瘤生长的抑制作用。
表2‐3 联合用药对荷瘤鼠移植瘤体积的影响(mm3)
注:*P<0.05,有显著性差异;‐‐‐,相对肿瘤增殖率(T/C%)>100%。
表2‐4 20(S)‐G‐Rh2联合TMZ对Hela移植瘤瘤重的影响
*:与空白对照组相比,P<0.05,有差异;**:与空白对照组相比,P<0.01,有显著性差异;
附图说明:
图1,20(S)‐G‐Rh2联合TMZ作用人源性脑胶质瘤SHG‐44细胞的相互作用
图2,20(S)‐G‐Rh2联合TMZ作用于人源性宫颈癌Hela细胞的相互作用
图3,各给药组Hela移植瘤生长曲线
具体实施方式:
以下通过实施例进一步说明本发明,但不作为对本发明的限制。
实施例1,不同比例的药物组合物
组合物及其制备:
人参皂苷Rh2和替莫唑胺的组合物,其重量比例为1:0.25,其制备方法是,将两种 药物充分混合均匀即可。
组合物及其制备:
人参皂苷Rh2和替莫唑胺的组合物,其重量比例为1:8,其制备方法是,将两种药物充分混合均匀即可。
组合物及其制备:
人参皂苷Rh2和替莫唑胺的组合物,其重量比例为1:1,其制备方法是,将两种药物充分混合均匀即可。
组合物及其制备:
人参皂苷Rh2和替莫唑胺的组合物,其重量比例为1:2,其制备方法是,将两种药物充分混合均匀即可。
实施例2
片剂
【处方】
实施例1的任何一种组合物100g
微晶纤维素50g
微粉硅胶3g
硬脂酸镁1.5g
【制法】取原、辅料分别过100目筛;取实施例1的任何一种组合物、微晶纤维素,混匀,用60%乙醇适量作为粘合剂制软材,过20目筛制颗粒,60℃干燥,取出,过30目筛整粒,加入微粉硅胶及硬脂酸镁,混匀,压片,制成1000片,即得。
实施例3
【处方】
实施例1的任何一种组合物75g
微晶纤维素37g
微粉硅胶2.3g
硬脂酸镁1.1g
【制法】取原、辅料分别过100目筛;取实施例1的任何一种组合物、微晶纤维素,混匀,用60%乙醇适量作为粘合剂制软材,过20目筛制颗粒,60℃干燥,取出,过30目筛整粒,加入适量微粉硅胶及硬脂酸镁,混匀,压片,
制成1000片,即得。
实施例4
【处方】
实施例1的任何一种组合物133g
微晶纤维素66g
微粉硅胶4g
硬脂酸镁2g
【制法】取原、辅料分别过100目筛;取实施例1的任何一种组合物、微晶纤维素,混匀,用60%乙醇适量作为粘合剂制软材,过20目筛制颗粒,60℃干燥,取出,过30目筛整粒,加入适量微粉硅胶及硬脂酸镁,混匀,压片,制成1000片,即得。
实施例5
胶囊,取实施例1的任何一种组合物100mg,加入适量淀粉,硬脂酸镁等辅料,制粒,整粒,装入1号胶囊,即得。
实施例6
口服液,取实施例1的任何一种组合物100mg,加入适量蔗糖,防腐剂,加水到1000ml,分装成10ml一支,即得口服液。
实施例7
颗粒剂,取实施例1的任何一种组合物100mg,加入适量糊精、甜菊素,干式制粒,整粒,分装,即得。
实施例8
注射剂,实施例1的任何一种组合物150g加水溶解,另氯化钠、对羟基苯甲酸乙酯加热水溶解,混匀,调pH值5-7。注射用水稀释至1000ml,用中空纤维膜滤过,灌装,灭菌,即得。
实施例9
称取实施例1的任何一种组合物20g作为原料药备用;称取栓剂基质200g,加热至80℃融化,搅拌均匀;边搅拌边将原料加入辅料基质中,搅拌30min使之均匀,保持药液温度不低于60℃;将配制好的药液注入栓剂模具中,药液略溢出模具,置于4℃冰箱中冷却3小时;削去溢出部分,脱模,密封装于铝塑复合膜包装袋中,即得栓剂。
实施例10
实施例1的任何一种组合物150g加水溶解,另加甘露醇500g加热水溶解,混匀,注射用水稀释至5000ml,用中空纤维膜滤过,灌装,灭菌,冻干即得冻干粉针。
实施例11
称取实施例1的任何一种组合物20g作为原料药备用;称取滴丸基质200g,加热至80℃融化,搅拌均匀;边搅拌边将原料加入辅料基质中,搅拌30min使之均匀,保持药液温度不低于60℃;将配制好的药液注入滴丸机中,滴成滴丸,即得。
- 还没有人留言评论。精彩留言会获得点赞!