抑制整合素α5的物质在制备预防内皮细胞激活和/或动脉粥样硬化的产品中的新用途的制作方法与工艺
本发明属于生物技术领域,具体涉及抑制整合素α5的物质在制备预防内皮细胞激活和/或动脉粥样硬化的产品中的新用途。
背景技术:
动脉粥样硬化是严重威胁人类身体健康的疾病,常常引起心梗、脑梗等严重并发症。目前的研究公认,血管内皮细胞激活,功能障碍是动脉粥样硬化发病的起始步骤。因此,探讨内皮激活的机制并进行干预,对预防动脉粥样硬化有着非常重要的意义。血管内皮是循环血液与血管壁之间的重要屏障,参与调节血管内外物质交换,合成释放血管活性物质,调节凝血和血管平滑肌的舒缩等。最重要的,血管内皮直接感受来自血流的机械作用力的影响,亦即血流剪切力,其在动脉粥样硬化发病中有着举足轻重的作用。临床资料表明,在同一患者中,血管系统经受着相同的血脂、血压、血糖等其他条件,但是动脉粥样硬化斑块好发于血管的拐弯以及分叉处。决定斑块的这种特征性分布的因素就是血流剪切力。剪切力对血管功能的影响较为复杂,目前已有研究认为主要决定因素包括剪切力的大小和剪切力的方向。在整个血管系统中,血管直部感受层流,其主要特征呈方向一致的高剪切力,对内皮细胞具有抗炎、抗凋亡、上调内皮细胞保护性基因表达的作用,从而发挥对内皮的保护作用,具有抗动脉粥样硬化的特点;而血管的拐弯和分叉处则感受紊乱的流体形式,在体外通常用湍流(紊流的一种形式)来模拟,其主要特征呈方向不定的低剪切力,能上调内皮细胞中炎症基因如细胞间粘附分子1(ICAM-1)、血管细胞粘附分子(VCAM-1)的表达、促进内皮细胞氧自由基的产生、加速内皮细胞更迭,从而激活内皮细胞,使内皮细胞具有易感性,能够促进动脉粥样硬化的发生。脂筏(Lipidraft),是内皮细胞膜上特殊的结构域,其具有富含鞘磷脂和胆固醇的特点,结构致密,是蛋白质停泊的平台,与膜的信号转导及蛋白质分选有密切关系。参与感受流体剪切力的刺激,帮助进行机械信号的转导。内皮细胞中整合素表达含量丰富,参与细胞内外信号的转导,介导细胞与细胞外基质间的相互调节。有报道认为激活的整合素在机械信号转导中发挥着重要作用。而正常血管中,整合素α5主要分布于血管内皮中,是内皮细胞较为重要的整合素受体。已有报道认为其分别在内皮细胞和巨噬细胞中介导NF-κB、炎症小体的激活,从而发挥促炎反应。
技术实现要素:
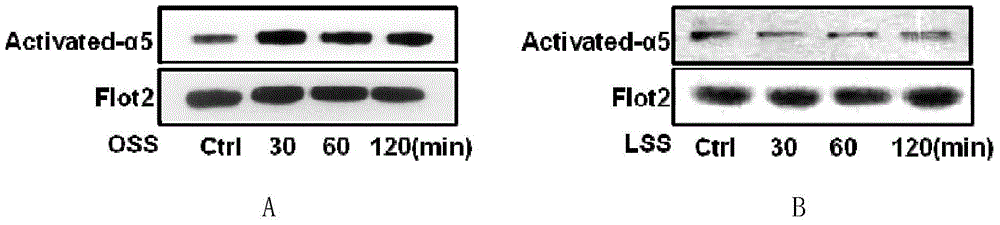
本发明的目的是提供抑制整合素α5的物质在制备预防内皮细胞激活和/或动脉粥样硬化的产品中的新用途。本发明还保护与整合素α5结合从而抑制所述整合素α5的活性的物质在制备产品中的应用;所述产品的用途为如下(a)、(b)、(c)、(d)、(e)和(f)中的至少一种:(a)预防和/或治疗动脉粥样硬化;(b)抑制湍流的如下作用:促使血管内皮细胞中激活状态的整合素α5的含量增加;(c)抑制湍流的如下作用:促进血管内皮细胞与THP-1细胞的粘附作用;(d)抑制湍流的如下作用:促进血管内皮细胞中的炎症小体激活;(e)抑制湍流的如下作用:促进血管内皮细胞中的Caspase-1p20和IL-1βp17增加;(f)抑制湍流的如下作用:促进血管内皮细胞中的VCAM-1和/或ICAM-1增加。所述整合素α5具体可为序列表的序列1所示的蛋白质或序列表的序列3所示的蛋白质。所述“与整合素α5结合从而抑制所述整合素α5的活性的物质”具体可为所述整合素α5的抗体,例如购自美国Abcam公司,货号为ab72663的整合素α5的特异性中合抗体(特异结合激活状态的整合素α5)。本发明保护一种产品,其活性成分为与整合素α5结合从而抑制所述整合素α5的活性的物质;所述产品的用途为如下(a)、(b)、(c)、(d)、(e)和(f)中的至少一种:(a)预防和/或治疗动脉粥样硬化;(b)抑制湍流的如下作用:促使血管内皮细胞中激活状态的整合素α5的含量增加;(c)抑制湍流的如下作用:促进血管内皮细胞与THP-1细胞的粘附作用;(d)抑制湍流的如下作用:促进血管内皮细胞中的炎症小体激活;(e)抑制湍流的如下作用:促进血管内皮细胞中的Caspase-1p20和IL-1βp17增加;(f)抑制湍流的如下作用:促进血管内皮细胞中的VCAM-1和/或ICAM-1增加。所述整合素α5具体可为序列表的序列1所示的蛋白质或序列表的序列3所示的蛋白质。所述“与整合素α5结合从而抑制所述整合素α5的活性的物质”具体可为所述整合素α5的抗体,例如购自美国Abcam公司,货号为ab72663的整合素α5的特异性中合抗体(特异结合激活状态的整合素α5)。所述产品可以进行局部或全身给药,给药方式可为口服或注射。同时可以全身服用降低胆固醇的制剂以干预脂筏结构,增加产品疗效。本发明还保护抑制整合素α5的编码基因表达的物质在制备产品中的应用;所述产品的用途为如下(a)、(b)、(c)、(d)、(e)和(f)中的至少一种:(a)预防和/或治疗动脉粥样硬化;(b)抑制湍流的如下作用:促使血管内皮细胞中激活状态的整合素α5的含量增加;(c)抑制湍流的如下作用:促进血管内皮细胞与THP-1细胞的粘附作用;(d)抑制湍流的如下作用:促进血管内皮细胞中的炎症小体激活;(e)抑制湍流的如下作用:促进血管内皮细胞中的Caspase-1p20和IL-1βp17增加;(f)抑制湍流的如下作用:促进血管内皮细胞中的VCAM-1和/或ICAM-1增加。所述整合素α5具体可为序列表的序列1所示的蛋白质或序列表的序列3所示的蛋白质。所述整合素α5的编码基因具体可为序列表的序列2所示的DNA分子或序列表的序列4自5’末端第223-3384位核苷酸所示的DNA分子。所述抑制整合素α5的编码基因表达的物质具体可为序列表的序列6所示的siRNA、编码序列表的序列6所示的siRNA的DNA分子或具有编码序列表的序列6所示的siRNA的DNA分子的重组载体。所述编码序列表的序列6所示的siRNA的DNA分子包括如下两个元件:序列表的序列5自5’末端第1-21位核苷酸和序列表的序列5自5’末端第28-48位核苷酸。所述编码序列表的序列6所示的siRNA的DNA分子具体可如序列表的序列5所示。所述“具有编码序列表的序列6所示的siRNA的DNA分子的重组载体”具体可为重组腺病毒质粒或重组腺病毒。所述重组腺病毒质粒具体可为如下重组质粒:(1)将序列表的序列5所示的DNA分子插入pYr-1.1载体的BsaI酶切位点,得到中间质粒;(2)使所述中间质粒甲与腺病毒骨架载体pAd/BL-DEST发生LR重组,得到具有序列5所示双链DNA分子和wtAd5(ΔE3)的基因组DNA的腺病毒质粒,即为重组腺病毒质粒。所述重组腺病毒具体可为将所述重组腺病毒质粒线性化后转染哺乳动物细胞,然后收集细胞并破碎,收集上清液即为含有所述重组腺病毒的病毒液。所述重组腺病毒的制备方法具体如下:取所述重组腺病毒质粒,用限制性内切酶PacI进行线性化,然后转染HEK293细胞,当细胞有CPE现象且有>50%脱壁时收集细胞,1500g离心5min并收集细胞,然后在干冰浴及37℃水浴之间快速反复冻融三次,1000g离心15min,收集上清液,即为含有所述重组腺病毒的病毒液。本发明还保护一种产品,其活性成分为抑制整合素α5的编码基因表达的物质;所述产品的用途为如下(a)、(b)、(c)、(d)、(e)和(f)中的至少一种:(a)预防和/或治疗动脉粥样硬化;(b)抑制湍流的如下作用:促使血管内皮细胞中激活状态的整合素α5的含量增加;(c)抑制湍流的如下作用:促进血管内皮细胞与THP-1细胞的粘附作用;(d)抑制湍流的如下作用:促进血管内皮细胞中的炎症小体激活;(e)抑制湍流的如下作用:促进血管内皮细胞中的Caspase-1p20和IL-1βp17增加;(f)抑制湍流的如下作用:促进血管内皮细胞中的VCAM-1和/或ICAM-1增加。所述产品可以进行局部或全身给药,给药方式可为口服或注射。同时可以全身服用降低胆固醇的制剂以干预脂筏结构,增加产品疗效。所述整合素α5具体可为序列表的序列1所示的蛋白质或序列表的序列3所示的蛋白质。所述整合素α5的编码基因具体可为序列表的序列2所示的DNA分子或序列表的序列4自5’末端第223-3384位核苷酸所示的DNA分子。所述抑制整合素α5的编码基因表达的物质具体可为序列表的序列6所示的siRNA、编码序列表的序列6所示的siRNA的DNA分子或具有编码序列表的序列6所示的siRNA的DNA分子的重组载体。所述编码序列表的序列6所示的siRNA的DNA分子包括如下两个元件:序列表的序列5自5’末端第1-21位核苷酸和序列表的序列5自5’末端第28-48位核苷酸。所述编码序列表的序列6所示的siRNA的DNA分子具体可如序列表的序列5所示。所述“具有编码序列表的序列6所示的siRNA的DNA分子的重组载体”具体可为重组腺病毒质粒或重组腺病毒。所述重组腺病毒质粒具体可为如下重组质粒:(1)将序列表的序列5所示的DNA分子插入pYr-1.1载体的BsaI酶切位点,得到中间质粒;(2)使所述中间质粒甲与腺病毒骨架载体pAd/BL-DEST发生LR重组,得到具有序列5所示双链DNA分子和wtAd5(ΔE3)的基因组DNA的腺病毒质粒,即为重组腺病毒质粒。所述重组腺病毒具体可为将所述重组腺病毒质粒线性化后转染哺乳动物细胞,然后收集细胞并破碎,收集上清液即为含有所述重组腺病毒的病毒液。所述重组腺病毒的制备方法具体如下:取所述重组腺病毒质粒,用限制性内切酶PacI进行线性化,然后转染HEK293细胞,当细胞有CPE现象且有>50%脱壁时收集细胞,1500g离心5min并收集细胞,然后在干冰浴及37℃水浴之间快速反复冻融三次,1000g离心15min,收集上清液,即为含有所述重组腺病毒的病毒液。本发明还保护序列表的序列6所示的siRNA。本发明对于动脉粥样硬化的治疗和预防具有重大价值。附图说明图1为血流剪切力对原代培养的内皮细胞中整合素α5(Integrinα5)脂筏转位的调节。图2为血流剪切力对原代培养的内皮细胞中整合素α5(Integrinα5)活性的调节。图3为实施例2的步骤一的2的结果。图4为实施例2的步骤一的3的结果。图5为实施例2的步骤二的结果。图6为实施例2的步骤三的结果。图7为实施例2的步骤三的结果。图8为实施例3的结果。具体实施方式以下的实施例便于更好地理解本发明,但并不限定本发明。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的试验材料,如无特殊说明,均为自常规生化试剂商店购买得到的。以下实施例中的定量试验,均设置三次重复实验,结果取平均值。实施例中的检测中,所采用的二抗均购自CellSignaling公司,兔源二抗的货号为7074s,鼠源二抗的货号为7076s。基于人的整合素α5基因见序列表的序列2,编码序列表的序列1所示的蛋白质。实施例1、相关机理的发现发明人通过对内皮细胞进行层流和湍流两种剪切力刺激后,利用定量蛋白质组学结合生物信息学分析比较内皮细胞表面脂筏相关蛋白质的变化,来探究介导两种剪切力不同作用的分子和机制。其中,在两种剪切力处理后,挑选出具有统计学差异的蛋白,其中最为显著的是整合素α5(Integrinα5),在利用分子生物学技术对蛋白质组学数据进行验证后,发明人对其功能和发挥作用的机制进行了进一步探讨。发明人的研究结果首次发现,在湍流的作用下,整合素α5向脂筏转位(即在血管内皮组织中的整合素α5向脂筏富集;脂筏中的整合素α5的存在形式为激活状态的整合素α5),脂筏帮助其功能上进行激活,从而激活炎症小体,释放炎症因子IL-1β,上调内皮细胞表面的粘附分子ICAM-1(细胞间粘附分子)、VCAM-1(血管细胞粘附分子),从而增加内皮细胞表面的炎症细胞的粘附,造成动脉粥样硬化的启动。而相反,在层流的作用下,整合素α5从脂筏中转位出来(即在血管内皮组织中的整合素α5向非脂筏富集;非脂筏中的整合素α5的存在形式为非激活状态的整合素α5),激活被下调,抑制其介导的炎症反应。因此,在全身或者湍流作用的血管局部对整合素α5或者决定其功能激活的脂筏进行干预,对于局部内皮细胞激活及斑块产生可能具有保护作用。图1为血流剪切力对原代培养的内皮细胞中整合素α5(Integrinα5)脂筏转位的调节;A为湍流(OSS)引起整合素α5(α5)由非脂筏(Non-raft)转位向脂筏(Raft),B为层流(LSS)引起整合素α5(α5)由脂筏(Raft)转位向非脂筏(Non-raft)。图2为血流剪切力对原代培养的内皮细胞中整合素α5(Integrinα5)活性的调节;A为湍流(OSS)引起整合素α5(α5)随时间逐渐激活,B为层流(LSS)引起整合素α5(α5)活性被抑制。实施例2、细胞实验整合素α5的特异性中合抗体(特异结合激活状态的整合素α5);购自美国Abcam公司,货号为ab72663。β-环状糊精(β-cyclodextrin简称β-CD):Sigma公司,货号H107。Caspase-1抑制剂:Biovision公司,货号A1902。THP-1细胞(人单核细胞型淋巴瘤):ATCC编号TIB-202。用荧光标记物(BCECF-AM,Invitrogen)对THP-1细胞进行标记后,得到标记后的THP-1细胞。用离体的人脐带制备人血管内皮细胞:制备方法见参考文献:ZhuY,LinJH,LiaoHL,FriedliO,Jr.,VernaL,MartenNW,StrausDS,StemermanMB.Ldlinducestranscriptionfactoractivatorprotein-1inhumanendothelialcells.Arteriosclerosis,thrombosis,andvascularbiology.1998;18:473-480。一、整合素α5的特异性中合抗体的作用效果(westernblot检测)1、分组处理在37℃、5%CO2培养箱中进行,平时采用含15%(体积比)FBS的M199培养基,处理前4小时(处理包括给药处理和剪切力处理,当某一组同时包括给药处理和剪切力处理时,以在前处理的时间点计)更换为含2%(体积比)FBS的M199培养基:第一组(ctrl):取100cm细胞培养皿,在每个皿内放置一个无菌玻璃片,在无菌玻璃片上接种人血管内皮细胞培养35小时;第二组(OSS):取100cm细胞培养皿,在每个皿内放置一个无菌玻璃片,在无菌玻璃片上接种人血管内皮细胞,培养25小时,然后取出无菌玻璃片,对无菌玻璃片上附着的细胞进行流体剪切力刺激(湍流,0.5±4dyn/cm2,10小时);第三组(OSS+Ab):取100cm细胞培养皿,在每个皿内放置一个无菌玻璃片,在无菌玻璃片上接种人血管内皮细胞,培养24小时(此时细胞长满玻璃片,约3×106个细胞),然后每皿加入整合素α5的特异性中合抗体并使其浓度为5μg/ml,培养1小时,然后取出无菌玻璃片,对无菌玻璃片上附着的的细胞进行流体剪切力刺激(湍流,0.5±4dyn/cm2,10小时);第四组(OSS+Ab):取100cm细胞培养皿,在每个皿内放置一个无菌玻璃片,在无菌玻璃片上接种人血管内皮细胞,培养24小时(此时细胞长满玻璃片,约3×106个细胞),然后每皿加入整合素α5的特异性中合抗体并使其浓度为10μg/ml,培养1小时,然后取出无菌玻璃片,对无菌玻璃片上附着的的细胞进行流体剪切力刺激(湍流,0.5±4dyn/cm2,10小时)。2、westernblot检测激活状态的整合素α5、Caspase-1p20和IL-1βp17Caspase-1p20为pro-Caspase-1的活性形式,IL-1βp17为pro-IL-1β的活性形式。Caspase-1p20和IL-1βp17含量增高代表炎症小体激活。完成步骤1的分组处理后,分别提取细胞膜总蛋白和全细胞总蛋白。westernblot检测细胞膜总蛋白中激活状态的整合素α5的含量(采用的一抗为兔源integrinα5antibody,购自CellSignaling公司,货号4705),采用Flot2作为内参蛋白(检测内参蛋白的一抗为兔源flotillin-2antibody,购自SantaCruz公司,货号sc-28320)。westernblot检测全细胞总蛋白中pro-Caspase-1和Caspase-1p20的含量(采用的一抗为兔源Caspase-1antibody,购自CellSignaling公司,货号3866)、pro-IL-1β和IL-1βp17的含量(鼠源IL-1βantibody,购自CellSignaling公司,货号12242),采用β-actin作为内参蛋白(检测内参蛋白的一抗为鼠源β-actinantibody,购自SantaCruz公司,货号sc-81178)。结果见图3。第一组和第二组的细胞膜总蛋白中,激活状态的整合素α5含量在OSS的处理下被上调。整合素α5的特异性中合抗体通过与整合素α5结合降低了激活状态的整合素α5含量,且特异性抗体加入量越多激活状态的整合素α5含量越低,呈现剂量效应。与第一组相比第二组的全细胞总蛋白中Caspase-1p20和IL-1βp17含量增加,即OSS促使炎症小体激活,加入整合素α5的特异性中合抗体后,Caspase-1p20和IL-1βp17含量相对第二组降低,且同样呈现剂量效应。结果表明:湍流(OSS)引起炎症小体激活,IL-1β释放增加,整合素α5的特异性中合抗体能够阻断OSS的效应。3、westernblot检测VCAM-1和ICAM-1完成步骤1的分组处理后,提取全细胞总蛋白。westernblot检测全细胞总蛋白中VCAM-1的含量(采用的一抗为兔源VCAM-1antibody,购自CellSignaling公司,货号12367)和ICAM-1的含量(采用的一抗为鼠源ICAM-1antibody,购自BD公司,货号611704),采用β-actin作为内参蛋白(检测内参蛋白的一抗为鼠源β-actinantibody,购自SantaCruz公司,货号sc-81178)。结果见图4。与第一组相比第二组的全细胞总蛋白中VCAM-1和ICAM-1含量增加,加入整合素α5的特异性中合抗体后,VCAM-1和ICAM-1含量相对第二组降低,且同样呈现剂量效应。结果表明:湍流(OSS)引起人血管内皮细胞表面粘附分子ICAM-1、VCAM-1表达增加,阻断整合素α5能够阻断湍流的效应。二、整合素α5的特异性中合抗体的作用效果(THP-1细胞与人血管内皮细胞粘附实验)在37℃、5%CO2培养箱中进行,平时采用含15%(体积比)FBS的M199培养基,处理前4小时(处理包括给药处理和剪切力处理,当某一组同时包括给药处理和剪切力处理时,以在前处理的时间点计)更换为含2%(体积比)FBS的M199培养基:第一组(ctrl):取6孔板,在每个孔内放置一个无菌盖玻片,在无菌盖玻片上接种人血管内皮细胞,培养35小时,然后每孔加入2×106个标记后的THP-1细胞,37℃孵育30分钟,然后用PBS缓冲液洗涤以除去未被粘附的THP-1细胞,用荧光显微镜观察;第二组(α5Ab):取6孔板,在每个孔内放置一个无菌盖玻片,在无菌盖玻片上接种人血管内皮细胞,培养24小时(此时细胞长满玻璃片,约1.2×106个细胞),然后每孔加入整合素α5的特异性中合抗体并使其浓度为10μg/ml,培养1小时,然后更换为新的培养基并培养10小时,然后每孔加入2×106个标记后的THP-1细胞,37℃孵育30分钟,然后用PBS缓冲液洗涤以除去未被粘附的THP-1细胞,用荧光显微镜观察;第三组(OSS):取6孔板,在每个孔内放置一个无菌盖玻片,在无菌盖玻片上接种人血管内皮细胞,培养25小时,取出无菌盖玻片,对无菌盖玻片上附着的的细胞进行流体剪切力刺激(湍流,0.5±4dyn/cm2,刺激10小时),然后将每个无菌盖玻片放入新的6孔板的每个孔中,然后每孔加入2×106个标记后的THP-1细胞,37℃孵育30分钟,然后用PBS缓冲液洗涤以除去未被粘附的THP-1细胞,用荧光显微镜观察;第四组(OSS+α5Ab):取6孔板,在每个孔内放置一个无菌盖玻片,在无菌盖玻片上接种人血管内皮细胞,培养24小时(此时细胞长满玻璃片,约1.2×106个细胞),然后每孔加入整合素α5的特异性中合抗体并使其浓度为10μg/ml,培养1小时,取出无菌盖玻片,对无菌盖玻片上附着的的细胞进行流体剪切力刺激(湍流,0.5±4dyn/cm2,刺激10小时),然后将每个无菌盖玻片放入新的6孔板的每个孔中,然后每孔加入2×106个标记后的THP-1细胞,37℃孵育30分钟,然后用PBS缓冲液洗涤以除去未被粘附的THP-1细胞,用荧光显微镜观察。结果见图5。湍流(OSS)引起THP-1细胞与内皮细胞之间的粘附增加,加入整合素α5的特异性中合抗体可以抵抗OSS引起的粘附增加,即阻断整合素α5能够阻断湍流的效应。三、环糊精的作用效果(westernblot检测)在37℃、5%CO2培养箱中进行,平时采用含15%(体积比)FBS的M199培养基,处理前4小时(处理包括给药处理和剪切力处理,当某一组同时包括给药处理和剪切力处理时,以在前处理的时间点计)更换为含2%(体积比)FBS的M199培养基:第一组(ctrl):取100mm培养皿,每个皿内置一个无菌玻璃片,在无菌玻璃片上接种人血管内皮细胞,培养36小时,取样(提取全细胞总蛋白,westernblot检测全细胞总蛋白中VCAM-1的含量和ICAM-1的含量);第二组(β-CD):取100mm培养皿,每个皿内置一个无菌玻璃片,在无菌玻璃片上接种人血管内皮细胞,培养24小时(此时细胞长满玻璃片,约3×106个细胞),然后每皿加入β-CD并使其浓度为5mmol/L,培养2小时,然后更换新的培养基并培养10小时,取样(提取全细胞总蛋白,westernblot检测全细胞总蛋白中VCAM-1的含量和ICAM-1的含量);第三组(OSS):取100mm培养皿,每个皿内放置一个无菌玻璃片,在无菌玻璃片上接种人血管内皮细胞,培养26小时,取出无菌玻璃片,对无菌玻璃片上附着的细胞进行流体剪切力刺激(湍流,0.5±4dyn/cm2,刺激10小时),取样(提取全细胞总蛋白,westernblot检测全细胞总蛋白中VCAM-1的含量和ICAM-1的含量);第四组(OSS+β-CD):取6孔板,在每个孔内放置一个无菌玻璃片,在无菌玻璃片上接种人血管内皮细胞,培养24小时(此时细胞长满玻璃片,约3×106个细胞),然后每皿加入β-CD并使其浓度为5mmol/L,培养2小时,然后更换新的培养基并培养2小时,取出无菌玻璃片,对无菌玻璃片以及其上附着的的细胞进行流体剪切力刺激(湍流,0.5±4dyn/cm2,刺激10小时),取样(提取全细胞总蛋白,westernblot检测全细胞总蛋白中VCAM-1的含量和ICAM-1的含量)。westernblot检测方法见步骤一的3。结果见图6。四、环糊精的作用效果(THP-1细胞与人血管内皮细胞粘附实验)在37℃、5%CO2培养箱中进行,平时采用含15%(体积比)FBS的M199培养基,处理前4小时(处理包括给药处理和剪切力处理,当某一组同时包括给药处理和剪切力处理时,以在前处理的时间点计)更换为含2%(体积比)FBS的M199培养基:第一组(ctrl):取6孔板,在每个孔内放置一个无菌盖玻片,在无菌盖玻片上接种人血管内皮细胞,培养36小时,然后每孔加入2×106个标记后的THP-1细胞,37℃孵育30分钟,然后用PBS缓冲液洗涤以除去未被粘附的THP-1细胞,用荧光显微镜观察;;第二组(β-CD):取6孔板,在每个孔内放置一个无菌盖玻片,在无菌盖玻片上接种人血管内皮细胞,培养24小时(此时细胞长满玻璃片,约1.2×106个细胞),然后每孔加入β-CD并使其浓度为5mmol/L,培养2小时,然后更换为新的培养基并培养10小时,然后每孔加入2×106个标记后的THP-1细胞,37℃孵育30分钟,然后用PBS缓冲液洗涤以除去未被粘附的THP-1细胞,用荧光显微镜观察;第三组(OSS):取6孔板,在每个孔内放置一个无菌盖玻片,在无菌盖玻片上接种人血管内皮细胞,培养26小时,取出无菌盖玻片,对无菌盖玻片上附着的的细胞进行流体剪切力刺激(湍流,0.5±4dyn/cm2,刺激10小时),然后将每个无菌盖玻片放入新的6孔板的每个孔中,然后每孔加入2×106个标记后的THP-1细胞,37℃孵育30分钟,然后用PBS缓冲液洗涤以除去未被粘附的THP-1细胞,用荧光显微镜观察;第四组(OSS+β-CD):取6孔板,在每个孔内放置一个无菌盖玻片,在无菌盖玻片上接种人血管内皮细胞,培养24小时(此时细胞长满玻璃片,约1.2×106个细胞),然后每孔加入β-CD并使其浓度为5mmol/L,培养2小时,取出无菌盖玻片,对无菌盖玻片上附着的的细胞进行流体剪切力刺激(湍流,0.5±4dyn/cm2,刺激10小时),然后将每个无菌盖玻片放入新的6孔板的每个孔中,然后每孔加入2×106个标记后的THP-1细胞,37℃孵育30分钟,然后用PBS缓冲液洗涤以除去未被粘附的THP-1细胞,用荧光显微镜观察。结果见图7。图6和图7的结果表明,湍流(OSS)引起内皮细胞表面粘附分子ICAM-1、VCAM-1表达增加,单核细胞与内皮细胞之间的粘附增加,通过β-环状糊精破坏脂筏能够阻断湍流的效应。实施例3、在体实验腺病毒骨架载体pAd/BL-DEST:购自长沙赢润生物技术有限公司。GFP腺病毒质粒rAd-NC-shRNA:购自长沙赢润生物技术有限公司,货号rAdNC03。LDLR-/-小鼠(种系名称:B6.129S7-Ldlrtm1Her/J):购自美国TheJacksonLaboratory公司,产品储存号002207。HEK293细胞:ATCC编号CRL-1573。pYr-1.1载体(全称为pYr-1.1-hU6-EGFP):长沙赢润生物技术有限公司,货号VRY0359。一、制备重组腺病毒1、基于小鼠的整合素α5基因(又称ITGA5基因,见序列表的序列4,序列4自5’末端第223-3384位核苷酸为开放阅读框;编码序列表的序列3所示的蛋白质),设计1个RNAi靶点(靶点为序列4自5’末端第948-968位核苷酸)。2、基于步骤1选择的靶点,设计并合成一个双链DNA分子,如序列表的序列5所示。序列5:5’-GCAGATCTCGGAGTCCTATTACTCGAGTAATAGGACTCCGAGATCTGCTTTTTT-3’。序列表的序列5所示的DNA编码序列表的序列6所示的siRNA。序列6:5’-GCAGAUCUCGGAGUCCUAUUA-3’。3、将步骤二合成的DNA分子插入pYr-1.1载体的BsaI酶切位点,得到中间质粒。4、使步骤3得到的中间质粒甲与腺病毒骨架载体pAd/BL-DEST发生LR重组,得到具有序列5所示双链DNA分子和wtAd5(ΔE3)的基因组DNA的腺病毒质粒。5、制备病毒液将步骤4得到的腺病毒质粒用限制性内切酶PacI进行线性化,然后将6微克线性化的质粒转染1.5×106个HEK293细胞,在37℃、5%CO2条件下培养,当细胞有明显的CPE现象且有>50%脱壁时收集细胞,1500g离心5min并收集细胞,然后在干冰浴及37℃水浴之间快速反复冻融三次,1000g离心15min,收集上清液,即为病毒液甲。用GFP腺病毒质粒rAd-NC-shRNA代替腺病毒质粒甲进行上述操作,得到病毒液乙。6、小鼠实验取LDLR-/-小鼠,对左颈总动脉分支中颈内动脉、枕动脉进行结扎,在距离颈内动脉分叉处1.5cm左右用动脉夹夹闭左颈总动脉近心端,同时夹闭甲状腺上动脉,在颈外动脉剪开小切口,放出颈总动脉夹闭段的残留血液,用32G胰岛素注射器吸取冰浴的病毒液经切口插入并注射5×108pfu重组腺病毒,孵育40分钟,孵育完成后吸出腺病毒,并快速短暂松开近心端止血夹冲洗残留腺病毒,之后结扎颈外动脉切口近心端,松开全部动脉夹,缝合切口。完成手术后,小鼠进行连续一周的高脂喂养(高脂饲料购自美国ResearchDier公司,货号为D12109),取小鼠的左颈总动脉部分,用不同一抗孵育过夜,然后用二抗孵育,核染色,在荧光共聚焦显微镜下观察得到的结果。采用的一抗为兔源VCAM-1antibody或鼠源ICAM-1antibody,采用的二抗为购自美国earthox公司的cy3affinipuregoatanti-rabbitigG(货号E031620-01)或cy3affinipuregoatanti-mouseigG(货号E031610-01)。结果见图8。结果表明,抑整合素α5基因表达后,湍流引起的局部内皮细胞激活明显被抑制。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1