超声流体向量成像装置及其方法与流程
技术领域
本发明一般地涉及一种超声成像系统,更特别地涉及一种用于成像脉管流体的超声系统。这个成像系统可以被用于非侵入性地可视化人体血管中的血流。
背景技术:
人体动脉中的血流动态的非侵入性可视化被广泛地认为具有很高的诊断意义,因为它可以有助于血管异常情况的临床检测(斯坦曼DA,泰勒CA,流体成像和计算:大动脉血流动态,生物医学工程年报,2005;33:1704-1709(Steinman DA,Taylor CA.Flow imaging and computing:large artery hemodynamics.Ann.Biomed.Eng.,2005;33:1704-1709))。例如,监测颈动脉中的流动模式在中风预后方面长期以来一直是有用的(唐纳GA,费舍尔M,麦克劳德M,戴维斯SM,中风,柳叶刀,2008;371:1612-1623;希尔兹RC,颈动脉狭窄的医疗管理,血管外科学和血管内治疗展望,2010;22:18-27(Donnan GA,Fisher M,Macleod M,Davis SM.Stroke.Lancet,2008;371:1612-1623;Shields RC.Medical management of carotid stenosis.Perspect.Vasc.Surg.Endovasc.Ther.,2010;22:18-27))。这些年来,人们已经提出了一些非侵入性流体成像模式(欧文AR,罗迪提GH,外周动脉疾病:非侵入性成像的角色演变,研究生医学杂志,2011:87:189-198;沃尔巴斯特AB,亨迪WR,医学成像中的演变和实验技术,放射学,2006;238:16-39(Owen AR,Roditi GH.Peripheral arterial disease:the evolving role of non-invasive imaging.Postgrad.Med.J.,2011;87:189-198;Wolbarst AB,Hendee WR.Evolving and experimental technologies in medical imaging.Radiology,2006;238:16-39)),并且这些非侵入性流体成像模式中,超声也许已经将它本身确立为可以容易地应用到点护理诊断中的一种独特的床头成像模式(比尔瑞格SM,琼斯A,超声与包括CT、MR、PET和血管造影术的替代成像模式的准确性和成本比较,医学超声诊断杂志,2009;25:138-144;摩尔CL,库佩尔JA,点护理超声检查,新英格兰医学杂志,2011;364:749-757(Bierig SM,Jones A.Accuracy and cost comparison of ultrasound versus alternative imaging modalities,including CT,MR,PET,and angiography,J.Diagnost.Med.Sonography,2009;25:138-144;Moore CL,Copel JA.Point-of-care ultrasonography.New Eng.J.Med.,2011;364:749-757))。在大多数已有的超声扫描设备中,流体信息可以以彩色血流图像的形式实时渲染,其提供了轴向流体速度(或者流体能量)在成像视野上的2D映射图(埃文斯DH,彩色血流和运动成像,机械工程师学会会报,H部,2010;224:241-253;霍斯金斯PR,迈克迪肯WN,血流和组织运动的彩色超声成像,英国放射学杂志,1997;70:878-890(Evans DH.Color flow and motion imaging.Proc.Inst.Mech.Eng.H,2010;224:241-253;Hoskins PR,McDicken WN.Colour ultrasound imaging of blood flow and tissue motion.Br.J.Radiol.,1997;70:878-890))。当与绘制单个采样门处的瞬时流体曲线的多普勒频谱模式一起使用时,这个流体成像模式可以提供大量的在空间和时间维度上的关于流体行为的信息(盖提妮D,索达克M,用多普勒超声检查诊断颈动脉狭窄:现状,超声医学杂志,2005;24:1127-1136;霍斯金斯PR,使用超声成像测量的血液动态和血流,机械工程师学会会报,H部,2010;224:255-271(Gaitini D,Soudack M.Diagnosing carotid stenosis by Doppler sonography:state of the art.J.Ultrasound Med.,2005;24:1127-1136;Hoskins PR,Haemodynamics and blood flow measured using ultrasound imaging.Proc.Inst.Mech.Eng.H,2010;224:255-271))。
尽管在临床筛查中应用广泛,超声彩色血流成像众所周知具有一些方法缺陷(埃文斯(Evans)2010)。特别地,由于它的工作原理典型地基于轴向多普勒估计,因此当波束-血流角度(即,超声波传播轴线与血流轨迹之间的角度)随血管变化时,它容易出现错误(埃文斯DH,詹森JA,尼尔森MB,超声彩色多普勒成像,界面聚焦,2011;1:490-502(Evans DH,Jensen Ja,Nielsen MB.Ultrasound color Doppler imaging.Interface Focus,2011;1:490-502))。这个问题代表了在血管不是直管形式的诊断场景中的重要缺陷,比如颈动脉中的分枝形状(库DN,动脉中的血流,流体力学年评,1997;29:399-434(Ku DN.Blood flow in arteries.Annu.Rev.Fluid Mech.,1997;29:399-434))。在这些情况下,正确地解释彩色血流图像对超声医师而言是具有挑战性的(阿宁C,埃克特B,颈动脉检查中的彩色多普勒伪影的诊断相关性,欧洲放射学杂志,2004;51:246-251;鲁本斯DJ,巴特S,纳迪卡S,库里南J,多普勒伪影和缺陷,北美放射临床,2006;44:805-835(Arning C,Eckert B.The diagnostic relevance of colour Doppler artefacts in carotid artery examinations.Eur.J.Radiol.,2004;51:246-251;Rubens DJ,Bhatt S,Nedelka S,Cullinan J.Doppler artifacts and pitfalls.Radiol.Clin.N.Am.,2006;44:805-835),特别是当它被具有在流动速度上的显著的随时间的变化的脉动性血流状况恶化时。
为了超声能够成功提供弯曲血管中的血流动态的清楚的映射,必须解决波束-血流角度依赖性的问题并获得反映实际血流特性的速度估计(邓迈尔B,比奇KW,拉伯斯KH,普利特M,斯川达尼斯Jr DE,用于角度无关速度测量的交叉波束向量多普勒超声,超声医学和生物学,2000,26:1213-1235;托尔托拉P,巴姆比G,里奇S,用于向量血流测量的精确多普勒角度估计,关于超声、铁电体和频率控制的IEEE学报,2006;53:1425-1431;托尔托拉P,达莱A,博尼E,弗让卡兰茨L,里奇S,“用于可行的向量多普勒血液速度测量的自动角度跟踪过程”,超声医学和生物学(2010),36:488-496(Dunmire B,Beach KW,Labs KH,Plett M,Strandness Jr DE.Cross-beam vector Doppler ultrasound for angle-independent velocity measurements,Ultrasound Med.Biol.,2000,26:1213-1235;Tortoli P,Bambi G,Ricci S.Accurate Doppler angle estimation for vector flow measurements.IEEE Trans.Ultrason.Ferroelec.Freq.Contr.,Tortoli P,Dallai A,Boni E,Francalanci L,Ricci S,“An automatic angle tracking procedure for feasible vector Doppler blood velocity measurements”,Ultrasound Med.Biol.(2010),26:488-496))。为了完成这个任务,血流估计不仅需要沿着轴向方向执行(在彩色血流成像中就是这种情况),也需要沿着成像视野的侧向方向执行,使得血流角度和速度大小都可以被无不确定性地确定(埃文斯等(Evans et al.),2011)。通过这种基本原理的激励,用于流体向量估计的新的成像范式已经被提出。这些范式尝尝被分类为向量流体成像方法,它们通常基于四种类型的估计原则:(i)多角度多普勒分析(卡皮勒瑞L,斯卡比亚M,玛索缇L,用于动态向量速度映射的多普勒系统,超声医学和生物学,2002;28:237-248;卡瑞普范格斯OD,鲁宾JM,霍尔AL,佛尔克斯JB,旋转盘超声多普勒体模的向量多普勒成像,超声医学和生物学,2006;32:1037-1046;帕斯托雷利A,托里切利G,斯卡比亚M,比亚吉E,玛索缇L,用于临床实验的实时2D向量多普勒系统,医学影像IEEE学报,2008;27:1515-1524(Capineri L,Scabia M,Masotti L.A Doppler system for dynamic vector velocity maps.Ultrasound Med.Biol.,2002;28:237-248;Kripfgans OD,Rubin JM,Hall AL,Fowlkes JB.Vector Doppler imaging of a spinning disc ultrasound Doppler phantom.Ultrasound Med.Biol.,2006;32:1037-1046;Pastorelli A,Torricelli G,Scabia M,Biagi E,Masotti L.A real-time 2-D vector Doppler system for clinical experimentation.IEEE Trans.Med.Imag.,2008;27:1515-1524));(ii)来自于具有横向振荡的声场的双轴相移估计(佩德森MM,皮赫尔MJ,豪格奥德P,汉森JM,汉森KL,尼尔森MB,詹森JA,体内频谱和向量速度估计的实时性的比较,超声医学和生物学,2012;39:145-151;阿德森J,詹森JA,横向振荡方法研究,关于超声、铁电体和频率控制的IEEE学报,2006;53:959-971;阿德森J,尼尔森MB,尼尔森KR,詹森JA,体内血液向量速度估计的实例,超声医学和生物学,2007;33:541-548(Pedersen MM,Pihl MJ,Haugaard P,Hansen JM,Hansen KL,Nielsen MB,Jensen JA.Comparison of real-time in vivo spectral and vector velocity estimation.Ultrasound Med.Biol.,2012;39:145-151;Udesen J,Jensen JA,Investigation of transverse oscillation method.IEEE Trans.Ultrason.Ferroelec.Freq.Contr.,2006;53:959-971;Udesen J,Nielsen MB,Nielsen KR,Jensen JA.Examples of in vivo blood vector velocity estimation.Ultrasound Med.Biol.,2007;33:541-548));(iii)帧间血液斑点追踪(博斯LN,吉曼BJ,安德森ME,格布哈特SC,特里希GE,用于多维度流体估计的斑点追踪,超声学,2008;38:369-375;艾比利ES,相耦合二维斑点追踪算法,关于超声、铁电体和频率控制的IEEE学报,2006;53:972-990;许T,巴什福德GR,使用依赖于扫描方向和A线采集速度的斑点图案的二维血流速度估计,关于超声、铁电体和频率控制的IEEE学报,2013;60:898-908(Bohs LN,Geiman BJ,Anderson ME,Gebhart SC,Trahey GE,Speckle tracking for multi-dimensional flow estimation.Ultrasonics,2008;38:369-375;Ebbini ES,Phase-coupled two-dimensional speckle tracking algorithm.IEEE Trans.Ultrason.Ferroelec.Freq.Contr.,2006;53:972-990;Xu T,Bashford GR.Two-dimensional blood flow velocity estimation using ultrasound speckle pattern dependence on scan direction and A-line acquisition velocity.IEEE Trans.Ultrason.Ferroelec.Freq.Contr.,2013;60:898-908));和(iv)定向互相关分析(詹森JA,使用沿着流体方向的聚焦的定向速度估计I:理论和仿真,关于超声、铁电体和频率控制的IEEE学报,2003;50:857-872;詹森JA,班吉恩格拉德R,使用沿着流体方向的聚焦的定向速度估计II:实验研究,关于超声、铁电体和频率控制的IEEE学报,2003;50:873-880;寇特贝克J,詹森JA,使用定向互相关方法的速度向量角度的估计,关于超声、铁电体和频率控制的IEEE学报,2006;53:2036-2049(Jensen JA.Directional velocity estimation using focusing along the flow direction I:theory and simulation,IEEE Trans.Ultrason.Ferroelec.Freq.Contr.,2003;50:857-872;Jensen JA,Bjerngaard R.Directional velocity estimation using focusing along the flow direction II:experimental investigation.IEEE Trans.Ultrason.Ferroelec.Freq.Contr.,2003;50:873-880;Kortbek J,Jensen JA.Estimation of velocity vector angles using the directional cross-correlation method.IEEE Trans.Ultrason.Ferroelec.Freq.Contr.,2006;53:2036-2049))。虽然这些方法每个都有自己的优点,但是众所周知它们所有都会在某些情况下产生错误的流体向量估计。特别是,当追踪快速流体时,多普勒/相移估计易于混迭伪像,而斑点追踪和定向互相关在跟踪平面外运动方面具有难度(汉森LK,阿德森J,欧德尔希德N,亨策L,汤姆森C,詹森JA,尼尔森MB,三个超声向量速度技术与MR相衬血管造影术的体内比较,超声学,2009;49:659-667;斯维伦斯A,赛赫尔斯P,托普H,拉乌斯托肯L,使用超声的二维血液速度估计:颈动脉分枝模式下基于血流仿真的斑点追踪与交叉波束向量多普勒比较,关于超声、铁电体和频率控制的IEEE学报,2010a;57:327-339(Hansen LK,Udesen J,Oddershede N,Henze L,Thomsen C,Jensen JA,Nielsen MB.In vivo comparison of three ultrasound vector velocity techniques to MR phase contrast angiography.Ultrasonics,2009;49:659-667;Swillens A,Segers P,Torp H,Lovstakken L.Two-dimensional blood velocity estimation with ultrasound:speckle tracking versus crossed-beam vector Doppler based on flow simulations in a carotid bifurcation model.IEEE Trans.Ultrason.Ferroelec.Freq.Contr.,2010a;57:327-339))。当血流速度随脉动流动周期的不同相位而显著变化时以及当成像帧率不足够时,这些缺点会特别暴露出来(斯维伦斯A,赛赫尔斯P,拉乌斯托肯L,使用组合的斑点追踪和相移估计器的颈动脉分枝中的二维血流成像:基于超声仿真和体内分析的研究,超声医学和生物学,2010b;36:1722-1735(Swillens A,Segers P,Lovstakken L.Two-dimensional flow imaging in the carotid bifurcation using a combined speckle tracking and phase-shift estimator:a study based on ultrasound simulations and in vivo analysis.Ultrasound Med.Biol.,2010b;36:1722-1735))。
技术实现要素:
本发明涉及非侵入性的、精确且实现时间分辨的、用于具有空间时间波动的脉管流体的成像和复杂分析的装置和方法。特别地,本发明涉及一种可以被称为“向量投射体成像(Vector Projectile Imaging(VPI))”的新的基于超声成像的架构,其以毫秒级别的时间分辨率动态地渲染成像视野上的复杂流动模式。VPI基于三个原则建立:(i)高帧率宽视野数据采集(基于偏转平面波发射);(ii)源自多角度多普勒分析的流体向量估计(与数据正则化和最小二乘法拟合相关联);和(iii)彩色编码的向量投射体的动态可视化(具有被显示为附加物的流动斑点)。
VPI可以使像颈动脉分枝处一样的弯曲脉管中的在空间时间上变化的流体轨迹能够进行定量的和一致的跟踪。本发明比现有的方法更先进。特别地,本发明具有双重模式流体信息,包括速度编码的流体投射体(而不仅仅是质点)和流体斑点。本发明使用了新的数据处理方法和新的渲染方法以支持一致的流体估计。在设计VPI时,一致的流体向量估计性能被通过下列技术的综合使用而实现:(i)可以容易地提供远远高出视频显示范围的高数据采集帧率的宽视野超声扫描方案;和(ii)与事后正则化策略和最小二乘估计原理相关联的多角度多普勒分析。而且,如果高成像帧率和一致的流体向量估计是可获得的,则可以预估流体向量的动态可视化可以通过以双重形式渲染它们而变成可能,其中该双重形式描述:(i)质点投射体,其定量地突出局部流体速度、方向和轨迹;和(ii)流体斑点,其充当用以增强可视化效果的定性附加物。
本发明容易地与早先的显示通过球面波发射(尼克洛夫SI,詹森JA,医学超声中的体内合成孔径血流成像,关于超声、铁电体和频率控制的IEEE学报,2003;50:848-856;欧德尔希德N,詹森JA,合成孔径向量血流成像中影响聚焦的效果,关于超声、铁电体和频率控制的IEEE学报,2007;54:1811-1825(Nikolov SI,Jensen JA.In-vivo synthetic aperture flow imaging in medical ultrasound.IEEE Trans.Ultrason.Ferroelec.Freq.Contr.,2003;50:848-856;Oddershede N,Jensen JA.Effects influencing focusing in synthetic aperture vector flow imaging.IEEE Trans.Ultrason.Ferroelec.Freq.Contr.,2007;54:1811-1825))或者平面波激励(厄柯偌尔IK,斯维伦斯A,赛赫尔斯P,达尔T,托普H,拉乌斯托肯L,基于多角度平面波成像的血流和组织的同时量化,关于超声、铁电体和频率控制的IEEE学报,2013;60:727-738;弗林J,戴格尔R,普弗洛格若斯L;林克哈特K,卡克科斯基P,用于使用平面波发射的向量多普勒成像的估计和显示,IEEE超声会议论文集,2011;413-418;弗林J,戴格尔R,普弗洛格若斯L;卡克科斯基P,使用单平面波发射角度的高帧率向量速度血流成像,IEEE超声会议论文集,2012;323-325;卢JY,王Z,权SJ,使用高帧率成像方法的血流速度向量成像,IEEE超声会议论文集,2006;963-967;阿德森J,格兰F,汉森KL,詹森JA,汤姆森C,尼尔森MB,使用平面波的高帧率血液向量速度成像:仿真和初步实验,关于超声、铁电体和频率控制的IEEE学报,2008;55:1729-1743(Ekroll IK,Swillens A,Segers P,Dahl T,Torp H,Lovstakken L,Simultaneous quantification of flow and tissue velocities based on multi-angle plane wave imaging.IEEE Trans.Ultrason.Ferroelec.Freq.Contr.,2013;60:727-738;Flynn J,Daigle R,Pflugrath L,Linkhart K,Kaczkowski P.Estimation and display for vector Doppler imaging using plane wave transmissions.Proc.IEEE Ultrason.Symp.,2011;413-418;Flynn J,Daigle R,Pflugrath L,Kaczkowski P.High frame rate vector velocity blood flow imaging using a single plane wave transmission angle.Proc.IEEE Ultrason.Symp.,2012;323-325;Lu JY,Wang Z,Kwon SJ.Blood flow velocity vector imaging with high frame rate imaging methods.Proc.IEEE Ultrason.Symp.,2006;963-967;Udesen J,Gran F,Hensen KL,Jensen JA,Thomsen C,Nielsen MB.High frame-rate blood vector velocity imaging using plane waves:simulations and preliminary experiments.IEEE Trans.Ultrason.Ferroelec.Freq.Contr.,2008;55:1729-1743))实现高帧率向量流体成像的可能性的效果区分。如将被通过拟人流体体模有效性研究所证明的一样,VPI代表了将高帧率数据采集、正则化流体向量估计和在动态可视化上的创新独特地关联的新成像方法。
VPI具有下列的使其与常规的彩色血流成像(CFI)区别开的关键特征:1)可以容易地提供远远超出视频显示范围的成像帧率(例如,大于1,000fps);2)提供了考虑多方向流体分量的流体速度向量的估计;3)用以突出它们的空间时间动态的基于投射体的流体向量渲染。这些特征通过宽视野数据采集原则、流体向量分析算法和在计算机视觉上的创新的独特结合而成为可能。
本发明的技术的步骤包括数据采集、正则化的流体向量估计和动态可视化。每个步骤可以被简要地概述如下。
1.数据采集。VPI基于在超声发射(Tx)的期间M个偏转平面波的使用。对于每个Tx角度,用于2D图像栅格的平行的波束合成被在N个动态接收(Rx)偏转角度上进行。该M个Tx的脉冲调制方案重复,形成环,与多普勒中的慢时间采样类似。VPI的有效帧率则简单地等于FR=fPW/M,其中fPW是每个平面波发射事件的速率(即,等于脉冲重复频率,或者PRF)。通过简单地调节PRF,FR可以根据需要被增加到大于1,000fps以追踪快速变化的流体。注意,对于2D图像栅格内的每个像素Po,在慢时间中存在MN个波束合成了的总体(即,MN个1-D慢时间信号阵列;每个对应一个Tx-Rx角度的组合)。
2.正则化了的流体向量估计。这个过程被为个体像素独立地执行。在每个实现中,该过程可以被分成两个阶段:(i)对于那个像素的MN个慢时间总体中每一个的速度估计;(ii)通过得自于所有Tx-Rx角度对的MN个速度估计的最小二乘拟合进行的向量计算。在阶段1中,对于该MN个慢时间总体(矩阵表示为xmn)中的每一个,多级子采样被首先执行以获得更精细的慢时间分辨率。对于为xmn构建的这组子采样了的总体,执行三个步骤:(i)杂波滤波(以抑制组织回波);(ii)速度估计(基于一阶滞后自相关:标准CFI估计器);(iii)混迭校正。其后,子采样了的总体被平均以获得那个Tx-Rx角度对的平均流体估计。在对所有角度对做了相同的处理之后,将获得MN个原始速度值(矩阵表示为u)。在阶段2,流体向量v=(vx,vz)被如下文所述的一样由u获得。首先,基于交叉波束多普勒原理,MN×2角度矩阵A由所有MN个Tx-Rx角度组合形成。众所周知的是,u=Av。因此,v通过执行最小二乘拟合操作Au计算出。
3.动态可视化。对于每个像素的v估计,形成单色、彩色编码的箭头。对于高的速度幅度,它的对应的箭头将在颜色上更亮并且在长度上更长。不同VPI帧的箭头被汇编,并且它们被显示为运动的投射体以使能定量的可视化。
附图说明
本发明的前述的和其他的目标和优点参考下文中的详细说明和附图将变成更显然的,其中:
图1a和1b图示了在实现本发明的过程中的数据采集,其基于平面波发射和平行的波束合成(二者都从多个角度进行)的使用;
图2a和2b图示了用于对于每个像素位置的根据本发明的流体向量估计的设置和它的相应的来自于所有Tx-Rx角度对的慢时间信号组;
图3a和3b是使用颜色编码的质点投射体的动态渲染的根据本发明的定量血流可视化;
图4a、4b和4c图示了用于拟人颈动脉分枝体模研究的设置和分别为健康人和患病病人的颈动脉分枝的共面几何形状的图像;
图5a和5b图示了对于在三个不同深度处的血管估计出的流体向量的彩色静态图和速度相对相距血管的近端壁的位置的曲线;
图6a-6d是根据本发明的静止帧渲染,其显示了在(a)主波(peak systole)处、(b)降中峡(post-systolic down stoke)的结束处、(c)重博波(dicrotic wave)峰值处和(d)重博波(dicrotic wave)的结束处,健康颈动脉分枝体模中的流体扰动的形成和消散,而图6e在多普勒频谱中显示了在脉动周期中的相对位置;
图7a-7d图示了在(a)主波(peak systole)处、(b)主波后射流波前(post-systolic jet front)到达ICA远端部时、(c)重博波(dicrotic wave)峰值处和(d)重博后射流波前(post-dicrotic jet front)到达ICA远端部时,在具有50%ICA偏心性狭窄的颈动脉分枝体模中的两个狭窄后部流体再循环区域中的空间时间上的差异,而图7e在多普勒频谱中显示了在脉动周期中的相对位置;
图8a和8b图示了在(a)主波(systole)之后和(b)重博波(dicrotic wave)之后在健康分枝体模的颈动脉球中观察到的流体再循环区域的空间峰值尺寸上的差异,而图8c显示了当这两个图像在脉动周期中发生时在两个多普勒频谱中的相应的时刻;
图9a和9b显示了在主波(peak systole)和重博波(dicrotic wave)峰值的期间50%狭窄的分枝体模中的流体再循环区域,其中相对时间被标记在图9c中的两个多普勒频谱中;而图9d和9e显示了在(d)主波(systole)和(e)重博波(dicrotic wave)的期间邻近ICA内壁的再循环区域,图9f显示了被标记在位于ICA内壁的近端部和远端部处的两个采样体积的多普勒频谱中的相对时间;
图10是根据本发明的VPI中涉及的平台的系统级示意图;
图11a和11b是对于(a)健康的和(b)在ICA的入口处具有50%偏心性狭窄的两个颈动脉分枝模型,在主波(peak systole)处获得的VPI的实例图像;
图12(b1)至12(b4)是根据本发明的静止帧渲染图,其仅仅以灰阶斑点的形式显示了在(a)主波(peak systole)、(b)降中峡(post-systolic down stoke)的结束处、(c)重博波(dicrotic wave)峰值处和(d)重博波(dicrotic wave)的结束处健康颈动脉分枝体模中的流体扰动的形成和消散;和
图13(c1)至13(c4)是根据本发明的静止帧渲染图,其仅仅显示了在(a)主波(peak systole)、(b)降中峡(post-systolic down stoke)的结束处、(c)重博波(dicrotic wave)峰值处和(d)重博波(dicrotic wave)的结束处在健康颈动脉分枝体模中的流体扰动的形成和消散中的投射体。
具体实施方式
执行本发明的向量投射体成像(VPI)的装置的设置被图示在图10中。这个设置执行步骤(1)数据采集、(2)正则化了的流体向量估计(包括第一阶段的多级子采样和第二阶段的流体向量获得)和(3)动态可视化。
为了实现数据采集,超声换能器阵列10被定位在邻近脉管的病人身体的外侧,其中将被成像的液体(例如,血液)在该脉管中。阵列10以高速率发射一系列未聚焦的、偏转的超声平面波11进入组织。相对于换能器表面13的发射角度在每个波之后变化。换能器10也以不同的接收偏转角接收从组织反射的波并且将它存储在波束合成前数据采集装置12中。这个数据是以对于每个角度的帧的形式的。
每个接收的数据帧被应用到单独的波束合成器30(被以虚线包围)中,该波束合成器30包括波束合成电路141至14N。每个波束合成电路的输出被在用于级1至K的子采样电路161至16K中子采样。每个子采样电路的输出又被在正则化流体估计电路18中处理。然后,一帧的流体估计电路的输出被在电路20中平均。
最小二乘向量估计电路22执行两个主要处理阶段,即(i)每一帧上的频谱偏移估计的正则化和(ii)基于最小二乘拟合的轴线-侧向向量分量估计。这个电路使用具有事后数据正则化的定制估计算法。在显示渲染电路24中,双重可视化方法被使用,在其中主通道显示颜色编码的质点投射体(小箭头),该质点投射体的颜色代码和长度都与在所成像的脉管中的特定位置处的速度大小相关。投射体的方向显示了流体方向。这些投射体的位置被在帧之间动态地更新以与在大小和方向上的变化一起定量地突出显示流体路径。次可视化通道显示基于慢时间滤波能量获得的灰阶流体斑点。这个补充的流体信息充当流体轨迹的附加描述。电路24的输出是VPI图像26。
数据采集
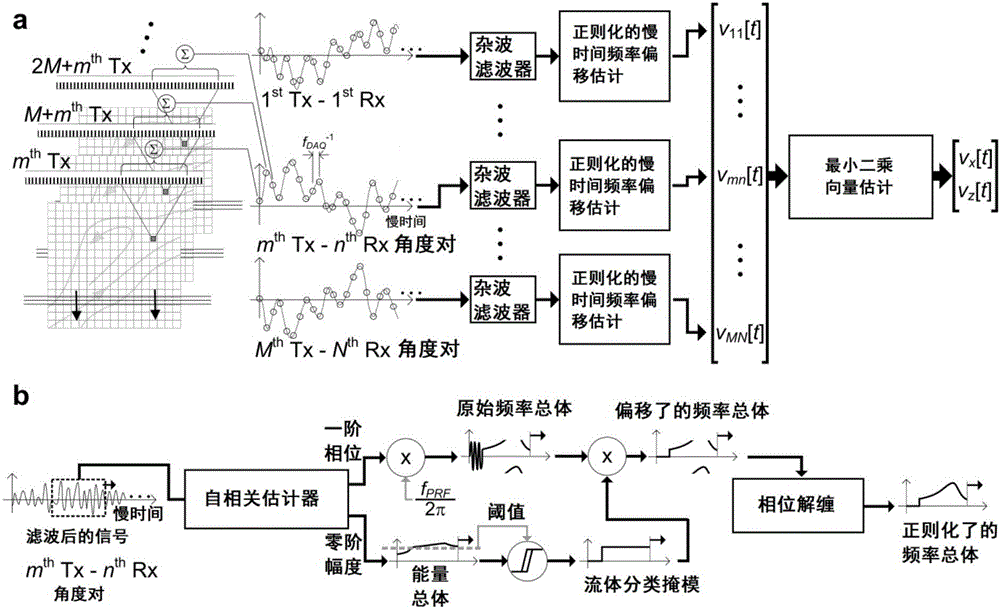
VPI中的数据采集基于平面波发射和平行的波束合成(二者都从多个角度执行)的使用。如图1a所示,在发射(Tx)上,M个平面波脉冲事件11被顺序发射,并且它们每个具有不同的偏转角度。这组发射被重复执行以便于慢时间数据采集。如图1b所示,在接收(Rx)上,N个数据帧的平行波束合成(每个具有不同的偏转角度)被为每个平面波脉冲事件执行。同一个脉冲序列包括MN个Tx-Rx角度对。
使用VPI架构,高帧率的流体向量信息的采集通过执行偏转平面波发射而变得容易,其中该偏转平面波发射的工作原理近年来已经成熟地用于超声成像应用场合。见蒙塔尔多G,坦特M,贝尔克夫J,本尼茨N,芬克M,“用于非常高帧率的超声成像和瞬时弹性成像的相干平面波复合”,关于超声、铁电体和频率控制的IEEE学报,(2009),56:489-506(Montaldo G,Tanter M,Bercoff J,Benech N,Fink M.,“Coherent plane-wave compounding for very high frame rate ultrasonography and transient elastography”,IEEE Trans.Ultrason.Ferroelec.Freq.Contr.,(2009),56:489-506),其在此被整体引入。如图1a所示,发射序列包括被按顺序发射的一组M个宽视野未聚焦脉冲事件。在相邻发射之间,发射(Tx)的偏转角度(即,相对于换能器表面法线13的传播角度)被递增变化以便覆盖在整组脉冲事件上的M个角度的跨距。这个数据采集方案可以被认为是已经被应用到向量流体估计上的两角度平面波发射策略(厄柯偌尔等人,2013,上文中引用)的一般形式。使用超过两个Tx角度的优点是流体向量可以通过基于最小二乘拟合原理求解线性方程组的超定系统而鲁棒地估计出。对于一个具有M个Tx角度和脉冲重复频率fPRF的序列,标称数据采集帧率(fDAQ)(即,一组发射可以被以其执行的速率)实际上等于fPRF/M。由于在超声成像中fPRF典型地在kHz的范围内,因此只要Tx角度的数量保持较小,fDAQ就可以远超出视频显示范围。
对于在给定Tx角度下的每个平面波发射,一组N个波束合成后的数据帧被基于在波束合成前数据采集装置12处从换能器10获得的通道域脉冲回波(从组织中反射的波)的相应的阵列而并行地产生。如图1b中所示,每个帧由不同的接收(Rx)偏转角度形成。帧中的个体像素位置的波束合成后的数据值被通过利用可以使用并行计算解决方案以实时吞吐地执行的成熟的动态接收聚焦原理计算。见于BYS,曾IKH,余ACH,“基于GPU的波束合成器:合成孔径成像和平面波复合的快速实现”,关于超声、铁电体和频率控制的IEEE学报,(2011),58:1698-1705(Yiu BYS,Tsang IKH,Yu ACH,“GPU-based beam former:fast realization of synthetic aperture imaging and plane wave compounding”,IEEE Trans.Ultrason.Ferroelec.Freq.Contr.,(2011),58:1698-1705),其在此被整体引入。通常,具有M个独特的Tx角度时,波束合成的数据帧由Tx-Rx角度对的MN个组合导出(见图1b)。使用多个Rx角度的主要理由是这种策略将有效地提高向量流体估计可用的独立频移估计的总数量(MN个,而不是M个)。最小二乘向量估计过程的鲁棒性则可以被进一步增强,并且更一致的流体向量估计可以被获得(将被在下文中讨论)。
为了监测在血流动态上的随时间的变化,平面波发射和接收波束合成被为所有MN个Tx-Rx角度对执行多次(如图1a中所示)。这个过程实质上与在埃文斯DH,迈克迪肯WN,多普勒超声:物理学、仪器和信号处理,第二版,纽约:威利,(2000)(Evans DH,McDicken WN.Doppler Ultrasound:Physics,Instrumentation and Signal Processing.2nd Ed.New York:Wiley,(2000))(该文献在此被整体引入)中披露的单采样门脉冲多普勒超声成像中执行慢时间采样相同。这样,在每个像素位置处,具有MN个(每个Tx-Rx角度对一个)流体向量估计可用的波束合成了的样本的慢时间总体。对于所有总体,慢时间采样率简单地等于fDAQ(即,一组Tx脉冲事件的重复频率),fDAQ又等于fPRF/M,如在贝尔克夫J,蒙塔尔多G,卢帕斯T,萨弗里D,麦泽尔F,芬克M,坦特M,“超快速复合多普勒成像:提供完整的血流特性”,关于超声、铁电体和频率控制的IEEE学报,(2011),58:134-147(Bercoff J,Montaldo G,Loupas T,Savery D,Meziere F,Fink M,Tanter M.,“Ultrafast compound Doppler imaging:providing full blood flow characterization”,IEEE Trans.Ultrason.Ferroelec.Freq.Contr.,(2011),58:134-147)(其在此被整体引入)中描述的一样。而慢时间混迭极限(根据奈奎斯特定理,其等于2fDAQ)又由2fPRF/M给出。在需要更高的慢时间混迭极限以便于追踪更快的血流速度的情况下,Tx角度的数量应该保持较小;同样,应该使用更高的fPRF,只要它满足最大成像深度限制,其中该最大成像深度限制最终由脉冲回波检测关系zmax 5co/2fPRF(埃文斯和迈克迪肯(Evans and McDicken),2000,上文中引用)决定。
流体向量估计
在每个慢时间时刻,本发明的VPI方法在所有像素位置处基于它们相应组的MN个慢时间总体独立地执行流体向量估计。
VPI中的流体向量估计通过对于每个像素位置处理它的来自于所有Tx-Rx角度对的相应组慢时间信号而进行。图2(a)图示了为了计算流体向量(vx[t],vz[t])而在每个Tx-Rx角度对上单独执行的杂波滤波和频率偏移估计。最小二乘拟合然后被用该组频率偏移估计{vmn[t]}作为数据输入而执行。图2(b)图示对于第m个Tx角度和第n个Rx角度,正则化的频率偏移估计涉及:在慢时间滑动窗口上的自相关计算(一阶滞后相位和零阶滞后幅度被分别用于频率和能量计算)、基于确定能量阈值的流体区域掩蔽和相位解缠。
如图2a所示,用滤波器30进行的杂波滤波被首先单独地应用到每个慢时间总体上以抑制不需要的组织回波或者所发射的信号的反射。随后,两个主要的处理阶段被执行:(i)在MN个滤波后的总体中的每一个上的正则化慢时间频率偏移估计被在估计电路32中执行;和(ii)基于与不同的Tx-Rx角度对相对应的MN个频率偏移估计的最小二乘拟合的轴向-侧向向量分量估计被在最小二乘向量估计器22(图10中所示)中执行。每个处理阶段的具体操作被在下文中描述。
为了根据需要获得一致的慢时间频率偏移估计以用于准确的向量计算,一种具有事后数据正则化的定制估计算法被设计出以单独地处理每个滤波后的慢时间总体。如图2b中所示,该算法通过借助于使用滑动窗口策略来计算不同慢时间时刻处的平均信号频率而开始。对于这个步骤,慢时间数据窗口(以给定的感兴趣时间为中心)被首先在过滤后的总体上定义,然后该窗口段上的平均频率被使用成熟的一阶滞后自相关相位算法在估计器36中计算。见上文中引用的埃文斯(Evans)2010,其在这里被整体引入。为了便于流体区域检测和流体斑点的附加渲染,慢时间窗口上的平均滤波后能量也被通过获得零阶滞后自相关幅度而并行地计算。这个估计过程通过简单地将该窗口重新定位在新的感兴趣时间处而在其他的慢时间时刻处重复。而慢时间频率和能量估计的总体又被为MN个Tx-Rx角度对中的每一个获得。
在估计步骤之后,两阶段事后处理策略被执行以正则化慢时间频率估计总体的各项。首先,为了去除在流体没有被Tx-Rx角度对检测到的时刻处的虚假估计,如果在那个时刻处它们各自的慢时间能量估计低于预定阈值的话,慢时间频率总体中的相应项被设定为零(即,流体分类掩模38被与彩色血流成像中的色彩增益掩模类似地应用)。其次,类似于彩色血流信号处理中的先前努力,相位解缠被应用到筛选过的慢时间频率估计上以考虑当执行一阶滞后自相关算法时很可能会发生的可能的混迭伪像。见赖X,托普H,克瑞斯托冯森K,“用于血液速度估计的扩展自相关方法”,关于超声、铁电体和频率控制的IEEE学报,(1997),44:1332-1342(Lai X,Torp H,Kristoffersen K,“An extended autocorrelation method for estimation of blood velocity”,IEEE Trans.Ultrason.Ferroelec.Freq.Contr.,(1997),44:1332-1342),其在这里被整体引入。这个步骤使慢时间频率估计的动态范围有效地扩展超过奈奎斯特采样极限。注意,两个正则化步骤都在慢时间频率估计的所有MN个总体上单独地执行。
最小二乘向量计算算法
一旦MN个慢时间频率偏移被从所有Tx-Rx角度对估计出,流体向量的轴向和侧向分量就被使用多角度多普勒分析原理获得。见上文中引用的邓迈尔(Dunmire)等人的文献,其被整体引入。这个计算任务相当于求解方程组的超定系统,由此MN个数据值(即,在一个慢时间时刻处来自于所有Tx-Rx角度对的频率偏移估计)被用作输入以求解两个未知量(即,轴向速度和侧向速度)。具体地,流体向量v=(vz,vx)可以通过最小二乘拟合方法估计。采用这种代数架构的优点是每个结果的流体向量估计将被在对于给定的输入它的均方误差最小的意义上优化。而在具有带噪声的数据输入的情况下,与常规的两角度向量多普勒方法所对应的两个方程、两个未知量的公式相比,一致的估计性能仍然可以保持(上文中引用的厄柯偌尔(Ekroll)等人2013年的文献和卡瑞普范格斯(Kripfgans)等人2006年的文献)。
在最小二乘向量计算方法中,v可以通过用每个MN×1测量值向量u(由个体频率偏移值构成)进行矩阵运算而计算。
最小二乘流体向量估计器可以被认为是在其中多个Tx-Rx角度对被代替先前已经描述过的两角度方法使用的交叉波束多普勒估计方法的一般形式。见卡瑞普范格斯(Kripfgans)等人2006年的文献,托尔托拉(Tortoli)等人2006年、2010年的文献以及厄柯偌尔(Ekroll)等人2013年的文献,这些文献都在上文中引用并且在这里被整体引入。在具有MN个Tx-Rx角度对的组合的情况下,第m个Tx的角度可以被表示为θm并且第n个Rx的角度可以被表示为注意,由于使用了平面波发射和动态接收聚焦,θm和对于成像视野内的所有像素将保持相同。从多普勒方程中熟知的是,具有这种角度对结构,以速度大小v和角度α运动的物体的慢时间频率偏移φmn等于:
其中co是声速,fo是超声中心频率。见邓迈尔(Dunmire)等人2000年的文献,该文献在上文中引用并且在这里整体引入。在类似的推导之后,(A1)中表示的数学形式可以通过注意两点而更改:(i)存在三角关系[cos(A-B)=cos(A)cos(B)+sin(A)sin(B)];和(ii)轴向和侧向速度分量分别等于vz=vcos(α)以及vx=vsin(α)。见曾IKH,余BYS,于ACH,“用于合成孔径成像的最小二乘向量流体估计器”,IEEE超声会议论文集,(2009),1387-1390(Tsang IKH,Yiu BYS,Yu ACH,“A least-squares vector flow estimator for synthetic aperture imaging”,Proc.IEEE Ultrason.Symp.,(2009),1387-1390),其在这里被整体引入。将这些关系代入(A1),可以获得下列的多普勒方程的修改形式:
流体向量估计器寻求通过由(A2)的MN个关系形成方程组的超定系统而求解(A2)中的两个未知量vx和vz,如通过使用不同的Tx-Rx角度对使其可行一样。以矩阵表示,这个方程组系统对于给定的流体向量v=(vx,vz)可以以下列形式表示:
其中A为角度对矩阵(大小为MN×2),u作为测量值向量(大小为MN×1)。注意,对于给定的Tx-Rx角度对,umn实质上等于公式(A2)的右手侧(即,)。
根据线性代数的原理,众所周知的是方程(3)中的v可以通过将A的伪逆矩阵与v相乘而获得:一种常常被称为最小二乘拟合方案的解决方案。见穆恩TK,斯特林WC,“用于信号处理的数学方法和算法”,上马鞍河:普伦蒂斯大厅,(2000)(Moon TK,Stirling WC,“Mathematical Methods and Algorithms for Signal Processing”,Upper Saddle River:Prentice-Hall,(2000)),其在这里被整体引入。因此,对于每个MN×1的测量值向量u(由个体的频率偏移值构成),v可以通过进行下列矩阵运算而计算:
其中上标T表示矩阵转置操作,实体(AT A)–1AT在线性代数中众所周知,是矩阵A的伪逆矩阵。见穆恩TK,斯特林WC,“用于信号处理的数学方法和算法”,上马鞍河:普伦蒂斯大厅,(2000)(Moon TK,Stirling WC,“Mathematical Methods and Algorithms for Signal Processing”,Upper Saddle River:Prentice-Hall,(2000)),其在这里被整体引入。注意,伪逆矩阵(AT A)–1AT实质上是2×MN的恒定值的矩阵(只要Tx-Rx角度对保持相同)。因此,相同的伪逆矩阵可应用于不同的像素位置。也值得指出的是,对于方程(4)中给出的最小二乘估计器,结果的流体向量估计可以被认为是在对于给定的输入它的均方误差最小的意义上的最优解。值得强调的是,方程(4)在每个像素位置以及在每个慢时间时刻个别地进行。
动态可视化过程
使用根据本发明的计算协议,流体向量信息帧可以以帧率fVPI产生,当执行滑动窗口实现过程时,对于K个慢时间采样的步长,该帧率fVPI等于fDAQ/K[即,fPRF/(MK)]。为了便于这些流体向量估计的动态渲染,使用了一种新的双重可视化方法。它的主可视化通道显示颜色编码了的质点投射体(小箭头),该质点投射体的颜色编码和投射体长度都与速度大小(在从零到可调的最大值的标度上)相关。投射体的方向显示流体的方向。这些投射体的位置在帧之间动态地更新以与在大小和方向上的变化一起定量地突出流体路径。次可视化通道显示基于慢时间滤波能量获得的灰阶流体斑点。这个补充的流体信息以与B模式流体成像技术所提供的类似的方式充当流体轨迹的附加描述。见乔RY,莫LY,霍尔AL,米勒SC,托梅纽斯KE,“B模式流体(B-flow)成像”,IEEE超声会议论文集,圣胡安,波多黎各,10月22-25,纽约:IEEE;(2000),1469-1472页,以及拉乌斯托肯L,本杰若姆S,马腾斯D,托普H,“血流成像—一种新的实时2-D血流成像技术”,关于超声、铁电体和频率控制的IEEE学报(2006),53:289-299(Chiao RY,Mo LY,Hall AL,Miller SC,Thomenius KE,“B-mode blood flow(B-flow)imaging”,In:Proceedings,IEEE Ultrasonics Symposium,San Juan,Puerto Rico,22-25October.New York:IEEE;(2000),p.1469-1472;and Lovstakken L,Bjaerum S,Martens D,Torp H,“Blood flow imaging—A new real-time,2-D flow imaging technique”,IEEE Trans Ultrason Ferroelectr Freq Control(2006),53:289-299)。注意,通过我们的双重可视化方法渲染的多方向流体动态的图形表示与近年来已经在超声流体成像中报导的基于点的质点可视化算法是本质不同的。
VPI通过颜色编码的质点投射体的动态渲染提供了定量的流体可视化。在图3(a)中,图像视野中的一组像素首先被指定为投射体发射点。在流体区域之外的那些(基于能量阈值识别)被隐藏。投射体长度和色调被基于速度大小设定。图3(b)显示了通过基于速度向量估计计算它的帧间位移而更新了的投射体位置。
VPI可视化协议的动态投射体方法工作过程如下。首先,如图3a所示,在循环开始时,成像视野中的任意组像素被选择为发射点,并且它们各自的颜色编码了的投射体被显示。随后,为了更新下一帧中的每个投射体的位置,如图3b中所示,三个步骤被顺序执行:(i)通过投射体的相应的轴向-侧向速度与帧间时间(即,fVPI的倒数)之间相乘而计算增量2-D位移;(ii)基于计算出的位移(被离散到图像栅格中的最接近的像素)更新新的帧中的投射体位置;和(iii)在更新了的位置处显示新的帧的颜色编码了的投射体。这个过程实质上与计算机图形学领域中的算法类似并且在给定的投射体寿命期间重复(在帧的数量方面是随机的),并且之后整个动态可视化循环被通过在发射点重新生成新的投射体(基于在新的慢时间时刻的向量估计)而重新开始。见麦克劳林T,拉喏米RS,佩克尔特R,普斯特FH,陈M,“超过二十年的基于集成的、几何学的流体可视化”,计算机图形学论坛,2010;29:1807-1829(mcloughlin T,Laramee RS,Peikert R,Post FH,Chen M,“Over two decades of integration-based,geometric flow visualization”,Computer Graphics Forum 2010;29:1807-1829)。注意,为了抑制虚假的投射体,与彩色血流成像中使用的类似的显示增益策略被采用。特别地,仅仅当投射体的即时像素位置落入流体区域(如被基于慢时间滤波后能量图识别(即,具有大于给定阈值的能量的像素被分类为血流区域)的一样)内时该投射体才被显示。否则,新的投射体将被在原始发射点重新生成。
硬件和参数
该VPI发明已经使用一种为了研究目的的、通道域的成像平台实现,该成像平台允许将被单独配置的每个阵列元件的发射和接收操作。这个平台是一种复合系统,在其中SonixTouch研究型扫描器(加拿大不列颠哥伦比亚省里奇蒙德,Ultrasonix公司)的前端被连接到前波束合成数据采集工具,并且数据被通过通用串行总线链路(详细规格列在表1a中)传送到后端计算工作站。L14-5线阵阵列(Ultrasonix公司)被用作工作换能器。见张CCP,余ACH,萨利米N,于BYS,曾IKH,柯比B,阿扎尔RZ,迪基K,“用于先进超声成像方法的研究的多通道前波束合成数据采集系统”,关于超声、铁电体和频率控制的IEEE学报,(2012)59:243-253(Cheung CCP,Yu ACH,Salimi N,Yiu BYS,Tsang IKH,Kirby B,Azar RZ,Dickie K,“Multi-channel pre-beamform data acquisition system for research on advanced ultrasound imaging methods”,IEEE Trans Ultrason Ferroelectr Freq Control,(2012)59:243-253),其在这里被整体引入。
这个超声发射硬件的压力场记录使用被安装在三轴微定位器(ASTS-01,昂达(Onda)公司)的薄膜水听器(HMB-0500,美国加利福利亚桑尼维尔昂达(Onda)公司)获得。当以平面波激励模式工作时,我们的扫描器硬件产生一个降额的0.72MPa的峰值负压(位于2厘米深度处)。对于我们的给定脉冲参数,这个压力对应0.32的机械指数,0.16W/cm2的空间峰值、时间平均的强度,和27W/cm2的空间峰值、时间峰值的强度(假定在摄氏度的脱气水中工作)。这些数字完全在美国食品及药品管理局所规定的安全限度内。见达克FA,“超声和次声的医疗和非医疗防护标准”,生物物理和分子生物学的研究进展(2007)93:176-191(Duck FA,“Medical and non-medical protection standards for ultrasound and infrasound”,Prog Biophys Mol Bio(2007)93:176-191)。
具有三个Tx角度(-10°,0°,+10°)和三个Rx角度(-10°,0°,+10°)的向量估计结构已经实现(即,M=3,N=3,MN=9)。为了实现这种结构,偏转平面波脉冲序列通过执行TEXO软件开发工具包(Ultrasonix公司)中的相关功能而定义仅仅产生角度偏转而没有聚焦的阵列通道延时而在平台上程序化。使用的典型的脉冲-回波成像参数如表1b中概述的一样,并且前波束合成通道域数据在接收中采集。
表1.VPI的实验实现使用的参数
表2.可替换的实验参数
一个3TX、3Rx的VPI结构被实现。而且,对于每个Tx-Rx角度对,在流体估计期间施行一个3级子采样。VPI被在与健康的和狭窄的颈动脉分枝相似的解剖学现实流体模型上测试。这些是适合的几何结构,因为它们内的流体动态已知是多方向的并且随时间显著变化的。体模是基于聚乙烯醇凝胶的失芯铸造的薄壁设计。脉动流体使用齿轮泵用可编程的流率供给。结果的图像显示在图11中。在图11中,图像是对于两个颈动脉分枝模型在主波(peak systole)处获得的VPI:图11(a)是健康的脉管,图11(b)是在到ICA的入口处50%偏心性狭窄的脉管。这显示了渲染两个分枝模型的长轴视图的VPI的实例。在主波(peak systole)处的结果被显示。在脉管健康的情况下,VPI准确地投射出了流体的主流经路径。在脉管狭窄的情况下,VPI定量地突出了在狭窄部分出现的高速射流、在狭窄部分下游的弯曲流经路径和在ICA球中的显著的再循环流。
在将离线的采集数据送到后端处理器之后,各种图像成形和可视化操作根据VPI的需要执行。首先,为了提高通道域信噪比,有限冲击响应带通滤波器(最低阶;参数列在表1c中)被使用Matlab(R2012a;Mathworks公司,纳提客,马萨诸塞州,美国(R2012a;Mathworks,Natick,MA,USA))应用到每个通道的前波束合成数据中。其后,来自于三个Rx角度的延时求和波束合成被基于例如在于等人2011年的文献(其在前文中引用并且被通过引用的方式整体引入)中披露的并行计算方法使用图形处理单元(GPU)执行。注意,两个GTX-590 GPU(NVidia公司,圣塔克拉拉,加利福利亚,美国)的阵列被用于这个操作以促使以实时吞吐的方式进行处理。随后,用于斑点成像的实现被使用,如在于BYS,曾IKH,余ACH,“基于GPU的波束合成器:合成孔径成像和平面波复合的快速实现”,关于超声、铁电体和频率控制的IEEE学报,(2011),58:1698-1705(Yiu BYS,Tsang IKH,Yu ACH,“GPU-based beam former:fast realization of synthetic aperture imaging and plane wave compounding”,IEEE Trans.Ultrason.Ferroelectr.Freq.Contl.,(2011),58:1698-1705)中披露的一样。此外,杂波滤波(以最低阶高通有限冲击响应滤波器的形式,见表1d中的参数部分)和一阶滞后自相关被在每个像素位置处在9个Tx-Rx角度对上分别单独执行。与向量估计相关的其他下游操作(事后正则化和最小二乘拟合)然后在Matlab中进行。特别的帧相关和中值滤波也被执行。最后,VPI图像组被使用本发明的双重动态可视化算法和表1d中列出的参数获得和渲染。注意,我们的VPI图像组中的流体信息被覆盖在背景的B模式图像帧的顶部上,其中该B模式图像帧由从9个Tx-Rx角度对形成的波束合成后数据帧的空间复合形成。
为了评估我们的VPI技术中使用的流体向量估计算法的准确性,稳流标定实验首先使用我们自制的多脉管流体体模进行。该体模包括三个薄壁直管,其长轴沿着同一个平面对准;每个管具有不同的直径(2、4和6mm)和流动角度(-10°、0°和+10°),并且它们被定位在不同的深度处(1.5、4和6cm)。通过使用与在我们先前的工作(于和余2013年的文献,前文中已引用)中所描述的类似的熔模铸造方案,该体模被使用聚乙烯醇冻凝胶作为组织模拟材料而制造出,其声衰减系数和声速被分别测量为0.24dB/cm、MHz和1518m/s。
体模被连接到齿轮泵(AccuFlow-Q,雪莱医学影像公司,伦敦,安大略省,加拿大(AccuFlow-Q,Shelley Medical Imaging,London,ON,Canada)),该齿轮泵以2.5mL/s的流率提供血液模拟液体(雪莱(Shelley);密度1037kg/m3,粘度3.95 3 106m2/s)的连续的循环。换能器扫描平面与三个脉管(其由于流体介导的扩张而分别被扩展到2.2、4.4和6.3的直径)的长轴对准。原始数据然后被基于上文中所述的参数针对三个Tx、三个Rx结构进行采集,并且管腔速度曲线被使用VPI流体向量计算算法进行估计。结果被与理论抛物线曲线相关,对于三个扩张了的脉管,其中心线速度分别为131、31和16cm/s。
为了估计VPI技术的实际效果,这个架构被用来对解剖学现实颈动脉分枝体模内的复杂流体动态进行成像。实际中,VPI的效果被通过拟人的颈动脉分枝体模研究而评估。图4(a)图示了包括流体回路和成像平台的实验装置。样本的B模式图像被针对两个分枝模型显示。在图4(a)中,发射脉冲电路40将它的信号发送到换能器阵列10,该换能器阵列10与图10中显示的相同或者类似,并且其可以具有例如128个TX/RX通道。它被来自于通道域数据采集工具48的信号触发。换能器使得超声波被施加到人造组织42上,该人造组织42具有分叉的液体流动路径。来自于组织模拟物42的液体经过两个分枝进入储液装置44,在该储液装置44处液体被收集并且通过泵46返回到组织模拟物中。来自于组织模拟物42的返回信号被阵列10接收并且被发送到通道域数据采集工具48,该通道域数据采集工具48调节该返回信号。电路48与图10中的电路12类似。这个经调节的信号被应用到波束合成器30,该波束合成器30与图10中的电路30相同或者类似。最小二乘向量估计被在电路22中执行,并且结果被以与图10中类似的形式在显示器26上呈现。
图4(b)显示了健康的共面几何形状的图像,图4(c)显示了具有在ICA分枝入口处的50%偏心性狭窄的患病分枝的图像。脉管尺寸如所显示的一样。(CCA=颈主动脉;ICA=颈内动脉;ECA=颈外动脉)。
注意,颈动脉分枝血管更适合这个研究,因为它在三个分枝(颈主动脉(CCA)、颈内动脉(ICA)和颈外动脉(ECA))的连接处附近具有弯曲的血管几何形状。换句话说,它有效地允许三Tx、三Rx VPI结构追踪具有显著的多方向的和空间时间的变化的流动模式的能力的测试。使用这些几何形状的另一个优点是它们的流体动态已经被其他人使用光学粒子图像测速法(柯法亚提S,泊伊普平TL,“通过适宜的正交分解和粒子图像测速进行的颈动脉分枝中的过渡血流分析”,医学工程与物理,2013;35:898-909,泊伊普平等人,(2010)(Kefayati S,Poepping TL”Transitional flow analysis in the carotid artery bifurcation by proper orthogonal decomposition and particle image velocimetry”.Med.Eng.Phys.,2013;35:898-909.;Poepping et al.(2010)))和计算流体动态法(斯坦曼DA,泊伊普平TL,唐巴斯科M,兰金RN,霍尔兹沃斯DW,“狭窄的颈动脉分枝处的血流模式:同心性和偏心性狭窄的效果比较”,生物医学工程年报,2000;28:415-423(Steinman DA,Poepping TL,Tambasco M,Rankin RN,Holdsworth DW,“Flow patterns at the stenosed carotid bifurcation:effect of concentric versus eccentric stenosis”,Ann.Biomed.Eng.,2000;28:415-423))而广泛的特性化。这个信息为与被通过VPI渲染的流体模式的比较提供了有效的参考。
两个不同的颈动脉分枝体模模型被用于实验:(i)健康的共面几何形状(图4b)和(ii)在ICA分枝入口处具有50%偏心性狭窄的患病的分枝(图4c)。该体模是用聚乙烯醇冻凝胶作为组织模拟材料的薄壁设计,并且它们被使用与上文中所描述的相同的过程制造。见上文中引用的于和余2013年的文献。流体脉动(具有72bpm的脉动频率(即,1.2Hz)和5mL/s的主波(systolic)流率)与颈动脉脉动模式类似,该颈动脉脉动模式以主升支(primary systolic upstroke)和次重博波(secondary dicrotic wave)为特征(在泵系统中预先定义)。如在其他处(于和余2013年的文献)所解释说明的一样,这些流体参数通常将产生层流状况,并且因此出现的任何复杂的流动模式都可以归因于由脉管几何形状中的局部弯曲(而不是湍流)引起的流体扰动。
稳流标定实验首先通过将健康的分枝体模连接到齿轮泵(AccuFlow-Q,雪莱医学影像公司,伦敦,安大略省,加拿大(AccuFlow-Q,Shelley Medical Imaging,London,ON,Canada))而进行,该齿轮泵以5mL/s的流率提供血液模拟液体(雪莱(Shelley);密度1037kg/m3,粘度3.95×106m2/s)的连续的循环。换能器扫描平面对准CCA长轴(由于流体介导的扩张而被扩展到6.4mm的直径),并且原始数据被基于先前描述的参数而针对三Tx、三Rx结构而采集。腔内速度曲线则被使用VPI的流体向量计算算法估计。结果被与理论抛物线曲线(具有31cm/s的中心线速度)比较。
下一步,脉动流体实验被使用分枝体模执行。流体脉动(具有72bpm的脉动频率(即,1.2Hz)和5mL/s的主波(systolic)流率)与颈动脉脉动模式类似,该颈动脉脉动模式以升支(primary systolic upstroke)和次重博波(secondary dicrotic wave)为特征(在泵系统中预先定义)。VPI电影回放文件则被通过处理在这种流体设定下采集的原始数据而产生,以确定VPI在可视化复杂流体特征上的能力。为了便于比较,多普勒频谱被通过重新处理在有代表性的像素位置处的原始慢时间总体而在这些位置处计算出。
VPI的向量计算算法发现能够以高准确度获得流体向量估计。从稳流标定实验中获得的相应的结果被显示在图5中。图5显示了在多脉管稳流标定实验(2.5mL/s的流率)中获得一致准确度的流体估计的向量投射体成像(VPI)(三发射[Tx]、三接收[Rx]结构)的流体向量估计量。图5(a)显示了被定位在不同的深度(1.5、4、6cm)、具有不同的尺寸(2、4、6mm直径)并且被定向在不同的角度(-10°、0°、+10°)的三个流体管道中的估计出的流体向量的静态图。每个向量的颜色编码和长度与流体速度的大小有关。考虑到高速度的动态范围,标尺被以对数的形式显示。见图5(b)-5(d)。对于这三个脉管,在腔内的不同轴向位置处的估计出的速度大小(实线)与理论值(虚线)非常匹配。结果值由50个侧向位置平均获得(误差线5标准差)。
这些图是当换能器与CCA血管平行放置时健康分枝体模(具有5ml/s的恒定流率)的CCA中的流体向量曲线。如图5a中可以观察到的一样,腔内的流体向量(被可视化为静态的颜色编码了的投射体)的角度方向通常是准确的,因为它们一致地描述了在包括三个不同角度的脉管的标定流体方案中的流体方向。在靠近换能器(顶部脉管,中心在1.5cm深度处)和远离换能器(底部脉管,中心在6cm深度处)的轴向位置处流体角度估计仍然保持鲁棒。
穿过三个脉管的内腔的估计出的流体速度大小通常发现类似于与理论预测良好匹配的抛物线形状。如图5(b)-(d)所示,对于顶部、中部和底部脉管,估计出的中心线速度大小分别为110.4/28.6和15.1cm/s(每个基于50个估计的平均值)。它们与理论值的不同分别为-16.1%、-9.1%和-6.2%。这个偏差最终对于平均速度估计而言是典型的,因为每个空间点(为有限尺寸的范围采样门)实际上沿着抛物线流动梯度覆盖一个速度范围,而平均速度估计又将对应于这个深度范围上的平均值。
标定结果显示,使用三个发射角度和三个接收角度(二者都为-10°、0°和+10°),即使当换能器被与脉管(6.4mm扩张直径;5ml/s稳定流率)平行地放置时,VPI都可以准确地计算流体向量。VPI的实际优点被通过既考虑健康的颈动脉分枝几何形状也考虑狭窄的颈动脉分枝几何形状的拟人流体体模研究而进一步证明。对于具有1.2Hz颈动脉脉动频率的健康分枝而言,VPI能够渲染多角度的和空间时间变化的流体模式(使用416fps的标称帧率,或者2.4ms的时间分辨率)。在狭窄的分枝(50%偏心性狭窄)的情况下,VPI使能高速流体射流和再循环区域的动态可视化。
使用VPI技术,在脉动流体情况下在弯曲脉管内出现的多方向的和空间时间变化的流体模式的时间分辨的定量的可视化被针对具有72bpm脉动频率的健康颈动脉分枝实现。例如,图6显示了健康颈动脉分枝体模内的流体动态的长轴视图。特别地,图6(a)-6(d)是静止帧VPI渲染图,其显示了健康颈动脉分枝体模中的流体扰动的形成和消散。显示了四个时间点的帧,即图6(a)是主波(peak systole)的图,图6(b)显示降中峡(post-systolic down stoke)的结束,图6(c)是重博波(dicrotic wave)峰值,图6(d)显示了重博波(dicrotic wave)的结束。脉动循环中的相对位置被标记在图6(e)中显示的从位于CCA中心处的1×1mm的采样体积获得的多普勒频谱中。标称VPI帧率(fVPI)和回放速率分别是416fps和50fps(对于三Tx、三Rx的VPI结构,由3,333Hz的fDAQ产生)。在流动模式上的多方向的和空间时间的变化被连贯地描述出。ICA颈动脉球中的流体扰动也被渲染。
标称VPI帧率(fVPI)是416fps,并且它被以50fps(fDAQ是3,333Hz)的速率回放。渲染的流体动态被发现是与从计算预测中获得的既定结果一致的。见伯杰SA,乔LD,“狭窄血管中的血流”,流体力学年报,(2000)32:347-382(Berger SA,Jou LD,“Flows in stenotic vessels”,Annu.Rev.Fluid Mech.,(2000)32:347-382)。特别地,可以容易地观察到,脉管的不同部分中由VPI渲染的流体速度和流体方向的时间估计如所期望的一样与流体脉冲的脉动同步。而且,在ECA分枝(下分枝)中,沿着脉管的流线型的前向流体(没有反向流体)在整个脉动周期中都是明显的。后者的观察有效地证明了VPI的流体向量估计过程对于流体角度变化(其由于它的入口段天生是弯曲的而一定会在ECA中出现)是鲁棒的。
VPI的技术优点可能通过它在健康的颈动脉分枝的ICA分枝中的流体扰动的渲染而更显著地证明。这个分枝对应图6中的上分枝。如所可视化的一样,虽然流体在ICA窦的内壁侧上仍然保持为层流,但是在它的外壁侧(颈动脉球位于该处)上的流体模式展现出了再循环行为,如由在60处的VPI的漩涡投射体运动所突出的一样。这种流体扰动现象已经发现在性质上是短暂的。特别地,它仅仅在脉动周期的特定相出现。
VPI的毫秒级时间分辨率(对于416fps的标称帧率为2.4ms)有效地使得能够追踪健康的分枝脉管的颈动脉球中何时出现流体扰动。图6显示了代表性地描述这个随时间变化的流体扰动趋势(每帧的对应的脉动周期相被标记在图6(e)中所示的CCA的脉冲多普勒频谱上)的一系列的关键VPI帧。在主波(peak systole)(图6(a))期间,颈动脉球区域中的流体在前向方向上。但是,在降中峡(post-systolic down stoke)相(图6(b))中,流体再循环区域A出现在ICA窦的这个部分中。它随后在产生次升支(secondary flow upstroke)(图6(c))的重博波(dicrotic wave)的期间消散,并且流体在脉动周期的这个相中再次向前运动。在重博波(dicrotic wave)结束时(次降支(secondary down stroke)在其之前),涡流B再次出现(图6(d))。
为了进一步证明VPI在准确可视化高复杂性流体动态方面的效果,图7显示了在ICA分枝的入口处具有50%偏心性狭窄的患病颈动脉分枝体模的长轴视图的VPI电影回放文件的静止帧(使用与之前相同的成像参数获得)。特别地,图7显示出了具有50%ICA偏心性狭窄的颈动脉分枝体模中的两个狭窄后流体再循环区域中的空间时间差异。该趋势被VPI帧在四个时刻处突出:图7(a)主波(peak systole);图7(b)主波后射流波前(post-systolic jet front)到达ICA远端部;图7(c)重博波(dicrotic wave)波峰;和图7(d)重博后射流波前(post-dicrotic jet front)到达ICA远端部。参考时间被标记在图7(e)中,该图7(e)显示了在CCA中心处对于一个范围内的采样门(1×1mm的采样体积大小)的多普勒频谱。VPI可以有效地突出在ICA入口(长轴视图)处具有50%偏心性狭窄的患病颈动脉分枝体模中的高速流体射流和流体再循环区域。成像参数与图6中的相同(fVPI:416fps;回放速率:50fps)。两个再循环区域中的流体扰动的时间过程动态被在两个放大的窗口中更详细地显示。
将被注意到的一个引人注目的发现是,在升支(systolic upstroke)的期间,高速流体射流(红色箭头)的形成可以被在狭窄的位置处动态地可视化。实际上,流体射流沿着ICA窦的内壁侧(即,未狭窄的侧)继续传播并且喷射穿过ICA内腔。然后它在靠近颈动脉球的远端部(ICA脉管在这里开始变得平直)处碰撞外ICA壁。随着碰撞外壁,射流方向被对着该壁切向地重新定向并且最终在它在更下游处消散之前倾斜。
在图7中,被VPI可视化的另一个重要特征是横越ICA内腔的狭窄后射流(post-stenotic flow jet)的两个侧翼上的两个流体再循环区域的存在。这两个区域中的一个位于颈动脉球区域C中,而另一个D在它在外壁处倾斜之后沿着消散的流体射流的弯曲部的正下方的内壁段。这个发现与从血流仿真研究(斯坦曼等人,2000)和粒子图像测速实验(柯法亚提和泊伊普平,2013,上文中引用;泊伊普平TL,兰金RN,霍尔兹沃斯GW,“使用脉冲多普勒超声的颈动脉分枝模型中的血流模式:同心性和偏心性狭窄在湍流和再循环上的效果比较”,超声医学和生物学,(2010)36:1125-1134(Kefayati and poepping 2013;cited above and Poepping TL,Rankin RN,Holdsworth DW,“Flow patterns in carotid bifurcation models using pulsed Doppler ultrasound:effect of concentric vs.eccentric stenosis on turbulence and recirculation”,Ultrasound Med.Biol.,(2010)36:1125-1134))中获得的结果非常匹配。
如图7(其显示了狭窄分枝体模的四个代表性的VPI帧)中所示,发现两个再循环区域在空间时间特征上完全不同。对于颈动脉球C处的区域,涡旋旋转在整个脉动周期上都维持而不会结束。相反,在内壁段处的流体再循环区域D在同一个周期内形成和中断两次,并且它当被由于在区域边界处的高速度梯度而产生较大流体剪切力的流体射流弓围绕时出现。注意,当主和次流体射流在主波(peak systole)(图7(a0)以及在重博波(dicrotic wave)峰值(图7(c)处))的期间分别在狭窄位置处刚出现时,这种弓还没有形成。它仅仅在射流波前已经完成了从狭窄位置到ICA的远端部的传播之后出现,由此环绕邻近内壁的慢流体(图7(b)和7(d))。
使用超声来可视化复杂的流体动态天生不是一个简单的任务。在研究一个前瞻性的解决方案的过程中,两种实际的脉管流体情况必须考虑:(i)在给定的时刻,流体速度和方向(即,流体向量)可能由于脉管几何形状的曲折性而在空间上变化;和(ii)在一个心脏搏动周期中,流体分量将由于脉动而在时间上偏移。VPI被设计来捕捉和渲染流体中的这些空间时间动态。
从技术的角度看,VPI具有使成像视野中的流体向量的时间分辨的可视化成为可能的三个重要特征。第一,它通过多角度平面波成像原理执行高帧率宽视野数据采集,以便实现所要求的高时间分辨率以监测流体脉动以及它们在成像视野中的空间变化(图1)。第二,VPI使用了特别设计的多Tx、多Rx多普勒分析构架以计算不同像素位置处以及每个时刻的流体向量(图2);鲁棒的估计性能通过在流体向量计算的期间引入事后正则化(流体区域检测、相位解缠)和最小二乘拟合原理而达到。第三,VPI以颜色编码的质点投射体的形式动态地渲染流体向量,该质点投射体的轨迹被通过投射体位置的帧间更新而描绘出(图3)。动态流体的感知被通过灰阶流体斑点的附加显示而增强。
VPI在可视化复杂流体动态方面的实际优点被通过具有受控流体条件(否则其在活体内是不可能的)的颈动脉分枝体模研究证明(图4)。在健康的分枝几何形状的情况下,VPI不仅能够准确地追踪脉动的流线型流体(图6),它也描述出了在颈动脉脉动循环的主和次降支相的期间颈动脉球中的流体再循环的短暂存在(图6)。在具有50%偏心性狭窄的颈动脉分枝几何形状中,VPI的可视化性能表现的更清楚明显。特别地,这个新技术有效地突出了从狭窄位置出现的高速流体射流和它的轨迹(图7)。而且,它使得能够进行颈动脉球区域中以及沿着ICA内壁段的流体扰动的时间分辨的观察(图7),二者都是狭窄的ICA分枝的已知特性(柯法亚提和泊伊普平,2013年;泊伊普平等人,2010年)。本发明是首次这种复杂的流体特征被通过基于超声的技术进行成像。
作为VPI在描述复杂流体模式的具体细节上的应用潜力的综合理解,图8概况了当通过这个成像架构观察时健康颈动脉分枝体模中的流体扰动趋势。图8(a)和8(b)显示了ICA的两个放大的视图,其证明了VPI分辨复杂流体细节的能力。这里显示了两帧,以描述在在主波(systole)之后在图8(a)中观察到的以及在重博波(dicrotic wave)之后在图8(b)中观察到的健康分枝体模的颈动脉球中的流体再循环区域的空间峰值上的不同。这两帧在脉动周期中的相应的时刻被标记在图8(c)中所示的多普勒频谱中,其中该多普勒频谱分别在颈动脉球的近端部和远端部(图8(a)、8(b)中由黄色框标记的位置)中由1×1mm采样体积获得。
在健康分枝的情况下,应该注意到的是,颈动脉球区域中的再循环区域在降中峡(post-systolic down stoke)结束处(图8a)比在重博波(dicrotic wave)的结束处(图8b)更大。特别地,如在这两帧中标记的一样(白色虚线;基于手动检查绘出),在降中峡(post-systolic down stoke)相的期间,该区域边界跨越整个颈动脉球区域,这很有可能是因为快速的流体减速;而在重博波(dicrotic wave)的结束处,再循环区域仅仅在接近提供更平缓的下降的ICA入口的区域中出现。这个现象与在颈动脉球的近端部和远端部处(其中四相流和三相流被分别观察)从采样门中提取出的多普勒频谱很好地匹配。
图9显示了在50%狭窄的分枝体模中流体再循环区域的时空特性的VPI引导分析。特别地,图9(a)和图9(b)分别显示了在主波(peak systole)和重博波(dicrotic wave)峰值的期间颈动脉球中的再循环模式。这两帧的相对时刻被标记在图9(c)中所示的两个多普勒频谱中,其中这两个多普勒频谱从流体射流和颈动脉球的远端部(图9(a)和9(b)中的黄色框)处获得。对于邻近ICA内壁的再循环区域,它的空间峰值大小由在主波(systole)(图9(d))和重博波(dicrotic wave)(图9(d))期间获得的两帧VPI帧突出显示。为了参考,位于ICA内壁的近端部和远端部处的两个采样体积的多普勒频谱被显示在图9(f)中。
对于狭窄的颈动脉分枝,它的两个流体再循环区域的空间范围显示出了实质不同。当VPI在脉动周期上在颈动脉球再循环区域的大小上没有检测到显著变化时(图9(a)和9(b)),这个新的成像工具确实使在ICA内壁处的流体再循环区域的尺寸变化暴露出来(图9(d)和9(e))。特别地,在主波(systole)的期间产生的主流体射流弓被发现沿着ICA内壁产生了更大的流体再循环区域,而由重博波(dicrotic wave)引起的次弓仅仅产生更小的流体再循环区域,这可能是因为由于射流速度较慢导致了流体剪切力较小。这种发现可以被从位于邻近ICA内壁的近端部分和远端部分处(在该处瞬时流动曲线本质上分别是四相和三相的)的采样门获得的多普勒频谱(图9(f))证实。相比之下,对于位于颈动脉球再循环区域内的采样门,它的多普勒频谱被发现是单相的并且相对于位于流体射流区域中的采样门在表现上是相反的(图9(c))。
如上文中提到的一样,灰阶流体斑点的附加显示可以增强该算法的流体可视化性能,因为帧间流体斑点位移可以用来突出流体轨迹路径。图4(b)图示了没有任何可视化增强的健康颈动脉分枝情形。图12显示了没有向量投射体显示的一组流体斑点帧(b1-b4)。当以远远超出视频显示范围的高帧率电影回放的形式可视化时,这些流体斑点将根据脉动流动模式在帧之间相干地移动。这种渲染形式将相应地描绘出轨迹。而,当与向量投射体同时显示时,它们将为复杂的流体信息提供次可视化通道。
图13显示了与图12中相同的流体,但是在这种情况下向量投射体被显示,而没有斑点(c1-c4)。具有斑点和投射体的完成了的图像显示在图6中。
作为具有精细的时间分辨率和流体向量估计能力的新研发的技术,VPI可以被用来研究各种形式的复杂流体动态。例如,除了如所说明的一样使用VPI来研究颈动脉分枝中的流体模式之外,这个技术可以被用来检查患病的脉管特征(比如,动脉瘤)内的多方向流体动态。而且,VPI可以被用来可视化具有颤动特征的湍流(其需要精细的时间分辨率以相干地渲染)。实现这些应用将有效地证实VPI在复杂流体分析上的诊断价值。
由于由VPI提供的精细时间分辨率依赖于使用宽视野数据采集序列(在其中超声发射本质上是未聚焦的),从更深的脉管处返回的流体信号结果将不可避免地是更弱的。当诊断其脉管趋向于位于远离皮肤表面的位置处的某些病人时,这个问题(其将被与深度相依赖的衰减自然地恶化)可能构成挑战。因此,当使用不同的体内扫描设置时,流体信号增强技术可以被使用以增强VPI架构的效率。可以使用的一个特别的策略是将编码激励原理引入发射脉冲序列设计中。见Zhao H,Mo LYL,Gao S的“巴克编码超声彩色血流成像:理论和实际的设计考虑”,关于超声、铁电体和频率控制的IEEE学报(2007),54:319-331(Zhao H,Mo LYL,Gao S,“Barker-coded ultrasound color flow imaging:Theoretical and practical design considerations”,IEEE Trans Ultrason Ferroelectr Freq Control (2007),54:319-331),其在此被整体引入。可替换地,微泡造影剂可以被引入以当进行VPI时增大流体信号水平。见特伦布莱-达维奥C,威廉姆斯R,米洛特L,布鲁斯M,伯恩斯PN,“超快速多普勒微泡成像”,2012IEEE超声研讨会中,德累斯顿,德国,10月7-10,纽约:IEEE;(2012),p.1315-1318(Tremblay-Darveau C,Williams R,Milot L,Bruce M,Burns PN,“Ultrafast Doppler imaging of microbubbles”,In Proceedings 2012IEEE Ultrasonics Symposium,Dresden,Germany,7-10October.New York:IEEE;(2012),p.1315-1318).
将被进一步完善的VPI的另一个方面是它的关于技术的实时实现的工程考虑。在图10的设置中,使用了实时GPU基波束合成器,但是数据被离线处理,因为扫描器硬件是基于使用通用串行总线数据传输链路的,而该通用串行总线数据传输链路的带宽不足以支持实时数据流。为了有效地促进VPI的在线执行,可以使用高速数据传输连接(例如,外围组件互连快速链路(Peripheral Component Interconnect Express links)),例如,具有支持进行实时数据吞吐的通道域数据流的超声扫描器结构。见戴格尔RE、卡茨多夫斯基PJ,“使用未聚焦波束的高帧率定量多普勒血流成像”,美国专利申请第12/490,780号(2009),以及沃尔兹克M、莱万多夫斯基M、佐尔克N,“实时超声PCI e数据流的优化和SAFT成像的Open CL处理”,2013IEEE超声研讨会中,布拉格,捷克共和国,7月21-25,纽约:IEEE;(2013)(Diagle RE,Kaczdowski PJ,“High frame rate quantitative Doppler flow imaging using unfocused transmit beams”,U.S.Patent Application serial number 12/490,780(2009);and Walczak M,Lewandowski M,Zolek N,“Optimization of real-time ultrasound PCI e data streaming and Open CL processing for SAFT imaging”,In proceedings,2013IEEE Ultrasonics Symposium,Prague,Czech Republic,21-25July.New York:IEEE;(2013)),该二者都在此被整体引入。
可替换地,VPI还可以用于超声心动图扫查。在超声心动图扫查中心脏内血流场的向量可视化目前依赖于彩色血流成像数据的后处理或者用以执行回波粒子图像速度测量的微泡造影剂的使用。为了在超声心动图应用中实现VPI,流体向量估计架构将需要被进一步完善以考虑由于心肌收缩而引起的非静止组织杂波。例如,当计算每个Tx-Rx角度对的频率偏移估计时,对组织运动偏差具有适应性的先进的信号处理方案可以适用于这个目的,比如最大似然估计(maximum likelihood estimation)和自适应秩本征估计(adaptive-rank eigen-estimation)。见拉沃斯托肯L、本杰若姆S、托普H,“存在杂波的情况下超声彩色血流成像中的最佳速度估计”,关于超声、铁电体和频率控制的IEEE学报(2007),54:539-549;和余ACH、科博尔德RSC,“彩色血流成像的单集群基本征处理方法—第二部分:矩阵铅笔估计器”,关于超声、铁电体和频率控制的IEEE学报(2008),55:573-587(Lovstakken L,Bjaerum S,Torp H,“Optimal velocity estimation in ultrasound color flow imaging in presence of clutter”,IEEE Trans.Ultrason.Ferroelec.Freq.Contr.,(2007),54:539-549;and Yu ACH,Cobbold RSC,“Single-ensemble-based eigen-processing methods for color flow imaging—Part II.The matrix pencil estimator”,IEEE Trans.Ultrason.Ferroelec.Freq.Contr.,(2008),55:573-587),其二者都在此被整体引入。
VPI可以被认为是在将超声用于流体估计目的方面的一种新的方法。特别地,与常规的彩色血流成像相比,它展现了在流体信息的获取、估计和渲染方式方面的极大变化。由于VPI实质上是非侵入的,因此这个技术在被引入作为用来扫查人体脉管中的复杂流体动态的常规诊断工具方面应该保有希望。例如,在颈动脉诊断中,与常规的多普勒频谱模式(其作为颈动脉疾病管理的临床实践的一部分而例行地进行)相比,VPI可能可以被采用作为评估颈动脉狭窄的严重程度的更直观的方法。如果这种临床转化效果可以被实现,则当前超声在脉管诊断中的角色毫无疑问将被扩展。
本发明在范围上将不被本文中说明的具体实施例所限制。实际上,由前文中的说明和后附的附图,除了上文中说明的那些之外的本发明的各种变型对于本领域技术人员而言将是显然的。这种变型将落入后附的权利要求的范围内。
- 还没有人留言评论。精彩留言会获得点赞!