白细胞介素4在制备促进急性脑损伤后神经功能恢复药物中的用途的制作方法
本发明属生物医药技术领域,涉及白细胞介素4(Interleukin-4,IL-4)在神经科学领域中的新医药用途。尤其涉及白细胞介素4在制备促进急性脑损伤后神经功能恢复药物中的用途。
背景技术:
现有技术公开了急性脑损伤(acute brain injury,ABI)是神经科学治疗及研究领域的重点对象,从广义方面来讲,急性脑损伤指由缺血、缺氧、创伤、出血、感染、中毒等各种原因引起的脑实质的急性损伤,包括开放型或闭合型脑外伤、缺血性或出血性脑中风、感染性脑脊髓膜炎甚至阿斯综合症等继发性脑损伤病变,其中创伤性脑损伤(traumatc brain injury,TBI)和缺血性脑中风(ischemic brain stroke,IBS)是急性脑损伤疾病中发病率、死亡率、致残率最高的疾病,其严重影响患者的生存率和预后生活质量。
研究显示,中风包括缺血性或出血性脑中风,其中缺血性脑中风(IBS)约占60%~80%。IBS是以脑组织缺血性损伤和相应神经功能病变体征为主要临床表现的急性脑血管病,据统计,目前我国每年有约800万BS患者,其中有超过150万患者死亡。目前唯一被FDA批准的有效治疗药物是组织纤溶酶原激活物(tissue plasminogen activator,tPA),tPA的主要作用是溶解血栓,且其使用受限于严格的时间窗和出血不良反应的限制,医疗实践中,仍有大量病患因错过tPA的使用时间窗而留下了永久的神经功能损伤。
同样,创伤性脑损伤(TBI)作为神经外科领域常见的急症之一,目前已成为全世界35岁以下青壮年人群第一位死亡和致残原因,特别是重型TBI,死亡率达到30%-50%;即便存活下来,中、轻度损伤患者10%会遗留永久残疾,而中度和重度患者可达到66%和100%。在我国,随着交通运输业、建筑业、体育事业发展,事故意外伤害发生率大大增加,造成TBI的发病率逐年增高,但目仍无有效的治疗药物。
因此,由于临床缺乏有效的药物治疗方法,IBS和TBI带来的肢体瘫痪等慢性神经功能缺损常常是不可逆转的、永久性的功能减退,需要长期、大量的医疗护理和日常生活照料,给社会和家庭带来极大的负担。故开拓研究思路,挖掘新的神经功能保护机制,开发新药研究以促进神经功能的恢复是迫在眉睫的。
现有技术的神经保护药物研究主要是关于灰质神经元的保护研究。研究显示,灰质有大 量神经元构成,缺血、缺氧、创伤所致的组织坏死凋亡产物(如兴奋性毒性氨基酸、氧自由基、炎症因子、钙离超载等)会导致神经元不可逆转的膜电位变化、胞膜通透性增高、坏死凋亡,而神经元新生的研究仍然是停留在初步的探索阶段,可见灰质的损伤很难逆转,灰质的保护很难有效;有关神经保护药物研究仅正对灰质神经元的保护尚不全面;同时,若干临床病例显示损伤面积相似的患者长期预后的神经功能恢复却并不一致,这提示灰质的修复与神经功能的恢复并不正向相关。
本申请的发明人基于现有技术的基础,拟通过损伤后的白质修复研究提供促进急性脑损伤后神经功能恢复药物,尤其是提供白细胞介素4在制备促进急性脑损伤后神经功能恢复药物中的用途。
技术实现要素:
本发明的目的在于基于现有技术的缺陷,提供促进急性脑损伤后神经功能恢复的药物,具体涉及白细胞介素4在制备促进急性脑损伤后神经功能恢复药物中的用途,尤其是白介素4在制备治疗缺血性中风药物中的用途。
本发明基于现有技术的研究基础,通过对国际公认的IBS疾病模型(MCAO)及TBI模型的两种模型损伤后病理研究发现,IBS和TBI的白质损伤有着极为相似的发病机理:急性血管病变引起的组织缺血缺氧或创伤引起的周围组织的二次脑损伤(secondary brain injury,SBI)均可造成氧自由基积累、钙超载、兴奋性毒性氨基酸增多,进而引起细胞水肿、膜通透性改变、膜电位和细胞代谢异常,继发白质区域少突胶质细胞坏死凋亡、髓磷脂蛋白脱失降解,导致轴突脱髓鞘,即继发的炎症反应(如炎性因子释放增多、髓鞘微环境改变、抗原提成能力增强、少突胶质细胞受到攻击),促使髓鞘相关蛋白(MBP)降解、少突胶质细胞凋亡,引起脱髓鞘病变;髓鞘的脱失一方面造成轴突裸露,电传导功能下降,另一方面,裸露的轴突更易受炎症反应侵蚀,导致轴突损伤等结果;将抑制IBS或TBI后白质的脱髓鞘病变,促进损伤后复髓鞘的修复进程,作为促进白质修复和远期神经功能恢复的攸关靶点:同时,依据:(1)维持髓鞘结构功能完整性,需加强“内因”——促进少突胶质细胞的再生、分化、成熟;(2)维持髓鞘结构功能完整性,需改变“外因”——抑制过度的炎症反应,为少突胶质细胞、髓鞘修复提供适宜的细胞/组织间微环境;而小胶质细胞作为中枢内仅有的免疫应答-炎症介导细胞,是控制、改善脑损伤后炎症反应情况的靶点细胞;进一步,采用给予IL-4后干预急性脑损伤(ABI),其中包括:明确IL-4干预ABI的给药方式、对远期运动感觉功能恢复和学习记忆功能恢复的促进作用实验、以及对损伤周边区域白质结构和功能恢复的促 进作用实验,结果显示,如,在体实验中,敲除IL-4的编码基因后,MCAO后的动物表现出急性期增大的梗死体积、增强的炎性反应,而对于敲除IL-4基因的动物给予术前一次性侧脑室注射IL-4,可以减轻上述损伤程度;结果验证了白介素4(IL-4)具有神经功能修复、保护作用,进一步可用于制备促进急性脑损伤后神经功能恢复药物,尤其制备治疗缺血性中风药物。
更具体的,本发明进行了下述有关IL-4促进ABI后神经功能恢复和白质修复的实验,结果证实IL-4具有明确抗脑白质损伤的神经保护作用,为其作为一种新型抗中枢神经系统损伤(尤其是白质损伤)药物及其临床应用提供了较完整的实验依据。
本发明进行了IL-4治疗急性脑损伤的作用实验,以建立的大脑中动脉栓塞模型(middle cerebral artery occlusion,MCAO)为例,验证经典急性脑损伤后使用IL-4干预后对神经功能的恢复作用及白质修复促进作用,结果显示:
MCAO后1d-9d,采用皮下植入渗透压依赖注药泵侧脑室立体定位注射IL-4(5ng/μl,持续给药共计500ng),使药物恒速、持续的注射入损伤对侧脑室,监测损伤后长期神经功能,显示IL-4对于MCAO小鼠具有明显的神经保护作用,可以改善损伤后小鼠感觉运动功能障碍,促进学习记忆脑的高级功能的恢复;
使用纳米药物载体包裹的IL-4(nano-IL-4)溶液损伤后鼻饲给药的干预方式,检测损伤后实验动物远期的神经功能,验证损伤后鼻饲吸入IL-4药物可以促进动物长期感觉运动功能和学习记忆功能的恢复,结果证明IL-4治疗ABI的干预方式不仅可以适用于需要微创脑室引流的患者,还可以采用雾化吸入的方式适用于闭合性颅内急性白质损伤的患者;
IL-4不能改善损伤灶的体积,但能明显抑制损伤后周边区胼胝体厚度的萎缩,促进损伤周边区皮层(cortex,CTX)、胼胝体(corpus callosum,CC)、纹状体(striatum,STR)中白质髓鞘碱性蛋白(MBP)的表达,减少因脱髓鞘而暴露的病理低磷酸化神经纤维蛋白(SMI-32)的表达;促进损伤后髓鞘完整性、厚度的修复/维持;促进损伤周边区胼胝体复合动作电位传导能力的提高和恢复;
ABI后的IL-4干预,可以将M2型小胶质细胞高度激活的时间窗由病理条件下的3-7d延长至14-35d,同时明显抑制14d后M1型小胶质细胞的表达,对ABI后损伤周边区小胶质细胞的激活有显著调节作用。
本发明的优点在于:提供了促进急性脑损伤后神经功能恢复的药物,具体涉及白细胞介 素4在制备促进急性脑损伤后神经功能恢复药物中的用途,尤其是白介素4在制备治疗缺血性中风药物中的用途;本发明通过实验结果证实:IL-4对于急性脑损伤所致的白质损伤相关神经功能障碍具有明显的神经保护作用,IL-4可以通过促进小胶质细胞M2型极化,促进白质损伤后少突胶质细胞分化成熟,加强白质损伤后的修复,改善了经功能。
本发明所述的IL-4可用于制成药物制剂,所述药物以固体或液体形式储存,以雾化吸入、静脉注射、腹腔注射以及纳米制剂等形式使用;或制成颅骨微创脑室引流配合脑室内用的滴注液制剂,其中所述药物以无菌注射剂或滴注液形式使用。
本发明所制备的药物制剂具有明确的神经保护作用,可用于治疗任何急性脑损伤引起的白质损伤相关神经功能缺损,包括脑底或脊柱的物理力、局部缺血或中风、阿斯综合征、脑血栓形成或栓塞、大脑出血、急性脑脊髓炎、脑积水、术后事件、急性脑感染、震荡或颅内压升高所引起的创伤性脑损伤所引起的肢体运动功能障碍、学习记忆能力下降等相关后遗症。
附图说明
图1显示了MCAO后IL-4脑室给药能够促进远期感觉运动功能的恢复,其中:
(A)MCAO后35d内前肢错步率(左)和后肢错步率(右)的统计图,纵坐标为患肢错步率=患肢总步数/患肢错步数;
(B)MCAO后35d内转棒实验持续时间的统计图,纵坐标为小鼠在转棒上持续运动直到掉落的时间;
实验数据用均数±标准误表示,*P<0.05,**P<0.01,IL-4组&PBS组;#P<0.05,##P<0.01,PBS组&Sham组。
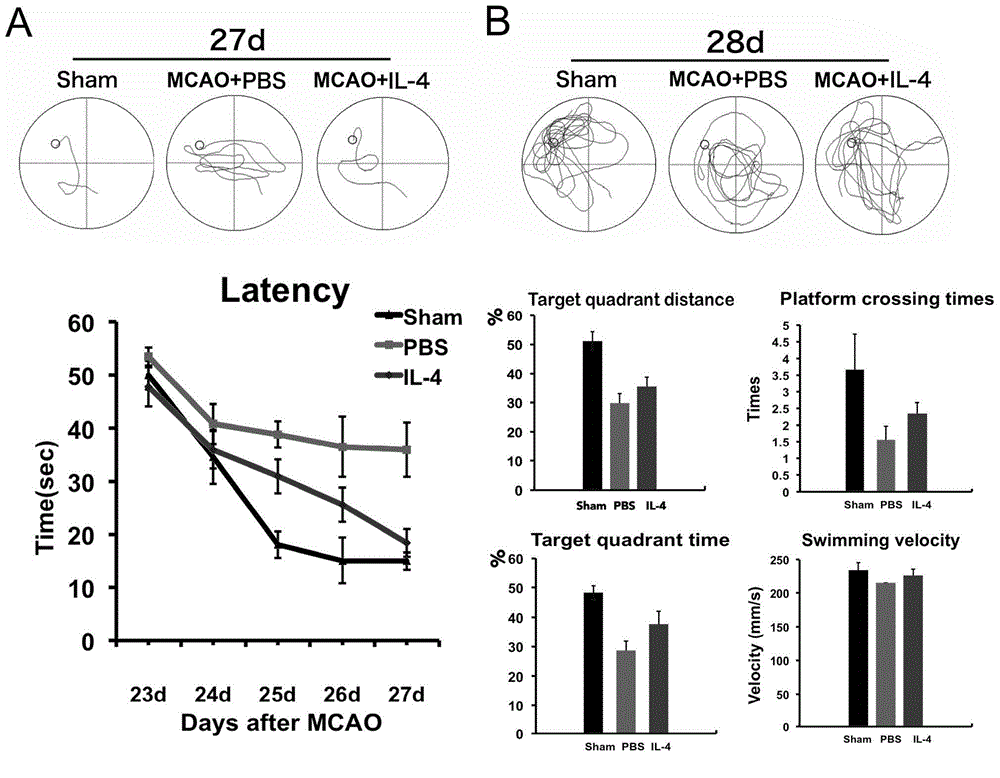
图2显示了MCAO后IL-4脑室给药能够促进远期认知功能的恢复,其中,
(A)MCAO后23d~27d训练并检测小鼠在水迷宫内找到固定平台位置的学习能力,上图,三组小鼠经过5天训练后在27d时找寻平台位置的路线代表图,下图,以小鼠找到平台潜伏期为纵坐标的统计图,潜伏期越短提示学习能力越强;
(B)MCAO后28d时撤去平台后对记忆能力相关指标的检测,上图,28d时三组小鼠60s内运动轨迹的代表图,下图,对28d时三组小鼠平台象限路程百分比(Target quadrant distance%)、平台象限时间百分比(Target quadrant time%)、平台穿越次数(Platform crossing times)、游泳速度(Swimming velocity)的统计图;
实验数据用均数±标准误表示,**P<0.01,IL-4组&PBS组;#P<0.05,##P<0.01,PBS组&Sham组。
图3显示了MCAO后IL-4脑室给药并不能够缩小梗死体积,其中,
(A)MCAO后35d时MAP-2染色代表图,每组小鼠间隔600μm依次选取相同层面的5张脑片,MAP-2阳性的绿色区域为未损伤区,白色虚线勾出的MAP-2的阴性区域为梗死区;
(B)对三组小鼠图A中所示1~5张层面脑片梗死面积的测量,纵坐标为梗死面积;
(C)对三组小鼠脑梗死体积的评估,纵坐标为梗死体积;
实验数据用均数±标准误表示,#P<0.05,##P<0.01,PBS组&Sham组。
图4显示了在WT小鼠上一次性鼻饲50μg/kg的nano-IL-4能维持1~2d的药物浓度,其中,(A)ELISA方法检测一次鼻饲给药后脑内IL-4浓度的实验流程示意图,在WT小鼠上一次鼻饲后分别于12h、1d、2d、3d取脑组织蛋白,用ELISA方法检测IL-4含量;
(B,C,D)一次鼻饲后不同时程脑内CTX、CC、STR区IL-4的含量,以每毫克总蛋白中IL-4的浓度(pg/mg protein)为纵坐标;结果显示,给予50μg/kg的nano-IL-4在CTX和STR的药理浓度能维持1d,为达到脑室给药相同效果,则该鼻饲剂量应连续给药6d;
实验数据用均数±标准误表示,*P<0.05,IL-4组&PBS组。
图5显示了MCAO后IL-4鼻饲给药能够促进远期感觉运动功能和学习记忆功能的恢复,
其中,(A)MCAO后35d内10次角落实验中左转次数的统计图,纵坐标为10次角落实验小鼠在双侧胡须触壁后从左侧向后转身的次数,左转次数越多表示偏身感觉-运动障碍越严重;
(B)MCAO后35d内转棒实验持续时间的统计图,纵坐标为小鼠在转棒上持续运动直到掉落的时间;
(C)MCAO后28d撤去平台时三组小鼠60s内运动轨迹的代表图;
(D)MCAO后24~28d的水迷宫实验中检测的相关指标,左上,24d~27d时找到平台潜伏期的统计,纵坐标为潜伏期;右上,28d时撤去平台后小鼠的平台象限路程百分比(Distance in target quadrant%);左下,28d时撤去平台后小鼠的平台穿越次数(Times of platform crossing);右下,游泳速度(Velocity)的统计图;
实验数据用均数±标准误表示,*P<0.05,**P<0.01,IL-4组&PBS组;#P<0.05,##P<0.01,###P<0.001PBS组&Sham组。
图6显示了MCAO后鼻饲nano-IL-4给药并不能够缩小梗死体积,其中,
(A)MCAO后35d时MAP-2染色代表图,每组小鼠间隔600μm依次选取相同层面的5张脑片,MAP-2阳性的绿色区域为未损伤区,白色虚线勾出的MAP-2的阴性区域为梗死区;
(B)对三组小鼠图A中所示1~5张层面脑片梗死面积的测量,纵坐标为梗死面积;
(C)对三组小鼠脑梗死体积的评估,纵坐标为梗死体积;
实验数据用均数±标准误表示,#P<0.05,##P<0.01,PBS组&Sham组。
图7显示了IL-4治疗能够改善MCAO后35d的远端胼胝体萎缩,其中,
(A)对MCAO后35d时MBP标记的梗死周边区胼胝体宽度测量的示意图,绿色为MBP标记的白质区域,a1、a2、a3,分别观测Sham组、PBS组、IL-4组35d时相同层面的脑片,白色方框内为梗死周边区胼胝体;a4、a5、a6,为三组白色方框内观测区域放大图,示意周边区胼胝体宽度测量方法:从中线(base line)向损伤侧将胼胝体做间隔均匀的14等份,短虚线显示每份胼胝体的宽度,其中红色短虚线表示三组之间有统计学差异的位置;
(B)对三组小鼠各自14等份处的相对胼胝体宽度的统计图,相对胼胝体宽度(Relative width of corpus callosum)=每等份胼胝体宽度/基本值;
实验数据用均数±标准误表示,*P<0.05,IL-4组&PBS组;#P<0.05,PBS组&Sham组。
图8.显示了IL-4治疗能够促进MCAO后35d时周边区皮层、胼胝体、纹状体成熟髓鞘蛋白的表达,其中,
(A)MCAO后35d时MBP与SMI-32共染色显示梗死区与周边区,在周边区的CTX、CC、STR区域使用相同曝光强度分别拍摄2、1、2张(图中白色方框)20X荧光照片;
(B)三组脑片的CTX、CC、STR区域MBP/SMI-32的共标表达情况,绿色为MBP,红色为SMI-32,白色虚线勾勒近端胼胝体区域,(C)MBP/SMI-32荧光强度比值统计图,CTX,皮层;CC,胼胝体;STR,纹状体;
实验数据用均数±标准误表示,*P<0.05,IL-4组&PBS组;##P<0.01,PBS组&Sham组。
图9显示了IL-4治疗能够增加MCAO后35d时周边区胼胝体有髓纤维髓鞘厚度,其中,
(A)MCAO后35d时电镜观察梗死周边区胼胝体横断面有髓纤维髓鞘覆盖情况,左列,6500X镜下观测到梗死周边区有髓纤维横断面,外周深色区域为髓鞘,绿色三角标记内径<400nm的轴突,红色箭头和三角标记内径为400~800nm的轴突,蓝色三角标记内径>800nm的轴突;右列,每组左列中红色箭头标记的代表性轴突放大图,箭头方向为内径测量方向,箭头长度显示内径,均为400~800nm,黄色箭头指示髓鞘与轴突外壁疏松处纤维连接情况。IC,infarct core,损伤中心区域;
(B)G-ratio统计图,对三组动物图A左列示意的CC部位轴突断面的内径(ID)和外径(OD)进行测量,并按照内径分为<400、400~800、>800nm三类进行统计,G-ratio=ID/OD;
(C)轴突断面内径(Inner diameter,ID)统计图,纵坐标为三类粗细轴突的内径值;实验数据用均数±标准误表示,**P<0.01,NS=no significance,IL-4组&PBS组;#P<0.05,##P<0.01,PBS组&Sham组;NS=no significance,IL-4组&Sham组。
图10显示了IL-4治疗能够促进MCAO后35d时周边区胼胝体有髓纤维电传导能力的恢复,其中,(A)MCAO后35d时进行CAPs试验的操作示意图,取冠状面位置为Bregma-1.58mmchu处新鲜脑片,在图示位置分别放置刺激电极(Stim)和记录电极(Rec),当两者间距离为0.9mm时,能够检测到差异;
(B)给予3mA电刺激记录电极在图A位置处记录到的N1和N2示意图,分别沿CAPs的起始点连线中点向过波谷顶点的基线平行线做垂线,该垂线段长度为N1或N2的振幅,黑色垂线段,N1振幅,蓝色垂线段,N2振幅;
(C)刺激电流为3mA且记录电极距ci刺激电极0.9mm时记录到的N1和N2振幅统计图,左,N1振幅统计图,右,N2振幅统计图,纵坐标表示振幅;
(D)N1和N2振幅测算方式,A、B两点分别为N1的起点、终点,D点为N1波峰;B、C两点分别为N2的起点、终点,E点为N2波峰,N1与N2振幅计算公式如图所示;
实验数据用均数±标准误表示,*P<0.05,NS=no significance,IL-4组&PBS组;#P<0.05,PBS组&Sham组。
图11显示了IL-4治疗能够抑制急性缺血性脑损伤后梗死周边皮层、纹状体M1型小胶质细胞的激活,
其中,(A)MCAO后7d、14d、35d时三组动物CTX和STR梗死周边区CD16+Iba-1+的M1型小胶质细胞表达情况,绿色为CD16+细胞,红色为Iba-1+细胞,黄色为二者共标的M1型小胶质细胞,白色虚线为参照相邻层面MAP-2染色中梗死区域而勾出的周边区与未损伤区的边界;
(B)CD16+Iba-1+的M1型小胶质细胞在CTX(上图)和STR(下图)个数统计图,纵坐标为每mm2面积内M1型小胶质细胞个数;
实验数据用均数±标准误表示,*P<0.05,**P<0.01,***P<0.001,IL-4组&PBS组;##P<0.01,##P<0.001,PBS组&Sham组。
图12.IL-4治疗能够促进急性缺血性脑损伤后梗死周边皮层、纹状体M2型小胶质细胞的激活,其中,
(A)MCAO后7d、14d、35d时三组动物CTX和STR梗死周边区CD206+Iba-1+的M2型小胶质细胞表达情况,绿色为CD206+细胞,红色为Iba-1+细胞,黄色为二者共标的M2型小胶质细胞,白色虚线为参照相邻层面MAP-2染色中梗死区域而勾出的周边区与未损伤区的边界;
(B)CD206+Iba-1+的M2型小胶质细胞在CTX(上图)和STR(下图)个数统计图,纵坐标为每mm2面积内M1型小胶质细胞个数;
实验数据用均数±标准误表示,***P<0.001,IL-4组&PBS组;##P<0.01,##P<0.001,PBS组&Sham组。
具体实施方式:
实施例1
1 实验材料和方法
1.1 实验动物与分组
清洁级成年雄性C57/BL6鼠(由中科院动物中心提供),8~10周龄,25-28g。术前动物在本实验室动物房饲养2~3天,自由饮食,室温20-22℃,每日光照12h/黑暗12h,使动物适应环境。将小鼠随机分为假手术组(sham组)、MCAO+PBS治疗对照组(PBS组)、MCAO+IL-4治疗组(IL-4组),侧脑室注射给药:采用皮下植入渗透压依赖注药泵(osmotic pump,1007D, )在MCAO后1d-9d持续给药(IL-4浓度为5ng/μl,共计500ng);鼻饲给药:MCAO后0d~5d,50μg/kg/d。侧脑室给药系列实验为每组10-13只行感觉运动、学习记忆神经功能测评,检测至术后35d。其中6只组织学染色,余下4-7只取相邻层面脑片分别做复合动作电位电生理、电镜实验;另取一批小鼠随机分为上述三组,每组10只,分别于术后7d、14d灌注、取脑、切片,结合35d切片,用于免疫组化染色实验。
1.2 模型制备
脑缺血动物模型(MCAO):用线栓法制备雄性8~10周C57/BL6小鼠大脑中动脉缺血再灌注模型。用1.5%异氟烷麻醉后,仰卧固定,颈部做约3cm正中切口,钝性分离甲状腺至两侧,钝性分离,暴露右侧胸锁乳突肌和胸骨舌骨肌间的三角区。分离颈内动脉至鼓泡,双极电凝器电凝甲状腺上动脉后,用动脉夹暂时夹闭颈总动脉和颈内动脉,在颈外动脉远心端剪一小口,将直径为0.23mm的8号线栓插入颈外动脉,彻底剪断颈外动脉远心端,将颈外动脉残端牵向外下方,使之与颈内动脉呈一条直线,轻柔缓慢地线栓将向前推进至遇阻力,将线栓与颈外动脉共同结扎以固定线栓,松开动脉夹,缝合切口。此时封闭了大脑中动脉出口,阻断了大脑中动脉的血流,制成MCAO模型。阻断60分钟后,暴露颈部切口,缓慢拔出线栓实现再灌注。
缺血期动物的脑血流、血气、体温等生理参数都可能影响实验结果,所以对实验小鼠进行围缺血期上述生理指标监测。动物在吸入麻醉状态下,右侧卧位,暴露左侧颞骨,生物胶 水将脑血流检测光纤固定于大脑中动脉处,待胶水凝结,用于脑血流监测。小心翻转动物至仰卧位,取左侧腹股沟切口,分离股动脉,将PE10硅胶管置入股动脉,在置入线栓前20min从股动脉采样测动脉血气。术中体温用肛温探头连续监测,并维持动物肛温在37±0.5。
1.3 神经行为学监测
1.3.1 角落实验(Corner Test)
对小鼠进行角落实验,以评估其感觉运动功能的缺损:将小鼠置于300的夹板入口,使其自行向角落前进。在小鼠前进至夹角顶端时,会向左或向右转向,记录下转向的方向,然后将小鼠重新置于夹板入口,重复以上步骤。每个小鼠重复以上步骤10次,计算向左转向的次数作为角落实验的评估指标。
1.3.2 Rotarod test(转棒实验)
在转棒上保持平衡需要本体觉、位置觉及微调运动能力。该测试要求小鼠在匀速旋转杆上保持平衡,并记录其在转棒上的运动时间及跌落时间得转棒旋转速度。在测验的时候,把小鼠放在他们自己的笼子里,让它们在测试房间内适应15分钟(适应环境阶段)。整个测试是由间隔15分钟的三次试验组成。在术前要进行连续三天的训练,直到每只小鼠能够在仪器上运动达400s。仪器设定为在5分钟内从20转/分钟加速到40转/分钟,然后以40转/分钟的恒速运转,总共持续500秒。在滚轴从20转/分钟加速到40转/分钟后,记录每只小鼠在轴上保持不落的时间。间隔15分钟后,进行第二次测试,一共记录三次试验结果。
1.3.3 Grid walking and footfault test(错步实验)
将小鼠鼠放于不锈钢架上,此架上有2cm×2cm的正方形小栅栏,钢架长40cm,宽20cm上,距离地面50cm;分别计数动物3分钟内左前肢和左后肢在栅栏上走的总步数,同时分别计数动物左前肢和左后肢没有踏在栅栏上而踏空了的步数作为踏错步数。错步率=踏错步数/总步数×100%。
1.3.4 Morris water maze(水迷宫测试)
水迷宫分为四个象限,将一圆形平台固定于水迷宫的第一象限,低于水面1cm的深度,实验分两个阶段,第一阶段——学习期(MCAO后第23-27天):将实验动物分别于第二、三、四象限的指定位置随机放入水中,动物入水时面向水池壁,由安装于水迷宫正上方的摄像头监控动物60s内在水中的运动情况,包括游泳速度、经过各象限的时间和距离、到达平台的潜伏期等指标。如果动物在60s内未能到达平台,由实验操作人员引导其找到平台,动物到达平台后,让其在平台上滞留30s后再进行后续实验。第二阶段——记忆期(MCAO第28天):将平台从第一象限移走,把经过前一阶段训练的动物于同样的位置随机放入水中,动物入水 时面向水池壁,由安装于水迷宫正上方的摄像头监控动物60s内在水中的运动情况,包括游泳速度,经过各象限的时间和距离,经过之前平台所在位置的次数等指标。
1.4 切片制备
分别将颅脑外伤后24h,35d的动物麻醉,用生理盐水和4%多聚甲醛溶液灌注固定,然后将固定后的脑组织置于30%的蔗糖溶液中脱水,用冰冻切片机冠状切取层厚为25μm的脑片,对35d实验动物组,在前联合与海马层面间,每间隔十张提取一张用于CV染色,分析梗塞体积。其余切片置于脑片储存液中,置于-20℃冰箱保存待用。
1.5 组织免疫荧光化学
1)漂洗:将从脑片储存液中挑出的脑片放入1xPBS中漂洗3次,每次10min;
2)破膜:漂洗后的脑片置于1%PBST中,室温静置15min
3)封闭:破膜后的脑片置于封闭液(10%羊血清或者5%驴血清)中,室温封闭1h;
4)一抗:完全吸去封闭液,加入用抗体稀释液(0.3%PBST)稀释至工作浓度的一抗,4℃过夜;
5)二抗:吸去一抗稀释液,用0.3%PBST漂洗3次,每次10min,加入用抗体稀释液稀释至工作浓度的荧光标记的二抗,避光,室温1hr;
6)漂洗:吸去二抗稀释液,用0.3%PBST漂洗3次,每次10min,全程避光;
7)贴片和封片:将染好的脑片贴于载玻片(未被明胶或者甘氨酸包被)上,稍干燥后用DAPI Fluoromount-G封片,避光,4℃保存,待观察。
1.6 复合动作电位的记录
胼胝体复合动作电位的记录参照Reeves等人的方法,先用5%异氟烷将小鼠诱导麻醉,用振动切片机制脑冠状切片,450μm层厚,然后将脑片放置在pH7.4的人工脑脊液中,在室温下将脑片置于人工脑脊液(ACSF)中孵育1h后转移至记录箱,记录箱周围用人工脑脊液(22℃)进行循环灌注,速率保持为3–4mL/min;为有效区分有髓鞘CAPs(N1)和无髓鞘CAPs(N2),CAPs须在室温(22℃)下记录;将一个双极钨丝刺激电极(电极间距约为0.5mm)放置在扣带回下方的胼胝体神经纤维开始投射的部位上,此处距离中线约1mm.将细胞外玻璃记录电极(当充满人工脑脊液时其尖端电阻为1–3mega-Ω)放置在距离刺激电极约0.444mm处的同侧远端胼胝体(或对侧扣带回下方的胼胝体)上。用频率为100kHz的Axoclamp 2b放大器记录诱发的复合动作电位,用标准化的输入–输出曲线测量每个脑片每一次诱发的复合动作电位的振幅,在10个均等的电流增幅(持续时间为200μsec,频率为0.1Hz)中通 过增加刺激脉冲的强度从而产生不同的振幅,强度变化范围为临界值(CAPs第一次被观察到时的电流)到最大值。为检验不应期,用最大电流水平(取决于记录脑片的输入–输出曲线)和成对脉冲刺激,使脉冲间隔以0.5msec的增幅从3msec增大到到12msec。然后,在距离刺激电极0.667mm,0.889mm,1.111mm处的共4个记录位点上,依次放置记录电极(Rec)并及时记录,一般情况下,每个位点给予3次电刺激。
1.7 脑组织超微结构观察
为检测急性脑中风后损伤周边区胼胝体中有髓和无髓纤维的损伤修复情况,在颅脑外伤后35d,常规处理小鼠,冰上分离,切取脑损伤周边区胼胝体组织,浸润在固定液内修整,制成1mm3的组织块,放入预冷的戊二醛中固定,后经脱水,浸透,包埋,超薄切片,染色等,制成透射电镜观察样品,electron microscope(CM120,Philips)对样品进行超微结构观察,其有髓纤维的脱髓鞘情况和无髓纤维的破坏程度。
1.8 ELISA测定脑内IL-4含量
1)包被孔板
包被孔板:将包被抗体(Capture Antibody)原液480μg/mL加入至0.5ml PBS溶液中,制备成工作浓度为4.0μg/mL的PBS溶液,立即使用排枪将该工作液加入新开封的96孔板中(100μl/孔),用保鲜膜封板,室温过夜;
洗板:将96孔板上面朝下,将包被工作液甩出,使用排枪加入洗涤液(Washing Buffer,300μl/孔)洗涤三次,每次10min,注意洗涤需彻底,将液体甩出后,还需将板面向下,在吸水纸上用力叩击,将孔内残余液体尽可能清除干净;
封闭:将溶剂稀释液(Reagent Diluent,200μl/孔)加入孔中,室温孵育1h;
洗板:重复第2步;
2)标准品的稀释
取130ng/mL鼠源IL-4标准品原液稀释在0.5ml溶剂稀释液(Reagent Diluent)中,在1000μl该液(浓度为1000pg/ml)中取出500μl,做对半稀释(浓度为500pg/ml),并依次对半稀释5次,依次得到浓度为250pg/ml、125pg/ml、62.5pg/ml、31.3pg/ml、15.6pg/ml的标准液,留做7个点得标准曲线;
3)蛋白检测
加样:将样本和标准液分别加入到包被好的96孔板中(100μl/孔),并做副孔,用保鲜膜封板,室温下孵育2h;
洗板:重复第2步;
检测:将检测抗体(Detection Antibody)原液36μg/mL加入至1.0ml稀释液中,制备成工作浓度为600ng/mL的检测稀释液,立即使用排枪将该工作液加入新开封的96孔板中(100μl/孔),用保鲜膜封板,室温2h;
洗板:重复第2步;
HRP标记:使用排枪,将Streptavidin-HRP加入至孔中(100μl/孔),用保鲜膜封板,室温2h,注意避光;
洗板:重复第2步;
显色:使用排枪,将R&D Systems公司的显色液加入孔中(100μl/孔),室温2h,注意避光;
终止反应:将终止液(2N HCL,100μl/孔)加入孔中,并轻弹板底使液体混匀;
立即使用酶标仪测定各孔吸光值,并结合标准曲线,计算样本中
IL-4的微量浓度。
1.9 数据处理及统计分析
利用SPSS 16.0统计软件分析处理数据,以均数±标准误表示。单因数方差分析(one way ANOVA)比较各组之间的差异,两两比较用Scheffé法,P<0.05为显著性界值。
结果显示:
2.1.急性缺血性脑中风后脑室注射IL-4治疗能够促进远期神经功能恢复
2.1.1 急性缺血性脑中风后脑室注射IL-4治疗能够促进远期感觉运动功能的恢复
感觉运动功能是脑最基本的神经功能,更是影响ABI患者恢复期及更远期生活质量的基本因素,同时,也是检测、评估ABI后神经功能恢复程度的金标准。我们使用错步实验(Foot fault test)和转棒实验(Rotarod test)同时检测感觉运动功能;
通过检测小鼠的错步率(图1A)和转棒持续时间(图1B),结果显示:MCAO造成了小鼠的感觉运动功能受损,前后肢的错步率持续至术后35天显著增加;而经IL-4治疗后,小鼠的运动功能得到显著改善,其前肢和后肢的错步率显著减少,在术后21天已逐步恢复到正常水平。检测运动协同功能的转棒实验也显示了同样的实验结果。
2.1.2 急性缺血性脑中风后脑室注射IL-4治疗能够促进远期学习记忆能力的恢复
学习记忆能力是脑的高级神经功能,ABI患者常在远期出现一定程度的认知障碍,故对学习记忆能力的评估也是检测ABI后高级神经功能恢复程度的又一重要指标。我们采用水迷宫(Morris water maze)检测动物学习能力和记忆能力;
在MCAO后23d~27d期间,每天对三组小鼠进行找寻平台的训练,记录并计算小鼠每天找 到平台的潜伏期,绘制成曲线图(图2A),在第28d时,移去平台,检测记忆能力相关指标(图2B)。图中可见,MCAO导致小鼠学习记忆功能下降,表现为找到平台潜伏期延长,平台象限所耗路程、时间和穿越平台次数均减少;而IL-4鼻饲治疗能够改善MCAO造成的远期感觉运动功能和学习记忆能力的损伤,明显缩短潜伏期,也使得小鼠在平台象限消耗的路程、时间和穿越平台次数由增加趋势。同时,三组小鼠的游泳速度(Swimming velocity)没有明显差异,证实了实验结果不受游泳速度干扰,具有可靠性。
2.2.脑室注射IL-4治疗引起的远期神经保护作用并不是因为缩小梗死体积
神经保护的机制无外乎灰质保护、白质修复两类,为了探究上述神经保护作用的机制,我们又进行MAP-2标记的梗死范围的测定(图3A)。结果显示,MCAO后IL-4脑室注射后的梗死面积(图3B)和梗死体积(图3C)与PBS组无显著差异,提示脑室注射IL-4的神经保护作用并非通过缩小梗死体积。
2.3.急性缺血性脑中风后鼻饲nano-IL-4能够促进远期神经功能恢复
为进一步肯定以上结论,并使IL-4的给药更接近临床,我们采用鼻饲nano-IL-4的治疗方法,进行平行验证实验。鼻饲后,IL-4能够通过嗅神经漏孔进入中枢,对行为学干扰小、无创伤、易操作、能够在MCAO后即刻给药,
2.3.1 ELISA方法确定鼻饲nano-IL-4治疗剂量
根据脑室注射给药的计量,以50μg/kg剂量鼻饲给药,并检测脑内IL-4的浓度及浓度维持情况:野生型(wild type,WT)小鼠进行一次鼻饲,分别于鼻饲后12h、1d、2d、3d取新鲜脑组织,提取总蛋白,使用ELISA检测单位总蛋白中IL-4含量(图4A),结果显示,给予50μg/kg的nano-IL-4在CTX(图4B)、CC(图4C)和STR(图4D)的浓度显著提高,并能维持1~2d。为达到脑室给药相同效果,则该鼻饲剂量连续给药6d。
2.3.2 急性缺血性脑中风后脑室注射nano-IL-4治疗能够促进远期感觉运动功能的恢复
采用角落实验(corner test)和转棒实验(rotarod test)对三组小鼠进行感觉运动功能评估(图5A、B)。结果显示,MCAO损伤导致小鼠感觉运动功能下降,角落实验中的左转次数显著升高,转棒时间明显下降,而IL-4治疗促进了感觉运功功能的恢复,在损伤14天后左转次数明显减少、转棒时间显著延长。
2.3.3 急性缺血性脑中风后鼻饲nano-IL-4治疗能够促进远期学习记忆能力的恢复
同理,使用水迷宫实验检测小鼠学习记忆功能(图5C、D)。MCAO导致小鼠学习记忆功能下降,表现为找到平台潜伏期延长、平台象限路程和穿越平台次数均减少;而IL-4鼻饲治疗能够改善MCAO造成的远期感觉运动功能和学习记忆能力的损伤,使潜伏期缩短、小鼠平台 象限路程和穿越平台次数增加。
2.4 急性缺血性脑中风后鼻饲nano-IL-4治疗引起的远期神经保护作用也并不是因为缩小梗死体积
为进一步明确IL-4的神经保护作用是否通过缩小梗死体积,对鼻饲nano-IL-4实验的三组小鼠进行了MAP-2标记梗死范围的测定(图6A),图中显示,MCAO后鼻饲nano-IL-4的梗死面积(图6B)和梗死体积(图6C)与PBS组无显著差异,提示鼻饲nano-IL-4的神经保护作用亦并非通过缩小梗死体积。
由于IL-4治疗并未减轻小鼠缺血后梗死体积,但却有效改善了缺血损伤后的神经功能转归,而白质的损伤对神经功能转归的影响要比灰质贡献更大,本实验进一步观察IL-4是否改善了缺血后白质的损伤;
2.5 IL-4治疗通过促进急性缺血性脑中风后远期的白质修复机制而产生神经保护作用
白质是神经元轴突汇集区域,脑内的皮层(CTX)、胼胝体(CC)、纹状体(STR)区域均有白质的分布,而其中CC区域是脑最内主要的白质神经传导束富集区,本实验从形态学、功能学两个角度对上述区域的白质修复情况进行观察;
2.5.1 IL-4治疗能够改善急性缺血性脑损伤导致的远端胼胝体的萎缩
为了评估损伤周边区胼胝体的宽度,本实验选取MCAO后35d时相同层面的脑片进行MBP染色标记(图7Aa1-3),MBP(myelin basic protein,髓鞘碱性蛋白)作为成熟髓鞘中高表达的特异性蛋白,可以用于标记健康的白质区域,图中可见,MCAO损伤导致远端胼胝体萎缩,表现为PBS组的第8、9、10段胼胝体(图7Aa4-6,损伤区脑室上方远端胼胝体)宽度显著降低,而IL-4治疗能够显著改善这种萎缩,使得该部位胼胝体宽度较PBS组明显增高图(图7B)。
2.5.2 IL-4治疗能够促进急性缺血性脑损伤后的梗死周边皮层、纹状体和近端胼胝体内髓鞘蛋白的修复
通过两种髓鞘蛋白MBP和SMI-32在该区域的表达,检测梗死周边区近端的白质修复情况(图8A),髓鞘碱性蛋白(myelin basic protein,MBP)是成熟的髓鞘内表达的特异性蛋白,白质损伤时会脱失;SMI-32标记非磷酸化神经丝的特异性蛋白,正常情况下表达在神经元胞体和突起,髓鞘损伤后暴露,可在轴突中有表达,结果显示,MCAO损伤后髓鞘成熟蛋白在CTX、CC、STR区域表达降低,表现为PBS组的MBP减弱,SMI-32增强,MBP/SMI-32比值显著降低;而IL-4治疗能够显著促进MCAO损伤后脑内成熟髓鞘蛋白的表达,使得上述三个区域的MBP/SMI-32比值明显上升(图8B、C)。
2.5.3 IL-4治疗能够改善急性缺血性脑损伤后周边区胼胝体的脱髓鞘病变,促进髓鞘修复
进一步更直观的检测髓鞘修复的情况,使用了电镜(electron microscope,EM)观察图8A所示的近端胼胝体的有髓纤维,如图9A所示,将有髓纤按内径分为<400nm轴突(绿色三角标记)、400~800nm轴突(红色箭头和三角标记)、>800nm轴突(蓝色三角标记),并分别计算G-ratio=内径(ID/外径(OD),结果显示:三组间的不同粗细轴突内径大小无差异,说明分组测量的轴突粗细一致(图9C),MCAO组内径<800nm轴突的髓鞘层与轴突外壁分离区的纤维网状髓鞘结构缺失(图9A PBS组黄色箭头),其髓鞘比Sham组变薄,G-ratio值较Sham组明显增高(图9B),但在这种损伤条件下,MCAO对>800nm轴突(图9A中蓝色三角所示)并未造成脱髓鞘病变;而IL-4治疗后疏松的髓鞘层与轴突外壁间区域出现了少许纤维连接结构(图9A IL-4组黄色箭头),并能够显著改善内径为400-800nm轴突的脱髓鞘病变,使G-ratio值显著降低,对<400nm轴突的脱髓鞘现象也有改善的趋势(图9B)。
2.5.4 急性缺血性脑损伤后周边区经IL-4治疗后修复的胼胝体电传导功能也有所增强
为了在功能上进一步确定IL-4的白质修复作用,使用复合动作电位记录(Compound action potentials,CAPs)的方法(图10A),利用有髓纤维(myelinated fiber,N1)传导快于无髓纤维(unmyelinated fiber,N2)的原理,对三组小鼠MCAO后35d时梗死周边区胼胝体的N1和N2的进行区分和统计(图10B)。如图10D所示统计计算各组小鼠胼胝体合动作电位传导幅度,结果显示(图10C):MCAO损伤使PBS组胼胝体传导能力显著降低,表现为,当给予3mA电流刺激且Stim和Rec间距离为0.9mm时,N1振幅下降,N2振幅也有降低趋势;而IL-4治疗促进了有髓纤维传导能力的恢复,表现为,在上述记录实验条件下,IL-4组N1振幅较PBS组明显升高,但N2振幅无明显差异,说明IL-4的白质修复作用主要通过促进有髓纤维传导功能的恢复。
2.6 急性缺血性脑中风后IL-4治疗能够调节小胶质细胞的激活:抑制M1型小胶质细胞表达,促进M2型小胶质细胞表达
检测7d、14d、35d时梗死周边区的小胶质细胞激活极性,明确IL-4的白质修复作用是通过诱导M2型小胶质细胞的激活实现。
2.6.1 IL-4治疗能够抑制急性缺血性脑损伤后梗死周边皮层、纹状体M1型小胶质细胞的激活
对三组小鼠的CTX、STR周边区CD16+Iba-1+标记的M1型小胶质细胞计数统计,结果显示MCAO损伤使得PBS组小鼠的M1型小胶质细胞过度激活,胞体胀大、分支变粗增多、成团 成簇聚集,数目持续增多至术后35天;而IL-4治疗抑制了M1型小胶质细胞的过度激活,降低其表达数目,使M1型小胶质细胞数目在CTX和STR区域分别于14天、7天后显著下降。
2.6.2 IL-4治疗能够促进急性缺血性脑损伤后梗死周边皮层、纹状体M2型小胶质细胞的激活
对三组小鼠CTX、STR的周边区CD206+Iba-1+标记的M2型小胶质细胞计数个数,结果显示,MCAO后PBS组小鼠的M2型小胶质细胞在CTX和STR的激活时程均较短,7天后开始下降,直至14天降低到术前水平;而IL-4治疗延长了STR区域M2型小胶质细胞激活的时间窗,使其数目缓慢降低,表达延长至术后35天。
实验结果表明,IL-4能够调节缺血性脑中风后梗死周边区小胶质细胞的激活,抑制M1型小胶质细胞过度激活,促进M2型小胶质细胞在损伤后中期、远期的表达,从而促进白质的修复,改善缺血损伤后神经功能转归。IL-4可用于制备治疗中枢神经系统白质损伤相关疾病的药物。
- 还没有人留言评论。精彩留言会获得点赞!