一种基于氧自由基的靶向功能材料及其应用的制作方法
本发明涉及药物技术领域,具体地说就是一种基于氧自由基原理的靶向功能材料及其应用。
背景技术:
肿瘤仍是世界上最严重的疾病之一,每年有一千万的新发病例。据统计在我国恶性肿瘤发病率为235.23/10万(男性268.65/10万,女性200.21/10万),中国人口标化率(中标率)184.58/10万。全国恶性肿瘤死亡率为148.81/10万(男性186.37/10万,女性109.42/10万)。虽然现今已经有很多抗肿瘤药物,但大多数药物在体内的分布不具选择性,或是水溶性差,如何有针对性的对肿瘤进行诊断并治疗是很重要的。近年来随着纳米技术的突飞猛进,带来了诊断与分子靶向肿瘤治疗技术的大发展。许多科学家以纳米材料作为抗肿瘤药物载体,用于疾病治疗,而在这些治疗过程中过,依靶向给药、可控释药为主要的药物开发和治疗研究的重点。
肿瘤靶向分为被动靶向和主动靶向,前者通过实体肿瘤的EPR(enhanced permeability and retention)效应实现,后者利用抗体与抗原或肿瘤相关受体的配体与受体间的特异性结合来实现,能够更好的将治疗剂量控制在尽可能低的范围内,以降低对非靶点的毒性,又能够将足够剂量的药物输送到病灶取得治疗效果。
目前为止,已发现的具有肿瘤靶向功能的配体主要有:抗体、表皮生长因子、促黄体激素释放激素(LHRH)、α2-糖蛋白、转铁蛋白、叶酸等,他们都能起到很好的靶向效果,但是他们大多价格昂贵,不易保存,容易变性而且他们中只能对特定的肿瘤进行靶向,例如:利妥昔单抗的靶点为CD20不但价格十分高昂而且只能用于非霍奇金淋巴瘤靶向治疗;叶酸不仅对肿瘤部位有靶向作用,还对炎症也有靶向作用。因此研究新的具有肿瘤靶向功能的配体有着重要的意义。
自由基是人体进行生命活动时所产生的一种活性分子(氧化的产物)。正常情况下,自由基具有调节细胞间的信号传递和细胞生长、抑制病毒和细菌的作用。但如果体内自由基过多,则可引起蛋白质(蛋白质食品)、核酸(DNA)变性,导致细胞和组织器官损伤,诱发各种疾病,并加速机体衰老。自由基ROS是一种缺乏电子的物质(不饱和电子物质), 进入人体后到处争夺电子,如果夺去细胞蛋白分子的电子,使蛋白质接上支链发生烷基化,形成畸变的分子而致癌。该畸变分子由于自己缺少电子,又要去夺取邻近分子的电子,又使邻近分子也发生畸变而致癌。这样,恶性循环就会形成大量畸变的蛋白分子。基因突变,形成大量癌细胞,最后出现癌症。而当自由基或畸变分子抢夺了基因的电子时,人就会直接得癌症。
四甲基哌啶TEMPO及其衍生物具有良好的顺磁性,已经成功的在生物化学领域用作电子自旋标记物,并取得了良好的标记效果;而且它还具有很强的捕获自由基的能力,是一种重要的自由基捕获剂。目前已有很多研究表明自由基和肿瘤的形成有着极为密切的关系,癌细胞在形成肿瘤的过程中,快速无节制的生长需要大量血液输送营养物质和氧气,引发血管生长过度丰富而杂乱,肿瘤的生长过程中,始终都伴随各类氧自由基的产生。而TEMPO及其衍生物具有很强的捕获自由基的能力,因此TEMPO及其衍生物可能成为一个潜在的靶向配体。
技术实现要素:
本发明的目的在于提供一种基于氧自由基原理且具有靶向功能的材料及其应用。
本发明的目的是通过以下技术方案来实现的:
一种基于氧自由基的靶向功能材料,具体为基于氧自由基原理且具有肿瘤靶向功能的配体,配体的结构特征为:含有氮氧自由基的哌啶类化合物,例如:2,2,6,6-四甲基哌啶-氮-氧化物(A);(4-氨基-2,2,6,6-四甲基哌啶-1-氧自由基;4-氨基-TEMPO(B);
一种基于氧自由基原理且具有靶向功能配体的制备方法,用一定方法先制备得到具有表面改性的载体,并将表面改性载体的特殊基团和TEMPO或其衍生物通过化学反应,用化学键连接起来,构成外面含有裸露TEMPO基团的抗肿瘤药物的载体;其合成示意步骤如化学式I;
所述的一定方法是指分子自组装法,高温沉淀法,热分解法,超声法中的一种。
所述的抗肿瘤药物的载体(A)为:纳米胶束(其粒径为1-1000nm)、纳米颗粒(其粒径为1-1000nm)、纳米囊泡(其粒径为1-1000nm)、纳米管(其粒径为1-1000nm)或一些修饰后保持药物本身性质的药物分子中的一种或几种。
所述的X为羧基(-COOH),氨基(-NH2),N-甲基丙烯酰氧琥珀酰亚胺(-NAS)中的一种;最好是-NAS基团,由于它能够很容易与不同的功能配体发生连接,如叶酸、荧光素、氮氧自由基。
所述的Y为氨基(-NH2),羧基(-COOH)中的一种,其中氨基优先。
所述的表面改性的载体是指含有荧光标记物质(例如:量子点(QDS),异硫氰酸荧光素(FITC),羟基荧光素(FAM),四氯荧光素(TET),菁染料(cy5.5)等)的载体中的一种或几种。
所述的表面改性载体的特殊基团为氨基,羧基,N-甲基丙烯酰氧琥珀酰亚胺(-NAS)基团中的一种或几种。
所述的TEMPO或其衍生物为氨基化、羧基化或其他化学方法修饰后的TEMPO或其衍生物,将TEMPO基团裸露载体在外面是为了使其能更好的与肿瘤及其环境接触达到更好的靶向效果。
所述的化学反应是指能使表面改性的纳米载体与TEMPO或其衍生物通过化学键连接起来,且不改变原有材料以及配体性能的化学反应,如酸胺缩合反应、酰胺缩合等的一种或几种。
一种基于氧自由基原理且具有靶向功能的配体靶向性能的验证
使用多功能活体成像系统(Coliper IVIS Lumina II)对荷瘤动物静脉单剂量注射生理盐水、无靶向配体纳米载体水溶液和具有靶向配体纳米载体水溶液后的动物体内分布进行实时的活体成像检测,在经过活体成像后对裸鼠进行解剖,取出其组织进行离体荧光成像。
所述的动物活体成像系统(In-vivo Imaging System),主要用于大鼠、小鼠等小动物的生物发光成像(bioluminescence imaging,BLI)和生物荧光成像(biofluorescence imaging,BFI),系统还兼有X-ray成像和放射性同位素成像等功能,可以在活体小动物内对标记对象进行直接而持续的观察。
所述的荷瘤是指接种癌细胞(人乳腺癌(MCF-7)细胞、人颈癌(Hela)细胞、人肺癌(A549)细胞等)后形成的实体瘤,实体瘤的体积要达到50mm3以上才可以。
所述的荷瘤动物是指用于实验且形成实体瘤的动物,如小鼠、兔子等,实验室中最常用的是裸鼠。
1.一种具有TEMPO基团或其衍生物的纳米载体的合成方法,其具体步骤如下:
取表面改性的纳米载体与TEMPO或其衍生物以摩尔比100∶0.01到100∶1的比例于圆底烧瓶中,加入20mL的溶剂,在20HZ-100HZ功率下,超声使其完全溶解,在0~360℃下发生化学反应且反应0.5~48h,待反应完全后将反应液用预处理过的透析袋(截留分子量:8000~14000g/mol)透析2-48h来除去有机溶剂、未反应的TEMPO或其衍生物以及其他的一些副产物,除杂后用不改变所得材料性能的方法来得到干燥的具有TEMPO基团的纳米载体;
2.一种具有TEMPO基团或其衍生物的纳米载体的靶向性能的验证,其具体步骤如下:
(1)将荷瘤小鼠的活体成像实验分为三组,每组3头小鼠。实验组每头小鼠以荧光试剂为1mg/Kg体重单剂量尾静脉注射给药。第一组3头小鼠的编号以及处理方式分别为:I-A:阴性对照组,生理盐水。
I-B:阳性对照组,无TEMPO组。
I-C:实验组,含TEMPO组。
第二组、第三组为第一组的平行组,6头小鼠的编号为II-A、II-B、II-C、III-A、III-B、III-C,处理方式同第一组。每组注射完成后,将小鼠由左至右依次摆放在样品台上,取不同时间点使用多功能活体成像系统(Coliper IVIS Lumina II)对小鼠进行活体成像,设置仪器激发波长为640nm,700nm处收集发射光,观察体内荧光分布情况来验证其靶向性。
(2)为了对活体成像结果的准确性进行表征,在经过尾静脉注射并活体成像后对裸鼠进行解剖,取出其组织进行离体荧光成像,来验证其靶向性。将对照组裸鼠同时处死,取其组织作为对照。组织的摆放按照从以上到下的顺序:心、肝、脾、肺、肾、肿瘤。
一种基于氧自由基的靶向功能材料具有靶向功能。
一种基于氧自由基的靶向功能材料在治疗肿瘤部位的靶向性材料中的应用。
一种基于氧自由基的靶向功能材料在治疗炎症部位的靶向性材料,治疗动脉硬化的靶向性材料或者治疗胃炎的靶向性材料中的应用。
一种基于氧自由基的靶向功能材料在治疗消化性溃疡的靶向性材料,治疗脑的再灌流性损害材料或者治疗胃炎材料中的应用。
一种基于氧自由基的靶向功能材料在治疗消化性溃疡材料,治疗原发性肾小球疾病材料或者治疗糖尿病材料中的应用。
一种基于氧自由基的靶向功能材料在治疗支气管哮喘材料,治疗肺气肿材料或者治疗震颤麻痹症材料中的应用。
与现有技术相比,本发明的积极效果是:
本发明的优点在于提供了一种新的具有肿瘤靶向功能配体,而且对氧自由基敏感,并可方便通过EPR进行跟踪监测。它不但便宜廉价、易保存,也可以与多种纳米载体进行连接,还可以实现同时靶向给药和肿瘤检测。
【附图说明】
图1以基础共聚物开发出功能模块组成仓储式功能模块库,根据需要选取相应的功能模块自组装成功能胶束。
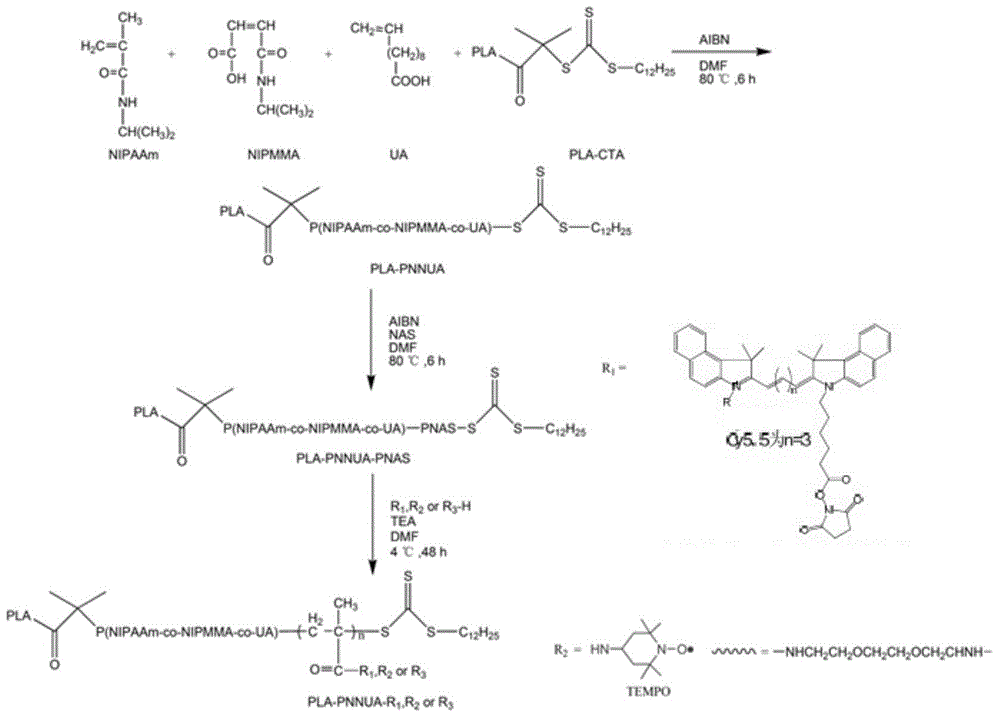
图2基础共聚物PLA-PNNUA-PNAS的合成及其两种功能模块PLA-PNNUA-cy5.5和PLA-PNNUA-TEMPO的合成。
图3基础共聚物PLA-PNNUA-PNAS的结构(A)与1H NMR谱(B)
图4多功能胶束的电子顺磁共振图谱。
图5具有cy5.5荧光染料的多功能胶束的荧光图谱。
图6多功能胶束的透射电镜照片QDs@PLA-PNNUA(A),QDs@PLA-PNNUA-TEMPO(B),PLA-PNNUA-Cy5.5(C)和PLA-PNNUA-Cy5.5(TEMPO)(D)
图7用cy5.5作为荧光探针对荷MCF-7荷瘤小鼠的活体成像(图7A)与组织照片(图7B)。
图8包埋油溶性QDs的多功能纳米胶束的荧光图谱
图9用QDs作为荧光探针对荷MCF-7荷瘤小鼠的活体成像(图9C)与组织照片(图9D)。
【具体实施方式】
以下提供本发明一种基于氧自由基原理且具有靶向功能的配体及其应用的具体实施方式。
实施例1
TEMPO对肿瘤部位的靶向性验证(1):
一.基础共聚物PLA-PNNUA-PNAS的合成
第一步,向烧瓶中加入一定比例的N-异丙基甲基丙烯酰胺、N-异丙基马来酰胺酸、10-十一烯酸,DMF(二甲基甲酰胺)溶解。加入AIBN(偶氮二异丁腈)和聚乳酸大分子RAFT引发剂。通氮气除氧。80℃反应6小时。反应结束后将反应液倒入无水乙醚中,将得到的沉淀离心收集,清洗后室温真空烘干,得白色粉末PLA-PNNUA。
第二步,以PLA-PNNUA作为RAFT引发剂,与单体NAS(N-甲基丙烯酰氧琥珀酰亚胺)制备基础共聚物PLA-PNNUA-PNAS。烧瓶中加入PLA-PNNUA和NAS单体,加入5mLDMF溶解,加入AIBN。通氮气除氧。80℃反应6小时。反应结束后将反应液倒入无水乙醚中,将得到的沉淀离心收集,清洗后室温真空烘干,得白色粉末PLA-PNNUA-PNAS。核磁共振氢谱(1H NMR,附图3)对PLA-PNNUA-PNAS的结构经行了表征,结果表明成功制备了环境响应基础共聚物PLA-PNNUA-PNAS。
二.肿瘤靶向PLA-PNNUA-TEMPO和荧光PLA-PNNUA-cy5.5的制备
1.TEMPO(4-氨基-2,2,6,6-四甲基哌啶-1-氧自由基)自旋标记PLA-PNNUA-TEMPO聚合物的制备
将PLA-PNNUA-PNAS与TEMPO溶于DMSO,避光反应48小时。反应液对1000mL超纯水透析24小时。冻干透析袋内的液体,得到橘红色粉末,为TEMPO自旋标记功能模块PLA-PNNUA-TEMPO。(电子顺磁共振图谱,附图4)
2.荧光PLA-PNNUA-cy5.5的制备
(1)PLA-PNNUA-NH2合成
首先将PLA-PNNUA-PNAS(0.4g)溶于5mL DMF加入圆底烧瓶。取6ml的乙二胺,慢慢滴加入烧瓶,磁力搅拌混合均匀后加入0.05mL的三乙胺,继续搅拌30分钟后将烧瓶放入4℃冰箱内避光反应48小时。反应完成后将反应液装入透析袋中,用1000mL超纯水透析24小时以除去有机溶剂、未反应的乙二胺以及其他的一些副产物。透析结束后将透析袋内的液体冻干,得到白色粉末(PLA-PNNUA-NH2)置于干燥器内待 用。
(2)PLA-PNNUA-cy5.5合成
首先将PLA-PNNUA-NH2(0.8g)溶于5mL DMSO加入圆底烧瓶。取1ml的DMSO将cy5.5完全溶解后,慢慢滴加入烧瓶,磁力搅拌混合均匀后加入0.05mL的三乙胺,在冰水浴中继续搅拌4h后将烧瓶放入4℃冰箱内避光反应48小时。反应完成后将反应液装入透析袋中,用1000mL超纯水透析24小时以除去有机溶剂、未反应的cy5.5以及其他的一些副产物。透析结束后将透析袋内的液体冻干,得到蓝色粉末(PLA-PNNUA-cy5.5)置于4℃冰箱内待用。
三.PLA-PNNUA-cy5.5胶束制备
在25mL圆底烧瓶中将共聚物PLA-PNNUA-cy5.5(10mg)和PLA-PNNUA-NAS(10mg)溶于10mL氯仿,超声分散15min后40℃减压旋蒸出去溶剂,使共聚物在圆底烧瓶的内表面形成一层薄膜。然后将圆底烧瓶置于超声波清洗器(超声功率:120W,频率:58kHz)中,用注射器缓慢加入10mL超纯水,每加2-3滴停下轻轻摇晃,使得薄膜充分被水浸润到。超纯水加完后,继续超声15min,即得纳米胶束溶液。将制备完成的纳米胶束溶液冻干保存-20℃冰箱内待用。(具有cy5.5荧光染料的多功能胶束的荧光图谱,附图5)
四.TEMPO和cy5.5一体化胶束制备
在25mL圆底烧瓶中将共聚物PLA-PNNUA-TEMPO(10mg)和PLA-PNNUA-cy5.5(10mg)溶于10mL氯仿.超声分散15min后40℃减压旋蒸出去溶剂,使共聚物在圆底烧瓶的内表面形成一层薄膜。然后将圆底烧瓶置于超声波清洗器(超声功率:120W,频率:58kHz)中,用注射器缓慢加入10mL超纯水,每加2-3滴停下轻轻摇晃,使得薄膜充分被水浸润到。超纯水加完后,继续超声15min,即得PLA-PNNUA-Cy5.5(TEMPO)纳米胶束溶液。冻干保存-20℃冰箱内待用。(具有cy5.5荧光染料的多功能胶束的电子顺磁共振图谱和荧光图谱,附图4和附图5)
五.小鼠MCF-7腋皮下接种肿瘤模型的建立
1体外细胞培养
(1)PBS缓冲液配制
在装有800mL超纯水的锥形瓶中加入8.0g NaCl,0.20g KCl,3.15g Na2HPO4.12H2O,0.24g KH2PO4,用盐酸调节溶液的pH至7.4,加水定容至1L,高温灭菌后,4℃低温保存待用。
(2)DMEM培养基的配制
配制1000mL的DMEM培养基:取DMEM培养基干粉一袋,倒入1000mL容量的容量瓶中,加入700mL超纯水,磁力搅拌溶解。然后加入1.5g NaHCO3,搅拌溶解后,加入100mL胎牛血清,青霉素-链霉素双抗液10mL,混匀后定容至1000mL,最后用0.22μm微孔滤膜无菌过滤后于4℃保存。
(3)RPMI 1640培养基的配制
配制1000mL的RPMI 1640培养基:取RPMI 1640培养基干粉一袋,倒入1000mL容量的容量瓶中,加入700mL超纯水,磁力搅拌溶解。然后加入1.5g NaHCO3,搅拌溶解后,加入100mL胎牛血清,青霉素-链霉素双抗液10mL,混匀后定容至1000mL,最后用0.22μm微孔滤膜无菌过滤后于4℃保存。
(4)细胞的体外培养
MCF-7细胞培养于DMEM培养基中,在37℃、5%CO2的细胞培养箱内培养。待细胞单层接近长满培养瓶时,用1-2mL 0.25%胰蛋白酶消化液消化,随后按1∶2的比例传代,每24h换新鲜培养基一次,过程中采用倒置显微镜观察细胞生长情况和贴壁形态。传代2-3次使细胞达到良好的生长状态,进行实验。
2裸鼠的饲养
雌性裸鼠5周龄,体重在16g左右,裸鼠在屏蔽的操静台饲养,温度控制在28℃左右,湿度在40%左右,饲养条件完全按照裸鼠饲养条件进行饲养。
3小鼠MCF-7腋皮下接种肿瘤模型的建立
取雌性裸小鼠(5周龄)9头,用无叶酸啮齿动物饲料饲养于无病原体环境中。取无菌培养、传代、处于对数生长期MCF-7细胞,在已灭菌的离心管中用无菌3ml培养基稀释成细胞悬液,接种于小鼠右腋皮下,每只小鼠接种0.25ml,建立小鼠MCF-7腋皮下接种肿瘤模型。待移植实体瘤的体积达到50mm3以上,进行活体成像实验。
六.荷瘤小鼠的活体成像实验对新配体的靶向性能验证
1.荷瘤小鼠的活体成像实验分为三组,每组3头小鼠。实验组每头小鼠以Cy5.5以5mg/Kg体重单剂量尾静脉注射给药。3头小鼠的编号以及处理方式分别为:
I-A:阴性对照组,生理盐水。
I-B:阳性对照组,PLA-PNNUA-Cy5.5胶束组。
I-C:PLA-PNNUA-Cy5.5(TEMPO)胶束。
注射后1h拍照并处死拍组织。
2设置仪器激发
从左至右一次为生理盐水对照组,PLA-PNNUA-Cy5.5对照组,PLA-PNNUA-Cy5.5(TEMPO)实验组。注射样品后小鼠成像以及各组织在640nm激发,700nm收集的成像图谱,如附图7所示
实验结果
附图7(A)中箭头处为荷瘤位置,I为尾部静脉注射100μL生理盐水对照组小鼠的成像图,II为尾部静脉注射无TEMPO的PLA-PNNUA-Cy5.5胶束(5mg/mL,200μL)的实验小鼠成像图,III为尾部静脉注射PLA-PNNUA-Cy5.5(TEMPO)纳米胶束(5mg/mL,200μL)的实验小鼠成像图。从图中可以看出,给药1h后,与I组和II组荷瘤小鼠相比,注射PLA-PNNUA-Cy5.5(TEMPO)胶束组的小鼠III活体成像在荷瘤部位的荧光强度最强,表明小鼠荷瘤部位的Cy5.5浓度较高,进而说明PLA-PNNUA-Cy5.5(TEMPO)胶束组在肿瘤部位的聚集浓度比PLA-PNNUA-Cy5.5胶束组聚集的浓度要大,也就是在胶束表面修饰TEMPO基团后,由于TEMPO基团和肿瘤部位的自由基等物质发生结合,使得纳米胶束有选择性地浓集定位于肿瘤部位。实验结果表明,与无TEMPO的纳米胶束组相比,PLA-PNNUA-Cy5.5(TEMPO)纳米胶束组在荷瘤小鼠体内表现出良好的主动靶向肿瘤组织的能力。
为了进一步证明由活体荧光成像所得到的纳米胶束组的成像结果以及纳米胶束在小鼠体内分布情况,将注射1h后的小鼠进行解剖,并得到解剖器官的荧光成像图。结果如图7(B)所示,各离体器官的荧光强度与活体成像所得到的结果相似,在离体成像图中,从上至下依次为心脏、肝脏、脾脏、肺脏、肾脏和肿瘤组织。从图中可看出,肝脏和肾脏的荧光强度很高,一方面由于这两个器官的自发荧光很高,另一方面这两个器官具有“排毒”的作用,因此纳米胶束也容易在此富集。与生理盐水组和无TEMPO的纳米胶束组相比,PLA-PNNUA-Cy5.5(TEMPO)纳米胶束组肿瘤组织处有较强的荧光,此结果与小鼠活体荧光成像结果具有一致性。
实验结果表明,与无TEMPO的纳米胶束组相比,PLA-PNNUA-Cy5.5(TEMPO)纳米胶束组在荷瘤小鼠体内表现出良好的主动靶向肿瘤组织的能力。这是由于TEMPO配体的连接,使纳米胶束不但具有了顺磁性能,还具有了捕捉自由基的能力。当含有TEMPO的纳米胶束随血液经过肿瘤组织时,由于肿瘤组织的自由基较多,裸露在胶束外面的TEMPO就会和自由基发生结合,停留在肿瘤组织部位,进而增大了纳米胶束在肿瘤部位的聚集,因此含TEMPO纳米胶束组在荷瘤小鼠体内肿瘤组织的荧光光强度较强。
所述的纳米胶束可换作表面含有TEMPO基团的纳米颗粒、纳米囊泡、纳米管等载体中的一种或几种。
实施例2
TEMPO对肿瘤部位的靶向性验证(2):
制备包埋疏水性量子点的TEMPO胶束,利用实例1方案对TEMPO的靶向验证一CdTe量子点(QDs)的制备
1水溶性CdTe量子点的制备
将CdCl2·2.5H2O(0.04mol/L,4mL)加入到100mL三口烧瓶中,稀释到50mL。磁力搅拌下依次加入100mg柠檬酸钠,Na2TeO3(0.01mol/L,4mL),50mg MPA,50mg NaBH4。当溶液的颜色变为灰绿色时,放入油浴中100℃加热回流,通过控制反应1-12h时间得到CdTe量子点。
2油溶性CdTe QOs的制备
取2mM水溶性CdTe QDs,加5ml十二硫醇和20ml丙酮,接回流装置,70℃水浴加热,磁力搅拌反应3h,减压旋转蒸发除去丙酮,加入15ml甲苯,萃取,分液取有机层,接回流装置,75℃水浴加热,磁力搅拌反应1h,旋转蒸发除去甲苯,加入三倍体积无水乙醇沉淀QDs,12000rpm/min离心10min,弃上清液,沉淀加适量无水乙醇涡旋振荡洗涤,12000rpm/min离心10min,弃上清液,加一定体积氯仿涡旋振荡溶解沉淀,12000rpm/min离心10min,吸取上清液,即得油溶性CdTe QDs。
二PLA-PNNUA-TEMPO合成
与实施例1中基础共聚物PLA-PNNUA-PNAS的合成相同
三QDs@PLA-PNNUA和QDs@PLA-PNNUA-TEMPO胶束的制备合成及表征
取0.1mg油溶性QDS溶于2ml四氢呋喃(THF),超声30min。将10mgPLA-PNNUA或PLA-PNNUA-TEMPO溶于7ml去离子水超声30min。在搅拌下将PLA-PNNUA-PAS或PLA-PNNUA-TEMPO溶液缓慢加入溶有QDs的四氢呋喃中,加完后继续搅拌12h。用1000ml去离子水透析24h,除去有机溶剂、未反应的4-NH2-TEMPO以及其他的一些副产物。透析过程的前4小时每小时换一次水,随后继续透析20小时。透析结束后将透析袋内的液体冻干得到浅黄色固体。在激发波长460nm下,600nm处的荧光峰是属于QDs@PLA-PNNUA和QDs@PLA-PNNUA-TEMPO胶束中QDs所发出荧光(包埋油溶性QDs的多功能纳米胶束的电子顺磁共振图谱和荧光图谱,附图4和附图8)。(在本专利中QDs用于靶向验证的荧光标记,同时也可视为药物模型。)
四小鼠MCF-7腋皮下接种肿瘤模型的建立以及对新配体的靶向性能验证,与实施例1除去把在激发波长改为460nm接受波长改为590nm外,其余相同,结果如附图9所示
实验结果
附图9(C)从左至右依次为:I为尾部静脉注射100μL生理盐水对照组小鼠的成像图,II为尾部静脉注射QDs@PLA-PNNUA纳米胶束(5mg/mL,200μL)的实验小鼠成像图,III为尾部静脉注射QDs@PLA-PNNUA-TEMPO纳米胶束(5mg/mL,200μL)的实验小鼠成像图,图中箭头处为荷瘤位置。图9为注射样品后小鼠成像以及各组织成像在460nm激发,590nm收集的成像图谱。从图中可以看出,给药1h后,与I组和II组荷瘤小鼠相比,注射QDs@PLA-PNNUA-TEMPO胶束组的小鼠III活体成像在荷瘤部位的荧光强度最强,表明小鼠荷瘤部位的QDs浓度较高,进而说明QDs@PLA-PNNUA-TEMPO胶束组在肿瘤部位的聚集浓度比QDs@PLA-PNNUA-PAS胶束组聚集的浓度要大。这个结果与实施例1的小鼠活体成像结果具有一致性。
为了进一步证明由活体荧光成像所得到的纳米胶束组的成像结果以及纳米胶束在小鼠体内分布情况,将注射1h后的小鼠进行解剖,并得到解剖器官的荧光成像图。结果如图9(D)所示,各离体器官的荧光强度与活体成像所得到的结果相似,在离体成像图中,从上至下依次为心脏、肝脏、脾脏、肺脏、肾脏和肿瘤组织。从图中可看出,肝脏和肾脏的荧光强度很高,这也是由于这两个器官的自发荧光很高和“排毒”性能,与生理盐水组和无TEMPO的纳米胶束组相比,QDs@PLA-PNNUA-TEMPO纳米胶束组肿瘤组织处有较强的荧光,此结果与小鼠活体荧光成像结果具有一致性。
许多研究表明在浓度相同的条件下Cy5.5在组织成像的能力远远大于QDs,但从图7(B)和9(D)所示的结果来看,在相同标尺下(108),在肿瘤部位的荧光强度几乎相同。这是由于我们所用的聚合物具有良好的pH性能,当胶束进入肿瘤组织时,因肿瘤组织的弱酸性,胶束结构遭到破坏,释放出包埋的油溶性CdTe QDs。由于油溶性CdTe QDs具有疏水性能,不溶于血液,不易被血液带走,从而可以聚集在肿瘤部位,这样就会使肿瘤部位的QDs浓度增大,显示出较强的荧光强度。这也进一步验证了我们制备的响应性材料具有良好的环境响应能力。
所述的纳米胶束可换作纳米颗粒、纳米囊泡、纳米管等载体中的一种或几种,进行TEMPO靶向性能的验证。
实施例3
TEMPO对炎症的靶向性验证:
采用美洲大蠊提取液,蟑螂提取液诱发等方法构建小鼠肺炎症模型,利用实施例1中材料和试验方法来验证TEMPO对炎症的靶向,结果表明含有TEMPO的载药载体对炎症部位有一定的靶向性。
实施例4
TEMPO对动脉硬化的部位靶向性验证:
利用腹腔注射蛋黄乳液等方法构建小鼠高血脂模型。构建方法:通过在动物饲料中加入过量的胆固醇和脂肪,饲养一定时间后,它的主动脉及冠状动脉处会逐渐形成粥样硬化斑块,并出现高血脂症。高胆固醇和高脂饮食,加入少量胆酸盐,可增加胆固醇的吸收,如再加入甲状腺抑制药--甲基硫氧嘧啶或丙基硫氧嘧啶可进一步加速病变的形成。利用实施例1中材料和试验方法来验证TEMPO对动脉硬化的靶向,结果表明含有TEMPO的载药载体对动脉硬化部位有一定的靶向性。
实施例5
利用含有TEMPO及其衍生物的纳米载药载体,对各种由自由基过多而引起疾病(如:脑血栓、脑的再灌流性损害、胃炎、消化性溃疡、原发性肾小球疾病、糖尿病(糖尿病食品)、支气管哮喘、肺气肿、震颤麻痹症等病症)的病灶部位进行靶向实验,结果表明含有TEMPO的载药载体对这些病灶部位有一定的靶向性。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员,在不脱离本发明构思的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!
- 靶向PD-1的多肽及其应用的制造方法与工艺
- 靶向同位素生产系统的制造方法与工艺
- 在制备68GA‑螯合物官能化的靶向剂中用作金属抑制剂的单糖、二糖或多糖的制造方法与工艺
- 用于引导和靶向按需物质递送的纳米结构的载体的制造方法与工艺
- 通过PROSTRATIN靶向K‑RAS介导的信号转导通路和恶性肿瘤的制造方法与工艺
- 肿瘤靶向核磁共振/荧光双模态成像造影剂及其制备和应用的制造方法与工艺
- pH氧化还原双敏感的PAMAM靶向纳米给药载体及其制备方法与制造工艺
- 具有卵巢肿瘤靶向D构型多肽及其基因递释系统的制造方法与工艺
- 靶向survivin纳米抗体及其制备方法和应用与制造工艺
- 用于PSMA靶向的成像和放射疗法的金属/放射性金属标记的PSMA抑制物的制造方法与工艺
- 阻断UBE2M介导Neddylation修饰在肾细胞癌治疗中的应用的制造方法与工艺
- 无载体共组装肿瘤靶向抗癌纳米药物及其制备方法与应用与流程
- 一种用于判断靶向单克隆抗体治疗肿瘤疗效的预测分子的制造方法与工艺
- 一种靶向CD47的免疫检查点抑制剂药物组合物及其制备方法与流程
- 具有淋巴靶向功能的生物自组装纳米晶注射剂及制备方法与流程
- 用于检测肝癌的基因标志物及其用途的制造方法与工艺
- 特异性shRNA筛选及其靶向Ang‑2基因抑制肺癌细胞的验证方法与流程
- 一种多功能自动化生物细胞提取分离控制系统及采用该系统实现的细胞提取分离方法与流程
- 一种融合蛋白及光敏剂复合物及其制备方法和应用与流程
- 具有可视化和显示光斑边界功能的光动力治疗系统的制造方法与工艺
- 肿瘤靶向核磁共振/荧光双模态成像造影剂及其制备和应用的制造方法与工艺
- pH氧化还原双敏感的PAMAM靶向纳米给药载体及其制备方法与制造工艺
- 具有卵巢肿瘤靶向D构型多肽及其基因递释系统的制造方法与工艺
- 靶向survivin纳米抗体及其制备方法和应用与制造工艺
- 用于PSMA靶向的成像和放射疗法的金属/放射性金属标记的PSMA抑制物的制造方法与工艺
- 一种线粒体靶向的粘度荧光探针及其制备方法和应用与制造工艺
- 一种兼具荧光可视、磁靶向和pH敏多功能的复合空心微球药物载体及其制备方法与制造工艺
- 一种用于修饰微泡的多肽以及靶向GBM的药物制剂的制造方法与工艺
- 白果内酯作为脑靶向增效剂在制备防治脑肿瘤药物的应用的制造方法与工艺
- 机器人辅助精确靶向穿刺软组织目标柔性针夹紧固定装置的制造方法
- 一种用于判断靶向单克隆抗体治疗肿瘤疗效的预测分子的制造方法与工艺
- 一种检测肺癌相关基因热点突变的试剂盒及其应用的制造方法与工艺
- 一种为肺癌提供离体个体化药物测试的方法及培养基与流程
- 一种谷胱甘肽/超声双重刺激响应纳米聚合物囊泡、其制备方法及应用与流程
- 一种多重刺激响应交联型聚合物纳米水凝胶、其制备方法及应用与流程
- 一种靶向CD47的免疫检查点抑制剂药物组合物及其制备方法与流程
- 具有淋巴靶向功能的生物自组装纳米晶注射剂及制备方法与流程
- 用于检测肝癌的基因标志物及其用途的制造方法与工艺
- 特异性shRNA筛选及其靶向Ang‑2基因抑制肺癌细胞的验证方法与流程
- 一种具有靶向功能仿病毒结构高分子囊泡及其制备与应用的制造方法与工艺