本发明属于生物技术领域,更具体地,本发明涉及miR-451作为调节血糖的靶标的用途。
背景技术:
正常机体血糖浓度在多种激素(如胰岛素和胰高血糖素等)的精细调节下保持相对恒定。上述激素主要通过作用于代谢相关组织器官(肝脏、脂肪组织、骨骼肌),调控糖代谢关键酶的活性或基因表达,从而影响葡萄糖的生成(糖原分解、糖异生)、摄取、利用和转化(合成糖原和脂肪等),维持血糖稳态。激素及其下游任何环节发生障碍都能导致糖代谢紊乱,影响血糖水平。近年来的研究发现,microRNA(miRNA)能通过转录后水平对胰岛素合成和分泌、激素下游信号分子及糖代谢相关基因的表达起调控作用,从而调控糖代谢及血糖水平,在血糖稳态的维持及糖尿病的发生发展中发挥重要作用。
目前对miR-451功能的研究主要是集中于红细胞分化与肿瘤领域。miR-451参与对红细胞分化与成熟的调控。miR-451在多种肿瘤组织中表达下降(如胃癌、结直肠癌、非小细胞肺癌、胶质细胞瘤等),在肿瘤的发生、发展中发挥重要作用,因此被称为抑癌micoRNA。miR-451在糖代谢和血糖调控中的作用未见报道。
技术实现要素:
本发明的目的在于提供miR-451作为调节血糖的靶标的用途。
在本发明的第一方面,提供miR-451或其调节剂在制备调节血糖的制剂中的用途。
在一个优选例中,所述的调节剂是上调剂,所述的miR-451或其上调剂用于制备降低血糖、改善葡萄糖耐受能力的制剂。
在另一优选例中,所述的miR-451或其上调剂还用于制备具有如下功能 的制剂:
降低肝脏的产糖能力;
降低肝脏的糖异生能力;
降低肝脏糖异生关键分子葡萄糖-6-磷酸酶(G6pase)和磷酸烯醇式丙酮酸羧激酶(PEPCK)的表达;
提高血甘油水平;
降低肝脏GyK蛋白水平;或
预防、缓解或治疗糖尿病(包括2型糖尿病)。
在另一优选例中,所述的miR-451的上调剂包括:miR-451模拟物,miR-451激动剂,miR-451前体,表达miR-451的表达系统、miR-451表达刺激剂。
在另一优选例中,所述的表达系统包括(但不限于):表达质粒、宿主细胞或病毒;所述的病毒包括腺病毒、腺相关病毒、慢病毒等。
在另一优选例中,所述的miR-451前体具有SEQ ID NO:2所示的核苷酸序列;或所述的表达miR-451的表达系统是包含有SEQ ID NO:2核苷酸序列的表达质粒或病毒。
在另一优选例中,所述的调节剂是下调剂,所述的miR-451的下调剂用于制备提高血糖的制剂。
在另一优选例中,所述的miR-451的下调剂还用于制备具有如下功能的制剂:
提高肝脏的产糖能力;
促进肝脏的糖异生能力;
提高肝脏糖异生关键分子葡萄糖-6-磷酸酶和磷酸烯醇式丙酮酸羧激酶的表达;
降低血甘油水平;
提高肝脏GyK蛋白水平;或
预防、缓解或治疗低血糖。
在另一优选例中,所述的miR-451的下调剂包括:抑制或阻止miR-451与其靶向基因位点结合的物质;较佳地为miR-451的antagomir,miR-451的抑制剂(inhibitor,含表达抑制剂),miR-451的反义核酸,siRNA或表达miR-451海绵体的表达系统。
在另一优选例中,所述的靶向基因为Gyk基因。
在另一优选例中,所述的miR-451海绵体与miR-451不完全匹配的结合序列(MBS)串联而成;较佳地,所述的miR-451海绵体具有SEQ ID NO:6所示的核苷酸序列。
在本发明的另一方面,提供一种用于调节血糖的制剂,所述的制剂是miR-451的上调剂,其包含表达miR-451的表达系统;较佳地,所述的表达miR-451的表达系统是包含有SEQ ID NO:2核苷酸序列的表达质粒、病毒或宿主细胞。
在本发明的另一方面,提供一种用于调节血糖的制剂,所述的制剂是miR-451的下调剂,其包含抑制或阻止miR-451与其靶向基因位点结合的物质;较佳地,所述抑制或阻止miR-451与其靶向基因位点结合的物质是表达miR-451海绵体的表达系统;更佳地,所述的miR-451海绵体与miR-451不完全匹配的结合序列串联而成;更佳地,所述的miR-451海绵体具有SEQ ID NO:6所示的核苷酸序列。
在本发明的另一方面,提供一种筛选调节血糖的潜在物质的方法,所述方法包括:
(1)用候选物质处理表达miR-451的体系;和
(2)检测所述体系中miR-451的表达;
其中,若所述候选物质可提高(优选显著提高,如提高20%以上,较佳的提高50%以上;更佳的提高80%以上)miR-451的表达,则表明该候选物质是降低血糖的潜在物质;若所述候选物质可降低(优选显著降低,如提高20%以上,较佳的降低50%以上;更佳的降低80%以上)miR-451的表达,则表明该候选物质是提高血糖的潜在物质。
在一个优选例中,步骤(1)包括:在测试组中,将候选物质加入到表达miR-451的体系中;和/或
步骤(2)包括:检测测试组的体系中miR-451的表达,并与对照组比较,其中所述的对照组是不添加所述候选物质的表达miR-451的体系;
如果测试组中miR-451的表达在统计学上高于(优选显著高于,如提高20%以上,较佳的提高50%以上;更佳的提高80%以上)对照组,就表明该候选物是降低血糖的潜在物质;如果测试组中miR-451的表达在统计学上低于(优选显著低于,如降低20%以上,较佳的降低50%以上;更佳的降低80%以上)对照组, 就表明该候选物是提高血糖的潜在物质。
在另一优选例中,所述的候选物质可以是:基于miR-451或调控其表达的基因或蛋白而设计的大分子(如肽、过表达载体)或小分子(如化合物)。
在另一优选例中,所述的体系选自:细胞体系(或细胞培养物体系)、亚细胞体系、溶液体系、组织体系、器官体系或动物体系。
在另一优选例中,所述的方法还包括:对获得的潜在物质进行进一步的细胞实验和/或动物试验,以从候选物质中进一步选择和确定对于调节血糖有用的物质。
本发明的其它方面由于本文的公开内容,对本领域的技术人员而言是显而易见的。
附图说明
图1、糖尿病模型小鼠肝脏miR-451表达升高。
A-C.C57BL/6小鼠喂饲常规饲料(Chow)或60%高脂饲料(HFD)12周,检测体重(A),血糖(B),以及肝脏miR-451水平(C)。
D.db/db小鼠或对照野生型小鼠(WT)肝脏miR-451水平。图中数值为均值±标准误,n=6-8,*P<0.05;**P<0.01,与常规饲料组小鼠相比(A-C);或与WT小鼠相比(D)。
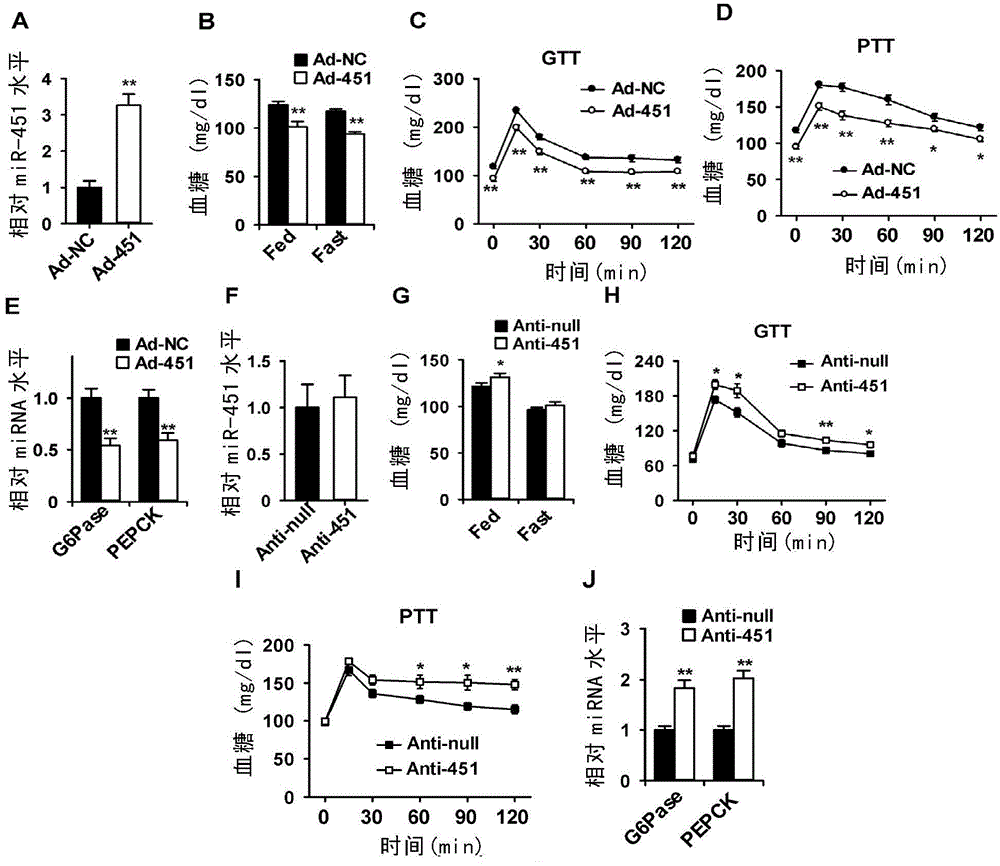
图2、miR-451通过抑制肝脏糖异生对血糖起负调控作用。
A-E.利用腺病毒表达系统在C57BL/6小鼠过表达miR-451(Ad-451)或对照序列(Ad-NC),分别检测肝脏miR-451水平(A),自由进食(Fed)和空腹6小时后(Fast)的血糖水平(B),进行糖耐量实验(C,GTT)和丙酮酸耐量实验(D,PTT),检测肝脏葡萄糖-6-磷酸酶(G6pase)和磷酸烯醇式丙酮酸羧激酶(PEPCK)的mRNA水平(E)。
F-J.在C57BL/6J小鼠注射表达miR-451海绵的腺病毒(Anti-451)或对照腺病毒(Anti-null),5天后分别检测肝脏miR-451水平(F),自由进食(Fed)和空腹6小时后(Fast)的血糖水平(G),进行糖耐量实验(H,GTT)和丙酮酸耐量实验(I,PTT),检测肝脏G6pase和PEPCK的mRNA水平(J)。图中数值为均值±标准误,n=6-8,*P<0.05;**P<0.01,与相应的对照小鼠相比。
图3、甘油激酶是miR-451的作用靶标。
A.miR-451序列与人(Has)、小鼠(Mmu)、大鼠(Rno)、黑猩猩(Ptr)及恒河猴(Mml)的甘油激酶(GyK)mRNA的3’非翻译区(3’UTR)序列比对。
B.含有野生型甘油激酶3’UTR(WT GyK)或突变型甘油激酶3’UTR(Mut1GyK,Mut2GyK)的报告基因质粒与miR-451模拟物或对照序列(NC)共转染HEK 293T细胞,检测荧光素酶活性。
C.小鼠肝细胞系AML-12转染miR-451模拟物或对照序列,检测GyK蛋白水平。
D-E.通过腺病毒系统在C57BL/6小鼠过表达miR-451(D)或抑制miR-451(E),检测肝脏GyK mRNA(D、E的上半部分图)和蛋白水平(D、E的下半部分图)。图中数值为均值±标准误。**P<0.01,与转染对照序列(NC)的细胞相比。
图4、甘油激酶对糖异生的调控作用。
利用腺病毒表达系统在C57BL/6小鼠过表达甘油激酶(Ad-GyK)或对照蛋白GFP(Ad-GFP),分别检测肝脏GyK mRNA水平(A),血糖水平(B),血甘油水平(C),肝脏G6Pase和PEPCK mRNA表达(F),检测以甘油为原料(D,GlyTT)或以丙酮酸为原料(E,PTT)的糖异生。图中数值为均值±标准误,n=6-8。*P<0.05;**P<0.01,与过表达GFP的对照小鼠相比。
图5、miR-451通过甘油激酶调控糖异生及血糖水平。
A-B.通过腺病毒表达系统在C57BL/6小鼠过表达miR-451(A)或抑制miR-451(B)对血甘油水平的影响。
C.在过表达miR-451的小鼠(Ad-451)或对照小鼠(Ad-NC)检测以甘油为原料的糖异生。
D-F.利用腺病毒表达系统在C57BL/6小鼠同时过表达miR-451和甘油激酶(GyK),观察小鼠的血糖(D),进行丙酮酸耐受实验(E),检测肝脏糖异生基因G6Pase和PEPCK的表达(F)。图中数值为均值±标准误,n=6-8。*P<0.05,**P<0.01,miR-451过表达小鼠与对照小鼠相比(A–C:Ad-451vs.Ad-NC; D-F:Ad-451+Ad-GFP vs.Ad-NC+Ad-GFP)。#P<0.05,##P<0.01,小鼠同时过表达miR-451及GyK(Ad-451+Ad-GyK)与过表达miR-451(Ad-451+Ad-GFP)相比(D-F)。
图6、过表达miR-451改善高脂饮食诱导的糖尿病小鼠的高血糖。
C57BL/6喂食常规饲料(Chow)或通过高脂饮食(HFD)诱导发生糖尿病,然后利用腺病毒表达系统在小鼠过表达miR-451(Ad-451)或对照序列(Ad-NC)、或注射等量磷酸缓冲液(PBS),检测自由进食和饥饿6小时后的血糖水平(A),进行糖耐量实验(B,GTT)和丙酮酸耐受实验(C,PTT),检测肝脏甘油激酶蛋白水平(D),以及肝脏糖异生基因G6Pase和PEPCK的mRNA水平(E)。图中数值为均值±标准误,n=6-10,*P<0.05,**P<0.01,HFD小鼠过表达miR-451(Ad-451)与过表达对照序列(Ad-NC)相比。
图7、过表达miR-451改善db/db小鼠的高血糖。
利用腺病毒表达系统在db/db小鼠过表达miR-451(Ad-451)或对照序列(Ad-NC),分别检测肝脏miR-451水平(A)、自由进食(Fed)和饥饿6小时(Fast)后的血糖水平(B);进行葡萄糖耐量实验(C,GTT)和丙酮酸耐受实验(D,PTT)。图中数值为均值±标准误。n=5-7,*P<0.05;**P<0.01,与过表达对照序列(Ad-NC)的db/db小鼠相比。
具体实施方式
本发明人经过深入的研究,发现miR-451通过调控甘油代谢及糖异生基因表达对糖异生和血糖起负调控作用,升高miR-451能抑制糖异生而改善高血糖,miR-451及其调节剂或类似物是调节血糖乃至治疗糖尿病(如2型糖尿病)的新靶标。
miR-451及其治疗用途
本发明中,所述的miR-451是具有SEQ ID NO:1所示核酸序列的小核糖核酸:
5’-AAACCGUUACCAUUACUGAGUU-3’(SEQ ID NO:1)。
所述的miR-451可以被分离自细胞,或者可通过人工合成的方式获得。在得知了miR-451或其前体的序列后,本领域人员可以方便地制备获得miR-451或其前体。
基于本发明的阐述,miR-451是一个新的、与血糖调节密切相关的药物靶点。针对miR-451的各种治疗手段可以作为防治动物(特别是人)的糖尿病或低血糖的新颖且有效的手段。
并且,miR-451也可以用于作为药物筛选的靶点,筛选通过提高miR-451的表达或活性而缓解或治疗高血糖或糖尿病的药物,或筛选通过降低miR-451的表达或活性而缓解或治疗低血糖的药物。
miR-451调节剂的治疗用途
基于本发明人的新发现,所述的miR-451的上调剂可用于制备缓解或治疗高血糖或糖尿病的制剂,特别是药物组合物。
所述的miR-451的上调剂是指任何可提高miR-451或其前体的活性、提高miR-451或其前体的稳定性、上调miR-451或其前体的表达、增加miR-451或其前体有效作用时间的物质,这些物质均可用于本发明,作为对于上调miR-451有用的物质,从而可用于缓解或治疗高血糖或糖尿病。它们可以是化合物、化学小分子、生物分子。所述的生物分子可以是核酸水平(包括DNA、RNA)的,也可以是蛋白水平的。
作为本发明的一种选择方式,所述的miR-451上调剂是miR-451的模拟物(mimics)或激动剂(Agomir),其具有与所述miR-451相同的效果,或者能够提高miR-451的表达或活性。
所述的miR-451的上调剂可以是经修饰的上调剂,所述的修饰包括:甲氧基化修饰、硫代修饰、胆固醇修饰、烷基修饰、锁核酸修饰、肽核酸修饰、和/或磷酸骨架由磷脂连接代替的反义核苷酸;较佳地,所述的修饰包括:3’端进行胆固醇修饰,5’端两个硫代骨架修饰,3’端四个硫代骨架修饰,全链甲氧基修饰。
作为本发明的优选选择方式,所述的miR-451上调剂是表达miR-451的表达系统。所述的表达系统没有特别的限制,任何可表达出具有miR-451或其类似物、模拟物相似活性的表达系统均可应用于本发明中。例如,所述的 表达系统包括但不限于:表达质粒、含有表达质粒的宿主细胞或病毒;所述的病毒包括腺病毒、腺相关病毒、慢病毒等。本领域技术人员了解如何表达出miR-451或其类似物、模拟物,并且已经有一些商业化的表达系统,均可应用于本发明中。
如本文所用,所述的“miR-451下调剂”包括了核酸抑制物、拮抗剂、抑制剂、阻滞剂、阻断剂等,只要它们能够下调miR-451或其前体的表达水平。它们可以是化合物、化学小分子、生物分子。所述的生物分子可以是核酸水平(包括DNA、RNA)的,也可以是蛋白水平的。
所述的miR-451下调剂是指任何可阻止miR-451(特别是其中的结合关键位点)或其前体与其靶向序列结合、降低miR-451或其前体的活性、降低miR-451或其前体的稳定性、下调miR-451或其前体的表达、减少miR-451或其前体有效作用时间的物质,这些物质均可用于本发明,作为对于下调miR-451有用的物质,从而可用于提高血糖。例如,所述的抑制剂是:核酸抑制物,蛋白抑制剂,抗体,配体,核酸酶,核酸结合分子,只要其能够下调miR-451的表达。例如,所述的抑制剂是核酸抑制物,其通过阻止miRNA与其靶向序列结合,从而发挥作用。所述的核酸抑制物例如选自(但不限于):miRNA的反义核酸,miRNA的锁核酸反义核酸;肽核酸;siRNA(沉默miRNA前体)。
作为本发明的优选方式,所述的miR-451下调剂是表达miR-451海绵体的表达系统。所述的miR-451海绵体与miR-451不完全匹配的结合序列(MBS)串联而成;较佳地,所述的miR-451海绵体具有SEQ ID NO:6所示的核苷酸序列。
药物组合物
本发明还提供了一种组合物,它含有有效量(如0.000001-50wt%;较佳的0.00001-20wt%;更佳的,0.0001-10wt%)的所述的miR-451或其调节剂(包括上调剂或下调剂),以及药学上可接受的载体。所述的组合物可用于调节血糖。
如本文所用,所述“有效量”是指可对人和/或动物产生功能或活性的且 可被人和/或动物所接受的量。所述“药学上可接受的载体”指用于治疗剂给药的载体,包括各种赋形剂和稀释剂。该术语指这样一些药剂载体:它们本身并不是必要的活性成分,且施用后没有过分的毒性。合适的载体是本领域普通技术人员所熟知的。在组合物中药学上可接受的载体可含有液体,如水、盐水、缓冲液。另外,这些载体中还可能存在辅助性的物质,如填充剂、润滑剂、助流剂、润湿剂或乳化剂、pH缓冲物质等。所述的载体中还可以含有细胞转染试剂。
在得知了所述miR-451或其调节剂的用途后,可以采用本领域熟知的多种方法来将所述的miR-451或其调节剂或它们的药物组合物给药于哺乳动物。包括但不限于:皮下注射、肌肉注射、静脉输入、经皮给予、局部给予、植入、缓释给予等。
本发明所述的miR-451或其调节剂的有效量可随给药的模式和待治疗的疾病的严重程度等而变化。优选的有效量的选择可以由本领域普通技术人员根据各种因素来确定(例如通过临床试验)。所述的因素包括但不限于:所述的miR-451或其调节剂的药代动力学参数例如生物利用率、代谢、半衰期等;患者所要治疗的疾病的严重程度、患者的体重、患者的免疫状况、给药的途径等。通常,当本发明的miR-451或其调节剂每天以约0.00001mg-50mg/kg动物体重(较佳的0.0001mg-10mg/kg动物体重)的剂量给予,能得到令人满意的效果。例如,由治疗状况的迫切要求,可每天给予若干次分开的剂量,或将剂量按比例地减少。
药物筛选
在得知了miR-451与血糖调节的密切相关性后,可以基于该特征来筛选调节miR-451的表达(及miR-451的调节剂)的物质。
因此,本发明提供一种筛选调节血糖的潜在物质的方法,所述的方法包括:用候选物质处理表达miR-451的体系;和检测所述体系中miR-451的表达;若所述候选物质可提高miR-451的表达,则表明该候选物质是降低血糖的潜在物质,反之则表达该候选物质是提高血糖的潜在物质。所述的表达miR-451的体系例如可以是细胞(或细胞培养物)体系,所述的细胞可以是内源性表达miR-451的细胞;或可以是重组表达miR-451的细胞。所述的表达 miR-451的体系还可以是亚细胞体系、溶液体系、组织体系、器官体系或动物体系(如动物模型,优选非人哺乳动物的动物模型,如鼠、兔、羊、猴等)等。
在本发明的优选方式中,在进行筛选时,为了更易于观察到miR-451的表达的改变,还可设置对照组,所述的对照组可以是不添加所述候选物质的表达miR-451的体系。
作为本发明的优选方式,所述的方法还包括:对获得的潜在物质进行进一步的细胞实验和/或动物试验,以进一步选择和确定对于调节血糖真正有用的物质。
本发明对于miR-451的表达、活性、存在量的检测方法没有特别的限制。可以采用常规的基因定量或半定量检测技术,例如(但不限于):聚合酶链式反应技术(PCR),Northern印迹法等。
另一方面,本发明还提供了采用所述筛选方法获得的可调节血糖的潜在物质。这些初步筛选出的物质可构成一个筛选库,以便于人们最终可以从中筛选出能够对于调节miR-451的表达和活性,进而调节血糖有用的物质。
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件如J.萨姆布鲁克等编著,分子克隆实验指南,第三版,科学出版社,2002中所述的条件,或按照制造厂商所建议的条件。
材料与方法
1、实验动物
C57BL/6背景的雄性小鼠购自上海斯莱克实验动物有限公司;db/db小鼠和对照野生型小鼠(wt)购自南京模式动物中心。小鼠饲养于SPF级动物房,12小时光照昼夜循环,除了实验特殊要求外,小鼠自由进食常规饲料和水。通过给8周龄C57小鼠喂食60%高脂饲料(Research Diets)至少12周建立高脂诱导的糖尿病小鼠模型。利用腺病毒系统进行肝脏过表达实验。所有的小鼠实验操作均遵循Institutional Animal Care以及Use Committee of the Institute for Nutritional Sciences有关细则。
2、腺病毒制备和纯化
miR-451腺病毒表达质粒使用AdEasy腺病毒质粒表达系统(Stratagene,La Jolla,CA)构建。插入的miR-451前体序列为:
5′-CTTGGGAATGGCGAGGAAACCGTTACCATTACTGAGTTTAGTAATGGTAACGGTTCTCTTGCTGCTCCCACA-3′(SEQ ID NO:2),
对照序列为:
5′-
CCTAAGGTTAAGTCGCCCTCGCCGAAGCGAGGGCGACTTAACCTTAGG-3′(SEQ ID NO:3)。
同样利用AdEasy腺病毒质粒系统构建表达小鼠GyK和miR-451海绵体的载体。扩增小鼠Gyk mRNA CDS区的PCR引物序列为:正向5′-AAGGAAAAAAGCGGCCGCGAAGCTGACTGACTTCC-3′(SEQ ID NO:4);反向5′-CCCAAGCTTAATCCGTGAGGTGGTATT-3′(SEQ ID NO:5)。
miR-451海绵体表达载体按文献方法构建(Nat Methods 2007;4:721-726.PLoS One 2012;7:e29275)。miR-451海绵体由三组共6个与miR-451不完全匹配的结合序列(miRNA binding site,MBS)串联而成,每组元件包含2个MBS,序列为:5′-GTCCCAACTCAGTAACCAAACGGTTTGCGGG-3′(SEQ ID NO:6,其中,单下划线标示一个MBS,双下划线标示另一MBS)。在细胞内表达后,可与miR-451的靶mRNA竞争结合miR-451,从而抑制miR-451的功能。
病毒在293A细胞中扩增后,收集上清和细胞,用0.5%NP-40室温裂解细胞20min,12000rpm 4℃离心10min;每100mL上清加入50mL PEG8000(20%PEG8000+2.5M NaCl),在冰上放置2h后,12000rpm 4℃离心20min;弃上清,用1.1g/mL CsCl(溶剂为20mM Tri-HCl,pH8.0)重悬沉淀,7000rpm,离心5min;取上清依次进行不连续和连续CsCl密度梯度离心,取病毒带用200倍体积的透析缓冲液在4℃透析三次,每次3h,分装病毒保存于-80℃,测定病毒滴度后按照需要量使用。
3、葡萄糖、丙酮酸和甘油耐受实验
小鼠禁食6h后,腹腔注射2g/kg体重的葡萄糖、2g/kg体重的丙酮酸或2g/kg体重的甘油进行葡萄糖耐受实验(Glucose tolerance test,GTT)、丙酮酸耐受实验(Pyruvate tolerance test,PTT)或甘油耐受实验(Glycerol tolerance test,GlyTT)。于注射前及注射后在15、30、60、90和120min用血糖仪从尾部取血测定血糖值。在利用腺病毒系统进行小鼠肝脏过表达miR-451、miR-451海绵体和Gyk时,通过尾静脉注射1×109PFU(plaque-forming units)腺病毒(配制于200μL PBS),5天后进行GTT、PTT和GlyTT实验。实验后注射6%水合氯醛(0.1ml/10g)麻醉处死小鼠,收集血清和肝脏等组织样品,保存于-80℃冰箱待之后分析。
4、血清生化分析
肝脏糖原含量按文献中报道的方法检测;血清胰岛素浓度用Millipore的胰岛素ELISA测定试剂盒;血清甘油水平用普利莱的甘油(液体样品)酶法测定试剂盒检测。
5、RNA抽提和荧光定量PCR
小鼠组织中的总RNA使用Invitrogen公司的TRIzol试剂抽提,步骤如下:每10~40mg组织在1.5mL EP管中加0.4mL TRIzol进行研磨后补至1mL,加入0.2mL氯仿,剧烈震荡15s后将其在室温下放置5min,在4℃下以12000rpm离心10min。约取350μL水样层转移到一干净的EP管中,加入等体积异丙醇沉淀RNA,室温条件下放置30min后,4℃下12000rpm离心10min。移去上层液体,用75%的乙醇溶液(DEPC水配制)洗涤RNA沉淀一次后,用DEPC水溶解。
RNA抽提后用Takara公司的DNaseⅠ消化,以去除DNA。取2μg RNA用M-MLV逆转录酶通过逆转录系统将mRNA逆转录得到cDNA,miR-451的逆转录则用特异的茎环引物进行逆转录,引物序列为:5′-CTCAACTGGTGTCGTGGAGTCGGCAATTCAGTTGAGAACTCAGT-3′。逆转录产物通过美国Applied Biosystems公司(Foster City,CA)的SYBR Green PCR system进行扩增,以36B4(mRNA)或U6(miRNA)为内参进行mRNA或miR-451丰度的分析。
荧光定量PCR使用的引物如表1。
表1
6、Western Blot
用含cocktail蛋白酶抑制剂的RIPA裂解液处理细胞或组织,离心去除细胞碎片,测蛋白质浓度。取等量的蛋白(10~20μg)与4×蛋白上样缓冲液混合上样,在恒压(80-120V)下进行SDS-PAGE电泳(凝胶厚度1.5mm,积层胶5%,分离胶10%),再用湿转法将蛋白质转移到PVDF膜上。用含5%脱脂奶粉的TBST溶液封闭PVDF膜1h,然后加入一抗,4℃结合过夜。用TBST室温洗膜3次,每次5min。加入相应的二抗于室温结合1~2h,再用TBST洗膜3次,用Thermo Scientific公司的SuperSignal West Pico Chemiluminescent Substrate检测系统显色。
7、双荧光素酶报告基因分析
通过PCR扩增出小鼠Gyk 3′UTR包含miR-451应答元件(miRNA response element,MRE)的DNA片段,克隆到带有海肾荧光素酶的pRL-TK质粒(Promega)上,构建报告基因质粒WT Gyk。PCR引物序列为:正向 5′-TGCTCTAGACTTTCTGTCTGGCTCTTA-3′(SEQ ID NO:19);反向:5′-AAGGAAAAAAGCGGCCGCGCATTATTGGCTTTATTCAC-3′(SEQ ID NO:20)。
将WT Gyk质粒中miR-451的MRE序列5′-AACGGTT-3′分别突变为5′-AACGCTT-3′和5′-AAGCGTT-3′,构建突变型Gyk报告基因质粒Mut1Gyk和Mut2Gyk。
293T细胞培养于4.5g/L高糖DMEM+10%FBS的培养基中,在12孔板培养24h后细胞汇合率达到80%,用Lipofectamine 2000(Invitrogen)转染20ng的WT Gyk、Mut1Gyk、Mut2Gyk和400ng表达萤火虫荧光素酶的报告基因内参质粒,同时共转20nM miR-451模拟体(mimics)或阴性对照(negative control),细胞转染24h后用Dual-Luciferase Reporter Assay System(Promega)分析。
miR-451模拟体的序列:5′-AAACCGUUACCAUUACUGAGUU-3′(SEQ ID NO:21);
NC阴性对照的序列:5′-UUCUCCGAACGUGUCACGUTT-3′(SEQ ID NO:22)。
8、统计学分析
实验结果均以均值±标准误的形式呈现,两组之间的差别用双尾非配对t检验进行统计分析,当P值小于0.05时认为有统计学差异(*P<0.05;**P<0.01)。
实施例1、肝脏miR-451通过调控糖异生对血糖起负调控作用
通过给C57BL/6小鼠喂饲高脂饲料诱导2型糖尿病,如图1所示,高脂饮食(HFD)12周后小鼠的体重(图1A)、血糖(图1B)均显著高于常规饲料喂养的小鼠。
实时定量PCR检测发现高脂饮食诱导的糖尿病小鼠肝脏miR-451显著升高(图1C)。同样,db/db糖尿病小鼠肝脏miR-451也显著升高(图1D)。
为了研究肝脏miR-451在代谢中的作用,本发明人利用腺病毒表达系统,观察在小鼠肝脏过表达miR-451对血糖的影响。
研究发现,正常C57BL/6J小鼠过表达miR-451(Ad-451)5天后,肝脏中miR-451显著升高(图2A)。与对照组相比,过表达miR-451能够显著降低自由进食和饥饿时的血糖(图2B);使小鼠的葡萄糖耐受性增强(图2C)。丙酮酸耐受实验观察肝脏过表达miR-451对糖异生的影响,发现过表达miR-451降低了肝脏的产糖能力(图2D),肝脏糖异生关键分子葡萄糖-6-磷酸酶(G6pase)和磷酸烯醇式丙酮酸羧激酶(PEPCK)的表达显著降低(图2E)。在小鼠过表达miR-451不影响小鼠的体重、摄食量、血清中的胰岛素水平以及小鼠对胰岛素的敏感性。
以上结果表明,肝脏miR-451升高降低了肝脏糖异生的能力,从而导致小鼠的低血糖症状。miR-451对血糖的调控作用不是通过影响血中胰岛素水平和外周器官对胰岛素的敏感性实现的。
为了进一步验证miR-451调控肝糖异生的功能,本发明人通过在C57BL/6J小鼠过表达miR-451海绵体(Anti-451)以抑制miR-451发挥作用(miR-451海绵体在细胞中表达后,可与miR-451的靶mRNA竞争结合miR-451,从而抑制miR-451的功能)。研究发现,小鼠过表达Anti-451后肝脏中miR-451的水平无显著变化(图2F);与过表达miR-451小鼠的表型相反,抑制miR-451使小鼠在自由进食情况下血糖升高(图2G);小鼠的葡萄糖耐受性降低(图2H);丙酮酸耐受实验中肝脏的产糖能力增加(图2I);肝脏糖异生基因G6pase和PEPCK的表达升高(图2J)。同样,抑制miR-451感染对小鼠的体重、摄食量、血清胰岛素水平、以及小鼠对胰岛素的敏感性无显著影响。这些结果说明抑制肝脏miR-451的作用促进了糖异生,使血糖水平升高。
综上所述,本发明人通过在小鼠肝脏过表达miR-451或抑制miR-451,发现miR-451对肝脏糖异生具有负调控作用,在维持生理性血糖稳态中发挥重要作用。
实施例2、甘油激酶是miR-451在肝脏的作用靶点
为了寻找miR-451调控肝脏糖异生的作用靶点,本发明人用targetscan,miRanda和DIANA-microT-CDS三个miRNA靶点预测软件分析了miR-451在肝脏内可能的作用靶点,从预测的靶点中选择在物种间保守并且功能上与糖 代谢相关的分子,获得了Cab39、Ywhaz和甘油激酶(Glycerol kinase,GyK)这三个候选靶分子。
本发明人检测了过表达miR-451小鼠肝脏的Cab39和Ywhaz的蛋白表达水平,发现过表达miR-451对Cab39和Ywhaz的蛋白水平无显著影响,说明miR-451调控糖异生的功能不是通过调控这两个蛋白的表达实现的。
本发明人发现,GyK 3′UTR上有一个与miR-451序列匹配的miRNA应答元件(miRNA response element,MRE),并且在人、小鼠、大鼠、黑猩猩和恒河猴之间具有保守性(图3A)。为了确定GyK是否是miR-451的作用靶点,本发明人分别构建了GyK 3′UTR区包含有miR-451MRE序列的荧光素酶报告基因质粒(WT GyK),MRE序列有一个碱基突变(Mut1GyK)和两个碱基突变(Mut2GyK)的报告基因质粒。通过双荧光素酶系统检测,发现在转染WT GyK报告基因质粒的细胞过表达miR-451模拟物能显著抑制荧光素酶的活性,而在转染Mut1GyK或Mut2GyK质粒的细胞过表达miR-451却不能抑制荧光素酶的活性(图3B),说明GyK是miR-451的作用靶点。并且,在培养的小鼠肝细胞系过表达miR-451能限制降低GyK的蛋白水平(图3C),说明肝细胞中的GyK确实是miR-451的作用靶标。
进一步在小鼠整体水平发现过表达miR-451能显著降低肝脏GyK的蛋白水平(图3D),而抑制miR-451则增加肝脏GyK的蛋白水平(图3E),但过表达miR-451和抑制miR-451对GyK mRNA水平均无显著影响(图3D-E)。
上述结果在整体水平证实肝脏GyK是miR-451的直接作用靶点,并且,miR-451并非通过降解GyK mRNA,而是通过抑制GyK mRNA的翻译而降低肝脏GyK的蛋白水平。
实施例3、miR-451通过GyK调控肝脏糖异生和血糖水平
在确定了肝脏GyK是miR-451的作用靶标后,进一步从功能上探讨GyK在肝脏糖异生中的作用及机制。GyK是甘油作为底物参与糖异生时催化甘油生成3-磷酸甘油的限速酶。在小鼠肝脏过表达GyK后(图4A),小鼠在自由进食下的血糖升高(图4B)。小鼠肝脏过表达GyK使血液甘油浓度显著降低(图4C),并且,明显地促进以甘油作为原料的糖异生(图4D)。这些结果说明,GyK在整体水平通过调控甘油代谢而调控糖异生,GyK在调控以甘油为原料的糖 异生中起作用。丙酮酸耐受实验显示,GyK过表达小鼠的糖异生能力也是增强的(图4E),说明GyK也调控其它原料参与的糖异生。与上述结果一致,本发明人在分子水平检测到GyK过表达使小鼠肝脏糖异生基因G6Pase和PEPCK表达升高(图4F)。这些结果提示,GyK除了通过影响甘油代谢、还通过影响糖异生基因表达调控糖异生。
为确定miR-451对肝脏糖异生的调控是否是通过GyK实现的,本发明人检测了过表达和抑制miR-451对小鼠血中甘油浓度的影响,发现过表达miR-451使小鼠血甘油水平显著升高(图5A),而抑制miR-451则使血甘油水平显著降低(图5B)。在小鼠腹腔注射甘油使血糖显著升高,而小鼠过表达miR-451则能够抑制甘油的这种产糖效应(图5C)。上述结果说明,miR-451通过GyK影响了机体对甘油的代谢及以甘油为原料的糖异生过程。并且,小鼠过表达GyK逆转了过表达miR-451造成的低血糖(图5D)。同时,丙酮酸耐受实验结果表明,GyK过表达回复了过表达miR-451对糖异生的抑制作用(图5E)。在分子水平,过表达GyK逆转了miR-451过表达对肝脏G6Pase和PEPCK表达的抑制作用(图5F)。
综合以上结果,说明miR-451通过GyK除了直接影响甘油为原料的糖异生,还通过影响糖异生关键基因表达调控所有原料的糖异生,从而影响机体血糖水平。
实施例4、升高肝脏miR-451通过抑制肝脏糖异生降低糖尿病小鼠的高血糖
鉴于肝脏miR-451对血糖具有负调控作用,而高脂饮食诱导的2型糖尿病小鼠肝脏mRN-451显著升高,本发明人推测肝脏miR-451升高可能有利于改善高血糖,是机体的一种代偿性反应。因此本发明人进一步观察在糖尿病小鼠模型过表达miR-451是否能抑制肝脏糖异生,改善小鼠的高血糖症状。
本发明人通过给小鼠喂食60%高脂饲料诱导糖尿病,通过腺病毒表达系统在小鼠过表达miR-451,发现miR-451过表达显著降低小鼠自由进食和饥饿情况下的血糖水平(图6A)。葡萄糖耐受实验和丙酮酸耐受实验的结果显示,过表达miR-451显著改善了小鼠的葡萄糖耐受能力(图6B)、降低了小鼠的糖 异生能力(图6C)。过表达miR-451使小鼠肝脏GyK蛋白水平降低(图6D)。与功能实验的结果相一致,肝脏糖异生基因G6Pase及PEPCK的表达在小鼠过表达miR-451后显著降低(图6E),这些结果表明,升高肝脏miR-451水平能通过抑制肝脏糖异生显著改善高脂饮食诱导的2型糖尿病小鼠的血糖水平,miR-451对糖异生的抑制在其中发挥了重要作用。此外,本发明人还观察了肝脏过表达miR-451对db/db小鼠糖代谢紊乱的影响。发现过表达miR-451也能显著改善db/db小鼠的高血糖症状(图7A-B),增强db/db小鼠的葡萄糖耐受性(图7C),降低小鼠肝脏的产糖能力(图7D)。这些结果验证了肝脏miR-451升高能够通过抑制肝糖异生改善糖尿病小鼠的高血糖。
综上所述,肝脏miR-451以GyK为靶标,通过调控甘油代谢及糖异生基本表达对糖异生和血糖起负调控作用。在2型糖尿病模型小鼠升高miR-451能抑制糖异生而改善高血糖。miR-451及其类似物是治疗2型糖尿病的新靶标,具有开发和应用价值。
实施例5、药物筛选
取小鼠肝细胞,该细胞可内源性表达miR-451。将该种细胞作为用于筛选调节血糖的药物的细胞模型。
测试组:用候选物质处理的上述细胞的培养物;
对照组:不用候选物质处理的上述细胞的培养物。
在处理后适当时间,测定所述细胞的miR-451的表达。如果与对照组相比,测试组中的miR-451的表达显著上升2倍以上,则说明该候选物质是潜在的降低血糖或治疗糖尿病的物质;如果与对照组相比,测试组中的miR-451的表达显著下降2倍以上,则说明该候选物质是潜在的升高血糖或治疗低血糖的物质。
在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
- 该技术已申请专利。仅供学习研究,如用于商业用途,请联系技术所有人。
- 技术研发人员:乐颖影;卓鉥;
- 技术所有人:中国科学院上海生命科学研究院;
- 我是此专利的发明人
- 该领域下的技术专家
- 如您需求助技术专家,请点此查看客服电话进行咨询。
- 1、司老师:1.制浆造纸 2.植物资源精细化工与化学 3.生物质精炼 4.天然产物化学
- 2、薛老师:1.CRISPR-Cas系统 2.基因编辑 3.基因修复 4.天然产物合成 5.单分子技术开发与应用
- 3、戴老师:1.天然药物(中药)合成生物学研究 2.酵母生物学与工程化研究
- 4、孟老师:1. 基于糖类的抗肿瘤药物的合成和活性评价及糖类疫苗的研制 2.功能糖类的化学酶法合成及构效关系研究 3.多糖及仿生材料功能的开发及应用
- 5、满老师:1.天然产品的提取分离与活性研究 2.天然产物活性与安全性评价 3.中药组方配伍机制研究
- 如您是高校老师,可以点此联系我们加入专家库。
- 还没有人留言评论。精彩留言会获得点赞!