青蒿素B抑制A549细胞迁移侵袭的作用的制作方法
本发明涉及医药技术领域,具体涉及青蒿素B在抑制A549细胞迁移侵袭中的应用。
背景技术:
肺癌严重危害了人类的健康,是预后最差的恶性肿瘤之一,其中非小细胞肺癌(non-small cell lung cancer, NSCLC)在肺癌中所占比例超过80%。70%的肺癌患者的死亡是由癌症转移所导致的。我国肺癌死亡率为27. 93/10万(男性39. 79/10万,女性16.62/10万),呈现逐年上升趋势,肺癌是影响我国居民健康的主要恶性肿瘤之一。
肺癌转移是肺癌的恶性标志和特征,是肺癌患者治疗失败和死亡的主要原因,同时也是患者肿瘤复发、病情恶化而最终死亡的病理基础,其占所有发病率的90%。手术、放射治疗、化学治疗及各种辅助治疗能有效遏制非小细胞肺癌的发展,然而由于肺癌的转移及其对已知化疗药物产生的耐药性,最终导致多数肺癌患者治疗的失败。目前,对于非小细胞肺癌转移即已有远处转移的治疗手段主要为采用化疗药物抑制转移肿瘤的增殖及诱导其凋亡,而应用于临床的针对原发肿瘤的化疗药物对转移性肿瘤并没有显著性疗效。现今治疗非小细胞肺癌晚期患者的药物治疗方法主要为一线方案治疗法(铂类与第三代化疗药物如紫杉醇、吉西他滨、长春瑞滨和多西紫杉醇等的联合用药)和二线药物治疗法(包括多西他赛、厄洛替尼和培美曲塞)。然而,晚期非小细胞肺癌患者的5年生存率低于5%,且因化疗药物存在骨髓抑制、心脏毒性等严重的毒副作用,局限了它们在临床上的使用。因此,开发高效低毒的新型抗肺癌转移药物是至关重要的。
青蒿素是以屠呦呦为首的中国中医科学院于1971年从中药黄花蒿中成功找到抗疟的有效成分,是我国自主研制的抗疟特效药。目前青蒿素类化合物的研究发现青蒿素及其衍生物除了抗疟作用外,亦被证明具有抗菌、抗肿瘤、抗病毒、抗纤维化、调节免疫功能等药理作用。在20世纪90年代,青蒿素及其衍生物的抗肿瘤作用及机制的研究越来越多。青蒿素及其衍生物对多种肿瘤细胞有杀伤作用也已被证明。
国内外学者对青蒿素类化合物抗肿瘤作用进行了不断深入的研究。Woedenbag等报道用MTT法检测发现,青蒿素有关的内过氧化物对艾氏腹水癌细胞有抑制作用。Huang等对双氢青蒿素的研究结果表明,双氢青蒿素通过增加活性氧、抑制缺氧诱导的相关因子的激活,对大鼠C6细胞具有选择性细胞毒作用。此外,研究发现二氢青蒿素能阻断beta-catenin通路而抑制骨癌的转移。青蒿素B作为青蒿素生物合成过程中的重要中间体,与其它青蒿素类化合物相比,具有毒性较低的特点并显示出良好的抗肿瘤活性。经查阅文献未见青蒿素B的抗肿瘤迁移侵袭作用的研究报道,其具有作为抗肿瘤药物潜在的开发价值。
技术实现要素:
本发明的目的在于提供一种青蒿素类药物治疗肿瘤疾病药物中的应用,青蒿素B在制备抗肿瘤转移药物中的应用。
本发明是通过如下的技术方案来实现的:采用划痕实验、粘附实验、克隆形成实验、Transwell 迁移/侵袭实验、微丝荧光染色等技术研究青蒿素B对肿瘤细胞的迁移侵袭的抑制作用;采用Western blotting法、q-PCR法、免疫荧光实验研究青蒿素B对肿瘤细胞迁移侵袭相关信号通路的影响,探究其作用机制。
本发明相对于现有技术有益效果在于:(1)青蒿素B对A549细胞粘附和克隆形成具有明显的抑制作用,同时抑制A549细胞丝状伪足的形成而影响细胞的运动能力进而抑制细胞的迁移侵袭能力。(2)青蒿素B抑制STAT3的活化和beta-catenin的表达,下调MMP-2和MMP-9的蛋白表达来抑制A549细胞的迁移侵袭。(3)青蒿素B可能通过直接靶向抑制STAT3的活化,抑制其磷酸化入核,从而调控A549细胞的迁移侵袭。
本发明为研制新的抗肿瘤转移药物提供了科学依据,对开发利用传统中药具有重要意义。
附图说明
图1为实例1中检测青蒿素B对A549细胞克隆形成的抑制作用。
图2为实例2中检测青蒿素B对A549细胞粘附的抑制作用。
图3-5为实例3中检测青蒿素B对A549细胞迁移的抑制作用。
图6为实例4中检测青蒿素B对A549细胞侵袭的抑制作用。
图7-11为实例5中Western blot检测青蒿素B对A549细胞迁移侵袭相关蛋白的影响。
图12为实例6中q-PCR检测青蒿素B对A549细胞MMP-2、MMP-9、beta-catenin的mRNA水平的影响。
图13为实例7中免疫荧光检测青蒿素B对A549细胞中STAT3转位入核的抑制作用。
具体实施方式:
下面结合技术方案和图表详细说明本发明的具体实施例。
实施例1: 青蒿素B对A549细胞克隆形成的影响
取对数生长期的单层培养细胞,制备100 cells/mL的细胞悬液。将细胞接种于6孔板,2 mL/孔,37℃、5% CO2培养箱培养过夜。加药培养:弃去孔内上清液,加入青蒿素B药液(0.625、1.25、2.5和5 μM)2 mL/孔,每个浓度设3个复孔。实验设加药组和阴性对照组,37℃、5% CO2的条件下继续培养14天,观察克隆情况,期间换一次液。培养14天后,弃去培养板中旧培养液,用PBS洗两次,用甲醇固定细胞30 min。结晶紫染色30 min,浸自来水中冲洗多余的染色液。将6孔板置于带网格的透明胶片,用肉眼直接计数克隆。
结果显示:随着青蒿素B的浓度增加,A549细胞的克隆数目逐渐减少,克隆形成能力减弱;5 μM青蒿素B对细胞克隆形成能力的抑制率达到60%左右,相比于阴性对照组具有显著性差异(P < 0.01),可见青蒿素B明显抑制A549细胞的克隆形成,对A549细胞的增殖作用具有显著的抑制,且具有浓度依赖性,见图1。
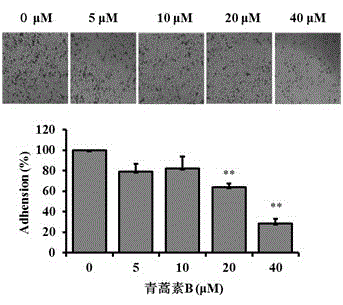
实施例2: 青蒿素B对A549细胞粘附的影响
取对数生长期的单层培养细胞,配制105 cells/mL的细胞悬液。用细胞悬液配制青蒿素B溶液,终浓度分别为40,20,10,5 μM。将含不同浓度的青蒿素B细胞悬液接种于 6孔板中,2 ml/孔,每个浓度3个复孔。实验设加药组和阴性对照组。 37℃、5% CO2的培养箱培养2.5 h后,用PBS轻轻洗两次去除未贴壁的细胞。用甲醇固定1 h,结晶紫染色1 h,浸自来水中冲洗多余的染色液,拍照并计数。
结果显示:青蒿素B浓度为20 μM和40 μM时,粘附的细胞数目明显少于对照组的细胞数目,且青蒿素B(40 μM)对于细胞粘附能力的抑制率达70%,相比于阴性对照组具有显著性差异(P < 0.01),而青蒿素B(5 μM和10 μM)对于细胞粘附的影响较对照组无显著性差异。该结果表明青蒿素B能影响A549细胞的粘附,见图2。
实施例3: 青蒿素B对A549细胞迁移的影响
① 划痕愈合实验:用直尺和Marker笔在6孔板底部画好线,将孔分布成3部分。制备5×105 cells/mL的细胞悬液,接种于6孔板,2 mL/孔,过夜铺满。划痕:用10 μL的枪头造划痕,该划痕经过底部的三条线,用PBS洗细胞2次,去除划下的细胞,并拍照。加药培养:制备4个不同浓度青蒿素B 溶液(即40、20、10、5 μM),2 mL/孔,每个浓度3个复孔,实验设加药组和阴性对照组。37℃、5% CO2的培养箱培养24 h后观察并拍照。
② Transwell 迁移实验:制备8×104 cells/200 μl的细胞悬液,用细胞悬液配制不同浓度的青蒿素B溶液(0、5、10、20、40 μM)加入到小室内层。共培养24 h。外层加入800 μL含20% FBS的培养基。去除培养基,使用甲醇固定30 min,用棉签小心去除小室内层的贴壁细胞。用PBS洗2遍。用0.25%结晶紫染色30 min。使用清水洗涤去掉多余的染料。显微镜下拍照。
③ 微丝荧光染色实验:制备1× 104 cells/mL 的细胞悬液接种在共聚焦皿中,200 μL/皿。置于37℃、5% CO2 细胞培养箱使其贴壁生长24 h。弃上清,加入青蒿素B 药液200 μL /皿,使青蒿素B终浓度为10、20、40 μM。实验设加药组、阴性对照组,于37℃、5% CO2细胞培养箱培养24 h。弃除培养液,PBS清洗两遍,4%多聚甲醛室温固定20 min。去4%多聚甲醛,并用PBS清洗两遍,0.2% TritonX-100孵育5 min。孵育后用PBS清洗两遍,FITC标记的鬼笔环肽于37℃进行染色30 min。染色后各样品PBS清洗两遍,在激光共聚焦显微镜下观察并拍照。
划痕试验结果:加药组划痕区细胞的迁移率明显少于对照组,并具有浓度依赖性,随着药物浓度的增加,划痕区愈合的宽度明显减少,青蒿素B为20 μM时,其对A549细胞的迁移抑制率达到50%左右,细胞迁移率与药物浓度关系见图3;
Transwell 迁移实验结果:随着青蒿素B给药浓度的增加细胞迁移的数目逐渐减少,呈
浓度依赖性。这表示青蒿素B对A549细胞的迁移能力具有明显的抑制作用,见图4;
微丝荧光染色实验:青蒿素B加药组与阴性对照组相比,细胞的丝状伪足发生明显变
化,随着青蒿素B浓度的增加,细胞的丝状伪足变短并且其数量逐渐减少。这说明青蒿素B通过影响A549细胞的丝状伪足抑制迁移能力,见图5。
实施例4:青蒿素B对A549细胞侵袭的影响
按基质胶:PBS=1:4的比例稀释基质胶,并均匀加入小室内层后置于37℃、5% CO2的培养箱30 min,待基质胶凝固,用PBS轻轻冲洗去除未凝固的多余基质胶。制备1× 104 cells/mL 的细胞悬液,用细胞悬液配制不同浓度的青蒿素B溶液(0、5、10、20、40 μM)加入到小室内层。共培养24 h。外层加入800 μL含20% FBS的培养基。去除培养基,使用甲醇固定30 min,用棉签小心去除小室内层的贴壁细胞。用PBS洗2遍。用0.25%的结晶紫染色30 min。使用清水洗涤去掉多余的染料。显微镜下拍照。
结果显示:A549细胞经结晶紫染色后,显微镜下可见细胞形态完整,细胞核呈深紫色,细胞浆呈淡紫色,并呈散在均匀分布。青蒿素B浓度的增加逐渐减少了细胞侵袭的数目,具有浓度依赖性,青蒿素B为20 μM时,其侵袭抑制率达到50%左右(P < 0.01)。这表明青蒿素B能显著抑制A549细胞的侵袭能力,见图6。
实施例5:Western blotting检测细胞侵袭转移相关蛋白表达的变化
考察的相关蛋白有:JNK1/2、p-JNK1/2、P38、p-P38、ERK1/2、p-ERK1/2、P-STAT3、STAT3、beta-catenin、EGFR、p-EGFR、MMP-2和MMP-9。制备1× 105 cells/mL 的细胞悬液,接种在六孔板中,2 mL/孔。置于37℃、5% CO2 细胞培养箱培养;24 h 后,弃上清,加入青蒿素B 药液2 mL /孔,使青蒿素B终浓度为2.5、5、10、20、40 μM。实验设加药组、阴性对照组,于37℃、5% CO2细胞培养箱培养4或24 h。此外,加入20 μM青蒿素B作用A549细胞,实验设加药组、阴性对照组,于37℃、5% CO2细胞培养箱分别培养0.17、0.5、1、2、4、8和24 h。提取细胞总蛋白:弃去上清,用PBS清洗细胞两次。冰浴环境下,每孔加入300 µL SDS裂解液裂解10 min。裂解完毕,于4℃,12000 rpm 下离心10 min,取上清,即得总蛋白。蛋白浓度测定:BCA 蛋白定量试剂盒测定蛋白浓度,根据标准曲线计算总蛋白含量,将各总蛋白浓度调成一致,加入5× buffer 后混匀,于100℃水中煮沸10 min,-20℃ 保存待用。
SDS-PAGE电泳:
分离胶 (10-15%) 配方见表1:
表1. SDS-PAGE 分离胶配方 (10 mL)
浓缩胶配方见表2:
表2. SDS-PAGE 浓缩胶配方 (4 mL)
取10 μL蛋白样品加入到上样孔道中,在样品的左侧孔道加入3 μL预染Marker。上样完毕,接通电源,调恒压70 V电泳,待蛋白样品进入到分离胶后,将电压调成120 V,继续电泳,待溴酚蓝前沿到达分离胶最底端时,终止电泳,取出凝胶。根据实验目的按照Marker 指示,切下所需目的蛋白的相应胶。剪切与胶大小相应的PVDF膜,置于甲醇中活化。按照阴极—海绵—滤纸—凝胶—PVDF膜—滤纸—海绵—阳极的顺序制备“三明治”,然后安装湿转仪。冰浴环境下恒流200 mA 进行转膜。转膜结束后,用含5% BSA的1×TBST溶液进行封闭PVDF膜。封闭完毕,用含5% BSA 的1×TBST溶液将目的蛋白的一抗稀释1000倍并孵育一抗,于4℃孵育过夜。次日, 取出PVDF 膜,1× TBST洗膜,洗涤4次,每次10 min。1× TBST溶液配制5% 脱脂奶粉溶液,将相应的二抗稀释2000倍并孵育二抗。二抗孵育完毕,将PVDF膜取出,用1× TBST洗膜,洗涤4次,每次10 min。将A 液和B 液等比例配制,敷在膜上。将X光片置于暗盒中压片3-5 min,取出光片显影、定影,冲洗并烘干,扫描胶片记录结果。
青蒿素B作用A549细胞4 h的结果显示:青蒿素B浓度依赖性地抑制了STAT3的磷酸化和beta-catenin的蛋白表达,对ERK1/2、p-ERK1/2、P38、p-P38、JNK、p-JNK和STAT3影响不明显,见图7;青蒿素B作用A549细胞24 h后,浓度依赖性地抑制了STAT3的磷酸化和beta-catenin、MMP-2及MMP-9的蛋白表达,但是对ERK1/2、p-ERK1/2、P38、JNK、p-EGFR和EGFR的影响不明显,而p-P38和p-JNK有所上调,见图8和图9;结合上述实验结果可以推测青蒿素B并没有通过作用于MAPKs信号通路和EGFR,而是直接作用于STAT3和beta-catenin通路来抑制A549细胞的迁移侵袭。此外,20 μM的青蒿素B作用A549细胞不同时间点(0.17、0.5、1、2、4、8和24 h)后的结果显示:随着青蒿素B作用时间的延长,STAT3的磷酸化和beta-catenin蛋白的表达发生明显的抑制,而STAT3、EGFR及p-EGFR基本没有变化,由此可以得出:青蒿素B通过抑制A549 细胞中STAT3的磷酸化和beta-catenin蛋白的表达进而下调MMP-2和MMP-9导致迁移侵袭的能力下降,见图10和图11。
实施例6 :q-PCR检测beta-catenin、MMP-2和MMP-9的mRNA表达变化
样品RNA的抽提:制备1× 106 cells/mL 的细胞悬液接种在六孔板中,2 mL/孔。置于37℃,5% CO2 细胞培养箱使其贴壁生长。24 h 后,弃上清,加入青蒿素B 药液2 mL /孔,使青蒿素B终浓度为5、20、40 μM。实验设加药组、阴性对照组,于37℃、5% CO2细胞培养箱中培养。24 h后,提取细胞RNA,弃去上清,PBS清洗2次,加入1 mL的TRIZOL试剂,在冰浴条件下裂解细胞。两相分离:每1 mL的TRIZOL试剂裂解的样品中加入0.2 mL的氯仿,盖紧管盖。手动剧烈振荡管体15 s后,静置 2-3 min。4℃下12000 rpm离心15 min。离心后混合液体将分为下层的红色氯仿相,中间层以及无色水相上层。RNA全部被分配于水相中。RNA沉淀:将水相上层转移到一干净无RNA酶的离心管中。加等体积异丙醇混合以沉淀其中的RNA,混匀后4℃孵育10 min,于4℃下12000 rpm 离心10 min。在管底部和侧壁上形成胶状沉淀块为RNA沉淀。RNA清洗:移去上清液,RNA沉淀加入至少1 mL的75%乙醇(75%乙醇用DEPC水配制),清洗RNA沉淀。混匀后,4℃下7000 rpm离心5 min。 RNA干燥:小心吸去大部分乙醇溶液,使RNA沉淀在超净台中干燥5-10 min。 溶解RNA沉淀:溶解RNA时,先加入无RNA酶的水40 μL用枪反复吹打几次,使其完全溶解,所得RNA溶液保存于-80℃待用。RNA纯度检测:RNA溶液的A260/A280的比值即为RNA纯度,比值范围1.8~2.1。检测后将各样品的浓度调为一致。
结果显示:青蒿素B能显著抑制beta-catenin、MMP-2和MMP-9 的mRNA水平,并具有浓度依赖性,具有显著性差异(P < 0.05)。实验结果说明青蒿素B既能抑制上述基因的蛋白表达也能抑制其mRNA的水平。该实验结果验证了青蒿素B通过影响beta-catenin来抑制MMP-2和MMP-9的表达从而发挥肿瘤迁移侵袭的抑制作用,见图12。
实施例7:免疫荧光法研究青蒿素B对STAT3在A549细胞内定位的影响
制备1× 104 cells/mL的A549细胞悬液接种在共聚焦皿中,200 μL/皿。置于37℃、5% CO2 细胞培养箱使其贴壁生长。24 h 后,弃上清,加入青蒿素B 药液200 μL /皿,使青蒿素B终浓度为10、20、40 μM。实验设加药组、阴性对照组,于37℃、5% CO2细胞培养箱培养。
次日,用PBS清洗1遍,4%多聚甲醛室温固定20 min。固定后,用PBS清洗1遍,0.2% TritonX-100孵育5 min。各样品均加入200 μL 的5% BSA进行室温封闭1-2 h。封闭后孵育一抗STAT3(1:200),放置于4℃孵育过夜,使抗体与目的蛋白充分结合。次日,各样品PBS清洗2遍,孵育Anti-Rabbit IgG (H+L), F(ab')2 Fragment (Alexa Fluor® 555 Conjugate),37℃,2 h。各样品PBS清洗2遍,DAPI染核,37℃,30 min。各样品PBS清洗2遍后共聚焦显微镜下拍照。
结果如图13所示:由阴性对照组中的结合图可知STAT3在细胞核中的量较多,而在加药10 μM后,STAT3在细胞核中有所减少,并在给药20 μM时减少的更为明显,这表明随着青蒿素B药物浓度的增加,STAT3的入核发生明显减少。由此可知:青蒿素B可能通过抑制STAT3的入核,从而抑制其迁移侵袭作用。
- 还没有人留言评论。精彩留言会获得点赞!