一种帕博西林或其药学上可接受的盐与药用辅料的组合物及其制备方法与流程
本发明属于药物制剂领域,具体涉及一种帕博西林或其药学上可接受的盐与药用辅料的组合物及其制备方法。
背景技术:
帕博西林(Palbociclib),化学名为6-乙酰基-8-环戊基-5-甲基-2-[5-(1-哌嗪基)吡啶-2-基氨基]-8H-吡啶并[2,3-d]嘧啶-7-酮,商品名为Ibrance,是辉瑞公司开发的一种口服的治疗转移性乳腺癌的新药,帕博西林是细胞周期素依赖性激酶4、6的抑制药物,主要通过抑制CDK4/6活性来阻止细胞由G1期到S期进而抑制DNA的合成。临床试验研究发现,帕博西林联合来曲唑对绝经后的局部浸润性乳腺癌患者或新近诊断的雌激素受体(ER)阳性,HER-2阴性的患者非常有效。帕博西林已于2015年2月3日获得了美国食品和药物管理局(FDA)批准上市。美国食品药监局(FDA)称该药是一种突破性药物,能够提供比现在市场上的药物更加持久的药效。
虽然帕博西林的疗效已获得广泛认可,但仍然存在一些缺陷。专利WO2014128588公开了帕博西林游离碱的两种晶型:Form A和Form B,但并未见无定型的报道。该药物用于制剂的是游离碱晶型Form A,虽然Form A是热力学稳定的晶型,稳定型良好,但从该晶型在水中的溶解度极低,近中性条件下,溶解度仅为19毫克/升。因此,该药物为难溶性药物,其极低的水溶性严重影响了药物的生物利用度。此外,患者之间药效差异较大,有13%的患者对原研药物吸收极低,餐后服用可稍稍提高药物的吸收,食用相当于3克花生油的低脂食物可提高吸收12%,而食用相当于67克花生油的高脂食物可提高吸收21%,但高脂食物对病人的健康也有相当大的危害。
药物的固体形态直接影响原料药的溶解速率、制剂的溶出度和生物利 用度,为了提高药物的生物利用度,降低用量、降低毒副作用,通常会开发药物的新的固体形态,因此,开发该药物溶解性更好、生物利用度更高的固体形式就显得很有必要。
药物的固体形态除晶态外,还有无定型状态,药物的无定型状态作为固体物质的一种特殊形态,在药物制备中有着重要的用途。无定型态药物不仅可以广泛应用于药物制剂中,而且可以通过多种技术手段和方法提高无定型态药物的稳定性,使之成为具有优良品质的药物。
由于帕博西林在生物利用度方面的不足和无定型药物活性成分在药物制剂方面的良好的应用前景,寻找新的无定型帕博西林及其制备方法就显得十分必要。
技术实现要素:
本发明的目的是提供一种帕博西林或其药学上可接受的盐与药用辅料的组合物及其制备方法,得到稳定性及分散性良好的无定型态的帕博西林或其药学上可接受的盐与药用辅料的组合物,增加了帕博西林或其盐的溶出度,该制备方法不受干燥过程的限制,也不受溶剂种类和溶剂量的限制,操作简便,成本低廉,易于实现,可实现工业化生产。
为了达到上述目的,本发明的技术方案如下:
一种帕博西林或其药学上可接受的盐与药用辅料的组合物,该组合物包含帕博西林或其药学上可接受的盐与药用辅料,两者的重量比为1:0.1~100,其中,所述组合物中的帕博西林或其药学上可接受的盐为无定型态,所述组合物的X-射线粉末衍射光谱中,扣除药用辅料的背景峰后无帕博西林或其盐的晶体的特征峰。
进一步,所述药用辅料选自稀释剂、润滑剂、粘合剂、崩解剂、表面活性剂、成膜材料、包衣材料和胶囊材料中的至少一种。
优选地,所述的药用辅料选自羟丙甲基纤维素、羟丙基纤维素、聚维酮,聚乙二醇、乙基纤维素、脂质体、甲基丙烯酸共聚物、聚醋酸乙烯、羧甲基乙基纤维素、羧甲基纤维素邻苯二甲酸酯、羟丙甲基纤维素邻苯二甲酸酯、羟丙甲基纤维素醋酸酯琥珀酸酯、聚丙烯酸树脂、聚羧乙烯、藻酸盐、卡拉胶、羧基乙酸内酯、树胶、聚乙烯醇、预胶化淀粉、交联淀粉、 羧甲基淀粉钠、糊精、聚环氧乙烷、壳聚糖、几丁聚糖、离子交换树脂和胶原蛋白中的至少一种。
本发明的帕博西林或其药学上可接受的盐与药用辅料的组合物的制备方法,包括如下步骤:
1)将帕博西林或其药学上可接受的盐和药用辅料混合,加热至药用辅料熔融;其中,帕博西林或其药学上可接受的盐与药用辅料的重量比为1:0.1~100;
2)混合均匀后冷却,将混合物粉碎,得到无定型态的帕博西林或其药学上可接受的盐与药用辅料的组合物。
进一步,所述药用辅料选自稀释剂、润滑剂、粘合剂、崩解剂、表面活性剂、成膜材料、包衣材料和胶囊材料中的至少一种。
优选地,步骤1)中所述的药用辅料选自羟丙甲基纤维素、羟丙基纤维素、聚维酮,聚乙二醇、乙基纤维素、脂质体、甲基丙烯酸共聚物、聚醋酸乙烯、羧甲基乙基纤维素、羧甲基纤维素邻苯二甲酸酯、羟丙甲基纤维素邻苯二甲酸酯、羟丙甲基纤维素醋酸酯琥珀酸酯、聚丙烯酸树脂、聚羧乙烯、藻酸盐、卡拉胶、羧基乙酸内酯、树胶、聚乙烯醇、预胶化淀粉、交联淀粉、羧甲基淀粉钠、糊精、聚环氧乙烷、壳聚糖、几丁聚糖和胶原蛋白中的至少一种。
本发明提供另一种帕博西林或其药学上可接受的盐与药用辅料的组合物的制备方法,包括如下步骤:
1)将帕博西林或其药学上可接受的盐和药用辅料在溶剂中混合,混合温度为-50~150℃,形成含帕博西林或其盐和药用辅料的溶液或悬浮液,其中,帕博西林或其药学上可接受的盐与溶剂的重量比为0.001~100:1,帕博西林或其药学上可接受的盐与药用辅料的重量比为1:0.1~100;
2)除去步骤1)得到的溶液或悬浮液中的溶剂,得到无定型态的帕博西林或其药学上可接受的盐与药用辅料的组合物。
进一步,所述药用辅料选自稀释剂、润滑剂、粘合剂、崩解剂、表面活性剂、成膜材料、包衣材料和胶囊材料中的至少一种。
优选地,步骤1)中所述的药用辅料选自羟丙甲基纤维素、羟丙基纤维素、聚维酮,聚乙二醇、乙基纤维素、脂质体、甲基丙烯酸共聚物、聚 醋酸乙烯、羧甲基乙基纤维素、羧甲基纤维素邻苯二甲酸酯、羟丙甲基纤维素邻苯二甲酸酯、羟丙甲基纤维素醋酸酯琥珀酸酯、聚丙烯酸树脂、聚羧乙烯、藻酸盐、卡拉胶、羧基乙酸内酯、树胶、聚乙烯醇、预胶化淀粉、交联淀粉、羧甲基淀粉钠、糊精、聚环氧乙烷、壳聚糖、几丁聚糖、离子交换树脂和胶原蛋白中的至少一种。
又,步骤1)所述溶剂选自含12个以下碳原子的醇类、酚类、醚类、卤代烃、酮类、醛类、腈类、酰胺、砜、亚砜、羧酸和水中的至少一种,步骤2)除去溶剂的方法包括:蒸发、真空蒸发、喷雾干燥、冷冻干燥、热熔挤出、过滤、离心或搅拌薄膜干燥。
本发明中的组合物是指混合物、复合物、共聚物、共沉淀物、共晶、固体分散体、溶剂合物和水合物。
本发明的帕博西林或其药学上可接受的盐与药用辅料的组合物,使用Cu-Kα辐射,以度2θ表示的X-射线粉末衍射光谱中扣除药用辅料的背景峰无帕博西林结晶态的特征峰,表明帕博西林或其药学上可接受的盐为无定型状态。现有技术中一般使用帕博西林的结晶态,未见其无定型态的报道。一般由于晶态物质分子的有序和周期性排列,降低了分子间相互作用的能量,能量较低,而本发明的帕博西林或其药学上可接受的盐为无定型态,分子处于高度无序状态,物质的表面自由能更大,固体物质中的分子较晶态固体物质中的分子有更高的能量,更容易分散,增加其溶出度,提高帕博西林或其盐的生物利用度。
本发明将帕博西林或其药学上可接受的盐和药用辅料混合均匀后,使用“固体分散剂”法,通过药用辅料的多聚体网状结构将药物分子阻隔,抑制结晶的发生,使其保持分散和无定型状态。本发明采用应用广泛、价格低廉、溶解性好的药用辅料,这些药用辅料与帕博西林或其药学上可接受的盐混合,配合蒸发、喷雾干燥、冷冻干燥和热熔挤出等技术可以得到帕博西林或其药学上可接受的盐的无定型形式,增加本发明帕博西林或其药学上可接受的盐的组合物中的帕博西林或其药学上可接受的盐的无定型态的稳定性。
本发明选用在药学上应用广泛的、价格低廉的辅料,得到帕博西林或其药学上可接受的盐与药用辅料的组合物,易于开发制剂配方,本发明的 制备方法不受干燥过程的限制,也不受溶剂种类和溶剂量的限制,操作简便,成本低廉,易于实现,可实现工业化生产。
与现有技术相比,本发明的有益效果是:
1)本发明制备的无定型帕博西林或其盐与药用辅料的组合物具有高度分散性及稳定性,在制成固体制剂后,经过崩解可使药物粒子的分散程度更好,分散及溶出速度更快,有利于药物的吸收。因此,无定型状态药物的溶出度明显增加,更有利于机体对药物的吸收,提高药物的生物利用度,使药物能够更好地发挥临床疾病治疗作用。
2)本发明无定型状态的帕博西林或其药学上可接受的盐与药用辅料的组合物的制备方法不受干燥过程的限制,也不受溶剂种类和溶剂量的限制,操作简便,成本低廉,易于实现,可实现工业化生产。
3)本发明制备的无定型状态的帕博西林或其盐与药用辅料的组合物在高温、高湿条件下,有关物质无显著改变,无帕博西林结晶析出;在加速试验条件下(40±2℃,湿度75%±5%),有关物质无显著改变,无帕博西林结晶析出,本发明的无定型状态的帕博西林或其药学上可接受的盐与药用辅料的组合物能保持良好的物理稳定性和化学稳定性,将会有广阔的应用前景。
附图说明
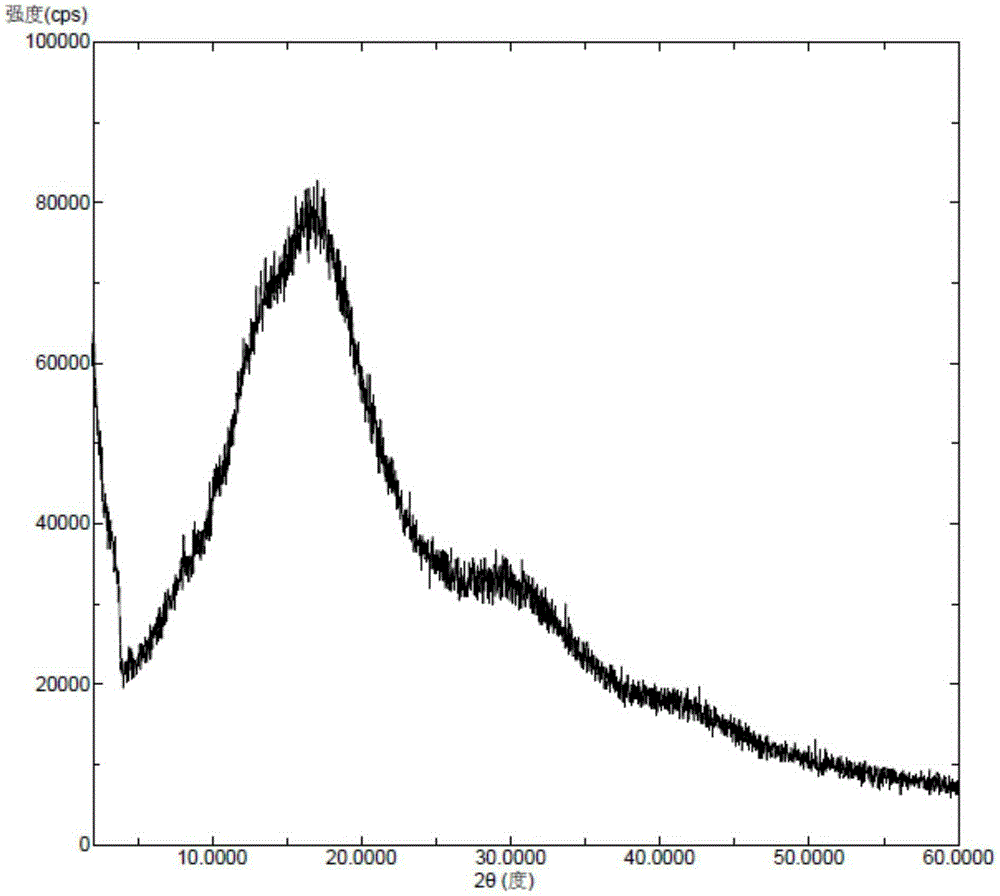
图1为本发明实施例1的无定型帕博西林和聚维酮K30的组合物的X-射线粉末衍射图。
图2为本发明实施例12的无定型帕博西林和聚丙烯酸树脂L100的组合物的X-射线粉末衍射图。
具体实施方式
以下结合具体实施例对本发明作进一步说明,但本发明的保护范围不受以下实施例的限制。
本发明所述的X-射线粉末衍射图在Ultima IV X-射线衍射仪上采集。本发明所述的X-射线粉末衍射的方法参数如下:
X-射线粉末参数:Cu-Kα
Kα1.5418
电压:40千伏
电流:40毫安
发散狭缝:自动
扫描模式:连续
扫描范围:自2.0至60.0度
取样步长:0.0200度
扫描速率:60度/分钟
实施例1
将帕博西林(50毫克)和聚维酮K30(100毫克)溶于正丁醇(600微升)、苯甲醚(900微升)和甲醇(600微升)中,加热到60℃搅拌溶清。将上述溶液迅速降温到-10℃,析出白色固体,过滤,干燥,得到无定型帕博西林与聚维酮K30的组合物,该组合物的X-射线粉末衍射图如图1所示,X-射线粉末衍射图中扣除药用辅料的背景峰后无帕博西林晶型的特征峰。
实施例2
将帕博西林盐酸盐(50毫克)和聚乙二醇4000(200毫克)溶于乙醇(600微升)和水(600微升)中,在-40℃下搅拌混合均匀。将上述溶液在旋转蒸发器中缓慢浓缩至干,得到白色固体,得到无定型帕博西林与聚乙二醇4000的组合物,该组合物的X-射线粉末衍射图中,扣除药用辅料的背景峰后无帕博西林盐酸盐晶型的特征峰。
实施例3
将帕博西林盐酸盐(5克)和聚乙二醇8000(10克)加入水(300毫升)中,加热到60℃搅拌溶清。将上述溶液用JISL微型喷雾干燥机LSD-48干燥,维持进口温度60℃、出口温度50℃,收集出口物料,得到白色固体,进一步真空干燥得到无定型帕博西林与聚乙二醇8000的组合物,该 组合物的X-射线粉末衍射图中,扣除药用辅料的背景峰后无帕博西林盐酸盐晶型的特征峰。
实施例4
将帕博西林羟基乙磺酸盐(1克)和羟丙甲基纤维素E50(0.2克)加到水(10毫升)中,加热到40℃搅拌溶清。将上述溶液冷冻干燥,得到白色固体,即无定型帕博西林与羟丙甲基纤维素E50的组合物,该组合物的X-射线粉末衍射图中,扣除药用辅料的背景峰后无帕博西林羟基乙磺酸盐晶型的特征峰。
实施例5
将帕博西林(1克)和聚乙二醇8000(50克)加热到熔融,搅拌下迅速冷却到室温,得到白色固体。将上述固体粉碎,得到白色粉末状固体,即无定型帕博西林与聚乙二醇8000的组合物,该组合物的X-射线粉末衍射图中,扣除药用辅料的背景峰后无帕博西林晶型的特征峰。
实施例6
将帕博西林(1克)、苯甲醚(0.1克)和聚乙二醇10000(100克)加热到240℃,混合均匀,迅速冷却到室温,得到白色固体。将上述固体粉碎,得到白色粉末状固体,即无定型帕博西林与聚乙二醇10000的组合物,该组合物的X-射线粉末衍射图中,扣除药用辅料的背景峰后无帕博西林晶型的特征峰。
实施例7
将帕博西林(1克)、苯甲醚(10克)、正丁醇(20克)和脂质体(4克)的混合物加热到90℃,搅拌,混合均匀,真空蒸发除去溶剂,冷却到室温得到白色固体,即无定型帕博西林与脂质体的组合物,该组合物的X-射线粉末衍射图中,扣除药用辅料的背景峰后无帕博西林晶型的特征峰。
实施例8
将帕博西林氢溴酸盐(1克)、甲醇(20克)和甲基丙烯酸共聚物A型(4克)的混合物加热到50℃,搅拌,溶清,真空蒸发除去溶剂,冷却到室温得到白色固体,即无定型帕博西林与甲基丙烯酸共聚物A型的组合物,该组合物的X-射线粉末衍射图中,扣除药用辅料的背景峰后无帕博西林氢溴酸盐晶型的特征峰。
实施例9
将帕博西林(1克)、正丁醇(20克)、苯甲醚(10克)和乙基纤维素(2克)的混合物加热到30℃,搅拌,混合均匀,真空蒸发除去溶剂,冷却到室温得到白色固体,即无定型帕博西林与乙基纤维素的组合物,该组合物的X-射线粉末衍射图中,扣除药用辅料的背景峰后无帕博西林晶型的特征峰。
实施例10
将帕博西林盐酸盐(1克)、甲醇(20克)和羟丙基纤维素SSL(4克)的混合物加热到30℃,搅拌溶清,真空蒸发除去溶剂,冷却到室温得到白色固体,即无定型帕博西林与羟丙基纤维素SSL的组合物,该组合物的X-射线粉末衍射图中,扣除药用辅料的背景峰后无帕博西林盐酸盐晶型的特征峰。
实施例11
将帕博西林羟基乙磺酸盐(1克)、甲醇(20克)、水(10克)和聚醋酸乙烯(4克)的混合物加热到30℃,搅拌溶清,真空蒸发除去溶剂,冷却到室温得到白色固体,即无定型帕博西林与聚醋酸乙烯的组合物,该组合物的X-射线粉末衍射图中,扣除药用辅料的背景峰后无帕博西林羟基乙磺酸盐晶型的特征峰。
实施例12
将帕博西林(50毫克)和聚丙烯酸树脂Eudragit L100(100毫克)加 入到甲醇(750微升),室温下搅拌溶清。将上述溶液在旋转蒸发器中缓慢浓缩至干,得到白色固体,即无定型帕博西林与聚丙烯酸树脂Eudragit L100的组合物,该组合物的X-射线粉末衍射图如图2所示,X-射线粉末衍射图中扣除药用辅料的背景峰后无帕博西林晶型的特征峰。
实施例13
将帕博西林(50毫克)和聚丙烯酸树脂Eudragit S100(5毫克)加入到甲醇(4毫升)和乙酸乙酯(1毫升),-30℃下搅拌溶清。将上述溶液在旋转蒸发器中缓慢浓缩至干,得到白色固体,搅拌下析出白色固体,即无定型帕博西林与聚丙烯酸树脂Eudragit S100的组合物,该组合物的X-射线粉末衍射图中,扣除药用辅料的背景峰后无帕博西林晶型的特征峰。
实施例14
将帕博西林(50毫克)和聚羧乙烯Carbomer 940(50毫克)加入到甲醇(4毫升)和四氢呋喃(1毫升),-30℃下搅拌混合均匀。将上述溶液在旋转蒸发器中缓慢浓缩至干,得到白色固体,搅拌下析出白色固体,即无定型帕博西林与聚羧乙烯Carbomer 940的组合物,该组合物的X-射线粉末衍射图中,扣除药用辅料的背景峰后无帕博西林晶型的特征峰。
实施例15
将帕博西林(50毫克)和预胶化淀粉Pharma-Gel(100毫克)加入到甲醇(4毫升)和水(1毫升),室温下混合均匀。将上述溶液在旋转蒸发器中缓慢浓缩至干,得到白色固体,搅拌下析出白色固体,即无定型帕博西林与Pharma-Gel预胶化淀粉的组合物,该组合物的X-射线粉末衍射图中,扣除药用辅料的背景峰后无帕博西林晶型的特征峰。
实施例16
将达格列净(50毫克)和高支链交联淀粉(50毫克)加入到甲醇(4毫升)和水(1毫升),室温下搅拌溶清,将上述溶液在旋转蒸发器中缓慢浓缩至干,得到白色固体,搅拌下析出白色固体,即无定型达格列净与 高支链交联淀粉的组合物,该组合物的X-射线粉末衍射图中,扣除药用辅料的背景峰后无帕博西林晶型的特征峰。
实施例17
将帕博西林(50毫克)和羧甲基纤维素钠SCMC(500毫克)加入到二甲基亚砜(5毫升),室温下搅拌溶清。将上述溶液在旋转蒸发器中缓慢浓缩至干,得到白色固体,即无定型帕博西林与羧甲基纤维素钠SCMC的组合物,该组合物的X-射线粉末衍射图中,扣除药用辅料的背景峰后无帕博西林晶型的特征峰。
实施例18
将帕博西林(50毫克)和几丁聚糖(500毫克)加入到乙醇(5毫升),室温下搅拌溶清,将上述溶液在旋转蒸发器中缓慢浓缩至干,得到白色固体,即无定型帕博西林与几丁聚糖的组合物,该组合物的X-射线粉末衍射图中,扣除药用辅料的背景峰后无帕博西林晶型的特征峰。
实施例19
将帕博西林(50毫克)和羧甲基淀粉钠Explotab(500毫克)加入到乙醇(5毫升),室温下搅拌混合均匀,将上述溶液在旋转蒸发器中缓慢浓缩至干,得到白色固体,即无定型帕博西林与羧甲基淀粉钠Explotab的组合物,该组合物的X-射线粉末衍射图中,扣除药用辅料的背景峰后无帕博西林晶型的特征峰。
实施例20
将帕博西林(50毫克)和藻酸盐E401(500毫克)加入到乙醇(5毫升),室温下搅拌混合均匀。将上述溶液在旋转蒸发器中缓慢浓缩至干,得到白色固体,即无定型帕博西林与藻酸盐E401的组合物,该组合物的X-射线粉末衍射图中,扣除药用辅料的背景峰后无帕博西林晶型的特征峰。
实施例21
将帕博西林(50毫克)和羧甲基纤维素邻苯二甲酸酯Agucoat CPD(5克)悬浮于甲醇(30毫升),加热到50℃搅拌混合均匀。将上述溶液在旋转蒸发器中缓慢浓缩除去大部分溶剂,过滤,干燥,得到白色固体,即无定型帕博西林与羧甲基纤维素邻苯二甲酸酯Agucoat CPD的组合物,该组合物的X-射线粉末衍射图中,扣除药用辅料的背景峰后无帕博西林晶型的特征峰。
实施例22
将帕博西林(50毫克)和卡拉胶E407(500毫克)悬浮于甲醇(30毫升),加热到50℃搅拌混合均匀,将上述溶液在旋转蒸发器中缓慢浓缩除去大部分溶剂,过滤,干燥,得到白色固体,即无定型帕博西林与卡拉胶E407的组合物,该组合物的X-射线粉末衍射图中,扣除药用辅料的背景峰后无帕博西林晶型的特征峰。
实施例23
将帕博西林(50毫克)和壳聚糖(5克)悬浮于甲醇(50毫升),加热到50℃搅拌混合均匀。将上述溶液在旋转蒸发器中缓慢浓缩除去大部分溶剂,过滤,干燥,得到白色固体,即无定型帕博西林与壳聚糖的组合物,该组合物的X-射线粉末衍射图中,扣除药用辅料的背景峰后无帕博西林晶型的特征峰。
实施例24
将帕博西林(30毫克)和聚丙烯酸树脂Eudragit E100(30毫克)溶于正丁醇(600微升)、苯甲醚(900微升)和N,N-二甲基甲酰胺(600微升)中,加热到50℃搅拌溶清,将上述溶液降温到10℃,析出白色固体,过滤,干燥,得到无定型帕博西林与聚丙烯酸树脂Eudragit E100的组合物,该组合物的X-射线粉末衍射图中,扣除药用辅料的背景峰后无帕博西林晶型的特征峰。
实施例25
将帕博西林(30毫克)和胶原蛋白Peptan(300毫克)溶于正丁醇(600微升)、苯甲醚(900微升)和乙腈(600微升)中,加热到50℃搅拌溶清。将上述溶液降温到10℃,析出白色固体,过滤,干燥,得到无定型帕博西林与胶原蛋白Peptan的组合物,该组合物的X-射线粉末衍射图中,扣除药用辅料的背景峰后无帕博西林晶型的特征峰。
实施例26
将帕博西林(30毫克)和树胶Galactosol(300毫克)溶于正丁醇(600微升)、苯甲醚(900微升)和甲醇(600微升)中,加热到50℃搅拌溶清。将上述溶液降温到10℃,析出白色固体,过滤,干燥,得到无定型帕博西林与树胶Galactosol的组合物,该组合物的X-射线粉末衍射图中,扣除药用辅料的背景峰后无帕博西林晶型的特征峰。
实施例27
将帕博西林羟基乙磺酸盐(30毫克)和羟丙甲基纤维素邻苯二甲酸酯HPMCP(30毫克)加入到乙醇(750微升)和水(750微升),加热到80℃搅拌混合均匀。将上述溶液在旋转蒸发器中缓慢浓缩除去溶剂,得到白色固体,即无定型帕博西林羟基乙磺酸盐与羟丙甲基纤维素邻苯二甲酸酯HPMCP的组合物,该组合物的X-射线粉末衍射图中,扣除药用辅料的背景峰后无帕博西林羟基乙磺酸盐晶型的特征峰。
实施例28
将帕博西林氢溴酸盐(30毫克)和离子交换树脂Amberlite IR-120(300毫克)加入到乙醇(750微升)和水(750微升),加热到80℃搅拌混合均匀。将上述溶液在旋转蒸发器中缓慢浓缩除去溶剂,得到棕色固体,即无定型帕博西林氢溴酸盐与离子交换树脂Amberlite IR-120的组合物,该组合物的X-射线粉末衍射图中,扣除药用辅料的背景峰后无帕博西林氢溴酸盐晶型的特征峰。
实施例29
将帕博西林(30毫克)和羧基乙酸内酯(300毫克)加入到乙醇(750微升)和水(750微升),加热到80℃搅拌混合均匀。将上述溶液在旋转蒸发器中缓慢浓缩除去溶剂,得到棕色固体,即无定型帕博西林与羧基乙酸内酯的组合物,该组合物的X-射线粉末衍射图中,扣除药用辅料的背景峰后无帕博西林晶型的特征峰。
实施例30
将帕博西林(30毫克)和糊精Maltrin M100(300毫克)加入到乙醇(750微升)和水(750微升),加热到80℃搅拌混合均匀。将上述溶液在旋转蒸发器中缓慢浓缩除去溶剂,得到棕色固体,即无定型帕博西林与糊精Maltrin M100的组合物,该组合物的X-射线粉末衍射图中,扣除药用辅料的背景峰后无帕博西林晶型的特征峰。
实施例31
将帕博西林盐酸盐(30毫克)和羧甲基纤维素钠SCMS(3毫克)加入到水(30毫升),加热到100℃搅拌混合均匀。将上述溶液在旋转蒸发器中缓慢浓缩除去溶剂,得到白色固体,即无定型帕博西林盐酸盐与羧甲基纤维素钠SCMC的组合物,该组合物的X-射线粉末衍射图中,扣除药用辅料的背景峰后无帕博西林盐酸盐晶型的特征峰。
实施例32
将帕博西林二盐酸盐(30毫克)和β-环糊精(30毫克)加入到甲醇(300微升)和水(300微升),室温下搅拌溶清。将上述溶液在旋转蒸发器中缓慢浓缩除去溶剂,得到白色固体,即无定型帕博西林二盐酸盐与β-环糊精的组合物,该组合物的X-射线粉末衍射图中,扣除药用辅料的背景峰后无帕博西林二盐酸盐晶型的特征峰。
实施例33
将帕博西林(30毫克)和羧甲基纤维素钠SCMC(30毫克)加入到 甲醇(300微升)和水(60微升),60℃下搅拌混合均匀。将上述溶液在旋转蒸发器中缓慢浓缩除去溶剂,得到白色固体,即无定型帕博西林与羧甲基纤维素钠SCMC的组合物,该组合物的X-射线粉末衍射图中,扣除药用辅料的背景峰后无帕博西林晶型的特征峰。
实施例34
将帕博西林(5毫克)和聚环氧乙烷Polyox WSR301(60毫克)加入到甲醇(300微升)和水(60微升),60℃下搅拌混合均匀。将上述溶液在旋转蒸发器中缓慢浓缩除去溶剂,得到白色固体,即无定型索非布韦与聚环氧乙烷Polyox WSR301的组合物,该组合物的X-射线粉末衍射图中,扣除药用辅料的背景峰后无帕博西林晶型的特征峰。
实施例35
将帕博西林(30毫克)和聚乙烯醇EG-40(60毫克)加入到甲醇(300微升)和水(60微升),60℃下搅拌溶清,将上述溶液在旋转蒸发器中缓慢浓缩除去溶剂,得到白色固体,即无定型帕博西林与聚乙烯醇EG-40的组合物,该组合物的X-射线粉末衍射图中,扣除药用辅料的背景峰后无帕博西林晶型的特征峰。
实施例36
将帕博西林(50毫克)和羟丙甲基纤维素醋酸酯琥珀酸酯Agoat MG(2克)加入到乙醇(10毫升)和水(2毫升),80℃下搅拌混合均匀,将上述溶液在旋转蒸发器中缓慢浓缩至干,得到白色固体,即无定型帕博西林与羟丙甲基纤维素醋酸酯琥珀酸酯Agoat MG的组合物,该组合物的X-射线粉末衍射图中,扣除药用辅料的背景峰后无帕博西林晶型的特征峰。
实施例37
将帕博西林(50毫克)和羧甲基乙基纤维素(2克)加入到乙醇(10毫升)和水(1毫升),80℃下搅拌混合均匀,将上述溶液在旋转蒸发器 中缓慢浓缩至干,得到白色固体,即无定型帕博西林与羧甲基乙基纤维素的组合物,该组合物的X-射线粉末衍射图中,扣除药用辅料的背景峰后无帕博西林晶型的特征峰。
实施例38:无定型帕博西林与聚维酮K30组合物的影响因素试验
材料:实施例1所得无定型帕博西林与聚维酮K30的组合物
表1:
表1说明:无定型帕博西林与聚维酮K30组合物在高温、高湿条件下,放置10天,有关物质无显著改变,无帕博西林结晶析出。
实施例39:无定型帕博西林与聚维酮K30组合物的影响因素试验
材料:实施例1所得无定型帕博西林与聚维酮K30的组合物
实验条件:温度40℃±2℃,湿度75%±5%
表2:
表2说明:无定型帕博西林与聚维酮K30组合物在加速试验条件下,放置6个月,有关物质无显著改变,无帕博西林结晶析出。
本发明的帕博西林或其药学上可接受的盐与药用辅料的无定型组合物,其溶出度明显增加,更有利于提高药物的生物利用度,使药物能够更好地发挥临床疾病治疗作用,该无定型物在加速试验条件下(40±2℃,湿度75%±5%),能保持良好的物理稳定性和化学稳定性。
- 还没有人留言评论。精彩留言会获得点赞!