聚肌胞苷酸,咪喹莫特和嘎德莫特在构建病毒免疫小鼠模型中的用途的制作方法
本发明涉及生物医药领域,特别是涉及聚肌胞苷酸,咪喹莫特和嘎德莫特在构建病毒免疫小鼠模型中的用途。
背景技术:
呼吸道病毒感染是常见的,且常表现出良性的临床病程。然而,相当多一部分的病人发展成伴随性或继发性细菌感染,这种并发症可导致呼吸衰竭或死亡。尽管在儿童,老人和免疫力抑制人群中,此类并发症的暴发率最高,但是病毒细菌性肺炎也可能出现于健康成年人群中,并导致沉重的疾病负担。随着流感感染流行,病毒-细菌性肺炎屡次被报道。它是导致20世纪的流感流行期和2009年甲型H1N1流感大流行期的患者死亡主要原因。
对于病毒感染是如何促进细菌感染的机制仍然知之甚少,但有可能极其复杂。流感研究案例已提出的机制包括流感引起一般具有保护性的呼吸道上皮细胞层的损伤机制,细菌介导受体的结合增强机制,抗炎因子如IL-10诱导机制,以及识别模式分子的表达如Toll样受体的减弱机制。此外,近期,我们和其他人发现,宿主针对流感的免疫反应,如I型和II型干扰素诱导,可能与抑制先天性抗菌免疫应答关键环节。原因包括巨噬细胞和嗜中性粒细胞应答受损先前文献显示:这两种类型的先天性免疫细胞在肺部病原菌清除方面具有至关重要的作用。然而,鉴于流感感染导致肺部的多样性变化,由流感诱导的非损伤性的抗病毒免疫通路的活化是否有助于细菌继发性感染的机制尚不明确。
此外,流感导致宿主防御障碍的现象是否与其他病毒病原体相关尚不清楚。在临床上,许多病毒与细菌会形成联合感染,包括呼吸道合胞病毒(RSV)和鼻腔病毒(这两者都是RNA病毒)。因此,我们进行了此项研究,假设仅仅活化宿主呼吸道疾病的病毒RNA识别受体将会导致细菌清除力的下降。我们在采用合成化合物(特别是聚肌胞苷酸,咪喹莫特和嘎德莫特)给药,接下来,进行细菌感染。此类药物是众所周知的可模拟病毒核酸对免疫系统的影响的药物。聚肌苷酸是可激活TLR3的合成化合物,TLR3受体可识别核内dsRNA;还有RIG类似受体(RLRs)维甲酸诱导性基因(RIG-I)和可识别RNA病毒核酸的黑色素瘤分化-相关蛋白5(MDA5)细胞质受体。咪喹莫特和嘎德莫特(R848)激活可识别单链RNA的TLR7。聚肌苷酸和TLR7激动剂作为治疗或预防剂,抵御流感或潜在生物病原体的多种呼吸道病原菌,包括流感,H5N1禽流感病毒,和土拉弗朗西斯菌。它们被认为是一种有效且安全的抗病毒免疫反应的“助推器”。以肺部感染小鼠作为动物模型,我们以滴鼻给药的方式,注入聚肌苷酸和TLR7激动剂,继而,以常见的呼吸道病原菌(可导致继发性肺炎的病原菌)感染实验小鼠,最终确定的抗病毒免疫通络的激活是否增加宿主继发性细菌感染的敏感性。我们发现,聚肌苷酸给药,类似流感感染,损害宿主对肺炎链球菌和金黄色葡萄球菌的清除力。此外,聚肌苷酸的有害作用可能是由I型干扰素介导的。我们的研究结果表明,聚肌苷酸可能不是一个良性免疫刺激分子,其作为病毒流行时的预防或治疗剂的存在疑虑。
技术实现要素:
呼吸道的病毒感染是常见呼吸道疾病,紧接着大部分的病人会发展成为伴随性或者继发性细菌感染,然而对于病毒感染是如何促进细菌感染的机制仍然知之甚少。虽然流感研究案例已经提出若干的机制,但是鉴于流感感染导致的肺部变化是多样的,由流感诱导的非损伤性的抗病毒免疫通路的活化是否有助于细菌继发性感染的机制尚不明确。此外,流感导致宿主防御障碍的现象是否与其他病毒病原体相关尚不清楚。近期,我们与他人的研究发现由流感引起的免疫应答反而能够抑制抗菌性先天免疫的关键部分,比如由IFNI和IFNII引起的免疫。
鉴于以上所述现有技术,本发明模拟了小鼠体内病毒免疫模型,第一方面提供聚肌胞苷酸在宿主肺部对细菌清除中的作用。
聚肌胞苷酸和咪喹莫特分别是TLR3激动剂和TLR7激动剂,都是我们所熟知的能够模拟核酸病毒对免疫系统影响的药物。实验数据显示,经聚肌胞苷酸鼻腔给药后的小鼠对于肺部肺炎链球菌的清除能力于对照组大大降低,而TLR7激动剂组无明显变化,同时我们也检测到聚肌胞苷酸也能使肺部对金黄色葡萄球菌的清除能力降低。
本发明第二方面提供细菌清除能力和聚肌胞苷酸的持续给药时间呈反向关系。
由于流感通常需要持续几天,所以我们进行了相关的实验。经聚肌胞苷酸给药一次或三次的实验小鼠对细菌的清除能力均都有所明显下降,但是经聚肌胞苷酸给药一次的小鼠肺部细菌的平均CFU值是对照组的8倍,而经聚肌胞苷酸给药三次的小鼠是13倍。因此细菌清除能力随着聚肌胞苷酸持续给药时间的增加而降低。
本发明第三方面提供TLR3和Cardif通路在聚肌胞苷酸诱导细菌清除率下降中的作用。
聚肌胞苷酸能同时激活TLR3和Cardif通路。我们发现,TLR3-/-小鼠和Cardif-/-小鼠在聚肌胞苷酸给药后,宿主对肺部的细菌清除率有所提高,而TLR3和Cardif双敲小鼠则表现为显著提高。TLR3和Cardif基因均无敲除的小鼠在无聚肌胞苷酸给药的条件下,其肺部的肺部的清除率与野生小鼠组无明显差异。因此,TLR3和Cardif通路均有助于聚肌胞苷酸诱导宿主对细菌的易感性。
本发明第四方面提供IFNI在肺部细菌清除中发生的作用
我们已证实,流感期间,IFNI可导致肺炎链球菌的清除率降低。在本发明中,我们发现经聚肌胞苷酸给药后的小鼠肺部IFN的表达量是明显升高,经聚肌胞苷酸给药后的IFNAR缺陷型小鼠肺部细菌的清除率有所增加。然而,我们使用IFNAR阻断抗体进行重复实验发现,在无病毒抗体的条件下,IFNI通路不会介导肺部对肺炎链球菌的清除。
本发明的第五方面提供IFNI可增加机体在抗病毒免疫机制活化条件下对肺炎链球菌的易感性。
聚肌胞苷酸处理后的野生型小鼠在细菌感染7天后死亡率即达到100%,而聚肌胞苷酸处理后的Ifnar−/−小鼠在细菌感染14天后,仍有60%的存活率。通过小鼠肺部切片发现,当继发性细菌感染引起早期和晚期细菌清除障碍后,IFNI在聚肌胞苷酸引起的死亡危害中起着一定的作用。
附图说明:
图1:聚肌胞苷酸提高肺组织对细菌的易感性。A. 实验小鼠每天分别用多聚肌胞苷酸(50 ug),TLR7激动剂,生理盐水处理,持续2天。最后一次处理24h后,用肺炎链球菌(900 CFU,30 ul)感染小鼠。在第三天的时候检测小鼠肺部细菌的CFU。*, p<0.05,p值的获得是通过单因素方差分析法分别比较聚肌胞苷酸组与生理盐水以及TLR7组。B. 实验小鼠每天分别用多聚肌胞苷酸(50 mg)和生理盐水处理,持续三天。最后一次处理24h后,用金黄色葡萄球菌(MRSA, LAC USA300; 6*106 CFU),24h后,检测小鼠肺部细菌的CFU。p<0.05,p值通过实验组和生理盐水组比较获得。实验结果由2组具有代表性的实验数据中分析获得
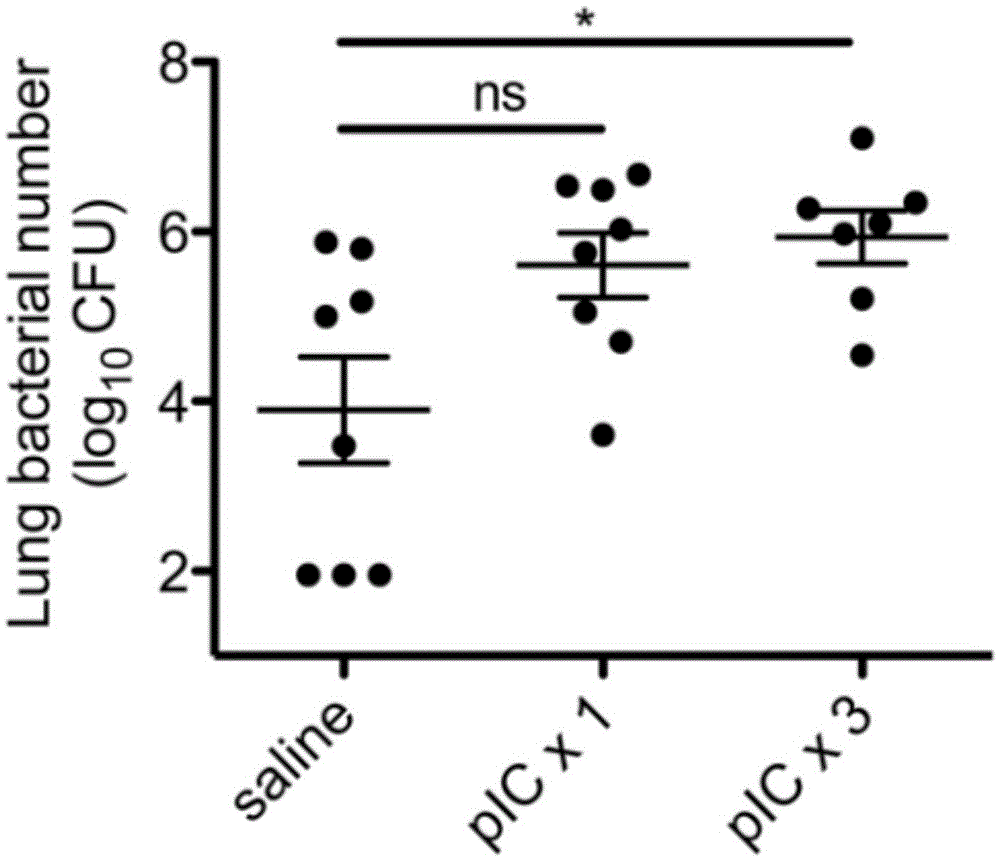
图2:聚肌胞苷酸的肺部细菌清除能力呈剂量依赖效果。小鼠每天以聚肌胞苷酸(pIC, 50ug)或生理盐水进行鼻腔内给药 ,持续1天或3天。最后一次给药24h后,用肺炎链球菌(1*105 CFU,30ul)感染小鼠。48h后,检测小鼠肺部细菌的CFU。*p<0.05。实验结果由2组具有代表性的实验数据中分析获得。
图3:在聚肌胞苷酸间接介导的免疫抑制中病毒模式识别途径的作用。用聚肌胞苷酸处理年龄和性别匹配的Cardif-/-, Tlr3-/-, Cardif-/-,/Tlr3-/-,野生型小鼠三天,接着已肺炎链球菌感染实验小鼠(1*104 CFU),48h后检测肺部细菌的CFU值。**, p<0.01,实验结果由2组具有代表性的实验数据中分析获得。
图4:经聚肌胞苷酸处理后的实验小鼠在稍后会出现细菌清除障碍现象。以聚肌胞苷酸(50ug)或生理盐水处理实验小鼠三天。最后一次给药24h后,用肺炎链球菌(1*104 CFU,30ul)感染小鼠。分别在第1,3,5天的时候检测小鼠肺部的细菌CFU值,每组都一个平均值。误差棒代表了标准差。*, p<0.05,实验结果由2组具有代表性的实验数据中分析获得。
图5:聚肌胞苷酸处理过的小鼠体内INFI的检测。A.用聚肌胞苷酸(50ug),gardiquimod(100ug),或生理盐水处理实验小鼠三天。小鼠整肺匀浆处理后用ELISA检测IFN-α4。每组标记平均值以及标准差(n=4)。*, p<0.05。B.用聚肌胞苷酸处理野生型(Ifnar+/+)小鼠和(Ifnar-/-)小鼠三天,紧接着用肺炎链球菌(7*104CFU)感染实验小鼠。48h后,检测小鼠肺部细菌的CFU。每组5只小鼠。*, p<0.05。C.用聚肌胞苷酸处理野生型(Ifnar+/+)小鼠三天,第四天用肺炎链球菌(2*104CFU)感染实验小鼠。同时给实验小鼠注射抗IFNAR抗体或者对照的IgG(第一天1.5mg,第三天0.75mg,第五天0.75mg)。肺炎链球菌感染48h后检测小鼠肺部的CFU值。*, p<0.05。
图6:在持续聚肌胞苷酸给药及肺炎链球菌感染下,Ifnar和野生组在后期的存活率及细菌的清除率。A.用聚肌胞苷酸处理年龄和性别匹配的野生型小鼠和Ifnar-/- 小鼠三天,紧接着用肺炎链球菌(1*104CFU)感染实验小鼠。观察肺炎链球菌感染后14天之内小鼠的生命迹象,若小鼠生命迹象垂危,则对其进行安乐死处理。**, p = 0.001。每组小鼠7-8只。所有其他的比较无统计学意义。实验结果由2组具有代表性的实验数据中分析获得。B,C.在不同的实验中,用聚肌胞苷酸处理年龄和性别匹配的野生型小鼠和Ifnar-/- 小鼠三天,分别在第三天和第四天用肺炎链球菌(1.5*104CFU)感染实验小鼠. B组小鼠检测小鼠肺部细菌CFU值,C组小鼠检测血液中细菌CFU值。*, p<0.05。每组小鼠4只。实验结果由2组具有代表性的实验数据中分析获得。
图7:肺炎链球菌感染后Cardif−/−和Ifnar−/−实验动物血液及肺组织负荷。年龄与性别相匹配的Cardif−/−和Ifnar−/−,以及野生型实验动物注射肺炎链球菌(1×104CFU)。48小时后,对实验动物进行安乐死,取肺组织及血液用于细菌CFU值计算。ns 表示无意义比较;直线表示检测最小值。数据由两个分开的实验得到。n=8/group。
图8:肺炎链球菌感染后Tlr3-/-和野生型实验动物血液及肺组织负荷。年龄与性别相匹配的Tlr3-/-和野生型实验动物注射肺炎链球菌(1×104 CFU)。48小时后,对实验动物进行安乐死,取肺组织及血液用于细菌CFU值计算。ns 表示无意义比较;直线表示检测最小值。数据由两个分开的实验得到。n=8-9/group。
图9:肺炎链球菌感染后聚肌胞苷酸给药动物的早期细菌负荷和炎症细胞的应答。年龄与性别相匹配的Ifnar-/-和野生型实验动物每天进行聚肌胞苷酸给药(50μg),持续3天,紧接着注射肺炎链球菌(7×103CFU)。6小时后,对实验动物进行支气管肺泡灌洗(BAL)。A.第一次1ml的支气管肺泡灌洗液稀释5倍,用于细菌CFU值计算。B.此时间点对于总支气管肺泡灌洗液中巨噬细胞和中性粒细胞(多形核白细胞)总量计算的描述。C.野生组和Ifnar-/-动物机体内中性粒细胞量。
图10:肺炎链球菌感染后聚肌胞苷酸给药动物肺部组织学切片。年龄与性别相匹配的Ifnar−/−和野生型实验动物每天进行聚肌胞苷酸给药(50μg),持续3天,紧接着在第3天注射肺炎链球菌(1×104 CFU)。取肺组织制成切片。组织切片显示,野生组肺组织呈现大面积的固结和炎性细胞浸润(左)。而Ifnar−/−组肺组织表现较小面积的炎症,肺组织大部分正常(右)。肺组织切片的描述代表每一组;n=3-4/group。
具体实施方式:
以下通过特定的具体实例说明本发明的实施方式,本领域技术人员可由本说明书所揭露的内容轻易地了解本发明的其他优点与功效。本发明还可以通过另外不同的具体实施方式加以实施或应用,本说明书中的各项细节也可以基于不同观点与应用,在没有背离本发明的精神下进行各种修饰或改变。
在进一步描述本发明具体实施方式之前,应理解,本发明的保护范围不局限于下述特定的具体实施方案;还应当理解,本发明实施例中使用的术语是为了描述特定的具体实施方案,而不是为了限制本发明的保护范围;在本发明说明书和权利要求书中,除非文中另外明确指出,单数形式“一个”、“一”和“这个”包括复数形式。
当实施例给出数值范围时,应理解,除非本发明另有说明,每个数值范围的两个端点以及两个端点之间任何一个数值均可选用。除非另外定义,本发明中使用的所有技术和科学术语与本技术领域技术人员通常理解的意义相同。除实施例中使用的具体方法、设备、材料外,根据本技术领域的技术人员对现有技术的掌握及本发明的记载,还可以使用与本发明实施例中所述的方法、设备、材料相似或等同的现有技术的任何方法、设备和材料来实现本发明。
除非另外说明,本发明中所公开的实验方法、检测方法、制备方法均采用本技术领域常规的小鼠鼻腔给药,细菌感染,CFU值测定,支气管肺泡灌洗,ELISA,小鼠肺组织的采集,制作石蜡切片及染色,统计分析及相关领域的常规技术。
呼吸道的病毒感染是常见呼吸道疾病,且常表现良性的临床病程。然而,相当多一部分的病人发展成伴随性或继发性细菌感染,这种并发症可导致呼吸衰竭或死亡。尽管儿童,老人和免疫力低下的人群常面临暴发此类并发症的高风险,但是病毒细菌性肺炎也可能出现于健康成年人,并导致沉重的疾病负担。随着流感感染流行,病毒-细菌性肺炎屡次被报道。对于病毒感染是如何促进细菌感染的机制仍然知之甚少。鉴于流感感染导致肺部的多样的变化,由流感诱导的非损伤性的抗病毒免疫通路的活化是否有助于细菌继发性感染的机制也尚不明确。在临床上,许多病毒与细菌会形成联合感染,包括呼吸道合胞病毒(RSV)和鼻腔病毒(这两者都是RNA病毒),流感导致宿主防御障碍的现象是否与其他病毒病原体相关尚不清楚。
小鼠
在所有实验中,使用C57BL/6J遗传背景且年龄和性别相匹配的小鼠。干扰素α/β受体基因双敲除小鼠由本实验室保存。Toll样受体3和CARDIF(也被称为干扰素β启动模拟器1,线粒体抗病毒信号蛋白和病毒诱导信号适配器)双基因敲除小鼠是由Toll样受体3基因敲除小鼠(来自日本大阪大学,Shizuo Akira的实验室)和CARDIF基因敲除小鼠(来自洛桑大学,Jurg Tschopp博士的实验室)杂交产生所得,这两种基因敲除小鼠都有完整的C57BL/6J遗传背景,并保存在我们实验室。干扰素α/β受体基因双敲除小鼠、Toll样受体3基因敲除小鼠、Toll样受体3和CARDIF双基因敲除小鼠、CARDIF基因敲除小鼠和野生型小鼠均保存在美国加州大学洛杉矶分校的同一特定无菌设施内。所有的动物实验都是按照国家卫生研究所政策中关于人文关怀和使用实验动物的条例来进行的,由美国加州大学洛杉矶分校的动物研究所进行监督(OARO协议2005-143),并注重减小实验动物的痛苦和折磨。
病毒样受体的配体和IFNAR抗体的接种
聚肌胞苷酸、咪喹莫特和嘎德莫特是由Invivogen公司提供的。小鼠腹腔注射氯胺酮和甲苯噻嗪的混合物,使其麻醉,然后使用聚肌胞苷酸(50 μg)、咪喹莫特(50 μg)和嘎德莫特(100 μg)混合于50 μl无菌生理盐水或生理盐水,鼻腔内给药。在聚肌胞苷酸给药第一天注射1.5 mg MAR1-5A3抗体(Leinco Technologies, I-401),小鼠体内将产生IFNAR1中和体。紧接着,在第3天及第5天(伴随肺炎链球菌感染)再次注射1.5 mg MAR1-5A3抗体,剂量0.75 mg。以正常小鼠的IgG表达水平为对照。
细菌制备和小鼠气管内接种
除非另有注明,否则一株血清型3肺炎链球菌(ATCC 6303)将用于所有的实验研究中。甘油冻存的细菌在Todd-Hewitt液进行培养,培养条件为5%的CO2, 37℃。在培养6小时,细菌达到对数生长期。将细菌进行离心,用无菌PBS将沉淀重悬。通过测定600 nm吸光度预估细菌的浓度,其次将细菌进行5倍稀释后,在琼脂平板上过夜培养,根据菌落数确定细菌的准确浓度。
在金黄色葡萄球菌感染实验中,耐甲氧西林的金黄色葡萄球菌菌株(USA300 /LAC)由Frank DeLeo 博士友情提供。金黄色葡萄球菌置于胰蛋白酶大豆肉汤(TSB)中,并存储于37℃的振荡培养箱(200rpm)中,进行过夜培养。隔夜培养的细菌在经1:200稀释,4个小时传代培养后,处于中期对数生长期。可通过测量600 nm的吸光度值预估细菌浓度。通过将稀释的细菌接种于TSB琼脂培养,过夜培养,以此确定原细菌的CFU值。
采用氯胺酮和甲苯噻嗪的混合物,经腹腔注射实验小鼠,使其处于麻醉状态;其次将小鼠的气管暴露,采用无菌27号针头注射30 μl的细菌培养液;最后将其皮肤切口缝合。
CFU值的测定
在预定的时间点,在小鼠体内注射二氧化碳使其安乐死。结合肝素抗凝剂,收集小鼠右心室的血液,并用PBS进行1:2稀释,并将10 μl血液接种于血琼脂(用于肺炎链球菌培养)和胰蛋白酶大豆肉汤琼脂平板上(用于金黄色葡萄球菌培养),以此来确定血液中细菌的CFU值。在小鼠肺切除前,将含有5mM EDTA的1mL PBS注入右心室,灌注至肺血管。在预定的时间点,将整个肺切除且在含有蛋白酶抑制剂混合物(罗氏公司)的1mL PBS中进行匀浆。用PBS将匀浆液进行1:5稀释。每种稀释液中10 μl溶液接种于血琼脂或TSB琼脂平板,以确定肺部细菌的CFU值。
支气管肺泡灌洗
在预定的时间点,使动物安乐死。小心剥离实验动物内的肺组织及气管。将1ml PBS-EDTA通过注入右心室,灌注肺血管。将聚乙烯管插入气管,每灌入1mL灌洗液,直至灌输满10ml(大概80%会回灌)。第一次的支气管肺泡灌洗液中一部分用于细菌计算,剩余的支气管肺泡灌洗液用以细胞计数。在支气管肺泡灌洗液中的细胞离心沉淀,以RPMI-1640培养基进行悬浮,在血细胞计数器下进行细胞计数。大概有50000-100000的细胞用于细胞离心涂片,以比较细胞间差异。细胞离心涂片经Diff-Quik染色(由Wright-Giemsa改良);大量的巨噬细胞、中性粒细胞、淋巴细胞和其他细胞采用双盲法(在每个载玻片的2个独立位置数10个细胞)计算。
细胞因子酶联免疫吸附测定(ELISA)
Verikine TM鼠干扰素α酶联免疫试剂盒从PBL InterferonSource公司(皮斯卡塔韦,新泽西州)购买。根据生产商的说明书,利用该试剂盒测定细胞因子水平。
肺组织取样
在指定的时间点,收集实验动物肺组织。1ml 4%的多聚甲醛灌注右心室,灌流至肺血管,加以固定。聚乙烯管插入气管,将约1ml 4%的多聚甲醛灌入,使肺部膨胀,使其固定;其次将气管的结扎。切除整个胸腔,并将其固定,浸泡于多聚甲醛6小时-过夜,然后将其送至美国加州大学洛杉矶分校转化病理核心实验室进行石蜡包埋、切片和通过苏木精-伊红染色法方法染色。切片是由Dr. W.Dean Wallace,一位病理学教员协助进行的,而他对动物的基因型并不清楚。
统计学分析
通过对数秩检验,我们比较了动物在辐射剂量大小或时间长短下的存活曲线。而对于其他数据,通过多重适当的比较法(双尾曼-惠特尼U检验(对于CFU)或单因素方差分析校正法)显示统计学分析的重要性。P=0.05或更低的AP值被认为具有统计学意义。所有计算均使用了Windows操作系统中的Prism软件程序进行(格拉夫派得软件公司)。在所有图表中误差线表示SEM和重复数。
实施例1
聚肌胞苷酸降低细菌的清除率
我们首先检测在细菌感染后,聚肌胞苷酸给药对细菌清除率的影响。实验动物进行持续两天(即2次)的聚肌胞苷酸或咪喹莫特鼻腔给药。在第三天(即最后一次聚肌胞苷酸剂量后的24小时),动物鞘内注射肺炎链球菌。我们发现进行鼻腔聚肌胞苷酸给药的动物肺部细菌量明显增加。有趣的是,与生理盐水对照组相比,咪喹莫特或者嘎德莫特(TLR7激动剂,如图1A)给药组在细菌清除方面并没有明显的差异。但两组在初始攻毒阶段表现强大的清除率。因此TLR7配体的单独给药不足以降低细菌的清除率。
其次,我们检测聚肌胞苷酸是否也降低另一个重要的引起病毒继发性细菌性肺炎的临床病原菌(耐甲氧西林金黄色葡萄球菌(MRSA))的清除率。与上文类相似,在金黄色葡萄球菌感染24h后,聚肌胞苷酸给药将减低其清除率(图1B)。因此,聚肌胞苷酸似乎损害了宿主肺组织对两种临床上引起病毒继发性细菌性肺炎病原菌(肺炎链球菌和耐甲氧西林金黄色葡萄球菌)的防御机制。
实施例2
聚肌胞苷酸提高了肺组织对细菌的易感性
其次,我们检测聚肌胞苷酸是否也降低另一个重要的引起病毒继发性细菌性肺炎的临床病原菌(耐甲氧西林金黄色葡萄球菌(MRSA))的清除率。与上文类相似,在金黄色葡萄球菌感染24h后,聚肌胞苷酸给药将减低其清除率(图1B)。因此,聚肌胞苷酸似乎损害了宿主肺组织对两种临床上引起病毒继发性细菌性肺炎病原菌(肺炎链球菌和耐甲氧西林金黄色葡萄球菌)的防御机制。
实施例3
聚肌胞苷酸给药后持续时间和细菌感染的风险
其次,我们观察,在聚肌胞苷酸给药后,动物机体体内的细菌清除率下降的时间点。由于病毒感染,例如流感,通常需要持续几天甚至更久的时间,随即我们进行了相关实验研究,以1剂量或3次剂量服用聚肌胞苷酸来模拟病毒感染的作用。经一次或3次聚肌胞苷酸或生理盐水鼻腔给药24h后,实验动物鞘内注射肺炎链球菌。在48h时,记录机体内的细菌量。我们发现,聚肌胞苷酸的剂量与细菌的清除率相关。一次性聚肌胞苷酸给药的实验动物机体内的细菌清除率将呈降低的趋势(比生理盐水对照组平均的CFU值高8倍,p=0.05),同时经3次聚肌胞苷酸给药的实验动物肺部细菌的CFU较高(如图2,比生理盐水组平均的CFU值高13倍,p=0.01)。因此,细菌清除力的损害程度与聚肌胞苷酸持续时间成正比。
实施例4
TLR3和Cardif通路有助于聚肌胞苷酸诱导宿主对细菌的易感性
由于聚肌胞苷酸同时激活了TLR3和Cardif依赖性解旋酶RIG-I和MDA5,我们试图确定是否其中一个或者两个通路都与聚肌胞苷酸损害宿主细菌清除力相关。对于此类研究,我们将聚肌胞苷酸用于TLR3(Tlr3-/-)缺失、Cardif(Cardif−/−)缺失以及两者同时缺失(双敲除)的实验动物。在抗病毒反应的初期,Cardif 充当RIG-I及MDA5信号的衔接分子。我们发现TLR3(Tlr3-/-)缺失或Cardif(Cardif-/−)的实验动物在聚肌胞苷酸给药后,机体内细菌清除率经有所提高。相比于生理盐水组, 双敲除(Cardif−/−/Tlr3−/−)组在继发性细菌感染环境下,进行聚肌胞苷酸给药,机体内细菌清除率显著提高(图3)。然而,既无Tlr3−/−或Cardif−/−缺陷的动物在无聚肌胞苷酸给药条件下,其肺部肺炎链球菌清除率与野生株组相比存在明显的差异(图7&8)。因此,动物模型研究性试验显示,聚肌胞苷酸对细菌清除率的不利影响与TLR3和Cardif依赖性抗病毒通路活化有关。
实施例5
聚肌胞苷酸对于后期细菌清除力的影响
鉴于在肺炎球菌感染48小时后,聚肌胞苷酸给药的实验动物体内含有较高的细菌量,我们希望确定,聚肌胞苷酸是否在后期对细菌的清除率带来不利的影响,或聚肌胞苷酸是否只是简单的延缓了细菌清除过程。因此我们进行每3日聚肌胞苷酸给药,其次进行肺炎链球菌的感染,并评估在感染后的第1,3和5天肺部细菌菌落数(CFU)。我们发现直至第5天,生理盐水对照组的肺部细菌量低于检测最小值,趋于健康;而聚肌胞苷酸给药的动物体内细菌量增加(图4),趋向于发病。因此,聚肌胞苷酸对肺部抗菌防御机制呈长期不利影响。
实施例6
I型干扰素在介导聚肌胞苷酸作用中的角色
我们之前已证实:在流感感染期间,已阐述的I型干扰素在宿主病毒感染过程中,可导致肺炎链球菌的清除率降低。因此,我们试图确定,聚肌胞苷酸的负面作用是否也可以用I型干扰素进行解释。首先,我们将聚肌胞苷酸(50微克)、嘎德莫特(100微克)以及生理盐水鼻腔给药三天,并检测肺部的I型干扰素的表达水平。我们发现,聚肌胞苷酸(非生理盐水或嘎德莫特)鼻腔给药组的肺部IFN-α水平呈现明显变化(图5A)。因此,该剂量下的嘎德莫特并不足以引起肺部I型IFN显著的变化。其次,我们将野生型动物和I型干扰素受体(Ifnar1-/−)缺陷的实验动物进行鼻腔给药3次;随后,进行肺炎链球菌感染;最后,检测细菌清除率。我们发现,(Ifnar−/−)动物能抵抗聚肌胞苷酸的负面作用,其细菌清除率有所增加(图5B)。无一组实验动物在此时间点出现明显的菌血症。因为先天性缺陷IFNAR的动物可能会存在微妙的补偿机制,我们使用IFNAR的阻断抗体进行相同的试验。在聚肌胞苷酸给药后,我们发现,IFNAR阻断抗体免疫组与IgG处理组相比可更好的控制肺炎球菌感染(图5C)。因此,基因缺失还是抗体引起IFNAR阻断导致I型IFN干扰素信号的消除,此过程可维护在聚肌胞苷酸给药下机体对于细菌清除作用。野生型和Ifnar动物在无聚肌胞苷酸给药条件下,机体细菌量没有明显变化。此暗示:在无病毒配体条件下,I型干扰素通路并不会介导肺部组织对肺炎链球菌的清除。
实施例7
聚肌胞苷酸给药实验动物的I型干扰素的检测
鉴于检测炎性细胞反应,我们将聚肌胞苷酸给药3天;其次,将野生型和Ifnar−/−的动物进行鞘内肺炎链球菌感染。在细菌感染后6h,我们实行支气管肺泡灌洗,以检查炎症细胞。我们发现,野生和Ifnar−/−组在6h时的细菌量存在显著差异(图9A)。野生组显示对数倍的细菌量CFU(野生型组平均CFU为51000,Ifnar−/−为740)。引人注意的是,尽管野生组细菌量较高,但其炎症反应相比Ifnar−/−缺失组处于缓和状态。平均来看,两组细胞数相似,即总细胞数(野生组1.7*106细胞,Ifnar−/−组2.0*106细胞),巨噬细胞(野生组1.2*106细胞,Ifnar−/−组21.3*106细胞)(图9B及数据未显示) 。尽管相比于野生组,Ifnar−/−动物机体内中性粒细胞量呈两倍以上的趋势(野生组为4.1*105,Ifnar−/−组中性粒细胞为8.0*105细胞),但无显著性差异(图9C)。因此,在此动物模型中,经聚肌胞苷酸给药的Ifnar动物组在感染6h后的清除能力有所提高。与聚肌胞苷酸给药野生组相比,聚肌胞苷酸给药的Ifnar动物组的中性粒细胞聚集量增加,引起机体对细菌清除力增强。
实施例8
聚肌胞苷酸引起依赖于I型干扰素的继发性细菌感染宿主的死亡率增加
鉴于聚肌胞苷酸可导致细菌清除率降低,我们希望检测,I型干扰素的消除是否可提高细菌感染后宿主生存率。我们将聚肌胞苷酸和生理盐水鼻腔给药,持续给药3天;其次,将野生型和Ifnar−-/−动物组进行肺炎链球菌感染(大约为LD50 量)。对实验动物进行监测,直至它们满足标准安乐死或其经肺炎链球菌感染后14天。我们发现,经聚肌胞苷酸给药的野生组实验动物在肺炎球菌感染后7天内死亡率为100%(图6A)。与之相反,经聚肌胞苷酸给药的Ifnar动物在细菌感染(p=0.01,聚肌胞苷酸给药野生组相比Ifnar动物组)14天后,存活率超过60%。肺炎链球菌感染下的生理盐水对照组和Ifnar−/−动物组无明显差异。总体而言,实验结果表明,聚肌胞苷酸诱导了I型干扰素。I型干扰素在抗病毒免疫机制活化条件下可增加动物机体对肺炎链球菌的易感性。
为了确定宿主死亡机制,我们在动物进行安乐死前检测肺部及血液的细菌量。相比于聚肌胞苷酸给药Ifnar-/−组,聚肌胞苷酸给药野生组的血液及肺部组织内的细菌量较高。以上结论暗示,在聚肌胞苷酸的给药和肺炎链球菌感染的条件下,I型干扰素的缺失导致细菌清除力大不相同(图6B和6C)。其次,我们检测聚肌胞苷酸给药Ifnar组和野生组的肺组织切片。野生组肺组织呈现大面积的固结和炎性细胞浸润,与组织内细菌的增加量一致。而Ifnar−/−组肺组织表现较小面积的炎症,肺组织大部分正常(图10)。因此,I型干扰素至少介导聚肌胞苷酸导致机体在继发性细菌感染后存活率下降的部分机制,而其主要是通过降低前期和后期机体细菌的清除率达到这一效果。
综上所述,本发明有效克服了现有技术中的种种缺点而具高度产业利用价值。
上述实施例仅例示性说明本发明的原理及其功效,而非用于限制本发明。任何熟悉此技术的人士皆可在不违背本发明的精神及范畴下,对上述实施例进行修饰或改变。因此,举凡所属技术领域中具有通常知识者在未脱离本发明所揭示的精神与技术思想下所完成的一切等效修饰或改变,仍应由本发明的权利要求所涵盖。
- 还没有人留言评论。精彩留言会获得点赞!