光甘草定的应用的制作方法
本发明涉及化妆品领域,特别涉及光甘草定的应用。
背景技术:
衰老,乃是指机体各器官功能普遍的、逐渐降低的过程。衰老有两种不同的情况,一种是正常情况下出现的生理性衰老;另一种是疾病引起的病理性衰老。是一种自然规律。但是,当人们采用良好的生活习惯和保健措施,就可以有效地延缓衰老,提高生活质量。中医理论认为,人体的生长、发育、衰老与脏腑功能和经络气血的盛衰关系密切。当机体气血不足,经络之气运行不畅,脏腑功能减退,阴阳失去平衡,均会导致和加快衰老,表现为精神不振、健忘、形寒肢冷、纳差少眠、腰膝无力、发脱齿摇、气短乏力,甚则面浮肿等。千百年来,人们一直在探索健康长寿的奥秘,充满对青春长驻、延年益寿的向往。
探索衰老发生的机理既是一个古老的问题,又是一个崭新的科研领域,在医学漫长的历史发展过程中,有人认为总共提出过数百个衰老的假说。祖国医学在抗衰老方面积累了丰富的经验,提出了“阴阳失调说”、“脏腑虚衰说”、“精气神亏耗学说”等等,渗透着对自然界宏观的认识。国外的古代医学家和哲学家也从不同角度解释衰老,提出温热学说、熵学说、磨损学说、自家中毒学说等,对于人们认识衰老起到积极的作用。但因历史条件与科学水平的限制,这些学说有很大的局限性。
现代研究表明,皮肤衰老反映在细胞水平即为细胞衰老,而成纤维细胞是真皮中的主体成分,它的衰老及生物学特性的改变是导致皮肤老化出现的重要原因。目前,大多都是通过在外用化妆品中添加表皮生长因子(EGF)来改善皮肤,其具有一定的效果。但是因为技术等原因,EGF原料的生产供应难以满足不断增长的需求,EGF的价格一直居高不下,不仅严重制约了EGF的临床研究和临床应用,也限制了EGF化妆品在消费人群中的进一步推广。 因此,开发一种高效的表皮生长因子受体(EGFR)激活分子不仅具有巨大的经济价值,也为EGF研究开发出更广阔的应用前景提供了最基本的保障。
技术实现要素:
有鉴于此,本发明提供一种光甘草定的应用。本发明的目的在于提供一种光甘草定的应用,其在预防和/或治疗皮肤衰老的化妆品中具有显著疗效。
为了实现上述发明目的,本发明提供以下技术方案:
本发明提供了光甘草定在制备用于预防和/或治疗衰老的化妆品中的应用。
在本发明的一些具体实施方案中,所述衰老为皮肤衰老。
在本发明的一些具体实施方案中,所述光甘草定的有效剂量为0.01μM~10μM。
在本发明的一些具体实施方案中,所述光甘草定的有效剂量为0.1μM~10μM。
在本发明的另一些具体实施方案中,所述光甘草定的有效剂量为0.01μM、0.1μM或10μM。
在本发明的另一些具体实施方案中,所述化妆品的剂型为水剂、蜜剂、奶剂、膏剂、霜剂、粉剂、块状、棒状中的一种或多种。
本实验采用分子数据库。该数据库主要包含中草药单体分子、小分子化合物、从天然产物中提取的化合物结构以及用计算机方法产生的虚拟化合物,在计算机辅助药物设计中,主要用于基于分子性质、药效基团和分子对接的数据库搜索。一方面它可以提供天然产物三维结构信息,另一方面,数据库还可以提供植物来源、传统功用、相关领域科学研究进展等重要信息。本发明通过分子对接技术,寻找到与表皮生长因子受体有特异结合的天然产物,从而开发出高效、高选择性的天然产物药物,同时也可以研究天然产物在体内的作用机理。随着中草药中的天然产物数据的积累,本发明的实验结果具有进一步研究开发和利用价值,有利于小分子作用机制的阐明和探究。
本发明通过将光甘草定作用于人皮肤成纤维细胞中,对人皮肤成纤维细胞进行CCK-8增殖实验、Edu法检测细胞增殖实验、流式细胞仪检测细胞周期实验。实验证实,光甘草定能有效促进人皮肤成纤维细胞增殖,增加S+G2M 期所占比例,其用于皮肤衰老预防或治疗疗效确切,副作用小,因此具有重要的现实意义。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍。
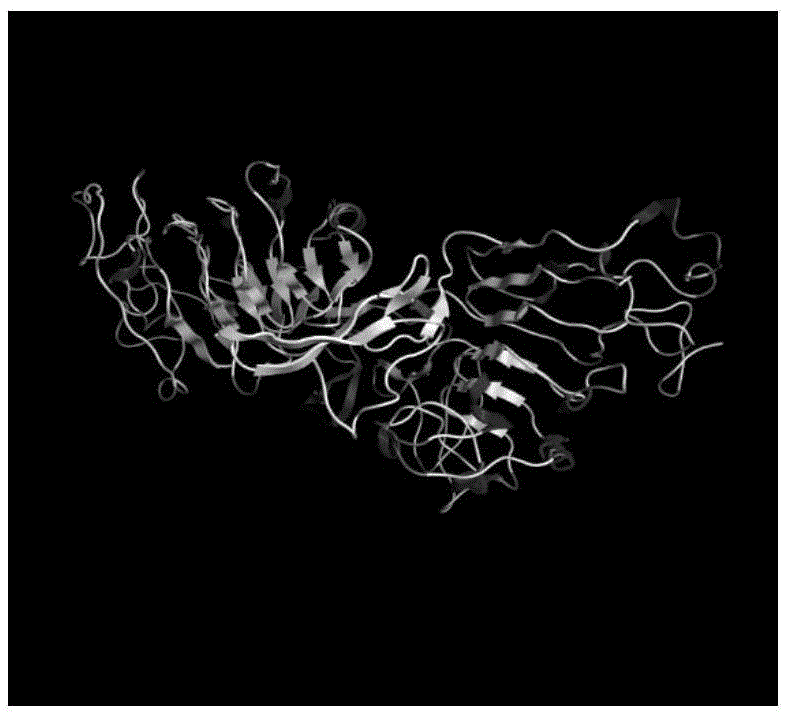
图1示EGFR分子模型正视图;
图2示EGFR分子模型俯视图;
图3示光甘草定对人皮肤成纤维细胞增殖的影响;
图4示光甘草定对HSF增殖的影响——荧光显微镜拍照图;
图5示光甘草定对HSF增殖的影响——荧光图片软件分析图;
图6示细胞周期分析图;
图7示细胞周期统计直方图;
图8示实施例3中对照组的肉眼观察结果;
图9示实施例3中光甘草定组的肉眼观察结果;
图10示实施例3中对照组HE染色×100结果;
图11示实施例3中光甘草定组HE染色×100结果。
具体实施方式
本发明公开了一种光甘草定的应用,本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法及应用已经通过较佳实施例进行了描述,相关人员明显能在不脱离本发明内容、精神和范围内对本文所述的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。
为了克服现有技术不足问题,本发明的目的在于提供一种光甘草定的应用,其在预防和/或治疗皮肤衰老的化妆品中具有显著疗效。
为解决上述技术问题,本发明采用的技术方案为:一种光甘草定在制备用于预防和/或治疗皮肤衰老化妆品中的应用。
进一步,所述的光甘草定用于预防及延缓皮肤保护剂。
本发明有以下有益效果:能有效促进皮肤成纤维细胞增殖,抗皮肤衰老,同时还具有使用方便,原料来源广泛,价格便宜,降低化妆品的毒性,安全 性能好。
所述光甘草定的浓度为0.01~10μM。
本发明提供的光甘草定的应用中所用原料及试剂均可由市场购得。
下面结合实施例,进一步阐述本发明:
实施例1:计算机分子模拟筛选功能性短肽实验
1.1实验材料
搭载了192AMD Opteron处理器组的超级计算机
1.2实验方法:
高通量计算机分子模拟筛选技术的原理如下:⑴药效团和靶点的初步筛选。即利用现有中草药分子单体数据库,对蛋白质等受体进行全面全面分析。模拟中草药单体分子与目标受体蛋白分子的相互作用,并且得到这几种物质结合的得分与作用位点。⑵分子对接。应用半柔性对接方法,通过不断优化小分子化合物的位置(取向)以及分子内部柔性键的二面角(构象),寻找小分子化合物与靶标大分子作用的最佳构象,允许小分子的构象发生变化,然后将库中的分子逐一与靶分子进行对接,计算结合自由能。以结合自由能作为评价对接结果的依据,根据此得分排名,找出与靶分子结合的最佳分子。⑶分子动力学模拟。用计算机在虚拟的情况下对受体配体复合物进行分子动力学模拟,模拟出该复合物在自然状态下最稳定的形态,并作出数据分析。能很好的模拟体内环境,通过精细的计算,能够准确的展现受体和配体结合的程度。精细筛选过程采用曙光5000系列的高性能计算机系统,利用多核并行的计算方式,大大提高实验的进度。
分子对接是本阶段实验的主要实验方法。通过研究小分子配体和受体生物大分子的相互作用,计算机可预测复合物的结合模式和亲和力,是目前药物设计等领域最重要的方法之一。分子对接是小分子配体和生物大分子受体通过几何匹配和能量匹配而相互识别的过程。在药物分子产生药效反应的过程中,药物分子与靶标相互结合,首先要两个分子充分接近,采取合适的取向,使两者在必要的部位相互契合,发生相互作用,续而通过适当的构象调整,得到一个稳定的复合物构象。通过分子对接确定复合物中两个分子正确的相对位置和取向,研究两个分子的构象,特别是底物的构象在形成复合物过程中的变化,是确定药物作用机制、设计新药的基础。以下是主要几种分 子对接方法:
表1 几种主要的分子对接方法
本项目主要使用Autodock实现分子对接计算。
分子对接计算:把配体分子放在受体活性位点的位置,然后按照几何互补、化学环境互补、能量互补等原则实时评价配体和受体相互作用的好坏,并找到两个分子之间最佳的结合模式。
评价方法:通过打分函数进行评估。每一个对接的算术在计算机分子筛选平台中都会进行自由能函数打分,该过程需平衡以下两种因素:时效性和精确度。目前这种评价主要包括以下三部分:⑴基于经验的回归参数的方法,即用多元回归的方法拟合各种物理参数对结合自由能的贡献,如FlexX程序中采用配体旋转键的个数、氢键、离子键,疏水和芳香环的π堆积作用,以及亲水作用。这种方法能快速直接地估算结合自由能;⑵基于分子力场的方法,该方法只考虑热焓对能量的贡献,不考虑熵的影响,一般情况下,采用标准力场的非键作用能如真空静电和范德华作用能用作打分函数,如DOCK程序中采用AMBER的能量函数:
⑶基于知识的打分函数。最初应用于蛋白质结构预测,打分函数用统计力学的方法得到蛋白质-配体的复合物结构,结合自由能函数为分子间距离的平均能的加和来计算。
1.3实验步骤:
1.3.1明确模拟对象:
本项目计算机分子模拟实验的模拟对象为待计算配体以及EGFR蛋白结构(图1),其中,图1为正视图,图2为俯视图。所有EGFR蛋白结构来自于蛋白质数据库,主要为解析度为的EGFR胞外域晶体结构(PDB编号:1NQL),以及解析度为的结合了EGF的变构后的EGFR胞外域晶体结构(PDB编号:1IVO)。
蛋白质结构的准备是虚拟筛选的重要一步。虚拟筛选的蛋白靶标的结构可以从PDB库(http://www.rcsb.org/pdb/index.htmL)中直接下载使用;也可以通过和家族中同源蛋白的序列、结构信息比较,同源模建而得。去除受体分子中的所有水分子和金属离子。接着是结合位点的描述,选择合适的配体结合口袋。本实验为保证实验结果的精确性,我们根据生物功能如结合、突变等实验信息,手动选择结合部位。
1.3.2制定模拟方案:
首先使用软件SYBYL1.1修饰获得的PDB文件,删除冗余分子以及无关基团,以获得纯净的蛋白质晶体结构;
其次使用软件Autodock4.0设置空间坐标,通过拉马克遗传算法(Lamarckian genetic algorithm),规定药物分子的结合位点,选定的活性位点即是配体(此处即为EGF)的结合位点。此时初始设置完毕。
1.3.3分子模拟计算:
包括对接和打分,这一步是虚拟筛选的核心步骤。对接操作是把每个小分子放到受体蛋白的配体结合位点,优化配体构像和位置,使之与受体有最佳的结合作用;给最佳结合构象打分,对所有化合物根据打分排序,然后从化合物库中挑出打分最高的小分子。
使用Autodock中的AutoGrid模块,计算配体和受体之间的结合自由能。此时为初步筛选,已经可以获得一部分分子与EGFR的亲和信息;
使用AMBER 11模拟套件进行分子动力学的模拟和数据分析。在EGFR的模拟中采用力场为AMBER ff03,这一力场对蛋白质二级结构的α-螺旋和β-折叠的受力施力分配较为均衡,因此更适合于EGFR的模拟。模拟环境采用TIP3P水盒子,即水环境,由于人体中主要成分是水,因此根据本项目实验目 的,选取水环境作为分子模拟的实验条件是合理的,可充分模拟人体内的水环境效果;
使用Gaussian03程序进行配体分子的几何结构最优化,获得最稳定的静电势能;
使用AMBER GAFF程序规定配体的其余力场参数;
使用AMBER 11软件的antechamber套件设定配体缺失的力场参数。
本阶段实验采用Autodock中的AutoGrid模块,计算配体和受体之间的结合自由能。
1.3.4命中化合物的后处理:
命中化合物的后处理通过计算分子的类药性质ADME/T(吸收absorption、器官分布distribution、体内代谢metabolism、排泄excretion和毒性toxicity)性质的估算,排除那些不具有类药性质的分子。
由于EGFR是一个相对大的分子体系,在分子模拟中需要耗费相当大的计算量,因此在药物初步筛选中我们采用了5ns的模拟时间。长距静电作用力使用Particle-Mesh Ewald方法计算,计算过程中,我们添加了钠离子,以中和EGFR产生的负电荷。
最终,我们可以计算出EGFR和配体的结合自由能,从而可以对配体激活EGFR的能力作出一个计算机评价。通过以上四步处理,大部分分子从化合物库中剔除,形成一个大小合理的化合物库,仅对这些适合成药的化合物或购买、或合成、或分离得到,然后再进行实际的生物测试。
1.4实验结果及分析
根据上述筛选标准,通过分子模拟所得的结合自由能绝对值评分排名,现阶段实验从中草药库中筛选出可以与EGFR结合形成良好构象,并且在结合自由能评分中获得较高分数。因此,本实验根据最终计算结果,得到如式Ⅰ所示的与EGFR具有较好结合效果的中草药单体:
光甘草定,两次模拟得分:-8.5;-8.3。
实施例2:光甘草定对人皮肤成纤维细胞增殖的影响
1材料
1.1细胞株
人皮肤成纤维细胞株(HSF),购于复旦大学IBS细胞资源中心。
1.2生化试剂
青霉素-链霉素溶液(100×)、胰酶细胞消化液(含酚红)、Phosphate-Buffered Saline(含135mM NaCl,4.7mM KCl,10mM Na2HPO4,2mM NaH2PO4,pH值为7.4),均为碧云天生物技术有限公司产品;DMEM高糖培养基、细胞冻存液,美国Gibco公司产品;澳洲优级胎牛血清,美国Gemini公司;TritonX-100、牛血清白蛋白(BSA)均为广州杰特伟生物科技有限公司;氯化钠、无水乙醇、多聚甲醛、二甲基亚砜(DMSO),均为广州化学试剂有限公司产品,分析纯。
1.3生化试剂盒
CCK-8试剂盒,日本DOJINDO公司;key Fluor488-EdU法细胞增殖检测试剂盒、细胞周期检测试剂盒,均为南京凯基生物公司产品。
1.4常用生化耗材
6孔、24孔、96孔细胞培养板、25cm2细胞培养瓶、0.22μm针头式无菌过滤器,15mL、50mL无菌离心管,均为洁特生物公司(JET)产品;冻存管,Sigma公司产品;流式细胞管,美国BD公司产品。
1.5主要仪器
EPICS XL-MCL型流式细胞仪,美国Beckman Coulter公司产品;二氧化碳培养箱、生物安全柜,均为艺思高(ESCO)科技有限公司产品;倒置显微镜,日本OLYMPUS公司产品;TW12恒温水浴锅,德国Julabo公司产品;AL 104-IC 电子分析天平,瑞士Mettler公司产品;Model 680型酶标仪,美国Bio-RAD公司产品;5810R台式高速冷冻离心机,德国Eppendorf公司产品;微量移液器,德国Eppendorf公司;DMI4000B智能型倒置荧光显微镜,德国Leica公司产品;细胞计数板,上海求精生化仪器公司;细胞冻存程序降温盒,美国Nalgene公司产品;液氮罐,美国Thermo公司产品;﹣80℃低温冰箱,美国Thermo公司产品;﹣20℃低温冰箱,青岛海尔公司产品。
1.6药品
EGF,无限极(中国)有限公司;光甘草定(GLA)纯度≥98.0%,购自Sigma-Aldrich公司。
1.7细胞培养常用实验试剂的配制
1.7.1完全无菌细胞培养基
无菌条件下量取DMEM高糖培养基90mL、胎牛血清10mL,混匀,加入青链霉素溶液1mL,0.22μm滤膜过滤除菌后分装,保存于4℃备用。
1.7.2EGF工作液的配制
(1)EGF为1mg/管,加入10mL完全培养基,震荡混匀,配成10mg/mL的母液,分装,﹣20℃避光保存;
(2)实验前取10μL EGF母液稀释,最终配置其他浓度分别为100ng/mL的EGF工作液。
1.7.3GLA工作液配制
以少量DMSO将纯品溶解配制成浓度为10M的母液,﹣20℃避光保存。实验前用培养液稀释至所需浓度(DMSO终浓度<1%)。
1.7.4 4%多聚甲醛溶液
称取40g的多聚甲酸加入900mI PBS中,充分搅拌后密封于广口瓶中,置于60℃温箱加热促溶,待完全溶解后加PBS定容至1000mL,4℃保存备用。
1.7.5 3%BAS溶液
称取3g BAS加入100mL双蒸水中,充分溶解后4℃短期保存备用。
1.7.6 0.5%TritonX-100
量取50μL TritonX-100加入9mLPBS中,振荡混匀,定容至10mL,使其终浓度为0.5%。
2实验方法
2.1细胞培养方法
2.1.1培养环境
将人皮肤成纤维细胞培养于含10%胎牛血清的DMEM培养液中(pH7.2~7.4),于5%CO2、37℃的饱和湿度培养箱中常规传代培养。
2.1.2细胞复苏
1)准备37℃水浴或1000mL的烧杯,内装2/3杯37℃的温水。
2)从液氮中取出冻存管、迅速置于温水中并不断搅动。使冻存管中的冻存物在1min之内融化。
3)用75%酒精擦拭消毒后,净化台上打开盖,用吸管吸出细胞悬液,装入离心管中,再补加10mL培养液,吹打使细胞悬浮。
4)1000rpm离心10min,弃去上清液。
5)沉淀加10mL培养液,吹打均匀,再离心10min,弃上清液。
6)加适当培养基后将细胞转移至培养瓶中,37℃细胞培养箱内培养,第二天观察生长情况。
2.1.3细胞的传代
1)待细胞铺满瓶底时进行传代。先将原有的培养基倒掉,然后加入PBS洗3次。
2)向瓶内加入1mL0.25%的胰蛋白酶,轻轻摇动培养瓶,使消化液流遍所有细胞表面,然后吸掉或倒掉消化液后再加1mL新得胰蛋白酶消化液,轻轻摇动后再倒掉大部分消化液,仅留少许进行消化,显微镜下观察。
3)当发现细胞彼此连接分开,胞质回缩变圆但尚末完全脱落时,弃去胰酶后立刻加入3mL DMEM培养基,终止消化。
4)用微量移液器,吸取吹瓶内培养液,反复吹打瓶壁分散细胞。
5)待细胞分散均匀后,1:3传代。
2.1.4细胞的冻存:
1)将生长至80%左右融合度的HSF,如上所述方法消化,离心,弃去上清液
2)细胞沉淀中加入细胞冻存液(4℃预冷),吹打混匀后转移至2mL细胞冻存管,
3)冻存管放入细胞冻存程序降温盒内,置于﹣80℃冰箱,24小时后取出冻存管,快速转移至液氮罐保存。
2.2CCK-8增殖实验
2.2.1细胞复苏和传代
方法同2.1.2和2.1.3。
2.2.2制备细胞悬液
取对数生长期的细胞,弃旧培养液,用PBS洗涤细胞3~4次,再用0.25%胰蛋白酶消化,消化后弃胰蛋白酶加进新培养基终止消化,吹打细胞使其从瓶壁上完全脱落。将其导入离心管离心1000r/min,离心5min。离心后,弃掉上清液,重新更换培养基。
2.2.3细胞计数
用95%酒精清洁计数板及专用盖玻片,然后于室温下晾干或用绸布拭干。取少许制备好的细胞悬液,在计数板上盖玻片的一端滴加微少量的细胞悬液,滴加时要防止悬液溢出盖玻片或溢入两侧的玻璃槽内,加样量也不要过少或带气泡。倒置显微镜下观察,在10×物镜下,计算计数板周边四个大方格中的细胞数。将计算结果代入下式,得出细胞密度
细胞数/毫升原液=(4个大方格的细胞数/4)×104
2.2.4细胞接种
参照细胞计数板所得出的浓度结果,按4×103/孔密度,200μL/孔接种于96孔板。用加样枪吸取PBS液200μL分别注入96孔板边缘四周(抵抗边缘效应),铺板完成后,盖上盖子,标明日期。放入5%CO2、37℃的培养箱中培养4~6h,直到细胞完全贴壁加药。
2.2.5进行药物干预
当细胞完全贴壁,吸出各个孔中培养液。设阳性对照组(EGF)﹑阴性对照组(只加入单细胞悬液不加任何药物)和实验组,实验组分为浓度为100、10、1、0.1、0.01μM每组各个浓度设5个复孔,各孔终体积为200μL,再将96孔板继续置于5%CO2﹑37℃的饱和湿度培养箱中培养,加药后进行培养3d进行测定。
2.2.6显色及酶标仪检测:
在细胞培养结束之前4h,无菌条件下去除原培养液,每孔加入20ul10%CCK-8溶液,37℃孵育4h。取出孔板,酶标仪检测450nm波长处的吸光值。数据输出,记录分析。
2.3Edu法检测细胞增殖
2.3.1细胞复苏和传代
方法同2.1.2和2.1.3。
2.3.2细胞接种
取对数生长期的HSF细胞,用PBS冲洗后,加胰酶细胞消化液消化,离心收集,弃上清,加入新鲜培养基重悬,按照10000个/孔的浓度接种于含细胞爬片的24孔培养板中,置于37℃、5%CO2培养箱中培养12h。
2.3.3加药及孵育
细胞生长贴壁后,吸出培养液,加入不同浓度的,使终浓度分别为10、1μM同时设立阴性对照与阳性对照孔并各设立3个复孔。加药后同条件下继续培养72h。
2.4.4采用南京凯基公司生产的key Fluor488-EdU法细胞增殖检测试剂盒检测短肽对细胞增殖的影响,按照说明书步骤操作:
2.4.4.1EdU标记:
1)将细胞完全培养基与EdU溶液按照2000:1比例配制适量50μM EdU稀释液。
2)加入50μMEdU稀释液200μL/孔、37℃、5%CO2培养箱孵育4h,弃培养基。
3)PBS清洗细胞,5min/次×2次,弃PBS。
2.4.4.2细胞固定及促渗:
1)加入细胞固定液(即含4%多聚甲醛的PBS)100μL/孔,室温孵育30min,弃细胞固定液。
2)加入含3%BSA的PBS100μL/孔,清洗,5min/次×2次。
3)加入渗透剂(0.5%TritonX-100的PBS)200μL/孔,室温脱色摇床孵育20min,弃渗透剂。PBS清洗1次,5min。
2.4.4.3EdU检测:
1)准备1×Click-iTEdU反应缓冲液:转移1×Click-iTEdU反应缓冲液试剂瓶中所有的溶液4mL至36mL的去离子水中。
2)制备一份10×的Click-iTEdU反应添加物储液:加1mL去离子水至10×的Click-iTEdU反应添加物储液试管中,混匀至全部溶解。
3)准备1×Click-iTEdU缓冲液添加物(见表格2):以去离子水稀释10×储液 至1×,溶液应新鲜配制,当天用完。
4)依据表2准备Click-iT反应混合物。
表2 Click-iT反应混合物:
5)去除促渗液,以每孔1mL的3%BSA的PBS的洗涤液洗涤2次,去除洗涤液。
6)加入0.5mL Click-iT反应混合物至每张爬片,简短摇晃培养板以确保反应混合物可以均匀覆盖爬片。
7)室温避光孵育30min。
8)除去反应混合物,每孔以1mL3%BSA in PBS洗涤2次,去除洗涤液。
2.4.4.4DNA染色:
1)以1mLPBS洗涤每孔1次,去掉洗涤液。
2)以PBS稀释Hoechst33342储液1:2000至1×Hoechst33342溶液,终浓度为5μg/mL。
3)每孔加1mL1×Hoechst33342溶液,室温避光孵育30min。除去Hoechst33342溶液。
4)1mLPBS洗涤每孔2次,去除洗涤液。于荧光显微镜蓝色及绿色荧光下观察,每张细胞爬片随机选取5个视野进行拍照,图像采用Image J软件进行计数增殖细胞核与总细胞核数目。
5)新增殖细胞在蓝光激发下细胞核发出绿色突光,所有的细胞(包括新增殖和未增殖分裂的细胞)在紫外激发下细胞核发出蓝色突光。将红色增殖细胞核的数目与蓝色总细胞核相比,计算得到EdU阳性细胞百分数,可检测细胞增殖情况。
2.4流式细胞仪检测细胞周期
2.4.1细胞复苏和传代
方法同2.1.2和2.1.3。
2.4.2细胞接种
取对数生长期的HSF细胞,用PBS冲洗后,加胰酶细胞消化液消化,离心收集,弃上清,加入新鲜培养基重悬,调整细胞浓度为1.0×105/mL,2mL/孔接种于6孔板中,置于37℃、5%CO2培养箱中培养12h,待细胞完全贴壁后,无血清培养液驯化24h,使细胞周期同步化。
2.4.3加药及孵育
吸出培养液,加入不同浓度的,使终浓度分别为10、1μM同时设立阴性对照与阳性对照孔并各设立4个复孔。加药后同条件下继续培养72h。
2.4.4采用南京凯基公司生产的细胞周期检测试剂盒检测短肽对细胞周期的影响,按照说明书步骤操作:
1)用PBS洗涤细胞一次(离心2000rpm,5min)收集并调整细胞浓度为1x106/mL,取1mL单细胞悬液;
2)制备的单细胞悬液离心后,去除上清,在细胞中加入体积分数为70%冷乙醇500ul固定(2小时至过夜),4℃保存,染色前用PBS洗去固定液;
3)加100μL RNase A37℃水浴30min;
4)再加入400μL PI染色混匀,4℃避光30min;
5)上机检测,记录激发波长488nm处红色荧光;
6)实验重复3次;
7)采用ModFit LT 4.1软件分析数据。结果以增殖指数(proliferous index,PI)即S和G2M期细胞百分比表示,计算公式:PI=(S+G2/M)/(G0/G1+S+G2/M),以此显示处于活跃增殖期的细胞比例大小。实验重复4次。
2.5统计学处理
所有实验数据以均数加减标准差(x±s)表示,结果用SPSS 11.0软件处理,多组间比较采用单因素方差分析,两两比较采用Dunnett-t检验。P<0.05为有统计学意义。
3实验结果
3.1CCK-8法检测GLA对HSF增殖能力的影响
用不同浓度GLA(0.01、0.1、1、10、100μM)处理HSF细胞72小时,cck-8检测HSF细胞的增殖,与阴性对照组比较,GLA0.01、0.1、1、10μM处理组与阴性对照组比较差异显著(p<0.05)。其中10μM组与0.01、0.1、1、100μM组相比,P<0.05,有统计学意义,即GLA浓度为10μM时,胞的数量最多。但是对于10μM GLA和100ng EGF(阳性对照组)两个组的作用差异无统计学意义。具体数据见表3,图3。
综上,不同浓度GLA(0.01、0.1、1、10μM)都能引起HSF增殖。我们在后续的实验中选择1、10μM的GLA处理细胞。
表3 GLA干预下各组细胞OD值(x±s)
注:*P<0.05,药物干预组与空白对照组相比;#P<0.05,10μMGLA组与其他浓度GLA组相比。
3.2EdU法检测GLA对HSF增殖能力的影响
分别用1和10μM的GLA以及100ng EGF处理细胞72h,用EdU检测细胞的增殖数目。如图4和图5所示:蓝色图(Hoechst)表示荧光显微镜视野下的所有染色细胞核,绿色图(EdU)表示该视野内新增殖的细胞核,Merge为两者的融合图。与Control组相比,10μM组和EGF组的细胞出现增殖(P<0.05)。结果表明10μM GLA和100ng/mL的EGF可以引起细胞增殖。但是对于10μMGLA和100ngEGF两个组的作用差异无统计学意义。
3.3GLA对HSF细胞周期的影响
如图6、图7所示,施加刺激72h后,实验组(10μM的GLA)与对照组相比较,DNA合成前期(G1)细胞所占百分比均有所减少,并且反映细胞增殖活 力的PI增殖指数[即(S+G2M)]明显升高。结果表明10μM的GLA可以引起细胞增殖(P<0.05)。但是对于10μM GLA和100ngEGF两个组的作用差异无统计学意义。
实施例3动物试验
1材料与方法
1.1实验动物:SD鼠12只,雌性,体重18.0士0.6g,购自中山大学动物实验中心。
1.2实验试剂:光甘草定(GLA)纯度≥98.0%,购自Sigma-Aldrich公司;用蒸馏水配制为10μM溶液。
1.3仪器:
Leica石蜡切片机,德国Leica公司产品;Shandon Paraffin Section Flotation Bath摊片机,美国Thermo Fisher Scientific公司产品;DM 2500B正立显微成像系统,德国Leica公司产品。
1.4实验分组及处理:
采用随机数字法,12只SD鼠被随机分为2组,每组6只:空白对照组:未给予任何处理;10μM光甘草定溶液组。上述各组在实验开始前一天背部剃毛(贯穿于整个实验过程中),范围为4×4cm2大小,于剃毛部位皮肤涂用上述相应药物,1次/日,连续1个月。
1.5皮肤表面肉眼观察
肉眼观察小鼠背部皮肤的色泽,光滑程度和皱纹情况等,判断动物皮肤变化情况,作为宏观体貌的观察指标。
1.6组织形态学观察
具体操作如下:
1.6.1.标本采集
实验第30d,所有动物腹腔注射10%水合氯醛进行麻醉,颈椎脱臼处死动物。快速剪取背背部约4×4cm2大小的脱毛皮肤,仔细除去皮下多余脂肪,取部分皮肤标本,小心摊平,10%甲醛固定48小时以上,拟作为皮肤组织切片进行组织形态学观察。
1.6.2.石蜡包埋
取出固定好的皮肤组织,用流水漂洗过夜,次日进行如下步骤的石蜡包埋:70% 乙醇1h→80%乙醇1h→90%乙醇1h→95%乙醇(Ⅰ)1h→95%乙醇(Ⅱ)1h→100%乙醇(Ⅰ)1h→100%乙醇(Ⅱ)1h→正丁醇1h→二甲苯30min→溶蜡(Ⅰ)1.5h→溶蜡(Ⅱ)2h→包埋。
1.6.3切片制作
常规皮肤组织石蜡切片,厚度6nm,将制好的切片于室温下瞭干过夜,随后放入4冰箱密封保存,备用。
1.6.4皮肤组织HE染色
1)切片脱蜡与复水
二甲苯(Ⅰ)2min→二甲苯(Ⅱ)10min→100%乙醇2min→95%的乙醇2min→80%乙醇2min→75%乙醇2min→自来水洗2min。
2)染色:苏木精染3min→自来水浸洗返蓝3min→蒸溜水浸洗3min;
3)脱水透明:70%乙醇2min→80%乙醇2min→90%乙醇2min→1%伊红染色3s→95%乙醇2min→100%乙醇(Ⅰ)2min→100%乙醇(Ⅱ)2min→二甲苯(Ⅰ)6min→二甲苯(Ⅱ)6min→中性树胶封片、凉干。
4)镜检观察。
HE染色中需时常在显微镜下观察染色的深浅,以便及时调控,结果应是细胞核被染成蓝色,核仁分明,伊红将细胞质染成红色,蓝色的细胞核与红色的胞浆对比鲜明。
2结果
2.1各组小鼠背部皮肤一般形态观察
空白对照组小鼠皮肤红润、光滑、无明显皱纹,充满弹性;实验组(10μM光甘草定溶液组)皮肤红润光泽,厚度适中,具有良好的皮肤弹性,且与空白对照组相比小鼠背侧表皮无皮肤增厚、脱屑、颜色加深等不良反应。(见图8~9)
2.2各组小鼠背部皮肤组织形态学观察
HE结果显示,空白对照组小鼠皮肤各层结构完整,皮下毛囊、皮脂腺饱满,表皮规则,表皮与真皮界线清晰,真皮层厚度正,染色均匀致密,胶原纤维束状排列,整齐而致密;实验组(10μM光甘草定溶液组)小鼠皮肤表皮层结构完整,细胞分层清晰,厚度正常,细胞成分及数量适中,真皮层可见 波浪状纤维组织,排列有序,分布均匀,疏密有致,且与空白对照组相比无差异。(见图10~11)
3结论
本实验通过综合运用肉眼观察、HE染色方法,从组织形态生物学方面的实验,较全面的验证了短肽Arg-Arg-Tyr与光甘草定对SD鼠皮肤的影响。结果显示光甘草定对正常SD鼠皮肤组织无毒副作用,对于皮肤安全可靠。
实施例4化妆品的制备
取光甘草定添加化妆品中可接受的辅料按照常规制备方法制得化妆品。所述化妆品是指以涂沫、喷洒或其他类似方法,施于人体表面(如表皮、毛发、指甲、口唇等),起到清洁、保养、美化或消除不良气味作用的产品,该产品对使用部位可以有缓和作用。
所述化妆品的剂型为液体、蜜剂、奶剂、膏剂、霜剂、粉剂、块状、棒状中的一种或多种。
所述肽的浓度为0.01-100μM。
实施例5化妆品的检验
按照化妆品国家标准对实施例3制备的化妆品进行检验,结果如表4:
表4 化妆品检验标准及结果
以上结果表明,本发明制得的化妆品符合中华人民共和国国家标准的相关规定。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!