用于治疗衰老和与年龄相关的疾病和症状的组合物和方法与流程
本申请要求2014年2月12日提交的US 61/9 39,092和2014年3月19日提交的US 61/955,463的权益,所述专利以引用的方式整体并入本文。
通过EFS网提交的序列表的引用
名为“20150211_034044_100WO1_seq_ST25”,大小是1.74kb的序列表的ASCII文本文件的内容创建于2015年2月8日,并且通过EFS网与本申请一起电子提交,以引用的方式整体并入本文。
对政府资助的致谢
本发明根据由国立卫生研究院授予的CA124974和CA149774在政府资助下进行。政府享有本发明的某些权利。
发明背景
1.发明领域
本发明涉及治疗衰老和与年龄相关的疾病。
2.相关技术的描述
代谢和衰老是密切关联的。相较于随意喂食,在进化上不同的生物体中进行膳食限制(DR)或卡路里限制(CR)一致地延长寿命,并且延迟与年龄相关的疾病。类似营养物限制情况和遗传或药理学营养物或能量代谢扰动也具有长寿益处。已鉴定以基本上未确定的分子机理调节衰老的若干化合物。
然而,对针对包括癌症、糖尿病和心血管疾病的与年龄相关的疾病,以及延长受试者的寿命的治疗仍然存在需要。
发明概述
在一些实施方案中,本发明涉及一种用于抑制、减弱、减缓或预防受试者的衰老的方法,其包括向所述受试者施用一种或多种结合所述受试者中ATP合成酶(例如ATP5B)的催化核心的β亚单位的化合物。在一些实施方案中,本发明涉及一种用于抑制、减弱、减缓或预防受试者的衰老的方法,其包括向所述受试者施用一种或多种抑制或降低所述受试者中ATP合成酶的活性的化合物。在一些实施方案中,本发明涉及一种用于治疗、抑制、减轻或预防受试者的与年龄相关的疾病的方法,其包括向所述受试者施用一种或多种结合所述受试者中ATP合成酶(例如ATP5B)的催化核心的β亚单位和/或抑制或降低所述受试者中所述ATP合成酶的活性的化合物。在一些实施方案中,本发明涉及一种用于抑制、减弱、减缓或预防受试者的衰老的方法,其包括向所述受试者施用一种或多种戊二酸化合物、一种或多种谷氨酸化合物或两者。在一些实施方案中,本发明涉及一种用于增加受试者的寿命的方法,其包括向所述受试者施用一种或多种结合所述受试者中ATP合成酶(例如ATP5B)的催化核心的β亚单位和/或抑制或降低所述受试者中所述ATP合成酶的活性的化合物。在一些实施方案中,相较于未治疗的受试者,受试者的寿命延长多达约60%或多达约70%。在一些实施方案中,受试者是动物,其可为或可不为衰老或与年龄相关的疾病的动物模型。在一些实施方案中,受试者是线虫、啮齿动物或非人灵长类动物。在一些实施方案中,受试者是人。在一些实施方案中,ATP合成酶是哺乳动物ATP合成酶、人ATP合成酶、哺乳动物线粒体ATP合成酶或人线粒体ATP合成酶。
在一些实施方案中,向受试者施用的化合物是戊二酸化合物或谷氨酸化合物。在一些实施方案中,向受试者施用至少一种戊二酸化合物和至少一种谷氨酸化合物。在一些实施方案中,向受试者施用的化合物是α-酮戊二酸(α-KG)化合物。在一些实施方案中,向受试者施用的化合物是2-羟基戊二酸(2-HG)化合物。在一些实施方案中,向受试者施用至少一种α-KG化合物和至少一种2-HG化合物。在一些实施方案中,以有效量或治疗有效量施用一种或多种化合物。在一些实施方案中,历经给定时间段以若干剂量(例如每日剂量持续一周或更久)施用一种或多种化合物的有效量或治疗有效量。在一些实施方案中,向受试者施用的一种或多种化合物的量使受试者中α-酮戊二酸水平增加约30-60%,优选约45-55%,更优选约50%。在一些实施方案中,以每天每千克受试者的重量,约0.25-2、优选约0.5-2、更优选约1-2、最优选约2克的每日剂量施用化合物。在一些实施方案中,受试者是动物,其可为或可不为衰老或与年龄相关的疾病的动物模型。在一些实施方案中,受试者是线虫、啮齿动物或非人灵长类动物。在一些实施方案中,受试者是人。在一些实施方案中,ATP合成酶是哺乳动物ATP合成酶、人ATP合成酶、哺乳动物线粒体ATP合成酶或人线粒体ATP合成酶。
在一些实施方案中,本发明提供至少一种结合ATP合成酶的催化核心的β亚单位或抑制或降低ATP合成酶的活性的化合物用于制造用以(a)抑制、减弱、减缓或预防受试者的衰老,(b)治疗、抑制、减轻或预防所述受试者的与年龄相关的疾病,和/或(c)增加所述受试者的寿命的药剂的用途。在一些实施方案中,本发明提供戊二酸化合物或谷氨酸化合物,其用于抑制、减弱、减缓或预防受试者的衰老;治疗、抑制、减轻或预防所述受试者的与年龄相关的疾病;和/或增加所述受试者的寿命。在一些实施方案中,化合物是戊二酸化合物或谷氨酸化合物。在一些实施方案中,化合物是戊二酸化合物和谷氨酸化合物。在一些实施方案中,化合物是α-KG化合物。在一些实施方案中,化合物是2-HG化合物。在一些实施方案中,化合物是α-KG化合物和2-HG化合物。在一些实施方案中,以有效量或治疗有效量提供化合物。在一些实施方案中,以分次剂量提供药剂。在一些实施方案中,以分次剂量提供有效量或治疗有效量。在一些实施方案中,受试者是动物,其可为或可不为衰老或与年龄相关的疾病的动物模型。在一些实施方案中,受试者是线虫、啮齿动物或非人灵长类动物。在一些实施方案中,受试者是人。在一些实施方案中,ATP合成酶是哺乳动物ATP合成酶、人ATP合成酶、哺乳动物线粒体ATP合成酶或人线粒体ATP合成酶。
在一些实施方案中,本发明提供一种治疗受试者的癌症的方法,其包括向所述受试者施用治疗有效量的一种或多种戊二酸化合物、一种或多种谷氨酸化合物或两者。在一些实施方案中,向受试者施用的化合物是戊二酸化合物或谷氨酸化合物。在一些实施方案中,向受试者施用至少一种戊二酸化合物和至少一种谷氨酸化合物。在一些实施方案中,向受试者施用的化合物是α-酮戊二酸(α-KG)化合物。在一些实施方案中,向受试者施用的化合物是2-羟基戊二酸(2-HG)化合物。在一些实施方案中,向受试者施用至少一种α-KG化合物和至少一种2-HG化合物。在其中癌症是神经胶质瘤的一些实施方案中,向受试者施用一种或多种α-KG化合物,并且不施用任何2-羟基戊二酸化合物。在一些实施方案中,以有效量或治疗有效量施用一种或多种化合物。在一些实施方案中,历经给定时间段以若干剂量(例如每日剂量持续一周或更久)施用一种或多种化合物的治疗有效量。在一些实施方案中,向受试者施用的一种或多种化合物的量使受试者中α-酮戊二酸水平增加约30-60%,优选约45-55%,更优选约50%。在一些实施方案中,以每天每千克受试者的重量,约0.25-2、优选约0.5-2、更优选约1-2、最优选约2克的每日剂量施用化合物。在一些实施方案中,受试者是动物,其可为或可不为衰老或与年龄相关的疾病的动物模型。在一些实施方案中,受试者是线虫、啮齿动物或非人灵长类动物。
在一些实施方案中,本发明提供一种治疗、抑制、减轻或预防受试者的与年龄相关的心脏病状的方法,其包括向所述受试者施用治疗有效量的一种或多种戊二酸化合物、一种或多种谷氨酸化合物或两者。在一些实施方案中,向受试者施用至少一种戊二酸化合物和至少一种谷氨酸化合物。在一些实施方案中,向受试者施用的化合物是α-酮戊二酸(α-KG)化合物。在一些实施方案中,向受试者施用的化合物是2-羟基戊二酸(2-HG)化合物。在一些实施方案中,向受试者施用至少一种α-KG化合物和至少一种2-HG化合物。在一些实施方案中,历经给定时间段以若干剂量(例如每日剂量持续一周或更久)施用一种或多种化合物的治疗有效量。在一些实施方案中,向受试者施用的一种或多种化合物的量使受试者中α-酮戊二酸水平增加约30-60%,优选约45-55%,更优选约50%。在一些实施方案中,以每天每千克受试者的重量,约0.25-2、优选约0.5-2、更优选约1-2、最优选约2克的每日剂量施用化合物。在一些实施方案中,受试者是动物,其可为或可不为衰老或与年龄相关的疾病的动物模型。在一些实施方案中,受试者是线虫、啮齿动物或非人灵长类动物。
上文一般性描述与下文详细描述两者均仅具有示例性和解释性,并且意图提供对如所要求保护的本发明的进一步解释。附图被包括以提供对本发明的进一步理解,并且并入本说明书中并构成本说明书的一部分,说明本发明的若干实施方案,以及连同描述一起用于解释本发明的原理。
附图描述
通过参照附图,本发明得以进一步理解,其中:
图1,图版a-f显示α-KG使秀丽隐杆线虫的成体寿命延长。
图2,图版a-i显示α-KG结合并抑制ATP合成酶。
图3,图版a-g显示α-KG长寿是通过ATP合成酶和DR/TOR轴介导。
图4,图版a-e显示由α-KG抑制ATP合成酶导致TOR路径活性保守降低。
图5,图版a-h显示补充α-KG使秀丽隐杆线虫成体寿命延长,但不改变细菌的生长速率或蠕虫的食物摄取、咽泵送速率或产卵量。在图版h中,各组中的第一棒条是媒介物。
图6,图版a-h显示α-KG结合到ATP合成酶的b亚单位,并且抑制复合物V而非其它ETC复合物的活性。
图7,图版a-c显示用寡霉素处理使秀丽隐杆线虫寿命延长,并且以依赖于let-363的方式增强自体吞噬。
图8,图版a-b显示对用a-KG或atp-2RNAi处理的蠕虫中的氧化应激的分析。
图9,图版a-c显示在不存在aak-2、daf-16、hif-1、vhl-1或egl-9下,α-KG达成的寿命。
图10,图版a-f显示a-KG降低TOR路径活性,但不直接与TOR相互作用。
图11,图版a-b显示在用ogdh-1RNAi处理的秀丽隐杆线虫中,自体吞噬被增强。
图12是显示α-KG DARTS样品中富含的蛋白质的表格。仅显示α-KG样品中具有至少15个光谱,并且富集至少1.5倍的那些蛋白质。
图13是概述来自α-KG实验的寿命数据的表格。
图14,图版A-C显示2-HG使成体秀丽隐杆线虫的寿命延长。
图15,图版A-D显示2-HG结合并抑制ATP合成酶。在图版B中,上部数据点是媒介物,中间数据点是(R)-2-HG辛酯,并且下部数据点是(S)-2-HG辛酯。
图16,图版A-E显示对IDH1(R132H)细胞中ATP合成酶的抑制。
图17A显示U87/IDH1(R132H)细胞对葡萄糖饥饿具有增加的敏感性(***P<0.001)。上部线是IDH1(WT)。
图17B显示α-KG辛酯处理的U87细胞在葡萄糖饥饿后展现活力降低(****P<0.0001)。在右侧,从上部至下部的各线是0μΜ、400μΜ和800μΜ。
图17C显示(R)-2-HG辛酯处理的U87细胞在葡萄糖饥饿后展现活力降低(***P<0.001)。在右侧,从上部至下部的各线是0μΜ、400μΜ和800μΜ。
图17D显示(S)-2-HG辛酯处理的U87细胞在葡萄糖饥饿后展现活力降低(*P<0.05)。在右侧,从上部至下部的各线是0μΜ、400μΜ和800μΜ。
图17E显示ATP5B敲低抑制U87细胞生长(***P=0.0004)。上部线是对照。
图17F显示HCT 116IDH1(R132H/+)细胞展现对补充以(R)-3-羟基丁酸的无葡萄糖培养基的易感性增加(***P<0.001)。利用双尾、双样本不等方差未配对t检验。在所有情况下都绘制平均值±s.d.。上部线是IDH1(+/+)。
图17G显示ATP5B敲低的U87细胞在无葡萄糖含半乳糖培养基中展现mTOR复合物1活性降低。
图17H显示用α-KG或2-HG的膜可渗透性酯酶可水解类似物处理的U87细胞在无葡萄糖含半乳糖培养基中展现mTOR复合物1活性降低。
图17I显示稳定表达IDH1(R132H)的U87细胞在无葡萄糖含半乳糖培养基中展现mTOR复合物1活性降低。
图18,图版A-B显示2-HG不影响通过电子传递链的电子流动,并且不影响ADP输入。在图版A中,上部数据点是媒介物,中间数据点是(R)-2-HG辛酯,并且下部数据点是(S)-2-HG辛酯。
图19,图版A-C显示2-HG抑制细胞呼吸。
图20,图版A-D显示2-HG积累的细胞的细胞能量学和代谢概况。在图版C和D中,各组中的第一棒条是媒介物。
图21,图版A-B显示HCT 116IDH1(R132H/+)细胞展现代谢易感性和生长抑制。在图版A中,**是IDH1(R132H/+);并且在图版B中,**是IDH1(R132H/+)。
图22,图版A-E显示在ATP5B敲低、用α-KG辛酯或2-HG辛酯处理或IDH1(R132H)突变后的细胞生长抑制。在图版A中,*是ATP5b siRNA;在图版B中,***是400μΜ,并且****是800μΜ;在图版C中,***是400μΜ,并且**是800μΜ;在图版D中,***是400μΜ,并且**是800μΜ;并且在图版E中,**是IDH1(R132H)。
图23是显示α-KG辛酯(200μΜ)完全消除(异丙基去甲肾上腺素)ISO诱发的肥大(左侧图版),以及抑制ISO和(苯肾上腺素)PE诱发的ANF(心房利钠因子)(中间图版)和BNP(脑利钠肽)(右侧图版)的过度表达(上部右侧图版)的图。
图24是显示从α-KG喂食的小鼠的心脏分离的线粒体(S1、S2)相较于来自对照小鼠的线粒体(C1、C2)展现较低状态3呼吸的OCR图。在状态3u下,从上部至下部的数据点是C2、C1、S2和S3。
图25是显示α-KG在体内的心脏保护作用的图。
这些附图中的若干的彩色版本可见于以引用的方式整体并入本文的Chin等,(2014)Nature 510:397-401以及与其相关的延伸数据图中。
发明详述
在一些实施方案中,本发明涉及用于治疗或抑制受试者的衰老和与年龄相关的疾病的方法,其包括向所述受试者施用至少一种戊二酸化合物、至少一种谷氨酸化合物或两者。在一些实施方案中,本发明涉及用于增加受试者的寿命的方法,其包括向所述受试者施用至少一种戊二酸化合物、至少一种谷氨酸化合物或两者。在一些实施方案中,本发明涉及用于治疗或抑制受试者的衰老和与年龄相关的疾病的组合物,所述组合物包含至少一种戊二酸化合物、至少一种谷氨酸化合物或两者。在一些实施方案中,本发明涉及用于增加受试者的寿命的组合物,所述组合物包含至少一种戊二酸化合物、至少一种谷氨酸化合物或两者。在一些实施方案中,受试者是动物,其可为或可不为衰老或与年龄相关的疾病的动物模型。在一些实施方案中,受试者是线虫、啮齿动物或非人灵长类动物。在一些实施方案中,受试者是人。
如本文所用,“与年龄相关的疾病”是指常与衰老相关的疾病和病症,并且包括癌症(例如神经胶质瘤、白血病、淋巴瘤、乳腺癌、前列腺癌、肺癌等)、神经退化性疾病(例如帕金森氏病(Parkinson's disease)、阿尔茨海默氏病(Alzheimer's disease)、亨廷顿氏病(Huntington's disease)、痴呆等)、肌肉减少症、骨量减少、骨质疏松、关节炎、动脉粥样硬化、心血管疾病、高血压、白内障、老花眼、青光眼、2型糖尿病、代谢综合征、脱发、慢性炎症、免疫衰老、年龄相关视力下降、年龄相关毛发脱落、变稀和/或变灰等。如本文所用,“与年龄相关的心脏病状”是指心脏肥大、心肌病变、心脏衰竭、心脏肥大、心肌病变、心脏衰竭和心血管疾病。
如本文所用,治疗或抑制受试者的“衰老”的方法和组合物是治疗或抑制与衰老相关的症状的那些。与衰老相关的症状包括癌症、胆固醇积累、动脉壁变硬、血压增加、免疫衰老、肌肉损失、骨损失、关节炎、骨质疏松、记忆力损失、听力损失、视力下降、皱纹增加、毛发脱落/变稀/变灰、应激抗性降低、痴呆、听力损失、视力损失、活动性损失、肌肉强度和耐力损失、虚弱、疲劳、对感染的易感性增加、皮肤干燥和/或起皱以及睡眠样式和昼夜节律循环改变。
如本文所用,“戊二酸化合物”是指α-KG化合物、2-HG化合物和具有以下结构式I的化合物:
其中
Ra和Rb各自独立地是负电荷、H、直链或支链C1-C10烷基、或直链或支链C1-C10烯基,并且
Rc是任选存在的,并且如果存在,那么Rc是H、直链或支链C1-C10烷基、或直链或支链C1-C10烯基,并且如果不存在,那么Z是双键,
及其药学上可接受的溶剂合物、盐、前药和代谢物。
如本文所用,“谷氨酸化合物”是指具有以下结构式II的化合物:
其中
Ra和Rb各自独立地是负电荷、H、直链或支链C1-C10烷基、或直链或支链C1-C10烯基,并且
及其药学上可接受的溶剂合物、盐、前药和代谢物。因为α-KG可通过使用谷氨酸脱氢酶进行氧化脱氨而从谷氨酸回补产生,以及作为其中谷氨酸是常见氨基供体的磷酸吡哆醛依赖性转氨反应的产物,所以谷氨酸是α-KG的前药。
如本文所用,“C1-C10烷基”是指具有1-10个碳原子的烷基,并且“C1-C10烯基”是指具有1-10个碳原子的烯基。
如本文所用,“α-KG”化合物是指α-酮戊二酸(α-酮戊二酸盐(酯))、α-酮戊二酸的衍生物(例如MacKenzie等(2007)Mol Cell Biol 27(9):3282-3289)中阐述的衍生物)、α-酮戊二酸的类似物(例如膦酸酯类似物(例如Bunik等(2005)Biochemistry 44(31):10552-61中叙述的那些))、α-酮戊二酸的酯(例如α-酮戊二酸二甲酯和α-酮戊二酸辛酯)以及各种物种特异性类似物,例如人α-酮戊二酸、猪α-酮戊二酸、鼠类α-酮戊二酸、牛α-酮戊二酸等。如本文所用,缩写“KG”可用于指代术语“酮戊二酸”,例如α-酮戊二酸缩写为α-KG。
如本文所用,“2-HG化合物”是指2-羟基戊二酸、2-羟基戊二酸盐(酯)、和具有2-羟基戊二酸基作为它的骨架结构的一部分的化合物,并且包括(S)-2-羟基戊二酸1-烷基酯、(R)-2-羟基戊二酸1-烷基酯、(S)-2-羟基戊二酸1-烯基酯、(R)-2-羟基戊二酸1-烯基酯、(S)-2-羟基戊二酸5-烷基酯、(R)-2-羟基戊二酸5-烷基酯、(S)-2-羟基戊二酸5-烯基酯和(R)-2-羟基戊二酸5-烯基酯,其中烷基是直链或支链C1-C10烷基,并且烯基是直链或支链C1-C10烯基。在一些实施方案中,2-HG化合物是(S)-2-羟基戊二酸1-辛酯、(R)-2-羟基戊二酸1-辛酯、(S)-2-羟基戊二酸5-辛酯、或(R)-2-羟基戊二酸5-辛酯。如本文所用,缩写“HG”可用于指代术语“羟基戊二酸”,例如2-羟基戊二酸缩写为2-HG。
“药学上可接受的溶剂合物”是指指定化合物的保留所述化合物的生物有效性的溶合形式。溶剂合物的实例包括与水、异丙醇、乙醇、甲醇、二甲亚砜、乙酸乙酯、乙酸、乙醇胺或丙酮组合的本发明化合物。有机化学领域技术人员将了解许多有机化合物可与它们在其中反应或它们从其沉淀或结晶的溶剂形成复合物。这些复合物称为“溶剂合物”。举例来说,与水的复合物称为“水合物”。式I和式II化合物的溶剂合物在本发明的范围内。有机化学技术人员也将了解许多有机化合物可以超过一种结晶形式存在。举例来说,在各溶剂合物之间,结晶形式可不同。因此,式I和式II化合物的所有结晶形式或其药学上可接受的溶剂合物都在本发明的范围内。
术语“药学上可接受的盐”是指药理学上可接受,并且对用本发明化合物治疗的受试者大致上无毒的盐形式。药学上可接受的盐包括由适合无毒有机或无机酸或无机碱形成的常规酸加成盐或碱加成盐。示例性酸加成盐包括由诸如盐酸、氢溴酸、氢碘酸、硫酸、氨基磺酸、磷酸和硝酸的无机酸获得的那些,以及由诸如对甲苯磺酸、甲烷磺酸、乙烷二磺酸、羟基乙磺酸、草酸、对溴苯磺酸、碳酸、丁二酸、柠檬酸、苯甲酸、2-乙酰氧基苯甲酸、乙酸、苯乙酸、丙酸、乙醇酸、硬脂酸、乳酸、苹果酸、酒石酸、抗坏血酸、顺丁烯二酸、羟基顺丁烯二酸、谷氨酸、水杨酸、对氨基苯磺酸和反丁烯二酸的有机酸获得的那些。示例性碱加成盐包括由氢氧化铵(例如氢氧化季铵,诸如氢氧化四甲铵)获得的那些,由无机碱,诸如碱金属或碱土金属(例如钠、钾、锂、钙或镁)氢氧化物获得的那些,以及由无毒有机碱,诸如碱性氨基酸获得的那些。
“药学上可接受的前药”是可在生理条件下或通过溶剂分解而转化成指定化合物或所述化合物的药学上可接受的盐的化合物。“药物活性代谢物”是指通过指定化合物或其盐在体内代谢产生的药理学活性产物。可使用本领域中已知的常规技术鉴定化合物的前药和活性代谢物。参见例如Bertolini,G.等,(1997)J.Med.Chem.40:2011-2016;Shan,D.等,J.Pharm.Sci.,86(7):765-767;Bagshawe K.,(1995)Drug Dev.Res.34:220-230;Bodor,N.,(1984)Advances in Drug Res.13:224-331;Bundgaard,H.,Design of Prodrugs(Elsevier Press,1985)以及Larsen,I.K.,Design and Application of Prodrugs,Drug Design and Development(Krogsgaard-Larsen等编,Harwood Academic Publishers,1991)。
在一些实施方案中,向受试者施用的戊二酸化合物的量是治疗有效量或有效量。如本文所用,“有效量”是相较于安慰剂产生可观察差异的剂量。“治疗有效量”是指一种或多种本发明化合物的在向受试者施用时,相较于对照,(i)治疗或抑制特定疾病、病状或病症,(ii)减弱、改善或消除特定疾病、病状或病症的一种或多种症状,和/或(iii)抑制或延迟特定疾病、病状或病症的一种或多种症状的发作的量。一种或多种本发明化合物的治疗有效量将视诸如给定化合物、药物制剂、施用途径、疾病或病症的类型、疾病或病症的程度、以及所治疗受试者的身份的因素而变化,但然而可易于由本领域技术人员确定。举例来说,戊二酸化合物、谷氨酸化合物或两者的“治疗有效量”是相较于一个或多个对照受试者,延迟或抑制与年龄相关的症状的发作和/或延长给定受试者的寿命的量。
在一些实施方案中,以每天每千克受试者的重量,约0.25-2、约0.5-2、约1-2、或约2克的每日剂量施用一种或多种戊二酸化合物和/或一种或多种谷氨酸化合物的治疗有效量。熟练技术人员将了解某些因素可影响为有效治疗受试者所需的剂量,所述因素包括但不限于疾病或病症的严重性、先前治疗、受试者的总体健康和/或年龄、以及存在的其它疾病。
如本文所示,使受试者中α-KG水平增加约50%的剂量导致最大寿命增加(多达约70%)。因此,在一些实施方案中,向受试者施用的一种或多种戊二酸化合物和/或一种或多种谷氨酸化合物的量是导致所述受试者中α-KG水平增加约50%的量。
可历经一个时间段以单次剂量或以多次剂量施用治疗有效量。举例来说,受试者可用一种或多种戊二酸化合物和/或一种或多种谷氨酸化合物治疗至少一次。然而,受试者可用一种或多种戊二酸化合物和/或一种或多种谷氨酸化合物持续给定治疗时期约每周一次至约每日一次治疗。治疗时期的时长将取决于多种因素,诸如疾病或病症的严重性、一种或多种本发明化合物的浓度和活性、或其组合。也应了解一种或多种用于治疗的化合物的有效剂量可历经特定治疗的过程增加或降低。
可以药物制剂形式提供待向受试者施用的一种或多种戊二酸化合物和/或一种或多种谷氨酸化合物。药物制剂可以适于所需施用模式的单位剂型制备。本发明的药物制剂可通过任何适合途径施用,所述途径包括口服、经直肠、经鼻、经表面(包括经颊和舌下)、经阴道和胃肠外(包括皮下、肌肉内、静脉内和皮内)。应了解施用途径可随接受者的状况和年龄、待治疗的病状的性质、以及本发明的给定化合物而变化。在一些实施方案中,施用途径是口服。在一些实施方案中,以食料形式提供一种或多种戊二酸化合物和/或一种或多种谷氨酸化合物。
应了解戊二酸化合物和/或谷氨酸化合物的用于药物制剂中的实际剂量将根据所使用的特定化合物、配制的特定组合物、施用模式、以及所治疗的特定部位、受试者和疾病而变化。用于一组给定病状的最优剂量可由本领域技术人员使用剂量确定测试鉴于给定化合物的实验数据来确定。前药的施用可在化学等效于完全活性形式的重量水平的重量水平下给药。
本发明的药物制剂包含治疗有效量的一种或多种本发明化合物以及惰性药学上可接受的载体或稀释剂。如本文所用,措辞“药学上可接受的载体”意图包括可与药物施用相容的任何和所有溶剂、分散介质、包覆剂、抗细菌剂和抗真菌剂、等张剂和吸收延迟剂等。采用的药物载体可为固体或液体。固体载体的实例是乳糖、蔗糖、滑石、明胶、琼脂、果胶、阿拉伯胶、硬脂酸镁、硬脂酸等。液体载体的实例是糖浆、花生油、橄榄油、水等。类似地,载体或稀释剂可包括本领域中已知的延时或定时释放物质,诸如单独或与蜡一起的单硬脂酸甘油酯或二硬脂酸甘油酯、乙基纤维素、羟丙基甲基纤维素、甲基丙烯酸甲酯等。针对药物活性物质使用所述介质和试剂在本领域中是已知的。
戊二酸化合物和谷氨酸化合物的毒性和治疗功效可通过在细胞培养物或实验动物中进行的例如用于确定LD50(对群体的50%具有致死性的剂量)和ED50(在群体的50%中具有治疗有效性的剂量)的标准药物程序来测定。毒性作用与治疗作用之间的剂量比率是治疗指数,并且它可表示为比率LD50/ED50。展现大治疗指数的化合物是优选的。尽管可使用展现毒性副作用的化合物,但应小心设计使所述化合物靶向受影响组织的部位的递送系统以使对未感染细胞的潜在损害最小,并且由此降低副作用。
由细胞培养测定和动物研究获得的数据可用于配制一定范围的用于人中的剂量。所述化合物的剂量优选处于具有少许或不具有毒性的一定范围的包括ED50的循环浓度内。视采用的剂型和利用的施用途径而定,剂量可在这个范围内变化。对于用于本发明方法中的任何化合物,治疗有效剂量可初始由细胞培养测定来估计。可配制动物模型中的剂量以实现如在细胞培养中确定的循环血浆浓度范围,其包括IC50(即测试化合物的实现半数最大症状抑制的浓度)。所述信息可用于更准确确定适用于人中的剂量。可例如通过高效液相色谱法测量血浆中的水平。
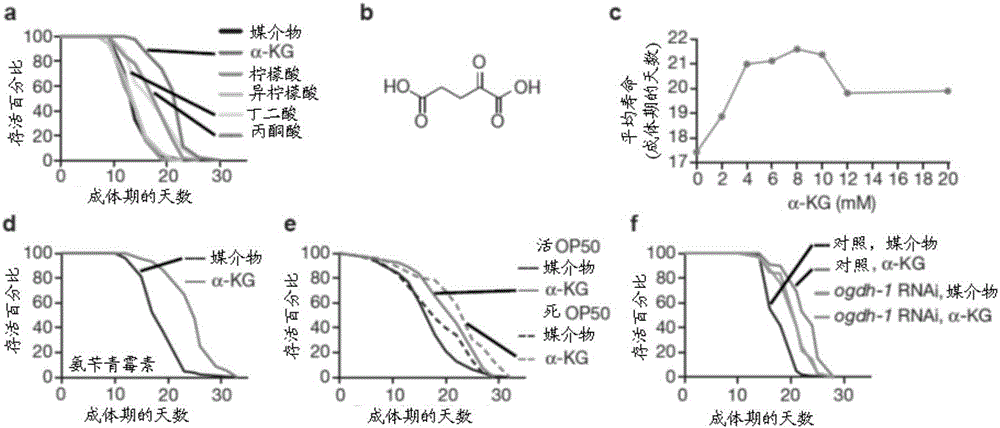
α-KG使成体秀丽隐杆线虫(C.elegans)的寿命延长
为获得对由内源性小分子调控衰老的了解,使用秀丽隐杆线虫模型,针对正常代谢物和异常疾病相关代谢物对成体寿命的影响来筛选它们。发现TCA循环中间体α-KG(而非异柠檬酸或柠檬酸)使衰老延迟,并且使秀丽隐杆线虫的寿命延长约50%(图1,图版a,图5,图版a)。在细胞中,α-KG(或2-氧代戊二酸,图1,图版b)通过由异柠檬酸脱氢酶(IDH)催化的氧化脱羧由异柠檬酸产生。α-KG以浓度依赖性方式使野生型N2寿命延长,其中8mMα-KG产生最大寿命延长(图1,图版c);8mM是用于所有随后秀丽隐杆线虫实验中的浓度。相较于媒介物板上的那些(图5,图版b),8mMα-KG板上的蠕虫中的α-KG浓度有约50%增加,或在假定均质分布的情况下,约160μΜ对约110μΜ。α-KG不仅延长寿命,而且也延迟年龄相关表型,诸如快速协调身体动作衰退(补充性视频1和2,可在因特网上在WorldWideWeb.natureDOTCOM/nature/journal/v510/n7505/fig_tab/nature13264_SV1.HyperTextMarkupLanguage和WorldWideWeb.natureDOTCOM/nature/journal/v510/n7505/fig_tab/nature13264_SV2.HyperTextMarkupLanguage处获得,其中“WorldWideWeb”是“www”,“DOTCOM”是“.com”,并且“HyperTextMarkupLanguage”是“html”)。在成体期补充α-KG足以达成长寿(图5,图版c)。
已显示稀释或杀灭细菌性食物会延长蠕虫寿命,但由α-KG达成的寿命增加不归因于细菌增殖、活力或代谢改变(图1,图版d-e,图5,图版d)。动物也不将α-KG处理的食物视为不太喜爱的(图5,图版e-f),并且在α-KG存在下,在食物摄取、咽泵送、觅食行为、体格大小、或产卵量方面不存在显著变化(图5,图版e-h,数据未显示)。
在细胞中,α-KG由α-KG脱氢酶(由ogdh-1编码)脱羧成丁二酰基-CoA和CO2,这是TCA循环中的关键控制点。通过ogdh-1RNAi增加α-KG水平(图5,图版b)也使蠕虫寿命延长(图1,图版f),这与α-KG独立于细菌性食物对长寿的直接作用一致。
为探究由α-KG达成的长寿的分子机理,使用无偏生物化学方法DARTS。易于培养的人细胞系(Jurkat)用作DARTS的蛋白质来源(图2,图版a)。质谱测定法鉴定在α-KG处理的样品中存在的最丰富和富含的蛋白质之中的ATP5B,即ATP合成酶的催化核心的β亚单位(图12);虽然程度较小,但同源性α亚单位ATP5A也是富含的。使用额外细胞系验证α-KG与ATP5B之间的相互作用(图2,图版b,数据未显示),并且关于秀丽隐杆线虫直系同源物ATP-2加以确证(图6,图版a)。
α-KG抑制来自牛心脏线粒体的复合物V而非复合物IV的活性(图2,图版c,图6,图版b,数据未显示)。这个抑制也易于在活哺乳动物细胞中(图2,图版d,数据未显示)以及活线虫中(图2,图版e)检测到,如通过ATP水平降低所证实。相伴地,氧消耗速率降低(图2,图版f-g),这类似于atp-2敲低的情况(图6,图版c)。复合物V而非其它ETC复合物由α-KG特异性抑制进一步通过呼吸控制分析来确认(图2,图版h,图6,图版d-h)。
为了解由α-KG达成的抑制的机理,研究ATP合成酶的酶抑制动力学。α-KG(从α-KG辛酯释放)使ATP合成酶的有效Vmax与Km两者均降低,从而指示无竞争性抑制(图2,图版i)。
为确定ATP-2对由α-KG达成的长寿的重要性,测量被给与α-KG的atp-2(RNAi)成体的寿命。atp-2(RNAi)动物比对照活得更长久(图3,图版a)。然而,它们的寿命未由α-KG进一步延长(图3,图版a),从而指示ATP-2涉及于α-KG的长寿益处中。相反,活的甚至更长久的胰岛素/IGF-1受体daf-2(e1370)突变蠕虫的寿命由α-KG进一步增加(图3,图版b)。值得注意的是,ATP合成酶的抑制剂寡霉素(oligomycin)也延长成体蠕虫的寿命(图7,图版a)。总之,由α-KG直接结合ATP-2、相关酶抑制、ATP水平和氧消耗降低、寿命分析以及与atp-2敲低或寡霉素处理的其它类似性(也参见图8)证明α-KG可能通过靶向ATP-2来延长寿命。
发现α-KG不延长eat-2(ad1116)动物的寿命(图3,图版c),所述动物是咽泵送受损,并且因此食物摄取降低的DR模型。eat-2突变体的长寿涉及DR对长寿的作用的重要介体TOR/let-363。同样,α-KG不使CeTOR(RNAi)动物的寿命增加(图3,图版d)。AMP活化的蛋白质激酶(AMPK)是细胞能量状态的另一保守主要感测体。在喂以稀释细菌的秀丽隐杆线虫中,AMPK/aak-2与FoxO转录因子DAF-16两者均介导DR诱导的长寿,但在eat-2模型中,两者均不为寿命延长所需。发现在aak-2(图9,图版a)和daf-16(图3,图版e)突变体中,α-KG的长寿作用小于在N2中(P<0.0001),从而表明α-KG长寿部分涉及AMPK和FoxO;然而,在aak-2(24.3%,P<0.0001)和daf-16(29.5%,P<0.0001)突变体或RNAi动物中,寿命由α-KG显著增加(图3,图版e,图9,图版a-b,数据未显示),从而指示由α-KG在长寿方面达成的AMPK-FoxO非依赖性作用。
α-KG不能进一步延长CeTOR(RNAi)动物的寿命指示α-KG处理和TOR失活通过相同路径(其中α-KG作用于TOR或TOR的上游),或通过集中于下游效应物的独立机理或平行路径来延长寿命。第一模型预测在α-KG处理后,TOR路径的活性将较小,而如果后述模型是真性的,那么TOR将不受α-KG处理的影响。支持第一模型的是,发现在用α-KG辛酯处理的人细胞中,TOR路径活性降低(图4,图版a,图10,图版a-b)。然而,α-KG不直接与TOR相互作用(图10,图版d-e)。与TOR涉及于α-KG长寿中一致,FoxA转录因子PHA-4同样涉及于α-KG诱导的长寿中(图3,图版f)。此外,在用α-KG(或ogdh-1RNAi)处理的蠕虫中以及在atp-2(RNAi)动物中,由TOR抑制与DR两者活化的自体吞噬显著增加(图4,图版b-c,图10,图版c,图11),如由GFP::LGG-1斑点的盛行所指示。
在用α-KG辛酯处理的哺乳动物细胞中,自体吞噬也被诱导(图10,图版f)。此外,在atp-2(RNAi)或CeTOR(RNAi)蠕虫中,α-KG不导致显著更大程度的自体吞噬(图4,图版b-c)。数据提供进一步证据表明α-KG通过抑制ATP合成酶来使TOR路径活性降低。类似地,自体吞噬由寡霉素诱导,并且寡霉素不加强CeTOR(RNAi)蠕虫中的自体吞噬(图7,图版b-c)。
α-KG不仅是代谢物,而且也是一大家族双加氧酶的共同底物。缺氧诱导性因子(HIF-1)由这些酶中的一个(即脯氨酰基4-羟化酶(PHD)EGL-9)修饰,并且此后由冯希佩尔-林道(von Hippel-Lindau,VHL)蛋白降解。发现α-KG使具有hif-1、egl-9和vhl-1功能损失突变的动物的寿命延长(图3,图版g,图9,图版c),并且由此表明这个路径在由α-KG延长寿命方面不起主要作用。然而,其它α-KG结合靶标也可在延长寿命方面起作用。
考查在分离的新生大鼠心肌细胞中,α-KG辛酯针对异丙基去甲肾上腺素(isoproterenol)诱发的肥大的保护作用。通过胶原蛋白酶消化来分离新生大鼠的心肌细胞,并且在含有10%胎牛血清(FCS)的DMEM中培养过夜,接着将培养基变换成无血清高葡萄糖胰岛素-转铁蛋白-亚硒酸钠(ITS)。通过用1mM异丙基去甲肾上腺素(ISO)或苯肾上腺素(phenylephrine,PE)处理细胞48小时来诱发心肌细胞的肥大。如图23中所示,α-KG辛酯(200μΜ)完全消除ISO诱发的肥大(左侧图版),以及抑制ISO和PE诱发的肥大相关标志物心房利钠因子(ANF)和脑利钠肽(BNP)的过度表达(右侧图版),从而指示由α-KG达成的心脏保护和抗肥大作用。
为测试α-KG辛酯在动物中的生物可用性和口服可用性,对动物喂以α-KG辛酯,并且评估α-KG辛酯的分子和细胞作用,特别是它对线粒体ATP合成酶(复合物V)活性的抑制是否可在体内重演。持续一周对小鼠喂以与α-KG辛酯(1.5mg/g体重)或辛醇(对照)预混合的食物膳食。在用α-KG辛酯或辛醇喂食5天之后,动物在生理上或在行为上未显示异常。将小鼠处死,收集心脏,并且分离线粒体。使用Seahorse XF-24分析器(Seahorse Bioscience)测量氧消耗速率(OCR)。如图24中所示,从α-KG喂食的小鼠分离的线粒体(S1、S2)相较于来自对照小鼠的线粒体(C1、C2)展现较低状态3呼吸,从而反映α-KG辛酯对分离的线粒体的直接作用。α-KG辛酯喂食的小鼠中的状态3呼吸的降低指示α-KG辛酯可被摄取,吸收,并且分布在体内以释放α-KG来作用于它的细胞靶标。
考查α-KG在体内的心脏保护作用。通过使用渗透小型泵(Alzet,1004型)在每天每克体重30μg的剂量下持续3周长期输注异丙基去甲肾上腺素来诱发肥大和心脏衰竭。8周龄的DBA2/J雌性小鼠用于这个研究。在三周研究期间,对小鼠每日喂以含每克体重0.5mgα-KG辛酯的食物。在实验结束时,通过评估心脏大小以及心脏与身体重量比率来确定ISO诱发的心脏肥大和心肌病变。如图25的左侧图版中所示,在实验结束时,心脏(mg)/身体(g)比率是5.32±0.26(n=4)(对于对照组)、7.26±0.12(n=3)(对于ISO和辛醇处理组)、以及6.81±0.24(n=6)(平均值,STEDV)(对于ISO和α-KG辛酯处理组)。ISO处理的小鼠显示心脏大小以及心脏与身体重量比率显著增加,而ISO处理的小鼠在也用α-KG辛酯治疗时展现心脏大小以及心脏与身体重量比率显著降低。
更重要的是,评估心输出量,并且通过超声波心动描记术来测定心脏射血分数。在处理之前的基础水平的心脏EF是55.1%±2.6(n=14)。如图25的右侧图版中所示,在研究结束时(3周),心脏EF是54.5%+0.9(对于无ISO对照组(n=2))、49.2%±1.9(对于ISO处理组(与辛醇一起)(n=3))、以及53.8%±2.3(对于ISO加α-KG辛酯处理(n=6))。在三周之后,对照组(无ISO,加辛醇)的EF与在处理之前的基础类似。相较于无ISO组,ISO处理组的EF显著降低。值得注意的是,ISO加α-KG辛酯的EF被恢复至无ISO组的水平。这些结果显示在实验性心脏衰竭动物模型中,α-KG可显著减轻ISO诱发的心脏肥大,并且恢复心输出量。
2-HG使成体秀丽隐杆线虫的寿命延长
尽管2-HG与α-KG展现结构类似性(图14,图版A),但2-HG与神经病症、癌症和各种与年龄相关的疾病相关联。因此,用2-HG进行各种实验以确定2-HG是否导致长寿降低。惊人地,(R)-2-HG与(S)-2-HG两者均在与α-KG类似的程度上使秀丽隐杆线虫的寿命增加(图14,图版B-C)。
DARTS分析显示2-HG靶向ATP5B。具体来说,发现(R)-2-HG与(S)-2-HG两者均结合ATP5B(图15,图版A,并且数据未显示)。类似于α-KG,2-HG抑制ATP合成酶(复合物V)(图15,图版B)。这个抑制是特异性的,因为2-HG不抑制其它电子传递链(ETC)复合物(图18,图版A),或ADP向线粒体中输入(图18,图版B)。由2-HG抑制ATP合成酶也易于在活细胞中检测到;用膜可渗透性α-KG辛酯或2-HG辛酯处理U87胶质母细胞瘤细胞(野生型IDH1/2)导致在线粒体氧化磷酸化情况下细胞ATP含量降低(图15,图版C),如同明确确定的ATP合成酶抑制剂寡霉素一样(图19,图版A)。在处理的细胞中,总体氧消耗速率与ATP合成酶关联的氧消耗速率两者均降低(图15,图版D以及图19,图版B-C)。
在约200μΜ的正常细胞浓度下,(R)-2-HG不大可能导致对ATP合成酶的显著抑制。然而,在其中(R)-2-HG积累至天然内源性水平的10-100倍的具有IDH1或IDH2突变的神经胶质瘤患者中,抑制ATP合成酶将为可能的。为测试这个理念,使用稳定表达IDH1(R132H)(即神经胶质瘤中最常见的IDH突变)的U87细胞。类似于上述2-HG辛酯处理的细胞,U87/IDH1(R132H)细胞相较于等基因IDH1(WT)表达性U87细胞展现ATP含量和氧消耗速率降低(图16,图版A-B)。在HCT 116IDH1(R132H/+)细胞中获得类似结果(图20,图版A)。在表达IDH1(R132H)的U87和HCT 116细胞中,细胞内(R)-2-HG水平比对照细胞高约50-100倍(图16,图版C,以及图20,图版B),并且与见于进行(R)-2-HG辛酯处理的细胞(图16,图版D)和IDH1突变肿瘤样品中的(R)-2-HG水平增加类似。这些数据与在突变IDH1癌细胞中,由(R)-2-HG抑制ATP合成酶和线粒体呼吸一致。
代谢物2-HG与TCA循环和相关氨基酸代谢路径相关联(图16,图版E)。为探究在2-HG辛酯处理后的潜在代谢变化,通过LC-MS测量2-HG辛酯处理的细胞中的代谢物水平。发现在2-HG辛酯处理之后,2-HG积累至约20-100倍(图16,图版D,以及图20,图版C)。相较于2-HG的积累,TCA循环代谢物或相关氨基酸不存在显著变化(<2倍)(图16,图版D,以及图20,图版C)。类似地,在α-KG辛酯处理的样品中,α-KG的积累是代谢概况方面的最深度变化(图20,图版D)。静态代谢概况支持以下见解:在2-HG(或α-KG)处理的细胞中观察的生物能转变(以及信号传导变化,参见下文)由ATP合成酶受2-HG(或α-KG)直接抑制而非整体代谢效应所致。
作为线粒体电子传递链(ETC)的末端组分(复合物V),ATP合成酶是细胞能量的主要来源以及唯一氧化磷酸化位点。当糖酵解受抑制时,诸如在葡萄糖不足的情况下,细胞被迫依赖于线粒体呼吸作为ATP的来源。因此,固有抑制突变IDH1癌细胞中的ATP合成酶和线粒体呼吸表明对于这些癌症来说可能的致命要害(Achilles'heel)。支持这个理念的是,当在无葡萄糖的含半乳糖培养基中培养时,例如当呼吸是主要能量来源时,IDH1(R132H)细胞展现细胞活力剧烈降低(图17,图版A以及图21,图版A)。这些结果指示IDH1(R132H)突变细胞对葡萄糖的剥夺特别敏感。突变细胞系对FBS剥夺不敏感(数据未显示),从而指示它对葡萄糖饥饿的增加的易感性是特异性的。在用α-KG辛酯或2-HG辛酯处理的U87细胞中(图17,图版B-D)以及在ATP5B敲低细胞中(图17,图版E),类似代谢易感性是明显的。这些研究结果指示具有IDH1(R132H)突变的癌细胞归因于由于ATP合成酶关闭而不能利用线粒体呼吸,所以也可对与葡萄糖限制类似的营养条件特别敏感。
在复杂生物体中,葡萄糖限制可通过酮症来实现,其中细胞使用酮体(而非葡萄糖)来获得能量。在长期饥饿(或禁食)后,酮症被天然诱发,呈现身体从它的相对持久脂肪储集库获得能量,同时使肌肉和其它组织中的蛋白质免受分解代谢的存活模式。酮症也可通过已显示抗癌益处的低碳水化合物-高脂肪“生酮膳食”实现。关于这个的一个原因可为肿瘤细胞主要依赖于葡萄糖来达成生长和存活。因为酮体的代谢完全依赖于线粒体氧化磷酸化,所以一个预测是如果酮体将是癌细胞的唯一能量来源,那么抑制癌细胞中的ATP合成酶(或其它ETC组分)将赋予存活劣势。因为U87细胞不能利用酮体来获得能量,所以为直接评估IDH1突变的影响,使用表达突变IDH1的HCT 116细胞。当在含有酮体(R)-3-羟基丁酸的生酮(无葡萄糖)培养基中培养时,IDH1突变HCT 116细胞相较于亲本细胞显示活力深度降低(图17,图版F),从而确认IDH突变细胞的所声称的代谢弱点。这些结果不仅进一步支持2-HG在突变IDH癌细胞中积累导致ATP合成酶抑制的研究结果,而且也表明在癌症治疗方面的新型代谢治疗策略。
类似于用降低TOR信号传导的ATP合成酶抑制剂α-KG辛酯或寡霉素处理,发现在ATP5B敲低细胞中(图17,图版G),在用2-HG的辛酯处理的细胞中(图17,图版H),以及在IDH1(R132H)表达性细胞中(图17,图版I),包括S6K和4E-BP1的mTOR复合物1底物的磷酸化被降低。这些结果指示抑制ATP合成酶导致细胞中的mTOR活性降低,这与在蠕虫和苍蝇中获得的结果一致。因为TOR是细胞生长的主要调控子,所以ATP合成酶受抑制的细胞中的mTOR路径活性降低预示可能的细胞生长阻滞。实际上,当以半乳糖作为唯一糖源培养ATP5B敲低细胞时,例如当它们被迫依赖于线粒体呼吸来产生ATP时,生长被完全阻滞(图17,图版E)。即使在葡萄糖培养基中,细胞生长降低也可易于检测(图22,图版A)。用α-KG辛酯或2-HG辛酯处理类似地抑制U87细胞生长(图22,图版B-D)。在测试的其它癌细胞系(包括A549和Jurkat)中,在永生化非恶性HEK 293细胞中,以及在正常人二倍体纤维母细胞WI-38中,也观察到由2-HG(以及由α-KG)达成的生长抑制(数据未显示),从而表明生长抑制的机理可为通用的,并且过量2-HG可充当生长抑制性代谢物。在表达突变IDH1(R132H)的U87细胞与HCT 116细胞两者中,类似生长抑制均是明显的(图22,图版E以及图21,图版B)。这些数据一起表明突变IDH1细胞中ATP合成酶和mTOR的一致抑制状态。
总之,类似于α-KG,2-HG的两种对映异构体均结合并抑制ATP合成酶,并且使秀丽隐杆线虫的寿命延长。由这些相关代谢物对ATP合成酶的抑制使线粒体呼吸和mTOR信号传导降低。2-HG与α-KG两者均展现广泛生长抑制作用,并且在葡萄糖限制条件下降低癌细胞活力。本文实验表明尽管2-HG是干扰各种α-KG结合因子,在癌症中具有重要性的致癌性代谢物,但2-HG也-通过抑制ATP合成酶和mTOR信号传导下游-来起降低肿瘤细胞生长和活力的作用。
以下实施例意图说明而非限制本发明。
实施例
线虫品系和维持。使用本领域中已知的方法维持秀丽隐杆线虫(Caenorhabditis elegans)品系。使用以下品系:
细胞培养
在补充以10%胎牛血清(FBS)和10mM葡萄糖的无葡萄糖DMEM(Life technologies,11966-025)中,或当指示时在补充以10%FBS和10mM半乳糖的无葡萄糖DMEM中培养U87细胞。IDH1(R132H)突变或IDH1(WT)表达性U87细胞如所报道(Li等Neuro Oncol 15,57-68)。用补充以10%FBS的EMEM(ATCC,30-2003)培养正常人二倍体纤维母细胞WI-38(ATCC,CCL-75)。用补充以10%FBS的DMEM(Life technologies,11966-065)培养HEK 293、A549和HeLa细胞。在补充以10%FBS的RPMI(Life technologies,11875-093)中培养Jurkat和HCT 116细胞。所有细胞都在37℃和5%CO2下培养。通过遵循制造商说明书,使用Thermo Scientific DharmaFECT转染试剂1,用指示的siRNA转染细胞。通过在生长抑制测定的第一天和最后一天进行免疫印迹来确认敲低效率。
化合物
使用本领域中已知的方法合成α-KG 1-辛酯、(S)-2-HG辛酯和(R)-2-HG辛酯。参见Jung和Deng,J Org Chem 77,11002-11005(2012);Albert等.Synthesis-Stuttgart,635-637(1987);以及Cancer Cell 19,17-30(2011)。对合成方法的修改如下:
合成α-KG辛酯
简要来说,在0℃下,添加1-辛醇(0.95ml,6.0mmol)、DMAP(37mg,0.3mmol)和DCC(0.743g,3.6mmol)至1-环丁烯-1-甲酸(0.295g,3.0mmol)于无水CH2Cl2(6.0ml)中的溶液中。在已搅拌1小时之后,使溶液升温至室温,并且再搅拌8小时。过滤沉淀,并且用乙酸乙酯(3X 100ml)洗涤。合并的有机相用水和盐水洗涤,并且经无水Na2SO4干燥。用80/1己烷/乙酸乙酯洗脱的硅胶快速柱色谱法产生呈澄清油状的环丁-1-烯甲酸辛酯(0.604g,96%)。向这个油状物(0.211g,1.0mmol)于CH2Cl2(10ml)中的-78℃溶液中鼓泡O3/O2直至溶液变蓝。通过用O2鼓泡来排放残余臭氧,并且使反应升温至室温并再搅拌1小时。添加二甲基硫醚(Me2S,0.11ml,1.5mmol)至混合物中,并且将它再搅拌2小时。在真空中移除CH2Cl2,并且将粗产物溶解于2-甲基-2-丁烯(0.8ml)于t-BuOH(3.0ml)中的溶液中。向这个中逐滴添加于H2O(1.0ml)中含有亚氯酸钠(0.147g,1.3mmol)和磷酸二氢钠单水合物(0.179g,1.3mmol)的溶液。将混合物在室温下搅拌过夜,接着用乙酸乙酯(3X 50ml)萃取。合并的有机相用水和盐水洗涤,并且经无水Na2SO4干燥。用5/1己烷/乙酸乙酯洗脱的硅胶快速柱色谱法产生α-KG辛酯,其在于冰箱中储存时变为灰白色固体(0.216g,84%)。
合成L-Glu 5-辛酯((S)-2-氨基-5-(辛基氧基)-5-氧代戊酸)
将L-谷氨酸(0.147g,1.0mmol)和无水硫酸钠(0.1g)溶解于辛醇(2.0ml)中,接着添加四氟硼酸-二甲基醚复合物(0.17ml)。将悬浮混合物在21℃下搅拌过夜。添加无水THF(5ml)至混合物中,并且将它经厚活性炭垫过滤。添加无水三乙胺(0.4ml)至澄清滤液中以获得乳白色浆液。在用乙酸乙酯(10ml)湿磨后,单酯单酸得以沉淀。收集沉淀,用额外乙酸乙酯(2X 5ml)洗涤,并且在真空中干燥以产生呈白色固体状的所需产物L-Glu 5-辛酯(0.249g,96%)。1H NMR(500MHz,乙酸-d4):δ4.12(dd,J=6.6,6.6Hz,1H),4.1 1(t,J=6.8Hz,2H),2.64(m,2H),2.26(m,2H),1.64(m,2H),1.30(m,10H),0.89(t,J=7.0Hz,3H)。13C NMR(125MHz,乙酸-d4):175.0,174.3,66.3,55.0,32.7,30.9,30.1 1,30.08,29.3,26.7,26.3,23.4,14.4。
合成D-Glu 5-辛酯((R)-2-氨基-5-(辛基氧基)-5-氧代戊酸)
通过严格相同程序,以D-谷氨酸起始来进行相对对映异构体(即D-Glu5-辛酯)的合成。光谱数据与对映异构化合物的光谱数据相同。
合成α-KG 5-辛酯(5-(辛基氧基)-2,5-二氧代戊酸)
2-氧代戊二酸1-苯甲酯5-辛酯:向L-Glu 5-辛酯(0.249g)于H2O(6.0ml)和乙酸(2.0ml)中的冷却至0℃的溶液中缓慢添加亚硝酸钠水溶液(0.207g,3.0mmol,于4ml H2O中)。使反应混合物缓慢升温至室温并搅拌过夜。浓缩混合物。将所得残余物溶解于DMF(10ml)中,并且添加NaHCO3(0.42g,5.0mmol)和苯甲基溴化物(0.242ml,2.0mmol)至混合物中。将混合物在21℃下搅拌过夜,接着用乙酸乙酯(3x 30ml)萃取。合并的有机相用水和盐水洗涤,并且经无水MgSO4干燥。用7/1己烷/乙酸乙酯洗脱的硅胶快速柱色谱法产生呈无色油状的混合二酯(S)-2-羟基戊二酸1-苯甲酯5-辛酯。向溶解于二氯甲烷(10.0ml)中的这个油状物中添加NaHCO3(0.42g,5.0mmol)和戴斯-马丁(Dess-Martin)过碘烷(0.509g,1.2mmol),并且在室温下搅拌混合物1小时,接着用乙酸乙酯(3x 30ml)萃取。合并的有机相用水和盐水洗涤,并且经无水MgSO4干燥。用5/1己烷/乙酸乙酯洗脱的硅胶快速柱色谱法产生呈白色固体状的所需2-氧代戊二酸1-苯甲酯5-辛酯(0.22g,66%)。1H NMR(500MHz,CDCl3):7.38(m,5H),5.27(s,2H),4.05(t,J=6.5Hz,2H),3.14(t,J=6.5Hz,2H),2.64(t,J=6.5Hz,2H),1.59(m,2H),1.28(m,10H),0.87(t,J=7.0Hz,3H)。13C NMR(125MHz,CDCl3):192.2,171.9,160.1,134.3,128.7,128.6,128.5,67.9,65.0,34.2,31.7,29.07,29.05,28.4,27.5,25.7,22.5,14.0。
α-KG 5-辛酯(5-(辛基氧基)-2,5-二氧代戊酸):向2-氧代戊二酸1-苯甲酯5-辛酯(0.12g,0.344mmol)于乙酸乙酯(15ml)中的溶液中添加5%Pd/C(80mg)。使氩气流在混合物上通过,接着用氢气替换氩气,并且剧烈搅拌混合物15分钟。混合物经厚硅藻土垫过滤以产生呈白色固体状的所需产物α-KG5-辛酯(0.088g,99%)。1H NMR(500MHz,CDCl3):8.16(br s,1H),4.06(t,J=6.5Hz,2H),3.18(t,J=6.5Hz,2H),2.69(t,J=6.0Hz,2H),1.59(m,2H),1.26(m,10H),0.85(t,J=7.0Hz,3H).。13C NMR(125MHz,CDC l3):193.8,172.7,160.5,65.5,33.0,31.7,29.08,29.06,28.4,27.8,25.8,22.5,14.0。
合成(S)2-羟基戊二酸1-辛酯((S)-2-HG辛酯)
(S)-2-氨基-5-(苯甲基氧基)-5-氧代戊酸:将L-谷氨酸(2.0g,13.6mmol)和无水硫酸钠(2.0g)溶解于苯甲醇(25ml)中,接着添加四氟硼酸乙醚复合物(3.7ml,27.2mmol)。将悬浮混合物在21℃下搅拌过夜。添加无水THF(75ml)至混合物中,并且将它经厚活性炭垫过滤。添加无水三乙胺(4.1ml)至澄清滤液中以获得乳白色浆液。在用乙酸乙酯(100ml)湿磨后,单酯单酸得以沉淀。将它收集,用额外乙酸乙酯(2x 10ml)洗涤,并且在真空中干燥以产生呈白色固体状的所需产物(S)-2-氨基-5-(苯甲基氧基)-5-氧代戊酸(3.07g,95%)。1H NMR(500MHz,乙酸-d4):δ7.41-7.25(m,5H),5.14(s,2H),4.12(m,1H),2.75-2.60(m,2H),2.27(m,2H)。13C NMR(125MHz,乙酸-d4):δ174.6,174.4,136.9,129.5,129.2,129.1,67.7,55.0,30.9,26.3。
(S)-2-羟基戊二酸5-苯甲酯1-辛酯:向(S)-2-氨基-5-(苯甲基氧基)-5-氧代戊酸(1.187g,5.0mmol)于H2O(25ml)和乙酸(10ml)中的冷却至0℃的溶液中缓慢添加亚硝酸钠水溶液(1.07g于15ml H2O中)。使反应混合物缓慢升温至室温并搅拌过夜。浓缩混合物。将所得残余物溶解于DMF(15ml)中,并且添加NaHCO3(1.26g,15mmol)和1-碘辛烷(1.84ml,10mmol)至混合物中。将混合物在21℃下搅拌过夜,接着用乙酸乙酯(3x 50ml)萃取。合并的有机相用水和盐水洗涤,并且经无水MgSO4干燥。用7/1己烷/乙酸乙酯洗脱的硅胶快速柱色谱法产生呈无色油状的所需混合二酯(S)-2-羟基戊二酸5-苯甲酯1-辛酯(0.785g,45%)。1H NMR(500MHz,CDCl3):δ7.37-7.28(m,5H),5.12(s,2H),4.26-4.19(m,1H),4.16(t,J=6.8Hz,2H),3.11(d,J=4.1Hz,1H),2.61-2.46(m,2H),2.26-2.14(m,1H),1.95(dtd,J=14.2,8.3,6.1Hz,1H),1.71-1.57(m,2H),1.39-1.20(m,10H),0.88(t,J=6.9Hz,3H)。13C NMR(125MHz,CDCl3):δ174.6,172.8,135.8,128.4,128.1,128.0,69.3,66.2,65.8,31.6,29.6,29.2,29.0(2C's),28.4,25.6,22.5,13.9。
(S)2-羟基戊二酸1-辛酯((S)-2-羟基戊二酸辛酯;(S)-2-HG辛酯):向(S)-2-羟基戊二酸5-苯甲酯1-辛酯(0.71g,2.0mmol)于MeOH(50ml)中的溶液中添加5%Pd/C(80mg)。使氩气条件在混合物上通过,接着用氢气替换氩气,并且剧烈搅拌混合物1小时。混合物经厚硅藻土垫过滤,并且蒸发有机相。通过用25/1CH2Cl2/MeOH洗脱的硅胶快速柱色谱法纯化残余物以产生呈白色固体状的(S)-2-HG辛酯(0.495g,48%)。1H NMR(500MHz,CDC l3):δ4.23(dd,J=8.0,4.2Hz,1H),4.16(t,J=6.8Hz,2H),2.60-2.42(m,2H),2.15(m,1H),1.92(dtd,J=14.2,8.2,6.1Hz,1H),1.69-1.59(m,2H),1.38-1.16(m,10H),0.86(t,J=7.0Hz,3H)。13C NMR(125MHz,CDC l3):δ178.8,174.8,69.3,66.1,31.7,29.4,29.1(2C's),28.9,28.4,25.7,22.5,14.0。
合成(R)2-羟基戊二酸1-辛酯((R)-2-HG辛酯)
通过严格相同程序,以D-谷氨酸起始来进行相对对映异构体(即(R)-2-HG辛酯)的合成。光谱数据与对映异构化合物的光谱数据相同。
秀丽隐杆线虫中的RNAi
通过对蠕虫喂以从pL4440载体表达靶标基因双链RNA(dsRNA)的HT115(DE3)细菌来实现秀丽隐杆线虫中的RNAi。参见Timmons和Fire,Nature 395,854(1998)。在含有1mM IPTG的板上过夜诱导dsRNA产生。除非另外陈述,否则所有RNAi喂食克隆都从秀丽隐杆线虫ORF-RNAi文库(Thermo Scientific/Open Biosystems)获得。秀丽隐杆线虫TOR(CeTOR)RNAi克隆(Long等.Curr Biol 12,1448-1461(2002))从Joseph Avruch(MGH/Harvard)获得。通过相应蛋白质的蛋白质印迹或通过mRNA的qRT-PCR来确认高效敲低。用于qRT-PCR的引物序列如下:
atp-2正向:TGACAACATTTTCCGTTTCACC(SEQ ID NO:1)
atp-2反向:AAATAGCCTGGACGGATGTGAT(SEQ ID NO:2)
let-363/CeTOR正向:GATCCGAGACAAGATGAACGTG(SEQ ID NO:3)
let-363/CeTOR反向:ACAATTTGGAACCCAACCAATC(SEQ ID NO:4)
ogdh-1正向:TGATTTGGACCGAGAATTCCTT(SEQ ID NO:5)
ogdh-1反向:GGATCAGACGTTTGAACAGCAC(SEQ ID NO:6)
通过定量RT-PCR验证ogdh-1与atp-2两者的RNAi敲低,并且也通过蛋白质印迹(Western blotting)验证atp-2敲低。在表达相应dsRNA的细菌上培养的幼体中,ogdh-1的转录物降低85%,并且atp-2的转录物和蛋白质水平分别降低52%和83%。此外,发现atp-2的RNAi与延迟的胚后期发育和幼体阻滞相关联,此与atp-2(ua2)动物的表型一致。通过qRT-PCR进行的分析指示在经受RNAi的幼体中,CeTOR的转录物适度但显著降低26%;此外,在这些动物中,自体吞噬的分子标志物被诱导,并且成体的寿命被延长,此与激酶的部分失活一致。
在寿命实验中,RNAi用于在存在或不存在外源性α-KG下失活成熟动物中的atp-2、ogdh-1和CeTOR。凭经验确定用于这些实验中的α-KG的浓度(8mM)最有益于野生型动物(图1,图版c)。这个方法使得能够评估必需蛋白质和路径对由补充性α-KG赋予的长寿的作用。具体来说,实质性而非完全失活已完成胚胎和幼体发育的成体动物中的atp-2是可能的。如本文所述,补充以8mMα-KG不进一步延长(并且实际上,有一次甚至降低)atp-2(RNAi)动物的寿命(图13),由此指示atp-2被涉及。在另一方面,完全失活atp-2将具有致死性,并且由此掩蔽由α-KG抑制ATP合成酶的益处。
寿命分析
使用标准方案在20℃下在固体线虫生长培养基(NGM)上进行寿命测定,并且在至少两个独立实验中重复。通过进行定时产卵(Sutphin和Kaeberlein,J Vis Exp(2009))或进行卵制备(在70μl M9缓冲液、25μl漂白剂(10%次氯酸钠溶液)和5μl 10N NaOH中溶解约100个妊娠蠕虫(Brenner Genetics 77,71-94(1974)))来使秀丽隐杆线虫同步。将幼小成体动物挑选于含有1.5%二甲亚砜(DMSO;Sigma,D8418)、49.5μΜ5-氟-2’-脱氧尿苷(Sutphin和Kaeberlein,J Vis Exp(2009))(FUDR;Sigma,F0503)、D-2-HG(Sigma,H8378)或L-2-HG(Sigma,90790)和α-KG(Sigma,K1128)或媒介物对照(H2O)的NGM测定板上。FUDR被包括来防止子代产生。通过添加NaOH来调整含有α-KG的培养基至pH 6.0(与对照板相同的pH)。在热压处理之后以及在培养基固化之前,将所有化合物混入NGM培养基中。用OP50(或指定RNAi喂食克隆,参见下文)接种测定板。每4天将蠕虫移动至新测定板(以确保一直存在足够食物以及降低霉菌污染的风险)。为评估蠕虫的存活,每2-3天用铂线刺戳动物,并且将未能响应的那些记为死亡。对于涉及突变品系的分析,相应亲本品系在相同实验中用作对照。
对于涉及RNAi的寿命实验,各板也含有1mM异丙基β-D-1-硫代半乳糖吡喃糖苷(IPTG;Acros,CAS 367-93-1)和50μg/ml氨苄青霉素(Fisher,BP1760-25)。通过对N2蠕虫喂以从pL4440表达靶标基因dsRNA的HT115(DE3)细菌来实现RNAi(Timmons和Fire,Nature 395,854(1998));对于每个实验,通过对N2蠕虫喂以表达GFP dsRNA或空载体(其给出相同寿命结果)的HT115(DE3)细菌来平行进行对照RNAi。
如对于α-KG所述用寡霉素(Cell Signaling Technology,9996)进行寿命实验(具有1.5%DMSO和49.5μΜFUDR的NGM板;N2蠕虫;OP50细菌)。
对于涉及smg-1(cc546ts);pha-4(zu225)和smg-1(cc546ts)的寿命实验(Timmons和Fire,Nature 395,854(1998);以及Gaudet和Mango,Science 295,821-825(2002)),使品系在24℃下从卵生长至L4期,这使smg-1温度敏感性等位基因失活,防止了含有提前终止密码子的pha-4(zu225)mRNA的mRNA监督介导的降解,并因此产生截短但功能齐全的PHA-4转录因子(Gaudet和Mango,Science 295,821-825(2002))。接着在L4期,使温度变换至20℃,此恢复smg-1功能,并且由此导致pha-4(zu225)mRNA降解。用α-KG处理开始于L4期。
寿命数据提供于图13中,包括样本大小。基于出版的手稿中在野外执行的标准来选择样本大小。无统计方法用于预先确定样本大小。将动物随机分配至实验组中。破裂、袋状化(例如展现内部子代孵化)或爬出板的蠕虫被删截。使用GraphPad Prism分析寿命数据;使用对数秩(曼特尔-考克斯(Mantel-Cox))检验计算P值。
食物偏好测定
如下进行从Abada等(Mol Cells 28,209-213(2009))改编的方案。用两个OP50斑点接种10cm NGM板,如图5,图版e中所示。在让OP50菌苔在室温下历经2天干燥之后,添加媒介物(H2O)或α-KG(8mM)至菌苔的上部,并且使其在室温下历经2天干燥。将约50-100个同步成体第1天蠕虫放置于板的中心上,并且在室温下3小时之后记录它们对任一细菌菌苔的偏好。
使用药物亲和力响应性靶标稳定性(DARTS)进行靶标鉴定
根据本领域中已知的方法使用DARTS进行靶标鉴定。参见例如Lomenick等PNAS USA 106,21984-21989(2009)。对于无偏靶标ID(图2,图版a),使用M-PER(Thermo Scientific,78501),在添加蛋白酶抑制剂(Roche,11836153001)和磷酸酶抑制剂(Lomenick等Curr Protoc Chem Biol 3,163-180(2011))下溶解人Jurkat细胞。添加TNC缓冲液(50mM Tris-HCl(pH8.0)、50mM NaCl、10mM CaCl2)至溶解产物中,并且接着使用BCA蛋白质测定试剂盒(Pierce,23227)测定蛋白质浓度。使细胞溶解产物与媒介物(H2O)或α-KG一起在冰上孵育1小时,随后在室温下再孵育20分钟。使用链霉蛋白酶(Pronase)(Roche,10165921001)在室温下进行30分钟消化,并且使用过量蛋白酶抑制剂以及立刻转移至冰中来终止。所得消化物通过SDS-PAGE分离,并且使用SYPRO Ruby蛋白凝胶染色剂(Invitrogen,S12000)观察。将来自α-KG泳道的染色增加的条带(对应于由于α-KG的结合而被保护免遭蛋白水解的潜在蛋白质靶标)和对照泳道的匹配区域切除,进行凝胶内胰蛋白酶消化,并且如所述(Lomenick等PNAS USA 106,21984-21989(2009);以及Lomenick等ACS Chem Biol 6,34-46(2011))经受LC-MS/MS分析。使用2.3.0版Mascot,以所有肽都满足显著性阈值0.05,相对于人Swissprot数据库(57.15发布版)搜索质谱测定法结果。
对于通过DARTS-蛋白质印迹进行的靶标验证(图2,图版b),在M-PER缓冲液(Thermo Scientific,78501)中,在添加蛋白酶抑制剂(Roche,11836153001)和磷酸酶抑制剂(50mM NaF、10mMβ-甘油磷酸酯、5mM焦磷酸钠、2mM Na3VO4)下溶解HeLa细胞。添加冷却TNC缓冲液(50mM Tris-HCl pH 8.0、50mM NaCl、10mM CaCl2)至蛋白质溶解产物中,并且通过BCA蛋白质测定试剂盒(Pierce,23227)测量溶解产物的蛋白质浓度。接着使蛋白质溶解产物与媒介物对照(H2O)或不同浓度的α-KG一起在室温下在600rpm下振荡下在Eppendorf热混合器中孵育3小时。在室温下进行20分钟链霉蛋白酶(Roche,10165921001)消化,并且通过添加SDS装载缓冲液以及立刻在70℃下加热10分钟来终止。使样品在4-12%Bis-Tris梯度凝胶(Invitrogen,NP0322BOX)上经受SDS-PAGE,并且针对ATP合成酶亚单位ATP5B(Sigma,AV48185)、ATP5O(Abcam,ab91400)和ATP5A(Abcam,ab110273)进行蛋白质印迹。通过DARTS确认α-KG与α-KG是其共同底物(Stubbs等J Med Chem 52,2799-2805(2009))的PHD-2/Egln1(D31E11)兔mAb(Cell Signaling Technology,4835)之间的结合。GAPDH(Ambion,AM4300)用作阴性对照。
对于使用秀丽隐杆线虫进行的DARTS(图6,图版a),使各种龄期的野生型动物在NGM/OP50板上生长,用M9缓冲液洗涤4次,并且立刻放置在-80℃冷冻器中。使用溶解基质C管(MP Biomedicals,6912-100)和FastPrep-24(MP Biomedicals)高速台式均质器在4℃室中在HEPES缓冲液(40mM HEPES pH 8.0、120mM NaCl、10%甘油、0.5%Triton X-100、10mMβ-甘油磷酸酯、50mM NaF、0.2mM Na3VO4、蛋白酶抑制剂(Roche,11836153001))中溶解动物(在6.5m/s下破坏蠕虫20秒,在冰上静息1分钟;重复两次)。在4℃下在14,000rpm下离心溶解的动物10分钟以集结蠕虫碎片,并且收集上清液供DARTS使用。通过BCA蛋白质测定试剂盒(Pierce,23223)来测定蛋白质浓度。1.13μg/μl的蠕虫溶解产物浓度用于DARTS实验。所有步骤都在冰上或在4℃下进行以帮助防止过早蛋白质降解。添加TNC缓冲液(50mM Tris-HCl pH 8.0、50mM NaCl、10mM CaCl2)至蠕虫溶解产物中。使蠕虫溶解产物与媒介物对照(H2O)或α-KG一起在冰上孵育1小时,接着在室温下孵育50分钟。
在室温下进行30分钟链霉蛋白酶(Roche,10165921001)消化,并且通过添加SDS装载缓冲液以及在70℃下加热10分钟来终止。接着使样品在NuPAGE Novex 4-12%Bis-Tris梯度凝胶(Invitrogen,NP0322BOX)上经受SDS-PAGE,并且用针对ATP5B,也识别ATP-2的抗体(Sigma,AV48185)进行蛋白质印迹。
对于2-HG实验,如上所述进行DARTS。简要来说,在M-PER缓冲液(Thermo Scientific,78501)中,在添加蛋白酶(Roche,11836153001)和磷酸酶(50mM NaF、2mM Na3VO4)抑制剂下溶解U87细胞。添加冷却TNC缓冲液(50mM Tris-HCl pH 8.0、50mM NaCl、10mM CaCl2)至溶解产物中,并且通过BCA蛋白质测定试剂盒(Pierce,23227)对等分试样测量溶液的蛋白质浓度。接着使剩余溶解产物与媒介物对照(H2O)或不同浓度的2-HG或α-KG一起在室温下孵育0.5小时。接着使样品经受链霉蛋白酶消化(Roche,10165921001,在室温下5分钟),所述消化通过添加SDS装载缓冲液以及立刻加热(95℃,5分钟)来终止。使样品在4-12%Bis-Tris梯度凝胶(Invitrogen,NP0322BOX)上经受SDS-PAGE,并且用针对ATP5B(Sigma,AV48185)或GAPDH(Santa Cruz,SC25778)的抗体进行蛋白质印迹。
复合物V活性测定
使用MitoTox OXPHOS复合物V活性试剂盒(Abcam,ab109907)测定复合物V活性。在添加磷脂之前使媒介物(H2O)或α-KG与酶混合。在使用α-KG辛酯的实验中,媒介物(1%DMSO)或α-KG辛酯与磷脂一起添加。将相对复合物V活性与媒介物进行比较。寡霉素(Sigma,O4876)作为阳性对照用于测定。
从小鼠肝分离线粒体
根据核准的UCLA动物研究方案进行动物研究。如所述(Rogers等PLoS One 6,e21746(2011))从3个月龄的C57BL/6小鼠分离线粒体。简要来说,将肝提取,在4℃下于MSHE+BSA(70mM蔗糖、210mM甘露糖醇、5mM HEPES、1mM EGTA和0.5%无脂肪酸BSA,pH 7.2)中切碎,并且冲洗数次以移除血液。所有随后步骤都在冰上或在4℃下进行。用玻璃Dounce均质器于10体积的MSHE+BSA中破坏组织(5-6次冲击),并且在800x g下离心匀浆10分钟以移除组织碎片和核。将上清液倾析通过细胞滤网,并且在8,000x g下离心10分钟。将深色线粒体集结块再悬浮于MSHE+BSA中,并且在8,000x g下再离心10分钟。最终线粒体集结块用于如下所述的各种测定。
亚线粒体粒子(SMP)ATP酶测定
使用亚线粒体粒子测量由ATP合成酶达成的ATP水解(参见Alberts,B.Molecular Biology of the Cell.第3版,(Garland Pub.,1994)以及其中参考文献)。如上所述从小鼠肝分离线粒体。将最终线粒体集结块在10μg/μl下再悬浮于缓冲液A(250mM蔗糖、10mM Tris-HCl、1mM ATP、5mM MgCl2和0.1mM EGTA,pH 7.4)中,在冰上经受超声处理(Fisher Scientific 550型声波分离粉碎机;中等功率,在10秒间隔的超声处理与在冰上静息之间交替,持续总计60秒超声处理),接着在4℃下在18,000x g下离心10分钟。收集上清液,并且在4℃下在100,000x g下离心45分钟。将最终集结块(亚线粒体粒子)再悬浮于缓冲液B(250mM蔗糖、10mM Tris-HCl和0.02mM EGTA,pH 7.4)中。
使用复合物V活性缓冲液如上测定SMP ATP酶活性。ADP的产生通过丙酮酸激酶和乳酸脱氢酶偶联于NADH氧化成NAD+。当添加外部ADP时,添加α-KG(多达10mM)不影响丙酮酸激酶或乳酸脱氢酶的活性。在340nm下NADH的吸光度降低与ATP酶活性相关。在添加活性缓冲液之前,使SMP(2.18ng/μl)与媒介物或α-KG一起在室温下孵育90分钟,接着持续1小时每1分钟测量在340nm下NADH的吸光度降低。寡霉素(Cell Signaling Technology,9996)作为阳性对照用于测定。
针对ATP水平的测定
将正常人二倍体纤维母细胞WI-38(ATCC,CCL-75)细胞在每孔2x 104个细胞下接种于96孔板中。用DMSO(媒介物对照)或α-KG辛酯在不同浓度下一式三份处理细胞2小时。使用CellTiter-Glo发光ATP测定(Promega,G7572)测量ATP水平;使用Analyst HT(Molecular Devices)读取发光。平行地,在M-PER(Thermo Scientific,78501)中溶解同等处理的细胞以通过BCA蛋白质测定试剂盒(Pierce,23223)获得蛋白质浓度。相对于蛋白质含量使ATP水平标准化。使用GraphPad Prism进行统计分析(未配对t检验)。
针对秀丽隐杆线虫中ATP水平的测定。将同步第1天成体野生型秀丽隐杆线虫放置在含有媒介物或8mMα-KG的NGM板上。在成体期的第2和8天,从α-KG或媒介物对照板分别收集9个重复样品和4个重复样品,各重复样品具有约100个蠕虫,在M9缓冲液中洗涤4次,并且冷冻在-80℃中。使用溶解基质C管(MP Biomedicals,6912-100)和FastPrep-24(MP Biomedicals)高速台式均质器溶解动物(在6.5m/s下破坏蠕虫20秒,在冰上静息1分钟;重复两次)。在4℃下在14,000rpm下离心溶解的动物10分钟以集结蠕虫碎片,并且保存上清液以根据制造商说明书,使用Kinase-Glo发光激酶测定平台(Promega,V6713)进行ATP定量。在白色不透明96孔组织培养板(Falcon,353296)中进行测定,并且使用Analyst HT(Molecular Devices)测量发光。相对于蠕虫的数目使ATP水平标准化。使用Microsoft Excel进行统计分析(t检验,双尾,双样本不等方差)。
对于2-HG实验,将U87细胞在每孔2x 104个细胞下接种于96孔板中,并且用指示的化合物一式三份处理2小时。使用CellTiter-Glo发光ATP测定(Promega,G7572)测量ATP水平;使用Analyst HT(Molecular Devices)读取发光。为确认在各处理之间的细胞数目是一致的,使用QuantiFluor dsDNA系统(Promega)使细胞溶解产物进一步经受dsDNA染色。使用GraphPad Prism进行统计分析(未配对t检验)。
测量氧消耗速率(OCR)和细胞外酸化速率(ECAR)
使用Seahorse XF-24分析器(Seahorse Bioscience)进行OCR测量(Wu等Am J Physiol Cell Physiol 292,C125-136(2007))。将细胞于补充以10%FBS和10mM葡萄糖的DMEM培养基中在50,000个细胞/孔下接种在Seahorse XF-24细胞培养微板中,并且在37℃和5%CO2下孵育过夜。用α-KG辛酯或DMSO(媒介物对照)进行的处理持续1小时。就在测量之前于未缓冲的DMEM培养基(pH 7.4,10mM葡萄糖)中洗涤细胞,并且维持在具有指示浓度的α-KG辛酯的这个缓冲液中。在基础条件下测量氧消耗速率3次,并且相对于每孔蛋白质浓度加以标准化。使用GraphPad Prism进行统计分析。
使用从Yamamoto等(Cell 147,827-839(2011))和Pathare等(PLoS Genet8,e1002645(2012))改编的方案对活秀丽隐杆线虫中氧消耗速率(OCR)进行测量。将野生型第1天成体N2蠕虫放置在含有8mMα-KG或H2O(媒介物对照),用OP50或HT115大肠杆菌(E.coli)接种的NGM板上。在成体期的第2天评估OCR。在成体期的第2天,收集蠕虫,并且用M9洗涤4次以除去细菌样品(我们进一步验证α-KG不影响细菌的氧消耗-因此,即使在洗涤之后存在任何残留细菌,观察到的OCR变化也将仍然是蠕虫特异性的),接着将动物于200μl M9中在每孔约200个蠕虫下一式四份接种于Seahorse XF-24细胞培养微板(Seahorse Bioscience,V7-PS)中。在基础条件下测量氧消耗速率7次,并且相对于每孔计数的蠕虫数目加以标准化。将实验重复两次。使用Microsoft Excel进行统计分析(t检验,双尾,双样本不等方差)。
对于2-HG实验,使用Seahorse XF-24分析器(Seahorse Bioscience)进行OCR和ECAR测量(Wu等Am J Physiol Cell Physiol 292,C125-136(2007))。将U87细胞于补充以10%FBS和10mM葡萄糖或10mM半乳糖的DMEM中在每孔50,000个细胞下接种于Seahorse XF-24细胞培养微板中,并且在37℃下在5%CO2中孵育O/N。用α-KG辛酯、(R)-2-HG辛酯、(S)-2-HG辛酯或DMSO(媒介物对照)进行的处理持续1小时。在测量之前即刻于未缓冲的DMEM(pH 7.4,10mM葡萄糖)中洗涤细胞,并且维持在具有指示浓度的化合物的这个缓冲液中。在基础条件下测量OCR或ECAR 3次,并且相对于每孔蛋白质浓度加以标准化。使用GraphPad Prism进行统计分析(未配对t检验,双尾,双样本不等方差)。
测量线粒体呼吸控制比率(RCR)
使用分离的小鼠肝线粒体分析线粒体RCR(参见Brand等Biochem J435,297-312(2011)以及其中参考文献)。如上所述从小鼠肝分离线粒体。将最终线粒体集结块再悬浮于30μl MAS缓冲液(70mM蔗糖、220mM甘露糖醇、10mM KH2PO4、5mM MgCl2、2mM HEPES、1mM EGTA和0.2%无脂肪酸BSA,pH 7.2)中。
通过如所述(Rogers等PLoS One 6,e21746(2011))操作偶联和电子流动测定来测量分离的线粒体呼吸。对于偶联测定,通过在4℃下在2,000x g下离心20分钟来将20μg线粒体于完全MAS缓冲液(MAS缓冲液补充以10mM丁二酸盐和2μΜ鱼藤酮)中接种至XF24Seahorse板中。就在测定之前,将线粒体补充以完全MAS缓冲液以达到总计500μl(具有1%DMSO、辛醇、α-KG辛酯或2-HG辛酯),并且在37℃下温热30分钟,随后开始氧消耗速率测量。线粒体呼吸开始于偶联状态2;状态3由2mM ADP引发;状态4o(寡霉素不敏感性,即复合物V非依赖性)由2.5μΜ寡霉素诱导,并且状态3u(FCCP解偶联的最大呼吸量)由4μΜFCCP诱导。最后,在测定结束时注射1.5μg/ml抗霉素A(antimycin A)。状态3/状态4o比率给出呼吸控制比率(RCR)。
对于电子流动测定,将MAS缓冲液补充以10mM丙酮酸钠(复合物I底物)、2mM苹果酸盐(复合物II抑制剂)和4μΜFCCP,并且以与对于偶联测定所述相同的方式接种线粒体。在基础读取之后,依序注射如下:2μΜ鱼藤酮(复合物I抑制剂)、10mM丁二酸盐(复合物II底物)、4μΜ抗霉素A(复合物III抑制剂)和10mM/100μΜ抗坏血酸盐/四甲基苯二胺(复合物IV底物)。
ATP合成酶抑制动力学
使用分离的线粒体进行ATP合成酶抑制动力学分析。如上所述从小鼠肝分离线粒体。将最终线粒体集结块再悬浮于补充以5mM抗坏血酸钠(Sigma,A7631)和5mM TMPD(Sigma,T7394)的MAS缓冲液中。
在含有5mM抗坏血酸钠、5mM TMPD、荧光素酶试剂(Roche,11699695001)、辛醇或α-KG辛酯、可变量的ADP(Sigma,A2754)和3.75ng/μl线粒体的MAS缓冲液中进行反应。通过光度计(Analyst HT,Molecular Devices)根据发光随时间增加来监测ATP合成。由寡霉素不敏感性发光获得的ATP合成酶非依赖性ATP形成作为背景被扣除。由在速度开始降低之前的前3分钟反应的斜率计算初始ATP合成速度。通过使用GraphPad Prism进行非线性回归最小二乘拟合来分析酶抑制动力学。
针对哺乳动物TOR(mTOR)路径活性的测定
通过包括S6K(T389)、4E-BP1(S65)、AKT(S473)和ULK1(S757)的已知mTOR底物的磷酸化水平来确定用α-KG辛酯、2-HG或寡霉素处理的细胞中的mTOR路径活性(Pullen和Thomas,FEBS Lett 410,78-82(1997);Burnett等PNAS USA 95,1432-1437(1998);Gingras等Genes Dev 15,2852-2864(2001);Sarbassov等Science 307,1098-1101(2005);以及Kim等Nat Cell Biol 13,132-141(2011))。使用的特异性抗体:P-S6K T389(Cell Signaling Technology,9234)、S6K(Cell Signaling Technology,9202S)、P-4E-BP1S65(Cell Signaling Technology,9451S)、4E-BP1(Cell Signaling Technology,9452S),P-AKT S473(Cell Signaling Technology,4060S),AKT(Cell Signaling Technology,4691S),P-ULK1S757(Cell Signaling Technology,6888),ULK1(Cell Signaling Technology,4773S)和GAPDH(Santa Cruz Biotechnology,25778)。
针对自体吞噬的测定
携带整合GFP::LGG-1翻译融合基因的DA2123动物(Kang等Genes Dev 21,2161-2171(2007);Hansen等PLoS Genet 4,e24(2008);以及Alberti等Autophagy 6,622-633(2010))用于定量自体吞噬的水平。为获得DA2123的同步群体,制备妊娠成体的卵制备物(通过于70μl M9缓冲液、25μl漂白剂和5μl 10N NaOH中溶解约100个妊娠蠕虫),并且使卵在M9中孵化过夜,从而导致饥饿诱导的L1滞育。将L1幼体放置于含有媒介物、8mMα-KG或40μΜ寡霉素,并且用大肠杆菌OP50、具有空载体的HT115(DE3)、或表达如所指示的靶向atp-2、CeTOR/let-363或ogdh-1的dsRNA的HT115(DE3)接种的NGM处理板上。当给定样品中大多数动物首先到达中间L3期时,将个别L3幼体封固于显微镜载片上,并且用1.6mM左旋咪唑(Sigma,31742)加以麻醉。使用具有LSM5Pascal激光器的Axiovert 200M Zeiss共焦显微镜观察线虫,并且使用LSM Image Examiner(Zeiss)捕集图像。对于各试样,使用ImageJ中的分析粒子(analyze particles)在三个140.97μm2的单独区域中计数包括侧向缝线细胞和Hyp7的表皮中的GFP::LGG-1斑点(自噬体)(Schneider等Nat Methods 9,671-675(2012))。使测量就基因型与补充物两者来说是盲性的。使用Microsoft Excel进行统计分析(t检验,双尾,双样本不等方差)。
针对哺乳动物细胞中的自体吞噬的测定。将HEK-293细胞于补充以10%FBS和10mM葡萄糖的DMEM培养基中在2.5x 105个细胞/孔下接种于6孔板中,并且孵育过夜,随后用辛醇(媒介物对照)或α-KG辛酯处理72小时。在具有蛋白酶和磷酸酶抑制剂的M-PER缓冲液中溶解细胞。使溶解产物在4-12%Bis-Tris梯度凝胶上在MES操作缓冲液下经受SDS-PAGE,并且针对LC3(Novus,NB100-2220)进行蛋白质印迹。LC3是蠕虫LGG-1的哺乳动物同源物,并且例如在饥饿后,在自体吞噬中使可溶性LC3-I向脂质化LC3-II的转化活化(Kabeya等EMBO J 19,5720-5728(2000))。
用8mMα-KG处理的秀丽隐杆线虫的咽泵送速率
评估每种条件20个野生型N2蠕虫的咽泵送速率。使用Zeiss M2BioDiscovery显微镜和附接的Sony NDR-XR500V摄像机在12倍光学变焦下持续1分钟记录咽收缩。使用MPlayerX在0.3x速度下重放所得视频,并且计数咽泵送数。使用Microsoft Excel进行统计分析(t检验,双尾,双样本不等方差)。
针对秀丽隐杆线虫中α-KG水平的测定
从具有媒介物(H2O)或8mMα-KG的板收集同步成体蠕虫,用M9缓冲液洗涤3次,并且快速冷冻。使用溶解基质C管(MP Biomedicals,6912-100)和FastPrep-24(MP Biomedicals)高速台式均质器在4℃室中在M9中溶解蠕虫(在6.5m/s下破坏蠕虫20秒,在冰上静息1分钟;重复三次)。在4℃下在14,000rpm下离心溶解的动物10分钟以集结蠕虫碎片,并且保存上清液。通过BCA蛋白质测定试剂盒(Pierce,23223)测定上清液的蛋白质浓度;在α-KG处理和媒介物处理的动物中,每个蠕虫的蛋白质水平不存在差异(数据未显示)。如先前所述(MacKenzie等Mol Cell Biol 27,3282-3289(2007))在进行修改下评估α-KG含量。在37℃下在100mM KH2PO4(pH 7.2)、10mM NH4Cl、5mM MgCl2和0.3mM NADH中孵育蠕虫溶解产物10分钟。接着添加谷氨酸脱氢酶(Sigma,G2501)以达到最终浓度1.83单位/ml。在这些条件下,谷氨酸脱氢酶使用α-KG和NADH来制备谷氨酸。在340nm下监测到吸光度降低。由NADH吸光度降低来测定细胞内α-KG水平。使用平均蛋白质含量(约245ng/蠕虫,根据BCA测定)和体积(对于长度是1.1mm,并且直径是60μm的成体蠕虫,约3nL)(WorldWideWeb.wormatlasDOTORG/hermaphrodite/introduction/Introfram eset.Hyper TextMarkupLanguage,其中“WorldwideWeb”是“www”,“DOTORG”是“.org”,并且“HyperTextMarkupLanguage”是“html”)估计动物内部存在的α-KG的近似体积摩尔浓度。
对于使用UHPLC-ESI/MS/MS定量分析蠕虫中的α-KG,将同步第1天成体蠕虫放置在具有或不具有细菌的媒介物板上24小时,接着收集,并且以与以上相同的方式溶解。在Agilent 1290Infinity UHPLC系统和使用电喷雾离子化(ESI)源以及Agilent射流技术的6460三重四极质谱仪(Agilent Technologies)上进行LC/MS/MSα-KG分析。用B.06.00版Agilent MassHunter数据获取软件获取数据,并且处理以进行前体和产物离子选择(用B.06.00版MassHunter定性分析软件),以及进行校正和定量(用B.06.00版针对QQQ的MassHunter定量分析软件)。
对于UHPLC,将3μl校正标准物和样品注射于UHPLC系统上,所述系统包括具有嵌入式真空脱气器的G4220A二元泵和恒温G4226A高性能自动取样器。使用50/50/0.04乙腈/水/具有10mM乙酸铵的氢氧化铵作为流动相A,以及95/5/0.04乙腈/水/具有10mM乙酸铵的氢氧化铵作为流动相B,在0.6ml/min的流速下使用来自Waters Corporation的ACQUITY UPLC BEH酰胺分析柱(2.1x 50mm,1.7μm)和VanGuard BEH酰胺预柱(2.1x5mm,1.7μm)。将柱维持在室温下。应用以下梯度:0-0.41分钟:100%B等度;0.41-5.30分钟:100-30%B;5.3-5.35分钟:30-0%B;5.35-7.35分钟:0%B等度;7.35-7.55分钟:0-100%B;7.55-9.55分钟:100%B等度。
对于MS检测,通过MRM以负离子化模式记录ESI质谱数据。使用1-分钟37%B等度UHPLC方法,通过柱在0.6ml/min的流速下测定α-KG和它的ISTD 13C4-α-KG(Cambridge Isotope Laboratories)的MRM跃迁。观察到前体离子[M-H]-和产物离子[M-CO2-H]-具有最高信噪比。前体离子和产物离子对于AKG分别是145.0和100.9,并且对于ISTD 13C4-α-KG分别是149.0和104.9。氮气用作干燥、套管和碰撞气体。所有源和分析器参数都分别使用Agilent MassHunter Source and iFunnel Optimizer和Optimizer软件优化。源参数如下:干燥气体温度120℃,干燥气体流速13L/min,雾化器压力55psi,套管气体温度400℃,套管气体流速12L/min,毛细管电压2000V,以及喷嘴电压0V。分析器参数如下:碎裂器电压55V,碰撞能量2V,以及池加速器电压1V。使在1分钟之前以及在5.3分钟之后的UHPLC洗脱液转向废物。
α-KG的膜可渗透性酯
α-KG辛酯,即α-KG的一种膜可渗透性酯(MacKenzie等Mol Cell Biol27,3282-3289(2007);Zhao等Science 324,261-265(2009);Xu等Cancer Cell 19,17-30(2011);以及Jin等Cancer Res 73,496-501(2013))在使用细胞和线粒体的实验中用于跨越脂质膜递送α-KG。在由细胞酯酶水解后,α-KG辛酯产生α-KG和副产物辛醇。发现尽管辛醇对照不具有作用(图6,图版e-f以及图10,图版a),但单独α-KG可结合并抑制ATP合成酶(图2,图版a-b,图6,图版a-b,并且数据未显示),降低ATP和OCR(图2,图版e,以及图2,图版g),诱导自体吞噬(图4,图版b),并且增加秀丽隐杆线虫寿命(图1、图3、图5、图9和图13)。使用在水解后发荧光的酯酶底物钙黄绿素(calcein)AM(C1430,Molecular Probes),并且也通过质谱测定法来确认酯酶在线粒体和细胞培养实验中的存在性和活性(数据未显示)。由酯酶达成的水解解释为何α-KG的不同酯(诸如α-KG 1-辛酯、α-KG 5-辛酯和α-KG二甲酯)对α-KG具有类似作用(图6,图版g-h,以及图13)。
细胞生长和活力测定
将细胞接种于12孔板中,并且在过夜孵育之后,用指示浓度的各化合物处理。在收集之后,用吖啶橙(Acridine Orange,AO)和DAPI染色细胞。基于遵循制造商说明书,通过NC3000(Chemometec)测量的AO和DAPI荧光来衡量细胞数目和活力。
代谢概况分析
培养细胞24小时,用PBS冲洗,并且添加含有[1,2-13C]葡萄糖(1g/L)的培养基。在培养24小时之后,用冰冷150mM NH4AcO(pH 7.3)冲洗细胞,随后添加400ml冷甲醇和400ml冷水。将细胞刮除,转移至Eppendorf管中,并且添加10nmol正缬氨酸以及400ml氯仿至各样品中。对于代谢物提取,将样品在冰上涡旋5分钟,短暂离心,并且将水层转移至玻璃小瓶中并干燥。将代谢物再悬浮于70%ACN中,并且将5ml样品装载于Phenomenex Luna 3u NH2 100A(150x 2.0mm)柱上。在UltiMate300RSLC(Thermo Scientific)上在流动相A(5mM NH4AcO,pH 9.9)和B(ACN)以及300毫升/分钟的流速下进行色谱分离。操作的梯度是历经18分钟从15%A至95%A,在95%A下9分钟等度,以及再平衡7分钟。用以极性转换模式(+3.0kV/-2.25kV)操作的Thermo Scientific Q Exactive质谱仪实现代谢物检测。TraceFinder 3.1(Thermo Scientific)用于使用保留时间和准确质量测量结果(<3ppm)将代谢物定量为曲线下面积。通过加和给定代谢物的所有同位素异位体来计算代谢物的相对量。
针对ADP输入的测定
将新鲜制备的小鼠肝线粒体在1μg/μl下悬浮于由220mM甘露糖醇、70mM蔗糖、2mM HEPES、2.74μΜ抗霉素A、5μΜ鱼藤酮、1mM EGTA和10mM磷酸钾缓冲液,pH 7.4组成的培养基中。使线粒体悬浮液与指定药物一起在37℃中孵育30分钟。在孵育之后,将悬浮液转移至冰中以孵育10分钟。之后,添加100μΜ[3H]ADP(比放射性185kBq/pmol),并且立刻涡旋混合物并在冰上孵育20秒。通过添加10μΜ羧基苍术苷终止反应,并且在4℃下在10,000g下离心混合物10分钟。在离心之后,收集上清液以进行读取,并且用补充以10μΜ羧基苍术苷的相同培养基洗涤集结块两次。在洗涤之后,通过添加0.2ml 1%SDS来溶解集结块。通过TRI-CARB 2300TR液体闪烁分析器测定溶解产物和上清液的放射性。通过集结块相对于集结块和上清液的总和读数的比率来确定ADP-ATP转移率。
统计分析
所有实验都重复至少两次,获得相同或类似结果。数据代表生物重复实验。适当统计检验用于每个图。数据满足对于各图所述的统计检验的假设。除非另外陈述,否则将平均值±s.d.绘制于所有图中。
结果
如图1中所示,α-KG使秀丽隐杆线虫的成体寿命延长。图版a显示在代谢物长寿筛选中,α-KG使成体蠕虫的寿命延长。8mM用于所有代谢物。图版b显示α-KG的结构。图版c显示α-KG在长寿方面的剂量响应。图版d-e显示α-KG使喂以氨苄青霉素阻滞的(图版d)或γ辐照杀灭的(图版e)细菌的蠕虫的寿命延长(P<0.0001)。图版f显示α-KG不进一步延长ogdh-1(RNAi)蠕虫的寿命(P=0.65)。
如图2中所示,α-KG结合并抑制ATP合成酶。图版a是在使用DARTS下将ATP5B鉴定为α-KG结合蛋白的Sypro Ruby染色凝胶。箭头=受保护条带。图版b是在使用DARTS和蛋白质印迹下确认α-KG特异性结合ATP5B的凝胶。图版c是显示ATP合成酶受α-KG(从α-KG辛酯释放)抑制的图。这个抑制是可逆的(未显示)。图版d-g显示(图版d)α-KG辛酯处理的正常人纤维母细胞(**P=0.0016,****P<0.0001)和(图版e)α-KG处理的蠕虫(第2天,P=0.969;第8天,*P=0.012)中的ATP水平降低。氧消耗速率降低显示于图版f(对于α-KG辛酯处理的细胞)(***P=0.0004,****P<0.0001)和图版g(对于α-KG处理的蠕虫)(P<0.0001)中。RLU,相对发光单位。图版h显示从α-KG辛酯(800μΜ)释放的α-KG使从小鼠肝分离的线粒体中状态3而非状态4o或3u(P=0.997)呼吸降低。相对于媒介物(5.2±1.0),在α-KG辛酯(3.1±0.6)的情况下,呼吸控制比率降低(*P=0.015)。图版i是由α-KG(通过原位水解α-KG辛酯产生)对ATP合成酶达成的稳态抑制动力学的Eadie-Hofstee图。[S]是底物(ADP)浓度,并且V是在200μΜ辛醇(媒介物对照)或α-KG辛酯存在下的初始ATP合成速度。根据非线性回归最小二乘拟合,α-KG(由α-KG辛酯产生)使表观Vmax(53.9至26.7)和Km(25.9至15.4)降低。图版c-i独立实验数目:2。绘制平均值±s.d.。利用双尾、双样本不等方差t检验。对于图版e,各组中的第一棒条是媒介物。
如图3中所示,α-KG长寿是通过ATP合成酶和DR/TOR轴介导。显示α-KG对以下蠕虫的寿命的影响:atp-2(RNAi)(图版a)、daf-2(e1370)(图版b)、eat-2(ad1116)(图版c)、CeTOR(RNAi)(图版d)、daf-16(mu86)(图版e)、pha-4(zu225)(图版f)或hif-1(ia4)(图版g)蠕虫。独立实验数目:RNAi对照(6)、atp-2(2)、CeTOR(3)、N2(5)、daf-2(2)、eat-2(2)、pha-4(2)、daf-16(2)、hif-1(5)。
如图4中所示,由α-KG抑制ATP合成酶导致TOR路径活性保守降低。图版a显示在用α-KG辛酯或寡霉素处理的U87细胞中,mTOR底物磷酸化降低。在HEK-293、正常人纤维母细胞和MEF中获得类似结果(未显示)。图版b显示在用α-KG或针对atp-2或CeTOR的RNAi处理的动物中,自体吞噬增加。图版c显示使用ImageJ定量的GFP::LGG-1斑点。2-3个独立实验。棒条指示平均值。****P<0.0001;NS,不显著。图版d显示在饥饿蠕虫中,α-KG水平增加(**P<0.01)。绘制平均值±s.d.。在图版c-d中,利用双尾、双样本不等方差t检验。图版e是α-KG介导的长寿的图解模型。因为饥饿秀丽隐杆线虫中的α-KG水平升高(图版d),所以α-KG可通过与饥饿/DR路径类似的机理来介导寿命延长(图版e)。
如图5中所示,补充α-KG使秀丽隐杆线虫成体寿命延长,但不改变细菌的生长速率或蠕虫的食物摄取、咽泵送速率或产卵量。图版a显示由α-KG在成体秀丽隐杆线虫中达成的稳健寿命延长。在三个独立实验中,8mMα-KG使N2的平均寿命增加平均47.3%(根据对数秩检验,对于每个实验,P<0.0001)。1号实验,mveh=18.9(n=87),mα-KG=25.8(n=96);2号实验,mveh=17.5(n=119),mα-KG=25.4(n=97);3号实验,mveh=16.3(n=100),mα-KG=26.1(n=104)。m,平均寿命(成体期的天数);n,测试动物的数目。图版b显示补充以8mMα-KG的蠕虫和RNAi敲低α-KGDH(由ogdh-1编码)的蠕虫具有增加的α-KG水平。将幼小成体蠕虫放置在用对照HT115大肠杆菌或表达ogdh-1dsRNA的HT115接种的处理板上,并且在24小时之后测定α-KG含量。图版c显示在卵期开始以及在成体期开始的α-KG处理产生相同寿命增加。媒介物,媒介物,用媒介物对照在整个幼体期和成体期期间处理(m=15.6,n=95);媒介物,α-KG,用媒介物在幼体期期间以及用8mMα-KG在成体期处理(m=26.3,n=102),P<0.0001(对数秩检验);α-KG,α-KG,用8mMα-KG在整个幼体期和成体期期间处理(m=26.3,n=102),P<0.0001(对数秩检验),m,平均寿命(成体期的天数);n,测试动物的数目。图版d显示α-KG不改变作为线虫的标准实验室食物来源的OP50大肠杆菌的生长速率。添加α-KG(8mM)或媒介物(H2O)至标准LB培养基中,并且通过添加NaOH来调整pH至6.6。在1:40稀释度下添加来自相同过夜OP50培养物的细菌细胞至LB±α-KG混合物中,接着放置在处于300rpm下的37℃孵育振荡器中。在1小时时间间隔下读取595nm下的吸光度以产生生长曲线。图版e是食物偏好测定的图示。图版f是显示N2蠕虫在用媒介物或α-KG处理的OP50大肠杆菌食物之间不显示偏好(P=0.85,根据双尾、双样本不等方差t检验),在同等处理的OP50大肠杆菌之间也不显示偏好的图。图版g显示在8mMα-KG的情况下,秀丽隐杆线虫的咽泵送速率不显著改变(根据双尾、双样本不等方差t检验)。图版h显示用8mMα-KG处理的秀丽隐杆线虫的产卵量。在20℃下进行产卵量分析。将10个L4野生型蠕虫各自单独放置于含有媒介物或8mMα-KG的NGM板上。每天将蠕虫以每板一个转移于新板上,并且使产下的卵在先前板上孵化和发育。当使用真空来将孵化体从板移除时,对它们计数。相较于媒介物板上的动物,在8mMα-KG的情况下的动物在产卵量方面不显示显著差异(P=0.223,根据双尾、双样本不等方差t检验)。在所有情况下都绘制平均值±s.d.。
如图6中所示,α-KG结合ATP合成酶的β亚单位,并且抑制复合物V而非其它ETC复合物的活性。图版a是显示在DARTS测定中在α-KG结合后ATP-2蛋白被保护免遭链霉蛋白酶消化的蛋白质印迹。针对人ATP5B的抗体(Sigma,AV48185)识别与秀丽隐杆线虫ATP-2具有90%同一性的表位144IMNVIGEPIDERGPIKTKQFAPIHAEAPEFMEMSVEQEILVTGIKVVDLL193(SEQ ID NO:7)。靠近20kDa的较低分子量条带是全长蛋白质的对应于由α-KG直接结合的结构域的蛋白水解片段。图版b显示α-KG不影响复合物IV活性。使用MitoTox OXPHOS复合物IV活性试剂盒(Abcam,ab109906)测定复合物IV活性。将相对复合物IV活性与媒介物(H2O)对照进行比较。氰化钾(Sigma,60178)作为阳性对照用于测定。使用MitoTox复合物VOXPHOS活性微板测定(Abcam,ab109907)来测定复合物V活性。图版c显示atp-2(RNAi)蠕虫相较于对照(gfp于RNAi载体中)具有较低氧消耗,对于整个时间序列,P<0.0001(t检验,双尾,双样本不等方差)(2个独立实验);与图2,图版g中所示的α-KG处理的蠕虫类似。图版d显示α-KG不影响通过电子传递链的电子流动。OCR来自在基础条件下(在FCCP存在下,丙酮酸盐和苹果酸盐分别作为复合物I底物和复合物II抑制剂)以及响应于依序注射鱼藤酮(Rote;复合物I抑制剂)、丁二酸盐(Succ;复合物II底物)、抗霉素A(AA;复合物III抑制剂)、抗坏血酸盐/四甲基苯二胺(Asc/TMPD;细胞色素c(复合物IV)底物)的分离的小鼠肝线粒体。在用800μΜα-KG辛酯处理30分钟之后,未观察到复合物I(C I)、复合物II(C II)或复合物IV(CIV)呼吸差异,而复合物V受相同处理抑制(参见图2,图版h)(2个独立实验)。图版e-f显示在辛醇或DMSO媒介物对照的情况下未观察到偶联(图版e)或电子流动(图版f)的显著差异。图版g-h显示用α-KG 1-辛酯或α-KG 5-辛酯处理在偶联(图版g)或电子流动(图版h)测定中产生相同结果。在所有情况下都绘制平均值±s.d.。
如图7中所示,用寡霉素处理使秀丽隐杆线虫寿命延长,并且以依赖于let-363的方式增强自体吞噬。图版a显示寡霉素以浓度依赖性方式使成体秀丽隐杆线虫的寿命延长。用寡霉素处理开始于幼小成体期。40μΜ寡霉素使N2蠕虫的平均寿命增加32.3%(P<0.0001,根据对数秩检验);对于细节,参见图13。图版b显示在媒介物、寡霉素(40μΜ)或α-KG(8mM)的情况下秀丽隐杆线虫的L3表皮的GFP::LGG-1斑点的共焦图像,以及使用ImageJ定量的含有GFP::LGG-1的斑点的数目。棒条指示平均值。用寡霉素或α-KG处理的秀丽隐杆线虫中的自体吞噬显著高于媒介物处理的对照动物中(t检验,双尾,双样本不等方差)。图版c显示在用寡霉素处理的对照蠕虫与用媒介物处理的CeTOR(RNAi)蠕虫之间不存在显著差异(n.s.),在媒介物处理的CeTOR(RNAi)蠕虫与α-KG处理的CeTOR(RNAi)蠕虫之间也不存在显著差异,这与图4,图版b-c中的独立实验一致;此外,寡霉素不加强CeTOR(RNAi)蠕虫中的自体吞噬(如果有的话,那么可存在小幅降低*);根据双尾、双样本不等方差t检验。棒条指示平均值。
图8显示对用a-KG或atp-2RNAi处理的蠕虫中的氧化应激的分析。图版a显示atp-2(RNAi)蠕虫比gfp对照蠕虫具有更高DCF荧光水平(P<0.0001,根据双尾、双样本不等方差t检验)。补充α-KG也导致在HT115(用于RNAi)喂食的蠕虫与OP50喂食的蠕虫两者中,DCF荧光均较高(分别是P=0.0007以及P=0.0012)。使用二乙酸2',7'-二氯二氢荧光素(H2DCF-DA)测量ROS水平。因为使用整个蠕虫溶解产物,所以此处测量总体细胞氧化应激。将H2DCF-DA(Molecular Probes,D399)溶解于乙醇中以达到1.5mg/ml的储备物浓度。每次在使用之前制备新鲜储备物。对于测量蠕虫溶解产物中的ROS,在室温下用0.1M NaOH水解30ng/ml工作浓度的H2DCF-DA 30分钟以产生2’,7’-二氯二氢荧光素(DCFH),随后与整个蠕虫溶解产物在黑色96孔板(Greiner Bio-One)中混合。DCFH被ROS氧化产生高度荧光性2',7'-二氯荧光素(DCF)。使用SpectraMax MS(Molecular Devices)在485/530nm的激发/发射下读取DCF荧光。H2O2用作阳性对照(未显示)。为制备蠕虫溶解产物,在含有媒介物或8mMα-KG以及OP50或HT115大肠杆菌的板上培养同步幼小成体动物1天,接着收集并如本文所述溶解。绘制平均值±s.d.。图版b显示在α-KG处理或atp-2(RNAi)后,蛋白质氧化不存在显著变化。通过OxyBlot来测定氧化蛋白质水平。将同步幼小成体N2动物放置于含有媒介物或8mMα-KG的板上,并且用OP50或表达对照或atp-2dsRNA的HT115细菌接种。收集成体第2天和第3天蠕虫,并且用M9缓冲液洗涤4次,接着在-80℃下储存至少24小时。添加Laemmli缓冲液(Biorad,161-0737)至每个样品中,并且通过交替煮沸/冷冻循环来溶解动物。在4℃下在14,000rpm下离心溶解的动物10分钟以集结蠕虫碎片,并且收集上清液供oxyblot分析。通过660nm蛋白质测定(Thermo Scientific,1861426)来测定样品的蛋白质浓度,并且对于所有样品都加以标准化。使用OxyBlot蛋白质氧化检测试剂盒(Millipore,S7150)检测各样品中蛋白质的羰基化。
图9显示在不存在aak-2、daf-16、hif-1、vhl-1或egl-9下,α-KG达成的寿命。图版a显示N2蠕虫,mveh=17.5(n=119),mα-KG=25.4(n=97),P<0.0001;或aak-2(ok524)突变体,mveh=13.7(n=85),mα-KG=17.1(n=83),P<0.0001。图版b显示喂以gfp RNAi对照的N2蠕虫,mveh=18.5(n=101),mα-KG=23.1A(n=98),P<0.0001;或daf-16RNAi,mveh=14.3(n=99),mα-KG=17.6(n=99),P<0.0001。图版c显示N2蠕虫,mveh=21.5(n=101),mα-KG=24.6(n=102),P<0.0001;hif-1(ia7)突变体,mveh=19.6(n=102),mα-KG=23.6(n=101),P<0.0001;vhl-1(ok161)突变体,mveh=20.0(n=98),mα-KG=24.9(n=100),P<0.0001;或egl-9(sa307)突变体,mveh=16.2(n=97),mα-KG=25.6(n=96),P<0.0001。m,平均寿命(成体期的天数);n,测试动物的数目。通过对数秩检验来确定P值。独立实验数目:N2(8)、hif-1(5)、vhl-1(1)、和egl-9(2);对于细节,参见图13。已使用两个不同hif-1突变等位基因(Zhang等PLoSOne 4,e6348(2009)):ia4(显示于图3,图版g中)是历经若干内含子和外显子的缺失;ia7(以上显示)是导致截短蛋白质的早期终止密码子。两个等位基因对寿命具有相同影响。关于α-KG长寿来测试两个等位基因,并且获得相同结果。
如图10中所示,α-KG降低TOR路径活性,但不直接与TOR相互作用。图版a显示在用α-KG辛酯处理的U87细胞中,而非在用辛醇对照处理的细胞中,S6K(T389)磷酸化降低。使用HEK-293和MEF细胞获得相同结果。图版b显示在WI-38细胞中,在由α-KG抑制复合物V后,AMPK(T172)磷酸化被上调,这与α-KG处理的细胞和动物中的ATP含量降低一致。然而,这个AMPK活化似乎涉及比mTOR失活更重度的复合物V抑制,因为寡霉素或较高浓度的α-KG辛酯使P-AMPK增加,而与降低细胞ATP含量(图2,图版d)或氧消耗(图2,图版f)的浓度类似的α-KG辛酯浓度也足以降低P-S6K。使用U87细胞获得相同结果。用针对P-AMPK T172(CellSignaling Technology,2535S)和AMPK(Cell Signaling Technology,2603S)的特异性抗体进行蛋白质印迹。图版c显示α-KG仍然诱导aak-2(RNAi)蠕虫中的自体吞噬;**P<0.01(t检验,双尾,双样本不等方差)。使用Image J定量含有GFP::LGG-1的斑点的数目。棒条指示平均值。图版d-e显示α-KG不直接结合到TOR,如通过DARTS所确定。在M-PER缓冲液(Thermo Scientific,78501)中,在添加蛋白酶抑制剂(Roche,11836153001)和磷酸酶抑制剂(50mM NaF、10mMβ-甘油磷酸酯、5mM焦磷酸钠、2mM Na3VO4)下溶解HEK-293(图版d)或HeLa(图版e)细胞。通过BCA蛋白质测定试剂盒(Pierce,23227)来测量溶解产物的蛋白质浓度。添加冷却TNC缓冲液(50mM Tris-HCl pH 8.0、50mM NaCl、10mM CaCl2)至蛋白质溶解产物中,并且接着使蛋白质溶解产物与媒介物对照(DMSO)或不同浓度的α-KG一起在室温下孵育1小时(对于图版d)或3小时(对于图版e)。在室温下进行20分钟链霉蛋白酶(Roche,10165921001)消化,并且通过添加SDS装载缓冲液以及立刻在95℃下加热5分钟(对于图版d)或在70℃下加热10分钟(对于图版e)来终止。使样品在4-12%Bis-Tris梯度凝胶(Invitrogen,NP0322BOX)上经受SDS-PAGE,并且用针对ATP5B(Santa Cruz,sc58618)、mTOR(Cell Signaling Technology,2972)或GAPDH(Ambion,AM4300)的特异性抗体进行蛋白质印迹。ImageJ用于定量mTOR/GAPDH和ATP5B/GAPDH比率。在α-KG存在下,mTOR蛋白对链霉蛋白酶消化的易感性不变,而如所预期,在α-KG存在下,ATP5B对链霉蛋白酶的抗性增加。图版f显示通过对MAP1LC3(Novus,NB 100-2220)的蛋白质印迹分析来确认用α-KG辛酯处理的HEK-293细胞中的自体吞噬增加,这与自体吞噬引发激酶ULK1的磷酸化降低一致(图4,图版a)。
如图11中所示,在用ogdh-1RNAi处理的秀丽隐杆线虫中,自体吞噬被增强。图版a显示用媒介物或α-KG(8mM)处理的中间L3期对照或ogdh-1敲低秀丽隐杆线虫的表皮中的GFP::LGG-1斑点的共焦图像。图版b显示使用ImageJ定量的GFP::LGG-1斑点的数目。棒条指示平均值,ogdh-1(RNAi)蠕虫具有显著较高自体吞噬水平,并且在ogdh-1(RNAi)蠕虫中,α-KG不显著加强自体吞噬(t检验,双尾,双样本不等方差)。
如图14中所示,2-HG使成体秀丽隐杆线虫的寿命延长。图版A显示2-羟基戊二酸和α-酮戊二酸的化学结构。图版B显示补充(R)-2-HG的蠕虫的寿命与补充以α-KG的蠕虫类似。在以下情况下的平均寿命(成体期的天数):媒介物处理,mveh=14.0(n=112个测试动物);mα-KG=20.7(n=114),P<0.0001(对数秩检验);m(R)-2-HG=20.0(n=110),P<0.0001(对数秩检验);mMet=14.7(n=116),P=0.4305(对数秩检验);mLeu=13.2(n=110),P=0.3307(对数秩检验)。图版C显示(S)-2-HG补充的蠕虫的寿命与补充以α-KG的蠕虫类似。mveh=15.7(n=85);mNa2α-KG=21.5(n=99),P<0.0001(对数秩检验);m(S)-2-HG=20.7(n=87),P<0.0001(对数秩检验)。所有代谢物都在8mM的浓度下给与。
如图15中所示,2-HG结合并抑制ATP合成酶。图版A是显示ATP5B是如通过DARTS和蛋白质印迹鉴定的2-HG结合蛋白的凝胶。图版B显示ATP合成酶受2-HG抑制。从2-HG辛酯(600μΜ)释放的2-HG使从小鼠肝分离的线粒体中状态3(由2mM ADP引发)而非状态4o(寡霉素不敏感性,也就是说复合物V非依赖性)或3u(FCCP解偶联的最大呼吸量)呼吸降低。辛醇用作媒介物。Oligo,寡霉素;FCCP,羰基氰化物-4-(三氟甲氧基)苯腙;AA,抗霉素A。图版C显示在用2-HG辛酯或α-KG辛酯处理的U87细胞中,ATP含量降低(*P<0.05,***P<0.001;未配对t检验,双尾,双样本不等方差)。辛醇对ATP含量不具有影响。图版D显示在葡萄糖培养基中,在2-HG辛酯处理的U87细胞中,如由OCR指示的呼吸降低(**P<0.01,未配对t检验,双尾,双样本不等方差)。相较于DMSO,辛醇显示对OCR无影响。绘制平均值±s.d.。
图16显示对IDH1(R132H)细胞中ATP合成酶的抑制。图版A显示在U87IDH1(R132H)细胞中,ATP水平降低(**P=0.0071)。利用双尾、双样本不等方差未配对t检验。在所有情况下都绘制平均值±s.d.。图版B)在U87IDH1(R132H)细胞中,呼吸降低(**P=0.0037)。图版C显示在U87/IDH1(R132H)细胞中,2-HG积累(***P=0.0003)。图版D显示(R)-2-HG辛酯处理的U87细胞的代谢概况(***P<0.001,*P=0.0435)。图版E是由α-KG和2-HG通过抑制ATP合成酶达成的代谢物信号传导的图解模型。
图17A-I显示ATP5B敲低、2-HG积累或IDH突变的细胞中的代谢易感性。图17A显示U87/IDH1(R132H)细胞对葡萄糖饥饿具有增加的敏感性(***P<0.001)。图17B-D显示α-KG辛酯或2-HG辛酯处理的U87细胞在葡萄糖饥饿后展现活力降低(****P<0.0001,***P<0.001,**P<0.01,*P<0.05)。辛醇对活力不具有影响。图17E)ATP5B敲低抑制U87细胞生长(***P=0.0004)。图17F显示HCT 116IDH1(R132H/+)细胞展现对补充以(R)-3-羟基丁酸的无葡萄糖培养基的易感性增加(***P<0.001)。利用双尾、双样本不等方差未配对t检验。在所有情况下都绘制平均值±s.d.。图17G-I显示ATP5B敲低、α-KG或2-HG的膜可渗透性酯酶可水解类似物处理或稳定表达IDH1(R132H)的U87细胞在无葡萄糖含半乳糖培养基中展现mTOR复合物1活性降低。S6K(T389)和4E-BP1(S65)是mTOR复合物1的底物。辛醇展现对TOR活性无影响。
如图18中所示,2-HG不影响通过电子传递链的电子流动,并且不影响ADP输入。图版A显示来自分离的小鼠肝线粒体的在基础条件下(在FCCP存在下,丙酮酸盐和苹果酸盐分别作为复合物I底物和复合物II抑制剂)以及响应于依序注射鱼藤酮(Rote;复合物I抑制剂)、丁二酸盐(复合物II底物)、抗霉素A(AA;复合物III抑制剂)、四甲基苯二胺(TMPD;细胞色素c(复合物IV)底物)的OCR。在用600μΜ2-HG辛酯处理30分钟之后,未观察到复合物I(C I)、复合物II(C II)或复合物IV(C IV)呼吸差异,而复合物V受相同处理抑制(图15,图版B)(2个独立实验)。辛醇用作媒介物。图版B显示在辛醇(媒介物对照)或2-HG辛酯(600μΜ)存在下测量ADP输入。(R)-2-HG辛酯,P=0.4237;(S)-2-HG辛酯,P=0.1623)。ADP输入的已知抑制剂CATR(羧基苍术苷)作为阳性对照用于测定(***P=0.0003)。利用双尾、双样本不等方差未配对t检验。在所有情况下都绘制平均值±s.d.。
如图19中所示,2-HG抑制细胞呼吸,并且降低ATP水平。图版A显示ATP合成酶的已知抑制剂寡霉素用作阳性对照。(*P<0.05;未配对t检验,双尾,双样本不等方差)。图版B-C显示用2-HG辛酯处理的U87细胞具有降低的ATP合成酶依赖性(寡霉素敏感性)氧消耗速率(OCR)(*P<0.05,**P<0.01,***P<0.001;未配对t检验,双尾,双样本不等方差)。在所有情况下都绘制平均值±s.d.。
图20显示2-HG积累的细胞的细胞能量学和代谢概况。图版A显示HCT 116IDH1(R132H/+)细胞展现呼吸降低(**P=0.0015)。图版B显示2-HG水平在HCT 116/IDH1(R132H/+)细胞中比在亲本对照细胞中高约100倍(****P<0.0001)。图版C显示在(S)-2-HG辛酯处理的U87细胞中,TCA循环中间体和相关氨基酸的代谢概况(*P<0.05)。图版D显示在α-KG辛酯处理的U87细胞中,TCA循环中间体和相关氨基酸的代谢概况(***P<0.001,**P<0.01)。未配对t检验,双尾,双样本不等方差。在所有情况下都绘制平均值±s.d.。
如图21中所示,HCT 116IDH1(R132H/+)细胞展现代谢易感性和生长抑制。图版A显示HCT 116IDH1(R132H/+)细胞对葡萄糖饥饿具有增加的敏感性。图版B显示HCT 116IDH1(R132H/+)细胞呈现生长速率降低。**P<0.01;未配对t检验,双尾,双样本不等方差。在所有情况下都绘制平均值±s.d.。
图22显示在ATP5B敲低、用2-HG辛酯或α-KG辛酯处理或IDH1(R132H)突变后的细胞生长抑制。图版A显示甚至在葡萄糖培养基中,ATP5B敲低也降低U87细胞的生长速率。图版B-D显示在无葡萄糖培养基中,在α-KG辛酯或2-HG辛酯处理后,U87细胞展现生长速率降低。虽然程度较小,但在葡萄糖培养基中,生长速率也降低(未显示)。图版E显示表达IDH1(R132H)的U87细胞甚至在葡萄糖培养基中也展现增殖速率降低。****P<0.0001,***P<0.001,**P<0.01,*P<0.05;未配对t检验,双尾,双样本不等方差。在所有情况下都绘制平均值±s.d.。
在与对α-KG和2-HG化合物进行的实验类似的实验中,施用D-谷氨酸与施用L-谷氨酸两者均使受试者的寿命增加(数据未显示)。
就为理解或完善本发明的公开内容所必需来说,本文提及的所有出版物、专利和专利申请都以引用的方式明确并入本文,所述引用的程度就好像各自被个别地如此并入一样。
由此已描述本发明的示例性实施方案,本领域技术人员应注意在公开内容内的仅具有示例性,并且可在本发明的范围内进行各种其它替代方案、改适和修改。因此,本发明不限于如本文说明的特定实施方案,而是仅受以下权利要求限制。
- 还没有人留言评论。精彩留言会获得点赞!