具有白细胞介素‑17作为佐剂的疫苗的制作方法
本发明涉及包含抗原和IL-17的疫苗以及施用所述疫苗的方法。
背景技术:
疫苗用于刺激个体的免疫应答,以提供针对特定疾病的保护和/或对特定疾病的治疗。一些疫苗包含诱导免疫应答的抗原。一些抗原引发强免疫应答,而其它抗原引发弱免疫应答。通过在疫苗中包含佐剂可以加强对抗原的弱免疫应答。佐剂以很多不同形式出现,例如铝盐、油乳剂、细菌或其它病原体的无菌成分、细胞因子等。
细胞因子是由影响其它细胞行为的细胞形成的蛋白质,并且与很多佐剂不同的是它们可以调节特异性免疫应答。一种所述细胞因子是白细胞介素-17(IL-17)。IL-17是通过受体传导信号以诱导抗微生物肽和促炎细胞因子如干扰素-γ(IFN-γ)的产生的细胞因子家族。细胞因子的IL-17家族诱导适应性免疫应答如2型T辅助(Th2)免疫应答和先天性免疫应答如中性粒细胞的扩增和募集。因此,细胞因子的IL-17家族可以桥连适应性免疫应答和先天性免疫应答。
还以许多不同方式(例如,注射、口服等)将疫苗施用到许多不同的组织(例如,肌内、鼻内等)中。然而,并非所有的递送方法都是等效的。一些递送方法允许在个体群体内的更大顺从性,而其它递送方法可影响疫苗的免疫原性和/或安全性。因此,在本领域中仍需要开发安全且更有效的增加对抗原的免疫应答的佐剂。
技术实现要素:
本发明针对一种包含抗原和IL-17的疫苗。
本发明还针对一种用于诱导获增加受试者的免疫应答的方法。方法可以包括向有需要的受试者施用抗原和IL-17。本发明总体上还涉及IL-17作为佐剂的用途。
附图说明
图1示出(A)绘制小鼠组对细胞因子水平的图;(B)绘制感染后天数(dpi)对存活百分比的图;以及(C)绘制dpi对存活百分比的图。
图2示出(A)绘制小鼠组对细胞因子水平的图;(B)绘制小鼠组对细胞因子水平的图;以及(C)绘制感染后天数(dpi)对存活百分比的图。
图3示出(A)绘制细胞类型对干扰素-γ(IFN-γ)产生细胞的百分比的图;(B)绘制感染后天数(dpi)对存活百分比的图;以及(C)绘制dpi对存活百分比的图。
图4示出(A)描绘将CD8+T细胞过继转移到受体小鼠中的实验方案的说明;(B)绘制感染后天数(dpi)对存活百分比的图;以及(C)绘制dpi对存活百分比的图。
图5示出(A)绘制小鼠类型对特异性溶胞百分比的图;以及(B)绘制CD8+T细胞群对特异性溶胞百分比的图。
图6示出(A)mRNA核苷酸序列;(B)编码核苷酸序列;以及(C)小家鼠(Mus musculus)(小鼠)IL-17A的氨基酸序列。
图7示出(A)mRNA核苷酸序列;(B)编码核苷酸序列;以及(C)智人(Homo sapiens)(人)IL-17A的氨基酸序列。
图8示出(A)mRNA核苷酸序列;(B)编码核苷酸序列;以及(C)特罗斯牛(Bos taurus)(牛)IL-17A的氨基酸序列。
图9示出(A)mRNA核苷酸序列;(B)编码核苷酸序列;以及(C)野猪(Sus scrofa)(猪)IL-17A的氨基酸序列。
图10示出(A)mRNA核苷酸序列;(B)编码核苷酸序列;以及(C)家犬(Canis lupus familiaris)(狗)IL-17A的氨基酸序列。
图11示出(A)mRNA核苷酸序列;(B)编码核苷酸序列;以及(C)原鸡(Gallus gallus)(鸡)IL-17A的氨基酸序列。
图12示出(A)优化的小鼠IL-17A核苷酸序列,其中加下划线的序列含有BamHI位点(GGA TCC)和Kozak序列(GCC ACC),并且加双下划线的序列含有终止密码子TGA和TAA以及XhoI位点(CTC GAG);(B)优化的小鼠IL-17A编码核苷酸序列;以及(C)由图12A和图12B的优化的核苷酸序列(即,SEQ ID NO:19和20)编码的小鼠IL-17A氨基酸序列。
图13示出(A)优化的人IL-17A核苷酸序列,其中加下划线的序列含有BamHI位点(GGA TCC)和Kozak序列(GCC ACC),并且加双下划线的序列含有终止密码子TGA和TAA以及XhoI位点(CTC GAG);(B)优化的人IL-17A编码核苷酸序列;以及(C)由图13A和图13B的优化的核苷酸序列(即,SEQ ID NO:22和23)编码的人IL-17A氨基酸序列。
图14示出(A)优化的牛IL-17A核苷酸序列,其中加下划线的序列含有BamHI位点(GGA TCC)和Kozak序列(GCC ACC),并且加双下划线的序列含有终止密码子TGA和TAA以及XhoI位点(CTC GAG);(B)优化的牛IL-17A编码核苷酸序列;以及(C)由图14A和图14B的优化的核苷酸序列(即,SEQ ID NO:25和26)编码的牛IL-17A氨基酸序列。
图15示出(A)优化的猪IL-17A核苷酸序列,其中加下划线的序列含有BamHI位点(GGA TCC)和Kozak序列(GCC ACC),并且加双下划线的序列含有终止密码子TGA和TAA以及XhoI位点(CTC GAG);(B)优化的猪IL-17A编码核苷酸序列;以及(C)由图15A和图15B的优化的核苷酸序列(即,SEQ ID NO:28和29)编码的猪IL-17A氨基酸序列。
图16示出(A)优化的狗IL-17A核苷酸序列,其中加下划线的序列含有BamHI位点(GGA TCC)和Kozak序列(GCC ACC),并且加双下划线的序列含有终止密码子TGA和TAA以及XhoI位点(CTC GAG);(B)优化的狗IL-17A编码核苷酸序列;以及(C)由图16A和图16B的优化的核苷酸序列(即,SEQ ID NO:31和32)编码的狗IL-17A氨基酸序列。
图17示出(A)优化的鸡IL-17A核苷酸序列,其中加下划线的序列含有BamHI位点(GGA TCC)和Kozak序列(GCC ACC),并且加双下划线的序列含有终止密码子TGA和TAA以及XhoI位点(CTC GAG);(B)优化的鸡IL-17A编码核苷酸序列;以及(C)由图17A和图17B的优化的核苷酸序列(即,SEQ ID NO:34和35)编码的鸡IL-17A氨基酸序列。
图18示出绘制免疫组对抗体滴度的图。
图19示出绘制免疫组对抗体滴度的图。
图20示出绘制针对用以下各项免疫的动物的时间(天)对温度的图:(A)活PRRSV疫苗;(B)杀死的PRRSV疫苗;(C)IL-17A(3μg)+PRRSV杀死的疫苗;和(D)IL-17A(9μg)+PRRSV疫苗。
图21示出绘制免疫组对抗体滴度的图。
图22示出绘制对于每个免疫组在21、35、48和63天的抗体水平的图。
图23示出绘制免疫组对抗体滴度的图。
具体实施方式
本发明涉及一种可以通过使用IL-17作为佐剂用于诱导获增加对抗原的免疫应答的疫苗。本发明涉及IL-17作为佐剂的用途,用来刺激受试者中的免疫应答。本发明还涉及一种通过向受试者施用抗原和IL-17用于免疫或诱导或增加受试者的免疫应答的方法。IL-17可以与抗原一起或与抗原分开给予IL-17。如在本发明中示出的,与仅包含抗原的疫苗相比,当在抗原之前施用IL-17时,在受试者中引发更大的免疫应答。所述分开施用使免疫系统为暴露于抗原做好准备,从而在受试者中提供对抗原的增加的免疫应答。
与不包含IL-17的疫苗相比,本发明的疫苗通过增加CD8+T细胞应答,可以在受试者中增加对抗原的免疫应答。这种增加的CD8+T细胞应答具有细胞溶解活性,并且分泌抗病毒细胞因子干扰素-γ(IFN-γ)。因此,IL-17可进一步增大对病毒抗原(例如,流感病毒抗原)的免疫应答。
与不包含IL-17的疫苗相比,与本发明的疫苗也可以通过增加抗体滴度和对抗原的抗体应答的持续时间来增加受试者中对抗原的免疫应答。
1.定义
除非另外定义,否则本文所使用的所有技术和科学术语具有如本领域的普通技术人员通常所理解的意义。如有冲突,将以本文件(包括定义)为准。虽然在本发明的实践或测试中可以使用与本文所描述的那些方法和材料类似或等效的方法和材料,但以下描述了优选的方法和材料。本文提及的所有公布、专利申请、专利以及其它参考文献以其全文以引用的方式并入本文。本文公开的材料、方法和实施例仅是示例性的,并不意图为限制性的。
如本文所用,术语“包含(comprise)”、“包括(include)”、“具有(having)”、“具有(has)”、“可以(can)”、“含有(contain)”以及其变化形式意图是不排除另外行为或结构的可能性的开放式连接词、术语、或词语。除非上下文另外清楚地说明,否则单数形式“一个/种(a)”、“一个/种(an)”以及“所述(the)”包括复数引用。本公开还涵盖包括本文所呈现的实施方案或要素、由本文所呈现的实施方案或要素组成以及主要由本文所呈现的实施方案或要素组成的其它实施方案,无论是否明确地提出。
如本文所用的“佐剂”意指添加至本文所描述的疫苗中以增强抗原的免疫原性的任何分子。
如本文所用的“编码序列”或“编码核酸”意指包含编码蛋白质的核苷酸序列的核酸(RNA或DNA分子)。编码序列可以进一步包含可操作地连接至调控元件的起始信号和终止信号,所述调控元件包括能够在向其施用核酸的个体或哺乳动物的细胞中指导表达的启动子和多腺苷酸化信号。
如本文所用的“互补序列”或“互补的”意指可以意味着核酸分子的核苷酸或核苷酸类似物之间的沃森-克里克(Watson-Crick)(例如,A-T/U和C-G)或Hoogsteen碱基配对的核酸。
如本文可互换使用的术语“电穿孔”、“电渗透”或“电动力学增强”(“EP”)意指使用跨膜电场脉冲在生物膜中诱导微观通路(孔隙);所述微观通路的存在允许生物分子如质粒、寡核苷酸、siRNA、药物、离子和水从细胞膜的一侧穿至另一侧。
如本文所用的片段或免疫原性片段意指编码能够在哺乳动物中引发免疫应答的多肽的核酸序列或其部分。片段可以是选自编码以下所列出的蛋白质片段的各种核苷酸序列中的至少一种的DNA片段。片段可以包含至少10%、至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%、至少90%或至少95%的一种或多种以下所列出的核酸序列。在一些实施方案中,片段可以包含以下所列出的核酸序列中的至少一种的至少20个核苷酸或更多、至少30个核苷酸或更多、至少40个核苷酸或更多、至少50个核苷酸或更多、至少60个核苷酸或更多、至少70个核苷酸或更多、至少80个核苷酸或更多、至少90个核苷酸或更多、至少100个核苷酸或更多、至少150个核苷酸或更多、至少200个核苷酸或更多、至少250个核苷酸或更多、至少300个核苷酸或更多、至少350个核苷酸或更多、至少400个核苷酸或更多、至少450个核苷酸或更多、至少500个核苷酸或更多、至少550个核苷酸或更多、至少600个核苷酸或更多、至少650个核苷酸或更多、至少700个核苷酸或更多、至少750个核苷酸或更多、至少800个核苷酸或更多、至少850个核苷酸或更多、至少900个核苷酸或更多、至少950个核苷酸或更多或至少1000个核苷酸或更多。
如本文所用的片段或免疫原性片段还意指能够在哺乳动物中引发免疫应答的多肽序列或其部分。片段可以是选自以下所列出的各种氨基酸序列中的至少一种的多肽片段。片段可以包含至少10%、至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%、至少90%或至少95%的一种或多种以下所列出的蛋白质。在一些实施方案中,片段可以包含以下所列出的蛋白质中的至少一种的至少20个氨基酸或更多、至少30个氨基酸或更多、至少40个氨基酸或更多、至少50个氨基酸或更多、至少60个氨基酸或更多、至少70个氨基酸或更多、至少80个氨基酸或更多、至少90个氨基酸或更多、至少100个氨基酸或更多、至少110个氨基酸或更多、至少120个氨基酸或更多、至少130个氨基酸或更多、至少140个氨基酸或更多、至少150个氨基酸或更多、至少160个氨基酸或更多、至少170个氨基酸或更多、至少180个氨基酸或更多、至少190个氨基酸或更多、至少200个氨基酸或更多、至少210个氨基酸或更多、至少220个氨基酸或更多、至少230个氨基酸或更多或至少240个氨基酸或更多。
如本文所用的“基因构建体”是指包含编码蛋白质的核苷酸序列的DNA或RNA分子。编码序列包含可操作地连接至调控元件的起始信号和终止信号,所述调控元件包括能够在向其施用核酸分子的个体的细胞中指导表达的启动子和多腺苷酸化信号。如本文所用,术语“可表达的形式”是指含有必要调控元件的基因构建体,所述必要调控元件可操作地连接至编码蛋白质的编码序列,使得当所述基因构建体存在于个体的细胞中时,编码序列将被表达。
如本文在两种或更多种核酸或多肽序列的背景下所使用的术语“相同的”或“同一性”意指序列具有指定百分比的在指定区上相同的残基。可以通过以下方式来计算百分比:最优比对两个序列,在指定区上比较两个序列,确定相同残基出现在两个序列中的位置的数目以得到匹配位置的数目,用匹配位置的数目除以指定区中的位置的总数目,并且将结果乘以100来得到序列同一性的百分比。在两个序列具有不同长度或比对产生一个或多个交错末端并且比较的指定区仅包含单个序列的情况下,单个序列的残基包括于计算的分母而不是分子中。在比较DNA和RNA时,可以认为胸腺嘧啶(T)和尿嘧啶(U)是等同的。可以手动地或通过使用计算机序列算法(如BLAST或BLAST 2.0)来执行同一性。
如本文所用的“免疫应答”意指响应于抗原的引入而产生的宿主的免疫系统(例如,哺乳动物的免疫系统)的活化。免疫应答可以呈细胞应答或体液应答或两者兼有的形式。
如本文所用的“核酸”或“寡核苷酸”或“多核苷酸”意指共价连接在一起的至少两个核苷酸。单链的描绘也定义互补链的序列。因此,核酸还涵盖所描绘的单链的互补链。核酸的许多变体可以用于与给定核酸相同的目的。因此,核酸还涵盖大致上相同的核酸及其互补序列。单链提供可以在严格杂交条件下与靶序列杂交的探针。因此,核酸还涵盖在严格杂交条件下杂交的探针。
核酸可以是单链的或双链的,或可以含有双链序列和单链序列的部分。核酸可以是DNA、基因组和cDNA、RNA或杂交体,其中核酸可以含有脱氧核糖核苷酸与核糖核苷酸的组合以及碱基的组合,所述碱基包括尿嘧啶、腺嘌呤、胸腺嘧啶、胞嘧啶、鸟嘌呤、肌苷、黄嘌呤、次黄嘌呤、异胞嘧啶和异鸟嘌呤。可以通过化学合成方法或通过重组方法获得核酸。
如本文所用的“可操作地连接”意指基因的表达受其在空间上所连接的启动子的控制。启动子可以定位于受其控制的基因的5'(上游)或3'(下游)。启动子与基因之间的距离可以与所述启动子与其所控制的基因(即启动子的来源基因)之间的距离大约相同。如本领域中已知的,可以容许所述距离的变化而不损失启动子功能。
如本文所用的“肽”、“蛋白质”或“多肽”可以意指氨基酸的连接序列,并且可以是天然的、合成的、或天然与合成的修饰或组合。
如本文所用的“启动子”意指合成的或天然来源的分子,所述分子能够在细胞中赋予、激活或增强核酸的表达。启动子可以包含一个或多个特异性转录调控序列,以进一步增强表达和/或改变其空间表达和/或时间表达。启动子还可以包括末端增强子或阻遏子元件,它们可以位于与转录起始位点相距多达数千个碱基对处。启动子可以源自以下来源,包括病毒、细菌、真菌、植物、昆虫和动物。启动子可以调控基因组分相对于其中发生表达的细胞、组织或器官或相对于发生表达所处的发育阶段或响应于外部刺激(如生理应激、病原体、金属离子或诱导剂)而组成型地或差异性地表达。启动子的代表性实例包括细菌噬菌体T7启动子、细菌噬菌体T3启动子、SP6启动子、lac操纵子-启动子、tac启动子、SV40晚期启动子、SV40早期启动子、RSV-LTR启动子、CMV IE启动子、SV40早期启动子或SV40晚期启动子和CMV IE启动子。
“信号肽”和“前导序列”在本文可互换使用,并且是指可以连接在本文所列出的IL-17蛋白(和/或抗原)的氨基末端的氨基酸序列。信号肽/前导序列通常指导蛋白质的定位。本文所使用的信号肽/前导序列优选地促进蛋白质从其产生细胞分泌。信号肽/前导序列通常在从细胞分泌后,从蛋白质(通常称为成熟蛋白质)的剩余部分裂解。信号肽/前导序列连接在蛋白质的N末端。
如本文所用的“受试者”可以意指想要或需要用本文所描述的疫苗进行免疫的哺乳动物。哺乳动物可以是人、黑猩猩、狗、猫、马、牛、猪、鸡、小鼠或大鼠。
如本文所用的“大致上相同的”可以意指第一氨基酸序列和第二氨基酸序列在1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、200、300、400、500、600、700、800、900、1000、1100或更多个氨基酸的区域上至少60%、65%、70%、75%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%。“大致上相同的”还可以意指第一核酸序列和第二核酸序列在1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、200、300、400、500、600、700、800、900、1000、1100或更多个核苷酸的区域上至少60%、65%、70%、75%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%。
如本文所用的“治疗(Treatment)”或“治疗(Treating)”可以意指通过预防、抑制、阻遏的手段保护动物免于疾病或完全消除疾病。预防疾病涉及在疾病发作之前向动物施用本发明的疫苗。抑制疾病涉及在疾病诱发之后但在其临床出现之前向动物施用本发明的疫苗。阻遏疾病涉及在疾病的临床出现之后向动物施用本发明的疫苗。
关于核酸而在本文中使用的“变体”意指(i)参考核苷酸序列的一部分或片段;(ii)参考核苷酸序列或其部分的互补序列;(iii)与参考核酸或其互补序列大致相同的核酸;或(iv)在严格条件下与参考核酸、其互补序列或与其大致相同的序列杂交的核酸。
变体可以进一步定义为通过氨基酸的插入、缺失、或保守性取代而在氨基酸序列上有所不同、但保留至少一种生物活性的肽或多肽。“生物活性”的代表性实例包括被特异性抗体结合或促进免疫应答的能力。变体还可以意指具有氨基酸序列的蛋白质,其中所述氨基酸序列大致上与具有保留至少一种生物活性的氨基酸序列的参考蛋白质相同。氨基酸的保守性取代,即用具有类似特性(例如,亲水性、带电区的程度和分布)的不同氨基酸置换氨基酸,在本领域被认为通常涉及微小变化。如本领域所理解的,这些微小变化可以部分地通过考虑氨基酸的亲水指数来鉴别。Kyte等,J.Mol.Biol.157:105-132(1982)。氨基酸的亲水指数基于对其疏水性和电荷的考虑。本领域已知具有类似亲水指数的氨基酸可以被取代并且仍然保留蛋白质功能。在一方面,具有±2的亲水指数的氨基酸被取代。氨基酸的亲水性还可以用于揭示将产生保留生物功能的蛋白质的取代。在肽的背景下氨基酸的亲水性的考虑允许计算所述肽的最大局部平均亲水性,其是据报道与抗原性和免疫原性良好相关的有用测量。如本领域所理解的,具有类似亲水性值的氨基酸的取代可以产生保留生物活性(例如免疫原性)的肽。可以用彼此具有±2之内的亲水值的氨基酸执行取代。氨基酸的疏水性指数和亲水性值均受所述氨基酸的具体侧链影响。与所述观察一致,与生物功能相容的氨基酸取代应理解为取决于氨基酸的相对相似性,并且特别是那些氨基酸的侧链,如通过疏水性、亲水性、电荷、大小和其它特性所揭示的。
变体可以是在全基因序列或其片段的全长上大致相同的核酸序列。核酸序列可在基因序列或其片段的全长上80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同。变体可以是在氨基酸序列或其片段的全长上大致相同的氨基酸序列。氨基酸序列可在氨基酸序列或其片段的全长上80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同。
如本文所用的“载体”意指含有复制起点的核酸序列。载体可以是病毒载体、细菌噬菌体、细菌人工染色体或酵母人工染色体。载体可以是DNA载体或RNA载体。载体可以是自我复制的染色体外载体,并且优选是DNA质粒。
对于本文数值范围的叙述来说,明确地涵盖具有相同精确度的介于其间的每个中间数字。例如,对于6至9的范围来说,除6和9之外,还涵盖数字7和8,并且对于范围6.0至7.0来说,明确地涵盖数字6.0、6.1、6.2、6.3、6.4、6.5、6.6、6.7、6.8、6.9和7.0。
2.疫苗
本文提供一种包含抗原和佐剂的疫苗。疫苗可以在受试者中增加抗原呈递和对抗原的总免疫应答。抗原和佐剂的组合比仅包含抗原的疫苗更有效地诱导免疫系统。这种更有效的免疫应答在任何疾病、病原体或病毒的治疗和/或预防方面提供增加的效率。
可以将疫苗的抗原和佐剂一起或分开地施用至有需要的受试者。在一些情况下,IL-17可以与疫苗的抗原分开施用,因为与仅包含抗原的疫苗相比,当在抗原之前施用IL-17时,在受试者中引发更大的免疫应答。所述分开施用使免疫系统为暴露于抗原做好准备,从而在受试者中提供对抗原的增加的免疫应答。
在一些实施方案中,可以在向受试者施用抗原之前至少1小时、2小时、3小时、4小时、5小时、6小时、7小时、8小时、9小时、10小时、11小时、12小时、13小时、14小时、15小时、16小时、17小时、18小时、19小时、20小时、21小时、22小时、23小时、24小时、36小时、48小时、60小时、72小时、84小时或96小时施用佐剂。在其它实施方案中,可以在向受试者施用抗原之前至少1天、2天、3天、4天、5天、6天、7天、8天、9天、10天、11天、12天、13天、14天、15天、16天、17天、18天、19天、20天、21天、22天、23天、24天、25天、26天、27天、28天、29天、30天、60天或90天施用佐剂。
在其它实施方案中,可以在向受试者施用抗原之前至少1周、2周、3周、4周、5周、6周、7周、8周、9周、10周、11周、12周、13周、14周或15周施用佐剂。在其它实施方案中,可以在向受试者施用抗原之前约12小时至约15周、约12小时至约10周、约12小时至约5周、约12小时至约1周、约12小时至约60小时、约12小时至约48小时、约24小时至约15周、约60小时至约15周、约96小时至约15周、约1天至约15周、约5天至约15周、约10天至约15周、约15天至约15周、约20天至约15周、约25天至约15周、约30天至约15周、约1周至约15周、约5周至约15周或约10周至约15周施用佐剂。
在另一个实施方案中,抗原和IL-17一起施用。在所述情况下,它们可以被配制在一起(例如,在相同容器中的混合物(admixture))或单独配制(并同时施用)。
在可替代的实施方案中,可以首先单独施用IL-17,并且随后再一次,在于抗原的混合物中或与抗原同时施用。
本发明的疫苗可以具有有效疫苗所要求的特征,如为安全的,以使得疫苗本身不会引起疾病或死亡;保护免受由暴露于活的病原体如病毒或细菌引起的疾病;诱导中和抗体来预防细胞的感染;诱导针对细胞内病原体的保护性T细胞;以及提供施用容易性、很少副作用、生物稳定性以及每剂量的低成本。通过如以下所论述组合抗原和佐剂,疫苗可实现这些特征中的一些或全部。
疫苗可以进一步修改抗原内的表位呈递,以诱导比仅包含抗原的疫苗更大的对抗原的免疫应答。当施用至不同组织(如肌肉或皮肤)时,疫苗可以进一步诱导免疫应答。
a.IL-17
本发明在疫苗或组合物中使用IL-17来诱导获刺激受试者中的免疫应答。IL-17可以是核酸序列、氨基酸序列或其组合。核酸序列可以是DNA、RNA、cDNA、其变体、其片段或其组合。核酸序列还可以包含编码通过肽键连接至IL-17的接头序列或标签序列的另外序列。氨基酸序列可以是蛋白质、肽、其变体、其片段或其组合。
术语IL-17指定为细胞白介素-17、其单体、其二聚体、其同源二聚体、其异源二聚体、其片段、其变体或其组合。IL-17可以是IL-17A(还称为CTLA-8)、IL-17B、IL-17C、IL-17D、IL-17E(还称为IL-25)和IL-17F。IL-17可以被分离并且来源于多种细胞类型,例如,17型T辅助(Th17)细胞、活化的T细胞和上皮细胞。IL-17细胞因子具有高度保守的C末端,所述C末端含有半胱氨酸结折迭结构;并且作为二硫键连接的二聚体来分泌(IL-17B除外)。IL-17B作为非共价二聚体来分泌。除同源二聚体之外,异源二聚体也可以在IL-17A与IL-17F之间形成。
疫苗可以包含约0.001μg至约100μg的IL-17,优选约0.001μg至约50μg、更优选约0.001μg至约10μg、甚至更优选约0.001μg至约5μg、约0.005μg至约4μg、约0.01μg至约3μg、约0.05μg至约2μg或约0.1μg至约1μg的IL-17。免疫治疗组合物可以包含至少约0.001μg、至少约0.002μg、至少约0.003μg、至少约0.004μg、至少约0.005μg、至少约0.006μg、至少约0.007μg、至少约0.008μg、至少约0.009μg、至少约0.01μg、至少约0.02μg、至少约0.03μg、至少约0.04μg、至少约0.05μg、至少约0.06μg、至少约0.07μg、至少约0.08μg、至少约0.09μg、至少约0.1μg、至少约0.2μg、至少约0.3μg、至少约0.4μg、至少约0.5μg、至少约0.6μg、至少约0.7μg、至少约0.8μg、至少约0.9μg、至少约1.0μg、至少约1.5μg、至少约2.0μg、至少约2.5μg、至少约3.0μg、至少约3.5μg、至少约4.0μg、至少约4.5μg或至少约5.0μg的IL-17。
与不包含IL-17的疫苗相比,在疫苗中包含IL-17可以增加或增强受试者中对抗原的免疫应答。在以下对抗原进行更详细地论述。在一些情况下,与不包含IL-17的疫苗相比,在疫苗内包含IL-17可以使对抗原的免疫应答增加约0.5倍至约15倍、约0.5倍至约10倍或约0.5倍至约8倍。或者,与不包含IL-17的疫苗相比,在疫苗内包含IL-17可以使对抗原的免疫应答增加至少约0.5倍、至少约1.0倍、至少约1.5倍、至少约2.0倍、至少约2.5倍、至少约3.0倍、至少约3.5倍、至少约4.0倍、至少约4.5倍、至少约5.0倍、至少约5.5倍、至少约6.0倍、至少约6.5倍、至少约7.0倍、至少约7.5倍、至少约8.0倍、至少约8.5倍、至少约9.0倍、至少约9.5倍、至少约10.0倍、至少约10.5倍、至少约11.0倍、至少约11.5倍、至少约12.0倍、至少约12.5倍、至少约13.0倍、至少约13.5倍、至少约14.0倍、至少约14.5倍或者至少约15.0倍。
在其它替代性实施方案中,与不包含IL-17的疫苗相比,在疫苗内包含IL-17可以使对抗原的免疫应答增加约50%至约1500%、约50%至约1000%,或者约50%至约800%。在其它实施方案中,与不包含IL-17的疫苗相比,在疫苗内包含IL-17可以使对抗原的免疫应答增加至少约50%、至少约100%、至少约150%、至少约200%、至少约250%、至少约300%、至少约350%、至少约400%、至少约450%、至少约500%、至少约550%、至少约600%、至少约650%、至少约700%、至少约750%、至少约800%、至少约850%、至少约900%、至少约950%、至少约1000%、至少约1050%、至少约1100%、至少约1150%、至少约1200%、至少约1250%、至少约1300%、至少约1350%、至少约1450%或者至少约1500%。
IL-17细胞因子通过IL-17受体家族的成员传导信号并且这些受体的活化触发细胞间通路,所述细胞间通路诱导促炎细胞因子(例如干扰素-γ(IFN-γ)、IL-6和肿瘤坏死因子α(TNF-α))的产生。因此,IL-17细胞因子的过量表达可以促进自身免疫性疾病和炎症性疾病的发展,所述疾病如哮喘、类风湿性关节炎、银屑病、移植排斥反应、炎症性肠道疾病和多发性硬化。
IFN-γ具有抗病毒、免疫调节和抗肿瘤特性,并且可以改变多种基因的转录以产生多种生理应答和细胞应答。由IFN-γ引起的一些作用包括促进自然杀伤(NK)细胞活性、引起正常细胞增加I类MHC分子的表达、增加巨噬细胞中的抗原呈递和溶酶体活性、诱导一氧化氮合酶(iNOS)以及促进Th1分化成有关细胞毒性CD8+T细胞的细胞免疫性,同时抑制体液(抗体)应答中的Th2分化。
细胞毒性CD8+T细胞(细胞毒性T淋巴细胞(CTL))是诱导感染病毒和其它病原体的细胞死亡的T细胞的亚组。在活化后,CTL经历克隆扩增以产生抗原特异性的效应细胞。效应CTL通过指导的胞吐作用(即,脱粒)分子的过程释放,所述分子杀死感染的细胞或靶细胞,例如,穿孔蛋白、粒溶蛋白和颗粒酶。当不再需要时,许多效应CTL死亡,但是一些效应细胞被保留为记忆细胞,以使得当再次遇到抗原时,记忆细胞分化成效应细胞以更快速地发动免疫应答。
当IL-17增加或增强免疫应答时,这种增加的免疫应答可以包括增加的细胞免疫应答。增加的细胞免疫应答可以包括增加的CD8+T细胞应答。增加的CD8+T细胞应答可以包括增加的细胞毒性CD8+T淋巴细胞(CTL)应答。增加的CTL应答可以包括增加靶细胞的抗原特异性溶胞的量。增加的CD8+T细胞应答可以包括增加CD8+T细胞群分泌IFN-γ的群体或频率。产生IFN-γ的CD8+T细胞可以具有细胞溶解活性。
进而,与不包含IL-17的疫苗相比,在疫苗内包含IL-17可以使IFN-γ水平增加约0.5倍至约15倍、约0.5倍至约10倍或约0.5倍至约8倍。与不包含IL-17的疫苗相比,在疫苗内包含IL-17可以使IFN-γ水平增加至少约0.5倍、至少约1.0倍、至少约1.5倍、至少约2.0倍、至少约2.5倍、至少约3.0倍、至少约3.5倍、至少约4.0倍、至少约4.5倍、至少约5.0倍、至少约5.5倍、至少约6.0倍、至少约6.5倍、至少约7.0倍、至少约7.5倍、至少约8.0倍、至少约8.5倍、至少约9.0倍、至少约9.5倍、至少约10.0倍、至少约10.5倍、至少约11.0倍、至少约11.5倍、至少约12.0倍、至少约12.5倍、至少约13.0倍、至少约13.5倍、至少约14.0倍、至少约14.5倍或者至少约15.0倍。
与不包含IL-17的疫苗相比,在疫苗内包含IL-17还可以使IFN-γ水平增加约50%至约1500%、约50%至约1000%或者约50%至约800%。与不包含IL-17的疫苗相比,在疫苗内包含IL-17还可以使IFN-γ水平增加至少约50%、至少约100%、至少约150%、至少约200%、至少约250%、至少约300%、至少约350%、至少约400%、至少约450%、至少约500%、至少约550%、至少约600%、至少约650%、至少约700%、至少约750%、至少约800%、至少约850%、至少约900%、至少约950%、至少约1000%、至少约1050%、至少约1100%、至少约1150%、至少约1200%、至少约1250%、至少约1300%、至少约1350%、至少约1450%或者至少约1500%。
当IL-17增加或增强免疫应答时,这种增加的免疫应答可以包括增加的体液免疫应答。增加的体液免疫应答可以包括增加的抗体滴度和增加的抗体应答的持续时间。因此,与不包含IL-17的疫苗相比,在疫苗中包括IL-17可以增加对抗原特异的抗体滴度。与不包含IL-17的疫苗相比,在疫苗中包括IL-17可以增加对抗原的抗体应答的持续时间。
本发明的目的因此涉及IL-17蛋白或核酸,用于作为佐剂使用。
本发明还涉及IL-17蛋白或核酸,用于在受试者中刺激抗原特异性免疫应答。
本发明还涉及IL-17蛋白或核酸,用于在受试者中诱导或刺激对抗原的CD8-T细胞应答。
本发明还涉及IL-17蛋白或核酸,与抗原组合,用于为受试者接种疫苗。
在一个优选的实施方案中,IL-17是IL-17A、其片段、其变体或其组合。IL-17A可以是单体、同源二聚体或与IL-17F形成的异源二聚体。
IL-17A可以是来自任何数量的有机体的IL-17A蛋白,例如,小鼠(小家鼠,Mus musculus)IL-17A蛋白、人(智人,Homo sapiens)IL-17A蛋白、牛(特罗斯牛,Bos taurus)IL-17A蛋白、猪(野猪,Sus scrofa)IL-17A蛋白、狗(家犬,Canis lupis familiaris)IL-17A蛋白和鸡(原鸡,Gallus gallus)IL-17A蛋白。小鼠IL-17A蛋白可以具有图6C中所示的氨基酸序列(即,SEQ ID NO:3)、其片段、其变体或其组合。人IL-17A蛋白可以具有图7C中所示的氨基酸序列(即,SEQ ID NO:6)、其片段、其变体或其组合。牛IL-17A蛋白可以具有图8C中所示的氨基酸序列(即,SEQ ID NO:9)、其片段、其变体或其组合。猪IL-17A蛋白可以具有图9C中所示的氨基酸序列(即,SEQ ID NO:12)、其片段、其变体或其组合。狗IL-17A蛋白可以具有图10C中所示的氨基酸序列(即,SEQ ID NO:15)、其片段、其变体或其组合。鸡IL-17A蛋白可以具有图11C中所示的氨基酸序列(即,SEQ ID NO:18)、其片段、其变体或其组合。IL-17A蛋白可以进一步包含一种或多种另外的氨基酸序列元件,例如,免疫球蛋白E(IgE)前导序列(例如,SEQ ID NO:38)、血凝素(HA)标签或IgE前导序列和HA标签二者。
编码IL-17A的核酸可以来自任何数量的有机体,例如小鼠(小家鼠)(图6A的SEQ ID NO:1和图6B的SEQ ID NO:2)、人(智人)(图7A的SEQ ID NO:4和图7B的SEQ ID NO:5)、牛(特罗斯牛)(图8A的SEQ ID NO:7和图8B的SEQ ID NO:8)、猪(野猪)(图9A的SEQ ID NO:10和图9B的SEQ ID NO:11)、狗(家犬)(图10A的SEQ ID NO:13和图10B的SEQ ID NO:14)以及鸡(原鸡)(图11A的SEQ ID NO:16和图11B的SEQ ID NO:17)。可以关于密码子使用和对应RNA转录物对编码IL-17A的核酸进行优化。可以针对表达对编码IL-17A的核酸进行密码子和RNA优化。编码IL-17A的核酸可以包含Kozak序列(例如,GCC ACC)以提高翻译起始的效率。编码IL-17A的核酸可以包含多个终止密码子(例如,TGA TAA)以提高翻译终止的效率。编码IL-17A的核酸还可以编码免疫球蛋白E(IgE)前导序列。IgE前导序列在核酸中可以位于IL-17A的5’。编码IL-17A的核酸还可以包含编码IgE前导序列的核苷酸序列(例如,SEQ ID NO:37)。
优化的小鼠IL-17A可以是核酸序列SEQ ID NO:19,其编码SEQ ID NO:21(图12A和图12C)。在一些实施方案中,优化的小鼠IL-17A可以是在SEQ ID NO:19中所列出的核酸序列的全长上具有至少约80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的核酸序列。在其它实施方案中,优化的小鼠IL-17A可以是编码在SEQ ID NO:21中所列出的氨基酸序列的全长上具有至少约80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的氨基酸序列的核酸序列。
优化的小鼠IL-17A可以是核酸序列SEQ ID NO:20,其编码SEQ ID NO:21(图12B和图12C)。在一些实施方案中,优化的小鼠IL-17A可以是在SEQ ID NO:20中所列出的核酸序列的全长上具有至少约80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的核酸序列。
小鼠IL-17A可以是在SEQ ID NO:21中所列出的氨基酸序列的全长上具有至少约80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的氨基酸序列。
优化的人IL-17A可以是核酸序列SEQ ID NO:22,其编码SEQ ID NO:24(图13A和图13C)。在一些实施方案中,优化的人IL-17A可以是在SEQ ID NO:22中所列出的核酸序列的全长上具有至少约80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的核酸序列。在其它实施方案中,优化的人IL-17A可以是编码在SEQ ID NO:24中所列出的氨基酸序列的全长上具有至少约80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的氨基酸序列的核酸序列。
优化的人IL-17A可以是核酸序列SEQ ID NO:23,其编码SEQ ID NO:24(图13B和图13C)。在一些实施方案中,优化的人IL-17A可以是在SEQ ID NO:23中所列出的核酸序列的全长上具有至少约80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的核酸序列。
人IL-17A可以是在SEQ ID NO:24中所列出的氨基酸序列的全长上具有至少约80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的氨基酸序列。
优化的牛IL-17A可以是核酸序列SEQ ID NO:25,其编码SEQ ID NO:27(图14A和图14C)。在一些实施方案中,优化的牛IL-17A可以是在SEQ ID NO:25中所列出的核酸序列的全长上具有至少约80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的核酸序列。在其它实施方案中,优化的牛IL-17A可以是编码在SEQ ID NO:27中所列出的氨基酸序列的全长上具有至少约80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的氨基酸序列的核酸序列。
优化的牛IL-17A可以是核酸序列SEQ ID NO:26,其编码SEQ ID NO:27(图14B和图14C)。在一些实施方案中,优化的牛IL-17A可以是在SEQ ID NO:26中所列出的核酸序列的全长上具有至少约80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的核酸序列。
牛IL-17A可以是在SEQ ID NO:27中所列出的氨基酸序列的全长上具有至少约80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的氨基酸序列。
优化的猪IL-17A可以是核酸序列SEQ ID NO:28,其编码SEQ ID NO:30(图15A和图15C)。在一些实施方案中,优化的猪IL-17A可以是在SEQ ID NO:28中所列出的核酸序列的全长上具有至少约80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的核酸序列。在其它实施方案中,优化的猪IL-17A可以是编码在SEQ ID NO:30中所列出的氨基酸序列的全长上具有至少约80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的氨基酸序列的核酸序列。
优化的猪IL-17A可以是核酸序列SEQ ID NO:29,其编码SEQ ID NO:30(图15B和图15C)。在一些实施方案中,优化的猪IL-17A可以是在SEQ ID NO:29中所列出的核酸序列的全长上具有至少约80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的核酸序列。
猪IL-17A可以是在SEQ ID NO:30中所列出的氨基酸序列的全长上具有至少约80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的氨基酸序列。
优化的狗IL-17A可以是核酸序列SEQ ID NO:31,其编码SEQ ID NO:33(图16A和图16C)。在一些实施方案中,优化的狗IL-17A可以是在SEQ ID NO:31中所列出的核酸序列的全长上具有至少约80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的核酸序列。在其它实施方案中,优化的狗IL-17A可以是编码在SEQ ID NO:33中所列出的氨基酸序列的全长上具有至少约80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的氨基酸序列的核酸序列。
优化的狗IL-17A可以是核酸序列SEQ ID NO:32,其编码SEQ ID NO:33(图16B和图16C)。在一些实施方案中,优化的狗IL-17A可以是在SEQ ID NO:32中所列出的核酸序列的全长上具有至少约80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的核酸序列。
狗IL-17A可以是在SEQ ID NO:33中所列出的氨基酸序列的全长上具有至少约80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的氨基酸序列。
优化的鸡IL-17A可以是核酸序列SEQ ID NO:34,其编码SEQ ID NO:36(图17A和图17C)。在一些实施方案中,优化的鸡IL-17A可以是在SEQ ID NO:34中所列出的核酸序列的全长上具有至少约80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的核酸序列。在其它实施方案中,优化的鸡IL-17A可以是编码在SEQ ID NO:36中所列出的氨基酸序列的全长上具有至少约80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的氨基酸序列的核酸序列。
优化的鸡IL-17A可以是核酸序列SEQ ID NO:35,其编码SEQ ID NO:36(图17B和图17C)。在一些实施方案中,优化的鸡IL-17A可以是在SEQ ID NO:35中所列出的核酸序列的全长上具有至少约80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的核酸序列。
鸡IL-17A可以是在SEQ ID NO:36中所列出的氨基酸序列的全长上具有至少约80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的氨基酸序列。
可以提供SEQ ID NO:21、SEQ ID NO:24、SEQ ID NO:27、SEQ ID NO:30、SEQ ID NO:33和SEQ ID NO:36的免疫原性片段。免疫原性片段可以包含至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的SEQ ID NO:21、SEQ ID NO:24、SEQ ID NO:27、SEQ ID NO:30、SEQ ID NO:33和/或SEQ ID NO:36。在一些实施方案中,免疫原性片段包含前导序列,例如,免疫球蛋白前导序列(如免疫球蛋白E(IgE)前导序列)。在一些实施方案中,免疫原性片段不含前导序列。
可以提供具有与SEQ ID NO:21、SEQ ID NO:24、SEQ ID NO:27、SEQ ID NO:30、SEQ ID NO:33和SEQ ID NO:36的免疫原性片段具有同一性的氨基酸序列的蛋白质的免疫原性片段。所述片段可以包含至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的与SEQ ID NO:21、SEQ ID NO:24、SEQ ID NO:27、SEQ ID NO:30、SEQ ID NO:33和/或SEQ ID NO:36具有95%或更高同一性的蛋白质。一些实施方案涉及与本文的IL-17A蛋白序列的免疫原性片段具有96%或更高同一性的免疫原性片段。一些实施方案涉及与本文的IL-17A蛋白序列的免疫原性片段具有97%或更高同一性的免疫原性片段。一些实施方案涉及与本文的IL-17A蛋白序列的免疫原性片段具有98%或更高同一性的免疫原性片段。一些实施方案涉及与本文的IL-17A蛋白序列的免疫原性片段具有99%或更高同一性的免疫原性片段。在一些实施方案中,免疫原性片段包含前导序列,例如,免疫球蛋白前导序列,如IgE前导序列。在一些实施方案中,免疫原性片段不含前导序列。
一些实施方案涉及SEQ ID NO:19、SEQ ID NO:20、SEQ ID NO:22、SEQ ID NO:23、SEQ ID NO:25、SEQ ID NO:26、SEQ ID NO:28、SEQ ID NO:29、SEQ ID NO:31、SEQ ID NO:32、SEQ ID NO:34和SEQ ID NO:35的免疫原性片段。免疫原性片段可以包含至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的SEQ ID NO:19、SEQ ID NO:20、SEQ ID NO:22、SEQ ID NO:23、SEQ ID NO:25、SEQ ID NO:26、SEQ ID NO:28、SEQ ID NO:29、SEQ ID NO:31、SEQ ID NO:32、SEQ ID NO:34和/或SEQ ID NO:35。在一些实施方案中,免疫原性片段包含编码前导序列(例如,如IgE前导序列的免疫球蛋白前导序列)的序列。在一些实施方案中,免疫原性片段不含编码前导序列的编码序列。
可以提供具有与SEQ ID NO:19、SEQ ID NO:20、SEQ ID NO:22、SEQ ID NO:23、SEQ ID NO:25、SEQ ID NO:26、SEQ ID NO:28、SEQ ID NO:29、SEQ ID NO:31、SEQ ID NO:32、SEQ ID NO:34和SEQ ID NO:35具有同一性的核苷酸序列的核酸的免疫原性片段。所述片段可以包含至少60%、至少65%、至少70%、至少75%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的与SEQ ID NO:19、SEQ ID NO:20、SEQ ID NO:22、SEQ ID NO:23、SEQ ID NO:25、SEQ ID NO:26、SEQ ID NO:28、SEQ ID NO:29、SEQ ID NO:31、SEQ ID NO:32、SEQ ID NO:34和/或SEQ ID NO:35具有95%或更高同一性的核酸。一些实施方案涉及与本文的IL-17A核酸序列的免疫原性片段具有96%或更高同一性的免疫原性片段。一些实施方案涉及与本文的IL-17A核酸序列的免疫原性片段具有97%或更高同一性的免疫原性片段。一些实施方案涉及与本文的IL-17A核酸序列的免疫原性片段具有98%或更高同一性的免疫原性片段。一些实施方案涉及与本文的IL-17A核酸序列的免疫原性片段具有99%或更高同一性的免疫原性片段。在一些实施方案中,免疫原性片段包含编码前导序列(例如,如IgE前导序列的免疫球蛋白前导序列)的序列。在一些实施方案中,免疫原性片段不含编码前导序列的编码序列。
b.抗原
抗原可以是在受试者中诱导免疫应答的任何物质。纯化的抗原通常其自身不是强免疫原性的,并且因此与如上所述的佐剂组合。当与佐剂组合时可以增强或增加对抗原的免疫应答。所述免疫应答可以是体液免疫应答和/或细胞免疫应答。在一些实施方案中,佐剂和抗原的组合可以增强或增加受试者的细胞免疫应答。
抗原可以是核酸序列、氨基酸序列、脂质、多糖或其组合。核酸序列可以是DNA、RNA、cDNA、其变体、其片段或其组合。核酸序列还可以包含编码通过肽键连接至抗原的接头序列或标签序列的另外序列。氨基酸序列可以是蛋白质、肽、其变体、其片段,或其组合。抗原可以处于纯化的形式,或混合物如提取物、细胞、病毒颗粒,等。
在特定的实施方案中,抗原是来自任何数量的有机体的蛋白质、核酸、或其片段、或其变体或其组合,或者抗原包含来自任何数量的有机体的蛋白质、核酸、或其片段、或其变体或其组合,有机体例如是病毒、寄生虫、细菌、真菌或哺乳动物。
抗原可以与感染性疾病(例如,病毒性疾病或细菌性疾病或寄生虫性疾病)、自身免疫性疾病、癌症、过敏或哮喘相关。在特定的实施方案中,抗原可以与疱疹、流感、乙型肝炎、丙型肝炎、人乳头瘤病毒(HPV)或人免疫缺陷病毒(HIV)相关。优选地,抗原可以与流感或HIV相关。
一些抗原可以诱导强免疫应答。其它抗原可以诱导弱免疫应答。当如上所述与佐剂组合时,抗原可以引发更大的免疫应答。
(1)病毒抗原
抗原可以是病毒抗原,或其片段或其变体。病毒抗原可以来自一种病毒,所述病毒来自以下家族之一:腺病毒科(Adenoviridae)、沙粒病毒科(Arenaviridae)、布尼亚病毒科(Bunyaviridae)、嵌杯病毒科(Caliciviridae)、冠状病毒科(Coronaviridae)、纤丝病毒科(Filoviridae)、嗜肝DNA病毒科(Hepadnaviridae)、疱疹病毒科(Herpesviridae)、正粘病毒科(Orthomyxoviridae)、乳多空病毒科(Papovaviridae)、副粘液病毒科(Paramyxoviridae)、细小病毒科(Parvoviridae)、小RNA病毒科(Picornaviridae)、痘病毒科(Poxviridae)、呼肠孤病毒科(Reoviridae)、逆转录病毒科(Retroviridae)、弹状病毒科(Rhabdoviridae)或披膜病毒科(Togaviridae)。病毒抗原可以来自乳头瘤病毒,例如人乳头瘤病毒(HPV)、人免疫缺陷病毒(HIV)、脊髓灰质炎病毒、肝炎病毒(例如,甲型肝炎病毒(HAV)、乙型肝炎病毒(HBV)、丙型肝炎病毒(HCV)、丁型肝炎病毒(HDV)和戊型肝炎病毒(HEV))、天花病毒(重型天花和轻型天花)、痘苗病毒、流感病毒、鼻病毒、登革热病毒、马脑炎病毒、风疹病毒、黄热病病毒、诺沃克病毒(Norwalk virus)、甲型肝炎病毒、人T-细胞白血病病毒(HTLV-I)、多毛细胞白血病病毒(HTLV-II)、加州脑炎病毒、汉坦病毒(Hanta virus)(出血热)、狂犬病病毒、埃博拉热病毒(Ebola fever virus)、马尔堡病毒(Marburg virus)、麻疹病毒、腮腺炎病毒、呼吸道合胞体病毒(RSV)、单纯性疱疹1(口腔疱疹)、单纯性疱疹2(生殖器疱疹)、带状疱疹(水痘-带状疱疹,也称为水痘)、巨细胞病毒(CMV)(例如,人CMV)、爱泼斯坦-巴尔病毒(Epstein-Barr virus)(EBV)、黄病毒、口蹄疫病毒、基孔肯亚病毒(chikungunya virus)、拉沙病毒(lassa virus)、沙粒病毒、致癌病毒、猪繁殖和呼吸综合征病毒(PPRS)、猪圆环病毒2型(PCV2)、口蹄疫病毒(FMDV)、禽流感病毒、禽副粘病毒1型也称为新城鸡瘟病毒(NDV)、禽偏肺病毒、马立克氏病病毒、甘保罗病病毒也称为传染性法氏囊病病毒(IBDV)、牛病毒性腹泻(BVD)、猪瘟(CSF)、细小病毒、假狂犬病病毒、鹭山病毒、猪疱疹病毒、猪痘病毒、猪流感病毒、水疱性口炎病毒或猪疹病的病毒。病毒性抗原可以来自犬瘟热病毒、犬呼吸道型冠状病毒、犬副流感病毒、犬腺病毒、犬细小病毒和犬呼肠病毒。
(a)肝炎抗原
IL-17可以与肝炎病毒抗原(即,肝炎抗原)或其片段或其变体联合或组合。肝炎抗原可以是来自甲型肝炎病毒(HAV)、乙型肝炎病毒(HBV)、丙型肝炎病毒(HCV)、丁型肝炎病毒(HDV)和/或戊型肝炎病毒(HEV)的抗原或免疫原。在一些实施方案中,肝炎抗原可以是编码来自HAV、HBV、HCV、HDV和HEV的一种或多种抗原的核酸分子(如质粒)。肝炎抗原可以是全长蛋白质的全长或免疫原性片段。
肝炎抗原可以包含共有序列和/或用于改善表达的修饰。包括密码子优化、RNA优化和添加高效免疫球蛋白前导序列以增加构建体的免疫原性的基因修饰可以包括在经过修饰的共有序列中。共有肝炎抗原可包含信号肽,如免疫球蛋白信号肽(如IgE或IgG信号肽),并且在一些实施方案中,可包含HA标签。可以设计免疫原,以引发比相应密码子优化的免疫原更强并且更广泛的细胞免疫应答。
肝炎抗原可以是来自HAV的抗原。肝炎抗原可以是HAV衣壳蛋白、HAV非结构蛋白、其片段、其变体或其组合。
肝炎抗原可以是来自HCV的抗原。肝炎抗原可以是HCV核衣壳蛋白(即,核心蛋白)、HCV包膜蛋白(例如,E1和E2)、HCV非结构蛋白(例如,NS1、NS2、NS3、NS4a、NS4b、NS5a和NS5b)、其片段、其变体或其组合。
肝炎抗原可以是来自HDV的抗原。肝炎抗原可以是HDVδ抗原、其片段或其变体。
肝炎抗原可以是来自HEV的抗原。肝炎抗原可以是HEV衣壳蛋白、其片段或其变体。
肝炎抗原可以是来自HBV的抗原。肝炎抗原可以是HBV核心蛋白、HBV表面蛋白、HBV DNA聚合酶、由基因X编码的HBV蛋白、其片段、其变体或其组合。肝炎抗原可以是HBV基因型A核心蛋白、HBV基因型B核心蛋白、HBV基因型C核心蛋白、HBV基因型D核心蛋白、HBV基因型E核心蛋白、HBV基因型F核心蛋白、HBV基因型G核心蛋白、HBV基因型H核心蛋白、HBV基因型A表面蛋白、HBV基因型B表面蛋白、HBV基因型C表面蛋白、HBV基因型D表面蛋白、HBV基因型E表面蛋白、HBV基因型F表面蛋白、HBV基因型G表面蛋白、HBV基因型H表面蛋白、其片段、其变体或其组合。肝炎抗原可以是共有HBV核心蛋白或共有HBV表面蛋白。
在一些实施方案中,肝炎抗原可以是HBV基因型A共有核心DNA序列构建体、连接至HBV基因型A核心蛋白的共有序列的IgE前导序列,或HBV基因型A共有核心蛋白序列。
在其它实施方案中,肝炎抗原可以是HBV基因型B共有核心DNA序列构建体、连接至HBV基因型B核心蛋白的共有序列的IgE前导序列,或HBV基因型B共有核心蛋白序列。
在其它实施方案中,肝炎抗原可以是HBV基因型C共有核心DNA序列构建体、连接至HBV基因型C核心蛋白的共有序列的IgE前导序列,或HBV基因型C共有核心蛋白序列。
在一些实施方案中,肝炎抗原可以是HBV基因型D共有核心DNA序列构建体、连接至HBV基因型D核心蛋白的共有序列的IgE前导序列,或HBV基因型D共有核心蛋白序列。
在其它实施方案中,肝炎抗原可以是HBV基因型E共有核心DNA序列构建体、连接至HBV基因型E核心蛋白的共有序列的IgE前导序列,或HBV基因型E共有核心蛋白序列。
在一些实施方案中,肝炎抗原可以是HBV基因型F共有核心DNA序列构建体、连接至HBV基因型F核心蛋白的共有序列的IgE前导序列,或HBV基因型F共有核心蛋白序列。
在其它实施方案中,肝炎抗原可以是HBV基因型G共有核心DNA序列构建体、连接至HBV基因型G核心蛋白的共有序列的IgE前导序列,或HBV基因型G共有核心蛋白序列。
在一些实施方案中,肝炎抗原可以是HBV基因型H共有核心DNA序列构建体、连接至HBV基因型H核心蛋白的共有序列的IgE前导序列,或HBV基因型H共有核心蛋白序列。
在其它实施方案中,肝炎抗原可以是HBV基因型A共有表面DNA序列构建体、连接至HBV基因型A表面蛋白的共有序列的IgE前导序列,或HBV基因型A共有表面蛋白序列。
在一些实施方案中,肝炎抗原可以是HBV基因型B共有表面DNA序列构建体、连接至HBV基因型B表面蛋白的共有序列的IgE前导序列,或HBV基因型B共有表面蛋白序列。
在其它实施方案中,肝炎抗原可以是HBV基因型C共有表面DNA序列构建体、连接至HBV基因型C表面蛋白的共有序列的IgE前导序列,或HBV基因型C共有表面蛋白序列。
在其它实施方案中,肝炎抗原可以是HBV基因型D共有表面DNA序列构建体、连接至HBV基因型D表面蛋白的共有序列的IgE前导序列,或HBV基因型D共有表面蛋白序列。
在一些实施方案中,肝炎抗原可以是HBV基因型E共有表面DNA序列构建体、连接至HBV基因型E表面蛋白的共有序列的IgE前导序列,或HBV基因型E共有表面蛋白序列。
在其它实施方案中,肝炎抗原可以是HBV基因型F共有表面DNA序列构建体、连接至HBV基因型F表面蛋白的共有序列的IgE前导序列,或HBV基因型F共有表面蛋白序列。
在其它实施方案中,肝炎抗原可以是HBV基因型G共有表面DNA序列构建体、连接至HBV基因型G表面蛋白的共有序列的IgE前导序列,或HBV基因型G共有表面蛋白序列。
在其它实施方案中,肝炎抗原可以是HBV基因型H共有表面DNA序列构建体、连接至HBV基因型H表面蛋白的共有序列的IgE前导序列,或HBV基因型H共有表面蛋白序列。
(b)人乳头瘤病毒(HPV)抗原
IL-17可以与人乳头瘤病毒(HPV)抗原或其片段或其变体联合或组合。HPV抗原可以来自引起宫颈癌、直肠癌和/或其它癌症的16型、18型、31型、33型、35型、45型、52型和58型HPV。HPV抗原可以来自引起生殖器疣并且已知为头颈癌原因的6型和11型HPV。
HPV抗原可以是来自每种HPV类型的HPV E6或E7域。例如,对于16型HPV(HPV16),HPV16抗原可以包括HPV16E6抗原、HPV16E7抗原、其片段、其变体或其组合。类似地,HPV抗原可以是HPV 6E6和/或E7、HPV 11E6和/或E7、HPV 18E6和/或E7、HPV 31E6和/或E7、HPV 33E6和/或E7、HPV 52E6和/或E7或者HPV 58E6和/或E7、其片段、变体或组合。
(c)RSV抗原
IL-17还可以与RSV抗原或其片段或其变体联合或组合。RSV抗原可以是人RSV融合蛋白(本文中还称为“RSV F”、“RSV F蛋白”和“F蛋白”)或其片段或变体。人RSV融合蛋白在A亚型RSV与B亚型RSV之间可以是保守的。RSV抗原可以是来自RSV长链(GenBank AAX23994.1)的RSV F蛋白或其片段或变体。RSV抗原可以是来自RSV A2链(GenBank AAB59858.1)的RSV F蛋白或其片段或变体。RSV抗原可以是RSV F蛋白或其片段或变体的单体、二聚体或三聚体。RSV抗原可以是优化的氨基酸RSV F氨基酸序列或其片段或变体。
RSV F的融合后形式在经过免疫的动物中引发高滴度中和抗体,并且保护动物免于RSV激发。本发明在所要求的疫苗中利用这种免疫应答。根据本发明,RSV F蛋白可以呈融合前形式或融合后形式。
RSV抗原还可以是人RSV附着糖蛋白(本文中还称为“RSV G”、“RSV G蛋白”和“G蛋白”)或其片段或变体。人RSV G蛋白在A亚型RSV与B亚型RSV之间有所不同。抗原可以是来自RSV长链(GenBank AAX23993)的RSV G蛋白或其片段或变体。RSV抗原可以是来自以下的RSV G蛋白:B亚型RSV分离物H5601、B亚型RSV分离物H1068、B亚型RSV分离物H5598、B亚型RSV分离物H1123或其片段或变体。RSV抗原可以是优化的氨基酸RSV G氨基酸序列或其片段或变体。
在其它实施方案中,RSV抗原可以是人RSV非结构蛋白1(“NS1蛋白”)或其片段或变体。例如,RSV抗原可以是来自RSV长链(GenBank AAX23987.1)的RSV NS1蛋白或其片段或变体。RSV抗原还可以是人RSV非结构蛋白2(“NS2蛋白”)或其片段或变体。例如,RSV抗原可以是来自RSV长链(GenBank AAX23988.1)的RSV NS2蛋白或其片段或变体。RSV抗原还可以是人RSV核衣壳(“N”)蛋白或其片段或变体。例如,RSV抗原可以是来自RSV长链(GenBank AAX23989.1)的RSV N蛋白或其片段或变体。RSV抗原可以是人RSV磷蛋白(“P”)蛋白或其片段或变体。例如,RSV抗原可以是来自RSV长链(GenBank AAX23990.1)的RSV P蛋白或其片段或变体。RSV抗原还可以是人RSV基质蛋白(“M”)蛋白或其片段或变体。RSV抗原可以是来自RSV长链(GenBank AAX23991.1)的RSV M蛋白或其片段或变体。
在其它实施方案中,RSV抗原可以是人RSV小疏水(“SH”)蛋白或其片段或变体。例如,RSV抗原可以是来自RSV长链(GenBank AAX23992.1)的RSV SH蛋白或其片段或变体。RSV抗原还可以是人RSV基质蛋白2-1(“M2-1”)蛋白或其片段或变体。例如,RSV抗原可以是来自RSV长链(GenBank AAX23995.1)的RSV M2-1蛋白或其片段或变体。RSV抗原还可以是人RSV基质蛋白2-2(“M2-2”)蛋白或其片段或变体。例如,RSV抗原可以是来自RSV长链(GenBank AAX23997.1)的RSV M2-2蛋白或其片段或变体。RSV抗原可以是RSV聚合酶L(“L”)蛋白或其片段或变体。例如,RSV抗原可以是来自RSV长链(GenBank AAX23996.1)的RSV L蛋白或其片段或变体。
在另外的实施方案中,RSV抗原可以具有NS1、NS2、N、P、M、SH、M2-1、M2-2或L蛋白的优化的氨基酸序列。RSV抗原可以是人RSV蛋白或重组抗原,如由人RSV基因组编码的蛋白质中的任一种。
在其它实施方案中,RSV抗原可以是但不限于:来自RSV长链的RSV F蛋白、来自RSV长链的RSV G蛋白、优化的氨基酸RSV G氨基酸序列、RSV长链的人RSV基因组、优化的氨基酸RSV F氨基酸序列、来自RSV长链的RSV NS1蛋白、来自RSV长链的RSV NS2蛋白、来自RSV长链的RSV N蛋白、来自RSV长链的RSV P蛋白、来自RSV长链的RSV M蛋白、来自RSV长链的RSV SH蛋白、来自RSV长链的RSV M2-1蛋白、来自RSV长链的RSV M2-2蛋白、来自RSV长链的RSV L蛋白、来自B亚型RSV分离物H5601的RSV G蛋白、来自B亚型RSV分离物H1068的RSV G蛋白、来自B亚型RSV分离物H5598的RSV G蛋白、来自B亚型RSV分离物H1123的RSV G蛋白,或其片段或其变体。
(d)流感抗原
IL-17可以与流感抗原或其片段或其变体联合或组合。流感抗原是能够在哺乳动物中引发针对一种或多种流感血清型的免疫应答的那些流感抗原。抗原可以包含全长翻译产物HA0、亚单位HA1、亚单位HA2、其变体、其片段或其组合。流感血凝素抗原可以是源自多种甲型流感血清型H1株的共有序列、源自多种甲型流感血清型H2株的共有序列、含有源自不同组的多种甲型流感血清型H1株的两个不同的共有序列的部分的杂交序列或源自多种乙型流感株的共有序列。流感血凝素抗原可以来自乙型流感。
流感抗原还可以含有至少一种抗原表位,所述抗原表位可以有效对抗特定流感免疫原,针对所述流感免疫原的免疫应答可以被诱导。抗原可以提供存在于完整流感病毒中的免疫原性位点和表位的全部谱系。抗原可以是可以源自血凝素抗原序列的共有血凝素抗原序列,所述血凝素抗原序列来自一种血清型的多种甲型流感病毒株,如血清型H1或血清型H2的多种甲型流感病毒株。抗原可以是可以通过组合两个不同的共有血凝素抗原序列或其部分获得的杂交共有血凝素抗原序列。两个不同的共有血凝素抗原序列各自可以源自不同组的一种血清型的多种甲型流感病毒株,如血清型H1的多种甲型流感病毒株。抗原可以是可以源自血凝素抗原序列的共有血凝素抗原序列,所述血凝素抗原序列来自多种乙型流感病毒株。
在一些实施方案中,流感抗原可以是H1HA、H2HA、H3HA、H5HA或BHA抗原。或者,流感抗原可以是包含共有H1氨基酸序列或共有H2氨基酸序列的共有血凝素抗原。共有血凝素抗原可以是包含两个不同的共有H1序列的部分的合成杂交共有H1序列,所述两个不同的共有H1序列各自源自来自另一者的不同组的序列。为合成杂交共有H1蛋白的共有HA抗原的实例是包含U2氨基酸序列的蛋白质。共有血凝素抗原可以是源自来自乙型流感株的血凝素序列的共有血凝素蛋白,如包含共有BHA氨基酸序列的蛋白质。
共有血凝素抗原可进一步包含一种或多种另外的氨基酸序列元件。共有血凝素抗原可进一步在其N末端上包含IgE或IgG前导氨基酸序列。共有血凝素抗原可进一步包含免疫原性标签,所述免疫原性标签是可以通过可容易获得的抗体进行检测的独特免疫原性表位。所述免疫原性标签的实例是可以连接在共有血凝素C末端上的9个氨基酸的流感HA标签。在一些实施方案中,共有血凝素抗原可进一步在其N末端上包含IgE或IgG前导氨基酸序列并且在其C末端上包含HA标签。
共有血凝素抗原可以是由共有流感氨基酸序列或其片段和变体组成的共有血凝素蛋白。共有血凝素抗原可以是包含非流感蛋白质序列和流感蛋白质序列或其片段和变体的共有血凝素蛋白。
共有H1蛋白的实例包括可由共有H1氨基酸序列组成的那些共有H1蛋白或进一步包含另外元件(如IgE前导序列或HA标签、或IgE前导序列和HA标签二者)的那些共有H1蛋白。
共有H2蛋白的实例包括可由共有H2氨基酸序列组成的那些共有H2蛋白或进一步包含IgE前导序列或HA标签、或IgE前导序列和HA标签二者的那些共有H2蛋白。
杂交共有H1蛋白的实例包括可由共有U2氨基酸序列组成的那些杂交共有H1蛋白或进一步包含IgE前导序列或HA标签、或IgE前导序列和HA标签二者的那些杂交共有H1蛋白。
杂交共有乙型流感血凝素蛋白的实例包括可以由共有BHA氨基酸序列组成的那些杂交共有乙型流感血凝素蛋白或它可以包含IgE前导序列或HA标签,或IgE前导序列和HA标签二者。
共有血凝素蛋白可以由共有血凝素核酸、其变体或其片段编码。与可以是源自来自不同株和变体的多种不同的血凝素序列的共有序列的共有血凝素蛋白不同,共有血凝素核酸是指编码共有蛋白质序列的核酸序列,并且所使用的编码序列可以不同于用于编码共有血凝素蛋白序列所源自的多个不同的血凝素序列中的特定氨基酸序列的那些编码序列。共有核酸序列可以是密码子优化的和/或RNA优化的。共有血凝素核酸序列可包含位于5’非翻译区域中的Kozak序列。共有血凝素核酸序列可包含编码前导序列的核酸序列。N末端前导序列的编码序列是血凝素编码序列的5’。N末端前导子可以促进分泌。N末端前导子可以是IgE前导子或IgG前导子。共有血凝素核酸序列可以包含编码免疫原性标签的核酸序列。免疫原性标签可以位于蛋白质的C末端上并且编码它的序列是HA编码序列的3’。免疫原性标签提供独特表位,存在针对所述表位的可容易获得的抗体,以使得可以在测定中使用所述抗体来检测和证实蛋白质的表达。免疫原性标签可以是位于蛋白质的C末端处的H标签。
(e)人免疫缺陷病毒(HIV)抗原
IL-17可以与HIV抗原或其片段或其变体联合或组合。HIV抗原可以包括经过修饰的免疫原共有序列。包括密码子优化、RNA优化和添加高效免疫球蛋白前导序列以增加构建体的免疫原性的基因修饰可以包括在经过修饰的共有序列中。可以设计新型免疫原,以引发比相应密码子优化的免疫原更强并且更广泛的细胞免疫应答。
在一些实施方案中,HIV抗原可以是A亚型共有包膜DNA序列构建体、连接至A亚型包膜蛋白的共有序列的IgE前导序列,或A亚型共有包膜蛋白序列。
在其它实施方案中,HIV抗原可以是B亚型共有包膜DNA序列构建体、连接至B亚型包膜蛋白的共有序列的IgE前导序列,或B亚型共有包膜蛋白序列。
在其它实施方案中,HIV抗原可以是C亚型共有包膜DNA序列构建体、连接至C亚型包膜蛋白的共有序列的IgE前导序列,或C亚型共有包膜蛋白序列。
在另外的实施方案中,HIV抗原可以是D亚型共有包膜DNA序列构建体、连接至D亚型包膜蛋白的共有序列的IgE前导序列,或D亚型共有包膜蛋白序列。
在一些实施方案中,HIV抗原可以是B亚型Nef-Rev共有包膜DNA序列构建体、连接至B亚型Nef-Rev蛋白的共有序列的IgE前导序列,或B亚型Nef-Rev共有蛋白序列。
在其它实施方案中,HIV抗原可以是A、B、C和D亚型DNA序列构建体的Gag共有DNA序列、连接至Gag共有A、B、C和D亚型蛋白的共有序列的IgE前导序列,或共有Gag A、B、C和D亚型蛋白序列。
在其它实施方案中,HIV抗原可以是MPol DNA序列或MPol蛋白序列。HIV抗原可以是Env A、Env B、Env C、Env D、B Nef-Rev、Gag以及其任何组合的核酸或氨基酸序列。
(f)猪繁殖和呼吸综合征病毒(PRRS)
IL-17可以与猪繁殖和呼吸综合征病毒(PRRS)抗原或其片段或其变体联合或组合。PRRS病毒抗原可以来自PRRS病毒株JXAI-R。在一些实施方案中,PRRS抗原可以是选自GP2(ORF2a)、GP3(ORF3)、GP4(ORF4)或GP5(ORF5)的糖蛋白或选自M(ORF6)和E(ORF2b)的非糖基化的蛋白,或它们的一个或多个组合。
PRRS病毒抗原可以包含共有序列和/或用于改善表达的修饰。基因修饰包括密码子优化、RNA优化并且添加高效免疫球蛋白前导序列以增加构建体的免疫原性可以包括在修饰的共有序列中。共有PRRS病毒抗原可以包含信号肽如免疫球蛋白信号肽如IgE或IgG信号肽,并且在一些实施方案中,可以包含HA标签。可以设计免疫原以引发比相应密码子优化的免疫原更强并且更广泛的细胞免疫应答。
(g)猪圆环病毒2型(PCV2)
IL-17可以与猪圆环病毒2型(PCV2)抗原或其片段或其变体联合或组合。在一些实施方案中,PCV2抗原选自蛋白ORF1、ORF2和ORF3,单独的或以组合的形式。PCV2抗原可以包含共有序列和/或用于改善表达的修饰。基因修饰包括密码子优化、RNA优化并且添加高效免疫球蛋白前导序列以增加构建体的免疫原性可以包括在修饰的共有序列中。共有PCV2抗原可以包含信号肽如免疫球蛋白信号肽如IgE或IgG信号肽,并且在一些实施方案中,可以包含HA标签。可以设计免疫原以引发比相应密码子优化的免疫原更强并且更广泛的细胞免疫应答。
(h)口蹄疫病毒(FMDV)
IL-17可以与口蹄疫病毒(FMDV)抗原或其片段或其变体联合或组合。在一些实施方案中,抗原是VP1或P1蛋白,单独的或以组合的形式。FMDV抗原可以包含共有序列和/或用于改善表达的修饰。基因修饰包括密码子优化、RNA优化并且添加高效免疫球蛋白前导序列以增加构建体的免疫原性可以包括在修饰的共有序列中。共有FMDV抗原可以包含信号肽如免疫球蛋白信号肽如IgE或IgG信号肽,并且在一些实施方案中,可以包含HA标签。可以设计免疫原以引发比相应密码子优化的免疫原更强并且更广泛的细胞免疫应答。
(2)寄生虫抗原
抗原可以是寄生虫抗原或其片段或变体。寄生虫可以是原生动物、蠕虫或外寄生物。蠕虫(即,肠虫(worm))可以是扁形虫(例如,吸虫和绦虫)、棘头虫或蛔虫(例如,蛲虫)。外寄生物可以是虱子、跳蚤、壁虱和螨虫。
寄生虫可以是引起以下疾病的任何寄生虫:棘阿米巴角膜炎、阿米巴病(Amoebiasis)、蛔虫病、巴贝西虫病(Babesiosis)、小袋虫病、浣熊蛔虫病(Baylisascariasis)、恰加斯病、华支睾吸虫病、锥蝇属病(Cochliomyia)、隐孢子虫病、裂头绦虫病、麦地那龙线虫病(Dracunculiasis)、包虫病、象皮病、蛲虫病、片吸虫病、姜片虫病、丝虫病、贾第鞭毛虫病、颚口线虫病、膜壳绦虫病、等孢子球虫病、片山热(Katayama fever)、利什曼病(Leishmaniasis)、莱姆病(Lyme disease)、疟疾、后殖吸虫病、蝇蛆病、盘尾丝虫病、虱病、疥疮、血吸虫病、昏睡症、类圆线虫病、绦虫病、弓蛔虫病、弓形虫病、旋毛虫病以及鞭虫病。
寄生虫可以是棘阿米巴(Acanthamoeba)、异尖线虫、人蛔虫(Ascaris lumbricoides)、肤蝇、结肠小袋虫(Balantidium coli)、臭虫、多节绦虫亚纲(绦虫)、恙螨、螺旋蝇蛆(Cochliomyia hominivorax)、溶组织内阿米巴、肝片吸虫(Fasciola hepatica)、兰伯贾第虫(Giardia lamblia)、钩虫、利什曼原虫(Leishmania)、锯齿舌形虫(Linguatula serrata)、肝吸虫、罗阿丝虫(Loa loa)、并殖吸虫属-肺吸虫、蛲虫、恶性疟原虫(Plasmodium falciparum)、血吸虫、粪类圆线虫(Strongyloides stercoralis)、螨虫、绦虫、刚地弓形虫(Toxoplasma gondii)、锥体虫、鞭虫或者吴策线虫(Wuchereria bancrofti)。
(a)疟疾抗原
IL-17可以与疟疾抗原(即,PF抗原或PF免疫原)或其片段或其变体联合或组合。抗原可以来自引起疟疾的寄生虫。引起疟疾的寄生虫可以是恶性疟原虫(Plasmodium falciparum)。恶性疟原虫抗原可以包括环子孢子(CS)抗原。
在一些实施方案中,疟疾抗原可以是编码恶性疟原虫免疫原CS、LSA1、TRAP、CelTOS和Ama1中的一个或多个的核酸分子如质粒。免疫原可以是全长蛋白质的全长或免疫原性片段。免疫原包含共有序列和/或用于改善表达的修饰。
在其它实施方案中,疟疾抗原可以是从GenBank数据库中的所有全长恶性疟原虫TRAP/SSP2序列(总共28个序列)设计的TRAP(也称为SSP2)的共有序列。共有TRAP免疫原(即,ConTRAP免疫原)可包含信号肽(如免疫球蛋白信号肽,如IgE或IgG信号肽),并且在一些实施方案中,可包含HA标签。
在其它实施方案中,疟疾抗原可以是CelTOS,其也称为Ag2并且是高度保守的疟原虫抗原。共有CelTOS抗原(即,ConCelTOS免疫原)可包含信号肽(如免疫球蛋白信号肽,如IgE或IgG信号肽),并且在一些实施方案中,可包含HA标签。
在另外的实施方案中,疟疾抗原可以是Ama1,其为高度保守的疟原虫抗原。疟疾抗原还可以是Ama1(即,ConAmaI免疫原)的共有序列,其在一些情况下包含信号肽(如免疫球蛋白信号肽,如IgE或IgG信号肽),并且在一些实施方案中,可包含HA标签。
在一些实施方案中,疟疾抗原可以是共有CS抗原(即,共有CS免疫原),其在一些情况下包含信号肽(如免疫球蛋白信号肽,如IgE或IgG信号肽),并且在一些实施方案中,可包含HA标签。
在其它实施方案中,疟疾抗原可以是包含本文所述的两种或更多种PF蛋白的组合的融合蛋白。例如,融合蛋白可包含直接彼此相邻地连接或者间隔子以之间具有间隔子或一个或多个氨基酸连接的共有CS免疫原、ConLSA1免疫原、ConTRAP免疫原、ConCelTOS免疫原和ConAma1免疫原中的两种或更多种。在一些实施方案中,融合蛋白包含两个PF免疫原;在一些实施方案中,融合蛋白包含三个PF免疫原;在一些实施方案中,融合蛋白包含四个PF免疫原;并且在一些实施方案中,融合蛋白包含五个PF免疫原。具有两个共有PF免疫原的融合蛋白可包含:CS和LSA1、CS和TRAP、CS和CelTOS、CS和Ama1、LSA1和TRAP、LSA1和CelTOS、LSA1和Ama1、TRAP和CelTOS、TRAP和Ama1或者CelTOS和Ama1。具有三个共有PF免疫原的融合蛋白可包含:CS、LSA1和TRAP;CS、LSA1和CelTOS;CS、LSA1和Ama1;LSA1、TRAP和CelTOS;LSA1、TRAP和Ama1;或者TRAP、CelTOS和Ama1。具有四个共有PF免疫原的融合蛋白可包含:CS、LSA1、TRAP以及CelTOS;CS、LSA1、TRAP以及Ama1;CS、LSA1、CelTOS以及Ama1;CS、TRAP、CelTOS以及Ama1;或者LSA1、TRAP、CelTOS以及Ama1。具有五个共有PF免疫原的融合蛋白可包含CS或CS-alt、LSA1、TRAP、CelTOS以及Ama1。
在一些实施方案中,融合蛋白包含连接至N末端的信号肽。在一些实施方案中,融合蛋白包含连接至每个共有PF免疫原的N末端的多个信号肽。在一些实施方案中,间隔子可包含在融合蛋白的PF免疫原之间。在一些实施方案中,融合蛋白的PF免疫原之间的间隔子可以是蛋白水解裂解位点。在一些实施方案中,间隔子可以是由在意图向其施用疫苗和/或摄取疫苗的细胞内发现的蛋白酶识别的蛋白水解裂解位点。在一些实施方案中,间隔子可包含在融合蛋白的PF免疫原之间,其中间隔子是由在意图向其施用疫苗和/或摄取疫苗的细胞内发现的蛋白酶识别的蛋白水解裂解位点,并且融合蛋白包含连接至每个共有PF免疫原的N末端的多个信号肽,以使得在裂解时,每个共有PF免疫原的信号肽使共有PF免疫原转移至细胞外。
(3)细菌抗原
抗原可以是细菌抗原或其片段或变体。细菌可以来自以下门中的任一种:酸杆菌门、放线菌门、产水菌门、拟杆菌门、Caldiserica门、衣原体门、绿菌门、绿弯菌门、产金菌门、蓝藻菌门、脱铁杆菌门、异常球菌-栖热菌门、网团菌门、Elusimicrobia门、纤维杆菌门、厚壁菌门、梭杆菌门、芽单胞菌门、黏胶球形菌门、硝化螺旋菌门、浮霉菌门、变形菌门、螺旋菌门、互养菌门、无壁菌门、热脱硫杆菌门、热袍菌门以及疣微菌门。
细菌可以是革兰氏阳性细菌或革兰氏阴性细菌。细菌可以是好氧细菌或厌氧细菌。细菌可以是自氧细菌或异氧细菌。细菌可以是嗜温菌、嗜中性菌、嗜极菌、嗜酸菌、嗜碱菌、嗜热菌、嗜冷菌、嗜盐菌或嗜高渗菌。
细菌可以是炭疽细菌、耐抗生素细菌、致病细菌、食物中毒细菌、传染性细菌、沙门氏菌属(Salmonella)细菌、葡萄球菌属细菌、链球菌属细菌或破伤风细菌。细菌可以是胸膜肺炎放线杆菌(Actinobacillus pleuropneumoniae)、炭疽杆菌(Bacillus anthracis)、结肠小袋纤毛虫(Balantidium coli)、多杀巴斯德菌(Pasteurella multocida)、鸭疫里默氏杆菌(Riemerella anatipestifer)、鼻气管炎鸟疫杆菌(Ornithobacterium rhinotracheale)、鸡毒支原体(Mycoplasma gallisepticum)、猪鼻支原体(Mycoplasma hyorhinis)、滑液囊支原体(Mycoplasma synoviae)、猪肺炎支原体(Mycoplasma hyopneumoniae)、犬支原体(Mycoplasma canis)、支气管炎博德特菌(Bordetella bronchiseptica)、短螺菌属(Brachyspira spp.)(优选是猪痢疾短螺旋体(B.hyodyentheriae)、结肠菌毛样短螺旋体(B.pilosicoli)、非致病性短螺旋体(B.innocens))、猪布鲁氏杆菌(Brucella suis)(优选是生化1型、2型和3型)、衣原体属和嗜衣原体属(Chlamydia and Chlamydophila sp.)(优选是反刍动物衣原体(C.pecorum)和流产嗜性衣原体(C.abortus))、梭菌属(Clostridium spp.)(优选是艰难梭菌(Cl.difficile)、产气荚膜菌A型、B型和C型(Cl.perfringens types A、B and C)、诺非氏梭菌(Cl.novyi)、腐败梭菌(Cl.septicum)、破伤风杆菌(Cl.tetani))、隐孢子虫(Cryptosporidium parvum)、艾美球虫属(Eimeria spp.)、猪附红细胞体(Eperythrozoonis suis)其现在称为猪嗜血支原体(Mycoplasma haemosuis)、猪红斑丹毒丝菌(Erysipelothrix rhusiopathiae)、大肠杆菌(Escherichia coli)、副猪嗜血杆菌(Haemophilus parasuis)(优选亚型1、7和14)、猪等孢球虫(lsospora suis)、胞内劳森氏菌(Lawsonia intracellularis)、溶血曼海姆菌(Mannheimia haemolytica)、分支杆菌属(Mycobacterium spp.)(优选是鸟结核分支杆菌(M.avium)、胞内分枝杆菌(M.intracellular)、结核分枝杆菌(M.tuberculosis)和牛分枝杆菌(M.bovis))、多杀巴斯德菌(Pasteurella multocida)、沙门氏菌属(Salmonella spp.)(优选是鼠伤寒沙门氏菌(S.thyhimurium)和猪霍乱沙门氏菌(S.choleraesuis))、葡萄球菌属(Staphylococcus spp.)(优选是家畜葡萄球菌(S.hyicus)、耐甲氧西林金黄色葡萄球菌(methicillin-resistant Staphylococcus aureus(MRSA))、链球菌属(Streptococcus spp.)(优选是猪链球菌(Strep.Suis))、耶尔森氏鼠疫杆菌(Yersinia pestis)。
(a)结核分支杆菌抗原
IL-17可以与结核分支杆菌抗原(即,TB抗原或TB免疫原)或其片段或其变体联合或组合。TB抗原可以来自TB抗原的Ag85家族,例如Ag85A和Ag85B。TB抗原可以来自TB抗原的Esx家族,例如EsxA、EsxB、EsxC、EsxD、EsxE、EsxF、EsxH、EsxO、EsxQ、EsxR、EsxS、EsxT、EsxU、EsxV以及EsxW,或它们的组合。
在一些实施方案中,TB抗原可以是编码来自Ag85家族和Esx家族的一种或多种结核分支杆菌免疫原的核酸分子(如质粒)。免疫原可以是全长蛋白质的全长或免疫原性片段。免疫原包含共有序列和/或用于改善表达的修饰。共有免疫原可包含信号肽如免疫球蛋白信号肽,如IgE或IgG信号肽,并且在一些实施方案中,可包含HA标签。
(b)胸膜肺炎放线杆菌抗原
IL-17可以与胸膜肺炎放线杆菌抗原或其片段或其变体联合或组合。在一些实施方案中,抗原选自外毒素ApxI、ApxII和ApxIII,单独地或组合地。在一些实施方案中,胸膜肺炎放线杆菌抗原可以是核酸如编码一个或多个胸膜肺炎放线杆菌抗原的质粒。抗原可以是全长蛋白质的全长或免疫原性片段。抗原可以包含共有序列和/或用于改善表达的修饰。共有抗原可包含信号肽如免疫球蛋白信号肽,如IgE或IgG信号肽,并且在一些实施方案中,可包含HA标签。
(4)真菌抗原
抗原可以是真菌抗原或其片段或变体。真菌可以是曲霉菌属(Aspergillus species)、皮炎芽生菌(Blastomyces dermatitidis)、假丝酵母(Candida yeasts)(例如,白色念珠菌(Candida albicans))、球孢子菌属(Coccidioides)、新型隐球菌(Cryptococcus neoformans)、格特隐球菌(Cryptococcus gattii)、皮肤真菌(dermatophyte)、镰刀菌属(Fusariumspecies)、荚膜组织胞浆菌(Histoplasma capsulatum)、毛霉菌亚门(Mucoromycotina)、耶氏肺孢子菌(Pneumocystis jirovecii)、申克孢子丝菌(Sporothrix schenckii)、明脐菌属(Exserohilum)或者枝孢菌属(Cladosporium)。
c.载体
疫苗可以包含一种或多种载体,所述载体包含编码抗原和佐剂的核酸。一种或多种载体可以能够表达抗原和佐剂。载体可以具有含有复制起点的核酸序列。载体可以是质粒、噬菌体、细菌人工染色体或酵母人工染色体。载体可以是自我复制染色体外载体抑或整合至宿主基因组中的载体。
一种或多种载体可以是表达构建体,所述表达构建体通常是用于将特定基因引入靶细胞中的质粒。一旦表达载体位于细胞内部,那么通过细胞转录和翻译机器核糖体复合物产生由基因编码的蛋白质。质粒经常经过工程改造以含有调控序列,所述调控序列充当增强子和启动子区域,并且导致表达载体上携带的基因的有效转录。本发明的载体表达大量稳定的信使RNA,和因此形成的蛋白质。
载体可具有表达信号(如强启动子、强终止密码子)、启动子与克隆基因之间的距离的调节以及转录终止序列和PTIS(可移动翻译起始序列)的插入。
(1)表达载体
载体可以是环状核酸(例如质粒)或线性核酸。环状核酸和线性核酸能够指导适当的受试者细胞中的特定核苷酸序列的表达。载体可以具有可操作地连接至编码抗原的核苷酸序列或编码佐剂的核苷酸序列的启动子,这些核苷酸序列可以可操作地连接至终止信号。载体还可以含有核苷酸序列的正确翻译所需的序列。包含目标核苷酸序列的载体可以是嵌合的,这意味着至少一种其组分相对于至少一种它的其它组分是异源的。表达盒中的核苷酸序列的表达可在组成型启动子或诱导型启动子的控制下,所述启动子仅在宿主细胞暴露于一些特定外部刺激时起始转录。在多细胞有机体的情况下,启动子还可以是对特定组织或器官或发育阶段特异性的。
(2)环状载体和线性载体
载体可以是环状质粒,所述环状质粒可通过整合至细胞基因组中来转化靶细胞或存在于染色体外(例如,具有复制起点的自主复制质粒)。
载体可以是pVAX、pcDNA3.0或provax,或能够表达编码抗原或佐剂的DNA并且使细胞能将序列翻译成由免疫系统识别的抗原或者佐剂的任何其它表达载体。
本文还提供能够经由电穿孔有效地递送至受试者并且表达一种或多种所需的抗原或者一种或多种所需的佐剂的线性核酸疫苗或线性表达盒(“LEC”)。LEC可以是没有任何磷酸主链的任何线性DNA。DNA可编码一种或多种抗原或者一种或多种佐剂。LEC可包含启动子、内含子、终止密码子和/或多腺苷酸化信号。抗原或佐剂的表达可由启动子控制。LEC可不包含任何抗生素抗性基因和/或磷酸主链。LEC可不包含与所需的抗原基因表达或所需的佐剂表达不相关的其它核酸序列。
LEC可源自能够线性化的任何质粒。质粒可能够表达抗原或佐剂。质粒可能够表达佐剂IL-17。质粒可以是pNP(Puerto Rico/34)或pM2(NewCaledonia/99)。质粒可以是WLV009、pVAX、pcDNA3.0或provax,或者能够表达编码抗原或编码佐剂的DNA并且使细胞能将序列翻译成由免疫系统识别的抗原或者佐剂的任何其它表达载体。
LEC可以是pcrM2。LEC可以是pcrNP。pcrNP和pcrMR可以分别源自pNP(Puerto Rico/34)和pM2(New Caledonia/99)。
表达载体也可以是重组病毒载体。这样的病毒载体可以生产自非致病性病毒如HVT、MDV、腺病毒、AAV、慢病毒、猪痘病毒,等。
(3)启动子、内含子、终止密码子和多腺苷酸化信号
载体可具有启动子。启动子可以是能够驱动基因表达并且调控所分离核酸的表达的任何启动子。所述启动子是经由DNA依赖性RNA聚合酶转录所需的顺式作用序列元件,所述顺式作用序列元件转录本文所描述的抗原序列或佐剂序列。用于指导异源核酸表达的启动子的选择取决于具体应用。在载体中,启动子可定位在距离转录起始点与其天然环境中距离转录起始位点大约相同的位置上。然而,可容许所述距离的变化只要不损失启动子功能即可。
启动子可以可操作地连接至编码抗原以及转录物的有效多腺苷酸化、核糖体结合位点和翻译终止所需的信号的核酸序列。启动子可以可操作地连接至编码佐剂和转录物的高效多腺苷酸化、核糖体结合位点和翻译终止所需的信号的核酸序列。
启动子可以是CMV启动子、SV40早期启动子、SV40晚期启动子、金属硫蛋白启动子、鼠乳腺肿瘤病毒启动子、劳斯(Rous)肉瘤病毒启动子、多角体蛋白启动子,或对于真核细胞中的表达显示有效的另一种启动子。
载体可包含增强子和具有功能性剪接供体和受体位点的内含子。载体可含有位于结构基因下游的转录终止区来提供有效终止。可从与启动子序列相同的基因获得或可从不同的基因获得终止区。
d.赋形剂和疫苗的其它组分
疫苗可进一步包含药学上可接受的赋形剂。药学上可接受的赋形剂可以是功能性分子,如媒介物、除IL-17之外的佐剂、载体或稀释剂。药学上可接受的赋形剂可以是转染促进剂,其可以包括表面活性剂,如免疫刺激复合物(ISCOMS)、弗氏不完全佐剂、LPS类似物(包括单磷酰脂质A)、胞壁酰肽、醌类似物、囊泡(如角鲨烯和角鲨烯)、透明质酸、脂质、脂质体、钙离子、病毒蛋白、聚阴离子、聚阳离子或纳米颗粒,或其它已知的转染促进剂。
转染促进剂是聚阴离子、聚阳离子(包括聚-L-谷氨酸盐(LGS))或脂质。转染促进剂是聚-L-谷氨酸盐,并且聚-L-谷氨酸盐可以小于6mg/ml的浓度存在于疫苗中。转染促进剂还可包括表面活性剂,如免疫刺激复合物(ISCOMS)、弗氏不完全佐剂、LPS类似物(包括单磷酰脂质A)、胞壁酰肽、醌类似物以及囊泡(如角鲨烯和角鲨烯),并且透明质酸还可结合基因构建体施用而使用。DNA质粒疫苗还可包含转染促进剂,如脂质、脂质体(包括卵磷脂脂质体或本领域已知的其它脂质体,如DNA-脂质体混合物(参见例如W09324640))、钙离子、病毒蛋白、聚阴离子、聚阳离子或纳米颗粒,或其它已知的转染促进剂。转染促进剂是聚阴离子、聚阳离子(包括聚-L-谷氨酸盐(LGS))或脂质。疫苗中的转染剂的浓度小于4mg/ml、小于2mg/ml、小于1mg/ml、小于0.750mg/ml、小于0.500mg/ml、小于0.250mg/ml、小于0.100mg/ml、小于0.050mg/ml或小于0.010mg/ml。
药学上可接受的赋形剂可以是除IL-17之外的佐剂。另外的佐剂可以是在替代性质粒中表达的或在疫苗中作为蛋白质与以上质粒组合递送的其它基因。佐剂可选自由以下各项组成的组:α-干扰素(IFN-α)、β-干扰素(IFN-β)、γ-干扰素、血小板衍生的生长因子(PDGF)、TNFα、TNFβ、GM-CSF、表皮生长因子(EGF)、皮肤T细胞虏获趋化因子(CTACK)、上皮胸腺表达趋化因子(TECK)、粘膜相关上皮趋化因子(MEC)、IL-12、IL-15、MHC、CD80、CD86(包括信号序列缺失的IL-15并且任选地包括来自IgE的信号肽)。佐剂可以是IL-12、IL-15、IL-28、CTACK、TECK、血小板衍生的生长因子(PDGF)、TNFα、TNFβ、GM-CSF、表皮生长因子(EGF)、IL-1、IL-2、IL-4、IL-5、IL-6、IL-10、IL-12、IL-18或其组合。
可以用作除IL-17之外的佐剂的其它基因包括编码以下各项的那些基因:MCP-1、MIP-la、MIP-1p、IL-8、RANTES、L-选择蛋白、P-选择蛋白、E-选择蛋白、CD34、GlyCAM-1、MadCAM-1、LFA-1、VLA-1、Mac-1、pl50.95、PECAM、ICAM-1、ICAM-2、ICAM-3、CD2、LFA-3、M-CSF、G-CSF、IL-4、IL-18的突变体形式、CD40、CD40L、血管生长因子、成纤维细胞生长因子、IL-7、IL-22、神经生长因子、血管内皮生长因子、Fas、TNF受体、Flt、Apo-1、p55、WSL-1、DR3、TRAMP、Apo-3、AIR、LARD、NGRF、DR4、DR5、KILLER、TRAIL-R2、TRICK2、DR6、半胱天冬酶ICE、Fos、c-jun、Sp-1、Ap-1、Ap-2、p38、p65Rel、MyD88、IRAK、TRAF6、IkB、无活性的NIK、SAP K、SAP-1、JNK、干扰素应答基因、NFkB、Bax、TRAIL、TRAILrec、TRAILrecDRC5、TRAIL-R3、TRAIL-R4、RANK、RANK LIGAND、Ox40、Ox40LIGAND、NKG2D、MICA、MICB、NKG2A、NKG2B、NKG2C、NKG2E、NKG2F、TAP1、TAP2以及其功能性片段。
疫苗可进一步包含如1994年4月1日提交的美国序列号021,579中所描述的基因疫苗促进剂,所述专利文献以引用的方式全部并入。
在特定的实施方案中,本发明的疫苗包含IL-17作为单一的佐剂。
可以根据待使用的施用方式来配制疫苗。可注射的疫苗药物组合物可以是无菌、不含热原并且不含微粒的。可以使用等渗制剂或溶液。用于等渗性的添加剂可以包括氯化钠、右旋糖、甘露醇、山梨醇和乳糖。疫苗可以包含血管收缩剂。等渗溶液可以包括磷酸盐缓冲盐水。疫苗可以进一步包含稳定剂(包括明胶和白蛋白)。稳定剂可以允许制剂在室温或环境温度下稳定持续延长的时间段,所述稳定剂包括LGS或聚阳离子或聚阴离子。
本发明的另外的目的涉及制备组合物的方法,包括可选地在可接受的赋形剂的存在下使抗原和IL-17蛋白或核酸混合。在特定的实施方案中,方法包括使1μg至10mg的抗原与0.001μg至约100μg的IL-17蛋白或核酸混合。
3.接种疫苗的方法
本发明还针对一种增加受试者中的免疫应答的方法。增强免疫应答可用于治疗和/或预防受试者的疾病。方法可以包括向受试者施用本文所公开的疫苗。与仅施用抗原的受试者相比,施用疫苗的受试者具有增加或增强的免疫应答。在一些实施方案中,免疫应答可以增加约0.5倍至约15倍、约0.5倍至约10倍,或者约0.5倍至约8倍。或者,施用疫苗的受试者中的免疫应答可以增加至少约0.5倍、至少约1.0倍、至少约1.5倍、至少约2.0倍、至少约2.5倍、至少约3.0倍、至少约3.5倍、至少约4.0倍、至少约4.5倍、至少约5.0倍、至少约5.5倍、至少约6.0倍、至少约6.5倍、至少约7.0倍、至少约7.5倍、至少约8.0倍、至少约8.5倍、至少约9.0倍、至少约9.5倍、至少约10.0倍、至少约10.5倍、至少约11.0倍、至少约11.5倍、至少约12.0倍、至少约12.5倍、至少约13.0倍、至少约13.5倍、至少约14.0倍、至少约14.5倍,或者至少约15.0倍。
在其它替代性实施方案中,施用疫苗的受试者中的免疫应答可以增加约50%至约1500%、约50%至约1000%,或者约50%至约800%。在其它实施方案中,施用疫苗的受试者中的免疫应答可以增加至少约50%、至少约100%、至少约150%、至少约200%、至少约250%、至少约300%、至少约350%、至少约400%、至少约450%、至少约500%、至少约550%、至少约600%、至少约650%、至少约700%、至少约750%、至少约800%、至少约850%、至少约900%、至少约950%、至少约1000%、至少约1050%、至少约1100%、至少约1150%、至少约1200%、至少约1250%、至少约1300%、至少约1350%、至少约1450%或者至少约1500%。
本发明还涉及用于向受试者接种疫苗的方法,或用于诱导获增加受试者中的免疫应答的方法,方法包括向需要其的受试者施用抗原和IL-17蛋白或核酸。可以一起或分别地(同时地或顺序地)施用抗原和IL-17蛋白或核酸。在一个特定的实施方案中,在抗原之前施用IL-17蛋白或核酸。可替代地或另外地,可以一起施用IL-17蛋白或核酸和抗原。此外,取决于受试者和病况,重复施用抗原和/或IL-17蛋白或核酸。
疫苗剂量可以是在1μg至10mg之间的活性组分/kg体重/时间,并且可以是20μg至10mg组分/kg体重/时间。可以每1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30或31天施用疫苗。用于有效治疗的疫苗剂量的数目可以是1、2、3、4、5、6、7、8、9或10。
a.施用
可以根据制药领域中的技术人员所熟知的标准技术来配制疫苗。所述组合物可以由医学领域的技术人员在考虑了如具体受试者的年龄、性别、体重和病状以及施用途径的这类因素之后,按其熟知的剂量和技术进行施用。受试者可以是哺乳动物,如人,或非人,如马、牛、猪、绵羊、猫、狗、大鼠、鸟或小鼠。
可以预防性地或治疗性地施用疫苗。在预防性施用中,可以足以诱导免疫应答的量施用疫苗。在治疗性应用中,以足以引起治疗效果的量向有需要的受试者施用疫苗。足以达到此目标的量定义为“治疗有效剂量”。对于这种用途有效的量取决于例如所施用的疫苗方案的具体组成、施用方式、疾病的阶段和严重程度、患者的总体健康状况以及处方医师的判断。
可以通过如文献中所描述的本领域熟知的方法来施用疫苗,所述文献如下:Donnelly等(Ann.Rev.Immunol.15:617-648(1997));Felgner等(美国专利号5,580,859,1996年12月3日发布);Felgner(美国专利号5,703,055,1997年12月30日发布);以及Carson等(美国专利号5,679,647,1997年10月21日发布),所有所述文献的内容以引用的方式整体并入本文。可以例如使用疫苗枪将疫苗的DNA与可以施用至个体的颗粒或珠粒进行复合。本领域的技术人员将知道药学上可接受的载体包括生理学上可接受的化合物的选择取决于例如表达载体的施用途径。
可以经由多种途径来递送疫苗。典型的递送途径包括肠胃外施用,例如,皮内、肌肉内或皮下递送。其它途径包括口服施用、鼻内和阴道内途径。特别是对于疫苗的DNA来说,可以将疫苗递送至个体的组织的间隙空间(Felgner等,美国专利号5,580,859和5,703,055,所有所述专利的内容以引用的方式整体并入本文)。还可以将疫苗施用至肌肉,或可以经由皮内或皮下注射或经皮(如通过离子电渗疗法)施用。还可以采用疫苗的表皮施用。表皮施用可以涉及机械地或化学地刺激表皮的最外层,以刺激对刺激物的免疫应答(Carson等,美国专利号5,679,647,所述专利的内容以引用的方式整体并入本文)。
还可以配制疫苗,用于经由鼻通道施用。适合用于经鼻施用的制剂(其中载体是固体)可以包括具有例如在约10微米至约500微米范围中的颗粒大小的粗糙粉末,所述粗糙粉末以其中采用鼻吸的方式来施用,即,通过鼻道从靠近鼻子的粉末的容器中快速吸入。制剂可以是鼻用喷雾剂、滴鼻剂或通过喷雾器进行气雾剂施用。制剂可以包含疫苗的水性溶液或油性溶液。
疫苗可以是液体制剂,如混悬剂、糖浆或酏剂。疫苗还可以是用于肠胃外、皮下、皮内、肌肉内或静脉内施用(例如,可注射施用)的制剂,如无菌混悬剂或乳剂。
疫苗可以掺入脂质体、微球体或其它聚合物基质中(Felgner等,美国专利号5,703,055;Gregoriadis,Liposome Technology,第I卷至第III卷(第二版,1993),所述文献的内容以引用的方式整体并入本文)。脂质体可以由磷脂或其它脂质组成,并且可以是制造和施用相对简单的无毒的、生理学上可接受的和可代谢的载体。
可以经由电穿孔,如通过美国专利号7,664,545中所描述的方法来施用疫苗,所述专利的内容以引用的方式并入本文。电穿孔可以通过美国专利号6,302,874、5,676,646、6,241,701、6,233,482、6,216,034、6,208,893、6,192,270、6,181,964、6,150,148、6,120,493、6,096,020、6,068,650和5,702,359中所描述的方法和/或装置来进行,所述专利的内容以引用的方式整体并入本文。可经由微创设备来进行电穿孔。
微创电穿孔设备(“MID”)可以是用于将以上所描述的疫苗和相关流体注射至身体组织中的装置。所述设备可包括中空针、DNA盒和流体递送部件,其中所述设备适于在使用中致动流体递送部件,以便在将针插入身体组织中的过程中同时(例如,自动地)将DNA注射至所述身体组织中。这具有以下优点:在插入针的同时逐渐注射DNA和相关流体的能力导致通过身体组织的流体的更均匀分布。由于注射的DNA分布在较大面积上,可减少注射过程中经受的疼痛。
MID可在不使用针的情况下将疫苗注射至组织中。MID可将疫苗作为小的流或射流以使得疫苗穿透组织的表面并且进入下层组织和/或肌肉的力进行注射。小的流或射流之后的力可由压缩气体(如在几分之一秒内通过微小孔的二氧化碳)的膨胀提供。微创电穿孔设备的实例和使用它们的方法在公布的美国专利申请号20080234655、美国专利号6,520,950、美国专利号7,171,264、美国专利号6,208,893、美国专利号6,009,347、美国专利号6,120,493、美国专利号7,245,963、美国专利号7,328,064和美国专利号6,763,264中进行描述,每个所述专利的内容以引用的方式并入本文。
MID可包括产生无痛地穿透组织的液体的高速射流的注射器。这类无针注射器可商购获得。本文可以使用的无针注射器的实例包括美国专利号3,805,783、4,447,223、5,505,697和4,342,310中所描述的那些,每个所述专利的内容以引用的方式并入本文。
可以使用无针注射器将呈适用于直接或间接电转运形式的所需的疫苗引入(例如注射)至待治疗的组织中,通常通过将组织表面与注射器接触,以便以足以导致疫苗渗透至组织中的力致动药剂射流的递送。例如,如果待治疗的组织是粘膜、皮肤或肌肉,那么将药剂朝向粘膜或皮肤表面以足以导致药剂渗透穿过角质层并且进入真皮层中或分别进入下层组织和肌肉中的力进行喷射。
无针注射器非常适合于将疫苗递送至所有类型的组织,特别是递送至皮肤和粘膜。在一些实施方案中,无针注射器可以用于将含有疫苗的液体推送至表面并且进入受试者的皮肤或粘膜中。可以使用本发明的方法治疗的各种类型的组织的代表性实例包括胰腺、喉、鼻咽、下咽部、口咽、唇、咽、肺、心脏、肾、肌肉、乳房、结肠、前列腺、胸腺、睾丸、皮肤、粘膜组织、卵巢、血管或其任何组合。
MID可具有将组织电穿孔的针电极。通过在多电极阵列(例如设置成矩形或正方形图案)中的多对电极之间脉冲来提供优于在一对电极之间脉冲的结果的改良的结果。例如在标题为“Needle Electrodes for Mediated Delivery of Drugs and Genes”的美国专利号5,702,359中公开的是针阵列,其中多对针可在治疗性治疗过程中进行脉冲。在所述应用中(其以引用的方式并入本文,如同其全文陈述一样),针安置在环形阵列中,但具有连接器和转换装置,从而实现相对对的针电极之间的脉冲。可使用用于将重组表达载体递送至细胞的一对针电极。这种设备和系统在美国专利号6,763,264中进行描述,所述专利的内容以引用的方式并入本文。或者,可使用单针设备,所述设备允许DNA注射和使用类似于正常注射针的单针电穿孔并且施加比通过目前所使用设备递送的电压低的电压的脉冲,从而减少患者经受的电感觉。
MID可包括一个或多个电极阵列。阵列可包括具有相同直径或不同直径的两个或多个针。针可均匀或不均匀地间隔开。针可介于0.005英寸与0.03英寸之间、0.01英寸与0.025英寸之间,或0.015英寸与0.020英寸之间。针的直径可以是0.0175英寸。针可间隔开0.5mm、1.0mm、1.5mm、2.0mm、2.5mm、3.0mm、3.5mm、4.0mm或更多。
MID可由脉冲发生器和在单个步骤中递送疫苗和电穿孔脉冲的两个或更多个针疫苗注射器组成。脉冲发生器可允许经由闪存卡操作的个人计算机灵活地编程脉冲和注射参数,以及电穿孔和患者数据的全面记录和储存。脉冲发生器可在短的时间段期间递送多种伏特脉冲。例如,脉冲发生器可递送100ms持续时间的三个15伏特脉冲。所述MID的实例是InovioBiomedical Corporation的Elgen 1000系统,所述系统在美国专利号7,328,064中进行描述,所述专利的内容以引用的方式并入本文。
MID可以是CELLECTRA(Inovio Pharmaceuticals,Blue Bell PA)设备和系统,其是便于将大分子(如DNA)引入身体或植物中选定组织的细胞中的模块化电极系统。模块化电极系统可包括多个针电极、皮下针、提供从可编程恒流脉冲控制器至多个针电极的导电链路的电连接器,以及电源。操作者可以握住安装在支撑结构上的多个针电极,并且将它们牢牢地插入到身体或植物中的选定组织中。然后经由皮下针将大分子递送到选定组织中。激活可编程恒流脉冲控制器,并且将恒流电脉冲施加至多个针电极。所施加的恒流电脉冲促进将大分子引入多个电极之间的细胞中。由于细胞的过度加热造成的细胞死亡通过借助于恒流脉冲限制组织中的功率消耗而得以最小化。Cellectra设备和系统在美国专利号7,245,963中进行描述,所述专利的内容以引用的方式并入本文。
MID可以是Elgen 1000系统(Inovio Pharmaceuticals)。Elgen 1000系统可包括提供中空针的设备;和流体递送部件,其中装置适于在使用中致动流体递送部件,以便在将针插入身体组织中的过程中同时(例如,自动地)将流体(本文所描述的疫苗)注射至所述身体组织中。优点是:在插入针的同时逐渐注射流体的能力导致通过身体组织的流体的更均匀分布。还据信,由于注射的流体的体积分布在较大面积上,减少了在注射过程中经受的疼痛。
此外,流体的自动注射有助于所注射流体的实际剂量的自动监测和配准。可以根据需要出于文件编制目的通过控制单元来储存这一数据。
应理解,注射速率可以是线性或非线性的,并且可在已经将针插入穿过待治疗的受试者的皮肤之后并且在将所述针进一步插入身体组织中时进行注射。
可通过本发明的装置将流体注射至其中的适合组织包括肿瘤组织、皮肤或肝组织,但也可以是肌肉组织。
装置进一步包括用于引导针插入身体组织中的针插入部件。通过针插入的速率来控制流体注射的速率。这具有以下优点:既可以控制针插入,又可以控制流体的注射,以使得可以根据需要使插入速率与注射速率相匹配。它还使装置更易于用户操作。如果需要,可以提供用于将针自动地插入身体组织中的部件。
用户可以选择何时开始流体的注射。然而,理想地,在针的尖端到达肌肉组织时开始注射,并且装置可包括用于感测针何时插入至足以开始注射流体的深度的部件。这意味着当针达到所需深度(其将通常是肌肉组织开始处的深度)时,可以提示以自动地开始流体的注射。肌肉组织开始处的深度可以(例如)采用为预设针插入深度(如4mm的值),所述深度将被认为是对于针穿过皮肤层来说是足够的。
感测部件可包括超声探针。感测部件可包括用于感测阻抗或电阻的变化的部件。在这种情况下,部件可不如此记录针在身体组织中的深度,而将相反适于随着针从不同类型的身体组织移动至肌肉中来感测阻抗或电阻的变化。这些替代方案中的任一个提供相对准确和简单地操作的感测可开始注射的部件。可以根据需要进一步记录针的插入深度,并且所述深度可以用于控制流体的注射,以使得根据正被记录的针的插入深度来确定待注射的流体的体积。
装置可进一步包括:用于支撑针的底座和用于在其中接纳底座的壳体,其中底座可相对于壳体移动,以使得当底座相对于壳体处于第一后方位置时,针缩回壳体内,并且当底座在壳体内处于第二前方位置时,针延伸出壳体外。由于壳体可以在患者的皮肤上对准,并且然后可以通过相对于底座移动壳体来将针插入患者的皮肤中,所以这对于用户来说是有利的。
如上所述,希望实现流体注射的受控速率,以使得在将针插入皮肤中时,流体在针的长度上均匀分布。流体递送部件可包括适于以受控速率注射流体的活塞驱动部件。可以例如通过伺服马达来激活活塞驱动部件。然而,可通过在轴向方向上相对于壳体移动的底座来致动活塞驱动部件。应理解,可以提供用于流体递送的替代装置。因此,例如可以提供可以被挤压用于以受控或非受控速率流体递送的的封闭容器来代替注射管和活塞系统。
以上所描述的装置可以用于任何类型的注射。然而,设想到它在电穿孔的领域中尤其有用,并且因此它可进一步包括用于向针施加电压的部件。这允许针不仅用于注射,而且还用作电穿孔过程中的电极。这一点是尤其有利的,因为它意味着电场被施加至与所注射的流体相同的面积上。传统上电穿孔存在很难准确地将电极与之前注射的流体对准的问题,并且因此用户倾向于在较大的面积上注射大于所要求的体积的流体,并且在较高的面积上施加电场,以试图确保所注射的物质与电场之间的重叠。使用本发明,可减少所注射流体的体积和所施加电场的大小,同时实现电场与流体之间的良好配合。
本发明的另外的目的是试剂盒,其包括第一容器和第二容器,所述第一容器包含抗原并且所述第二容器包含IL-17蛋白或核酸。
本发明还涉及试剂盒,其包括含有处于与IL-17蛋白或核酸的混合物中的抗原的第一容器和用于向受试者施用所述混合物的部件。部件可以是任何可注射装置,注射器、贴片、喷雾器,等。
本发明具有多个方面,所述方面通过以下非限制性实施例说明。
实施例
实施例1
IL-6和TNF-α
IL-17A可诱导为先天性免疫应答的一部分的细胞因子,例如,白细胞介素-6(IL-6)和肿瘤坏死因子α(TNF-α)。为了确定IL-17A是否可以提高或增加对病毒抗原(例如,“活的”或感染性流感病毒抗原)的免疫应答并因此充当佐剂,在施用感染性病毒抗原之前施用IL-17A蛋白。因此,疫苗包含rIL-17A和甲型流感病毒H5N1,其中在不同的时间施用疫苗的两种组分。具体地说,对从接受包含IL-17A的疫苗和不包含IL-17A的疫苗的小鼠收集的血清中的IL-6和TNF-α的水平进行测量。
将两组C57BL/6小鼠在施用感染性病毒抗原(或者用其进行激发)前第7天和第2天分别用0.1μg和0.5μg重组IL-17A(rIL-17A)进行腹膜内(i.p.)施用(或预处理)。具体地说,rIL-17A是小鼠IL-17A同源二聚体,并且感染性病毒抗原是甲型流感病毒H5N1。在第0天向两组小鼠施用5LD50的甲型流感病毒H5N1。将H5N1病毒经鼻施用至小鼠。
第三组C57BL/6小鼠充当对照,并且既不施用rIL-17A也不施用甲型流感病毒H5N1(即,未处理过的小鼠)。在6dpi时,从小鼠收集血清,并且测量所收集的血清中的IL-6和TNF-α水平。
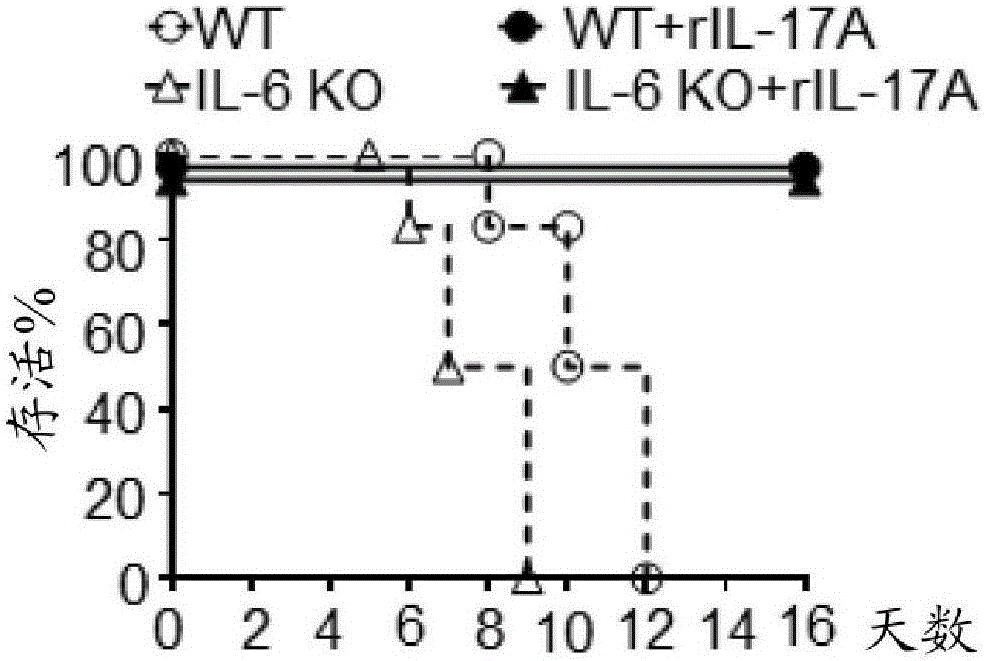
与未处理过的小鼠相比,在病毒激发前用rIL-17A预处理的小鼠的血清中具有增加的IL-6水平(图1A,**p<0.01)。IL-6水平的增加取决于预处理中所给予的rIL-17A的剂量,其中更高的rIL-17A剂量产生更高的血清IL-6水平。然而,用rIL-17A预处理并且用甲型流感病毒H5N1激发未改变TNF-α水平。
此外,将野生型(即,C57BL/6)小鼠、IL-6敲除的小鼠和TNFR1/2(即,TNF-α)敲除的小鼠单独地或与rIL-17A预处理组合用甲型流感病毒H5N1激发。然后测量感染之后的死亡率。如图1B中所示,野生型小鼠到约9dpi时死亡,而IL-6敲除的小鼠到12dpi时死亡。然而,100%的用rIL-17A预处理的野生型小鼠和IL-6敲除的小鼠经历甲型流感病毒H5N1激发仍然存活。这些数据指示虽然在用rIL-17A预处理之后,IL-6水平以剂量依赖性方式增加,但IL-6不是增加由包含IL-17A的疫苗所支持的免疫应答所需要的。
如图1C中所示,野生型小鼠和TNFR1/1敲除的小鼠分别到9dpi和12dpi时死亡。100%的用rIL-17A预处理的野生型小鼠和TNFR1/2敲除的小鼠经历甲型流感病毒H5N1激发仍然存活。这些数据指示TNF-α水平不响应于用rIL-17A预处理而变化,TNF-α也不是增加由包含IL-17A的疫苗所支持的免疫应答所需要的。
概括地说,包含IL-17A的疫苗不依赖于IL-6和TNF-α来增加对H5N1病毒的免疫应答(与不包含IL-17A的疫苗相比)。
实施例2
IFN-γ和IL-4
细胞因子,例如白细胞介素-4(IL-4)和干扰素-γ(IFN-γ),可控制由甲型流感病毒引起的感染。为了检查作为佐剂的IL-17A是否经由IL-4和IFN-γ来增加对抗原的免疫应答,对从施用包含IL-17A和甲型流感病毒H5N1或H7N9的疫苗和施用不包含IL-17A(即,仅甲型流感病毒H5N1或H7N9)的疫苗的小鼠收集的血清中的IL-4和IFN-γ的水平进行测量。
具体地说,将两组C57BL/6小鼠在病毒感染前第7天和第2天分别用0.1μg和0.5μg的rIL-17A进行腹膜内预处理。第三组C57BL/6小鼠不接受rIL-17A预处理。将三组小鼠在第0天用5LD50的甲型流感病毒H5N1进行激发。将H5N1病毒经鼻施用至小鼠。第四组C57BL/6小鼠充当对照,并且既不用rIL-17A预处理也不用甲型流感病毒H5N1激发(即,未处理过的小鼠)。在6dpi时,从小鼠收集血清,并且对所收集的血清中的IL-4和IFN-γ水平进行测量。
如图2A中所示,在四组小鼠之间没有观察到IL-4水平的显著性差异。图2A中的数据代表三次独立实验。与未处理过的小鼠相比,用甲型流感病毒H5N1激发的小鼠的IFN-γ水平增加。然而,与用甲型流感病毒H5N1激发的小鼠相比,IFN-γ水平响应于rIL-17A预处理而以剂量依赖性方式显著增加(图2A,*p<0.05(未配对的学生t检验))。用0.5μg的rIL-17A预处理的小鼠具有高于用0.1ug的rIL-17A预处理的小鼠、用H5N1激发的小鼠以及未处理过的小鼠的血清IFN-γ水平(图2A,分别约1.6倍、约3.25倍和约6.5倍的更高IFN-γ水平)。这些数据指示血清中的IFN-γ水平而不是IL-4水平响应于rIL-17A预处理而以剂量依赖性方式显著增加。
为了进一步检查IL-4和IFN-γ水平,重复以上实验,但用甲型流感病毒H7N9代替甲型流感病毒H5N1。具体地说,将两组C57BL/6小鼠在病毒感染前第7天和第2天分别用0.1μg和0.5μg的rIL-17A进行腹膜内预处理。第三组C57BL/6小鼠不接受rIL-17A预处理。将三组小鼠在第0天用10LD50的甲型流感病毒H7N9进行激发。将H7N9病毒经鼻施用至小鼠。第四组C57BL/6小鼠充当对照,并且既不用rIL-17A预处理也不用甲型流感病毒H7N9激发(即,未处理过的小鼠)。在6dpi时,从小鼠收集血清,并且对所收集的血清中的IL-4和IFN-γ水平进行测量。
如图2B中所示,在四组小鼠之间没有观察到IL-4水平的差异。图2B中的数据代表三次独立实验。IFN-γ水平在用甲型流感病毒H7N9激发的小鼠与在病毒激发前用0.1μg rIL-17预处理的小鼠之间具有可比性。然而,与未接受预处理的小鼠和用0.1μg rIL-17A预处理的小鼠相比,用0.5μgrIL-17A预处理的小鼠的IFN-γ水平显著增加(图2B,**p<0.01(未配对的学生t检验))。具体地说,与未接受用rIL-17A预处理的小鼠相比,用0.5μgrIL-17A预处理的小鼠具有约1.9倍的更高IFN-γ水平。这些数据指示血清中的IFN-γ水平而不是IL-4水平响应于rIL-17A预处理而以剂量依赖性方式显著增加。
为了进一步检查IFN-γ,将野生型(即,C56BL/6)和IFN-γ敲除的小鼠单独地或与rIL-17A预处理组合用甲型流感病毒H5N1进行激发。具体地说,将一组野生型小鼠(n=6)和一组IFN-γ敲除的小鼠(n=6)在病毒感染前第7天和第2天用0.5μg的rIL-17A进行腹膜内预处理。第二组野生型小鼠(n=6)和第二组IFN-γ敲除的小鼠(n=6)不接受rIL-17A预处理。将四组小鼠在第0天用5LD50的甲型流感病毒H5N1进行激发。将H5N1病毒经鼻施用至小鼠。在感染后针对死亡率每日监测小鼠持续16天。
如图2C中所示,用甲型流感病毒H5N1激发的野生型小鼠和IFN-γ敲除的小鼠分别到14dpi和10dpi时死亡。这一数据指示IFN-γ敲除的小鼠比野生型小鼠更易受H5N1病毒感染。此外,与未接受rIL-17A预处理的IFN-γ敲除的小鼠相比,用rIL-17A预处理IFN-γ敲除的小鼠延迟死亡。到16dpi时,约15%的用rIL-17A预处理的IFN-γ敲除的小鼠经历甲型流感病毒H5N1激发仍然存活。相比之下,100%的用rIL-17A预处理的野生型小鼠经历甲型流感病毒H5N1激发仍然存活。这些数据指示包含IL-17A的疫苗通过IFN-γ增强免疫应答。换句话说,IFN-γ是当疫苗包含IL-17A作为佐剂时提供增加的免疫应答所必需的。
概括地说,IL-4水平未响应于rIL-17A预处理而变化。然而,IFN-γ水平响应于rIL-17A预处理而以剂量依赖性方式增加,并且包含IL-17A作为佐剂的疫苗经由IFN-γ来支持增加的免疫应答。
实施例3
由CD8+T细胞和自然杀伤细胞产生的IFN-γ
在病毒感染过程中,IFN-γ可由CD4+T细胞、CD8+T细胞和/或自然杀伤(NK)细胞分泌。为了确定对由包含rIL-17A作为佐剂的疫苗诱导而增加的IFN-γ水平负责的一个或多个细胞群,在6dpi时检测IFN-γ阳性细胞。
具体地说,将野生型(即,C57BL/6)小鼠在施用病毒前第7天和第2天用0.5μg的rIL-17A进行腹膜内(i.p.)预处理。第二组C57BL/6小鼠不接受rIL-17A预处理。将这两组野生型小鼠加上一组IL-17A敲除的小鼠在第0天用5LD50的甲型流感病毒H5N1进行激发。将H5N1病毒经鼻施用至小鼠。另一组C57BL/6小鼠充当对照,并且既不用rIL-17A预处理也不用甲型流感病毒H5N1激发(即,未处理过的小鼠)。在6dpi时从四组小鼠分离脾细胞,并且用福尔马林灭活的甲型流感病毒H5N1在体外刺激脾细胞12小时(h)。通过流式细胞术测量由CD4+T细胞、CD8+T细胞或NK细胞分泌的IFN-γ,所述流式细胞术检测IFN-γ的细胞内染色。
如图3A中所示,与来自从接受不包含rIL-17A的疫苗(即,不接受rIL-17A预处理(但用病毒激发))的小鼠中分离的CD4+T细胞的IFN-γ分泌相比,来自从接受包含rIL-17A和病毒的疫苗(即,用rIL-17A预处理(并且用病毒激发))的C57BL/6小鼠中分离的CD4+T细胞的IFN-γ分泌被减少。因此,来自CD4+T细胞的IFN-γ分泌响应于rIL-17A预处理而减少。图3A中的数据代表三次独立实验。相比之下,与疫苗中不存在rIL-17A(即,不存在rIL-17A预处理)的情况相比,施用包含rIL-17A的疫苗(即,rIL-17A预处理)显著增加来自CD8+T细胞的IFN-γ分泌(图3A,**p<0.01)。与疫苗中不存在rIL-17A(即,不存在rIL-17A预处理)的情况相比,施用包含rIL-17A的疫苗(即,rIL-17A预处理)也显著增加来自NK细胞的IFN-γ分泌(图3A,*p<0.05)。因此,这些数据指示CD8+T细胞和NK细胞显著促成在由包含rIL-17A的疫苗所支持的增加的免疫应答中观察到的增加的IFN-γ水平。
因为CD8+T细胞响应于rIL-17A预处理而分泌IFN-γ,所以检查缺乏CD8+T细胞的小鼠(即,CD8敲除的小鼠)耐受甲型流感病毒H5N1激发的能力,来确定包含rIL-17A的疫苗是否经由CD8+T细胞增加对病毒抗原的免疫应答。具体地说,将野生型(即,C57BL/6)小鼠和CD8敲除的小鼠在施用病毒前第7天和第2天用0.5μg的rIL-17A进行腹膜内预处理。第二组C57BL/6小鼠和第二组CD8敲除的小鼠不接受rIL-17A预处理。将四组小鼠在第0天用5LD50的甲型流感病毒H5N1进行激发。将H5N1病毒经鼻施用至小鼠。在感染后针对死亡率每日监测小鼠持续16天。
如图3B中所示,用甲型流感病毒H5N1激发的野生型小鼠和CD8敲除的小鼠分别在12dpi和7dpi时死亡。这一数据指示CD8敲除的小鼠比野生型小鼠更易受H5N1病毒感染。此外,用rIL-17A预处理的CD8敲除的小鼠到8dpi时死亡,并且因此,与未接受rIL-17A预处理的CD8敲除的小鼠相比,用rIL-17A预处理CD8敲除的小鼠的死亡延迟1天(图3B)。如以上所观察,100%的用rIL-17A预处理的野生型小鼠经历甲型流感病毒H5N1激发仍然存活。这些数据指示包含rIL-17A的疫苗通过CD8+T细胞增加对甲型流感病毒的免疫应答。换句话说,CD8+T细胞是增加由包含IL-17A作为佐剂的疫苗所支持的免疫应答所必需的。
如以上所证明,NK细胞也响应于rIL-17A预处理而分泌IFN-γ。因此,检查缺失NK细胞的小鼠(即,抗NK 1.1小鼠)耐受甲型流感病毒H5N1激发的能力,来确定包含IL-17A作为佐剂的疫苗是否经由NK细胞增加对病毒的免疫应答。具体地说,检查四组C57BL/6小鼠。第一组C57BL/6小鼠既不缺失NK细胞也不用rIL-17A预处理。将第二组C57BL/6小鼠在施用病毒前第7天和第2天用0.5μg rIL-17A进行腹膜内预处理。将第三组C57BL/6小鼠在施用病毒前第7天、第3天和第1天用抗NK 1.1中和单克隆抗体进行腹膜内注射。将第四组C57BL/6小鼠在施用病毒前第7天、第3天和第1天用抗NK 1.1中和单克隆抗体进行腹膜内注射,并且在施用病毒前第7天和第2天用0.5μg的rIL-17A进行腹膜内预处理。将四组小鼠在第0天用5LD50的甲型流感病毒H5N1进行激发。将H5N1病毒经鼻施用至小鼠。在感染后针对死亡率每日监测小鼠持续16天。
如图3C中所示,用甲型流感病毒H5N1激发的野生型小鼠和NK缺失的(即,抗NK 1.1)小鼠分别到12dpi和9dpi时死亡。这一数据指示NK缺失的小鼠比野生型小鼠更易受H5N1病毒感染。到16dpi时,约70%的用rIL-17A预处理的NK缺失的小鼠(即,抗NK 1.1+rIL-17A)经历甲型流感病毒H5N1激发仍然存活(图3C)。100%的用rIL-17A预处理的野生型小鼠经历甲型流感病毒H5N1激发仍然存活。这些数据指示NK细胞在促进由包含rIL-17A作为佐剂的疫苗所提供的增加的免疫应答中起的作用(比CD8+T细胞)较小,因为与用rIL-17A预处理的野生型小鼠相比,缺失NK细胞但用rIL-17A预处理的小鼠具有适度降低的存活率(即,对病毒激发约100%相对于70%的存活率)。
概括地说,CD8+T细胞和NK细胞而不是CD4+T细胞的IFN-γ分泌响应于rIL-17A预处理而显著增加。因此,包含rIL-17A作为佐剂的疫苗经由由CD8+T细胞和NK细胞分泌的IFN-γ来增加对病毒的免疫应答,其中CD8+T细胞比NK细胞更有助于增强免疫应答。由包含rIL-17A作为佐剂的疫苗所支持的增加的免疫应答在不存在CD8+T细胞的情况下显著减小,但在不存在NK细胞的情况下适度减小。相反,在不存在CD8+T细胞的情况下,rIL-17A预处理延迟但不防止死亡。总之,这些数据指示产生IFN-γ的CD8+T细胞显著有助于增加由包含rIL-17A作为佐剂的疫苗所支持的对病毒的免疫应答。
实施例4
CD8+T细胞的过继转移
如以上所证明,包含IL-17A作为佐剂的疫苗增加对活病毒或感染性病毒的免疫应答,并且当在病毒之前施用IL-17A佐剂时,获得这种增加的免疫应答。这种增加的免疫应答由产生IFN-γ的CD8+T细胞促进。
如以下更详细地描述,过继转移用于进一步确立产生IFN-γ的CD8+T细胞促进由包含IL-17A作为佐剂的疫苗所支持的增加的免疫应答。在图4A中示出用于CD8+T细胞的过继转移的方案。
具体地说,将来自rIL-17A预处理的感染H5N1的小鼠或未处理的感染H5N1的小鼠的野生型CD8+T细胞过继转移到感染H5N1的野生型小鼠中。简单地说,将第一组C57BL/6(即,野生型)小鼠在病毒感染前第7天和第2天用0.5μg的rIL-17A进行腹膜内预处理。第二组C57BL/6小鼠不用rIL-17A预处理。第三组小鼠,即缺乏CD8+T细胞的小鼠(即,CD8敲除的小鼠)用作对照,并且也不用rIL-17A处理。将三组C57BL/6小鼠在第0天用5LD50的甲型流感病毒H5N1进行激发。将待接受过继转移的C57BL/6小鼠(即,受体小鼠)也在第0天用5LD50的甲型流感病毒H5N1进行激发。将H5N1病毒经鼻施用至小鼠。
在6dpi时,从用rIL-17A预处理的C57BL/6的小鼠(即,以上的第一组小鼠)中和从未接受rIL-17A预处理的C57BL/6的小鼠(即,以上的第二组小鼠)中分离CD8+T细胞。然后将从第一组小鼠中分离的1x 107个CD8+T细胞过继转移到已经感染甲型流感病毒H5N1持续6天的C57BL/6(即,野生型)小鼠中,并且每日监测这些受体小鼠(即,图4B中的WT CD8T细胞+rIL-17A)的死亡率直到16dpi。此外,将从第二组小鼠中分离的1x107个CD8+T细胞过继转移到已经感染甲型流感病毒H5N1持续6天的C57BL/6(即,野生型)小鼠中,并且每日监测这些受体小鼠(即,图4B中的WT CD8+T细胞)的死亡率直到16dpi。还针对死亡率每日监测CD8敲除的小鼠直到16dpi(即,图4B中的CD8KO)。
如图4B中所示(以及在实施例3和图3B中所观察到的),CD8敲除的小鼠在7dpi时死亡并且充当缺乏CD8+T细胞的小鼠的对照。图4B中的数据代表三次独立实验。接受来自第二组小鼠(即,未接受rIL-17A预处理但用甲型流感H5N1病毒激发的C57BL/6小鼠)的CD8+T细胞的受感染的C57BL/6小鼠在10dpi时死亡(图4B,WT CD8T细胞)。相比之下,50%的接受来自第一组小鼠(即,在用甲型流感H5N1病毒激发前用rIL-17A预处理的C57BL/6小鼠)的CD8+T细胞的受感染的C57BL/6小鼠在16dpi时存活(图4B,WT CD8T细胞+rIL-17A)。这些数据指示从用rIL-17A预处理的小鼠分离的CD8+T细胞给受体小鼠提供对病毒的增加的免疫应答。这些数据还指示在rIL-17A处理后,CD8+T细胞能够提供对甲型流感病毒的增加的免疫应答,即使在已经感染所述病毒的小鼠中。
此外,将来自在病毒激发前接受或未接受rIL-17A预处理的IFN-γ敲除的小鼠的CD8+T细胞过继转移到感染H5N1的野生型小鼠中,来进一步确立产生IFN-γ的CD8+T细胞有助于增加由包含rIL-17A作为佐剂的疫苗所支持的免疫应答。简单地说,将C57BL/6(即,野生型)小鼠在病毒感染前第7天和第2天用0.5μg的rIL-17A进行腹膜内预处理。将第一组IFN-γ敲除的小鼠也在病毒感染前第7天和第2天用0.5μg的rIL-17A进行腹膜内预处理。第二组IFN-γ敲除的小鼠不用rIL-17A预处理。将两组IFN-γ敲除的小鼠和rIL-17A预处理的C57BL/6小鼠在第0天用5LD50的甲型流感病毒H5N1进行激发。将待接受过继转移的C57BL/6(即,野生型)小鼠(即,受体小鼠)也在第0天用5LD50的甲型流感病毒H5N1进行激发。将H5N1病毒经鼻施用至小鼠。
在6dpi时,从用rIL-17A预处理的C57BL/6小鼠中分离CD8+T细胞,并且将1x 107个这些所分离细胞过继转移到已经感染甲型流感病毒H5N1持续6天的C57BL/6小鼠中。每日监测这些受体小鼠(即,图4C中的WTCD8T细胞+rIL-17A)的死亡率直到16dpi。
同样在6dpi时,从用rIL-17A预处理的IFN-γ敲除的小鼠(即,以上的第一组IFN-γ敲除的小鼠)中和从未接受rIL-17A预处理的IFN-γ敲除的小鼠(即,以上的第二组IFN-γ敲除的小鼠)中分离CD8+T细胞。然后将从第一组IFN-γ敲除的小鼠中分离的1x 107个CD8+T细胞过继转移到已经感染甲型流感病毒H5N1持续6天的C57BL/6(即,野生型)小鼠中。每日监测这些受体小鼠的死亡率直到16dpi(即,图4C中的IFN-γKO CD8T细胞+rIL-17A)。此外,将从第二组IFN-γ敲除的小鼠中分离的1x 107个CD8+T细胞过继转移到已经感染甲型流感病毒H5N1持续6天的C57BL/6(即,野生型小鼠)中。对于这些受体小鼠,每日监测死亡率直到16dpi(即,图4C中的IFN-γKO CD8T细胞)。
如图4C中所示(以及在图4B中所观察到的),50%的接受来自rIL-17A预处理的受感染的C57BL/6小鼠的CD8+T细胞的受感染的C57BL/6小鼠在16dpi时存活(即,图4C中的WT CD8T细胞+rIL-17A)。这一数据与以上所描述的并且在图4B中所示的观察结果一致,并且因此充当图4C的过继转移实验的阳性对照。图4C中的数据代表三次独立实验。
接受来自第二组IFN-γ敲除的小鼠(即,在病毒激发前未接受rIL-17A预处理的IFN-γ敲除的小鼠)的CD8+T细胞的受感染的C57BL/6小鼠在11dpi时死亡(图4C,IFN-γKO CD8T细胞)。这一数据指示不能产生IFN-γ并且源自未接受rIL-17预处理的小鼠的CD8+T细胞不能促进增加针对甲型流感H5N1病毒感染的免疫应答。接受来自第一组IFN-γ敲除的小鼠(即,在病毒激发前用rIL-17A预处理的IFN-γ敲除的小鼠)的CD8+T细胞的受感染的C57BL/6小鼠在12dpi时死亡(图4C,IFN-γKO CD8T细胞+rIL-17A)。这一数据指示不能产生IFN-γ并且源自用rIL-17A预处理的小鼠的CD8+T细胞不能促进增加针对甲型流感H5N1病毒感染的免疫。因此,由包含rIL-17A作为佐剂的疫苗所支持的增加的免疫应答由产生IFN-γ的CD8+T细胞促进,并且这种增加的免疫应答可(经由暴露于包含rIL-17A和病毒的疫苗的产生IFN-γ的CD8+T细胞的转移)转移至患有确定的病毒感染的小鼠。
概括地说,以上数据指示感染H5N1的小鼠在接受来自rIL-17预处理的小鼠的产生IFN-γ的CD8+T细胞之后恢复并且存活。接受不能产生IFN-γ的CD8+T细胞的感染H5N1的小鼠未从病毒感染中恢复和存活(无论是否用rIL-17预处理)。因此,产生IFN-γ的CD8+T细胞而不是那些不能产生IFN-γ的CD8+T细胞促进由包含IL-17A作为佐剂的疫苗所支持的增加的免疫应答。CD8+T细胞和从这些CD8+T细胞中产生的IFN-γ显著促成由包含IL-17A作为佐剂的疫苗所提供的增加的免疫应答。
实施例5
CD8+T细胞的溶解活性
细胞溶解性的CD8+T细胞还称为细胞溶解性T淋巴细胞(CTL)。CTL可以具有抗病毒活性。因此,针对细胞溶解活性检查产生IFN-γ的CD8+T细胞,其有助于由包含IL-17A作为佐剂的疫苗所支持的增加的免疫应答。具体地说,如以下所描述使用细胞溶解活性的体内和体外测定。
关于细胞溶解活性的体内测定,从未处理过的C57BL/6小鼠(即,既未接受rIL-17A预处理也未用流感病毒激发的小鼠)制备同源脾细胞。将同源脾细胞分成两组。将第一组同源脾细胞用灭活的甲型流感病毒H5N1进行脉冲,并且用10μM的羧基荧光素琥珀酰亚胺酯(CFSE,用于对细胞染色的荧光染料)进行标记。将第二组同源脾细胞用0.5μM的CFSE进行标记。将来自两组的相等数量的脾细胞混合在一起。
将野生型(即,C57BL/6)小鼠和缺乏CD8+T细胞的小鼠(即,CD8敲除的小鼠)在施用病毒前第7天和第2天用0.5μg的rIL-17A进行腹膜内预处理。第二组C57BL/6小鼠和第二组CD8敲除的小鼠不接受rIL-17A预处理。将四组小鼠在第0天用5LD50的甲型流感病毒H5N1进行激发。将H5N1病毒经鼻施用至小鼠。在6dpi时,将以上所描述的混合的脾细胞静脉内注射到这四组小鼠中。八小时之后,从受体小鼠中分离脾细胞,来确定体内抗原特异性细胞溶解的水平。
如图5A中所示,与未接受rIL-17A预处理的野生型小鼠相比,用rIL-17A预处理的野生型小鼠中的抗原特异性溶胞显著增加(即,分别为图5A中的WT和WT+rIL-17A)。图5A中的数据代表三次独立实验,平均值±SEM,并且***p<0.001(未配对的学生t-检验)。具体地说,rIL-17A预处理的野生型小鼠中的抗原特异性溶胞比未接受rIL-17A预处理的野生型小鼠中的抗原特异性溶胞高约4倍。这一数据指示rIL-17A预处理显著诱导CTL活性。换句话说,与不包含rIL-17A的疫苗相比,包含rIL-17A作为佐剂的疫苗显著诱导CTL活性。
此外,接受和未接受rIL-17A预处理的CD8敲除的小鼠具有类似水平的抗原特异性细胞溶解活性(图5A,分别为CD8KO+rIL-17A和CD8KO)。而且,无论是否接受rIL-17A预处理,CD8敲除的小鼠的抗原特异性溶胞水平低于野生型小鼠的所观察到的抗原特异性溶胞水平。因此,与野生型小鼠的CTL活性相比,接受和未接受rIL-17A预处理的CD8敲除的小鼠中的CTL活性均降低约2倍。概括地说,这些数据指示CD8+T细胞是细胞溶解活性所需要的,并且这种细胞溶解活性响应于rIL-17A预处理而显著增加。
为了进一步检查CD8+T细胞的细胞溶解活性,并且确定IFN-γ产生是否是细胞溶解活性所必需的,使用体外测定来评估不同CD8+T细胞群的细胞溶解活性。具体地说,将野生型小鼠和IFN-γ敲除的小鼠在施用病毒前第7天和第2天用0.5μg的rIL-17A进行腹膜内预处理。第二组野生型小鼠和第二组IFN-γ敲除的小鼠不接受rIL-17A预处理。将四组小鼠在第0天用5LD50的甲型流感病毒H5N1进行激发。将病毒经鼻施用至小鼠。在6dpi时,从四组小鼠中分离CD8+T细胞并且用作效应T细胞。
从未处理过的C57BL/6小鼠(即,既未接受rIL-17A预处理也未用流感病毒激发的小鼠)制备同源脾细胞。将同源脾细胞分成两组。将第一组同源脾细胞用灭活的甲型流感病毒H5N1进行脉冲并且用10μM的CFSE进行标记。将第二组同源脾细胞用0.5μM的CFSE进行标记并且充当阴性对照。
然后将第一组和第二组脾细胞独立地与从四组小鼠中的每组小鼠中分离的效应T细胞混合。在3天之后,通过流式细胞术分析特异性溶胞。
如图5B中所示,与从未接受rIL-17A预处理的野生型小鼠中分离的CD8+T细胞相比,从用rIL-17A预处理的野生型小鼠中分离的CD8+T细胞具有更高水平的抗原特异性溶胞(分别为图5B中的WT CD8和WTCD8+rIL-17A)。图5B中的数据代表三次独立实验,平均值±SEM,并且**p<0.01(未配对的学生t-检验)。这一数据指示rIL-17A预处理增加CD8+T细胞的细胞溶解活性,如也在以上所讨论的体内测定中所观察到的(图5A和5B)。与从rIL-17A预处理的野生型小鼠中分离的CD8+T细胞相比,不能产生IFN-γ的CD8+T细胞具有显著降低的水平的抗原特异性溶解活性(分别为图5B中的WT CD8+rIL-17A和IFN-γKO CD8)。此外,从rIL-17A预处理的IFN-γ敲除的小鼠中获得的CD8+T细胞具有与从未接受rIL-17A预处理的IFN-γ敲除的小鼠中分离的CD8+T细胞类似水平的抗原特异性溶解活性(分别为图5B中的IFN-γKO CD8+rIL-17A和IFN-γKOCD8)。与从rIL-17A预处理的野生型小鼠中分离的CD8+T细胞的CTL活性相比,从接受和未接受rIL-17A预处理的IFN-γ敲除的小鼠中分离的CD8+T细胞的CTL活性分别降低约3倍和约2倍。这些数据指示与野生型小鼠相比,CD8+T细胞的细胞溶解活性在IFN-γ敲除的小鼠中显著受损。这些数据还指示在没有IFN-γ产生的情况下,rIL-17A预处理未显著诱导CD8+T细胞的细胞溶解活性。
概括地说,从体内和体外抗原特异性溶胞测定获得的数据证明由rIL-17A预处理诱导的CD8+T细胞的细胞溶解活性取决于IFN-γ的产生。
因此,这些数据与来自以上实施例的数据一起证明,与不包含IL-17A的疫苗(即,在施用病毒之前没有IL-17A预处理)相比,包含IL-17A作为佐剂的疫苗(即,在施用病毒之前用rIL-17A进行预处理)增加了对病毒的免疫应答。由包含IL-17A作为佐剂的疫苗所提供的这种增加的免疫应答以剂量依赖性方式保护小鼠免于死亡。
由包含IL-17A作为佐剂的疫苗所提供的增加的免疫应答由具有抗原特异性细胞溶解活性的产生IFN-γ的CD8+T细胞促进。通过包含IL-17A作为佐剂的疫苗(即,通过IL-17A预处理)来诱导这些产生IFN-γ的细胞毒性CD8+T细胞。概括地说,包含IL-17A作为佐剂的疫苗显著诱导抗病毒免疫应答,所述抗病毒免疫应答进而保护(并治疗)接受所述疫苗的受试者免于流感病毒感染。
实施例6
IL-17A蛋白生产用于在实施例7-12中使用
将编码猪、牛、鸟、鼠科动物和人类IL-17A的cDNA亚克隆至pET28a载体中。每个cDNA都进行了密码子优化。将所产生构建体转化入BL21大肠杆菌(E.coli)中。对于每一个转化,选择最高表达IL-17A的克隆并且由所选择的克隆制备大接种(mast seeds)。进行小规模培养和IPTG诱导时间研究以确定用于蛋白表达和随后的纯化的条件。图6-图17示出研究中使用的mRNA序列、编码序列、氨基酸序列和核酸序列。
随后,以由小规模研究确定的最佳IPTG诱导进行中等规模的发酵(10升)。收获细菌并且从这些细菌中提取并纯化IL-17A。在这些中等规模的发酵研究中,发展了针对IL-17A的天然折叠过程。
在总结这些中等规模的发酵研究后,进行大规模发酵(50升)以生产IL-17A蛋白。对纯化和折叠的IL-17A进行质量控制研究,即浓度、纯度、内毒素和体外生物学活性。
实施例7
小鼠中IL-17A对抵抗猪繁殖和呼吸综合征(PRRS)的灭活疫苗的影响
图9和图14-图15示出在研究中使用的mRNA序列、编码序列、氨基酸序列和核酸序列。实施例7中使用的针对IL-17的序列是猪物种特异性的。
如上所述,与不包含IL-17A作为佐剂的疫苗相比,当IL-17A作为佐剂被包括在针对流感病毒的疫苗中时,提供了增强的或增加的免疫应答。为了进一步检测IL-17A用作佐剂的能力,将IL-17A包括在施用至小鼠的、抵抗猪繁殖和呼吸综合征(PRRS)的灭活疫苗中。具体地,将6至8周龄的昆明种小白鼠置于组中。每组4只动物。第一组接受乳化在油中的包含灭活的PRRS病毒(JXAI-R株)的疫苗。第二组小鼠接受乳化在油中的包含灭活的PRRS病毒(JXAI-R株)的疫苗和0.45μg/剂量的IL-17A蛋白。第三组小鼠接受乳化在油中的包含灭活的PRRS病毒(JXAI-R株)的疫苗和0.15μg/剂量的IL-17A蛋白。第四组小鼠接受乳化在油中的包含灭活的PRRS病毒(JXAI-R株)的疫苗和0.05μg/剂量的IL-17A蛋白。经由大腿中的肌内注射来施用疫苗。每次注射为100μl并且每只动物接受单次免疫。
在第-1、14、28和42天从每只小鼠采集血清样品,其中,在第0天免疫小鼠。在ELISA中测试血清以确定抗体滴度。在ELISA分析中使用的抗原是PRRS杀死的病毒。该ELISA的结果示于图18中。
这些数据表明,与接受不包含IL-17A的疫苗的动物相比,接受包含IL-17A的疫苗的那些动物中抗体滴度较高。此外,这种增加的抗体滴度取决于存在于疫苗中的IL-17A的剂量。0.45μg IL-17A在抗体滴度方面提供比0.15μg IL-17A更大的增加,反过来,0.15μg IL-17A在抗体滴度方面提供比0.05μg IL-17A更大的增加。因此,这些数据证明,与不包含IL-17A的疫苗相比,当IL-17A包含在疫苗中时,其增加抵抗病毒的反应性抗体的滴度。这些数据还证明,IL-17A的佐剂效果并不特定于流感病毒,其也增加对其他病毒例如PRRS的免疫应答。
实施例8
小猪中IL-17A对抵抗猪繁殖和呼吸综合征(PRRS)的灭活疫苗的影响
图9和图14-图15示出在研究中使用的mRNA序列、编码序列、氨基酸序列和核酸序列。
如上所述,在小鼠中,与不包含IL-17A的疫苗相比,在灭活的PRRS疫苗中包含IL-17A增强免疫应答。将这些研究延伸至小猪。具体地,将对PRRS病毒阴性的、约30日龄的35只小猪分为7组。经由检测PRRS病毒抗原的逆转录聚合酶链式反应(RT-PCR)分析和检测针对PRRS病毒的抗体的ELISA确定这些小猪对PRRS病毒呈阴性。第一组动物接受包含灭活的PRRS病毒的疫苗和3μg IL-17A蛋白。第二组动物接受包含灭活的PRRS病毒的疫苗和9μg IL-17A蛋白。第三组动物接受包含灭活的PRRS病毒的疫苗和27μg IL-17A蛋白。第四组动物接受包含PRRS病毒抗原的疫苗和9μg IL-17A蛋白。抗原是福尔马林杀死的PRRS病毒。第五组动物接受包含杀死的PRRS病毒的疫苗,即DHN(Dahuanong Veterinary Animal Health Corporation,大华农动物保健品有限公司,一家中国兽医疫苗公司)灭活疫苗。第六组动物接受生理盐水。第七组小鼠接受包含减毒PRRS病毒的疫苗,即DHN活减毒疫苗。PRRS病毒为JXAI-R株。
每只动物接受其各自疫苗的单次免疫,经由以2mL剂量的在颈部或耳中的肌内注射施用疫苗。在免疫后,观察每只动物持续至少三个连续日。观察包括记录每只动物的体温、饲料摄取和精神状态。
在免疫前和免疫后第14和28天采集血清样品,对于每个样品,采集不少于5mL的血清。通过间接ELISA在血清中检测针对PRRS病毒的抗体。来自该ELISA的结果示于图19中。与仅包含杀死的PRRS病毒的疫苗(即,第五组)相比,包含3μg或9μg的IL-17A的疫苗诱导了显著更高的抗PRRS病毒抗体的水平。由包含3μg的IL-17A的疫苗诱导的抗体应答与由包含减毒PRRS病毒的疫苗(即,第七组)诱导的抗体应答之间具有可比性。
还用PRRS病毒的NVDC-JXA1株激发第一、第二、第五和第七组的经免疫的小鼠。具体地,以3mL剂量,用大于或等于104.5TCID50/mL的病毒滴度激发动物。经由耳部肌肉施用病毒。在病毒激发后,每日观察动物持续21天,连同测量每日温度。该每日温度测量的结果示出于图20中。此外,在用杀死的PRRS病毒免疫的组(即,第五组)中,两只动物死亡,并且因此,该疫苗提供了在本研究中检查的四种疫苗中最差的保护(图20B,参见下降至0的线)。在用灭活的PRRS病毒和3μg的IL-17A免疫的组中也有两只动物死亡(即,第一组;图20C,参见下降至0的线),但是在与第五组动物相比较晚的时间点。因此,与仅包含杀死的PRRS病毒的疫苗相比,包含灭活的PRRS病毒和3μg的IL-17A的疫苗提供抵抗病毒激发的较大的保护。由包含灭活的PRRS病毒和9μg的IL-17A的疫苗以及仅包含减毒的PRRS病毒的疫苗提供了针对病毒激发的增强的保护。在保护动物免受病毒激发方面,这两种疫苗提供了类似的效力(图20A和图20D)。
概括地说,以上数据证明,当包含在疫苗中时,IL-17A增强对病毒的抗体应答,并且与不包含IL-17A的疫苗相比,提供对病毒激发增强的保护。
实施例9
IL-17A对针对猪圆环病毒2型的疫苗的影响
图6和图12示出在研究中使用的mRNA序列、编码序列、氨基酸序列和核酸序列。
如上所述,与不包含IL-17A的疫苗相比,在针对流感病毒和PRRS病毒的疫苗中包含IL-17A增强免疫应答和对病毒感染的保护。在小鼠中,关于针对猪圆环病毒2型(PCV2)的疫苗进一步检测IL-17A的这种佐剂效力。具体地,将如通过ELISA检测的针对PCV2的抗体为阴性的6至8周龄的健康雌性昆明种小鼠分组。如果针对PCV2抗体的ELISA不超过1:50,则认为该动物是对PCV2阴性的。每个组具有四只小鼠。第一组施用PCV2疫苗连同A15佐剂。A15佐剂是由Seppic公司(一家特许经营公司)生产并销售的一种佐剂。第二组小鼠施用PCV2疫苗连同0.05μg/剂量的IL-17A蛋白。第三组小鼠施用PCV2疫苗连同0.15μg/剂量的IL-17A蛋白。第四组小鼠施用PCV2疫苗连同0.45μg/剂量的IL-17A蛋白。第五组小鼠施用PCV2抗原而无任何佐剂。第六组小鼠施用生理盐水。PCV2抗原是为杀死的PCV2病毒的一种抗原。PCV2疫苗包含PCV2抗原和至少一种佐剂。在一个具体的实施方案中,佐剂是A15。
每只动物接受0.1mL/剂量的、在大腿肌肉中的单次免疫。抗原是PCV2LG病毒株。免疫后观察每只动物持续至少三个连续日。观察检查注射部位和动物移动。在第0、14、28、42、60、90和120天从每只动物获得血清。免疫发生于第0天。每个血清样品不少于100μL至200μL。通过间接ELISA测量血清中的针对PCV2的抗体。该ELISA分析的结果示于图21中。
这些数据表明,与在接受PCV2疫苗(即,第一组)的动物中测量的抗体滴度相比,在接受与PCV2疫苗组合的IL-17A剂量的动物(即,第二、三和四组)中测量的抗体滴度更高。具体的,0.45μg IL-17A诱导最高水平的针对PCV2的抗体。另外,与施用PCV2疫苗的组(即,第一组)相比,在施用与IL-17A组合的PCV2疫苗的组中的抗体应答的持续时间显著更长。具体地,0.45μg IL-17a诱导最长或最持久水平的抗PCV2抗体。概括地说,这些数据证明,与不包含IL-17A的疫苗相比,在疫苗中包含IL-17A增强免疫应答(例如,抗体滴度和抗体应答的持续时间)。
实施例10
IL-17A对针对猪圆环病毒2型的疫苗的影响
图6和图12示出在研究中使用的mRNA序列、编码序列、氨基酸序列和核酸序列。
如上所述,与仅PCV2疫苗相比,IL-17A与PCV2疫苗组合提供了增强的免疫应答。将PCV2疫苗和IL-17A的这些研究延伸至BALB/C小鼠中。将如通过针对PCV2抗体的ELISA检测的针对PCV2为阴性的5周龄雌性BALB/C小鼠分组。当ELISA中PCV2抗体滴度不超过1:50时,确定该小鼠是对PCV2阴性的。在每组中有6或7只小鼠。
第一组小鼠皮下接受PCV2疫苗。PCV2疫苗是PCV2抗原和A15佐剂。PCV2抗原是PCV2LG株,具体地,批次121129,IPMA,105.25TCID50/ml。第二组小鼠皮下接受PCV2疫苗和IL-17A的组合。第三组小鼠肌内接受PCV2疫苗。第四组小鼠肌内接受PCV2疫苗和IL-17A的组合。第五组小鼠接受生理盐水。在每次免疫时以0.5ml剂量的其各自疫苗免疫每只动物。每只动物接受两次免疫,其中,第一次免疫在第0天而第二次免疫在第21天。
在免疫后,连续观察动物持续至少三天。具体地,观察每只动物的注射部位和精神状态。在免疫前1天和第一次免疫后第21、35、49和63天从每只动物采集血清样品。通过间接免疫过氧化物酶单层分析(IPMA)和间接ELISA测试检测抗体。在以下表1和图22中示出针对第1、2、3、4和5免疫组中的每一个的抗体水平。图22是分为肌内免疫和皮下免疫的、表1中呈现的数据的图解说明。
表1:IL-17A+PCV2疫苗的抗体水平
表1中的数据和图22表明,当疫苗被皮下施用时,在疫苗中包含IL-17A作为佐剂提高抗体滴度。当疫苗被肌内施用时,IL-17A是较不有效的佐剂。概括地说,这些数据示出,与不包含IL-17A并且肌内施用的疫苗相比,包含IL-17A并且皮下施用的疫苗激发更高的抗体滴度。这些数据还证明,关于PCV2疫苗,IL-17A以组织特异性的方式发挥其佐剂作用,即,与施用的肌内途径相比,经由施用的皮下途径激发了更高的滴度。
实施例11
IL-17A对猪口蹄疫(FMD)灭活疫苗的影响
图9和图15示出在研究中使用的mRNA序列、编码序列、氨基酸序列和核酸序列。
如上所述,当包含在疫苗中时,IL-17A增加了针对流感、PRRS病毒和PCV2疫苗的免疫应答。为了进一步检测IL-17A的佐剂效果,在6至8周龄的昆明种小鼠中检测了口蹄疫(FMD)灭活疫苗。具体地,FMD灭活疫苗是杀死的猪FMD O型疫苗。这是针对猪FMD O型(OZK/93)株的疫苗。该疫苗由中国畜牧业有限公司和股份公司兰州制药厂(China Animal Husbandry Industry Limited and Share Ltd Lanzhou pharmaceutical factory)生产。其是批号为1009002的疫苗。
每组具有三只小鼠。第一组接受上述FMD灭活疫苗。第二组接受FMD灭活疫苗和IL-17A(0.45μg/剂量)。第三组接受FMD灭活疫苗和IL-17A(0.15μg/剂量)。第四组接受FMD灭活疫苗和IL-17A(0.05μg/剂量)。第五组接受生理盐水。每只动物经由肌内注射施用其各自免疫。每次注射为100μl。每只动物接受单次免疫。
在第0天于免疫前从每只动物采集血清样品。也在第14、28和42天从每只动物采集血清样品。通过ELISA分析和猪FMD O型VP1结构蛋白液相阻断ELISA抗体测试测量抗体滴度。来自以上测量的结果示于图23中。
这些结果表面,关于抗体滴度和抗体应答的持续时间,在免疫中包含IL-17A增加了抗原的免疫原性。具体地,与仅接受FMD疫苗的组相比,在接受与FMD疫苗组合的IL-17A的组中,抗FMD病毒抗体的水平更高。在此研究中检测的IL-17A的三个剂量中,0.15μg/剂量的IL-17A诱导最高水平的抗FMD病毒抗体。
另外,与当IL-17A不包括在免疫中时相比,当IL-17A包括在免疫中时,对FMD疫苗的抗体应答的持续时间更长。0.15μg/剂量的IL-17A诱导持久水平的抗FMD病毒抗体。
概括地说,这些数据表明,与不包含IL-17A的疫苗相比,在疫苗中包含IL-17A激发增强的免疫应答(例如,抗体滴度和持续时间)。这些数据还进一步表明,IL-17A提供其佐剂作用而不依赖于免疫原的特性(identity),因为当IL-17A包含在针对流感病毒、PRRS病毒、PCV2和FMD病毒的疫苗接种中时,观察到了增强的免疫应答。
实施例12
IL-17A对猪胸膜肺炎放线杆菌(APX I、II和III)疫苗的影响
如上所述,与不包含IL-17A的疫苗相比,在疫苗中包含IL-17A增加对免疫原的免疫应答。为了进一步检验IL-17A的佐剂效果,研究了14种佐剂对猪胸膜肺炎放线杆菌疫苗(即,Apx I、Apx II和Apx III)的影响。
具体地,猪研究包括两个组:
第一组用包含生理盐水、胃乳(Alugel)和抗原(即,Apx I、Apx II或Apx III)的制剂接种疫苗。AlOH为21%。
第二组用包含生理盐水、胃乳、抗原(即,Apx I、Apx II或Apx III)和IL-17A的制剂接种疫苗。IL-17A为15%而AlOH为21%。
每个免疫组包含5只三周龄的小猪,其易感于胸膜肺炎放线杆菌。每只小猪在第0天和第21天再次经由肌内免疫接种2ml剂量接受其各自的疫苗。在第21天(第一次免疫后)采集血样。针对每个样品进行血清学测试。血清学测试是关于针对Apx I、Apx II或Apx III的抗体。这些血清学测试的结果证明,与未用IL17免疫接种的小猪相比,用包含IL17的制剂免疫接种的所有小猪激发了至少两倍更高水平的抗体滴度。这些结果因此示出,IL17可以增加至少100%的在体内针对细胞抗原产生的免疫应答。
所公开的实施方案的各种变化和修改对于本领域技术人员来说将是显而易见的。可以在不背离本发明的精神和范围的情况下做出这类变化和修改,包括但不限于与本发明的化学结构、取代基、衍生物、中间体、合成、组合物、制剂或使用的方法有关的那些变化和修改。
- 还没有人留言评论。精彩留言会获得点赞!