具有减震元件的自助注射器的制作方法
本申请主张2014年5月7日申请的美国临时专利申请第61/990,063号的申请日权益。美国临时专利申请第61/990,063号的内容以全文引用的方式明确并入本文中。
技术领域
本公开涉及用于药物投递的注射装置。更特定来说,本公开涉及用于药物投递的注射装置,其包含在注射装置的操作期间减少震动的阻尼机构。
背景技术:
自助注射器和在体注射器在投递治疗方面提供若干益处。所述益处中的一者可包含与例如使用常规针筒的传统投递方法相比之下的使用简易性。
许多注射器系统使用线圈和其他弹簧结构以为例如针插入和流体投递等功能提供致动能量。弹簧的使用可提供简易性和低成本的益处,但可具有某些限制。
在弹簧致动器中在力与位移之间存在线性关系。为了在柱塞行程的末尾处提供用于药物投递的足够能量,可能在药物投递开始时将过多量的能量输入到系统。
此外,当经由自助注射器投递较高粘度药物时,必需的弹簧力将可能增加。具有较高弹簧常数的弹簧将更多的力传输到药物产品和主要容器。因为动能与速度的平方成比例,所以甚至弹簧常数的递增可导致施加到药物和主要容器的净动能的较大改变。
患者可将此过多的能量感觉为“拍击”或类似的物理“撞击”,因为弹簧驱动的柱塞碰撞储存药物的主要容器的止动件。已知此类机械撞击还可使注射器的用户分心或干扰所述用户,且可因此阻止恰当的剂量完成。因此需要消除此类干扰。
进一步已知由过多的能量产生的“拍击”和“撞击”可导致灾难效应,例如由剪切负荷导致的主要容器的破裂和药物产品损坏。此外,高力弹簧可在药物产品上产生高剪切速率。在一些情况下,此高剪切速率是不合意的。
因此,需要一种自助注射器,其可在与主要容器的止动件碰撞之前在维持既定的弹簧力负荷的同时减小柱塞的速度。此类自助注射器可潜在地使用起来更舒适且更安全,且适用于更大范围的药物。
技术实现要素:
本文公开的是用于药物投递的注射装置以及方法和系统。在本公开内,可参考“自助注射器”;然而,还应将此参考理解为是指描述内容适用的在体注射器。在各种实施例中,所述装置可包括:容器或贮存器,其用于储存药物,所述容器包括可移动地安置在所述容器中以用于排出所述药物的止动件;注射驱动机构,其包括用于作用在所述止动件上的柱塞,和用于向所述柱塞施加力以致使所述柱塞作用在所述止动件上以排出所述药物的能量源,所述力致使所述柱塞在作用在所述止动件上之前加速到一速度;以及阻尼机构,其用于在作用在所述止动件上之前减小所述柱塞的所述速度,所述阻尼机构包括外壳、可在所述外壳中移动且由所述柱塞作用的活塞组合件,和工作流体,所述工作流体可由所述活塞组合件移位以用于抵制所述柱塞的移动。所述容器或贮存器可含有药物或药剂,且可为药筒或预填充针筒。
在各种其他实施例中,所述装置可包括:容器,其用于储存药物,所述容器包括可移动地安置在所述容器中以用于排出所述药物的止动件;注射驱动机构,其包括用于作用在所述止动件上的柱塞,和用于向所述柱塞施加力以致使所述柱塞作用在所述止动件上以排出所述药物的能量源,所述力致使所述柱塞在作用在所述止动件上之前加速到一速度;以及阻尼机构,其用于在作用在所述止动件上之前减小所述柱塞的所述速度,所述阻尼机构包括安置在所述柱塞上的能量吸收材料。
在仍其他实施例中,所述注射装置可包括:容器,其用于储存药物,所述容器包括可移动地安置在所述容器中以用于排出所述药物的止动件;注射驱动机构,其包括用于作用在所述止动件上的柱塞,和用于向所述柱塞施加力以致使所述柱塞作用在所述止动件上以排出所述药物的能量源,所述力致使所述柱塞在作用在所述止动件上之前加速到一速度;外部罩壳,其用于包住所述容器,所述外部罩壳包含用于将容器保持在所述外部罩壳内的至少一个支撑部件,和阻尼机构,所述阻尼机构用于减小由所述能量源施加到所述容器的能量,所述阻尼机构包括吸收材料,所述吸收材料安置在所述至少一个支撑部件与所述容器之间和/或所述外部罩壳与所述容器之间。
附图说明
图1是根据本公开的用于药物投递的注射装置的示范性实施例的部分横截面的正视图。
图2是展示包括减震器的驱动阻尼机构的示范性实施例的注射装置的区段的横截面透视图,所述驱动阻尼机构可用于注射装置的各种实施例中。
图3A到3C是描绘图2的减震器和注射装置的操作的示范性模式的横截面侧视图。
图4A到4C是在根据本公开的另一实施例的注射装置中实施的类似于图2中所示的减震器的另一减震器的横截面侧视图,且描绘所述减震器和注射装置的操作的示范性模式。
图5A到5C是本公开的减震器的另一实施例的横截面侧视图,且描绘所述减震器和注射装置的操作的示范性模式。
图6是展示可用于注射装置的各种实施例中的减震器的另一示范性实施例的注射装置的区段的横截面透视图。
图7是展示可用于注射装置的各种实施例中的减震器的另一示范性实施例的注射装置的区段的横截面透视图。
图8A是展示驱动阻尼机构的不同示范性实施例的注射装置的横截面透视图。
图8B是图8A中所示的注射装置的区段的放大视图。
图9A是展示根据本公开的示范性实施例的约束的减震器的活塞的示范性实施例的透视图。
图9B是展示根据本公开的另一示范性实施例的约束的减震器的活塞的另一示范性实施例的透视图。
图10是展示驱动阻尼机构的另一示范性实施例的注射装置的区段的横截面图。
在图式中使用相同的参考数字来识别各种实施例中的相同或类似的元件和结构。
具体实施方式
本文公开的是用于药物投递的注射装置。在一个实施例中,所述注射装置包括:容器,其用于储存药物,所述容器包括可移动地安置在所述容器中以用于排出所述药物的止动件;注射驱动机构,其包括用于作用在所述止动件上的柱塞,和用于向所述柱塞施加力以致使所述柱塞作用在所述止动件上以排出所述药物的能量源,所述力致使所述柱塞在作用在所述止动件上之前加速到一速度;以及阻尼机构,其用于在作用在所述止动件上之前减小所述柱塞的所述速度,所述阻尼机构包括外壳、可在所述外壳中移动且由所述柱塞作用的活塞组合件,和工作流体,所述工作流体可由所述活塞组合件移位以用于抵制所述柱塞的移动。
在一些实施例中,所述能量源包括一或多个弹簧。
在一些实施例中,所述能量源包括气体压力或气体释放布置。
在一些实施例中,所述阻尼机构安置在所述止动件与所述柱塞之间。
在一些实施例中,所述阻尼机构安置在所述柱塞的与所述止动件相对的末端处。
在一些实施例中,所述阻尼机构与所述柱塞成一体。
在一些实施例中,所述活塞组合件包含活塞和用于推动或拉动所述活塞的杆。
在一些实施例中,所述活塞组合件包含圆盘状活塞。
在一些实施例中,所述活塞是刚性的。
在一些实施例中,所述活塞包含至少一个约束。
在一些实施例中,所述至少一个约束处于所述活塞的外围边缘中。
在一些实施例中,所述至少一个约束处于所述活塞中。
在一些实施例中,所述注射装置进一步包括在所述活塞的所述外围边缘与所述外壳之间的约束。
在一些实施例中,所述活塞是弹性的。
在一些实施例中,所述活塞是多孔的。
在一些实施例中,所述活塞组合件包含圆盘状活塞和用于推动或拉动所述活塞的杆。
在一些实施例中,所述活塞组合件包含包括两个或更多圆盘状部件的活塞。
在一些实施例中,所述圆盘状部件是刚性的。
在一些实施例中,所述圆盘状部件中的每一者包含至少一个约束。
在一些实施例中,所述至少一个约束处于所述圆盘状部件中的至少一者的外围边缘中。
在一些实施例中,所述至少一个约束处于所述圆盘状部件中的至少一者中。
在一些实施例中,所述注射装置进一步包括在所述部件中的至少一者的所述外围边缘与所述外壳之间的约束。
在一些实施例中,所述圆盘状部件是弹性的。
在一些实施例中,所述圆盘状部件是多孔的。
在一些实施例中,所述活塞组合件包含活塞和用于推动或拉动所述活塞的杆,所述活塞包括两个或更多圆盘状部件。
在一些实施例中,所述活塞组合件包含包括波纹管结构的活塞。
在一些实施例中,所述波纹管结构包含至少两个瓣和用于允许所述工作流体在所述两个瓣之间流动的约束。
在一些实施例中,所述活塞组合件包含活塞和用于推动或拉动所述活塞的杆,所述活塞包括波纹管结构。
在一些实施例中,所述波纹管结构包含至少两个瓣和用于允许所述工作流体在所述两个瓣之间流动的约束。
在一些实施例中,所述杆是中空的,以允许从所述波纹管结构排放所述工作流体。
在一些实施例中,所述杆是中空的,以允许从所述波纹管结构排放所述工作流体。
在一些实施例中,所述容器进一步包括剂量投递部件。
在一些实施例中,所述剂量投递部件包括注射针。
在一些实施例中,所述注射装置进一步包括用于激活所述注射驱动机构的触发机构。
在一些实施例中,所述注射装置进一步包括用于防止与所述剂量投递部件接触的防护机构。
在一些实施例中,所述注射装置进一步包括用于包住所述容器的外部罩壳,所述外部罩壳包含用于将容器保持在所述外部罩壳内的至少一个支撑部件,和安置在所述至少一个支撑部件与所述容器之间的能量吸收材料。
在一些实施例中,所述注射装置进一步包括用于包住所述容器的外部罩壳,和安置在所述外部罩壳与所述容器之间的能量吸收材料。
在一些实施例中,所述能量吸收材料包括一层阻尼材料。
在一些实施例中,所述能量吸收材料包括由两层或更多层阻尼材料形成的叠层。
在一些实施例中,所述叠层的层可具有相同或不同的阻尼特性。
在另一实施例中,所述注射装置包括:容器,其用于储存药物,所述容器包括可移动地安置在所述容器中以用于排出所述药物的止动件;注射驱动机构,其包括用于作用在所述止动件上的柱塞,和用于向所述柱塞施加力以致使所述柱塞作用在所述止动件上以排出所述药物的能量源,所述力致使所述柱塞在作用在所述止动件上之前加速到一速度;以及阻尼机构,其用于在作用在所述止动件上之前减小所述柱塞的所述速度,所述阻尼机构包括安置在所述柱塞上的能量吸收材料。
在另一实施例中,所述注射装置包括:容器,其用于储存药物,所述容器包括可移动地安置在所述容器中以用于排出所述药物的止动件;注射驱动机构,其包括用于作用在所述止动件上的柱塞,和用于向所述柱塞施加力以致使所述柱塞作用在所述止动件上以排出所述药物的能量源,所述力致使所述柱塞在作用在所述止动件上之前加速到一速度;外部罩壳,其用于包住所述容器;以及阻尼机构,其用于减小由所述能量源施加到所述容器的能量,所述阻尼机构包括安置在所述外部罩壳与所述容器之间的吸收材料。
在一些实施例中,所述外部罩壳包含用于将所述容器保持在所述外部罩壳内的至少一个支撑部件,其中所述能量吸收材料安置在所述至少一个支撑部件与所述容器之间。
在一些实施例中,所述注射装置进一步包括:外部罩壳;套管,其安置在所述外部罩壳内,所述容器安装在所述套管中;以及第一能量吸收或阻尼材料条带,其安置在所述容器与所述套管之间,处于所述容器和所述套管彼此接触的位置。
在一些实施例中,所述套管包含容器支撑凸缘,且所述容器包含边沿凸缘,所述第一能量吸收或阻尼材料条带安置在所述容器支撑凸缘与所述边沿凸缘之间。
在一些实施例中,所述注射装置进一步包括第二能量吸收或阻尼材料条带,其安置在所述套管与所述外部罩壳之间,处于所述套管和所述外部罩壳彼此接触的位置。
在一些实施例中,所述套管包含罩壳啮合凸缘,且所述外部罩壳包含支撑部件,所述第二能量吸收或阻尼材料条带安置在所述罩壳啮合凸缘与所述支撑部件之间。
在一些实施例中,所述注射装置进一步包括储存在所述容器中的药物。
在一些实施例中,所述药物选自由以下各者组成的群组:TNF抑制剂、降钙素基因相关肽受体的抗体、集落刺激因子、红细胞生成刺激剂、爱佩琳受体激动剂、抗胸腺基质淋巴细胞生成素抗体、抗胸腺基质淋巴细胞生成素受体抗体、结合人类前蛋白转化酶枯草杆菌蛋白酶/第9型科星的抗体和金属蛋白酶组织抑制剂。
本文进一步公开的是一种用于配给药物的方法。所述方法包括:提供容器,所述容器含有药物和可移动地安置在所述容器中以用于排出所述药物的止动件;使用由能量源驱动的柱塞作用在所述止动件上,所述能量源向所述柱塞施加力,所述力致使所述柱塞在作用在所述止动件上之前加速到一速度;以及使用阻尼机构在作用在所述止动件上之前减小所述柱塞的所述速度,所述阻尼机构包括可在外壳中移动且由所述柱塞作用的活塞组合件,和工作流体,所述工作流体可由所述活塞组合件移位以用于抵制所述柱塞的移动。
在一些实施例中,所述药物选自由以下各者组成的群组:TNF抑制剂、降钙素基因相关肽受体的抗体、集落刺激因子、红细胞生成刺激剂、爱佩琳受体激动剂、抗胸腺基质淋巴细胞生成素抗体、抗胸腺基质淋巴细胞生成素受体抗体、结合人类前蛋白转化酶枯草杆菌蛋白酶/第9型科星的抗体和金属蛋白酶组织抑制剂。
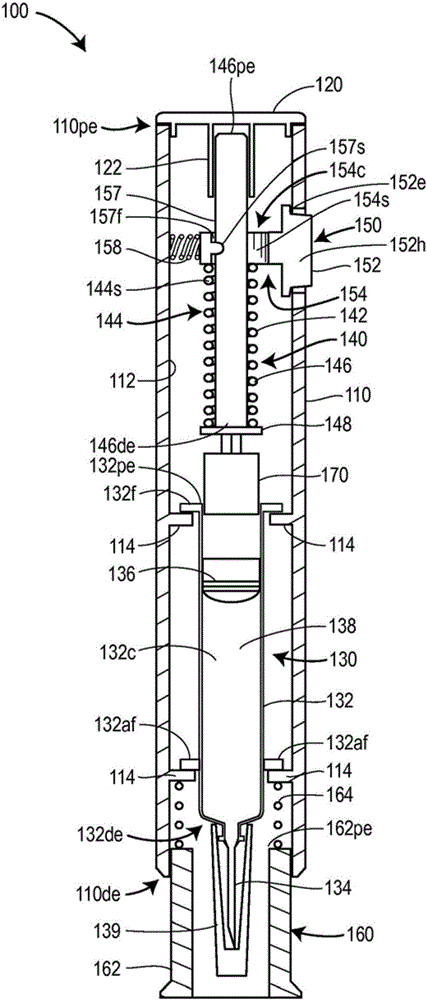
图1展示根据本公开的注射装置100的示范性实施例。注射装置100可被调适为单次使用的一次性注射器或多次使用的可再使用的注射器。注射装置100可被调适成投递任何合适的药剂或药物,包含具有高粘度的药剂或药物。注射装置100可由看护者或经过正式培训的保健提供者使用以配给注射。另外,注射装置100可被调适成用作用于自我给药的自助注射器。
参看图1,注射装置100可包含细长外壳或外部罩壳110。注射装置100可进一步包含以下各者中的一或多者:药物储存装置130(例如,针筒)、注射驱动机构140、驱动触发机构150、防护机构160,或驱动阻尼器机构170,其各自被包在外部罩壳110中。
外部罩壳110可为单个一体组件,或多组件组合件。如图1中所示,外部罩壳110具有内部表面112,所述内部表面可包含一或多个支撑部件114,其固定地安置在所述内部表面上以用于以固定的方式将药物储存装置130保持在外部罩壳110内。在一些实施例中,支撑部件114中的一或多者可包括连续环形突架或搁架。在其他实施例中,支撑部件114中的一或多者可形成为两个或更多共面突架或搁架片段。
在一些实施例中,支撑部件114中的一或多者可被配置为用于药物储存装置130的载架。载架可被配置和调适成轴向地移动和/或允许药物储存装置130相对于外部罩壳110移动,以在已经将注射装置100适当地定位在身体上的选定注射部位处之后将与药物储存装置130相关联的剂量投递部件134插入到用户或患者身体中。
仍参看图1,药物储存装置130可包含:主要容器132;剂量投递部件134,其可为注射针、插管或适合于将药物注射到身体中的任何其他流体施配元件;以及止动件136。主要容器132可为细长部件,其具有拥有开口(不可见)的封闭远端132de,和开放的近端132pe。主要容器132可进一步包含用于储存药剂或药物138的一或多个剂量的内部腔室132c。在一些实施例中,主要容器132的内部腔室132c可预填充有药剂或药物138的一或多个剂量。主要容器132可包含安置在开放近端132pe处或邻近处的边沿凸缘132f。在一些实施例中,凸缘132f可从主要容器132的外部表面向外延伸。凸缘132f可啮合安置在外部罩壳110的内部表面112上的支撑部件114中的一者。在一些实施例中,主要容器132可包含额外凸缘132af,其安置在主要容器132的远端132de与近端132pe之间。额外凸缘132af中的一或多者可从主要容器132的外部表面向外延伸,且啮合安置在外部罩壳110的内部表面112上的支撑部件114中的一或多者。在一些实施例中,主要容器132的封闭远端132de可啮合安置在外部罩壳110的内部表面112上的支撑部件(未图示)中的一或多者。
如图1中所示,剂量投递部件134可以与主要容器132的内部腔室132c成流体连通地安置在主要容器132的远端132de处,以用于投递药剂或药物138的剂量。可移除护罩139可安装在剂量投递部件134上以用于在使用注射装置100之前维持无菌状态。在其中支撑部件114相对于外部罩壳110固定的实施例中,剂量投递部件134可延伸穿过外部罩壳110的远端处的开口。
仍参看图1,药物储存装置130的止动件136可安置在主要容器132的内部腔室132c中,使得其可相对于主要容器132轴向移动,以用于通过剂量投递部件134排出药剂或药物138。在一些实施例中,药物储存装置130可包括常规的玻璃或塑料针筒或药筒。
当注射装置100不用于配给注射时,防护机构160防止用户或患者接触剂量投递部件134。如图1中所示,防护机构160包含:防护部件162,其可移动地安置在外部罩壳110的远端110de处;以及保持布置164,当注射装置100不在使用中时其将防护部件162保持在延伸位置,且在朝向患者的身体的注射部位按压注射装置100时允许防护部件162朝向外部罩壳110缩回。当注射装置100不用于配给注射时,防护部件162经由保持布置164相对于外部罩壳110保持在延伸位置中,进而环绕或覆盖剂量投递部件134。当朝向患者的身体的注射部位按压注射装置100时,防护部件162还朝向外部罩壳110缩回,以允许剂量投递部件134刺入身体。防护部件162可具有管状配置或任何其他合适的配置,其能够在防护部件162处于延伸位置中时防止用户或患者接触剂量投递部件134。保持布置164可包含盘簧或任何其他合适的机构,其能够将防护部件162保持在延伸位置中且在朝向患者的身体的注射部位按压注射装置100时允许防护部件162朝向外部罩壳110缩回。防护机构160可被配置成使得在防护机构160缩回期间防护部件162滑动到外部罩壳110的远端110de中或滑过所述远端。保持布置164可安置在防护部件162的近端162pe与外部罩壳110的一部分(例如,固定地安置在外部罩壳110的内部表面112上的支撑部件114中的一或多者)之间。
如图1中所示,注射驱动机构140可包含柱塞142和能量源144,所述能量源用于将柱塞142推进到药物储存装置130中以执行注射,或剂量投递部件134插入(例如,其中药物储存装置130被调适成相对于外部罩壳110轴向移动的实施例)和注射两者。柱塞142可包含杆部件146(或柱塞杆146),其分别具有远端146de和近端146pe。柱塞142可进一步包含安置在其远端146de处的头部件148(或柱塞头148)。
能量源144可包括一或多个弹簧元件。如图1中所描绘,在一些实施例中,弹簧元件中的一或多者可包括盘簧144s。柱塞142的杆部件146可延伸穿过盘簧144s,使得弹簧144s的一端啮合头部件148,且弹簧144s的另一端啮合驱动触发机构150。在注射装置100的操作之前,盘簧144s在柱塞142的头部件148与驱动触发机构150之间压缩,进而产生与头部件148和驱动触发机构150相抵的弹簧偏置力。当通过激活驱动触发机构150来操作注射装置100时,如本文中更详细地阐释,盘簧144s在远端扩展,进而将柱塞142推进到药物储存装置130中,以驱动止动件136穿过主要容器132,从而通过剂量投递装置134排出药物138。
在其他实施例中,能量源144可替代地或进一步包含气体压力或气体释放布置。由气体压力或气体释放布置提供的能量对柱塞142操作,以将其推进到药物储存装置130中,进而驱动止动件136穿过主要容器132,以通过剂量投递装置134排出药物138。
仍参看图1,在一些实施例中,外部罩壳110的开放近端110pe可包含罩盖120。罩盖120可与外部罩壳110成一体,或为已经固定地附接到外部罩壳110的近端110pe的单独部件。罩盖120可包含管状支撑部件122,当柱塞142相对于外部罩壳110处于最近端轴向位置中时(即,当注射装置100做好准备或处于随时可用模式中时),所述管状支撑部件可滑动地支撑柱塞杆146的近端146pe。
如图1中所示,驱动触发机构150可包含按钮部件152、柱塞释放部件154,和触发器偏置部件158。按钮部件152允许对驱动触发机构150进行致动以使用注射装置100配给注射。按钮部件152可包含被外围边缘部分152e环绕的头部152h。头部152h在外围边缘部分152e上方延伸,使得当外围边缘部分152e接触外部罩壳110的内部表面112时,所述头部可突出穿过外部罩壳110中形成的孔口,以允许用户对按钮部件152的致动。柱塞释放部件154可从按钮部件152的底部或内表面突出。在一些实施例中,柱塞释放部件154可包含柱塞切口154c,其被配置成界定细长C形表面154s。C形表面154s的上部可包含掣子或闩锁布置157的第一部件157f,其与柱塞杆146的外部表面上提供的对应第二部件157s合作。触发器偏置部件158与外部罩壳110的内部表面112相抵地推动按钮部件152的外围边缘,使得当驱动触发机构150的按钮部件152未被按压(即,被激活)时,按钮部件152的头部152h延伸穿过外部罩壳110的按钮孔口。这又迫使掣子或闩锁布置157的第一部件157f和第二部件157s保持彼此啮合,进而相对于外部罩壳110将柱塞142保持在最近端轴向位置中(即,注射装置100处于做好准备或随时可用模式中),如图1中所示,这将盘簧144s压缩在柱塞142的头部件148与柱塞释放部件154之间。触发器偏置部件158可包括盘簧或任何其他合适的装置,以用于在按钮部件152未被按压时与外部罩壳110的内部表面112相抵地偏置按钮部件152。
在将剂量投递部件134插入到身体中之后,用户或患者将驱动触发机构150的按钮部件152与触发器偏置部件158相抵地向下按压到外部罩壳110中,以致动注射驱动机构140配给注射;柱塞释放部件154在外部罩壳110内横向地移动,进而使掣子或闩锁布置157的第一部件157f和第二部件157s彼此脱离。这又释放柱塞142且允许能量源144将柱塞142推进到药物储存装置130中,以驱动止动件136穿过主要容器132,从而通过剂量投递装置134排出药物138。
仍参看图1,在柱塞142开始在远端将止动件136移动穿过主要容器132之前,驱动阻尼器机构170在减小柱塞142的速度的同时保持注射驱动机构140的既定力。通过减小柱塞142的速度,驱动阻尼器机构170实质上操作为减震元件,因为其减小施加到药物138和药物储存装置130的动能。驱动阻尼器机构170可被调适成减小柱塞142的速度,以确保投递到系统的压力不会诱发针筒破裂,投递到系统的压力防止对患者的可感知的“拍击”或不适,且/或投递到药物138的压力防止剪切力损坏药物138。
在一些实施例中,驱动阻尼器机构可被调适成将柱塞的速度减小小于1%。在其他实施例中,驱动阻尼器机构可被调适成将柱塞的速度减小约1%到5%。在其他实施例中,驱动阻尼器机构可被调适成将柱塞的速度减小约5%到10%。在其他实施例中,驱动阻尼器机构可被调适成将柱塞的速度减小约10%到15%。在其他实施例中,驱动阻尼器机构可被调适成将柱塞的速度减小约15%到20%。在其他实施例中,驱动阻尼器机构可被调适成将柱塞的速度减小约20%到30%。在仍其他实施例中,驱动阻尼器机构可被调适成将柱塞的速度减小约30%到50%。在又其他实施例中,驱动阻尼器机构可被调适成将柱塞的速度减小约51%到100%。可选择由驱动阻尼器机构提供的速度的减小,以通过防止可感知的“拍击”而防止对患者的物理干扰和/或不适,且/或减少药物储存装置的破裂,且/或减少由剪切负荷引起的药物产品损坏,且/或允许将所述注射装置用于注射具有较高粘度的药物。
如图1、2和3A到3C中所示,可将驱动阻尼器机构170成直线地安置在药物储存装置130的止动件136与柱塞142的柱塞头148之间,从而使注射装置100的大小最小化且在柱塞头/止动件界面处更有效地阻尼柱塞142的运动。在其他实施例中,如图4A到4C中所示,驱动阻尼器机构可成直线地安置在注射驱动机构的柱塞142的近端与外壳的罩盖120之间。在其他实施例中,驱动阻尼器机构可集成到柱塞242中,如图5A到5C中所示。
根据注射装置100的各种实施例,驱动阻尼器机构170可包括减震器。所述减震器使用粘性摩擦来抵制柱塞142的运动,进而减小柱塞142的速度。图2和3A到3C描绘可用于注射装置100中的线性减震器172的示范性实施例。如所示,减震器172包含外壳174、外壳174内部含有的工作流体178,和可移动地安置在外壳174内的活塞组合件176。外壳174可包括圆柱形侧壁174sw,所述圆柱形侧壁的第一端和第二端中的每一者被端壁174ew封闭。在一些实施例中,外壳174可由刚性材料制成,例如塑料或金属。外壳174内含有的工作流体178可包括(非限制)油(例如,矿物油)、硅酮材料、水或空气。
如图2和3A到3C中所示,活塞组合件176可包括活塞180和用于将活塞180推动穿过减震器外壳174的杆184。在其他实施例中,例如图4A到4C中所示,活塞杆可被配置和调适成拉动活塞穿过减震器外壳194。如图2中所示,活塞180可包括单个圆盘状结构或部件182(活塞圆盘部件182),其分别具有前沿表面182l和后沿表面182t。活塞杆184延伸穿过外壳174的端壁174ew中的一者中的孔口174a,且可具有附接到活塞圆盘部件182的前沿表面182l或后沿表面182t或与其成一体的一端,这取决于其在阻尼行程中是推动(图2和3A到3C)还是拉动(图4A到4C)活塞圆盘部件182。活塞杆184的自由端(其通常安置在外壳174外部)可附接到柱塞头148,如图2和3A到3C中所示。可在孔口174a中或邻近处提供例如O型环等密封件(不可见),以防止工作流体178在活塞杆184与外壳174的端壁174ew中的孔口174a之间泄漏出外壳174。在一些实施例中,注射装置100的活塞组合件176可由刚性材料制成,例如塑料或金属。在其他实施例中,活塞组合件176可由弹性材料制成,例如天然聚合物或合成聚合物。在仍其他实施例中,活塞组合件176可由多孔刚性材料制成。
图3A到3C描绘图2中所示的减震器172的操作的一个示范性模式。如图3A中所示,在致动驱动触发机构之后,注射驱动机构140的能量源(例如,弹簧144s)使柱塞142朝向安置在药物储存装置130的主要容器132中的止动件136前进。一旦减震器172接触止动件136,如图3B中所示,来自弹簧144s的负荷便开始传输到减震器172,进而在活塞圆盘部件182从外壳174的一端移动到另一端时,致使位于减震器活塞圆盘部件182的前方的工作流体178被推动或移位穿过一或多个约束而到活塞圆盘部件182后方的位置。工作流体178穿过一或多个约束的流动产生粘性摩擦,这抵制活塞圆盘部件182的移动,进而阻尼柱塞运动。在其中活塞圆盘部件182是由刚性材料制成的一些实施例中,所述约束可包括活塞圆盘部件182的外围边缘与减震器外壳174的侧壁174sw之间的小间隙(未图示)。在其他实施例中,所述约束进一步或替代地包括在活塞圆盘部件182的外围边缘中提供的一或多个凹槽186,如图9A中所示,和/或延伸穿过活塞圆盘部件182的一或多个开口188,如图9B中所示,在工作流体178从活塞圆盘部件182的前方移位到活塞圆盘部件182后方时,工作流体178流动穿过所述凹槽或开口。在其中活塞圆盘部件182是由弹性材料制成的其他实施例中,活塞圆盘部件182的外围边缘可充分向后弯曲以在活塞圆盘部件182的外围边缘与减震器外壳174的侧壁174sw(未图示)之间产生窄的间隙或约束,使得工作流体178可以流动穿过所述间隙或约束。在其中活塞圆盘部件182是由多孔材料制成的其他实施例中,工作流体178将流动穿过活塞圆盘部件182的孔(约束)。在这些实施例中的每一者中,减震器172的所述一或多个约束提供对作用在柱塞142上的能量源144(例如,弹簧144s)的力的速度相依阻力。此阻力在耦合到柱塞142时会在减小柱塞142的速度的同时维持能量源144(例如,弹簧144s)的力,之后柱塞142开始移动止动件136。约束的大小、数目和类型、用于减震器172中的工作流体178的类型、外壳174和活塞组合件176的配置,及其任何组合可经过调整和/或选择以允许调谐驱动阻尼器机构170的阻尼特性,以恰当地阻尼注射驱动机构140的震动特性。
如图3C中所示,活塞圆盘部件182啮合减震器外壳174的端壁中的前沿一者,且弹簧144s的力在远端使止动件136、减震器172和柱塞142以减小的速度移动穿过药物储存装置130的主要容器132,从而从主要容器132排出药物138。
图4A到4C描绘成直线地安置在注射驱动机构的柱塞杆146的近端146pe与注射装置的外部罩壳的罩盖120之间的减震器192的操作的一个示范性模式。在此实施例中,可通过与外部罩壳的罩盖120的管状支撑部件122一体地形成的掣子123将减震器外壳194保持在管状支撑部件122中。可在管状支撑部件122中界定的悬臂弹簧125上提供此布置。安置在减震器外壳194内的活塞杆204的末端可附接到活塞圆盘部件202的前沿表面202l,且活塞杆204的自由端可附接到柱塞杆146的近端146pe,使得通过能量源(例如,弹簧144s)在远端驱动柱塞杆146。活塞杆204拉动活塞圆盘部件202穿过减震器外壳194。
如图4A到4C中所示,在致动驱动触发机构之后,注射驱动机构的能量源(例如,弹簧144s)开始使柱塞142朝向安置在药物储存装置130的主要容器132中的止动件136前进。由弹簧144s施加到柱塞142的负荷可传输到减震器192。在活塞圆盘部件202被从减震器外壳194的一端拉动到另一端时,位于活塞圆盘部件202的前方的工作流体194被推动或移位穿过一或多个约束而到活塞圆盘部件202后方的位置。由流动穿过一或多个约束的工作流体198产生的阻力在柱塞142的头部件碰撞止动件136之前在维持弹簧144s的力的同时减小柱塞142的速度。柱塞142的头部件以减小的速度碰撞止动件136,且能量源(例如,弹簧144s)的力开始在远端使止动件136和柱塞142移动穿过药物储存装置130的主要容器132,从而从主要容器132排出药物138。大约在同时,减震器192的活塞圆盘部件202到达其行程的末尾,且啮合减震器外壳194的前沿端壁194ew。可选择能量源(例如,弹簧144s)以将足够能量施加到柱塞142来克服掣子和悬臂布置123/125,使得在能量源(例如,弹簧144s)驱动柱塞142、止动件136和药物138穿过药物储存装置130的主要容器132时,所述掣子和悬臂布置从外部罩壳罩盖120的管状支撑部件122释放减震器192,以允许柱塞142移动。减震器192从管状支撑部件122的释放减少了啮合的持续时间,这允许减小注射装置的总长度。
图5A到5C描绘集成到柱塞242中的减震器212的操作的示范性模式。如图5A到5C中所示,集成的减震器212包含由管状壁214t和柱塞头248形成的外壳214,所述柱塞头封闭管状壁214t的开放远端。减震器212进一步包含由中空柱塞杆246的远端壁220形成的活塞,其起初安置在减震器外壳214的管状壁214t的开放近端中。减震器212的工作流体218起初在柱塞杆246的远端壁220的前方在减震器外壳214中提供。如图5A中所示,在致动驱动触发机构(未图示)之后,注射驱动机构的能量源(例如,弹簧244s)将力施加到柱塞杆246,且使柱塞242朝向安置在药物储存装置130的主要容器132中的止动件136前进。一旦柱塞头248与止动件136接触,如图5B中所示,来自弹簧244s的负荷便传输到一体地形成于柱塞242中的减震器212。位于柱塞杆246的端壁220的前方的工作流体218被推动或移位穿过在端壁220中提供的一或多个约束(如先前所描述),且在其在远端移动到减震器外壳214中时进入端壁220后方的由中空柱塞杆246界定的空间中。由减震器212提供的阻力或阻尼在柱塞杆246啮合柱塞头248以移动止动件136之前会减小柱塞杆246的速度,且在执行阻尼的同时维持弹簧244s的力。
如图5C中所示,柱塞杆246的端壁220啮合柱塞头248,其标记减震器的阻尼行程的末尾。弹簧244s接着与止动件136相抵地推进或推动作为单个组件(即,柱塞)的柱塞杆246和柱塞头248,以在远端驱动止动件136穿过药物储存装置130的主要容器132,从而从主要容器132排出药物138。
图6展示减震器的另一示范性实施例。减震器270大体上类似于先前所描述的减震器,不同之处在于活塞组合件276的活塞包括沿着活塞杆284彼此间隔开的两个或更多圆盘部件282。两个或更多活塞圆盘部件282和可与每个活塞圆盘部件282相关联的先前描述的约束向活塞移动提供一连串阻力,其中所述阻力中的每一者可相同和/或不同。减震器270的所述一连串阻力允许在逐级地或递增地减小柱塞的速度的同时维持能量源(例如,弹簧144s)的力。在一些实施例中,多圆盘活塞组合件276可由刚性材料制成,例如塑料或金属。在此类实施例中,控制或界定由每个活塞圆盘部件282提供的阻力的约束可包括活塞圆盘部件282中的一或多者的外围边缘与减震器外壳274的侧壁274sw之间的小间隙(未图示)。在如图9A到9B中所示的其他此类实施例中,所述约束可包括在活塞圆盘部件182中的一或多者的外围边缘中提供的一或多个凹槽186(图9A),或延伸穿过一或多个活塞圆盘部件182从而将活塞圆盘部件中的一或多者形成为多孔圆盘的一或多个开口188(图9B),及其任何组合。在其他实施例中,多圆盘活塞组合件276可由弹性材料制成,例如天然弹性体或合成弹性体,使得每个活塞圆盘部件282的边际外围边缘可充分向后弯曲以在活塞圆盘部件282的外围边缘与减震器外壳274的侧壁274sw之间产生窄的间隙或约束,使得工作流体可以流动穿过所述间隙或约束。如果将空气用作工作流体,那么活塞组合件276的弹性活塞圆盘部件282可用于产生挤压膜阻尼效应。上文关于图2、3A到3C、4A到4C以及5A到5C所描述的减震器中的任一者可利用图6的活塞组合件276。
图7展示本发明的减震器的示范性实施例。减震器370包括外壳374和活塞组合件376,所述活塞组合件包括中空活塞杆384和活塞,所述活塞被配置成附接到安置在外壳374内的活塞杆384的末端的波纹管状结构(波纹管活塞结构)。中空活塞杆384可具有孔口384a,以用于将流动穿过中空活塞杆384的工作流体(未图示)排放到减震器外壳374之外。波纹管活塞结构可包括含有工作流体的一或多个可收缩瓣,所述流体可为空气或任何其他合适的工作流体。可在瓣壁的多个部分中提供开口386(约束),所述瓣壁的多个部分将波纹管活塞结构的每个邻近对的瓣彼此连接且连接到中空活塞杆384。开口386允许瓣中含有的工作流体从一个瓣流动到另一个瓣,进而充当约束。当波纹管活塞结构被推动或拉动到减震器外壳374的端壁374ew中且通过由驱动柱塞机构的能量源(例如,弹簧144s)供应的作用在柱塞142上的力收缩时,减震器370提供阻尼。当波纹管活塞结构的瓣收缩时,在瓣内部含有的工作流体流动穿过开口386、中空活塞杆384和杆孔口384a时,提供阻尼作用。上文关于图2、3A到3C、4A到4C以及5A到5C所描述的减震器实施例中的任一者可利用图7的活塞组合件376。
图8A和8B展示本发明的驱动阻尼器机构的示范性实施例。在此实施例中,驱动阻尼器机构470可包括附接到柱塞142的头部件148的细长能量吸收或阻尼材料条带472。当附接到柱塞142的头部件148的阻尼材料条带472碰撞安置在药物储存装置130的主要容器132中的止动件136且进行压缩以吸收由能量源(例如,弹簧144s)供应到柱塞142的力,进而提供减小柱塞142的速度的对柱塞142的滞后阻尼时,提供阻尼。所述阻尼材料可包括单层阻尼材料,或为由两层或更多层阻尼材料形成的叠层。在一些实施例中,所述两层或更多层阻尼材料可彼此结合。在其他实施例中,所述两层或更多层阻尼材料不彼此结合。一或多层阻尼材料可由粘弹性材料或合成多孔材料(例如,气凝胶)制成。叠层阻尼材料的所述层可具有相同或不同的阻尼特性以调谐驱动阻尼器机构470的阻尼特性,从而恰当地阻尼驱动柱塞机构的震动特性。在各种实施例中,一或多层阻尼材料可由在商标下出售且由Aearo E-A-R Specialty Composites制造的热塑性粘弹性材料制成。
参看图10,注射装置的一些实施例可进一步或替代地包含驱动阻尼器机构,其包括安置在药物储存装置130的主要容器132的每个部分之间的能量吸收或阻尼材料条带482,所述条带啮合或接触外部罩壳110的支撑部件114中的一者。如图10中所示,阻尼材料482可安置在凸缘132f与支撑部件114之间,和在主要容器132的封闭远端132de与支撑部件114之间。在其他实施例中,阻尼材料条带可安置在外部罩壳110的内部表面与主要容器132之间的各个位置处。之所以提供阻尼是因为阻尼材料条带482进行压缩以吸收由碰撞止动件的柱塞引起的力,所述力是由能量源供应。在一些实施例中,所述阻尼材料可由粘弹性材料或气凝胶制成。在一些实施例中,所述阻尼材料可包括单层阻尼材料,或为由彼此结合的两层或更多层阻尼材料形成的叠层。所述叠层的所述层可具有相同或不同的阻尼特性以调谐驱动阻尼器机构的阻尼特性,从而恰当地阻尼驱动柱塞机构的震动特性。在本发明的各种实施例中,一或多层阻尼材料可由在商标下出售且由Aearo E-A-R Specialty Composites制造的热塑性粘弹性材料制成。
再次参看图8A和8B,药物储存装置130可安装在可在外部罩壳110内提供的保持套管400中。保持套管400可包含用于支撑药物储存装置130的主要容器132的容器支撑凸缘410和用于啮合罩壳110的支撑部件114中的一或多者的罩壳啮合凸缘412。类似于上文所描述的条带,可以在药物储存装置130与保持套管400之间和/或罩壳110与保持套管400之间使用能量吸收或阻尼材料条带482来阻尼施加到药物储存装置130和储存在药物储存装置130的主要容器132中的药物138的柱塞/止动件力。在所示的实施例中,第一能量吸收或阻尼材料条带482可安置在保持套管400的容器支撑凸缘410与药物储存装置130的主要容器132的边沿凸缘132f之间。第二能量吸收或阻尼材料条带482可安置在保持套管400的罩壳啮合凸缘412与外部罩壳110的支撑部件114之间。注射装置的其他实施例可包含安置在主要容器132与保持套管400之间和/或保持套管400与外部罩壳110之间和/或在注射装置内的其他接触点处的能量吸收或阻尼材料条带。
以上描述描述了用于与药物投递装置一起使用的各种系统和方法。应清楚,所述系统、药物投递装置或方法可进一步包括下文列出的药物或药剂的使用,其中应注意,以下列表都不应被视为包括一切或具限制性。药剂将含在贮存器中。在一些实例中,所述贮存器是填充有或预填充有用于治疗的药剂的主要容器。所述主要容器可为药筒或预填充针筒。
举例来说,药物投递装置或更具体来说所述装置的贮存器可填充有集落刺激因子,例如粒细胞集落刺激因子(G-CSF)。此类G-CSF药剂包含(但不限于)(非格司亭(filgrastim))和(培非格司亭(pegfilgrastim))。在各种其他实施例中,所述药物投递装置可与各种药品一起使用,例如红细胞生成刺激剂(ESA),其可呈液体或冻干的形式。ESA是刺激红细胞生成的任何分子,例如(阿法依泊汀(epoetin alfa))、(阿法达贝泊汀(darbepoetin alfa))、(德尔塔依泊汀(epoetin delta))、(甲氧基聚乙二醇-贝塔依泊汀)、MRK-2578、INS-22、(泽塔依泊汀(epoetin zeta))、(贝塔依泊汀)、(泽塔依泊汀)、(阿法依泊汀)、阿法依泊汀Hexal、(阿法依泊汀)、(塞塔依泊汀(epoetin theta))、(塞塔依泊汀)、(塞塔依泊汀)、阿法依泊汀、贝塔依泊汀、泽塔依泊汀、塞塔依泊汀和德尔塔依泊汀,以及在以下专利或专利申请中公开的分子或其变体或类似物,所述专利或专利申请中的每一者以全文引用的方式并入本文中:美国专利第4,703,008号;第5,441,868号;第5,547,933号;第5,618,698号;第5,621,080号;第5,756,349号;第5,767,078号;第5,773,569号;第5,955,422号;第5,986,047号;第6,583,272号;第7,084,245号;和第7,271,689号;以及PCT公布第WO 91/05867号;第WO 95/05465号;第WO 96/40772号;第WO 00/24893号;第WO 01/81405号;和第WO 2007/136752号。
ESA可为红细胞生成刺激蛋白。如本文所使用,“红细胞生成刺激蛋白”是指例如通过结合于红细胞生成素受体并引起受体二聚化,直接或间接地引起受体激活的任何蛋白。红细胞生成刺激蛋白包含结合于红细胞生成素受体并将其激活的红细胞生成素和其变体、类似物或衍生物;结合于红细胞生成素受体并激活所述受体的抗体;或结合于红细胞生成素受体并将其激活的肽。红细胞生成刺激蛋白包含(但不限于)阿法依泊汀、贝塔依泊汀、德尔塔依泊汀、欧米茄依泊汀(epoetin omega)、约塔依泊汀(epoetin iota)、泽塔依泊汀和其类似物、聚乙二醇化红细胞生成素、氨甲酰化红细胞生成素、模拟肽(包含EMP1/hematide)以及模拟抗体。示范性红细胞生成素刺激蛋白包含红细胞生成素、达贝泊汀、红细胞生成素激动剂变体以及结合且激活红细胞生成素受体的肽或抗体(且包含在美国公布第2003/0215444号和第2006/0040858号中报告的化合物,其中每一者的公开内容以全文引用的方式并入本文中),以及在以下专利或专利申请中公开的红细胞生成素分子或其变体或类似物,所述专利或专利申请各自以全文引用的方式并入本文中:美国专利第4,703,008号;第5,441,868号;第5,547,933号;第5,618,698号;第5,621,080号;第5,756,349号;第5,767,078号;第5,773,569号;第5,955,422号;第5,830,851号;第5,856,298号;第5,986,047号;第6,030,086号;第6,310,078号;第6,391,633号;第6,583,272号;第6,586,398号;第6,900,292号;第6,750,369号;第7,030,226号;第7,084,245号;和第7,217,689号;美国公布第2002/0155998号;第2003/0077753号;第2003/0082749号;第2003/0143202号;第2004/0009902号;第2004/0071694号;第2004/0091961号;第2004/0143857号;第2004/0157293号;第2004/0175379号;第2004/0175824号;第2004/0229318号;第2004/0248815号;第2004/0266690号;第2005/0019914号;第2005/0026834号;第2005/0096461号;第2005/0107297号;第2005/0107591号;第2005/0124045号;第2005/0124564号;第2005/0137329号;第2005/0142642号;第2005/0143292号;第2005/0153879号;第2005/0158822号;第2005/0158832号;第2005/0170457号;第2005/0181359号;第2005/0181482号;第2005/0192211号;第2005/0202538号;第2005/0227289号;第2005/0244409号;第2006/0088906号;和第2006/0111279号;以及PCT公布第WO 91/05867号;第WO 95/05465号;第WO 99/66054号;第WO 00/24893号;第WO 01/81405号;第WO 00/61637号;第WO 01/36489号;第WO 02/014356号;第WO 02/19963号;第WO 02/20034号;第WO 02/49673号;第WO 02/085940号;第WO 03/029291号;第WO 2003/055526号;第WO 2003/084477号;第WO 2003/094858号;第WO 2004/002417号;第WO 2004/002424号;第WO 2004/009627号;第WO 2004/024761号;第WO 2004/033651号;第WO 2004/035603号;第WO 2004/043382号;第WO 2004/101600号;第WO 2004/101606号;第WO 2004/101611号;第WO 2004/106373号;第WO 2004/018667号;第WO 2005/001025号;第WO 2005/001136号;第WO 2005/021579号;第WO 2005/025606号;第WO 2005/032460号;第WO 2005/051327号;第WO 2005/063808号;第WO 2005/063809号;第WO 2005/070451号;第WO 2005/081687号;第WO 2005/084711号;第WO 2005/103076号;第WO 2005/100403号;第WO 2005/092369号;第WO 2006/50959号;第WO 2006/02646号;和第WO 2006/29094号。
用于与所述装置一起使用的其他药品的实例可包含(但不限于)抗体,例如(帕尼单抗(panitumumab))、XgevaTM(地诺单抗(denosumab))和ProliaTM(地诺单抗);其他生物制剂,例如(依那西普(etanercept)、TNF-受体/Fc融合蛋白,TNF阻断剂)、(培非格司亭、聚乙二醇化非格司亭、聚乙二醇化G-CSF、聚乙二醇化hu-Met-G-CSF)、(非格司亭、G-CSF、hu-MetG-CSF)和(罗米司亭(romiplostim));小分子药物,例如(西那卡塞(cinacalcet))。所述装置还可与治疗性抗体、多肽、蛋白或其他化学物(例如铁,例如纳米氧化铁、右旋糖酐铁、葡萄糖酸铁和蔗糖铁)一起使用。所述药品可呈液体形式,或由冻干形式复原。
特定说明性蛋白是下文陈述的具体蛋白,包含其融合物、片段、类似物、变体或衍生物:
OPGL特异性抗体、肽体和相关蛋白等(又称为RANKL特异性抗体、肽体等),包含完全人类化和人类OPGL特异性抗体,尤其是完全人类化单克隆抗体,包含(但不限于)PCT公布第WO 03/002713号中所描述的抗体,所述公布的关于OPGL特异性抗体和抗体相关蛋白的方面以全文引用的方式并入本文中,所述OPGL特异性抗体和抗体相关蛋白尤其是具有其中所陈述的序列的OPGL特异性抗体和抗体相关蛋白,尤其是(但不限于)其中指示的OPGL特异性抗体和抗体相关蛋白:9H7;18B2;2D8;2E11;16E1;和22B3,包含具有如其中在图2中所陈述的SEQ ID NO:2的轻链和/或其中在图4中所陈述的SEQ ID NO:4的重链的OPGL特异性抗体,其中每一者以全文引用的方式个别地且特定地并入本文中,完全如在前述公布中公开一般;
肌肉生长抑制素结合蛋白、肽体及相关蛋白等,包含肌肉生长抑制素特异性肽体,尤其是美国公布第2004/0181033号和PCT公布第WO 2004/058988号中所描述的肌肉生长抑制素特异性肽体,所述公布尤其是关于肌肉生长抑制素特异性肽体的部分以全文引用的方式并入本文中,所述肌肉生长抑制素特异性肽体包含(但不限于)mTN8-19家族肽体,包含SEQ ID NO:305-351的肽体,包含TN8-19-1到TN8-19-40、TN8-19con1和TN8-19con2;SEQ ID NO:357-383的mL2家族肽体;SEQ ID NO:384-409的mL15家族肽体;SEQ ID NO:410-438的mL17家族肽体;SEQ ID NO:439-446的mL20家族肽体;SEQ ID NO:447-452的mL21家族肽体;SEQ ID NO:453-454的mL24家族肽体;和SEQ ID NO:615-631的肽体;其中每一者以全文引用的方式个别地且特定地并入本文中,完全如在前述公布中公开一般;
IL-4受体特异性抗体、肽体和相关蛋白等,尤其是抑制由IL-4和/或IL-13结合于受体所介导的活性的IL-4受体特异性抗体、肽体和相关蛋白等,包含PCT公布第WO 2005/047331号或PCT申请第PCT/US2004/37242号和美国公布第2005/112694号中所描述的IL-4受体特异性抗体、肽体和相关蛋白等,所述公布和申请尤其是关于IL-4受体特异性抗体的部分以全文引用的方式并入本文中,所述IL-4受体特异性抗体尤其是其中所描述的此类抗体,尤其是(且非限制)其中指定的抗体:L1H1;L1H2;L1H3;L1H4;L1H5;L1H6;L1H7;L1H8;L1H9;L1H10;L1H11;L2H1;L2H2;L2H3;L2H4;L2H5;L2H6;L2H7;L2H8;L2H9;L2H10;L2H11;L2H12;L2H13;L2H14;L3H1;L4H1;L5H1;L6H1,其中每一者以全文引用的方式个别地且特定地并入本文中,完全如在前述公布中公开一般;
白细胞介素-受体1(“IL1-R1”)特异性抗体、肽体和相关蛋白等,包含(但不限于)美国公布第2004/097712号中所描述的白细胞介素-受体1特异性抗体、肽体和相关蛋白等,所述公布关于IL1-R1特异性结合蛋白、单克隆抗体的部分以全文引用的方式并入本文中,所述IL1-R1特异性结合蛋白、单克隆抗体具体来说尤其是(非限制)其中指定的IL1-R1特异性结合蛋白、单克隆抗体:15CA、26F5、27F2、24E12和10H7,其中每一者以全文引用的方式个别地且特定地并入本文中,完全如在前述公布中公开一般;
Ang2特异性抗体、肽体和相关蛋白等,包含(但不限于)PCT公布第WO03/057134号和美国公布第2003/0229023号中所描述的Ang2特异性抗体、肽体和相关蛋白等,所述公布中的每一者尤其是关于Ang2特异性抗体和肽体等的部分以全文引用的方式并入本文中,所述Ang2特异性抗体和肽体等尤其是具有其中所描述的序列的Ang2特异性抗体和肽体等且包含(但不限于):L1(N);L1(N)WT;L1(N)1K WT;2xL1(N);2xL1(N)WT;Con4(N)、Con4(N)1K WT、2xCon4(N)1K;L1C;L1C 1K;2xL1C;Con4C;Con4C 1K;2xCon4C1K;Con4-L1(N);Con4-L1C;TN-12-9(N);C17(N);TN8-8(N);TN8-14(N);Con 1(N),还包含抗Ang 2抗体和调配物,例如PCT公布第WO 2003/030833号中所描述的抗Ang 2抗体和调配物,所述公布关于抗Ang 2抗体和调配物的方面以全文引用的方式并入本文中,尤其是Ab526;Ab528;Ab531;Ab533;Ab535;Ab536;Ab537;Ab540;Ab543;Ab544;Ab545;Ab546;A551;Ab553;Ab555;Ab558;Ab559;Ab565;AbF1AbFD;AbFE;AbFJ;AbFK;AbG1D4;AbGC1E8;AbH1C12;AblA1;AblF;AblK、AblP;和AblP,呈它们在其中所描述的各种排列,其中每一者以全文引用的方式个别地且特定地并入本文中,完全如在前述公布中公开一般;
NGF特异性抗体、肽体和相关蛋白等,具体来说,包含(但不限于)美国公布第2005/0074821号和美国专利第6,919,426号中所描述的NGF特异性抗体、肽体和相关蛋白等,所述公布和专利尤其关于NGF特异性抗体和相关蛋白的方面以全文引用的方式并入本文中,在此方面,具体来说,包含(但不限于)其中指定为4D4、4G6、6H9、7H2、14D10和14D11的NGF特异性抗体,其中每一者以全文引用的方式个别地且特定地并入本文中,完全如在前述公布中公开一般;
CD22特异性抗体、肽体和相关蛋白等,例如美国专利第5,789,554号中所描述的CD22特异性抗体、肽体和相关蛋白等,所述专利关于CD22特异性抗体和相关蛋白的方面以全文引用的方式并入本文中,所述CD22特异性抗体和相关蛋白尤其是人类CD22特异性抗体,例如(但不限于)人类化和完全人类抗体,包含(但不限于)人类化和完全人类单克隆抗体,尤其包含(但不限于)人类CD22特异性IgG抗体,例如连接到人类-鼠单克隆hLL2κ链的人类-鼠单克隆hLL2γ链二硫化物的二聚体,包含(但不限于)例如依帕珠单抗(Epratuzumab)中的人类CD22特异性完全人类化抗体,CAS登记号501423-23-0;
IGF-1受体特异性抗体、肽体和相关蛋白等,例如PCT公布第WO06/069202号中所描述的IGF-1受体特异性抗体、肽体和相关蛋白等,所述公布关于IGF-1受体特异性抗体和相关蛋白的方面以全文引用的方式并入本文中,所述IGF-1受体特异性抗体和相关蛋白包含(但不限于)其中指定为L1H1、L2H2、L3H3、L4H4、L5H5、L6H6、L7H7、L8H8、L9H9、L10H10、L11H11、L12H12、L13H13、L14H14、L15H15、L16H16、L17H17、L18H18、L19H19、L20H20、L21H21、L22H22、L23H23、L24H24、L25H25、L26H26、L27H27、L28H28、L29H29、L30H30、L31H31、L32H32、L33H33、L34H34、L35H35、L36H36、L37H37、L38H38、L39H39、L40H40、L41H41、L42H42、L43H43、L44H44、L45H45、L46H46、L47H47、L48H48、L49H49、L50H50、L51H51、L52H52的IGF-1特异性抗体,以及IGF-1R结合片段和其衍生物,其中每一者以全文引用的方式个别地且特定地并入本文中,完全如在前述公布中公开一般;
而且,用于本发明的方法和组合物中的抗IGF-1R抗体的非限制性实例是以下各者中所描述的抗IGF-1R抗体中的每一者和全部:
(i)美国公布第2006/0040358号(2006年2月23日公布)、第2005/0008642号(2005年1月13日公布)、第2004/0228859号(2004年11月18日公布),包含(但不限于)例如抗体1A(DSMZ寄存编号DSM ACC 2586)、抗体8(DSMZ寄存编号DSM ACC 2589)、抗体23(DSMZ寄存编号DSM ACC 2588)和其中所描述的抗体18;
(ii)PCT公布第WO 06/138729号(2006年12月28日公布)和第WO05/016970号(2005年2月24日公布),和Lu等人(2004)的《生物化学杂志(J.Biol.Chem.)》279:2856-2865,包含(但不限于)其中所描述的2F8、A12和IMC-A12抗体;
(iii)PCT公布第WO 07/012614号(2007年2月1日公布)、第WO 07/000328号(2007年1月4日公布)、第WO 06/013472号(2006年2月9日公布)、第WO 05/058967号(2005年6月30日公布)和第WO 03/059951号(2003年7月24日公布);
(iv)美国公布第2005/0084906号(2005年4月21日公布),包含(但不限于)其中所描述的抗体7C10、嵌合抗体C7C10、抗体h7C10、抗体7H2M、嵌合抗体*7C10、抗体GM 607、人类化抗体7C10版本1、人类化抗体7C10版本2、人类化抗体7C10版本3和抗体7H2HM;
(v)美国公布第2005/0249728号(2005年11月10日公布)、第2005/0186203号(2005年8月25日公布)、第2004/0265307号(2004年12月30日公布)和第2003/0235582号(2003年12月25日公布),和Maloney等人(2003)的《癌症研究(Cancer Res.)》63:5073-5083,包含(但不限于)其中所描述的抗体EM164、重构EM164、人类化EM164、huEM164v1.0、huEM164v1.1、huEM164v1.2和huEM164v1.3;
(vi)美国专利第7,037,498号(2006年5月2日发布)、美国公布第2005/0244408号(2005年11月30日公布)和第2004/0086503号(2004年5月6日公布),和Cohen等人(2005)的《临床癌症研究(Clinical Cancer Res.)》11:2063-2073,例如抗体CP-751,871,包含(但不限于)其中所描述的由杂交瘤产生的具有以下ATCC登录号的抗体中的每一者:PTA-2792、PTA-2788、PTA-2790、PTA-2791、PTA-2789、PTA-2793,和抗体2.12.1、2.13.2、2.14.3、3.1.1、4.9.2和4.17.3;
(vii)美国公布第2005/0136063号(2005年6月23日公布)和第2004/0018191号(2004年1月29日公布),包含(但不限于)其中所描述的抗体19D12和包括以编号PTA-5214寄存在ATCC的质体15H12/19D12HCA(γ4)中的多核苷酸编码的重链和以编号PTA-5220寄存在ATCC的质体15H12/19D12LCF(κ)中的多核苷酸编码的轻链的抗体;以及
(viii)美国公布第2004/0202655号(2004年10月14日公布),包含(但不限于)其中描述的抗体PINT-6A1、PINT-7A2、PINT-7A4、PINT-7A5、PINT-7A6、PINT-8A1、PINT-9A2、PINT-11A1、PINT-11A2、PINT-11A3、PINT-11A4、PINT-11A5、PINT-11A7、PINT-11A12、PINT-12A1、PINT-12A2、PINT-12A3、PINT-12A4和PINT-12A5;其中每一者和全部尤其关于前述的靶向IGF-1受体的抗体、肽体和相关蛋白等方面以全文引用的方式并入本文中;
B-7相关蛋白1特异性抗体、肽体、相关蛋白等(“B7RP-1”,在文献中还称为B7H2、ICOSL、B7h和CD275),尤其是B7RP特异性完全人类单克隆IgG2抗体,尤其是结合B7RP-1的第一免疫球蛋白样结构域中的抗原决定基的完全人类IgG2单克隆抗体,尤其是抑制B7RP-1与激活T细胞上其天然受体ICOS的相互作用的完全人类IgG2单克隆抗体,具体来说,尤其在所有前述方面中,美国公布第2008/0166352号和PCT公布第WO 07/011941号中所公开的完全人类IgG2单克隆抗体,所述公布关于所述抗体和相关蛋白的方面以全文引用的方式并入本文中,所述抗体和相关蛋白包含(但不限于)在其中如下指定的抗体:16H(其中分别具有轻链可变序列SEQ ID NO:1和重链可变序列SEQ ID NO:7);5D(其中分别具有轻链可变序列SEQ ID NO:2和重链可变序列SEQ ID NO:9);2H(其中分别具有轻链可变序列SEQ ID NO:3和重链可变序列SEQ ID NO:10);43H(其中分别具有轻链可变序列SEQ ID NO:6和重链可变序列SEQ ID NO:14);41H(其中分别具有轻链可变序列SEQ ID NO:5和重链可变序列SEQ ID NO:13);和15H(其中分别具有轻链可变序列SEQ ID NO:4和重链可变序列SEQ ID NO:12),其中每一者以全文引用的方式个别地且特定地并入本文中,完全如在前述公布中公开一般;
IL-15特异性抗体、肽体和相关蛋白等,例如,具体来说,人类化单克隆抗体,尤其是例如美国公布第2003/0138421号;第2003/023586号;和第2004/0071702号;以及美国专利第7,153,507号中所公开的抗体等抗体,所述公布和专利中的每一者关于IL-15特异性抗体和相关蛋白(包含肽体)的方面以全文引用的方式并入本文中,所述IL-15特异性抗体和相关蛋白尤其包含(例如)(但不限于)HuMax IL-15抗体和相关蛋白,例如146B7;
IFNγ特异性抗体、肽体和相关蛋白等,尤其是人类IFNγ特异性抗体,尤其是完全人类抗IFNγ抗体,例如,美国公布第2005/0004353号中所描述的完全人类抗IFNγ抗体,所述公布关于IFNγ特异性抗体的方面以全文引用的方式并入本文中,所述IFNγ特异性抗体尤其是例如其中指定为1118;1118*;1119;1121;和1121*的抗体。这些抗体中的每一者的重链和轻链的整个序列以及它们的重链和轻链可变区和互补决定区的序列各自以全文引用的方式个别地且特定地并入本文中,完全如前述公布和Thakur等人(1999)的《分子免疫学(Mol.Immunol.)》36:1107-1115中公开一般。另外,对在前述公布中提供的这些抗体的性质的描述也以全文引用的方式并入本文中。特异性抗体包含前述公布中公开的具有重链SEQ ID NO:17和轻链SEQ ID NO:18的特异性抗体;具有重链可变区SEQ ID NO:6和轻链可变区SEQ ID NO:8的特异性抗体;具有重链SEQ ID NO:19和轻链SEQ ID NO:20的特异性抗体;具有重链可变区SEQ ID NO:10和轻链可变区SEQ ID NO:12的特异性抗体;具有重链SEQ ID NO:32和轻链SEQ ID NO:20的特异性抗体;具有重链可变区SEQ ID NO:30和轻链可变区SEQ ID NO:12的特异性抗体;具有重链序列SEQ ID NO:21和轻链序列SEQ ID NO:22的特异性抗体;具有重链可变区SEQ ID NO:14和轻链可变区SEQ ID NO:16的特异性抗体;具有重链SEQ ID NO:21和轻链SEQ ID NO:33的特异性抗体;以及具有重链可变区SEQ ID NO:14和轻链可变区SEQ ID NO:31的特异性抗体。所预期的一种特异性抗体是在前述美国公布中公开且具有其中公开的完整重链SEQ ID NO:17且具有其中公开的完整轻链SEQ ID NO:18的抗体1119;
TALL-1特异性抗体、肽体和相关蛋白等,以及其他TALL特异性结合蛋白,例如美国公布第2003/0195156号和第2006/0135431号中所描述的TALL特异性结合蛋白,所述公布中的每一者关于TALL-1结合蛋白的方面以全文引用的方式并入本文中,所述TALL-1结合蛋白尤其是表4和5B的分子,其中每一者以全文引用的方式个别地且特定地并入本文中,完全如在前述公布中公开一般;
甲状旁腺素(“PTH”)特异性抗体、肽体和相关蛋白等,例如美国专利第6,756,480号中所描述的甲状旁腺素特异性抗体、肽体和相关蛋白等,所述专利尤其关于结合PTH的蛋白的部分以全文引用的方式并入本文中;
血小板生成素受体(“TPO-R”)特异性抗体、肽体和相关蛋白等,例如美国专利第6,835,809号中所描述的血小板生成素受体特异性抗体、肽体和相关蛋白等,所述专利尤其关于结合TPO-R的蛋白的部分以全文引用的方式并入本文中;
肝细胞生长因子(“HGF”)特异性抗体、肽体和相关蛋白等,包含靶向HGF/SF:cMet轴(HGF/SF:c-Met)的肝细胞生长因子特异性抗体、肽体和相关蛋白等,例如美国公布第2005/0118643号和PCT公布第WO 2005/017107号中所描述的中和肝细胞生长因子/扩散因子(HGF/SF)的完全人类单克隆抗体、美国专利第7,220,410号中所描述的huL2G7和美国专利第5,686,292号和第6,468,529号以及在PCT公布第WO 96/38557号中所描述的OA-5d5,所述专利和公布中的每一者尤其关于结合HGF的蛋白的部分以全文引用的方式并入本文中;
TRAIL-R2特异性抗体、肽体、相关蛋白等,例如美国专利第7,521,048号中所描述的TRAIL-R2特异性抗体、肽体,相关蛋白等,所述专利尤其关于结合TRAIL-R2的蛋白的部分以全文引用的方式并入本文中;
活化素A特异性抗体、肽体、相关蛋白等,包含(但不限于)美国公布第2009/0234106号中所描述的活化素A特异性抗体、肽体、相关蛋白等,所述公布尤其关于结合活化素A的蛋白的部分以全文引用的方式并入本文中;
TGF-β特异性抗体、肽体、相关蛋白等,包含(但不限于)美国专利第6,803,453号和美国公布第2007/0110747号中所描述的TGF-β特异性抗体、肽体、相关蛋白等,所述专利和公布中的每一者尤其关于结合TGF-β的蛋白的部分以全文引用的方式并入本文中;
淀粉样蛋白β特异性抗体、肽体、相关蛋白等,包含(但不限于)PCT公布第2006/081171号中所描述的淀粉样蛋白β特异性抗体、肽体、相关蛋白等,所述公布尤其关于结合淀粉样蛋白β的蛋白的部分以全文引用的方式并入本文中。所预期的一种抗体是前述公布中所公开的具有包括SEQ ID NO:8的重链可变区和具有SEQ ID NO:6的轻链可变区的抗体;
c-Kit特异性抗体、肽体、相关蛋白等,包含(但不限于)美国公布第2007/0253951号中所描述的c-Kit特异性抗体、肽体、相关蛋白等,所述公布尤其关于结合c-Kit的蛋白和/或其他干细胞因子受体的部分以全文引用的方式并入本文中;
OX40L特异性抗体、肽体、相关蛋白等,包含(但不限于)美国公布第2006/0002929号中所描述的OX40L特异性抗体、肽体、相关蛋白等,所述公布尤其关于结合OX40L的蛋白和/或OX40L受体的其他配体的部分以全文引用的方式并入本文中;以及
其他示范性蛋白,包含(阿替普酶(alteplase),tPA);(阿法达贝泊汀);(阿法依泊汀,或红细胞生成素);GLP-1,(干扰素β-1a);(托西莫单抗(tositumomab),抗CD22单克隆抗体);(干扰素-β);(阿仑单抗(alemtuzumab),抗CD52单克隆抗体);(德尔塔依泊汀);(硼替佐米(bortezomib));MLN0002(抗α4β7 mAb);MLN1202(抗CCR2趋化因子受体mAb);(依那西普,TNF-受体/Fc融合蛋白,TNF抑制剂);(阿法依泊汀);(西妥昔单抗(cetuximab),抗EGFR/HER1/c-ErbB-1);(促生长激素,人类生长激素);(曲妥单抗(trastuzumab),抗HER2/neu(erbB2)受体mAb);(促生长激素,人类生长激素);(阿达木单抗(adalimumab));溶液中的胰岛素;(干扰素alfacon-1);(奈西立肽(nesiritide);重组人类B型钠尿肽(hBNP));(阿那白滞素(anakinra));(沙莫司亭(sargamostim),rhuGM-CSF);(依帕珠单抗,抗CD22 mAb);BenlystaTM(lymphostat B,贝利木单抗(belimumab),抗BlyS mAb);(替奈普酶(tenecteplase),t-PA类似物);(甲氧基聚乙二醇-贝塔依泊汀);(吉妥单抗(gemtuzumab ozogamicin));(依法利珠单抗(efalizumab));(赛妥珠单抗(certolizumabpegol),CDP 870);SolirisTM(依库丽单抗(eculizumab));培克珠单抗(pexelizumab)(抗C5补体);(MEDI-524);(兰尼单抗(ranibizumab));(17-1A,依决洛单抗(edrecolomab));(乐地单抗(lerdelimumab));TheraCim hR3(尼妥珠单抗(nimotuzumab));Omnitarg(帕妥珠单抗(pertuzumab),2C4);(IDM-1);(B43.13);(维西珠单抗(visilizumab));美坎珠单抗(cantuzumab mertansine)(huC242-DM1);(贝塔依泊汀);(奥普瑞白介素(oprelvekin),人类白细胞介素-11);(聚乙二醇化非格司亭,聚乙二醇化G-CSF,聚乙二醇化hu-Met-G-CSF);(非格司亭,G-CSF,hu-MetG-CSF);Orthoclone(莫罗单抗-CD3(muromonab-CD3),抗CD3单克隆抗体);(阿法依泊汀);(英利昔单抗(infliximab),抗TNFα单克隆抗体);(阿昔单抗(abciximab),抗GP lIb/Ilia受体单克隆抗体);(抗IL6受体mAb);(贝伐单抗(bevacizumab))、HuMax-CD4(扎木单抗(zanolimumab));(利妥昔单抗(rituximab),抗CD20mAb);(埃罗替尼(erlotinib));Roferon--(干扰素-α-2a);(巴利昔单抗(basiliximab));(罗美昔布(lumiracoxib));(帕利珠单抗(palivizumab));146B7-CHO(抗IL15抗体,参见美国专利第7,153,507号);(那他珠单抗(natalizumab),抗α4整合素mAb);(MDX-1303,抗炭疽杆菌保护性抗原mAb);ABthraxTM;(帕尼单抗);(奥马珠单抗(omalizumab));ETI211(抗MRSA mAb);IL-1捕获剂(两个IL-1受体组分(I型受体和受体辅助蛋白)的人类IgG1和胞外域的Fc部分);VEGF捕获剂(融合到IgG1Fc的VEGFR1的Ig结构域);(达利珠单抗(daclizumab));(达利珠单抗,抗IL-2RαmAb);(替伊莫单抗(ibritumomab tiuxetan));(依泽替米贝(ezetimibe));(阿塞西普(atacicept),TACI-Ig);抗CD80单克隆抗体(加利昔单抗(galiximab));抗CD23mAb(鲁昔单抗(lumiliximab));BR2-Fc(huBR3/huFc融合蛋白,可溶BAFF拮抗剂);CNTO 148(戈利木单抗(golimumab),抗TNFαmAb);HGS-ETR1(马帕木母单抗(mapatumumab);人类抗TRAIL受体-1mAb);HuMax-CD20(奥克珠单抗(ocrelizumab),抗CD20人类mAb);HuMax-EGFR(扎鲁木单抗(zalutumumab));M200(伏洛昔单抗(volociximab),抗α5β1整合素mAb);MDX-010(伊匹单抗(ipilimumab),抗CTLA-4mAb和VEGFR-1(IMC-18F1);抗BR3mAb;抗艰难梭菌毒素A和毒素B C mAb MDX-066(CDA-1)和MDX-1388);抗CD22dsFv-PE38结合物(CAT-3888和CAT-8015);抗CD25mAb(HuMax-TAC);抗CD3mAb(NI-0401);阿德木单抗(adecatumumab);抗CD30mAb(MDX-060);MDX-1333(抗IFNAR);抗CD38mAb(HuMax CD38);抗CD40L mAb;抗Cripto mAb;抗CTGF特发性肺纤维化I期纤维蛋白原(FG-3019);抗CTLA4mAb;抗嗜酸细胞活化趋化因子mAb(CAT-213);抗FGF8mAb;抗神经节苷脂GD2mAb;抗神经节苷脂GM2mAb;抗GDF-8人类mAb(MYO-029);抗GM-CSF受体mAb(CAM-3001);抗HepC mAb(HuMax HepC);抗IFNαmAb(MEDI-545,MDX-1103);抗IGF1R mAb;抗IGF-1R mAb(HuMax-Inflam);抗IL12mAb(ABT-874);抗IL12/IL23mAb(CNTO 1275);抗IL13mAb(CAT-354);抗IL2Ra mAb(HuMax-TAC);抗IL5受体mAb;抗整合素受体mAb(MDX-018,CNTO 95);抗IP10溃疡性结肠炎mAb(MDX-1100);抗LLY抗体;BMS-66513;抗甘露糖受体/hCGβmAb(MDX-1307);抗间皮素dsFv-PE38结合物(CAT-5001);抗PD1mAb(MDX-1106(ONO-4538));抗PDGFRα抗体(IMC-3G3);抗TGFβmAb(GC-1008);抗TRAIL受体-2人类mAb(HGS-ETR2);抗TWEAK mAb;抗VEGFR/Flt-1mAb;抗ZP3mAb(HuMax-ZP3);NVS抗体#1;和NVS抗体#2。
还可包含骨硬化蛋白抗体,例如(但不限于)雷莫芦单抗(romosozumab)、布罗珠单抗(blosozumab)或BPS 804(Novartis)。还可进一步包含多个疗法,例如利妥木单抗(rilotumumab)、比沙洛姆(bixalomer)、曲巴纳尼(trebananib)、加尼图单抗(ganitumab)、可那木单抗(conatumumab)、二磷酸莫替沙尼(motesanib diphosphate)、布罗达单抗(brodalumab)、维度皮帕(vidupiprant)、帕尼单抗、地诺单抗、NPLATE、PROLIA、VECTIBIX或XGEVA。另外,所述装置中可包含结合人类前蛋白转化酶枯草杆菌蛋白酶/第9型科星(PCSK9)的单克隆抗体(IgG),例如,美国专利第8,030,547号、美国公布第2013/0064825号、WO2008/057457、WO2008/057458、WO2008/057459、WO2008/063382、WO2008/133647、WO2009/100297、WO2009/100318、WO2011/037791、WO2011/053759、WO2011/053783、WO2008/125623、WO2011/072263、WO2009/055783、WO2012/0544438、WO2010/029513、WO2011/111007、WO2010/077854、WO2012/088313、WO2012/101251、WO2012/101252、WO2012/101253、WO2012/109530和WO2001/031007。
还可包含塔利拉帕(talimogene laherparepvec)或用于治疗黑素瘤或其他癌症的另一种溶瘤HSV。溶瘤HSV的实例包含(但不限于)塔利拉帕(美国专利第7,223,593号和第7,537,924号);OncoVEXGALV/CD(美国专利第7,981,669号);OrienX010(Lei等人(2013),《世界胃肠病学杂志(World J.Gastroenterol.)》19:5138-5143);G207、1716;NV1020;NV12023;NV1034和NV1042(Vargehes等人(2002),《癌症基因疗法(Cancer Gene Ther.)》9(12):967-978)。
还包含TIMP。TIMP是金属蛋白酶的内源性组织抑制剂(TIMP)且在许多天然过程中是重要的。TIMP-3由各种细胞表达或且存在于细胞外基质中;其抑制所有主要的软骨降解金属蛋白酶,且可在结缔组织的许多退化性疾病(包含类风湿性关节炎与骨关节炎)中以及癌症和心血管疾病中起作用。在2003年5月13日发布的美国专利第6,562,596号中公开了TIMP-3的氨基酸序列和编码TIMP-3的DNA的核酸序列,所述专利的公开内容以引用的方式并入本文中。可以在美国公布第2014/0274874号和PCT公布第WO 2014/152012号中找到TIMP突变的描述。
还包含人类降钙素基因相关肽(CGRP)受体的拮抗抗体和靶向CGRP受体和其他令人头痛的标靶的双特异性抗体分子。可以在PCT申请第WO 2010/075238号中找到关于这些分子的进一步信息。
另外,可以在所述装置中使用双特异性T细胞衔接器抗体(BiTe)(例如,布里莫单抗(Blinotumomab))。替代地,可在所述装置中包含APJ大分子激动剂,例如,爱佩琳或其类似物。可以在PCT公布第WO 2014/099984号中找到关于此类分子的信息。
在某些实施例中,药剂包括治疗有效量的抗胸腺基质淋巴细胞生成素(TSLP)或TSLP受体抗体。可用于此类实施例中的抗TSLP抗体的实例包含(但不限于)美国专利第7,982,016号和第8,232,372号以及美国公布第2009/0186022号中所描述的抗TSLP抗体。抗TSLP受体抗体的实例包含(但不限于)美国专利第8,101,182号中所描述的抗TSLP受体抗体。在尤其优选的实施例中,药剂包括治疗有效量的在美国专利第7,982,016号内指定为A5的抗TSLP抗体。
虽然已经依据示范性实施例描述了药物注射装置、驱动阻尼器机构、系统、方法及其元件,但它们不限于此。详细描述将被解释为仅为示范性的,且未描述本发明的每个可能的实施例,因为如果有可能的话,描述每个可能的实施例将是不实际的。可使用当前技术或在本专利的申请日之后开发的技术来实施众多替代性实施例,其将仍属于界定本发明的权利要求书的范围。
应理解,通过在本专利的末尾陈述的权利要求书的语句来界定本发明的法定范围。所附权利要求书应被广泛地解释为包含可由所属领域的技术人员在不脱离所述装置、驱动阻尼器机构、系统、方法及其元件的等效物的范围的情况下制作的其他变体及其实施例。
- 还没有人留言评论。精彩留言会获得点赞!