涂覆有交联的聚磷酸胆碱的体内植入式假体的制作方法
本发明涉及包括光引发剂、交联剂和具有丙烯酸酯基的磷酸胆碱(phosphorylcholine,PC)单体的用于体内植入式假体的涂层组合物、利用所述涂层组合物涂覆体内植入式假体的方法和涂覆有交联的聚磷酸胆碱的整形用假体。
背景技术:
随着医术的发展能够进行组织或器官的移植,但是组织或器官的供给仍不足,作为其替选方案,能够代替其的人造组织或器官的开发备受关注。因此,为了提供体内可移植人造组织和器官,正在开发和使用各种生物材料。这些生物材料不仅需要具有与实际的生物组织或器官的物理特性相似的物理特性(强度、粘度、弹性等),而且价格最好也要稳定,以便许多患者能够利用。为了探索这样的生物材料,付出了多方面的努力,但现状是可利用的生物相容性(biocompatibility)材料依然不足,而且目前市售的材料经常伴随副作用。在将在隆胸手术/乳房重建手术中使用的整形假体植入体内时发生的球形挛缩是副作用的典型示例。隆胸手术占全世界整形手术的约20%,且当包括如对乳房癌患者在去除组织后实施的重建手术时,该比例进一步增大。广泛使用的乳房整形用假体的表面由称为聚二甲基硅氧烷(polydimethylsiloxane,PDMS)的材料形成,具有与实际乳房组织不同的化学性质,因此接受隆胸手术/乳房重建手术的患者中的约17.5%经历了由非正常纤维组织包围假体周围的、称为球形挛缩(或包膜挛缩,capsular contracture)的副作用。球形挛缩不仅会导致患者疼痛,而且在严重的情况下,需要用手术去除球形挛缩,从而给患者造成精神/经济损失。因此,正在开发用于防止球形挛缩的各种方法,但是示出成功可能性的事例极其罕见。这种副作用是不仅在乳房整形后,而且在其他大部分向体内植入假体的手术后可能最常发生的严重并发症。如上所述,现状是,在发生该副作用时,除了通过外科手术去除之外,没有特别的治疗方法。此外,即使选择了通过手术去除的方法,在组织细胞严重粘附在假体表面的情况下,也难以完全去除。因此,即使通过手术去除,也可能会伴随着严重的后遗症,从而降低患者的生活质量,且由于治疗和管理费用的增加而支出大量的医疗费,从而可能会导致社会经济损失。
如上所述,不论何种假体,只要植入生物体内,则由于使异物(foreign body)与组织分离的生物体防御机制而形成包膜(capsule),过度的包膜挛缩由于身体反应而使胶原纤维包膜(collagen-fiber capsule)变厚,从而引起疼痛且导致假体变形。从外部植入的许多人造假体在生物体内被识别为异物,且粘结有体液内的各种蛋白质,且通过随后的各种生物化学过程而引起血栓形成、免疫反应、组织变形、坏死和/或退化。因此,在假体的表面涂覆生物相容性物质以防止将假体识别为异物的环节可以被认为是完成生物相容性体内植入式假体(包括减少包膜挛缩)的最重要的要素。当前,为了减少由于生物体内对整形用假体的过度的异物反应而发生的包膜挛缩,正进行各种尝试,例如改变植入位置、利用抗生素洗涤、使用类固醇、对假体表面进行质感(Textured)加工等,但现状是至今没有能够从根本上使将假体识别为异物的机制失效的方法。
作为体内植入式假体的代表性表面材料使用的基于聚二甲基硅氧烷的材料,由于高透氧性、优秀的机械性能、光学透明度、自动愈合(self-sealing)、易加工性和化学稳定性而应用于各种医疗设备,诸如眼科生物材料、微流体装置、人造肺和人造手指关节。此外,PDMS的内在疏水性和生物粘附性是其用作生物材料的最大制约因素。例如,非特异性蛋白质粘附到所述材料被认为是引起后续事件(包括血栓形成、异物反应、细菌感染以及其他不期望的反应)的第一阶段。在微流体系统的超灵敏度分析中,粘附到PDMS上的生物分子显着地降低了检测期间的信噪比。在人造肺中的重要问题是在大的血液接触面积中的血液活化。因此,需要有快速且容易地改变PDMS的表面特性的方法。
当前,聚合物涂层技术自身正迅速发展,但迄今为止其应用于生物假体的示例非常罕见。虽然报道了在药物洗脱支架等中尝试金属-聚合物涂层的示例,但是迄今为止仍停留在喷涂等水平。最近,在各个领域中正研究仿生合成磷脂聚合物(biomimetic synthetic phospholipid polymer)。尤其是,作为2-甲基丙烯酰氧基乙基磷酸胆碱(2-methacryloyloxyethyl phosphorylcholine,MPC)的聚合物的聚(甲基丙烯酰氧基乙基磷酰胆碱)(poly(methacryloyloxyethyl phosphorylcholine),PMPC)具有类似于构成人体生物膜的磷脂之一的磷脂酰胆碱(phosphatidyl choline)的头部的结构,因此,PMPC示出生物相容性、防止血栓形成等血液相容性(hemocompatibility)、防止蛋白质或细胞粘附等效果,因此正作为药物传递、组织工程和其他各种生物材料的表面材料而进行研究。因此,PMPC已经作为用于诸如药物洗脱支架的生物植入物(bioimplant)的涂层材料被使用,且示出了优异的生物相容性。
技术实现要素:
技术问题
本发明人已进行了深入研究,以利用模仿生物膜的聚合物来制备抑制由于植入体内的人造假体而引起的异物反应的硅假体,其结果确认到,在利用模仿作为生物膜磷脂的主成分的磷脂酰胆碱的聚合物涂覆硅假体表面(其中,通过进一步添加交联剂而使所涂覆的磷脂酰胆碱聚合物链彼此交联)时,硅假体在被植入体内后示出生物相容性,从而能够抑制异物反应,而且所述交联提高涂层强度,从而即使在强的刺激下涂层也不容易脱落,由此完成了本发明。
技术方案
本发明的一个目的在于提供一种用于体内植入式假体的涂层组合物,该涂层组合物包括光引发剂、交联剂和具有丙烯酸酯基的磷酸胆碱单体。
本发明的另一目的在于提供一种对体内植入式假体进行涂覆的方法,该方法包括:将所述涂层组合物施加至体内植入式假体的步骤;以及用紫外线照射被施加有所述涂层组合物的体内植入式假体的步骤。
本发明的又一目的在于提供一种涂覆有交联的聚磷酸胆碱的体内植入式假体。
有益效果
根据本发明,能够通过添加包括光引发剂、交联剂和具有丙烯酸酯基的磷酸胆碱单体的涂层组合物并照射紫外线的简单方法,制造被涂覆有交联的聚磷酸胆碱的体内植入式假体,所述交联的聚磷酸胆碱涂层不仅可以赋予表面亲水性,而且能够显著减少蛋白质的粘附和能够引发诸如包膜挛缩等副作用的成纤维细胞的粘附。此外,所述涂层具有即使在刺激下也不会脱落的涂层强度,从而在植入体内后即使在强烈的移动等情况下也不会脱落,因此可以有效地应用于在诸如乳房整形用假体等、副作用减小的体内植入式假体的制造。
附图说明
图1是示意性地示出根据本发明的利用交联的涂覆方法(交联)和现有的涂覆方法(一般)的图。
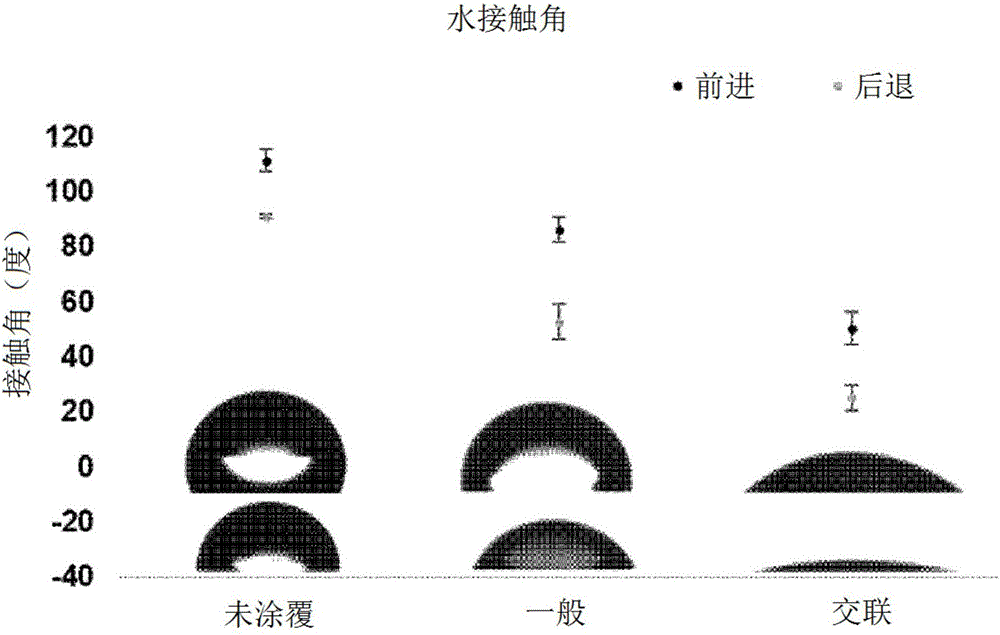
图2是示出通过根据本发明的利用交联的涂覆方法和现有的涂覆方法而制备的表面和没有涂覆的表面(未涂覆)的水接触角的图。
图3是示出采用XPS针对通过根据本发明的利用交联的涂覆方法和现有的涂覆方法而制备的表面和没有涂覆的表面进行表面元素分析的结果的图。
图4是示出相对于在没有涂覆的表面上的BSA吸附,在通过根据本发明的利用交联的涂覆方法和现有的涂覆方法而制备的表面上的BSA吸附率减小的图。
图5是示出相对于在没有涂覆的表面上的BPF吸附,在通过根据本发明的利用交联的涂覆方法和现有的涂覆方法而制备的表面上的BPF吸附率减小的图。
图6是示出相对于在没有涂覆的表面上的细胞(NIH-3T3)吸附,在通过根据本发明的利用交联的涂覆方法和现有的涂覆方法而制备的表面上的细胞吸附率减小的图。
图7是示出进行H&E(苏木精-伊红)染色并用显微镜观察到的、植入大鼠内的假体上形成的包膜的厚度的图。
图8是示出在植入假体的大鼠中在4周和12周后测量细胞质(cellularity)和血管质(vascularity)的结果的图。
图9是示出在植入假体的大鼠中通过免疫组织化学(immunohistochemistry)分析测量的TGF-β、α-SMA(平滑肌肌动蛋白)、髓过氧化物酶和CD34的表达程度的图。
具体实施方式
在用于实现上述目的的一方面中,本发明提供一种用于体内植入式假体的涂层组合物,该涂层组合物包括光引发剂、交联剂和具有丙烯酸酯基的磷酸胆碱单体。
本发明的特征在于,考虑到现有的具有丙烯酸酯基的磷酸胆碱通过利用紫外线照射光引发剂而形成的自由基进行聚合反应以形成线性磷酸胆碱聚合物,进一步添加交联剂,以形成彼此交联的网状聚合物膜,而不是形成所述线性磷酸胆碱聚合物。通过所述交联剂而交联的网状聚合物膜的特征为涂覆强度提高,因此即使在诸如超声波处理的强刺激下也不会损坏。报道称在涂覆有线性磷酸胆碱聚合物的假体中蛋白质和/或细胞粘附性也减小,从而能够减少作为在乳房整形患者中可能发生的副作用的球形挛缩,然而,随着时间的推移,假体持续经受身体移动和/或体内的物理刺激(压力或变形),因此涂层可能会脱落,在这种情况下,不能确保上述涂覆的假体的副作用减小效果。因此,需要具有即使在较强的刺激下也不会损坏的强度的涂层。因此,为了解决该问题,本发明的特征在于,可利用额外包括交联剂的组合物而形成网状聚合物,利用该网状聚合物涂覆体内植入式假体,从而提供相比现有的线性聚合物具有增加的强度的涂层。
本发明的术语“体内植入式假体”也被简称为“假体”,作为为了重建或更换损坏或缺损的生物组织、用于美容的整形用途、或治疗而植入体内的结构,例如可以为固体形式的结构或具有流动性的密封袋状形式的结构等。
能够利用本发明的涂层组合物进行涂覆的体内植入式假体可以为具有这样的官能团的物质:该官能团能够提供能够借助光引发剂而与作为涂层组合物的一成分的磷酸胆碱所具有的丙烯酸酯基的、包括C=C键的末端键合的自由基,使得所述磷酸胆碱能够通过所述丙烯酸酯基的、包括C=C键的末端与假体的外表面进行共价键合。可以使用本领域中公知的任何用于体内植入式假体的材料(除了金属或亲水性乙烯类材料之外),而没有限制,例如,所述体内植入式假体的外表面材料可以包括聚二甲基硅氧烷(polydimethylsiloxane,PDMS)类材料、羟基磷灰石(hydroxyapatite,HA)材料、聚乳酸(polylactic acid,PLA)类材料、聚乙醇酸(polyglycolic acid,PGA)类材料、聚四氟乙烯(polytetrafluoroethylene,PTFE)类材料、聚对苯二甲酸乙二醇酯(polyethylene terephthalate,PET)类材料、聚丙烯类材料、聚酰胺类材料、聚缩醛类材料、聚酯类材料或聚甲基丙烯酸甲酯类材料,但不限于此。
优选地,所述具有丙烯酸酯基的磷酸胆碱可以为MPC或丙烯酰氧基乙基磷酸胆碱(APC),但不限于此。其不限于具体的化学式,不管连接形式如何,包括丙烯酸酯类单体,该丙烯酸酯类单体包括具有磷酸胆碱或含磷和氮的两性离子的甲基丙烯酸酯,而没有限制。
本发明的术语“光引发剂(photoinitiator)”指的是能够接收光以形成自由基的物质。因此,通过用光照射所述引发剂以形成自由基,能够引起自由基聚合反应(radical polymerization),此时,优选地,光可以为紫外线。所述自由基聚合反应为通过连续添加自由基而形成聚合物的聚合方法,所述自由基通常可以通过各种机制由独立的引发剂分子形成。
一旦开始反应,则所形成的自由基利用来自包括双键的聚合物单体的π-键(pi bond)的一个电子来形成稳定的单键,由此所述双键转换成单键,同时在没有与自由基形成键的其他碳原子中形成包括另一电子的新自由基。通过所形成的新自由基使上述过程反复,同时使聚合物链生长。
优选地,所述光引发剂可以为二苯甲酮、过氧化苯甲酰(benzoyl peroxide)、偶氮二异丁腈(azobisisobutyronitrile,AIBN)或2,2-二甲氧基-2-苯基苯乙酮(2,2-dimethoxy-2-phenylacetophenone,DMPA),但不限于此。
优选地,所述交联剂可以选自由二季戊四醇五丙烯酸酯、二季戊四醇六丙烯酸酯、乙二醇二丙烯酸酯、乙二醇二甲基丙烯酸酯、甲基丙烯酸烯丙酯、甲基丙烯酸乙酰乙酰氧基乙酯、甲基丙烯酸异氰酸酯基乙酯、甲基丙烯酸异丁酯、甲基丙烯酸正丁酯及其组合构成的组,但不限于此。
优选地,根据本发明的涂层组合物可以包括相对于磷酸胆碱单体为0.01摩尔%至0.2摩尔%的所述光引发剂,但不限于此。
优选地,根据本发明的涂层组合物可以包括相对于磷酸胆碱单体为0.01摩尔%至2.0摩尔%的所述交联剂,但不限于此。
在所述光引发剂和/或所述交联剂的使用量小于所述范围的下限(即,小于0.01摩尔%)时,表面生成的聚合物的量,例如聚合物链的数量和/或各聚合物链的长度(分子量)显著降低,因此MPC不能均匀地且充分地覆盖假体的表面、或不能充分地进行交联,因此不能获得期望的物理性能,或不能获得期望的涂层强度且在洗涤中涂层可能会脱落。此外,在所述光引发剂和/或所述交联剂的使用量大于所述范围的上限(即,光引发剂的含量超过0.2摩尔%或交联剂的含量超过2.0摩尔%)时,由于过度的交联而使假体无法具有期望的弹性,有可能过度硬化,且有可能引起不必要的样品浪费。
在另一方面中,本发明提供一种对体内植入式假体进行涂覆的方法,该方法包括:将根据本发明的涂层组合物施加至体内植入式假体的步骤;以及用紫外线照射被施加有所述涂层组合物的体内植入式假体的步骤。
优选地,可以在将所述涂层组合物施加成均匀地接触假体表面后利用紫外线照射,使得体内植入式假体的表面能够被均匀地涂覆。
在另一方面中,本发明提供一种涂覆有交联的聚磷酸胆碱的体内植入式假体。
所述体内植入式假体的定义和特性与上述相同。
优选地,能够通过将根据本发明的涂层组合物施加至假体表面后使其进行交联反应而制造体内植入式假体,但不限于此。可以使用本领域公知的方法执行所述交联反应,而没有限制。例如,可以通过照射紫外线来执行所述交联反应。
优选地,所述体内植入式假体可以具有用于重建或更换损坏或缺损的生物组织的用途、用于美容的整形用途、或治疗用途,例如,可以用于隆胸或乳房重建,但不限于此。
例如,根据本发明的涂覆有交联的聚磷酸胆碱的乳房整形用假体能够显著降低蛋白质和成纤维细胞的吸附,从而能够降低引发诸如球形挛缩等副作用的可能性,且具有增大的涂层强度,因此即使在强的刺激下涂层也不会脱落,从而即使剧烈移动也能保持稳定,因此不用担心由于随着时间推移而涂层脱落等导致的功能下降。
实施例
以下,将通过实施例更详细地说明本发明。这些实施例是用于更具体地说明本发明,本发明的范围不受限于这些实施例。
实施例1:涂覆有交联的PMPC的PDMS的制备
将包括10g/L作为光引发剂的二苯甲酮和作为交联剂的二季戊四醇五(或六)丙烯酸酯的引发剂溶液和包括0.50M作为聚合物单体的MPC和作为交联剂的乙二醇二甲基丙烯酸酯(ethylene glycol dimethacrylate,EGDMA)的聚合物单体溶液施加至想要涂覆的硅(聚二甲基硅氧烷,polydimethylsiloxane,PDMS)材质的假体,在15cm的距离处利用紫外线照射15分钟,以使假体能够通过自由基聚合反应被涂覆。所有的光引发剂溶液通过使用丙酮作为溶剂进行制备,而与交联剂的种类和存在与否无关,且所有的MPC溶液通过使用去离子水作为溶剂进行制备,而与交联剂的种类和存在与否无关。根据需要,去除单体溶液内的氧气。在下表1中示出所述溶液的组分和在作为对照组使用的没有交联的涂覆方法中使用的溶液的组分。相对于所使用的聚合物单体MPC,所述交联剂二季戊四醇五(或六)丙烯酸酯和乙二醇二甲基丙烯酸酯的使用量分别为0.5摩尔%和1摩尔%。在用于后续分析前,利用超声波将所涂覆的假体洗涤2次,持续10分钟,以去除剩余的反应物。相比通常使用的洗涤方法,所述利用超声波的洗涤方法是较过激的方法,为了模拟由生物体内移植后的移动等造成的涂层脱落等,使用该稍微强烈的洗涤方法。
比较例1:涂覆有PMPC的PDMS的制备
为了确认利用上述根据本发明的引发剂制备的交联的PMPC涂层的效果,除了在引发剂溶液和聚合物单体溶液中不包括引发剂之外,使用与实施例1相同的方法来对硅假体进行涂覆。在下表1中示出各溶液的组分。在表1中同时示出用于自由基反应的条件和洗涤方法。
[表1]
实验例1:水接触角测量
通过水接触角测量来确认通过所述实施例1(交联)和比较例1(一般)而制备的涂覆有交联的PMPC或非交联的PMPC的PDMS假体表面的亲水性变化。作为阴性对照组,使用没有涂覆的PDMS(未涂覆)。具体地,利用动态水接触角测量方法(dynamic water contact angle measurement)中的俘滴法(captive drop method),测量前进接触角(advancing contact angle)和后退接触角(receding contact angle)。前进接触角是通过在利用针使表面上的去离子水的量从0μl增加至6μl时测量表面和水滴形成的角度而得到的,后退接触角是通过在使表面上的去离子水的量从6μl减少至3μl时测量表面和水滴形成的角度而得到的。所述前进接触角是相对准确地表示表面的疏水性的值且后退接触角是相对准确地表示表面的亲水性的值,在本发明中,相比前进接触角,后退接触角的变化量大,因此通过后退接触角的变化获得关于表面亲水性的信息。在图2中示出所获得的图像和由此确定的水接触角。
如图2所示,作为阴性对照组使用的没有涂覆的PDMS示出高的疏水性,因此在前进接触角和后退接触角方面都示出高的水接触角,然而,在涂覆有PMPC的表面中水接触角显著减小,在涂覆有交联的PMPC的表面中水接触角进一步减小。也就是说,可确认:表面由于PMPC涂层而示出亲水性,在使PMPC交联的情况下,表面的亲水性进一步增大。
实验例2:利用X射线光电子能谱(XPS)的表面元素分析
为了确认通过上述实验例1确认的水接触角变化(即,亲水性程度的变化)是由于引入磷酸胆碱基而引起的,利用XPS实施表面元素分析,其结果在图3中示出。
如图3所示,相比没有涂覆的PDMS,涂覆有交联的PMPC的表面的氧含量保持相同的水平,但是碳和/或硅的比率显著降低。具体地,关于碳峰,亚甲基和/或甲基的峰大幅减小,同时开始形成-C-O-和-C=O键的峰。此外,在没有涂覆的PDMS中没有检测到的氮和磷的含量大幅增加。将该结果与在涂覆有交联的PMPC的表面中测量所述水接触角的结果(测量值显著减小)比较时,所述水接触角减小(即亲水性增加)与表面中负电性相对高的氧、氮和/或磷的含量增加相一致,这也示出包括这些元素的磷酸胆碱基的含量增加。
此外,涂覆有没有交联的PMPC的表面没有示出明显的氮和/或磷峰,推断这是因为由于利用超声波的强烈的洗涤大部分涂层损坏或没有考虑被涂覆在表面上的聚合物的量由于交联剂而增加的效果。这表示根据本发明的交联的PMPC涂层由于交联而即使在强的刺激下也不会损坏。
实验例3:蛋白质的吸附程度测量
通过二辛可宁酸(bicinchoninic acid,BCA)测定来确认通过所述实施例1(交联)和比较例1(一般)而制备的涂覆有交联的PMPC或非交联的PMPC的PDMS假体表面的蛋白质吸附。作为阴性对照组,使用没有涂覆的PDMS(未涂覆)。所述蛋白质使用牛血清白蛋白(Bovine Serum Albumin,BSA)和牛血浆纤维蛋白原(bovine plasma fibrinogen,BPF)。在利用浓度为4.5mg/ml的BSA或浓度为0.3mg/ml的BPF分别将没有涂覆的PDMS、涂覆有PMPC的PDMS和涂覆有交联的PMPC的PDMS在37℃下培养1小时后,在各条件下利用干净的杜氏磷酸盐缓冲液(DPBS)在37℃下以200rpm的转速将PDMS轻柔地洗涤两次(每次1分钟)。然后,为了量化被吸附在表面上的蛋白质的量,执行BCA测定。具体地,使用Thermo Scientific公司的BCA试剂盒,以25:24:1的体积比混合包含在试剂盒中的样品A、样品B和样品C,以制备测定溶液。将所洗涤的各PDMS放置在新的DPBS缓冲液中,并添加与缓冲液相同量的测定溶液,在60℃下培养1小时后,在570nm下测量吸光度,从而测量被吸附在表面的蛋白质的相对量。其结果分别在图4和图5中示出。
如图4和图5所示,相比没有涂覆的表面,吸附到PDMS表面的BSA在涂覆有PMPC的表面中减小24%且在涂覆有交联的PMPC的表面中减小33%,相比没有涂覆的表面,吸附到PDMS表面的BPF在涂覆有PMPC的表面中减小45%且在涂覆有交联的PMPC的表面中减小62%。也就是说,可确认:对于BSA和BPF,相比没有涂覆的表面,在涂覆有PMPC的表面中吸附均减少,尤其是,在涂覆有交联的PMPC的表面中蛋白质吸附均更显著地减少。
实验例4:细胞的吸附程度测量
考虑到包膜挛缩(capsular contracture)与成纤维细胞的过度增值和取决于其的胶原蛋白生成等密切相关,在通过所述实施例1(交联)和比较例1(一般)而制备的涂覆有交联的PMPC或非交联的PMPC的PDMS中培养成纤维细胞NIH 3T3细胞,以确认细胞吸附程度。在5%的二氧化碳和37℃下在包括10%的胎牛血清(FBS)的DMEM培养基中培养所述NIH 3T3细胞。为每个直径为1.5cm的PDMS分配30000个细胞,在5%的二氧化碳和37℃下培养45小时后,利用新的DMEM培养基(含有10%的FBS)轻轻洗涤后,执行CCK(细胞计数试剂盒)测定。CCK溶液使用同仁化学(Dojindo)公司的产品,将所洗涤的各PDMS放置在新的DMEM培养基(含有10%的FBS)中,并添加相当于培养基体积的10%的量的CCK溶液,然后在5%的二氧化碳和37℃下培养4小时,在450nm下测量吸光度,从而测量吸附在表面的细胞的相对量。其结果在图6中示出。
如图6所示,确认到,相比没有涂覆的PDMS,在涂覆有PMPC的表面中成纤维细胞的表面吸附显著减少(减少39%)。此外,在涂覆有交联的PMPC的PDMS上,确认到细胞吸附更显著地减少(减少69%)。因此,不仅能够显著减小整形后由于成纤维细胞的过度增值等而引起的诸如包膜挛缩的副作用,而且如在上述实施例1中所示,根据本发明的涂覆有交联的PMPC的PDMS即使在强的刺激下也能保持涂层状态,因此在整形后在强烈运动下或随着时间推移也能保持涂层状态,因此能够预测能够减小由涂层的脱落引起的副作用。
实验例5:生物体内包膜生成程度测量
将表面涂覆有PMPC的PDMS块和作为对照组的没有进行表面处理的PDMS块分别植入斯普拉-道来氏(Sprague-Dawley)大鼠背部的左侧和右侧,饲养一个月和三个月后观察体内反应。首先,测量围绕假体表面形成的包膜的厚度。进行H&E染色后,利用显微镜观察包膜的厚度,其结果在图7中示出。如图7所示,在一个月和三个月中,在植入体内的涂覆有PMPC的PDMS块的表面形成的包膜都比对照组薄。这种涂覆有PMPC的假体中所形成的包膜的减少表示由涂层引起的异物反应减少。此外,测量细胞质和血管质并在图8中示出,并通过免疫组织化学(immunohistochemistry)分析测量转化生长因子-β(TGF-β)、α-平滑肌肌动蛋白(smooth muscle actin,SMA)、髓过氧化物酶(myeloperoxidase)以及CD34的表达程度并在图9中示出。
其结果是,在植入被涂覆有PMPC的PDMS时,相比对照组,炎症细胞数显著降低,作为炎症指数的髓过氧化物酶水平在经过一个月和三个月后也均显著降低。此外,作为炎症反应和纤维组织形成指数的TGF-β、α-SMA分别在经过一个月和三个月时相比对照组也显著降低,该结果对应于,按包膜形成的时间顺序,随着组织的炎症反应减少而纤维组织的形成减少的顺序。相反,作为血管形成标志物的CD34的表达水平没有显著差异。这表示异物反应和血管形成之间的关联性小。
- 还没有人留言评论。精彩留言会获得点赞!