包含非离子性表面活性剂的新型药物组合物的制作方法
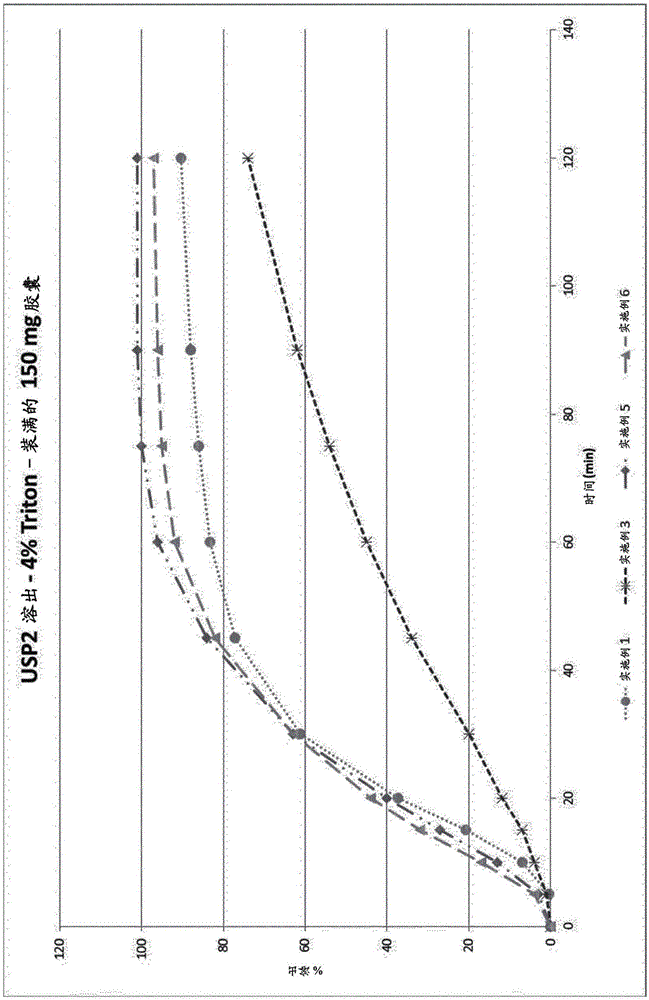
9-乙基-6,6-二甲基-8-(4-吗啉-4-基-哌啶-1-基)-11-氧代-6,11-二氢-5H-苯并[b]咔唑-3-甲腈为已知具有间变性淋巴瘤激酶(ALK)抑制活性的四环化合物(WO2010/143664)。间变性淋巴瘤激酶(ALK)是属于胰岛素受体家族的受体型酪氨酸激酶之一。据报道,ALK的基因改变导致与其它基因融合的异常激酶的产生。伴随ALK异常的病症的实例包括癌症和癌症转移。因此,ALK抑制剂将提供有效治疗和预防所述病症的药物。这种药物需要以可口服给药的制剂形式开发。然而,可口服给药的制剂的性质取决于药物化合物的生物利用度水平。作为影响生物利用度的因素,可考虑药物化合物的水溶性和溶出速度。通常,当水溶性差或不溶于水的化合物被口服给药时,其显示差的生物利用度。如果溶出时间超过胃肠道吸收区中的运送时间,缓慢的溶出也导致差的生物利用度。通过改善活性成分的口服吸收性质来提高生物利用度对于获得活性成分的药物效果的稳定和可再现的展示来说也是重要的。虽然本发明使用的9-乙基-6,6-二甲基-8-(4-吗啉-4-基-哌啶-1-基)-11-氧代-6,11-二氢-5H-苯并[b]咔唑-3-甲腈具有优异的ALK抑制活性,但它也是在整个pH范围内几乎不溶于水的弱碱。它在覆盖1至20和更高的HLB范围的多种配制的赋形剂中也难溶,其。由于其差的水溶性或在水中的不溶性,需要进一步研究以可口服给药的制剂形式开发它们。本发明提供了一种药物组合物,其可提高用于治疗人类癌症的9-乙基-6,6-二甲基-8-(4-吗啉-4-基-哌啶-1-基)-11-氧代-6,11-二氢-5H-苯并[b]咔唑-3-甲腈的生物利用度。此外,药物以分散形式给药,其促进化合物在与肠或胃肠道体液接触时快速和完全分散。药物的完全和精细分散转而能够使化合物快速溶出。由此,本发明的药物组合物还可降低人体暴露中的个体内和个体间的差异性,所述差异性经常伴随生物利用度差的药物。也避免由于溶解性而引起的任何障碍,诸如使用大量通常用于在溶液中溶解或分散难溶性化合物的赋形剂的引起的任何障碍。图1示出了根据实施例1、2、3、5、6、7和9制备的胶囊的生物相关介质(FeSSIF/USP4)中的溶出结果。图2示出了根据实施例1、3、5和6制备的胶囊在Triton介质(4%Triton/USP2)中的溶出结果。图3示出了根据实施例1和9制备的胶囊的Triton介质(4%Triton/USP2)中的溶出结果的差异。术语“活性药物成分”(或“API”)表示具有特定生物活性的药物组合物中的化合物或其药学上可接受的盐。术语“生物药剂学分类系统”或"BCS"是指由AmidonGL,H,ShahVP,CrisonJR在Pharm.Res.1995,12(3):413–20中理论化的生物制药药物分类的管理性(regulatory)术语并述于FDABCS指南中。术语“滴点(droppoint)”是指在特定测试条件下组合物从半固态转变为液态的温度。术语“游离碱当量”是指活性药物成分形式的药学上可接受的盐的重量,因此计算为活性药物成分形式的游离碱形式。例如,如果以盐的形式使用API,则提及“50mg游离碱当量的API”意指在完全解离该盐时,提供50mg游离碱所需的盐的量。术语“亲水-亲油平衡”(HLB)值表示非离子性表面活性剂的亲水性程度。HLB值由表面活性剂分子的亲水部分的分子量与其总分子量之比确定,如GriffinW.C.,JournaloftheSocietyofCosmeticChemists(1949)1:311所述。术语“药学上可接受的”表示可用于制备药物组合物的材料的属性,其通常是安全的、无毒的,并且既不是生物学上也不是其它方面不期望的,并且对于兽医以及人类药学用途是可接受的。术语“药学上可接受的盐”是指保持游离碱或游离酸的生物学有效性和性质的那些盐,其不是生物学上或其它方面不期望的。所述盐与无机酸和有机酸形成,所述无机酸诸如盐酸、氢溴酸、硫酸、硝酸、磷酸等,特别是盐酸,所述有机酸诸如乙酸、丙酸、乙醇酸、丙酮酸、草酸、马来酸、丙二酸、琥珀酸、富马酸、酒石酸、柠檬酸、苯甲酸、肉桂酸、扁桃酸、甲磺酸、乙磺酸、对甲苯磺酸、水杨酸、N-乙酰半胱氨酸等。此外,这些盐可通过向游离酸中添加无机碱或有机碱来制备。衍生自无机碱的盐包括但不限于钠盐、钾盐、锂盐、铵盐、钙盐、镁盐等。衍生自有机碱的盐包括但不限于以下有机碱的盐:伯胺、仲胺和叔胺;取代胺,包括天然存在的取代胺;环胺和碱性离子交换树脂,诸如异丙胺、三甲胺、二乙胺、三乙胺、三丙胺、乙醇胺、赖氨酸、精氨酸、N-乙基哌啶、哌啶、聚亚胺树脂等。式(I)化合物的具体药学上可接受的盐为盐酸盐、甲磺酸盐和柠檬酸盐。更具体地,式(I)化合物的药学上可接受的盐为盐酸盐。术语“药物组合物”(或“组合物”)表示施用于有此需要的哺乳动物例如人的包含治疗有效量的活性药物成分以及药学上可接受的赋形剂的混合物或溶液。术语“聚氧乙烯失水山梨醇脂肪酸酯”表示山梨醇及其酐的油酸酯,通常与环氧乙烷共聚。具体的聚氧乙烯失水山梨醇脂肪酸酯为聚氧乙烯20失水山梨醇单油酸酯,也称为聚山梨酯80或吐温80(T80)。术语“聚氧甘油酯”是指甘油的单酯、二酯和三酯与聚乙二醇的单酯和二酯的混合物。聚氧甘油酯的实例是辛酰己酰聚氧甘油酯、月桂酰聚氧甘油酯、亚油酰聚氧甘油酯、油酰聚氧甘油酯或硬脂酰聚氧甘油酯。聚氧甘油酯的具体实例为月桂酰聚氧甘油酯。更具体地,作为表面活性剂A的聚氧甘油酯为HLB为14且滴点为44℃的月桂酰聚氧甘油酯,特别是月桂酰macrogol-32甘油酯,也称为月桂酰polyoxyl-32甘油酯、月桂酰macrogol甘油酯、月桂酰基聚氧甘油酯、聚氧甘油月桂酸酯、PEG甘油月桂酸酯、氢化椰油PEG-32酯或Gelucire44/14。术语“丙二醇单月桂酸酯”是指月桂酸的丙二醇单酯和二酯的混合物。丙二醇单月桂酸酯的具体实例为丙二醇单月桂酸酯II型,其中单酯的含量等于或大于90%,也称为lauroglycol90(LG90)。术语“生育酚衍生物”是指任选通过连接基连接到聚合物或共聚物链的生育酚部分。具体的生育酚衍生物为生育酚聚乙二醇。更具体的生育酚衍生物为维生素E聚乙二醇琥珀酸酯。此外,具体的生育酚衍生物为维生素E聚乙二醇琥珀酸酯,其中聚乙二醇链的链长为1000,也称为TPGS、生育酚聚乙二醇琥珀酸酯、α-生育酚聚乙二醇琥珀酸酯、维生素EPEG琥珀酸酯、托可索仑(tocofersolan)和托可索仑(tocophersolan)。除非另有说明,否则所有百分比均以组合物总重量的重量百分比给出。本发明提供了一种药物组合物,其包含a)一种或多种活性成分或其药学上可接受的盐,b)在室温为固体的非离子性表面活性剂A,和c)在室温为液体的非离子性表面活性剂B,其中表面活性剂A和B的HLB独立地等于或大于8,并且其中活性成分或其药学上可接受的盐分散于由其它成分形成的基质中。本发明的一个具体实施方案为如本文所述的药物组合物,其中活性成分分散于由表面活性剂A和B形成的基质中。本发明的另一具体实施方案为如本文所述的药物组合物,其中活性成分呈微粉化形式。在如本文所述的本发明的另一具体实施方案中,微粉化活性成分的粒度为0.2μm至20μm。在如本文所述的本发明的更具体的实施方案中,微粉化活性成分的粒度为0.2μm至15μm。在本文所述的本发明的另一具体实施方案中,微粉化活性成分的粒度为0.2μm至8μm。本发明的一个具体实施方案为如本文所述的药物组合物,其仅包含一种活性成分或其药学上可接受的盐。本发明的另一具体实施方案为如本文所述的药物组合物,其中活性成分或其药学上可接受的盐之一为根据生物药剂学分类系统的III类或IV类药物。本发明的一个具体实施方案为如本文所述的药物组合物,其中活性成分或其药学上可接受的盐之一为根据生物药剂学分类系统的IV药物。本发明的另一具体实施方案为如本文所述的药物组合物,其中活性成分之一为激酶抑制剂或其药学上可接受的盐。本发明的一个具体实施方案为如本文所述的药物组合物,其中活性成分之一为ALK抑制剂或其药学上可接受的盐。本发明的一个具体实施方案为如本文所述的药物组合物,其中活性成分之一为9-乙基-6,6-二甲基-8-(4-吗啉-4-基-哌啶-1-基)-11-氧代-6,11-二氢-5H-苯并[b]咔唑-3-甲腈或其药学上可接受的盐。本发明的一个更具体实施方案为如本文所述的药物组合物,其中活性成分之一为9-乙基-6,6-二甲基-8-(4-吗啉-4-基-哌啶-1-基)-11-氧代-6,11-二氢-5H-苯并[b]咔唑-3-甲腈或其药学上可接受的盐且呈结晶形式。本发明的另一更具体实施方案为如本文所述的药物组合物,其中活性成分之一为9-乙基-6,6-二甲基-8-(4-吗啉-4-基-哌啶-1-基)-11-氧代-6,11-二氢-5H-苯并[b]咔唑-3-甲腈盐酸盐。本发明的另一具体实施方案为如本文所述的药物组合物,其包含20至250mg游离碱当量的9-乙基-6,6-二甲基-8-(4-吗啉-4-基-哌啶-1-基)-11-氧代-6,11-二氢-5H-苯并[b]咔唑-3-甲腈。本发明的另一更具体实施方案为如本文所述的药物组合物,其包含20至225mg游离碱当量的9-乙基-6,6-二甲基-8-(4-吗啉-4-基-哌啶-1-基)-11-氧代-6,11-二氢-5H-苯并[b]咔唑-3-甲腈。本发明的另一更具体实施方案为如本文所述的药物组合物,其包含100至200mg游离碱当量的9-乙基-6,6-二甲基-8-(4-吗啉-4-基-哌啶-1-基)-11-氧代-6,11-二氢-5H-苯并[b]咔唑-3-甲腈。本发明的另一更具体实施方案为如本文所述的药物组合物,其包含125至175mg游离碱当量的9-乙基-6,6-二甲基-8-(4-吗啉-4-基-哌啶-1-基)-11-氧代-6,11-二氢-5H-苯并[b]咔唑-3-甲腈。本发明的另一更具体实施方案为如本文所述的药物组合物,其包含150mg游离碱当量的9-乙基-6,6-二甲基-8-(4-吗啉-4-基-哌啶-1-基)-11-氧代-6,11-二氢-5H-苯并[b]咔唑-3-甲腈。本发明的另一更具体实施方案为如本文所述的药物组合物,其包含161mg的9-乙基-6,6-二甲基-8-(4-吗啉-4-基-哌啶-1-基)-11-氧代-6,11-二氢-5H-苯并[b]咔唑-3-甲腈盐酸盐。本发明的另一具体实施方案为如本文所述的药物组合物,其特征在于药物组合物的滴点为32至41℃。本发明的另一具体实施方案为如本文所述的药物组合物,其特征在于药物组合物的滴点为35至39℃。本发明的另一具体实施方案为如本文所述的药物组合物,其中表面活性剂A的HLB等于或大于12。本发明的另一具体实施方案为如本文所述的药物组合物,其中表面活性剂B的HLB等于或大于12。本发明的另一具体实施方案为如本文所述的药物组合物,其中表面活性剂A为生育酚衍生物或聚氧甘油酯。本发明的一个具体实施方案为如本文所述的药物组合物,其中表面活性剂A为生育酚衍生物或辛酰己酰聚氧甘油酯、月桂酰聚氧甘油酯、亚油酰聚氧甘油酯、油酰聚氧甘油酯或硬脂酰聚氧甘油酯。在如本文所述的本发明的另一具体实施方案中,其中聚氧甘油酯的滴点为40至48℃。本发明的一个更具体实施方案为如本文所述的药物组合物,其中聚氧甘油酯的滴点为40至46℃。本发明的一个更具体实施方案为如本文所述的药物组合物,其中月桂酰聚氧甘油酯的亲水-亲油平衡(hydrophilicbalance)为12-15且滴点为40至46℃。本发明的一个更具体实施方案为如本文所述的药物组合物,其中表面活性剂A为生育酚衍生物或月桂酰聚氧甘油酯。本发明的一个具体实施方案为如本文所述的药物组合物,其中生育酚衍生物为生育酚聚乙二醇酯。本发明的一个更具体实施方案为如本文所述的药物组合物,其中生育酚衍生物为维生素E聚乙二醇琥珀酸酯。本发明的一个更具体实施方案为如本文所述的药物组合物,其中生育酚衍生物为维生素E聚乙二醇琥珀酸酯,其中聚乙二醇链的链长为1000。本发明的一个更具体实施方案为如本文所述的药物组合物,其中月桂酰聚氧甘油酯的HLB为14且滴点为44℃。本发明的一个更具体实施方案为如本文所述的药物组合物,其中表面活性剂A为维生素E聚乙二醇琥珀酸酯,其中聚乙二醇链的链长为1000,或者月桂酰聚氧甘油酯,其HLB为14且滴点为44℃。本发明的另一具体实施方案为如本文所述的药物组合物,其中表面活性剂B为辛酰己酰聚氧甘油酯、聚氧乙烯失水山梨醇脂肪酸酯、丙二醇单月桂酸酯I型或丙二醇单月桂酸酯II型。本发明的一个具体实施方案为如本文所述的药物组合物,其中表面活性剂B为聚氧乙烯失水山梨醇脂肪酸酯或丙二醇单月桂酸酯II型。本发明的一个更具体实施方案为如本文所述的药物组合物,其中聚氧乙烯失水山梨醇脂肪酸酯选自聚氧乙烯20失水山梨醇单月桂酸酯、聚氧乙烯(4)失水山梨醇单月桂酸酯、聚氧乙烯20失水山梨醇单棕榈酸酯、聚氧乙烯20失水山梨醇单硬脂酸酯、聚氧乙烯(4)失水山梨醇单硬脂酸酯、聚氧乙烯20失水山梨醇三硬脂酸酯、聚氧乙烯20失水山梨醇单油酸酯、聚氧乙烯(5)失水山梨醇单油酸酯、聚氧乙烯20失水山梨醇三油酸酯和聚氧乙烯20失水山梨醇单异硬脂酸酯。本发明的一个更具体实施方案为如本文所述的药物组合物,其中聚氧乙烯失水山梨醇脂肪酸酯选自聚氧乙烯20失水山梨醇单月桂酸酯、聚氧乙烯20失水山梨醇单棕榈酸酯、聚氧乙烯20失水山梨醇单硬脂酸酯、聚氧乙烯20失水山梨醇单油酸酯和聚氧乙烯20失水山梨醇单异硬脂酸酯。本发明的一个更具体实施方案为如本文所述的药物组合物,其中聚氧乙烯失水山梨醇脂肪酸酯为聚氧乙烯20失水山梨醇单油酸酯。本发明的另一具体实施方案为如本文所述的药物组合物,其包含重量比为1:1至8:2的表面活性剂A和B。本发明的一个更具体实施方案为如本文所述的药物组合物,其包含重量比为7:3的表面活性剂A和B。本发明的一个具体实施方案为如本文所述的药物组合物,其包含9-乙基-6,6-二甲基-8-(4-吗啉-4-基-哌啶-1-基)-11-氧代-6,11-二氢-5H-苯并[b]咔唑-3-甲腈或其药学上可接受的盐;维生素E聚乙二醇琥珀酸酯;和聚氧乙烯20失水山梨醇单油酸酯。本发明的一个更具体实施方案为如本文所述的药物组合物,其包含4至50重量%的9-乙基-6,6-二甲基-8-(4-吗啉-4-基-哌啶-1-基)-11-氧代-6,11-二氢-5H-苯并[b]咔唑-3-甲腈盐酸盐;35至70%的维生素E聚乙二醇琥珀酸酯;和15至30重量%的聚氧乙烯20失水山梨醇单油酸酯。本发明的一个更具体实施方案为如本文所述的药物组合物,其包含20至225mg的9-乙基-6,6-二甲基-8-(4-吗啉-4-基-哌啶-1-基)-11-氧代-6,11-二氢-5H-苯并[b]咔唑-3-甲腈或其药学上可接受的盐;150至300mg的维生素E聚乙二醇琥珀酸酯;和50至150mg的聚氧乙烯20失水山梨醇单油酸酯。本发明的一个更具体实施方案为如本文所述的药物组合物,其包含150mg游离碱当量的9-乙基-6,6-二甲基-8-(4-吗啉-4-基-哌啶-1-基)-11-氧代-6,11-二氢-5H-苯并[b]咔唑-3-甲腈;245mg的维生素E聚乙二醇琥珀酸酯;和105mg的聚氧乙烯20失水山梨醇单油酸酯。本发明的一个更具体实施方案为如本文所述的药物组合物,其包含161mg的9-乙基-6,6-二甲基-8-(4-吗啉-4-基-哌啶-1-基)-11-氧代-6,11-二氢-5H-苯并[b]咔唑-3-甲腈盐酸盐;245mg的维生素E聚乙二醇琥珀酸酯;和105mg的聚氧乙烯20失水山梨醇单油酸酯。本发明的另一具体实施方案为如本文所述的药物组合物,可通过以下方式获得a)熔融表面活性剂A;b)混合熔融的表面活性剂A和液体表面活性剂B;且c)将活性成分或其药学上可接受的盐混悬于所获得的混合物中。本发明的另一实施方案为包含如本文所述的药物组合物的胶囊。本发明的另一实施方案为如本文所述的药物组合物在制备用于治疗或预防癌症的药物中的用途。本发明的另一具体实施方案为如本文所述的药物组合物在制备用于治疗或预防肺癌的药物中的用途。本发明的另一具体实施方案为如本文所述的药物组合物在制备用于治疗或预防非小细胞肺癌的药物中的用途。本发明的另一实施方案为如本文所述的药物组合物用于治疗或预防癌症的用途。本发明的另一具体实施方案为如本文所述的药物组合物用于治疗或预防肺癌的用途。本发明的另一具体实施方案为如本文所述的药物组合物用于治疗或预防非小细胞肺癌的用途。本发明的另一具体实施方案为如本文所述的药物组合物,其用于治疗或预防癌症。本发明的另一具体实施方案为如本文所述的药物组合物,其用于治疗或预防肺癌。本发明的另一更具体实施方案为如本文所述的药物组合物,其用于治疗或预防非小细胞肺癌。本发明的另一实施方案为制备如本文所述的药物组合物的方法,包括步骤a)、b)和c)a)熔融表面活性剂A;b)混合熔融的表面活性剂A和液体表面活性剂B;且c)将活性成分或其药学上可接受的盐混悬于所获得的混合物中。制备过程:在实施例1至9中,API是指9-乙基-6,6-二甲基-8-(4-吗啉-4-基-哌啶-1-基)-11-氧代-6,11-二氢-5H-苯并[b]咔唑-3-甲腈盐酸盐。所使用的胶囊为根据M.J.Rathbone,J.Hadgraft,M.S.Roberts(Eds.),Modified-ReleaseDrugDeliveryTechnology,MarcelDekker,NewYork,2003,pp.177–188制备并由Capsugel,France提供的Licaps胶囊1号。实施例根据以下制备方法制备:a)填充物质的制备表面活性剂A在密闭容器中在50-55℃加热直至完全熔融。表面活性剂B同时平衡至室温。将两种赋形剂容器搅拌并取出所需的量。将它们在共混容器中组合并短时间搅拌直至它们均匀。在填充物质冷却至约42-45℃后,分批添加微粉化的API,同时用螺旋桨型搅拌器搅拌填充物质。根据批量大小,共混容器需要保持在最低42℃。将混悬液搅拌至均匀。取决于共混容器,进行通过真空的额外脱气步骤,或者应当使用更长的搅拌时间以除去在API添加期间已经搅拌的任何空气。b)包囊/密封/干燥将填充物质转移到CFS包囊机(制造商:Capsugel,France)的料斗中。将料斗加热至40-45℃,保持填充物质温度范围为38-43℃。泵机组的加热选择在37℃。CFS在单个过程运行中进行包囊、密封和干燥。将密封的胶囊在室温储存,这导致填充基质的固化。由此,API被捕获在精细分散的状态中。溶出测试方法方法USP2溶出参数mL(手动取样),无需更换培养基。可根据实测的释放速率调整时间。位置样品从溶出介质的表面和旋转桨叶的顶部之间的中间区域抽出,离容器壁不小于1cm。对于自动取样(例如SotaxAT7或AT70),在取样时间之前将25mL测试溶液通过回路泵送以预冲洗取样管线和过滤器。前过滤器套管过滤器35μm(例如PSFIL035-SX-100)过滤器具有1μm玻璃纤维膜的25mm注射过滤器(PallCorporation;#PN4529);弃去前3mL。沉降篮(Sinker)日本沉降篮(供应商编号:65-190-012)分析方法在230nm处进行HPLC用于溶出介质的化学品和试剂可使用同等质量的试剂和化学品。化学品/试剂质量/纯度供应商编码水去离子水-HCl37%用于分析Merck1.00317TritonX-100用于分析Merck1.08603NaCl用于分析Merck1.06404溶出介质制备可使用替代制备和稀释方案。模拟胃液(SGF)pH1.2+4%TritonX-100精确称量4g氯化钠并溶于约1L水中。添加7mL37%发烟浓盐酸。称量40gTritonX-100,转移至溶液中并混合溶解。通过高效液相色谱确定仪器和条件(可使用等效仪器和适当的操作条件。)柱清洗:在测量最多6个样品溶液和1个对照溶液后,洗涤色谱柱。该柱清洗在下述条件下进行。流动相A:水/乙腈/三氟乙酸(1200:800:1)流动相B:乙腈/三氟乙酸(2000:1)流动相流量:通过改变如下所示的流动相A和流动相B的百分比控制浓度梯度。梯度:用于HPLC的化学品和试剂可使用同等质量的试剂和化学品。化学品/试剂质量/纯度供应商编码水HPLC级,去离子的--乙腈HPLC级Merck1.00030.2500TFAHPLC级Merck8.08260HPLC流动相制备在2l容量瓶中混合1200mLHPLC级的水和800mL乙腈,添加1mLTFA。使用之前脱气。柱清洗流动相A在2l容量瓶中混合1200mLHPLC级的水和800mL乙腈,添加1mLTFA。使用之前脱气。流动相B在2l容量瓶中混合2000mL乙腈,添加1mLTFA。使用之前脱气。关注的峰:组分近似保留时间(分钟)响应因子(RF)艾乐替尼(Alectinib)3.01.00运行时间:5分钟参考溶液(一式两份制备)可使用同等量和体积。150mg游离碱胶囊强度的参考溶液:称量9mg的艾乐替尼参考物质(盐酸盐)至50mL琥珀色容量瓶中。添加5mL乙腈:水(1:1v/v)并超声处理直至溶解。用溶出介质稀释至体积,混匀。参考溶液的稳定性:在琥珀色玻璃烧瓶中的参考溶液在室温稳定5天。样品溶液的稳定性:在HPLC小瓶中的样品溶液在室温在自动进样器中稳定11天。HPLC系统适用性测试:从最少6次参考溶液注射(参考溶液A和B的最少3次注射)计算的响应因子的相对标准偏差(Srel)必须小于或等于2.0%。如果Srel大于2.0%,则必须调查原因。可使用相同的原始数据重新评估SST,忽略如果发现根本原因且如果最少有6次进样可用时失败的注射。如果不是,则必须再次进行完整的分析。计算具有体积校正的溶出,取出体积未经替换原则:使用外部标准进行面积评价%校正的溶出:该方程适用于无介质替换的溶出计算通过未校正的UV/HPLC溶出%进行测定确定t=取样数目(t=1至x)%D(t)=第t个样品的%溶出%Dnc(t)=第t个样品的%未经校正的溶出AM=样品溶液的峰面积ASt=参考溶液的峰面积ESt=参考物质的质量(mg)P=以%计的参考物质的纯度L=样品的标签声明(mg)VM=溶出介质的体积(ml)VP=取样的体积(ml)VST=参考溶液的稀释(ml)溶出测试–USP4溶出参数用于溶出介质的化学品和试剂可使用同等质量的试剂和化学品。化学品/试剂质量/纯度供应商编码水去离子水-NaOH用于分析冰乙酸用于分析NaCl用于分析Merck1.06404SIF粉末V1用于分析溶出介质制备可使用替代制备和稀释方案。进食状态模拟肠液pH5.0溶解(精确称量):4.040gNaOH(小球)、8.650g冰乙酸、11.874gNaCl于约0.900L纯净水中。用1NNaOH或1NHCl调节pH至5。在室温用净化水补足体积(1.000L)。向约0.5L缓冲液中添加11.200g(精确称量)SIFPowderOriginal。搅拌直至粉末完全溶解。在室温用缓冲液补足体积(1.000L)。通过高效液相色谱法确定根据USP2方法进行参考溶液(一式两份制备)根据方法USP2使用其中描述的溶出介质(SGF+4%Triton-X)进行。HPLC系统适用性测试根据USP2方法进行计算根据USP2方法进行滴点确定设备:MettlerToledoFP90测量室:FP83HT方法描述:设备用二苯甲酮作为参考物质进行测试。将样品插入测量池中。将烘箱以1℃/分钟的加热速率加热低于估计的滴点约5℃。一旦从2.8mm开口释放液滴,设备将记录液滴在从开口落下期间通过光束时的样品的滴点。实施例1实施例2实施例3实施例4实施例5实施例6实施例7实施例8实施例9实施例10实施例11实施例12当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1