包含叶绿素a或脱镁叶绿酸a的皮肤状态改善用组合物的制作方法
本发明是在韩国教育部的支援下根据项目编号NN11700实现的,上述项目的研究管理专业机关为韩国研究财团,研究事业名称为“支援一般研究者事业(基本)”,研究项目名称为“开发与用于治疗急性骨髓性白血病的口服用FMS样酪氨酸激酶3(FLT3)抑制剂相关的研究”,主管机关为光州科学技术院,研究期间为2013年11月1日至2014年10月31日。
本专利申请主张2014年6月2日在韩国专利厅提交的韩国专利申请第10-2014-0067083号的优先权,上述专利申请的公开内容作为参照引入本说明书中。
本发明涉及包含叶绿素a或脱镁叶绿酸a的皮肤状态改善用组合物。
背景技术:
皱纹、下垂及松弛是由环境因素和遗传因素,如紫外线(UV)、红外线及激素的变化等各方面引起的皮肤老化的特征[1、2]。老化的皮肤的结构特征主要表现为真皮(dermis)的变化,而真皮由胶原(collagen)、透明质酸(hyaluronic acid)、弹性蛋白(elastin)、纤维连接蛋白(fibronectin)、蛋白聚糖(proteoglycan)及其他细胞外基质蛋白质(extracellular matrix protein)形成。在这种结构的结构要素中,主要由成纤维细胞(fibroblast)合成的第一型胶原在皮肤结合组织中,作为最丰富的蛋白质,对皮肤起支援强度和弹力性的作用[3]。
长期暴露于紫外线下成为早期皮肤老化或光辐射皮肤老化的主要原因[23]。光辐射皮肤老化可解释为由紫外线造成的反复性的炎症过程所引起的。皮肤炎症生产出多种基质金属蛋白酶(matrix metalloproteinase,MMP),这将会在真皮及表皮中以非正常方式分解细胞外基质,且引起丧失功能的基质结构要素的蓄积[24]。因基质分解和皮肤炎症等,而所积累的皮肤损伤会导致生产过多的基质金属蛋白酶,且这与皱纹的形成有关。
据报告,多种化合物及植物提取物对皮肤具有抑制炎症及改善皱纹的效果。对动物范例(无毛小鼠)口服给药维生素C、E、碧容健及月见草油(evening primrose oil)复合体的情况下,具有可以缓解因长期暴露于紫外线而产生的皱纹的效果[27]。据报告,人参成分、鞣花酸(ellagic acid)及绿茶的多酚(polyphenol)也具有改善由紫外线引起的皮肤老化的效果[28、29、30]。被解释为,大多数的多酚的皱纹改善效果与抗氧化作用有关[30],呈现改善皱纹效果的作用方式与基质金属蛋白酶的生成抑制有关。
在本发明中,发明人们发现了叶绿素a(Chlorophyll a)及脱镁叶绿酸a(Pheophorbide a)具有缓解由紫外线引起的皮肤炎症,及改善皱纹的效果。并且,脱镁叶绿酸a呈现出了抑制由紫外线诱导的基质金属蛋白酶生产的效果。这种研究结果表现出叶绿素a及脱镁叶绿酸a可以以皮肤状态改善用物质来被使用。
在本说明书全文中参照了多篇论文及专利文献,且其引用有所标记。所引用的论文及专利文献的公开内容,作为参照其全部插入于本说明书中,从而明确说明了本发明所属技术领域的水准及本发明的内容。
技术实现要素:
技术问题
本发明人们为了开发能够有效改善如紫外线等外部刺激引起的皮肤损伤的物质,研究并作出了努力。其结果发现,叶绿素a及脱镁叶绿酸a对如皮肤皱纹的改善及皮肤炎症的缓解等皮肤状态改善非常有效,从而完成了本发明。
因此,本发明的目的为提供皮肤状态改善用组合物。
本发明的另一目的及益处根据下述的发明的详细说明、发明要求保护范围及附图来更加明确。
解决问题的方案
根据本发明的一实施方式,本发明提供皮肤状态改善用组合物,包含叶绿素a或脱镁叶绿酸a有效成分。
根据本发明的再一实施方式,本发明提供紫外线引起的皮肤损伤预防、改善或治疗用组合物,包含叶绿素a或脱镁叶绿酸a作为有效成分。
根据本发明的另一实施方式,本发明提供晒伤预防或治疗用组合物,包含叶绿素a或脱镁叶绿酸a作为有效成分。
本发明人们为了开发能够有效改善如紫外线等外部刺激引起的皮肤损伤状态的物质,研究并作出了努力,其结果确认到,叶绿素a及脱镁叶绿酸a对如皮肤皱纹的改善及皮肤炎症的缓解等皮肤状态改善非常有效。
叶绿素(Chlorophyll)作为在植物中最丰富的成分,一般在以3:1至3:2的比率具有a、b型,存在于高等植物中。传统上,植物的叶绿素通过抗-炎症效果来用于管理伤口、烧伤及溃疡等的受伤[4],也作为用于增进健康的健康食品来使用过[5]。此外,包含叶绿素的植物提取物的化妆品组合物也为了管理皮肤损伤而被使用[6]。
叶绿素生成多个种类的派生物,而其中包含脱镁叶绿素(pheophytin)、脱镁叶绿酸(pheophorbide)、氯(chlorin)及植烷酸(phytanic acid)。以往的研究者阐明了包含叶绿素、脱镁叶绿素及脱镁叶绿酸的叶绿素派生物具有潜在的化学性癌预防功能[7、8]。并且,还阐明了,成罐头的绿色蔬菜共同包含的脱镁叶绿素、原焦脱镁叶绿酸(pyropheophytin)及脱镁叶绿酸派生物具有潜在肿瘤抑制效果[9、10]。可知的是,脱镁叶绿酸也用作对于癌进行光动力学治疗的光毒性(phototoxic)物质[11]。但是,现在还不知道脱镁叶绿酸或叶绿素对皮肤皱纹改善具有何种效果。
本说明书中的“皮肤状态改善”虽然意味着改善皮肤皱纹、缓解皮肤炎症或防止皮肤老化,但不局限于此。
皮肤皱纹是由包括阳光的多种因素引起真皮中的胶原纤维、弹力纤维等发生变性,且由于皮肤水分减少则皮肤弹性下降,从而皮肤发生折叠而形成的。在多种因素中紫外线为最主要的原因。
根据本发明任一实施例,若对小鼠照射紫外线后,口服给药叶绿素a或脱镁叶绿酸a,则具有改善皱纹的效果。
在皮肤炎症反应中免疫细胞的活性起重要的作用。被活化的免疫细胞或免疫细胞生产的细胞因子等通过不断刺激周围辅助细胞引起细胞的过度的活化或细胞凋亡,来诱发组织的破坏等副作用,从而引发炎症反应。在皮肤炎症反应中,黏附分子(adhesion molecule)在角化细胞(kerat inocyte)、单核细胞(monocyte)及淋巴细胞(lymphocyte)间的结合中起重要的作用,而黏附分子包括细胞内粘附分子-1(Intracel lular adhesion molecule-l,ICAM-l)、血管粘附分子-1(vascular adhesion molecules-1,VCAM-1)和E-选择(E-selection)等。如上所述的黏附分子将多种免疫相关细胞用皮肤组织浸润,从而通过皮肤细胞和免疫细胞间的各种相互反应来引发了炎症反应。因此,抑制这种粘合分子的表达,从而可以缓解皮肤炎症的反应。
根据本发明的任一实施例,在对小鼠照射紫外线后口服给药叶绿素a或脱镁叶绿酸a的情况下,细胞内粘附分子-1的表达降低,且真皮中的炎症细胞的浸润也减少了。这种结果表明,叶绿素a或脱镁叶绿酸a具有缓解由紫外线引起的皮肤炎症反应的效果。
皮肤老化根据对老化的影响因素可分为内因性老化(intrinsic aging)和外因性老化(extrinsic aging)。内因性老化为随着年龄的增长皮肤的结构和生理功能与环境无关的减退,外因性老化是因为皮肤长时间暴露于太阳光等外部环境而产生的。尤其,将光造成的老化称为光辐射皮肤老化(photoaging),紫外线会成为皮肤老化的生理学及形态学变化的主要原因。因紫外线生成有害活性氧后,若无法借助体内的多种保护装置来有效地去除,则会引发一系列的炎症反应来造成皮肤损伤。
本发明的叶绿素a或脱镁叶绿酸a具有改善紫外线引起的皮肤皱纹及缓解皮肤炎症的效果,这意味着,在皮肤老化中具有改善由光辐射皮肤老化引起的皮肤状态的效果。
紫外线分为紫外线A(UVA,200~280nm)、紫外线B(UVB,280~320nm)、紫外线C(UVC,320~400nm)三种,紫外线C基本上被臭氧层吸收,只有紫外线A和紫外线B到达地表,而对皮肤产生影响。尤其,其中紫外线B为在紫外线中对皮肤造成的损伤最为严重。紫外线B到达真皮上部,迅速引起烧伤或红斑,若进一步进行,则形成皮肤表层黑色素且造成色素的沉积,还会导致上皮细胞的增殖、DNA损伤等,从而诱发皮肤皱纹及皮肤癌。并且,据悉还会在皮肤细胞中诱发炎症反应。
如上所述,本发明的叶绿素a或脱镁叶绿酸a呈现出改善紫外线引起的皮肤皱纹及缓解皮肤炎症的效果,可有效地用于预防、改善及治疗紫外线引起的皮肤损伤。
本说明书中“晒伤(sunburn)”的主要原因为紫外线,若紫外接到达皮肤上,则不仅直接作用于血管壁,而且大部分被皮肤细胞吸收来进行刺激,使得分泌组织胺、前列腺素等炎症物质。其炎症物质通过增加血管壁的渗透性来将炎症细胞从血管移动至皮肤组织。即,由于紫外线皮肤发生炎症反应,从而出现红斑、热疳、疼痛、浮肿等症状。因此,若抑制炎症细胞在血管中向皮肤组织浸润,则抑制炎症反应,从而可以预防或治疗晒伤。
根据本发明的任一实施例,在对小鼠照射紫外线后口服给药叶绿素a或脱镁叶绿酸a的情况下,在真皮减少了炎症细胞的浸润。
根据本发明的任一实施例,向人体皮肤纤维芽细胞中照射紫外线后用脱镁叶绿酸a处理的情况下,减少了基质金属蛋白酶-1及基质金属蛋白酶-3的生产。
基质金属蛋白酶为铅-依赖性的肽链内切酶。它们可以分解所有种类的细胞外基质,且在细胞的增殖、分化、移动、血管的生成及细胞自杀中起重要的作用。尤其,紫外线增加皮肤中基质金属蛋白酶的生产来分解胶原,从而引起皮肤老化反应,如形成皱纹等。即,若在暴露于紫外线的皮肤中抑制基质金属蛋白酶生产,则可以预防或治疗紫外线引起的皮肤损伤。
可知的是,基质金属蛋白酶-1不仅参与在正常的生理反应分解细胞外基质,而且在疾病的进行过程中也分解细胞外基质,尤其,起分解第一、第二及第三型胶原的作用。
基质金属蛋白酶-3起分解Ⅱ、Ⅲ、Ⅳ、Ⅸ及Ⅹ类型胶原、蛋白聚糖(proteoglycans)、纤维连接蛋白(fibronectin)、层粘连蛋白(laminin)及弹性蛋白(elastin)的功能,并且,还活化其他基质金属蛋白酶,如基质金属蛋白酶-1、基质金属蛋白酶-7及基质金属蛋白酶-9等。因此,基质金属蛋白酶-3被认为在重组皮肤组织中最为主要的因子。
本发明的组合物可以以口服的皮肤改善用化妆品组合物来所提供。本发明的化妆品组合物包含上述叶绿素a或脱镁叶绿酸a作为有效成分以外,还包含食品组合物或在口服用医药上通常使用的成分,还可以包含通常的辅助剂,例如,抗氧化剂、安定化剂、增溶剂、维生素、颜料及香料等,并且包含载体。
本发明的口服用化妆品组合物所包含的载体为当制剂时通常所使用的,包含乳糖、葡萄糖、蔗糖、山梨醇、甘露醇、淀粉、阿拉伯树胶、磷酸钙、藻酸盐、明胶、硅酸钙、微晶纤维素、聚乙烯吡咯烷酮、纤维素、水、糖浆、甲基纤维素、羟基苯甲酸甲酯、羟基苯甲酸丙酯、滑石、硬脂酸镁及矿物油等,但是不局限于此。本发明的口服用化妆品组合物包含上述成分以外,还包含润滑剂、湿润剂、甜味剂、香味剂、乳化剂、悬浮剂、保鲜剂等。
并且,本发明的组合物可以以药学组合物来所提供。
根据本发明的优选实施例,本发明的组合物为(a)本发明的叶绿素a或脱镁叶绿酸a的药学有效量;以及(b)包含药学上可接受的载体的药学组合物。本说明书中的用语“药学有效量”意味着达成叶绿素a或脱镁叶绿酸a的效能或活性的充足的量。
本发明的组合物在以药学组合物制成的情况下,本发明的组合物包含药学上课接受的载体。被包含在本发明的药学组合物的药学上可接受的载体为当制剂时通常所利用的,包含乳糖、葡萄糖、蔗糖、山梨醇、甘露醇、淀粉、阿拉伯树胶、磷酸钙、藻酸盐、明胶、硅酸钙、微晶纤维素、聚乙烯吡咯烷酮、纤维素、水、糖浆、甲基纤维素、羟基苯甲酸甲酯、羟基苯甲酸丙酯、滑石、硬脂酸镁及矿物油等,但是不局限于此。除了上述成分之外,本发明的药学组合物还可以包含润滑剂、湿润剂、甜味剂、香味剂、乳化剂、悬浮剂、保鲜剂等。在Remington's Pharmaceut ical Sciences(19th ed.,1995)中详细记载了合适的药学上可接受的载体及制剂。
本发明的药学组合物可以口服给药。
本发明的药学组合物的合适的给药量为根据如制剂化方法、给药方式、患者的年龄、体重、性别、病态、饮食、给药时间、给药路径、排泄速度及反应灵敏性等因素来可以给予多种处方。
本发明的药学组合物在该发明所属技术领域内,随着普通技术人员可以容易地实施的方法,通过利用药学上可接受的载体及/或成型添加剂来制剂,从而以单位用量形态来进行制备或放入大用量容器内来可以进行制备。此时,剂型可以是油或水性媒介中的溶液、悬浮液、糖浆剂或油滑液形态或也可以是浓缩剂、散剂、粉末剂、颗粒剂、片剂、胶囊剂形态,还可以包含分散剂或安定化剂。
并且,本发明的组合物可以以食品组合物来进行提供。
根据本发明的优选实施例,本发明的组合物为(a)本发明的叶绿素a或脱镁叶绿酸a的食品学有效量;以及(b)包含食品学上可接受的载体的食品学组合物。
本发明的组合物在以食品组合物来制成的情况下,作为有效成分,不仅包含叶绿素a或脱镁叶绿酸a,而且还包含当制作食品时通常所添加的成分,例如:蛋白质、碳水化合物、脂肪、营养素、调味剂及香味剂。上述碳水化合物的例有单糖类,例如葡萄糖、果糖等;二糖类,例如麦芽糖、蔗糖、低聚糖等;以及多糖类,例如一般的糖,如糊精、环糊精等,以及糖醇,如木糖醇、山梨醇、赤藻糖醇等。作为香味剂可以使用天然香味剂[索马甜,甜菊提取物(例如甜叶菊甙A、甘草素等)]及合成香味剂(糖精、阿斯巴甜等)。例如,本发明的食品组合物在以口服液来制成的情况下,可以将包含本发明的土茯苓提取物之外,还可以包含柠檬酸、液态果糖、砂糖、葡萄糖、醋酸、苹果酸、果汁、杜仲提取物、大枣提取物、甘草提取物等。
发明的效果
概括本发明的特征及益处为如下:
(a)本发明提供皮肤状态改善用组合物,包含叶绿素a或脱镁叶绿酸a作为有效成分。
(b)根据本发明,叶绿素a或脱镁叶绿酸a具有改善紫外线引起的皮肤皱纹的效果。
(c)根据本发明,叶绿素a或脱镁叶绿酸a具有缓解紫外线引起的炎症反应的效果。
(d)本发明的组合物以口服给药为特征,可以以化妆品组合物、药学组合物及食品组合物来进行提供。
附图说明
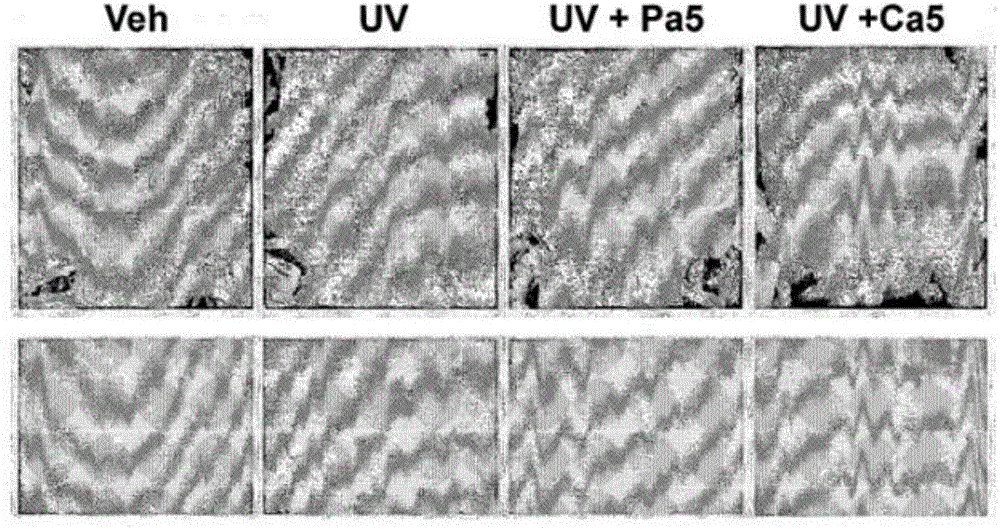
图1a为在给药脱镁叶绿酸a或叶绿素a的小鼠背部皮肤中,示出皱纹减少的图片。
图1b为在给药脱镁叶绿酸a或叶绿素a的小鼠群体中,示出视觉上的皱纹等级比仅照射紫外线的群体显著减少的图表。
图1c为在小鼠中因阴性复制物而出现的皱纹。
图1d为将背部的皱纹区域利用影子区域来所计算的图表。
图2a为在给药脱镁叶绿酸a的小鼠的真皮中,示出炎症细胞浸润与仅照射紫外线的小鼠相比减少的图片。
图2b为在给药脱镁叶绿酸a或叶绿素a的小鼠中,示出表皮厚度显著减少且真皮中的胶原束变得更厚的图片。
图2c为在给药脱镁叶绿酸a或叶绿素a的小鼠中,示出表皮厚度与仅照射紫外线的小鼠相比减少的图表。
图3a为在给药脱镁叶绿酸a的小鼠真皮中,示出炎症细胞浸润与仅照射紫外线的小鼠相比减少的图片。
图3b为示出在照射紫外线的小鼠的真皮上部和表皮中的细胞内粘附分子-1的表达与仅给药赋形剂(vehicle)的小鼠相比相当高的图片。在给药脱镁叶绿酸a或叶绿素a的小鼠中细胞内粘附分子-1的表达与仅照射紫外线的小鼠相比减少了。
图3c为示出在表皮中,将炎症细胞的浸润用显微镜观察计算结果,给药脱镁叶绿酸a或叶绿素a的小鼠中的炎症细胞的浸润与照射紫外线光的小鼠相比减少的图表。
图4a为在人皮肤成纤维细胞(hDF)照射紫外线且用各种浓度的脱镁叶绿酸a处理后,分析细胞存活率的图表。
图4b为在人皮肤成纤维细胞照射紫外线且用各种浓度的脱镁叶绿酸a处理后,用蛋白质印迹法分析基质金属蛋白酶-1、基质金属蛋白酶-2、基质金属蛋白酶-3的表达水平变化的图片。
图4c为在人皮肤成纤维细胞照射紫外线且用各种浓度的脱镁叶绿酸a处理后,用实时逆转录聚合酶链式反应(RT PCR)法分析基质金属蛋白酶-1的mRNA表达水平的图表。
图4d为在人皮肤成纤维细胞照射紫外线且用各种浓度的脱镁叶绿酸a处理后,用实时逆转录聚合酶链式反应法分析基质金属蛋白酶-2的mRNA表达水平的图表。
图4e为在人皮肤成纤维细胞照射紫外线且用各种浓度的脱镁叶绿酸a处理后,用实时逆转录聚合酶链式反应法分析基质金属蛋白酶-3的mRNA表达水平的图表。
图5a为在人皮肤成纤维细胞照射紫外线且用各种浓度的脱镁叶绿酸a处理后,用蛋白质印迹法分析磷酸化c-Jun氨基末端激酶(pJNK)、c-Jun氨基末端激酶(JNK)、磷酸化细胞外信号调节激酶l/2(pERKl/2)及细胞外信号调节激酶l/2(ERK1/2)的蛋白质的表达水平变化的图片。
图5b为示出在人皮肤成纤维细胞中处理脱镁叶绿酸a且用共聚焦显微镜(confocal)观察2小时的脱镁叶绿酸a与浓度成比列地位于细胞质的图片。
具体实施方式
以下,通过实施例本来对本发明进行更详细的说明。这些实施例仅是用于更具体地说明本发明的,对本发明所属领域内的普通技术人员而言,本发明的保护范围不随本发明的主旨而局限于这些实施例是不言自明的。
实施例
实验材料及实验方法
细胞培养
人皮肤成纤维细胞(primary human dermal fibroblast,hDF)细胞株由全南大学医科大学金诚贞教授提供。细胞培养为在37℃,5%的CO2条件使用添加5%胎牛血清(fetal bovine serum,Gibco Laboratories,Grand Island,NY,USA)及1%青霉素(penici 11in,100units/ml)/链霉素(streptomycin,100mg/ml)的达尔伯克改良伊格尔培养基(Dulbecco's Modified Eagle's Medium(DMEM,Gibco Laboratories,Grand Island,NY,USA))培养。
紫外线照射方法
使用了紫外光源具有280nm及380nm发光范围的飞利浦TL20W/12卢比的荧光日光灯(Philips TL 20W/12RS fluorescent sun lamp)。采用紫外线测定仪(GUVx-TlxGS5-LA2,Genicom Daejeon,Korea)测定了皮肤表面的紫外线强度。与紫外光源相距30cm处的紫外线照射强度为1.0mW/cm2。在培养皿将细胞培养至75~80%,然后用磷酸盐缓冲液清洗两次后,照射紫外线并处理了实验物质。此后,在遮光的状态下,直到进行下一个分析为止继续培养。
为了对动物照射紫外线,首先对小鼠背部皮肤照射了最小红斑剂量(minimal erythema dose,MED)。最小红斑剂量意味着,在照射24小时后可以诱导具有显著界限的红斑(erythema)的最小量。将紫外线以每周3次对小鼠照射了8周。前3周,每次将照射量增加1MED(本发明中1MED=30mJ/cm2),此后维持3MED。
细胞存活率分析(Cell viability assay)
为了分析细胞活性采用了水溶性四氮唑试验(water soluble tetrazolium test)方法。利用EZ Cytox细胞活力检测试剂盒(Ez-cytox Cell Viability Assay Kit(Daei 1Lab Co,Seoul,Korea))分析了活细胞的定量。通过利用变色龙多标签读板(Chameleon multi-label plate reader(Hidex Personal Life Science,Hidex Oy,Finland))在450nm下测定吸光度,来用光谱测定法分析了甲月替染料(formazan dye)。
实时逆转录聚合酶链式反应(Real-time RT-PCR)
根据制备者的指示使用Trizol试剂(Invitrogen,Carlsbad,CA,USA),分离了所有RNA。利用ImProm IITM反转录系统(ImProm-IITM Reverse Transcription system(Pr omega,Madison,WI,USA))来用2.5μg的所有RNA合成了cDNA。为了分析各基因的表达水平,利用荧光定量DNA扩增仪(DNA Engine Opticonl(MJResearch,Waltham,MA,USA))来用上述合成的cDNA进行了PCR扩增。为了在PCR扩增过程中探测荧光,利用了SYBR Premix Ex Taq(Takara Bio,Otsu,Japan),通过将全部分量为10μl,其中1μl的cDNA/control及个基因包含特异性引物来进行了PCR扩增。所使用的引物如下:
基质金属蛋白酶-1
正方向CTG AAG GTG ATG AAG CAG CC
逆方向AGT CCA AGA GAA TGG CCG AG
基质金属蛋白酶-2
正方向GAT ACC CCT TTG ACG GTA AGG A
逆方向CCT TCT CCC AAG GTC CAT AGC
基质金属蛋白酶-3
正方向ATT CCA TGG AGC CAG GCT TTC
逆方向CAT TTG GGT CAA ACT CCA ACT GTG
甘油醛-3-磷酸脱氢酶(GAPDH)
正方向CGG AGT CAA CGG ATT TGG TCG TAT
逆方向AGC CTT CTC CAT GGT GGT GAA GAC
PCR扩增反应进行条件如下:
(1)在95℃下,变性(denaturation)10分钟
(2)循环40回:变性(95℃下,一秒),退火(60℃下,5秒)伸展(72℃下,25秒)。
蛋白质印迹法分析
从样品到所有蛋白质提取物准备在溶解试剂50mM Tris(pH 7.4),150mM NaCl,1mM EGTA,1%NP-40,0.25%sodium deoxycholate,1mM PMSF,and phosphatase inhibitor mixture(Sigma,St Louis,MO,USA)}里后加热5分钟。利用Bio-Rad蛋白测定染料试剂浓缩物(Bio-Rad Protein Assay Dye Reagent Concentrate(Bio-Rad Laboratories,Hercules,CA,USA))来将溶解的蛋白质定量后,用聚丙烯酰胺凝胶电泳(SDS-PAGE)进行分离并移至聚偏氟乙稀(polyvinylidene di fluoride,PVDF)膜(Amersham Pharmacia Biotech,Piscataway,NJ,USA)。在4℃下,将膜用特定的一次抗体反应一个晚上后,利用化学发光检测试剂盒(chemiluminescence detection kit(Amersham Pharmacia Biotech))对与辣根过氧化物酶(horseradish peroxidase,HRP)相连接的二次抗体和蛋白质带进行了视觉化。所使用的各个一次抗体如下:基质金属蛋白酶-1(Chemicon,Bedford,MA,USA)、基质金属蛋白酶-2(Chemicon,Bedford,MA,USA)、基质金属蛋白酶-3(Epitomics,Burl ingame,CA,USA)、磷酸化c-Jun氨基末端激酶(phospho c-Jun N-terminal kinase,pJNK)、c-Jun氨基末端激酶、磷酸化细胞外信号调节激酶(phospho extracellular signal-regulated kinase,pErk)及细胞外信号调节激酶(所有Cell Signaling Technology,Beverly,MA,USA)。
共聚焦显微镜(Confocal microscopy)
在盖玻片(coverslip)上,以5×104/well培养人皮肤细胞后,将脱镁叶绿酸a在37℃下不部暴露于光的状态下处理了2小时。而且,在磷酸缓冲盐溶液中用4%的多聚甲醛固定了细胞。在440nm的激发波长(excitation wavelength)及655nm的发射波长(emission wavelength)下,利用FV1000共聚焦显微镜(FV1000confocal microscope(Olympus,Tokyo,Japan))对脱镁叶绿酸a的荧光进行了视觉化。荧光强度决定了细胞内是否吸收脱镁叶绿酸a。
实验动物
使从查尔斯河实验室(Charles River Laboratories(Wilmington,MA))购买的6周龄雌性SKH-1无毛小鼠适应一周。有空调的房间以12小时有光/12小时无光的周期,在可以自由地吃的条件下,饲养小鼠。房间温度维持在23士3℃,湿度维持在55士15%。所有实验由光州科学技术学院动物实验伦理委员会(animal care and use committee)承认。
试验物质的口服给药
适应期满后,将小鼠以每个群体6只分成了4个群体。各群体如下:
(a)阴性对照组
(b)仅照射紫外线的阳性对照组
(c)照射紫外线的同时每天给药5mg/kg叶绿素a的群体
(d)照射紫外线的同时每天给药5mg/kg脱镁叶绿酸a的群体
将叶绿素a(Ca,Sigma-Aldrich,St Louis,MO,USA)或脱镁叶绿酸a(Pa,Frontier Scientific,Logan,UT,USA)分别溶解于40%的400溶液的聚乙二醇(Sigma-Aldrich,St Louis,MO,USA)中使用。作为控制的赋形剂(vehicle),仅用40%的400溶液的聚乙二醇制备后给药阴性对照组及阳性对照组群体的小鼠。在照射紫外线后立即进行了试验物质的给药。
背部皮肤的皱纹评价
继续暴露于低用量的紫外线后,为了获得背部皮肤的临床的图像(clinical),使用了数码相机(Sony Cyber shot DSC-W570,5Xoptical zoom,16.1megapixels,Sony Corporation,Tokyo,Japan)。放大的皱纹可以使用数码相机上的 IIHybridM(3Gen,LLC,San Juan Capistrano,CA,USA)来获得。根据Bissett等[20]记述的方法对小鼠背部的皱纹定了等级。由此定的等级如下:
等级0-无任何粗皱纹的情况;
等级1-由少数的浅的粗皱纹的情况;
等级2-由一些粗皱纹的情况;
等级3-由多个粗皱纹的情况。
为了分析皮肤的皱纹,使用了以阴性雕刻的复制物,此方法由柳等[21]所记述的方法。即,将半流动体的硅聚合物与催化剂(Imprint II GarantTM Light Body,3M)相混合后,在背部皮肤上适用了,使足以渗透至越过轮廓线渗入到皱纹内。形成了复制物,在具有设定的入射角(incident angle)的标准灯光下,对此复制物进行了分析,使得生成与皱纹的高度成比例的反射影子。采用图像分析软件(ImageJ software,NIH Image,National Institutes of Health,Bethesda,MD,USA;online at:http://rsb.info.nih.gov/ij/)从图像影子区域测定了所截的图像。
组织学检查
将从照射紫外线的小鼠背部辟出取出的组织样品固定在4%的多聚甲醛后,被包含于石蜡中。对厚度为4μm的薄的切片用苏木精(hematoxylin)及曙红(eosin)溶液进行了染色。为了视觉化胶原的沉积,用Accustain tr ichrorae stain(Sigma-Aldr ich,St.Louis,Missouri,USA)对切片进行了染色。采用i-Solution DT image acquisition and analysis program(IMT i-solution,Vancouver,Canada)及Leica microscope(Leica,Wetzlar,Germany)测定了从颗粒型角膜层的接合部位到真皮-表皮的接合部位的表皮厚度。为了评价表皮的厚度,在载玻片下测定了任意的十个部位。在高性能场计算了从表皮到皮下脂肪层的炎症细胞。
棉衣组织化学法(Immunohistochemistry)
使用厚度为5μm的石蜡切片,进行了对基质金属蛋白酶-1(Chemicon International,Temecula,CA,USA)、细胞内粘附分子-1(Santa Cruz Biotech,Santa Cruz,CA,USA)及Type 1Collagen(Santa Cruz Biotechnology,Sant Cruz载玻片,CA,USA)的免疫组织化学染色。使用二甲苯(xylene)及酒精从载玻切片去除石蜡并进行了水化。为了去除切片上的内生的(endogenous)过氧化物酶(peroxidase),在3%的H2O2中培养后,为了阻断非特异性的抗体结合部位,用3%的牛血清进行了培养。为了检出基质金属蛋白酶-1、type 1collagen及细胞内粘附分子-1,分别准备了小鼠抗-人类基质金属蛋白酶-1单克隆抗体(1:100)、山羊抗-人类type 1collagen多克隆抗体(1:100)及小鼠抗-人类细胞内粘附分子-1单克隆抗体(1:100)。随后,为了视觉化各抗体的特定靶,通过采用DAKO LSAB+system-HRPkit(DAKO Corporation,Carpinter ia,CA,USA)来适用了avidin-biot in-peroxidase complex方法。使用苏木精作为对照染色。
统计分析
各个的离体(in vitro)实验进行了3次,所有数据以平均±标准误差来表示。群体之间的显著差异用T检验(Student T test)及方差分析(ANOVA)进行了分析。p-value<0.05为在统计学上是显著的。
实验结果
在给药脱镁叶绿酸a或叶绿素a的群体中,皱纹的临床分数(clinical score)得到了改善。
连续8周对反复照射紫外线的无毛小鼠皮肤皱纹作出了评价。在小鼠的背部用数码相机拍摄了皱纹及阴性的复制图像(negative replica image)的皮肤特性,且用图像分析软件进行了分析(图1)。在将小鼠背部皮肤长时间反复暴露于紫外线的情况下,回诱导作为光辐射皮肤老化的典型特征的皱纹和皮肤变粗的现象。在照射紫外线后立即给药脱镁叶绿酸a或叶绿素a的情况下,与对照组相比皱纹的厚度明显被减少了,且显示出微细的皱纹。并且,两名熟练的专家确认了对于临床图片的视觉化的皱纹等级,结果示出给药脱镁叶绿酸a或叶绿素a的群体中的皱纹等级下降了。在复制图像中,给药脱镁叶绿酸a或叶绿素a的群体与对照组相比皱纹区域也减少了。
给药脱镁叶绿酸a或叶绿素a的小鼠的背部皮肤组织病理学得到了改善。
为了调查脱镁叶绿酸a或叶绿素a对由照射紫外线被诱导的炎症反应的影响,将照射紫外线的小鼠背部皮肤切片化后,用H&E进行了染色(图2)。在给药脱镁叶绿酸a或叶绿素a的情况下,确认到了,与对照组相比表皮和真皮上部的炎症细胞和浸润减少了。
表皮变厚意味着有过因照射紫外线而被诱导的炎症反应,将表皮的厚度用马森三色(Masson-trichrome)染色法作出了评价。在照射紫外线的情况下,与仅用赋形剂(vehicle)处理的群体相比表皮厚度增加了。在给药脱镁叶绿酸a或叶绿素a的群体中厚度减少表示的是炎症程度下降了。并且,观察到了,给药脱镁叶绿酸a或叶绿素a的群体与对照组的群体相比真皮中的胶原破坏更少。即,在仅照射紫外线的群体中观察到了表皮中的微细的胶原束,且随着真皮-表皮结合部位和上部真皮观察到退化的变透明的(hyalinized)物质被沉积而扩散。与此相反,在给药脱镁叶绿酸a或叶绿素a的群体中观察到,与对照组相比在真皮中厚的胶原束和上部真皮中退化的物质减少了。
给药脱镁叶绿酸a或叶绿素a的群体与仅照射紫外线的对照组相比细胞内粘附分子-1表达降低了。
细胞内粘附分子-1为媒介白细胞的相互作用并干涉收集炎症细胞的细胞表面的粘附分子(surface adhesion molecule)。紫外线的照射会在角质细胞中诱导细胞内粘附分子-1,众所周知细胞内粘附分子-1在发生炎症细胞浸润的炎症部位的细胞膜,以高的水平来表达[22]。对细胞内粘附分子-1进行免疫组织化学染色的结果,确认了紫外线处理的群体与仅处理赋形剂(vehicle)的群体相比在表皮和真皮上部细胞内粘附分子-1的表达程度增加了(图3)。这可能是因为在真皮上部发生了炎症细胞的浸润。给药脱镁叶绿酸a或叶绿素a的群体与仅照射紫外线的群体相比在表皮和真皮上部细胞内粘附分子-1的表达程度减少了。
若在人皮肤成纤维细胞(hDF)中照射紫外线后处理脱镁叶绿酸a,则基质金属蛋白酶(基质金属蛋白酶)生产会减少。
为了评价脱镁叶绿酸a对基质金属蛋白酶生产的影响,将人皮肤成纤维细胞培养至培养皿的80%后,照射紫外线(20mJ/cm2)并用各种浓度的(0、10、20、50μM)的脱镁叶绿酸a进行了处理。而且,在遮光的状态下将细胞培养72小时后,进行了细胞毒性评价。细胞的生存能力不受紫外线的照射及试验物质的处理的影响(图4a)。
并且,照射紫外线且处理试验物质后培养24小时,然后利用实时逆转录聚合酶链式反应方法分析了基质金属蛋白酶的mRNA水平。将甘油醛-3-磷酸脱氢酶基因作为内部的控制来适用,将对于甘油醛-3-磷酸脱氢酶的基质金属蛋白酶-1的相对量用条(bar)来表示(图4c至图4e)。在仅照射紫外线的情况下,基质金属蛋白酶-1/甘油醛-3-磷酸脱氢酶mRNA的水平增加了14倍。在处理脱镁叶绿酸a的情况下,基质金属蛋白酶-1及基质金属蛋白酶-3水平显著的减少了。基质金属蛋白酶-2mRNA水平基本上不受紫外线照射的影响。
为了确认基质金属蛋白酶蛋白质的表达水平,进行了蛋白质印迹法。分别对基质金属蛋白酶-l、基质金属蛋白酶-2及基质金属蛋白酶-3用一次抗体分析的结果,基质金属蛋白酶-1及3的量以与处理脱镁叶绿酸a的量成比例的方式减少了(图4b)。总之,呈现出蛋白质水平与mRNA表达水平相一致。
在人皮肤成纤维细胞(WF)中,脱镁叶绿酸a抑制由紫外线照射所诱导的胞外信号调节激酶(Mitogen-activated protein kinase,MAPK)磷酸化。
众说周知的是,基质金属蛋白酶与由紫外线照射所诱导的基质金属蛋白酶生产有关。要确认脱镁叶绿酸a对由紫外线照射引起的MAPK的磷酸化有何影响。为此,对照射紫外线的人皮肤成纤维细胞进行脱镁叶绿酸a处理,在遮光的状态下培养2小时后,将溶解细胞来进行了蛋白质印迹法(图5a)。为了确认被磷酸化c-Jun氨基末端激酶、c-Jun氨基末端激酶、被磷酸化的磷酸化细胞外信号调节激酶及细胞外信号调节激酶蛋白质的表达水平,适用了对各个把蛋白质的一次抗体。蛋白质印迹法分析结果,在处理20μΜ及50μΜ的脱镁叶绿酸a细胞中,观察到磷酸化的c-Jun氨基末端激酶及磷酸化的细胞外信号调节激酶的表达水平减少了。并且,基本的c-Jun氨基末端激酶蛋白质水平与脱镁叶绿酸a量成比例的减少了。
在人皮肤成纤维细胞中,利用共聚焦显微镜来对在2个小时内脱镁叶绿酸a被吸收的图像进行了视觉化(图5b)。在用蛋白质印迹法分析MAPK的结果中,在照射紫外线后处理10μΜ的脱镁叶绿酸a2小时的情况下,MAPK磷酸化抑制效果低于在20μΜ及50μΜ中显示的效果,这可能是因为与20μΜ及50μΜ相比在10μΜ的脱镁叶绿酸a中细胞吸收不够好。
参考文献
[1]Jenkins,G.,Molecular mechanism of skin aging.Mech.Ageing.Dev.2002,123,801-810.
[2]Kim,HH.,Lee,MJ.,Lee SR.,Kim KH.,et al.,Augmentation of UV-induced skin wrinkling by infrared irradiation in hairless mice.Mech.Ageing.Dev.2005,126,1170-1177.
[3]Gelse,K.,Poschl,E.,Aigner,T.,Col lagens―structure,function,and biosynthesis.Adv.Drug.Deliv.Rev.2003,55,1531-1546.
[4]Ferruzzi,MG.,Fai 11a,ML.,Schwartz,SJ.,Assessment of degradation and intestinal cell upt ke of carotenoids and chlorophyl 1derivatives from spinach puree using an in vitro digestion and Caco-2human cell model.J.Agric.Food.Chem.2001,49,2082-2089.[5]Schoefs,B.,Chlorophyl 1and carotenoid analysis in food products.Properties of the pigments and methods of analysis.Trends.Food.Sci.Techno 1.2002,13,361-371.
[6]Czerpak,R.,Pietryczuk,A.,Therapeutic,cosmetic and dietary significance of some algae.Postepy.Fitoterapi i.2009,10,168-174.
[7]Negishi,T,,Rai,H.,Hayat su,H.,Ant igenotoxic act ivity of natural chlorophylls.Mutat.Res.1997,376,97-100.
[8]Nakamura,Y.,Murakami,A.,Koshimizu,K.,Oh i gash i,H.,Identification of pheophorbide a and its related compounds in the leaves of Neptunia oleracea.Biosci.Biotechnol.Biochem.1996,60,1028-1030.
[9]Nakamura,Y.,Murakami,A.,Koshimizu,.,Oh i ash i,H.,Inhibitory effect of pheophorbide a,a chlorophyl 1related compound,on skin tumor promotion in ICR mice.Cancer.Lett.1996,108,247-255.
[10]Harttig,U.,Bai ley,G.S.,Chemoprevent ion by natural chlorophyl Is in'vivo:inhibition of dibenzo[a,l]pyrene-DNA adducts in rainbow trout liver.Carcinogenesis 1998,19,1323-1326.
[11]Dougherty,T.J.,Gomer,C.J.,Henderson,B.W.,et al.,Photodynamic therapy.J.Natl.Cancer.Inst.1998,90,889-905..
[12]Endo,H.,Hosoya,H,,Koyama,T.,Ichioka,M.,Isolation of 10-hydroxypheophorbi de a as a photosensitizing pigment from alcohol-treated chlorella cells.Agric.Biol.Chem.1982,46,2183-2193.
[13]Fuj ishima,I.,Sakai,T.,Tanaka,T.,Ryu,H.,et al.,Photodynamic Therapy Using Pheophorbide a arid Nd:YAG Laser.Neurol.Med.Chir.(Tokyo).1991,31,257-263.
[14]Matsuura,E.,Aoki,K.,Hirano,R.,Yamada,K.,Kawahara,H.,Photodynamic act ion of salted Takana or pheophorbide a in the salted Takana on erythrocyte of rats.Eiy.o To.Shokuryo.1977,30,307-311(in Japanese).
[15]Heaton J.W.,Marangoni A.G.,Chlorophyll degradation in processed foods and senescent planttissues.Trends.Food.Sci.Tech.1996,7,8-15
[16]Heinrich,M.,Bork,P.M.,Schmitz,M.L.,Rimpler,H.,et al.,Pheophorbide A from Solanum diflorum interferes with NF-B activation.Planta.Med.2001,67,156-157.
[17]Subramoniam,A.,Asha,V.V.,Nair,S.A.,Sasidharan,S.P.,et al.,Chlorophyll revisited:Anti-inflammatory activities of chlorophyll a and inhibition of expression of TNF-gene by the same.Inflammation.2012,35,959-966.
[18]Islam,M.N.,Ishita,I.J.,Jin,S.E.,Choi,R.J.,et al.,Anti-inflammatory activity of edible brown alga Saccharina japonica and its constituents pheophorbide a and pheophytin a in LPS-stimulated RAW 264.7 macrophage cells.Food.Chem.Toxicol.2013,55,541-548.
[19]Lee,J.Y.,Zhao,L.,Youn,H.S.,Weatherill,A.R.,et al.,Saturated fatty acid activates but polyunsaturated fatty acid inhibits Toll-like receptor 2 dimerized with Toll-like receptor 6 or 1.J.Biol.Chem.2004,279,16971-16979.
[20]Bissett,D.L.,Hannon,D.P.,Orr,T.V.,An animal model of solar-aged skin:histological,physical,and visible changes in UV-irradiated hairless mouse skin.Photochem.Photobiol.1987,46,367-378.
[21]Ryu,J.S.,Park,S.G.,Kwak,T.J.,Chang,M.Y.,et al.,Improving lip wrinkles:lipstickrelated image analysis.Skin.Res.Technol.2005,11,157-164.
[22]Krutmann,J.,Grewe,M.,Involvement of cytokines,DNA damage,and reactive oxygen intermediates in ultraviolet radiation-induced modulation of intercellular adhesion molecule-1 expression.J.Invest.Dermatol.1995,105(1 Suppl),67S-70S.
[23]Fisher,G.J.,Wang,Z.Q.,Datta,S.C.,Varani,J.,et al.,Pathophysiology of premature skin aging induced by ultraviolet light.N.Engl.J.Med.1997,337,1419-1428.
[24]Lee,Y.M.'Li,W.H.,Kim,Y..,Kim,K.H.,Chung,J.H.,Heat-induced MMP-1 expression is mediated by TRPVl through PKC alpha signaling in HaCaT cells.Exp.Dermatol.2008;17,864-870.
[25]Saarialho-Kere,U.K.,Crouch,E.C.,Parks,W.C.,Matrix metal loproteinase matr i lysin is const i tut ively expressed in adult human exocrine epithelium.J.Invest.Dermatol.1995,105,190-196.
[26]Ropke,C.D.,Sawada,T.C.,da Silva,V.V.,Michalany,N.S..,de Moraes Barros,S.B.,Photoprotect ive effect of Pothomorphe umbel lata root extract against ultraviolet radiation induced chronic skin damage in the hairless mouse.Clin.Exp.Dermatol.2005,30,272-276.
[27]Cho,H.S.,Lee,M.H.,Lee,J.W.,No,K.0.,et al.,Anti-wrinkling effects of the mixture of vitamin C,vitamin E,pycnogeno 1 and evening primrose oi 1,and molecular mechanisms on hairless mouse skin caused by chronic ultraviolet B irradiat ion.Photodermatol.Photoimmunol.Photomed.2007,23,155-162.
[28]Kang,T.H.,Park,H.M.,Kim,Y.B.,Kim,H.,et al.,Effects of red ginseng extract on UVB irradiat ion-induced skin aging in hairless mice.J.Ethnopharmacol.2009,123,446-451.
[29]Bae,J.Y.,Choi,J.S.,Kang,S.W.,Lee,Y.J.,et al.,Dietary compound ellagic acid alleviates skin wrinkle and inflammation induced by UV-B irradiation.Exp.Dermatol.2010,19,182-190.
[30]Vayalil,P.K.,Mittal,A.,Hara,Y.,Elmets,C.A.,atiyar,S.K.,Green tea polyphenols prevent ultraviolet light-induced oxidative damage and matri metal loproteinases expression in mouse skin.J.Invest.Dermatol.2004,122,1480-1487.
[31]Ferruzzi,M.G.,Blakeslee,J.,Digestion,absorption,and cancer preventative activity of dietary chlorophyll derivatives.Nutr.Res.2007,27,1-12.
[32]Muthusamy,V.,.Piva,T.J.,The UV response of the skin:a review of the MAPK,NF Β and TNF a signal transduction pathways.Arch.Dermatol.Res.2010,302,5-17.
[33]Yarr,M.,in:Wolff K(Ed.),Fitzpatrick's Dermatology in General Medicine,7th edn-Aging of Skin,McGraw-Hill,New York,2008,pp.963-973.
[34]undu,J.K.,Chun,K.S.,Kim,S.0.,Surh,Y.J.,Resveratrol inhibits phorbol ester-induced eye 1 ooxygenase-2 expression in mouse skin:MAPKs and AP-1 as potential molecular targets.Biofactors 2004,21,33-39.
[35]Sharma,S.D.,Meeran,S.M.,Katiyar,S.K.,Dietary grape seed pr oant hocyan i d i ns inhibit UVB induced oxidative stress and activation of m i t ogen-ac t i vat ed protein kinases and nuclear factor kappa B signaling in in vivo SKH-1 hairless mice.Mol.Cancer Ther.2007,6,995-1005.
[36]Cui,G.,Qin,X.,Zhang,Y.,Gong,Z.,et al.,Berber ine differentially modulates the activities of ERK,p38 MAPK,and JNK to suppress thl7 and thl t eel 1differentiation in type 1 diabetic mice.J.Biol.Chem.2009,284,28420-28429.
[37]Wu,L.C.,Lin,Y.Y.,Yang,S.Y.,Weng,Y.T.,Tsai,Y.T.,Antimelanogenic effect of c-phycocyanin through modulation of tyrosinase expression by upregulation of ERK and downregulation of p38 MAPK signaling pathways.J.Biomed.Sci.2011,18,74
- 还没有人留言评论。精彩留言会获得点赞!