用于保护母猪的后代免于猪流行性腹泻病毒的疫苗的制作方法
发明领域本发明涉及用于保护母猪的后代免于猪流行性腹泻病毒(pedv)感染的疫苗以及保护母猪的后代免于pedv感染的方法。
背景技术:
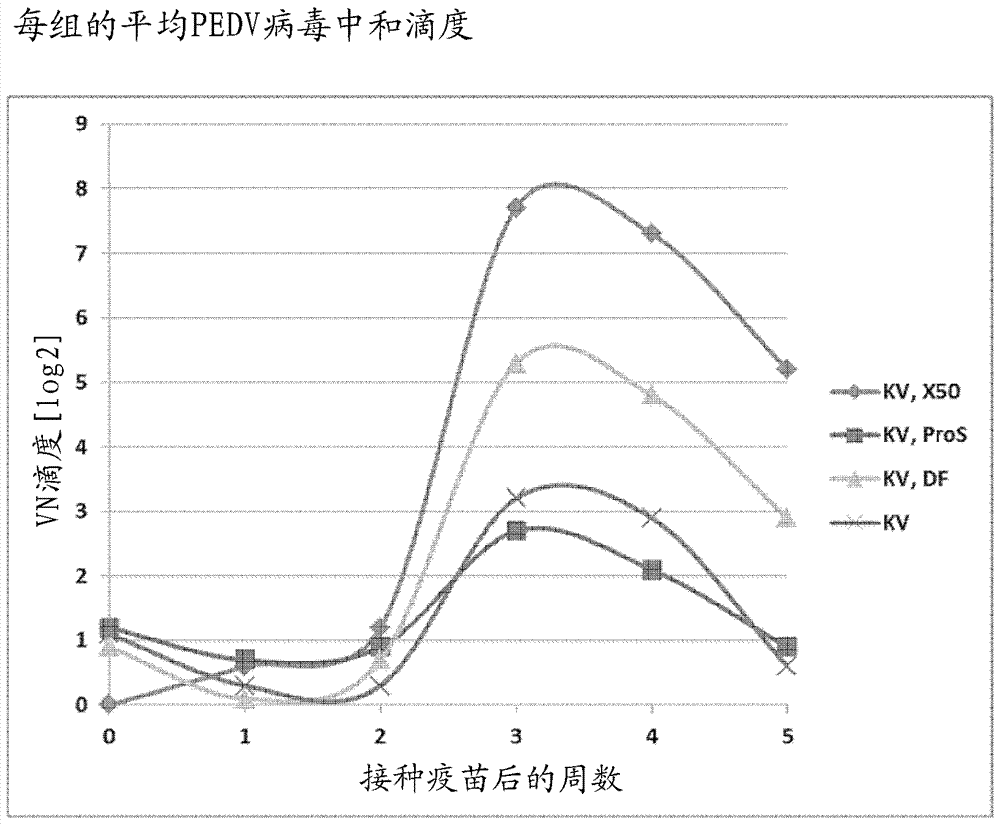
:猪流行性腹泻病毒(pedv)是冠状病毒科、甲型冠状病毒属的成员。其为正义(positive-sense)、有包膜、单链rna病毒。在1971年首次在英国育肥型和肥育猪中观察到猪流行性腹泻(ped)。在1980年代和1990年代,ped在整个欧洲,在国家诸如比利时、英国、德国、法国、荷兰和瑞士流行。这些爆发相对温和,且可以控制。目前,没有迹象表明欧洲存在pedv。伴随高死亡率的严重的pedv爆发在亚洲是常见的,其中它在某些地区可能已变得流行性。自2010年以来,中国已经出现了爆发的大幅增加,这是由于新毒株的出现,而目前pedv是导致亚洲养猪业的巨大经济损失的主要病原体之一。亚洲样pedv毒株在2013年4月首次进入美国,并且已传播至加拿大和拉丁美洲。pedv最通常经由与受感染的猪的粪-口接触来传播,并且也可能通过受污染的设备、污染物或人员引入。受感染的猪、肮脏的鞋子、衣服、手、设备或卡车可以传播该疾病。但也有迹象表明pedv可以通过空气传播。卫生和生物安全是最佳的预防手段。在猪中,疾病的严重程度是可变的,并且取决于畜群的流行病学状况。主要且通常唯一的临床体征是急性水样腹泻和呕吐。在未接种疫苗的动物中,可以在所有年龄的猪中都观察到呕吐、急性水样腹泻和食欲不振;发病率接近100%。尤其乳猪是非常易感的,并且它们通常表现出水样腹泻、脱水和代谢性酸中毒,其中死亡率通常在50%和80%之间。另一方面,育肥型和生长型猪表现出腹泻、厌食和抑郁症,其发病率高,但死亡率低(1-3%)。当将pedv感染的猪引入未接种疫苗的场所时,临床体征通常在4-5天内出现。pedv不能传播至人类。发明目标本发明的目标是设计适于保护幼猪免于pedv感染的疫苗。本领域中描述了旨在用于所有年龄的动物抵抗pedv感染的疫苗。然而,在许多情况下未报告或未明确报告实际保护。需要能够在幼猪中提供水平与典型猪在野生型感染后获得的抗体水平相当的病毒中和抗体(“vn”)的疫苗。发明概述为了实现本发明的目标,已经设计了用于通过以对应于至少3.0e6(即3.0x106)tcid50杀死的全pedv的抗原的剂量向母猪施用疫苗而保护母猪(术语“母猪”不排除雌性动物实际上是小母猪)的后代免于猪流行性腹泻病毒感染的疫苗,所述疫苗包含非活性pedv抗原和含油佐剂。已经显示,用该疫苗,母猪可以安全地免疫并且能够达到至少与pedv野生型感染后存活的动物中获得的典型滴度相当的vn滴度。油性佐剂看起来优于广泛使用的明矾佐剂,并且对于该特定疫苗是安全的(油的典型最小量为1%,但可以为2、3、4、5、6、7、8、9、10%或甚至更高)。本发明部分基于这样的认识:鉴于当前疫苗能够在接种疫苗的猪中诱导非常高滴度的vn抗体,接种疫苗的母猪的后代将获得相同水平或甚至更高水平的抗体,因为,如通常已知,母猪能够甚至进一步将这些抗体集中于其初乳中。这与母猪能够经由哺乳额外提供细胞介导的免疫的事实相结合,提供了当前疫苗完全适合于通过哺乳保护接种疫苗的母猪的后代免于pedv感染(通常称为生乳免疫)。优选地,母猪在怀孕时接种疫苗,但母猪也可以在临怀孕之前接种疫苗。实际上,天然水平滴度可以在至少四个月期间保护猪(参见:nationalhogfarmer,sep2,2014michaelmurtaugh,cheryldvorak,suzannestonedepartmentofveterinaryandbiomedicalsciences,universityofminnesota,st.paul;www.nationalhogfarmer.com)。因此,鉴于怀孕持续少于4个月的事实,在怀孕之前诱导高滴度应当能够经由哺乳提供对后代的保护,特别是当母猪进行重复接种疫苗时。例如,每8、10、12、14、16、18、20、22、24或26周(2、2½、3、3½、4、4½、5、5½或6个月)重复的常规一次性接种疫苗被认为足以诱导并保持所需水平的滴度水平。此外,当通过引发-加强接种疫苗(在通常2至4周的非常短时间段内的两次接种疫苗)替换(每次)一次性接种疫苗时,可以进一步改善滴度。本发明还涉及保护母猪的后代免于猪流行性腹泻病毒(pedv)感染的方法,所述方法包括向怀孕母猪施用包含非活性pedv抗原和含油佐剂的疫苗,其中所述疫苗包含对应于至少3.0e6tcid50杀死的全pedv的剂量的抗原。定义疫苗是保护免于接种疫苗后感染病原微生物的组合物,即预防或减少微生物感染或免于由感染导致的临床疾病的组合物,所述保护、预防或减少通常通过在接种疫苗的宿主中例如经由抗体干扰微生物本身来实现。接种疫苗因此预防或至少降低感染水平和/或预防或至少降低由该感染导致的临床疾病的水平。安全疫苗是这样的疫苗,其在施用疫苗之后的头24小时内引发典型的低于2.0℃、优选低于1.5℃、优选低于1.0℃的直肠温度升高,同时,如果其产生局部反应,所述反应必须是温和的(肿胀低于10cm2,优选低于5cm2,更优选低于3cm2,甚至更优选低于2cm2,最优选低于1cm2)和短暂的(在2周内、优选1周内、更优选3天内、最优选一天内消失)。非活的猪流行性腹泻病毒抗原意指不同于活的(能够复制的)全病毒的pedv抗原。具体而言,其涵盖杀死的病毒和病毒亚单位,后者任选地被重组表达。不可代谢的油是在动物的寿命期间(对于猪,这直到猪为26-30周龄),在施用之后不被个体动物代谢的油(矿物、天然或合成来源的液体物质,其不能与水自由混合)。所述油可以分布在动物体内,但不会被动物的代谢过程降解。实例是矿物油诸如液体石蜡油或重矿物油、天然油诸如角鲨烷(氢化的鲨鱼肝油)、以及合成油诸如合成c15-c17烃类。对应于至少“x”tcid50杀死的全pedv的非活抗原的剂量意指非活性抗原(即,不同于能够复制的全微生物的抗原)的剂量使得用非活抗原至少获得与用每剂量包含“x”tcid50杀死的全ped病毒的疫苗可以获得的vn滴度相同的vn滴度。杀死的全病毒意指由杀死(灭活)活的全病毒导致的抗原性构成。这不排除病毒颗粒在灭活或任何进一步下游处理期间至少部分破裂。对应于蛋白(的一部分)的多肽意指所述多肽至少含有该蛋白(的部分),其在蛋白(的该部分)的长度上与天然存在的蛋白具有至少80%的序列同源性,优选至少81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99直至最高达100%的序列同源性。pedv的刺突蛋白是约1400个氨基酸长的大型i型跨膜蛋白。像冠状病毒的其它刺突蛋白一样,所述蛋白是高度糖基化的。所述刺突蛋白被布置在两个结构域中:称为s1的负责受体结合的n-末端结构域和负责融合的c-末端s2结构域。实施方案在根据本发明使用的疫苗的一个实施方案中,所述抗原的剂量对应于至少1.5e7tcid50杀死的全pedv。在该剂量下,看起来可能获得对应于pedv野生型感染后诱导的峰值水平的滴度水平。在另一个实施方案中,所述油是不可代谢的油。不可代谢的油,尽管在许多情况下对猪不安全,但看起来优于其它佐剂,诸如广泛使用的可代谢的油和氢氧化铝凝胶,并且当以有限量施用时,特别是当油以小于50%v/v、优选小于40%v/v的量存在时,不可代谢的油对于该特定疫苗是安全的。降低油的量预期甚至进一步增加安全性。优选地,油的量在10%和40%之间,更优选地在15%和30%之间。在又另一个实施方案中,将所述油乳化在亲水性溶剂中。在亲水性溶剂诸如例如水中乳化所述油,预期进一步增加疫苗的安全性。在又另一个实施方案中,除了不可代谢的油以外,所述疫苗还包含维生素e乙酸酯。该油性、可生物降解的物质可以进一步改进疫苗功效和稳定性。在一个实施方案中,所述抗原含有对应于pedv的刺突蛋白的s1结构域的c末端三分之二的多肽。ped病毒的该部分已经证明能够并提供所需vn滴度。优选地,所述多肽对应于pedv的刺突蛋白的s1结构域或甚至pedv的整个刺突蛋白。一种将刺突蛋白呈递至免疫系统的简单方法是提供杀死的全pedv作为抗原。实施例实施例1病毒中和测定在vero细胞上使用病毒中和(vn)测定法测试血清中针对pedv的中和抗体的存在。简言之,在含有抗生素青霉素和链霉素的amem-tpb细胞培养基中制备测试样品或参考血清的连续两倍稀释液。每种稀释物与等体积的100tcid50的感染性pedv毒株混合,所述感染性pedv毒株在感染易感vero细胞后表达绿色荧光蛋白(gfp)。在37℃下预温育1小时后,将病毒/血清稀释混合物转移至含有vero-ccl81细胞的96孔微量滴定板。在37℃下温育48小时后,通过显微镜测定指示病毒复制的gfp荧光的程度。将抗体滴度计算为其中表明无病毒复制的最高血清稀释度的倒数的log2。获得的vn滴度被表示为从重复测量计算的平均值。以该方式,确定了在感染后存活的野生型pedv感染的猪中的vn滴度为5.0log2/ml或更高的水平,其中峰值水平为8.0至9.0log2。实施例2佐剂类型的影响研究设计20只pedv血清阴性的仔猪可用于该试验。当仔猪为大约五周龄时,将它们经由肌内(im)途径接种疫苗,并在其后2周加强。所有施加都给予至颈部中。所述疫苗在2ml中含有1.5·107tcid50的1mm双乙烯亚胺(bei)灭活的杀死的全pedv(细胞培养适应的dr13)。在临第一次接种疫苗之前和其后一、二、三、四和五周收集血液样品。从血液样品收集血清,并测定病毒中和抗体滴度。在每次接种疫苗当天和其后测量直肠温度。将动物分成四组,每组五只动物(参见表1)。第一组接受市售佐剂xsolve™(可得自msdanimalhealth,boxmeer,thenetherlands)中配制的杀死的全病毒疫苗,使得最终疫苗包含21%v/v的不可代谢的油marcol™52和1.25%v/v的可代谢的油维生素e乙酸酯。第二组接受市售佐剂diluvacforte™(可得自msdanimalhealth,boxmeer,thenetherlands)中配制的相同抗原,使得最终疫苗包含7.5%v/v的可代谢的油维生素e乙酸酯。第三组接受含有明矾水凝胶的疫苗prosystem™ce(可得自merckanimalhealth,usa)中配制的相同抗原。第四组接受无佐剂的水中配制的相同抗原。表1.动物组及其处理的概述组别仔猪数pedv抗原剂量佐剂15杀死的全病毒1.5e7tcid50xsolve25杀死的全病毒1.5e7tcid50diluvacforte35杀死的全病毒1.5e7tcid50prosystemce45杀死的全病毒1.5e7tcid50-结果体温每组的平均体温的概述显示于表2中。可以得出结论,没有一种疫苗引起超过1℃的严重温度升高,并且xsolve诱导了所测试的三种佐剂中的最大温度升高。在该组中观察到的最高个体温度升高为1.7℃。表2.第一次或第二次接种疫苗后取得的平均直肠温度。病毒中和测定每组的计算的平均vn滴度图示显示于图1中。可以得出结论,杀死的全病毒抗原能够诱导良好的vn滴度。佐剂的贡献如下:基于不可代谢的油的佐剂产生最高滴度,随后是基于可代谢的油的佐剂,其后是基于氢氧化铝凝胶的佐剂。实施例3非活抗原类型的影响研究设计60只pedv血清阴性的仔猪可用于该试验。当仔猪为大约五周龄时,将它们用2ml疫苗经由肌内(im)途径免疫,并在其后3周加强。所有施加都给予至颈部中。实验组的概述在表3中给出。在第一次接种疫苗之前和其后两、三、四、五和六周收集血液样品。从血液样品收集血清,并测定病毒中和抗体滴度。在接种疫苗当天和其后4和24小时测量直肠温度。在每次接种疫苗后,在接种疫苗后2、4、6、8、10、12和14天在接种疫苗部位上触诊所有仔猪。表3.动物组及其处理的概述材料和方法亚单位疫苗本研究中使用的亚单位疫苗中存在的抗原基于pedv刺突(s)蛋白的s1结构域。s1氨基酸序列源自与指标毒株usa/colorado/2013相同的美国分离株。使用全长s1结构域以及s1结构域的n-末端三分之一或c-末端三分之二。为了促进蛋白纯化和改善免疫原性,将一些s1蛋白用源自人或猪免疫球蛋白的fc片段c-末端标记。所有蛋白都在hek293t细胞中表达,纯化,并测定蛋白含量。简言之,用编码所需pedv多肽(任选地具有小鼠fc标签)的表达质粒转染hek293t细胞。转染后一天,用新鲜培养基替换细胞培养液。转染后六天,收集细胞培养基并将其通过离心澄清。随后通过与a蛋白琼脂糖珠结合来纯化多肽。在允许多肽结合珠粒后,将其使用pbs洗涤三次,并且将多肽洗脱于0.5mhacph3中。通过使用3mtrisph8.8中和ph(最终ph7.5)。最后,使用nanodrop在od280处测定多肽浓度。将多肽储存在-80℃下。s1蛋白的概述在图2中给出。在xsolve中以10μgs1蛋白/2ml剂量配制亚单位疫苗。杀死的病毒疫苗kv疫苗含有用1mmbei灭活的杀死的全pedv。该毒株,细胞培养适应的d13,与usa/colorado/2013共享93.3%的其氨基酸。将kv抗原在xsolve中配制为即用型制剂。病毒中和测定在vero细胞上使用病毒中和(vn)测定法测试血清中针对pedv的中和抗体的存在。简言之,在含有抗生素青霉素和链霉素的amem-tpb细胞培养基中制备测试样品或参考血清的连续两倍稀释液。每种稀释物与等体积的100tcid50的感染性pedv毒株混合,所述感染性pedv毒株在感染易感vero细胞后表达绿色荧光蛋白(gfp)。在37℃下预温育1小时时段后,将病毒/血清稀释混合物转移至含有vero-ccl81细胞的96孔微量滴定板。在37℃下温育48小时后,通过显微镜测定指示病毒复制的gfp荧光的程度。将抗体滴度计算为其中表明无病毒复制的最高血清稀释度的倒数的log2(每50µl)。获得的vn滴度被表示为从重复测量计算的平均值。在允许使用毒株dr13或毒株gd01的替代vn测试中测试合并的血清。由于gd01需要胰蛋白酶用于感染,如下修改上述方法:在37℃下共温育1小时后,将病毒/血清混合物在vero-ccl81细胞上在37℃下放置2小时。然后除去混合物,将细胞用pbs洗涤两次,并且在加有10µg/ml胰蛋白酶的amem-tpb(对于gd01)(或在毒株dr13用于该程序的情况下,无胰蛋白酶的amem-tpb)存在的情况下,将细胞在37℃下温育48小时。pedv抗体elisa在抗体elisa中测定血清中的针对源自usa/colorado/2013的pedv刺突蛋白的s1部分的抗体。为此,将板用100µlpedvs1(0.25µg/ml)包被。将血清在pbs0/1%bsa中1:900稀释,并添加至包被的孔中,随后在37℃下温育1小时。在用pbs0/0.05%tween-20两次洗涤后,将100μlpbs0/1%bsa/0.5%tween20中1:10,000稀释的兔α猪igghrpo缀合物添加至孔中,并且将板在37℃下温育1小时。用pbs0/0.05%tween-20三次洗涤后,向每个孔中添加100μl/孔的tmb“超缓慢”底物,随后在室温下温育10分钟(在黑暗中)。通过向每孔添加100μl的25%硫酸终止反应。用elisa阅读器测量在405nm处的光密度(od)。包括来自天然感染的猪的血清作为阳性对照。结果体温每组的平均体温的概述显示于表4中。可以得出结论,没有一种疫苗引起超过1摄氏度的严重的平均温度升高。在接种疫苗后4小时看到最大的温度升高,但在大多数情况下,在接种疫苗后24小时温度恢复至正常水平。对于组6中的一只动物,在加强接种疫苗后4小时,观察到最高的个体温度升高(2.3℃)。表4.第一次或第二次接种疫苗后取得的平均直肠温度。局部反应在接种疫苗后2、4、6、8、10、12和14天,在肌内疫苗施加部位触诊动物。从长度和宽度(以cm计),计算局部反应(即肿胀)的表面。组2b中的一只动物在加强接种疫苗后直接显示非常温和(<1cm2)和短暂的(在一天内消失)肿胀。对于所有其它59只动物,没有观察到局部反应。病毒中和抗体对于杀死的全病毒疫苗,使用待通过血清抗体中和的dr13毒株进行病毒中和测定。每组的计算的平均vn滴度呈现于表5中。从该表可以得出结论,dr13kv抗原以明显的剂量反应方式诱导良好的vn滴度。看起来,对应于3.0e6tcid50杀死的全pedv的最小剂量是诱导高于5log2的vn滴度所必需的。本实施例的结果证实了实施例2的结果。表5.pedv中和抗体滴度(log2/50µl)。以第一次接种疫苗后的周数表示时间(t)。对于亚单位疫苗,使用替代vn测试。这是因为在其它vn测试中使用的dr13-gfp毒株的刺突蛋白与衍生s1亚单位的us分离株的刺突蛋白约93.3%相同,并且与毒株gd01的刺突约92.7%相同。该序列差异可能解释为什么在其它测试中不能检测到vn抗体。因此,在每组中合并血清,并在允许使用dr13-gfp或gd01毒株的替代vn测试中测定血清中和抗体的存在。结果概述于表6中。表6.合并血清中的pedv中和抗体滴度(log2/50µl)。以第一次接种疫苗后的周数表示时间(t)。实际上,dr13毒株看起来不适合于检测由亚单位疫苗诱导的vn滴度。然而,杀死的全病毒疫苗的合并血清中的dr13中和抗体滴度看起来与在第一次接种疫苗后4、5和6周个别测定的vn滴度的组平均值良好对应(结果未显示)。该结果证明:(i)可以合并血清以建立每组的vn滴度,和(ii)用于测定合并血清中的vn滴度的替代vn测定法提供与针对dr13-gfp专门开发的vn测定法相似的结果。如果测定gd01中和抗体滴度,则s1亚单位的结果(如表6、右侧栏中所示)如下:除了s1-n-fc,它们都诱导vn滴度。数据显示:(i)完整s1或其c-末端部分是用于触发vn抗体应答的良好抗原,和(ii)具有fc片段的c-末端延伸改善免疫应答。此外,显示10μg的s1亚单位能够诱导vn滴度,其至少与用每剂量包含3e06tcid50杀死的全ped病毒的疫苗获得的水平相同。因此,10μg的s1亚单位是对应于至少3e06tcid50杀死的全ped病毒的剂量。为了检查这后一种对应关系,使用x-solve佐剂和0.4µg-2.0µg-10µg-50µg的s1亚单位的剂量范围制作剂量-反应曲线。在im接种疫苗(引发-加强方案,其具有三周的时间间隔)之后,较低剂量导致约仅1的最大vn滴度(log2/50µl,接种疫苗后6周),而10μg组具有6.5的vn滴度,而50μg组具有7.0的vn滴度。这证实了10μg的s1亚单位是对应于至少3e06tcid50杀死的全ped病毒(即,确定的能够诱导至少5的vn滴度的最小剂量)的剂量。针对刺突的s1亚单位的抗体在接种疫苗后的最后两个时间点,对上述合并的血清进行elisa。elisa数据与vn滴度良好对应(参见表7)。表7.s1elisa中测量的1:900稀释的血清的od450值。以第一次接种疫苗后的周数表示时间(t)。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1