眼用混悬液制剂的制作方法
本发明主要涉及包含(R)-(-)-2-(4-溴-2-氟苄基)-1,2,3,4-四氢吡咯并[1,2-a]吡嗪-4-螺-3'-吡咯烷-1,2',3,5'-四酮的眼用混悬液制剂,特别是其可用于后眼段的疾病。
背景技术:
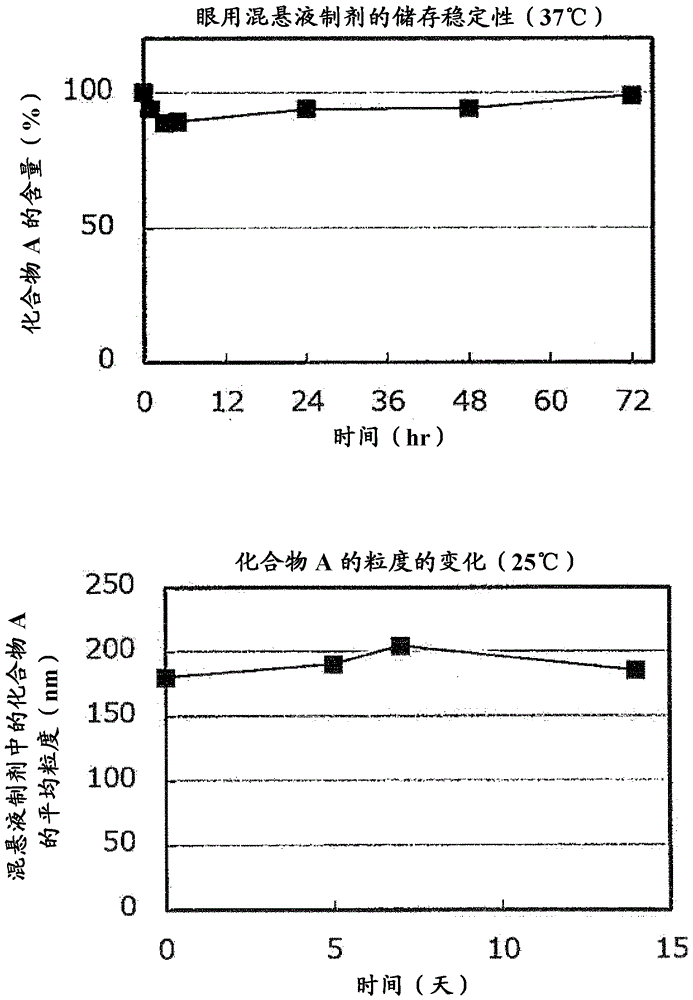
:后眼段组织如玻璃体、视网膜、脉络膜和巩膜是视觉表现的重要区域。如果该区域被损坏,它可能常常导致严重降低的视敏度或视力丧失。后眼段的典型疾病包括年龄相关性黄斑变性、糖尿病性视网膜病变、糖尿病性黄斑水肿、黄斑水肿、近视性脉络膜新生血管形成、视网膜静脉阻塞、脉络膜新生血管形成、葡萄膜炎、视网膜色素变性、增殖性玻璃体视网膜病变和中心性浆液性脉络膜视网膜病变。特别地,年龄相关性黄斑变性或糖尿病性视网膜病变是在诸如欧洲、美国和日本等发达国家中引起晚-中年至老年人视力丧失的主要疾病,这在眼科临床以及全社会中是非常有问题的疾病(专利文献1)。一般来说,通过血液向后眼段(例如视网膜)的药物递送受到后眼段中的血液-视网膜屏障(BRB)的严重限制。当在滴眼液中给药时,大部分药物可以通过泪液翻转从眼表快速排出,然后通过鼻泪管转移到全身循环的血液中(非专利文献1)。因此,如果眼用制剂中的药物的量为100,则在滴眼液中给予的递送药物的量在药物转移最多的角膜中为0.1-0.5;在前房水/虹膜和睫状体中为0.01-0.1;在晶状体和玻璃体中为约0.0001,即,已知递送量太低(非专利文献2)。此外,通常认为药物通过滴眼液中的给药几乎不能递送到后眼段,因为后眼段位于晶状体或玻璃体的更后面。并且,通常认为在低水溶性药物的情况下使用的眼用混悬液比通常的眼用溶液更难以通过滴眼液给药递送到眼后段,因为这种药物不是溶解于水中,因此其通常几乎不被眼内部位吸收(非专利文献3)。在临床实践中存在一些眼用混悬液,但是使用限于在前眼段中的疾病例如结膜炎。认为将药物递送到后眼段的手段只有向玻璃体的注入或手术,或者通过全身循环血液的全身给药,即其他手段是非常困难的(专利文献4,非-专利文献4)。后眼段的疾病是引起严重症状的眼疾病,但是对其有用的药物很少,此外,由于靶向部位是药物难以递送的后眼段,因此给药受限。因此,现在通过将抗血管内皮生长因子(抗-VEGF)注射入玻璃体、将类固醇注射入玻璃体或眼球囊、光动力疗法(PDT)、玻璃体的手术等进行疾病的治疗。然而,所有这些当前的治疗,即注射到眼睛等,对于患者是非常侵入性的,并且对患者造成疼痛,因此期望开发新的给药,例如滴眼液。(R)-(-)-2-(4-溴-2-氟苄基)-1,2,3,4-四氢吡咯并[1,2-a]吡嗪-4-螺-3'-吡咯烷-1,2',3,5'-四酮(雷尼司他)(下文中称为"化合物A")具有抑制醛糖还原酶的强效作用,并且该化合物也是一种低毒性化合物,因此该化合物可用作用于治疗糖尿病并发症的药物(专利文献2,专利文献3)。现有技术[专利参考文献][专利文献1]JP2009-196973A[专利文献2]JP2516147B[专利文献3]WO1999/020276[专利文献4]JP2005-097275A[非专利参考文献][非专利文献1]"DrugDeliverytothePosteriorEyeSegment"YuukiTAKASHIMA,Thearchivesofpracticalpharmacy,72(2),117-121(2012)[非专利文献2]StandardYakugakuSeries7"SeizaikanoScience",ThePharmaceuticalSocietyofJapan编辑,TokyoKagakuDoujin发行,第四章"Representativeformulation"22-2Ophthalmicformulation,p103-p105[非专利文献3]"Tenganzai-notekiseishiyouhandbookQ&A",ThePharmaceuticalManufacturers'AssociationofTokyo,Tenganzaikenkyukai等制造,JAPANOPHTHALMOLOGISTSASSOCIATION监督,2011年9月,第一版,第5页[非专利文献4]"Studytoidentifyorallybioavailablecalpaininhibitorstodevelopanagentfortreatingaretinaldisease"YoshihisaSHIRASAKI,GraduateSchoolofNaturalScience&Technology,Doctoralthesisabstracts,AbstractofDissertationandAbstractofExaminationoutcome,P605-p610,2007年9月发行。技术实现要素:(技术问题)为了通过全身循环血液将有效浓度的药物递送到后眼段,因为血液-视网膜屏障(BRB),认为有必要通过施用非常高的剂量来增加全身循环血液中的药物浓度。为了避免这种高剂量的风险,本发明的目的是提供一种用于后眼段疾病并避免由于高剂量全身暴露引起的副作用的眼用制剂,另外还提供一种包含化合物A或其生理学上可接受的盐的稳定的眼用制剂。(问题的解决方案)本发明人进行了广泛的研究以达到上述目的,然后发现化合物A或其生理学上可接受的盐在分散介质中的混悬液的滴眼液给药可以使药物以治疗所需的高转移性递送到后眼段,同时保持药物的稳定性和抑制全身暴露的量,此外还发现化合物A或其生理学上可接受的盐对眼疾病如年龄相关性黄斑变性具有有用的药理作用。也就是说,本发明通过将化合物A或其生理学上可接受的盐悬浮作为眼用制剂而完成。本发明的概述如下描述。(项1)一种眼用混悬液制剂,其包含(R)-(-)-2-(4-溴-2-氟苄基)-1,2,3,4-四氢吡咯并[1,2-a]吡嗪-4-螺-3'-吡咯烷-1,2',3,5'-四酮(下文称为"化合物A")或其生理学上可接受的盐。(项2)项1的制剂,其中化合物A或其生理学上可接受的盐分散在分散介质中。(项3)项2的制剂,其中所述混悬液中化合物A或其生理学上可接受的盐的平均粒度为1nm至20μm。(项4)项3的制剂,其中所述混悬液中化合物A或其生理学上可接受的盐的平均粒度为10nm至20μm。(项5)项2至4中任一项的制剂,其中所述分散介质为水性分散介质。(项6)项2至5中任一项的制剂,其中所述分散介质包含分散剂和/或表面活性剂。(项7)项6的制剂,其中所述分散介质包含分散剂和表面活性剂。(项8)项2至7中任一项的制剂,其中所述混悬液的pH为3至9。(项9)项2至8中任一项的制剂,其中所述混悬液的渗透压为20mOsm至1000mOsm。(项10)项2至9中任一项的制剂,其包含每1mL所述混悬液中1mg至500mg的化合物A或其生理学上可接受的盐。(项11)项2至10中任一项的制剂,其中溶解于所述混悬液中的化合物A或其生理学上可接受的盐与所述制剂中所有化合物A或其生理学上可接受的盐的比例为0.001%至10%。(项12)项2至11中任一项的制剂,其中溶解于所述混悬液中的化合物A或其生理学上可接受的盐与所述制剂中所有化合物A或其生理学上可接受的盐的比例为0.001%至1%。(项13)项1至12中任一项的制剂,其用于治疗前眼段中的疾病和/或后眼段中的疾病。(项14)项13的制剂,其中所述疾病是与VEGF相关的疾病。(项15)项13或14的制剂,其中所述疾病是年龄相关性黄斑变性、糖尿病性视网膜病变、糖尿病性黄斑水肿、近视性脉络膜新生血管形成、视网膜静脉阻塞和/或白内障。(项16)一种试剂盒,其包含下述(1)和(2)的组合:(1)包含化合物A或其生理学上可接受的盐的制剂和(2)包含分散介质的制剂。(项17)项16的试剂盒,其中制剂(1)中的化合物A或其生理学上可接受的盐的平均粒度为1nm至20μm。(项18)项17的试剂盒,其中制剂(1)中的化合物A或其生理学上可接受的盐的平均粒度为10nm至20μm。(项19)项16至18中任一项的试剂盒,其中制剂(1)或制剂(2)可包含分散剂和/或表面活性剂。(项20)项16至19中任一项的试剂盒,其用于治疗前眼段中的疾病和/或后眼段中的疾病。(项21)用于治疗与VEGF相关的疾病的药物,其包含化合物A或其生理学上可接受的盐。(项22)项21的药物,其中所述疾病是年龄相关性黄斑变性和/或糖尿病性视网膜病变。(项23)项2至4中任一项的制剂,其中所述混悬液包含分散剂和/或表面活性剂。(项24)项23的制剂,其中所述混悬液包含分散剂和表面活性剂。(本发明的效果)本发明可以提供包含化合物A或其生理学上可接受的盐的稳定的眼用制剂,其不仅对前眼段的疾病,而且对后眼段的疾病具有治疗作用,并且可以避免由于高剂量全身暴露导致的副作用。化合物A在水中的溶解度低,因此如果制备包含化合物A的水溶液制剂,其浓度应该低。然而,通过作为混悬液制备包含化合物A的制剂,该制剂将变成高度浓缩的制剂,预期其以实际的给药频率(例如每天1次至6次)将足够量的药物递送至患病部位。此外,化合物A还有另一个问题,即溶液状态的稳定性非常差,溶液中的化合物可以在数小时内分解,但是包含化合物A的混悬液制剂可以提供具有耐受分解的能力,并且对于实际储存还具有良好的稳定性的眼用制剂。本发明的眼用制剂可以对主要通过侵入性方法治疗的后眼段中的疾病提供突破性治疗,对患者的负担较小。附图说明图1表示关于眼用混悬液制剂中化合物A的含量和粒度的储存稳定性的结果。上图的纵轴表示混悬液制剂中化合物A的含量(%),横轴表示时间(hr)。下图的纵轴表示混悬液制剂中化合物A的平均粒度(nm),横轴表示时间(天)。图2表示在大鼠中至后眼段的转移性的评价(I-1)。在四个图的上方三个图中,纵轴表示各组织中化合物A的浓度(第一、第二和第三图分别显示眼用制剂A1、眼用制剂Z和口服给药的结果)。纵轴的单位对于视网膜和角膜中的浓度为μg/g,对于血浆中的浓度为μg/mL。横轴表示各组织(从左侧,视网膜、角膜和血浆)。在四个图的最低图中,纵轴表示视网膜/血浆的比率,横轴表示各给予的制剂(从左侧,口服给药、眼用制剂Z、眼用制剂A1)。视网膜/血浆的比率表示“在视网膜中化合物A的浓度(μg/g)/在血浆中化合物A的浓度(μg/mL)”。图3表示在大鼠中至后眼段的转移性的评价(I-2)。在每个图中,纵轴表示化合物A在各组织(从上侧,视网膜、角膜和血浆)中的浓度。纵轴的单位对于视网膜和角膜中的浓度为μg/g,对于血浆中的浓度为μg/mL。横轴表示每种给予的制剂(从左侧,眼用制剂Z和眼用制剂A1)。图4表示在大鼠中至后眼段的转移性的评价(II)。在每个图中,纵轴表示化合物A在各组织(从上侧,视网膜、角膜和血浆)中的浓度。横轴表示滴眼液的给药数(从左侧,1次/眼、3次/眼、5次/眼)。图5表示在大鼠中至后眼段的转移性的评价(III)。在四个图的上部三个图中,纵轴表示各组织中化合物A的浓度(第一、第二和第三图分别显示视网膜、角膜和血浆的结果)。横轴表示各给予的混悬液制剂,以及各混悬液制剂中化合物A的各平均粒度(nm)。在四个图的最低图中,纵轴表示视网膜/血浆的比率,横轴表示各给予的混悬液制剂,以及各混悬液制剂中化合物A的各平均粒度(nm)。视网膜/血浆的比率表示“化合物A在视网膜中的浓度(μg/g)/化合物A在血浆中的浓度(μg/mL)”。图6显示在大鼠中至后眼段的转移性的评价(IV)。在每个图中,纵轴表示化合物A在各组织(从上侧,视网膜、角膜和血浆)中的浓度。纵轴的单位对于视网膜和角膜中的浓度为μg/g,对于血浆中的浓度为μg/mL。横轴表示每种给予的混悬液制剂和每种混悬液制剂的pH。图7表示在大鼠中至后眼段的转移性的评价(V)。在图中,纵轴表示化合物A在视网膜中的各浓度(μg/g)。横轴表示各给予的混悬液制剂以及各混悬液制剂中化合物A、B或C的各平均粒度(nm)。图8显示化合物A对于抗VEGF作用的影响。在图中,纵轴表示HREC的距离迁移,其是在伤口之后不久的每个伤口宽度的距离迁移(%)。横轴表示各测试条件[DMSO(%),使用药物(醛糖还原酶抑制剂或Lucentis®(通用名:雷珠单抗))及其剂量,VEGF浓度(ng/mL)]。图9表示在大鼠中至后眼段的转移性的评价(III-2)。在每个图中,纵轴表示化合物A在各组织(从上侧,视网膜、角膜和血浆)中的浓度。横轴表示每种给予的混悬液制剂的浓度。图2、图3、图4至图9的右上方的“均值±se”意指每个指示的值表示每组中的平均值,并且每个误差范围表示se(标准误差)。“n”表示每组的样本数量。具体实施方式本发明的制剂是眼用制剂,其特征在于化合物A或其生理学上可接受的盐(下文中,其可以作为整体称为“本发明的药物”)悬浮在分散介质中。本发明的制剂包括包含化合物A或其生理学可接受的盐和分散介质的眼用混悬液,以及通过将化合物A或其生理学上可接受的盐分散在分散介质中来制备使用的混悬液的试剂盒。本发明的制剂中的活性成分化合物A可以是游离形式或与生理学上可接受的,即药学上可接受的无机或有机碱形成的盐形式。无机和有机碱包括例如碱金属如钠和钾,氢氧化铵,异丙胺,二乙胺,乙醇胺,哌啶和赖氨酸。并且,本发明的化合物A或其生理学上可接受的盐也可以是水合物或溶剂合物的形式,因此本发明中的化合物A或其生理学上可接受的盐包括这样的水合物和溶剂合物。其详细情况在专利文献2中描述。化合物A或其生理学上可接受的盐例如可以根据专利文献2制备。本文中使用的术语“混悬液”是指化合物A或其生理学上可接受的盐作为固体分散在分散介质中的状态,其还包括其中本发明的药物部分溶解在分散介质中的混悬液。如果本发明的药物由于储存而在混悬液中沉淀或聚集,则在使用之前可以松散地摇动该混悬液以恢复到常规悬浮状态,这也包括在本发明的混悬液中。然而,本发明不包括其中药物被分散、乳化或包封在油和脂肪液滴中的制剂,例如脂质体和乳液制剂。具体地,本发明的制剂中的药物颗粒不需要用脂肪或油成分包衣,并且本发明不包括例如,其中本发明药物包封在脂质体中的混悬液制剂,或其中包含本发明的药物的油和脂肪液滴分散在水中的水包油乳液制剂。溶解在混悬液中的化合物A或其生理学上可接受的盐与制剂中的所有化合物A或其生理学上可接受的盐的比例通常为0.001%至10%,从至眼后段的视网膜的转移性、化学稳定性和粒度的物理稳定性等的观点来看优选0.001%至5%,进一步优选0.001%至2%,更优选0.001%至1%,甚至更优选0.001%至0.5%,和特别优选0.001至0.1%。优选地,本发明的制剂不包括具有增溶作用以增强本发明药物的溶解度的成分作为添加剂,但可包括这样的具有增溶作用的成分,除非成分的量可影响本发明药物的溶解度。这种具有增溶作用的成分包括例如环糊精。本文中的“分散体”是指化合物A或其生理学上可接受的盐均匀地悬浮在分散介质中的状态,其还包括暂时混悬液和部分聚集的混悬液,除非它们作为眼用制剂使用存在问题。悬浮在混悬液制剂中的固体化合物A或其生理学上可接受的盐的平均粒度不应受到限制,但是从制造可处理性和至后眼段的转移性的观点来看,优选为20μm或更小,更优选2μm或更小,甚至更优选为700nm或更小,甚至更优选为650nm或更小,甚至更优选为460nm或更小,甚至更优选为300nm或更小,甚至更优选为230nm或更小,特别优选为200nm或更小。并且,悬浮在本发明的混悬液制剂中的固体化合物A或其生理学上可接受的盐的平均粒度优选为1nm或更大,更优选为5nm或更大,甚至更优选为10nm或更大。平均粒度的范围优选为10nm至20μm或1nm至20μm,更优选为10nm至2μm或1nm至2μm,更优选为10nm至700nm或1nm至700nm,甚至更优选为1nm至650nm,进一步优选为1nm至460nm,甚至更优选为1nm至300nm,甚至更优选为10nm至300nm或5nm至300nm,甚至更优选为1nm至230nm,甚至更优选为5nm至230nm,甚至更优选为5nm至200nm,特别优选为10nm至200nm或10nm至230nm。本文中使用的平均粒度是指悬浮在混悬液制剂中的化合物A或其生理学上可接受的盐、微粉化的化合物A或其生理学上可接受的盐、或固体化合物A或其生理学上可接受的盐的平均粒度。本文中使用的平均粒度是指通过下述装置和方法获得的平均粒度。当在混悬液制剂中测量平均粒度时,可以将混悬液的浓度稀释至其可测量的浓度。上述具有可接受的粒度的化合物A或其生理学上可接受的盐可通过湿磨或干磨制备。湿磨制备可以通过用搅拌器、均化器等将化合物搅拌或分散在合适的溶剂(用于研磨)中进行。或者,可以使用湿式喷射磨机如StarBurst,以及球磨机,珠磨机,均质混合机,均化器等,通过在合适的溶剂(用于研磨)中研磨化合物来制备研磨的化合物。例如,在用于研磨的溶剂中的化合物A或其生理学上可接受的盐可以用行星式球磨机(LP-4/2,ITOMANUFACTURINGCO.,LTD.)研磨,其中化合物的含量为1-500mg/mL,速度为30-370rpm。干磨制备可以用下述装置进行:气流型粉碎机,如螺旋喷射磨机,Jet-O-Mill,逆流磨机和喷射磨机;剪切型粉碎机,例如锤磨机,筛粉机和样品磨;滚动球磨机,例如球磨机,珠磨机等等。此外,除了通过分散、研磨等使颗粒更小的分解(break-down)方法之外,本文中使用的研磨的化合物A或其生理学上可接受的盐也可以通过使用喷雾干燥、结晶或冷冻干燥的装配(build-up)方法来制备。如果制剂在最后步骤中是/成为用于滴眼液的悬浮状态,则眼用制剂可以分类在本发明中。例如,在通过干磨制备本发明的制剂的情况下,可以用上述研磨装置研磨化合物A或其生理学上可接受的盐,以使粒度达到期望,具体地,每个上述平均粒度,然后悬浮在分散介质中以获得制剂。本发明的制剂还包括在使用中制备混悬液的实施方案(即试剂盒),即分别制备化合物A或其生理学上可接受的盐和分散介质,以及在使用时悬浮化合物A或其生理学上可接受的盐在分散介质中。在通过湿磨制备本发明的制剂的情况下,化合物A或其生理学可接受的盐和用于研磨的溶剂的混合物可以用上述研磨装置研磨,用于研磨的溶剂可以通过冷冻干燥或其它方式除去,然后将冻干产物悬浮在分散介质中以获得制剂。本发明的制剂还包括分别制备冻干产物和分散介质并在使用时将冻干产物悬浮在分散介质中的实施方案(即试剂盒)。即,本发明的实施方案中也包括含有下述(1)和(2)的组合的试剂盒:(1)包含本发明的药物的冻干组合物和(2)分散介质。如下所示,当化合物A或其生理学上可接受的盐与包含表面活性剂、分散剂等的用于研磨的溶剂一起研磨,并且通过冷冻干燥或其它方式除去用于研磨的溶剂时,化合物A或其生理学可接受的盐的冻干产物可以包含表面活性剂、分散剂等,以及还包含一部分用于研磨的溶剂。在上述情况下,分散介质可以用作用于研磨的溶剂,并且研磨的混悬液也可以通过任选地在不冷冻干燥的情况下稀释而作为本发明的制剂提供。本发明的制剂还包括在一次注射或一周或其它时期用完的制剂,以及在使用时制备混悬液的制剂,其使用限于在制备混悬液后一周、一个月或其它时期。本文使用的分散介质是指可以使化合物A或其生理学上可接受的盐分散在液体制剂中的生物相容性溶剂,并且可以包括单组分溶剂和多组分溶剂,只要化合物A在分散介质中的溶解度优选为0.4mg/mL或更低,更优选为0.1mg/mL或更低。具体地,分散介质包括水性溶剂以及油性溶剂,例如蓖麻油、聚氧乙烯蓖麻油、聚氧乙烯氢化蓖麻油和液体石蜡。并且,其可以包括两种或更多种溶剂的混合物。本文使用的优选分散介质是水性分散介质。水性分散介质是指相对于全部分散介质溶剂含有90w/w%或更多水,优选为95w/w%或更多水,更优选为99w/w%或更多水的水性溶剂。特别优选的作为分散介质的溶剂是水。水以外的水性分散介质中的溶剂包括乙醇、甘油、丙二醇、茴香油、苯乙醇、单乙醇胺、乙酸、冰醋酸、盐酸、苄醇和聚乙二醇。然而,如上所述,本文使用的分散介质不包括用于水包油乳液制剂的分散介质,其中包含本发明的药物的油和脂肪液滴分散在水中。本文使用的分散介质可以含有添加剂,例如分散剂、表面活性剂、润湿剂、张度剂、缓冲剂、防腐剂、pH调节剂。优选地,分散介质包括表面活性剂和/或分散剂。本文中使用的优选的分散介质包括水,更优选的分散介质是含有表面活性剂或分散剂的水,甚至更优选包含表面活性剂和分散剂两者的水。此外,本文中使用的优选分散介质还包括含有表面活性剂或分散剂的水性溶剂,和含有表面活性剂和分散剂两者的水性溶剂。本文使用的分散介质的pH通常为3-9,优选3-8,更优选4-7,特别优选4-6。分散介质的pH可以用下述pH调节剂调节。本文中使用的用于研磨的溶剂是指用于湿磨化合物A或其生理学上可接受的盐的溶剂,其中化合物A的溶解度优选为0.4mg/mL或更低。具体地,本文中使用的用于研磨的溶剂包括水、多元醇(例如甘油、丙二醇和聚乙二醇)、庚烷和己烷。并且,其可以包括两种或更多种溶剂的混合物。优选的混合溶剂是相对于全部溶剂包含90w/w%或更多水,和任选地包括上述多元醇的水性溶剂,更优选包括相对于全部溶剂95w/w%或更多水,特别优选99w/w%或更多水。本文中使用的优选的用于研磨的溶剂是水,其适当时可以含有添加剂,例如表面活性剂、分散剂和盐,以有助于研磨化合物A或其生理学上可接受的盐。上述分散介质可以用作用于研磨的溶剂。本发明的制剂可以在灭菌后提供,其中灭菌可以通过例如过滤、辐射或高压釜处理化合物A或其生理学上可接受的盐在分散介质中的混悬液来进行。适当时,化合物A或其生理学上可接受的盐、冻干混悬液、分散介质和任选加入的添加剂可以分别灭菌。并且,制备本发明的眼用制剂的全部过程或部分过程也可在无菌环境中进行。考虑到颗粒的状态、颗粒的尺寸等,本发明中的粒度例如以下面解释的方式测量,但不应限于此。对于分散在混悬液制剂中的固体化合物A或其生理学上可接受的盐,其粒度为1nm-5μm,优选10nm-5μm;通过用分散介质稀释混悬液制剂以将混悬液制剂中的化合物A或其生理学上可接受的盐的含量调节至约200-500μg/mL,然后用测量仪器ZetaSizernanoS(MalvernInstrumentsLtd,MalvernUK)测量稀释的样品,进行其粒度的测量。通过动态光散射进行粒度的测量/计算,其中材料RI和分散剂RI为1.33,并且所计算的粒度的Z均值的平均值显示为测量的粒度。对于分散在混悬液制剂中的固体化合物A或其生理学上可接受的盐,其粒度为5μm或更大;通过用分散介质稀释混悬液制剂以将混悬液制剂中的化合物A的含量调节至约10-50μg/mL,用超声波(15秒)和搅拌器(速度:1200rpm)分散稀释的混悬液,用激光衍射粒度分析仪:HEROS/BR-multi和湿分散装置:CUVETTE(SympatecGmbH)[范围R3,使用50mL池,触发条件(时间基准:1000.00ms,测定:10s实际时间)]测量分散的样品,并通过计算模式HRLD计算粒度的X50值,进行其粒度的测量。X50值显示为测量值。对于干磨化合物A或其生理学上可接受的盐,使用激光衍射粒度分析仪:HEROS/BR-multi和干分散装置(SympatecGmbH)[范围R3,触发条件(开始:ch.25≥0.5%,停止:ch.25≤0.5%,持续2秒或10秒作为实际时间),分散压力2.0巴]进行其粒度的测量,并且由计算模式HRLD计算的X50值显示为测量值。本文使用的表面活性剂是在其分子中具有亲水基团和疏水基团(亲脂基团)的材料;当其浓度高于某一浓度时可形成胶束、囊泡或层状结构;可以使极性物质和非极性物质混合均匀;具有降低表面张力的作用;并且具有6,000或更小的分子量;并且它是有助于润湿化合物A或其生理学上可接受的盐的纳米颗粒的添加剂。本文所用的具体表面活性剂包括聚山梨醇酯80、聚氧乙烯氢化蓖麻油、聚氧乙烯蓖麻油、烷基二氨基乙基甘氨酸盐酸盐、聚乙二醇40硬脂酸酯、甘油、丙二醇、硫酸软骨素钠、单硬脂酸铝、烷基烯丙基聚醚醇、胆固醇、蔗糖脂肪酸酯、脱水山梨糖醇脂肪酸酯、脱水山梨糖醇倍半油酸酯、角鲨烷、硬脂醇、鲸蜡醇、聚西托醇1000、癸二酸二乙酯、十二烷基苯磺酸钠、脱水山梨醇三油酸酯、壬基苯氧基聚氧乙烯乙磺酸酯铵、聚氧乙烯油胺、聚氧乙烯十八烷基醚、聚氧乙烯鲸蜡基醚、聚氧乙烯脱水山梨糖醇单月桂酸酯、聚氧乙烯山梨醇聚醚蜂蜡、聚氧乙烯壬基苯基醚、聚氧乙烯聚氧丙二醇、聚氧乙烯聚氧丙烯鲸蜡基醚、聚乙二醇35蓖麻油、聚山梨酯20、聚山梨醇酯60、聚乙二醇400、聚乙二醇4000、聚乙二醇6000、脱水山梨醇单油酸酯、甘油单硬脂酸酯、脱水山梨糖醇单硬脂酸酯、月桂基二甲基氧化胺溶液、十二烷基硫酸钠、月桂酸二乙醇酰胺、月桂酰肌氨酸钠、聚桂醇(lauromacrogol)、聚氧乙烯月桂基醚磷酸钠和聚氧乙烯油基醚磷酸酯。优选地,其包括聚山梨酯80、聚氧乙烯氢化蓖麻油、聚氧乙烯蓖麻油、烷基二氨基乙基甘氨酸盐酸盐、聚乙二醇40硬脂酸酯、甘油、丙二醇、硫酸软骨素钠、单硬脂酸铝、聚乙二醇4000和聚乙二醇6000;更优选聚山梨醇酯80、烷基二氨基乙基甘氨酸盐酸盐和聚氧乙烯氢化蓖麻油。并且,可以使用两种或更多种表面活性剂,优选2-3种表面活性剂。表面活性剂的量优选为相对于混悬液总量的0.001-5重量%。本文使用的分散剂是作为分子量为6,000或更大的聚合物的添加剂,并且可以进入纳米颗粒之间的空间以有助于防止聚集。本文中使用的具体分散剂包括羧基乙烯基聚合物、聚乙烯吡咯烷酮(聚维酮)、甲基纤维素、羟丙基甲基纤维素(羟丙甲纤维素)、羟乙基纤维素、羟丙基纤维素、聚乙烯醇、羧基甲基纤维素钠(羧甲纤维素钠)、泰洛沙泊、印度胶、阿拉伯树胶、阿拉伯胶粉、刺梧桐树胶、黄原胶、甲基丙烯酸氨基烷基酯共聚物RS、丙二醇藻酸酯、羧甲基淀粉钠、琼脂粉、琥珀酸二辛酯磺酸钠和糊精。优选地,其包括羧基乙烯基聚合物、羟乙基纤维素、聚乙烯吡咯烷酮(聚维酮)、甲基纤维素、羟丙基甲基纤维素(羟丙甲纤维素)、聚乙烯醇、羧基甲基纤维素钠(羧甲纤维素钠)和泰洛沙泊;更优选羧基乙烯基聚合物、羟乙基纤维素、聚乙烯吡咯烷酮(聚维酮)、甲基纤维素、羟丙基甲基纤维素(羟丙甲纤维素)和聚乙烯醇。并且,可以使用两种或更多种分散剂。分散剂的量优选为相对于混悬液总量的0.001-5重量%。润湿剂包括乙醇、油酸、硅酸镁、轻质无水硅酸和磷酸胆碱。张度剂包括氯化钠、氯化钾、山梨醇、葡萄糖、蔗糖、D-甘露醇、乙醇、油酸、硅酸镁、轻质无水硅酸和磷酸胆碱,优选氯化钠。缓冲剂包括磷酸钠、磷酸氢二钠、磷酸二氢钠、乙酸钠、柠檬酸、柠檬酸钠、碳酸氢钠和氨丁三醇,优选磷酸氢二钠和柠檬酸。防腐剂包括季铵盐,例如苯扎氯铵、苄索氯铵和氯化十六烷基吡啶;对羟基苯甲酸酯,例如对羟基苯甲酸甲酯、对羟基苯甲酸乙酯、对羟基苯甲酸丙酯和对羟基苯甲酸丁酯;苯甲醇;苯乙醇;山梨酸和山梨酸盐;葡萄糖酸洗必太溶液。pH调节剂包括盐酸、柠檬酸、冰醋酸、磷酸、磷酸二氢钠、氢氧化钠、氢氧化钾、碳酸钠、碳酸氢钠和磷酸氢二钠水合物。合适时任选地含有上述添加剂的本发明的眼用混悬液制剂可以用化合物A或其生理学上可接受的盐制备,其中化合物A或其生理学上可接受的盐的量通常为每1mL分散介质中1至500mg,优选5至300mg,更优选10至300mg,更优选10至200mg,特别优选20至300mg,25至300mg,10至150mg或25至230mg,但本发明不应限于上述量。本发明的混悬液制剂的pH通常为3-9,优选3-8,更优选4-7,特别优选4-6。混悬液的pH可以用上述pH调节剂调节。本发明的混悬液制剂的渗透压通常为20-1000mOsm,优选100-700mOsm,更优选180-500mOsm,特别优选200-360mOsm。混悬液的渗透压可以用上述张度剂调节。上述混悬液的渗透压可以用例如通过离心混悬液获得的上清溶液测量。例如,可以使用渗透压测量装置“OSMOSTATOM-6040”(ARKRAY,Inc.)来进行测量。在不抑制本发明的药理学作用的情况下,本发明的制剂可以包含其它活性成分。根据本发明,已经发现化合物A或其生理学上可接受的盐可以抑制VEGF刺激对细胞迁移的促进作用,如下面的试验实施例所示。因此,本发明的制剂中的化合物A或其生理学上可接受的盐预期对各种眼科疾病具有治疗效果,因为该化合物具有抑制醛糖还原酶的作用、抑制VEGF产生的作用、和抑制VEGF刺激对细胞迁移的促进作用的作用。此外,本发明的包含化合物A或其生理学上可接受的盐的混悬液制剂特别地具有良好的至后眼段的转移性,因此本发明的混悬液制剂还预期在治疗上适用于需要向后眼段给药的后眼段的疾病,例如年龄相关性黄斑变性、糖尿病性视网膜病变、糖尿病性黄斑水肿、黄斑水肿、近视性脉络膜新生血管形成、视网膜静脉阻塞、脉络膜新生血管形成、葡萄膜炎、色素性视网膜炎、增殖性玻璃体视网膜病变和中枢性浆液性脉络膜视网膜病变,但本发明的目标疾病不应限于这些疾病。特别地,预期本发明的制剂治疗性地应用于与VEGF相关的疾病、由VEGF介入引起的疾病或由VEGF介入发生的疾病后的疾病。此外,当将本发明的制剂治疗性地应用于需要向前眼段给药的前眼段的疾病(例如角膜炎、结膜炎、新生血管性青光眼、干眼症和白内障),或者药物需要穿过血液-水性屏障(BAB)或角膜转运的疾病时,也预期本发明的制剂具有显著的治疗效果。本发明的眼用混悬液制剂的剂量和给药应基于药物功效、给药途径、症状、年龄、体重等适当地确定。本发明中优选的剂量和给药是例如以滴眼液给予包含1-500mg/mL化合物A或其生理学上可接受的盐的混悬液制剂,其量为各眼睛每次1-2滴,一天总共1次至约6次。通常,滴眼液中的一滴的量为20-80μL,优选30-50μL。本发明中的给药期间应根据症状的严重程度等来决定,包括例如,1或多个周,优选约1周至约4周,更优选约4或更多周。本发明的制剂也可用于除了人以外的哺乳动物的眼科疾病,例如猴、牛、马、狗和猫。实施例下面通过参照实施例、参考例、比较例、试验等详细说明本发明,但不应限于此。参考例1:化合物A的制备化合物A根据T.Negoro等人J.Med.Chem.1998,41,4118-4129中所述的方法制备。向其粗产物(10g)中加入活性炭(50%湿度,0.8g)和2-丙醇(101g),将反应溶液加热至其回流温度(约84℃)并在相同温度下静置30分钟。将反应溶液在相同温度下过滤,用2-丙醇(13.8g)洗涤。将得到的滤液加热至75℃或更高,冷却至60℃,在60℃下保持1小时,然后冷却至0℃。在过滤器上收集沉淀的固体并真空干燥,得到化合物A,为白色晶体(9.3g)。XRD;2θ=11.5,15.4,15.7,16.3,16.9,18.2,19.3,20.1,20.9,21.6,22.2,23.3,24.0,24.7,25.1,26.4,27.5,28.4,28.8,29.6,29.9,30.9,31.9,32.4。差示扫描量热法(DSC)显示外推熔融起始温度为186.7℃的吸热峰。上述粉末X射线衍射的测量使用粉末X射线衍射系统XRD-6100(ShimadzuCorp.)进行,其各条件如下:X射线管:CuKα(波长1.54埃),管电压:30.0kV,管电流:20.0mA,驱动轴:θ-2θ,测量范围:5-40度,步宽:0.020度,速度:2.00(度/分),计数时间:0.60秒。使用ThermoPlus2(RigakuCorporation)在流动空气下在25℃至250℃之间进行上述差示扫描量热法(DSC)的测量,其中在铝容器中称量的样品为约10mg,升温速度为5℃/分钟。使用喷射磨机将上述得到的化合物A粒化,改变研磨条件,得到三种具有不同平均粒度的化合物A。所得三种化合物A的平均粒度为1.43μm、6.29μm和21.98μm。使用上述激光衍射粒度分析仪测量用喷射磨机(干磨)进行粒化所得到的化合物A的平均粒度,以在计算模式LD中算出的粒度的X50值表示。参考例2:分散介质的制备(pH5.0)向0.9%(w/v)氯化钠的0.02mol/L水性磷酸氢二钠的水溶液(a)中加入0.9%(w/v)氯化钠的0.01mol/L水性柠檬酸的水溶液(b)以将溶液(a)的pH调节至5.0(加入比(a):(b)=约1:1),得到pH5.0的柠檬酸盐-磷酸盐缓冲液。将20g羟丙基甲基纤维素溶解在380g纯水中,制备400g5%羟丙基甲基纤维素水溶液,向其中加入1600gpH5.0的柠檬酸盐-磷酸盐缓冲溶液,以制备2000g1%羟丙基甲基纤维素水溶液。将500mg27-33%的烷基二氨基乙基甘氨酸盐酸盐水溶液溶解在400g的1%羟丙基甲基纤维素水溶液中,再向其中加入2.5g聚山梨醇酯80,然后将混合物溶解。通过加入1%羟丙基甲基纤维素水溶液使溶液的重量为500g,用1mol/L盐酸水溶液将溶液的pH调节至5.0,得到分散介质(pH5.0)。制备的分散介质(pH5.0)的组成如下所示。[表1]成分量柠檬酸0.76mg/g磷酸氢二钠1.13mg/g氯化钠7.2mg/g羟丙基甲基纤维素9.9mg/g27-33%烷基二氨基乙基甘氨酸盐酸盐水溶液1mg/g聚山梨醇酯805mg/g盐酸少量实施例1:眼用混悬液制剂的制备将4g用喷射磨机粒化的化合物A(平均粒度:1.43μm)和12mL参考例2中制备的分散介质(pH5.0)放入螺纹瓶中,将混合物用搅拌器搅拌30分钟。然后,将整个样品混合物转移到研磨罐中。用4mL分散介质洗涤螺纹瓶,并将洗涤溶液也放入研磨罐中。向多个制备的研磨罐中的每一个加入50g具有以下限定的各直径尺寸的氧化锆珠。将研磨罐安放在行星式球磨机(LP-4/2,ITOMANUFACTURINGCO.,LTD.)中,并将其中的内容物在300rpm下研磨2小时。用筛子过滤各研磨溶液以除去珠,然后用搅拌器/消泡剂“THINKYMIXERAR-250”(THINKYCORPORATION)脱泡30秒,得到混悬液制剂A1、A2、A3和B-D。混悬液制剂A1、A2和A3:所用珠粒的直径尺寸为0.5mm。混悬液制剂B:使用珠粒的直径尺寸为2.0mm。混悬液制剂C:使用珠粒的直径尺寸为3.0mm。混悬液制剂D:所用珠粒的直径尺寸为5.0mm。将2.2g喷射研磨的化合物A(平均粒度:1.43μm、6.29μm或21.98μm)和10mL分散介质(pH5.0)加入到螺纹瓶中,并用搅拌器搅拌10分钟,得到混悬液制剂E、F或G。通过上述方法测量悬浮在混悬液制剂A1至A3和B至G中的化合物A的各平均粒度。所得到的各平均粒度如下所示。混悬液制剂A1:209.0nm混悬液制剂A2:195.2nm混悬液制剂A3:227.0nm混悬液制剂B:451.2nm混悬液制剂C:609.9nm混悬液制剂D:801.2nm混悬液制剂E:1944nm混悬液制剂F:9560nm混悬液制剂G:20430nm参考例3:各眼用混悬液制剂中药物的定量分析向100μL的各混悬液制剂A1至A3和B至G中加入800μL的1%HPMC和100μL的乙腈,将各混合物用涡旋振荡。将100μL各振荡混合物放入10mL量瓶中,向其中加入1%HPMC/乙腈(1:1),混合物完全溶解。用1%HPMC/乙腈(1:1)将溶液的总体积精确调节至10mL,得到其每种分析样品。使用超高效液相色谱仪(SHIMADZU),使用柱YMC-PackProC185μm150x4.6mm分析混悬液制剂A1至A3和B至G中的各化合物A的含量(其为溶解化合物A和悬浮化合物A的组合含量)。分析结果如下所示。混悬液制剂A1:200.1mg/mL混悬液制剂A2:216.2mg/mL混悬液制剂A3:207.1mg/mL混悬液制剂B:211.0mg/mL混悬液制剂C:195.6mg/mL混悬液制剂D:218.8mg/mL混悬液制剂E:135.4mg/mL混悬液制剂F:201.8mg/mL混悬液制剂G:224.5mg/mL。参考例4:制备分散介质(pH3.0)向0.9%(w/v)氯化钠的0.02mol/L磷酸氢二钠水溶液的水溶液(c)中加入0.9%(w/v)氯化钠的0.01mol/L水性柠檬酸的水溶液(d),以将溶液(c)pH调节至3.0(加入比(c):(d)=约2:8),得到pH3.0的柠檬酸盐-磷酸盐缓冲溶液。将得到的pH3.0的柠檬酸盐-磷酸盐缓冲液以与上述pH5.0柠檬酸盐-磷酸盐缓冲溶液的情况类似的方式处理,得到分散介质(pH3.0)。制备的分散介质(pH3.0)的组成如下所示。[表2]成分量柠檬酸1.22mg/g磷酸氢二钠0.45mg/g氯化钠7.2mg/g羟丙基甲基纤维素9.9mg/g27-33%烷基二氨基乙基甘氨酸盐酸盐水溶液1mg/g聚山梨醇酯805mg/g盐酸少量参考例5:制备分散介质(pH8.0)向0.9%(w/v)氯化钠的0.02mol/L磷酸氢二钠水溶液的水溶液(e)中加入0.9%(w/v)氯化钠的0.02mol/L的磷酸二氢钠水溶液的水溶液(f),以将溶液(e)的pH调节至8.0(加入比(e):(f)=约19:1),得到pH8.0的磷酸盐缓冲溶液。将得到的pH8.0的磷酸盐缓冲溶液以与上述pH5.0的柠檬酸盐-磷酸盐缓冲溶液的情况类似的方式处理(条件是使用1mol/L氢氧化钠水溶液代替1mol/L盐酸水溶液),得到分散介质(pH8.0)。制备的分散介质(pH8.0)的组成如下所示。[表3]成分量磷酸二氢钠0.10mg/g磷酸氢二钠2.15mg/g氯化钠7.2mg/g羟丙基甲基纤维素9.9mg/g27-33%烷基二氨基乙基甘氨酸盐酸盐水溶液1mg/g聚山梨醇酯805mg/g氢氧化钠少量实施例2:眼用混悬液制剂的制备使用直径为1.0mm的珠和分散介质(参考例4的pH3.0、参考例2的pH5.0或参考例5的pH8.0),以类似于实施例1的方式制备混悬液制剂H、I或J。得到的混悬液制剂的各pH如下所示。混悬液制剂H(pH3):3.09混悬液制剂I(pH5):5.07混悬液制剂J(pH7):7.10悬浮在混悬液制剂H、I和J中的化合物A的各平均粒度通过上述方法测量。所得到的各平均粒度如下所示。混悬液制剂H(pH3):352.1nm混悬液制剂I(pH5):263.2nm混悬液制剂J(pH7):256.0nm以上述方式分析混悬液制剂H、I和J中的各化合物A的含量,分析结果如下所示。混悬液制剂H(pH3):217.9mg/mL混悬液制剂I(pH5):220.0mg/mL混悬液制剂J(pH7):222.4mg/mL比较例1:包含化合物A的眼用溶液制剂的制备向0.9%(w/v)氯化钠的0.1mol/L磷酸二氢钠水溶液的溶液中加入0.9%(w/v)氯化钠的0.1mol/L磷酸氢二钠溶液的溶液,将溶液的pH调节至8.0,用纯水将溶液稀释1.25倍(以下称为“pH8.0溶液”)。向所得到的1mL溶液中加入400μg喷射研磨的化合物A和0.08mL乙醇,将化合物A溶解,得到溶液制剂Z。比较例2:包含[5-[(1Z,2E)-2-甲基-3-苯基亚丙烯基]-4-氧代-2-硫代噻唑烷-3-基]乙酸或(2S,4S)-6-氟-2',5'-二氧代螺[色烷-4,4'-咪唑烷]-2-甲酰胺的眼用混悬液制剂的制备将2g的[5-[(1Z,2E)-2-甲基-3-苯基亚烯丙基]-4-氧代-2-硫代噻唑烷-3-基]乙酸(以下称为“化合物B”)和6mL的参考例2中制备的分散介质(pH5.0)装入螺纹瓶中,并将混合物用搅拌器搅拌30分钟。然后,将整个样品混合物转移到研磨罐中。用2mL分散介质洗涤螺纹瓶,并将洗涤溶液也放入研磨罐中。向研磨罐中加入50g直径为1.0mm的珠。将研磨罐放置在行星式球磨机(LP-4/2,ITOMANUFACTURINGCO.,LTD.)中,并将其中的内容物在300rpm下研磨6小时。用筛子过滤研磨的溶液以除去珠粒,然后用搅拌器/消泡剂“THINKYMIXERAR-250”(THINKYCORPORATION)脱泡30秒,得到混悬液制剂X1。另外,将1.84g的(2S,4S)-6-氟-2',5'-二氧代螺[色烷-4,4'-咪唑烷]-2-甲酰胺(以下称为“化合物C”)和6mL参考例2中制备的分散介质(pH5.0)装入螺纹瓶中,用搅拌器搅拌混合物30分钟。将得到的样品以与上述化合物B类似的方式处理,得到混悬液制剂Y1。将1.1g化合物B和5mL参考例2中制备的分散介质(pH5.0)放入螺纹瓶中,并将混合物用搅拌器搅拌10分钟,得到混悬液制剂X2。以类似的方式,也从化合物C制备混悬液制剂Y2。以与化合物A的平均粒度的测量类似的方式测量悬浮在混悬液制剂X1、Y1、X2和Y2中的化合物B和化合物C的各平均粒度。所获得的各平均粒度如下所示。混悬液制剂X1:555.7nm混悬液制剂Y1:290.8nm混悬液制剂X2:8970nm混悬液制剂Y2:5430nm混悬液制剂X1、Y1、X2和Y2中的化合物B和化合物C的各含量以上述方式分析,并且分析结果显示如下。混悬液制剂X1:215.4mg/mL混悬液制剂Y1:214.1mg/mL混悬液制剂X2:187.7mg/mL混悬液制剂Y2:196.8mg/mL本文的实施例和参考例的结果概述如下。[表4]试验1:包含化合物A的眼用混悬液制剂的储存稳定性的评价关于眼用混悬液制剂,根据以下程序评价在37℃下储存的化合物A的含量变化和在25℃下储存的化合物A的粒度变化。根据实施例1中所述的程序,用分散介质(pH5.0)和直径为0.5mm的珠制备眼用混悬液制剂。通过上述方法分析所得眼用混悬液制剂中化合物A的含量和悬浮化合物A的平均粒度。分析结果分别为220.95mg/mL和170.2nm。将制备的眼用混悬液制剂在37℃下储存规定时间,然后进行超声波处理以使其均匀化。向100μL的眼用混悬液制剂中加入800μL的1%HPMC和100μL的乙腈,并将混合物用涡旋振荡。将100μL的振荡混合物放入10mL量瓶中,向其中加入1%HPMC/乙腈(1:1)以将溶液的总体积精确地调节至10mL。使用得到的溶液作为化合物A的分析样品。使用柱YMC-PackProC185μm150x4.6mm,用超高效液相色谱仪(SHIMADZU)分析每个储存时间的每个样品。分析结果示于图1。随后,根据实施例1中所述的程序,用分散介质(pH5.0)制备眼用混悬液制剂。在研磨中,使用直径为0.5mm的珠粒2小时,然后将珠粒变为直径为0.02mm的珠粒,将混合物研磨2小时。通过上述方法分析所得眼用混悬液制剂中化合物A的含量和悬浮化合物A的平均粒度。分析结果分别为168.5mg/mL和180.5nm。将制备的眼用混悬液制剂在25℃下储存,通过上述方法分析每个时间段储存的样品的平均粒度。分析结果示于图1。图1显示本发明的眼用混悬液制剂中的化合物A的含量即使在储存72小时后也没有降低很多。并且,即使在储存14天后,其平均粒度也没有变化。该结果表明本发明的眼用制剂在化学和物理上是稳定的,并且不需要在寒冷地方储存,即可以在环境温度下储存。试验2:在大鼠中评价至后眼段的转移性(I-1)和(I-2)对于糖尿病大鼠模型的双眼,其中化合物A作为混悬液制剂(200mg/mL)以一般耐受剂量悬浮的眼用混悬液制剂A1,或其中化合物A溶解(400μg/mL)的眼用溶液制剂Z,以滴眼液以5分钟的间隔以5μL的量施用于一只眼睛中(其为大鼠滴眼液的最大耐受剂量),共5次。给药后60分钟,测量角膜、视网膜和血浆中化合物A的各浓度。滴眼液对一次的耐受体积具有限制,这与其它剂型不同。因此,从最大耐受剂量的滴眼液获得的药物向目标组织的递送量是重要的。耐受体积根据动物种类而变化,并且大鼠中的最大体积对于一只眼睛为5μL。化合物A在水中的溶解度非常低,因此在制备其眼用溶液制剂时,向溶液中加入添加剂以使化合物A的溶解度高于原始溶解度,从而制备眼用溶液制剂Z(400μg/mL)。此外,DiabeticRetinopathy,INTECH,Phapter15"ProphylacticMedicalTreatmentofDiabeticRetinopathy",AkihiroKakehashi等人公开了向SDT大鼠口服重复给予化合物A的实验,其中使得视网膜毛细血管变弱并且抑制视网膜中VEGF产生的化合物A的剂量为1.0mg/kg。在本试验中,化合物A的剂量(1.0mg/kg)经口重复给药,每天一次,持续21天。在最终给药后60分钟,测量角膜、视网膜和血浆中的化合物A的各浓度。结果示于图2和图3。图2显示通过眼用混悬液制剂A1的滴眼给药、眼用溶液制剂Z的滴眼给药和口服重复给药,至血浆、角膜和视网膜的化合物A的递送量(浓度)。化合物A到血浆、角膜和视网膜的各递送比率如下所示。通过滴眼给予眼用混悬液制剂A1的各组织中化合物A的浓度比率为血浆:角膜:视网膜=约1:101:33.5。通过滴眼给予眼用溶液制剂Z的各组织中化合物A的浓度比率为血浆:角膜:视网膜=约1:1689:1。并且,通过口服重复给药,各组织中化合物A的浓度比率为血浆:角膜:视网膜=约1:1:1。另外,各给药组的各视网膜/血浆比[视网膜/血浆比=(视网膜中的化合物A浓度(μg/g))/(血浆中的化合物A浓度(μg/mL))]显示如下。眼用混悬液制剂A1的给药组的视网膜/血浆比=33.5。眼用溶液制剂Z的给药组的视网膜/血浆比=1.1。口服重复给药组的视网膜/血浆比=1.0。在滴眼液中给予眼用溶液制剂Z的大鼠中,视网膜/血浆比为1.1,与通过口服给药的视网膜/血浆比(1.0)几乎相同。该结果表明,大部分眼用溶液制剂Z通过鼻泪管进入全身循环的血液,然后到达视网膜。另一方面,在给予本发明的眼用混悬液制剂A1的大鼠中,视网膜/血浆比为33.5,是口服给予SDT大鼠有效剂量的化合物A用于糖尿病性视网膜病变所得的视网膜/血浆比(1.0)或给予眼用溶液制剂Z所得的视网膜/血浆比(1.1)的30多倍。这表明眼用混悬液制剂可通过直接递送途径递送到视网膜。在试验2中给予大鼠眼用混悬液制剂A1和眼用溶液制剂Z的各组织中的化合物A的各浓度示于图3。在给予眼用溶液制剂Z的大鼠中,虽然化合物A的浓度比原始溶解度高(400μg/mL),但是向视网膜的递送率低(0.0473μg/g),即,不认为这项试验预示治疗效果。另一方面,在给予眼用混悬液制剂A1的大鼠中,到达视网膜的递送率足够高(342μg/g),足以预期是治疗效果,其中化合物A在制剂中的浓度是作为混悬液的一般耐受剂量(200mg/mL)。在滴眼液中给予的混悬液制剂中的化合物A的浓度是溶液制剂的500倍[(200mg/mL)/(400μg/mL)],但是其在源自混悬液制剂的视网膜中的量比溶液制剂高得多(7230倍[(342μg/g)/(0.0473μg/g)]。另一方面,对于至前眼段的角膜的递送和至血浆的递送,其来自混悬液制剂的角膜和血浆中的各个量仅分别为溶液制剂的14倍和232倍,尽管以滴眼液给予的混悬液制剂中的化合物A的量是溶液制剂的500倍。已经发现,包含化合物A的眼用混悬液制剂可以以比通过全身循环的口服给药或通过眼用溶液制剂的滴眼液更加足够的浓度的化合物A递送。因此,认为包含化合物A或其生理学上可接受的盐的眼用混悬液制剂在其作用与其副作用之间具有足够的分离,因此可以使包括视网膜在内的后眼段中的疾病安全地得到治疗。试验3:在大鼠中评价至后眼段的转移性(II)对SD大鼠的双眼,眼用制剂A2以滴眼液以对一只眼睛5μL的量以5分钟的间隔给予一次、三次或五次。给药后60分钟,测量角膜、视网膜和血浆中化合物A的各浓度。结果示于图4。如图4所示,眼用混悬液制剂使得化合物A在血浆中的浓度随给药频率而增加。然而,视网膜中的浓度不受给药频率的影响,即在一次给药中将所需量的化合物A递送至视网膜。从该结果,已经发现包含化合物A或其生理学上可接受的盐的眼用混悬液制剂可以通过这样的低的给药频率抑制循环水平的升高,并且还使制剂充分递送到视网膜中。试验4:在大鼠中评价至后眼段的转移性(III)对SD大鼠的双眼,以滴眼液以对于一只眼睛5μL的量给予眼用制剂A3或眼用制剂B-G一次。给药后60分钟,测量角膜、视网膜和血浆中化合物A的各浓度。结果示于图5。另外,用分散介质稀释眼用制剂A3以制备具有不同浓度的化合物A(20mg/mL)的眼用混悬液制剂,然后将稀释的制剂给予SD大鼠。给药后60分钟,测量角膜、视网膜和血浆中化合物A的各浓度(III-2)。结果示于图9。如图5所示,平均粒度越小,视网膜中的化合物A的浓度越高。然而,在角膜和血浆中,对于化合物A的浓度没有大的差异,只要平均粒度小于9560nm。与口服给药或用溶液眼部给药(口服给药:1.0,用溶液眼部给药:1.1)相比,使用混悬液制剂的眼部给药显示出更高的视网膜/血浆比(约4-12),甚至对于具有各种平均粒度的所有眼用混悬液制剂也是如此。并且,包含平均粒度为700nm或更小的化合物A的眼用混悬液制剂在视网膜中的浓度与血浆中的浓度之间具有较大的差异。考虑到该结果,认为眼用混悬液制剂可以表现出高效果并且还减少副作用。如图9所示,混悬液制剂中化合物A的浓度越高,视网膜中化合物A的浓度越高。通常认为,至后眼段的药物递送取决于溶解在水中的药物的量。然而,在该试验中,令人惊奇的是,无论溶解的化合物A的量如何,化合物A到视网膜的递送量随着化合物A的悬浮状态的浓度而增加。并且,用混悬液制剂的眼部给药显示比口服给药或用溶液眼部给药(口服给药:1.0,用溶液眼部给药:1.1)更高的视网膜/血浆比(约12),与混悬液浓度无关。试验5:在大鼠中评价至后眼段的转移性(IV)对SD大鼠的双眼,以滴眼液以对于一只眼睛5μL的量给予眼用制剂H(pH3)、眼用制剂I(pH5)或眼用制剂J(pH7)一次。给药后60分钟,测量角膜、视网膜和血浆中化合物A的各浓度。结果示于图6。如图6所示,眼用制剂I(pH5)、眼用制剂H(pH3)和眼用制剂J(pH7)全部显示足以能够治疗后眼段的疾病的至视网膜的递送水平。特别地,眼用制剂I(pH5)显示出向视网膜的非常高的递送。然而,至角膜和血浆的递送不受pH的这种影响。试验6:在大鼠中评价至后眼段的转移性(V)对SD大鼠的双眼,以滴眼液以对一只眼睛5μL的量给予眼用制剂I、眼用制剂F、眼用制剂G、眼用制剂X1、眼用制剂X2、眼用制剂Y1或眼用制剂Y2一次。给药后60分钟,测量视网膜中化合物A的各浓度。结果示于图7。如图7所示,包含化合物A的眼用混悬液制剂比包含化合物B或C的眼用混悬液制剂多得多地递送到视网膜。甚至当眼用混悬液制剂中的化合物A具有9560nm的平均粒度时,需要量的化合物A被递送到视网膜。然而,在化合物B或化合物C的情况下,具有任何平均粒度的化合物几乎不能递送到视网膜。试验7:化合物A关于VEGF刺激对细胞迁移的促进作用的抑制作用通过JDiabetesComplications.2012;26(5):369-77中描述的实验方法(细胞迁移测定)评价化合物A的抗VEGF作用。在实验中,使用从CellSystemCo.,LTD.获得的正常人视网膜毛细血管内皮细胞(HREC),并且本文使用的细胞培养物是CS-C培养基(CellSystemCo.,LTD.)。将化合物A、化合物B或化合物C溶解在二甲基亚砜(DMSO)中,将各溶液用细胞培养物稀释,以将DMSO中的浓度调整为0.1%,将各0.1%溶液用于实验。对于Lucentis,将其制剂原液用细胞培养物稀释,其中稀释比为每4mL细胞培养物中50μL制剂原液,并且将稀释的溶液用于实验。将HREC接种在6孔板中,并孵育直至汇合率为80-90%。在测定通过VEGF刺激的细胞迁移之前20-24小时,将细胞培养物更换为含有0.1%胎牛血清的细胞培养物。然后,用200μL移液管吸头在每孔一点处损伤培养细胞单层,并用显微镜测量伤口的宽度。损伤后,取决于每个试验条件,将细胞培养物改变为含有VEGF、每种醛糖还原酶抑制剂(化合物A、化合物B、化合物C)或Lucentis的细胞培养物。改变细胞培养物后约18小时,用显微镜测量伤口的每个宽度,并通过比较该宽度与刚刚损伤的宽度来评价抗VEGF作用。结果示于图8。如图8所示,结果表明VEGF刺激促进了HREC迁移,而Lucentis和醛糖还原酶抑制剂抑制了迁移。用1nM((0.42ng/mL)L)化合物A抑制HREC迁移的作用与100nM((28ng/mL)/L)化合物C的水平相同,并且比1000nM((320ng/mL)/L)化合物B更有效。另外,化合物A的迁移抑制比其它醛糖还原酶抑制剂的迁移抑制更有效,如下表所示的作用比所示。并且1nM化合物A的迁移抑制与抗VEGF抗体Lucentis处于相同的水平。[表5]AR抑制剂AR抑制作用,Ki(nM)化合物A0.23(X1.0)化合物C1.9(X8.3)化合物B62(X270)DiabeticRetinopathy,INTECH,Phapter15,"ProphylacticMedicalTreatmentofDiabeticRetinopathy",AkihiroKakehashi等人显示向非肥胖2型糖尿病模型的SDT大鼠重复口服给予化合物A可以减弱视网膜毛细血管并抑制视网膜中的VEGF产生,该发现表明,在促进VEGF生产之前预防性给予化合物A用于与VEGF相关的疾病,预计抑制进展到一定水平。然而,该文献没有清楚表明,化合物A通过降低已经产生的VEGF的作用对疾病发作后的治疗有效。另外,非专利文献1仅显示了口服给药的数据,但没有显示通过滴眼给药抑制进展的可能性。本试验已经清楚表明,化合物A或其生理学上可接受的盐可以抑制VEGF刺激对细胞迁移的促进作用,并且还显示对已经产生的VEGF的抗VEGF作用。该发现表明,本发明可以在发病后治疗与VEGF相关的疾病,例如年龄相关性黄斑变性和糖尿病性视网膜病变。并且,化合物A的抗VEGF作用比其它醛糖还原酶抑制剂更有效力,并且其与作为抗VEGF抗体制剂的Lucentis处于相同的水平。参考例6:混悬液制剂样品(1)至(4)的制备样品(1)的制备:根据实施例1的步骤,使用分散介质(pH5.0)和直径为0.5mm的珠制备包含化合物A(250mg/mL)的眼用混悬液制剂。样品(2)的制备:根据参考例2,通过使用聚氧乙烯氢化蓖麻油代替在参考例2的步骤中的聚山梨醇酯80,制备包含0.3%聚氧乙烯氢化蓖麻油的分散介质(pH5.0)。将15mL分散介质和5g化合物A放入螺纹瓶中,并将混合物进行超声5分钟。将全部内容物转移到用于研磨的注射器StarBurstMini(SuginoMachineLimited),并将螺纹瓶用5mL分散介质洗涤,并将洗涤溶液也放入注射器中。将注射器中的内容物在245MPa的研磨压力下研磨30分钟,以制备包含化合物A(250mg/mL)的眼用混悬液制剂。样品(3)的制备:将1g喷射研磨的化合物A加入到10g甘油中,并将混合物用搅拌器搅拌1小时,以制备包含化合物A的混悬液制剂。样品(4)的制备:将1g喷射研磨的化合物A加入到10g水中,并将混合物用搅拌器搅拌1小时,以制备包含化合物A的混悬液制剂。试验8:化合物A的溶解度的评价使用离心分离机HITACH-GX(HitachiKokiCo.,Ltd.)将样品(1)至(4)各500μL离心分离(150,000rpm,10分钟,5℃)。向100μL得到的上清液中加入800μL1%HPMC和100μL乙腈或水,混合物用涡流振荡,得到其各分析样品。使用柱YMC-PackProC185μm150x4.6mm,用超高效液相色谱(SHIMADZU)分析溶解在每个样品中的各化合物A的含量。分析结果示于表6中。表6显示,溶解在水性混悬液中的化合物A的百分比非常小。[表6]以上述方式分析悬浮在样品(1)和(2)中的化合物A的各平均粒度。结果分别为244.2nm和276.7nm。在25℃下储存一个月和两个月的样品(2)中的各粒度分别为277.3nm和256.9nm。工业适用性考虑到这些实施例、参考例、试验等,本发明的眼用制剂具有良好的至后眼段的转移性,并且可以适合用于治疗眼科疾病,例如后眼段的疾病。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1