含有喹高利特的药物装置单元的制作方法
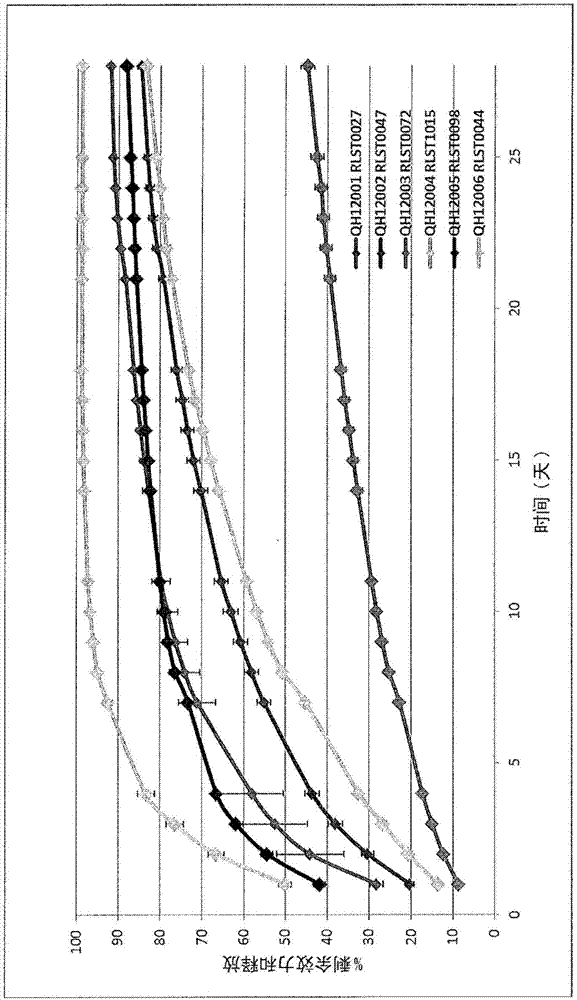
发明领域本发明涉及由聚氨酯嵌段共聚物形成并且包含多巴胺激动剂喹高利特(quinagolide)的固体受控释放聚合物药物装置单元,其具体为预期用于药物向患者持续释放的阴道环的形式。聚合物药物装置单元具体(尽管不限于)预期用于子宫内膜异位症(endometriosis)的治疗。背景子宫内膜异位症是雌激素依赖性慢性妇科疾病,其病理学特征在于在主要位于形成腹腔、卵巢、和直肠阴道隔膜的衬里的腹膜上的子宫外部存在子宫内膜状组织。子宫内膜异位症是盆腔疼痛和降低的生育能力的主要促成因素。在子宫外部的区域中的子宫内膜状细胞(子宫内膜异位症)受激素变化影响并且以与在子宫内部发现的细胞相似的方式响应,导致伴随血管发生、粘连、纤维化、疤痕、神经浸润、和解剖学畸变。子宫内膜异位症与多种令人痛苦症状相关,包括痛经(dysmenorrhoea)、性交疼痛(dyspareunia)、盆腔疼痛和不孕。在患者的亚群中,子宫内膜异位症可以发展为侵袭性的、使人虚弱的疾病。不存在针对子宫内膜异位症的治疗,但是在许多女性中,其在更年期之后减轻。在生殖年龄的患者中,子宫内膜异位症仅仅受到控制并且涉及药物治疗或手术治疗、或同时进行这二者的重复过程。目标是提供缓解疼痛,限制疾病的进展,并且在在需要时恢复或保持生育能力。针对子宫内膜异位症的药物治疗包括:用孕酮(progesterone)或孕激素(progestin)治疗,激素避孕治疗,具有雄激素活性的抑制性类固醇如达那唑(danazol)和gesterone,促性腺素释放激素激动剂治疗,和阻止雌激素形成的芳香酶抑制剂。这些药物治疗全都具有负面影响生殖力的抗排卵效果。在专利us2012/0157489、us2010/0113499和us2008/0293693中说明了喹高利特用于子宫内膜异位症的治疗的用途。尤其是,us2012/0157489提出了借助通过阴道施用(例如通过阴道子宫托或片剂、或通过阴道环)递送喹高利特的子宫内膜异位症的治疗。喹高利特是用于治疗升高的催乳素水平的多巴胺受体d2激动剂。其可以以商品名商购获得,并且以盐酸盐的形式制造和使用。喹高利特具有以下的化学式:并且是n,n-二乙基-n’-[(3s,4as,10ar)-6-羟基-1-丙基-1,2,3,4,4a,5,10,10a-八氢苯并[g]喹啉-3-基]磺酰胺。在eur.j.endocrinol,2006年2月1日,154,第187-195页中公开了喹高利特用于治疗高催乳素血症的用途。根据大量先前的参考文献,阴道环用于以持续释放方式施用药物的用途是已知的。wo2009/094573公开了聚氨酯阴道环用于孕酮的递送的用途。其他出版物公开了聚氨酯阴道环用于多种药物的持续递送的用途,包括wo2010/019226、wo2004/096151、us4,235,988和wo2005/004837、wo2013/013172。受控治疗的先前专利公布wo2008/007046公开了适用于制备用于在长时间期间释放药物活性剂的受控释放组合物的亲水性热塑性聚氨酯弹性体聚合物的用途;并且尤其是它们在子宫托、栓剂或阴道环中的用途。在m.r.clark等人,journalofpharmaceuticalsciences,第101卷,第2期,2012年2月以及wo2012/066000中,还公开了聚醚氨基甲酸酯弹性体用于递送抗hiv药物的用途。发明概述本发明基于对特别适用于药用聚合物药物装置单元并且提供改善的药物释放控制的一组聚氨酯嵌段共聚物的确认。具体地,聚合物促进初期和持续释放动力学和/或特征/性能的控制和操控。当加载有喹高利特时,已经发现确认的聚氨酯嵌段共聚物在其初期和长期释放期间提供更好的控制。本发明还在于意外发现了,使用由在本文中所公开的聚合物形成(或包含在本文中所公开的聚合物)的阴道环以持续释放方式递送的喹高利特在慢性病子宫内膜异位症的治疗和/或预防方面的有效性。本发明提供了药用受控释放聚合物药物装置单元,所述包含加载或分散在其中有喹高利特。具体地,本发明的聚合物药物装置单元用于喹高利特的受控和/或持续递送,并且被形成、设计和调整为在阴道内使用、施用或穿戴。本发明的聚合物药物装置单元发现在子宫内膜异位症的治疗和/或预防中的具体应用。应该理解的是,术语“治疗”和“预防”包括患子宫内膜异位症的女性所经历的症状的任何减轻或消除以及子宫内膜异位症的进展/发展的任何一般的抑制和/或延缓。例如,术语“治疗”和/或“预防”可以包括与盆腔疼痛有关或归因于盆腔疼痛(例如,痛经和非月经盆腔疼痛(nmpp))的症状的任何减轻、改善或消除。在不希望受理论约束的情况下,建议可以通过分析总体盆腔疼痛(包括与痛经和/或nmpp相关的疼痛)的平均日数值评定量表(nrs)评分的变化来评估盆腔疼痛的程度(及其变化)。这样的分析可以在等于或相当于1-12,例如1-10、1-8、1-6、1-4或甚至例如4-6个月经周期的时间期间进行。通过在相当于或等于约例如1-12、1-10、1-8、1-6、1-4或甚至例如4-6个月经周期的时间期间分析性交疼痛的平均日nrs分数,可以进一步或备选地评估子宫内膜异位症的任何基于药物装置单元的治疗和/或预防的效率或功效。另外地或备选地,在约2、3、4、5和/或6个月经周期之后或期间,通过例如分析或确定biberoglu和behrman量表(b&b)的平均个体和复合总体症状和征兆严重性评分、生存质量调查(如ehp-5)或患者改善总体分类调查(pgic)和镇痛药的使用(频率和数量)的降低,可以评估子宫内膜异位症的任何基于药物装置单元的治疗和/或预防的效率或功效。技术人员将会理解,在通过参照一些疼痛状态(如上所述)来评估药物装置单元效率和/或功效的情况下,施用或穿戴本发明的药物装置单元的受试者所经历的疼痛的量的减少可以表示子宫内膜异位症的成功的治疗和/或预防。根据第一方面,提供一种聚合物药物装置单元,所述聚合物药物装置单元包含:(i)可通过使下列各项一起反应获得的聚氨酯嵌段共聚物:(a)聚环氧烷烃;(b)二官能化合物;(c)二官能异氰酸酯;和(d)任选的包含聚环氧烷烃嵌段的嵌段共聚物;以及(ii)作为药用活性剂的喹高利特。本发明的聚合物药物装置单元可以被称为聚合物药物装置组合单元——应理解的是这两个术语是同义的。鉴于以上,本发明的聚合物药物装置单元可以包含聚氨酯嵌段共聚物和活性剂(例如喹高利特),所述活性剂包含或分散在聚合物内。因此,本发明的药物装置单元应被解释为含有药物或活性成分/剂的装置。相反,本发明的药物装置单元主动起受控释放药物载体或装置的作用。术语“药物装置单元”意在表示凭借其设计、物理特征和/或组成性质允许药物以受控方式释放的药物和装置/载体的组合产品(其中所述装置或载体可以主动或被动发挥作用)。本发明的药物装置单元是可以包含在使用中能够分配和/或洗脱活性剂的加载有药物(活性剂)的聚合物系统或加载有药物(活性剂)的聚合物装置的集成单元。本发明的药物装置单元可以用于活性剂的受控和/或持续递送。应该指出的是,尽管本发明根据聚合物药物装置单元进行了描述,但是可以预期药物装置单元的其他形式(各自包含喹高利特),包括,例如,浸渍有或含有喹高利特的经皮贴剂(等)。如以下更详细描述的,本发明的药物装置单元可以采取用于阴道内使用的加载有药物(活性剂)的聚合物环和/或子宫托的形式。在不希望受理论约束的情况下,应理解,除了与任何初期和持续药物释放的控制相关的优点之外,本发明的药物装置单元相对于口服的制剂还提供了某些改进。例如,如在本文中所描述的阴道内药物装置单元的使用促进活性剂(例如喹高利特)从阴道向盆腔中的子宫内膜异位症病灶的有利分布而没有任何首次通过效应(first-passeffect)。此外,发明人已经显示,本发明的药物装置单元既安全又被使用者充分耐受(如在临床研究000155中所示;安慰剂对照的、双盲、平行、随机研究;关于进一步说明参见第38页)。此外,药物装置单元被形成并且调整为使得将它们在阴道内维持长的时间段。此外,药物装置单元是自保持的(self-retaining)。喹高利特(c20h33n3o3s)是具有约395g/mol的分子量的选择性的d2受体激动剂。本发明涉及加载有喹高利特或在其中分散有喹高利特的药物装置单元。喹高利特可以以商品名获得,并且如在本文中所使用的,术语“喹高利特”包括所有可商购获得的形式以及其功能衍生物和变体。术语“喹高利特”还包括所有药用(和活性)盐和酯,包括,例如,喹高利特盐酸盐。喹高利特盐酸盐是高熔点(在分解下为231-237℃)的白色晶体粉末,其难溶于水。术语“喹高利特”还包括任何确定的活性对映体(例如(-)对映体(参见下式1))。如在下式1和2中所示,喹高利特盐酸盐(c20h33n3o3s,hcl)是以1:1比率含有分别具有绝对构型(3s,4as,10ar)和(3r,4ar,10as)的两种对映体的外消旋体。喹高利特的两种主要代谢物n-脱乙基(也被称为m1或sdz214-368)和n,n-二脱乙基n-脱乙基(也被称为m1或sdz214-368)和n,n-二脱乙基(也被称为m2或sdz214-992)可以具有与喹高利特相似的d2s结合亲和力和效力;因此,如在本文中所使用的术语“喹高利特”可以延伸至喹高利特代谢物——包括,例如m1和m2代谢物。所述术语可以延伸至在体内代谢为m1和/或m2代谢物中的任一个或二个的任何喹高利特类似物或衍生物。考虑到喹高利特(m1/m2)代谢物是活性的(并且这些可用于子宫内膜异位症的治疗和/或预防),本发明可以延伸至用于子宫内膜异位症的治疗和/或预防的喹高利特(m1/m2)代谢物(或者实际上任何其他在本文所述的活性喹高利特盐、衍生物和/或对映体)。此外,本发明可以延伸至喹高利特(m1/m2)代谢物(或者实际上任何其他在本文所述的活性喹高利特盐、衍生物和/或对映体)在用于子宫内膜异位症的治疗和/或预防的药物的制造中的用途。本发明还可以包括治疗或预防子宫内膜异位症的方法,所述方法包括向需要其的受试者施用治疗有效量的喹高利特(m1/m2)代谢物(或者实际上任何其他在本文所述的活性喹高利特盐、衍生物和/或对映体)的步骤。因此,本发明的聚合物药物装置单元可以包含如上所述的聚氨酯嵌段共聚物和加载或分散在其中的一定量的喹高利特盐酸盐。应该指出的是,在整个说明书中,术语“包含”用于表示本发明的实施方案“包含”所指出的特征,并且因此也可以包括其他特征。然而,在本发明的上下文中,术语“包含”还可以包括其中本发明“基本上由相关特征组成”或“由相关特征组成”的实施方案。组分(a)可以包含一种或多种聚环氧烷烃。聚环氧烷烃含有重复醚键-r-o-r-并且可以具有两个以上作为末端官能团的羟基。它们可以通过在阴离子开环聚合反应中环醚对引发剂的催化加成而制备。例如,环醚如环氧乙烷和环氧丙烷,与含活性氢的化合物(引发剂)如水、二醇、多元醇和胺反应。在一些情况中,可以使用催化剂。例如,通常采用氢氧化钾或氢氧化钠作为碱性催化剂。在达到所需的聚合度之后,可以将催化剂中和,通过过滤移除,并且可以加入添加剂如抗氧化剂。可以制备出不同结构、链长度和分子量的各种各样的可用的聚氨酯嵌段共聚物。例如,通过选择一种或多种氧化物、引发剂、和反应条件以及催化剂,可以使在低分子量聚环氧烷烃至高分子量聚合物的范围内的一系列聚醚多元醇聚合。这些聚合物也被称为聚亚烷基二醇或聚二醇。在本发明中采用的聚氨酯嵌段共聚物中,聚环氧烷烃可以是聚乙二醇(peg)、聚丙二醇(ppg)、聚(四亚甲基氧化物)(ptmo)或聚(六亚甲基氧化物)(phmo)。聚环氧烷烃可以是聚丙二醇。聚乙二醇含有重复单元(ch2ch2o)并且可以具有结构ho(ch2ch2o)nh,其中n是取决于聚乙二醇的分子量的大小不同的整数。在本发明中所使用的聚乙二醇通常是直链聚乙二醇和/或通常具有200至35,000g/mol、具体是1,000至10,000g/mol并且尤其是1,500至5,000g/mol的分子量。例如,聚乙二醇可以具有大约2,000g/mol的分子量。聚丙二醇含有重复单元(ch2ch(ch3)o)并且可以具有结构ho(ch2ch(ch3)o)nh,其中根据n是取决于聚丙二醇的分子量而大小不同的整数。在本发明中所使用的聚丙二醇通常是直链聚丙二醇和/或通常具有200至35,000g/mol、具体1,000至10,000g/mol并且尤其是1,500至5,000g/mol的分子量。例如,聚丙二醇可以大约2,000g/mol的分子量。由于在聚合期间伯羟基和仲羟基的共存和由于在聚合物上的多个甲基侧链,聚丙二醇具有独特的物理和化学性质。丙二醇的常规聚合得到无规立构聚合物。全同立构聚合物主要存在于实验室中。还可以产生无规立构和全同立构聚合物的混合物。聚丙烯具有许多和聚乙二醇相同的性质。所有分子量的聚丙二醇通常是具有低倾倒点的澄清、粘性液体,并且其显示出相反的温度-溶解度关系,随着分子量增加水溶解度快速降低。末端羟基经历伯醇和仲醇的典型反应。聚丙二醇的仲羟基的反应性不如聚乙二醇中的伯羟基。在本发明中所使用的聚氨酯嵌段共聚物也可以通过使包含聚环氧烷烃嵌段的嵌段共聚物与组分(a)、(b)和(c)一起反应获得。包含聚环氧烷烃嵌段的嵌段共聚物可以是聚环氧烷烃嵌段共聚物。嵌段共聚物可以包含聚乙二醇、聚丙二醇、聚(四亚甲基氧化物)(ptmo)、聚(六亚甲基氧化物)(phmo)、和/或聚硅氧烷如聚二甲基硅氧烷(pdms)的嵌段。嵌段共聚物可以包含聚乙二醇和聚丙二醇的嵌段。基于环氧丙烷和环氧乙烷的嵌段共聚物的制备可以从乙二醇、甘油、三羟甲基乙烷、三羟甲基丙烷、季戊四醇、山梨糖醇、蔗糖和多种其他化合物开始。还可以制备混合和交替的嵌段共聚物。当ppg的仲羟基被环氧乙烷封端时,得到了具有末端伯羟基的peg和ppg的嵌段共聚物。与仲羟基相比,伯羟基与异氰酸酯的反应性更高。在本发明中所使用的peg-ppg-peg和ppg-peg-ppg共聚物通常是直链的,具有在200至14,000g/mol范围内的分子量。例如,在本发明中所使用的peg-ppg-peg和ppg-peg-ppg嵌段共聚物可以具有大约2,000g/mol的分子量。如将理解的,在嵌段共聚物中的peg含量可以变化。例如,可以使用包含大约10重量%的peg的peg-ppg-peg共聚物。在其他实例中,可以使用包含大约50重量%的peg的ppg-peg-ppg共聚物。这些示例性嵌段共聚物通常是可商购获得的。然而,应该理解的是,可以使用具有备选组成范围的嵌段共聚物以提供根据本发明的药物递送装置。在本说明书中,术语“当量”用作意指数均分子量除以化合物的官能度。组分(b)可以包含一种或多种二官能化合物。二官能化合物与二官能异氰酸酯反应。适合的二官能化合物包括,例如,二醇、二胺和氨基醇。通常,使用短链二醇作为二官能化合物。例如,可以使用在c3至c20、具体c4至c10、尤其是c4至c6范围内的二醇。二醇可以是饱和的或不饱和的二醇。可以使用支链或直链二醇。适合的二醇的代表性的实例包括(但不限于)1,4-丁二醇、1,5-戊二醇、1,6-己二醇、1,10-癸二醇、1,12-十二烷二醇和1,16-十六烷二醇。在一些情况中,使用较低熔点的二官能化合物,如戊二醇(例如1,5-戊二醇)可以增加聚合物的制造的容易程度。例如,当通过反应性挤出过程制造聚合物时,使用戊二醇可以是特别有用的。组分(c)可以包含一种或多种二官能异氰酸酯。二官能异氰酸酯可以是芳族二异氰酸酯,如二苯基甲烷-4,4'-二异氰酸酯。二官能异氰酸酯可以是脂族二异氰酸酯,如二环己基甲烷-4,4'-二异氰酸酯(dmdi)、六亚甲基二异氰酸酯(hmdi)等。在一个实施方案中,二官能异氰酸酯是dmdi。通常,起始组分(a)、(b)和(d)的组合摩尔比应当等于起始组分(c)的摩尔比。遵照该一般原理可以确保平衡的化学计量并且促进所有起始聚合物组分的完全(或基本上完全)的反应。在起始组分的反应期间,可以监测一种或多种反应参数以评估起始组分的反应/消耗的化学计量和/或进展。组分(a):(b):(c)的摩尔比通常在0.05-0.75:1:1.00-2.00的范围内。在还存在组分(d)的那些情况中,组分(a):(b):(c):(d)的比率通常在0.05-0.75:1:1.00-2.00:0.01-0.50的范围内。在一些情况中,摩尔比可以在0.05-0.25:1:1.05-1.5:0.025-0.30的范围内。在其他情况中,组分的摩尔比可以在0.05-0.20:1:1.1-1.4:0.03-0.25的范围内。例如,组分的摩尔比可以是大约0.16:1:1.21:0.06。如技术人员将会理解的,组分的以上摩尔比基于具有理想分子量的组分(a)和(d)。例如,在组分(a)是ppg和/或组分(b)是ppg-peg-ppg嵌段共聚物的情况下,以上摩尔比适用于具有2000的理想分子量的那些组分中的每一个。因此,为了确保当使用不同原料时在聚氨酯嵌段共聚物中组分(a)、(b)、(c)和任选的(d)的重量百分比保持一致,技术人员可以适当地调整摩尔比(例如,在确定组分(a)和(d)的确切平均分子量之后)。本发明的聚合物通常通过在催化剂的存在下使组分(例如以上组分(a)、(b)和(c))中的一种或多种一起反应而制备。适合的催化剂可以包括例如,基于金属羧酸盐的无锡催化剂,例如烷酸铋或烷酸锌催化剂。这样的催化剂可以基于铋或锌与包含2至12个碳原子并且可以是支链或直链的有机酸的配位,例如新癸酸铋。代表性的实例可以包括,但不限于以商品名或kat销售的催化剂。可以使用的其他催化剂包括,例如,氯化铁、氯化铋、氯化锌和氯化铝。备选地,可以使用锡系催化剂(如辛酸亚锡)和/或胺系催化剂(例如,三乙二胺(teda)或1,4-二氮杂双环[2.2.2]辛烷(dabco))。可以将催化剂以其不纯或纯净的形式加入至一种或多种组分中。备选地,可以将催化剂作为溶液或分散液加入至一种或多种组分中。例如,可以在使用前将催化剂在反应的溶剂或多元醇组分中稀释。适合的溶剂可以包括,但不限于醇(如乙醇)、芳族溶剂(如二甲苯)、或其他有机溶剂(如乙酸丁酯或乙酸甲氧基丙酯)。本发明的聚合物药物装置单元可以包含(或者基本上由其组成,或者由其组成)由在下表1中确定的起始聚合物组合物制成的聚氨酯嵌段共聚物:聚丙二醇2000聚合物骨架868.6mg聚乙二醇-聚丙二醇2000聚合物骨架306.0mg二环己基甲烷4,4’-二异氰酸酯聚合物链连接剂884.8mg1,5-戊二醇聚合物增链剂290.3mg新癸酸铋催化剂2.4mg表1:用于制备用于在阴道环中使用的聚氨酯嵌段共聚物的起始聚合物组合物的实例配方。术语“起始聚合物组合物”包括在例如制备本发明的聚氨酯嵌段共聚物的反应性挤出和/或其他聚合过程中使用的那些组分和/或组合物。此外,尽管根据要制备的聚合物,术语包括在表1中确定的那些起始组合物,但是可以使用其他起始组合物和/或量。聚合物药物装置单元可以包含本文所述的聚氨酯嵌段共聚物中的一种或多种。聚合物药物装置单元可以包含含有所描述的聚合物中的一种或多种的单片式(monolithic-type)或单基质型(singlematrix-type)结构。备选地,聚合物药物装置单元可以包含储层(reservoir)型结构。例如,聚合物药物装置单元可以包含层状结构,每个层包含本文所述的聚合物中的一种或多种。在这样的实施方案中,内层可以加载有活性剂,如喹高利特。储层型聚合物药物装置单元可以包含含有(或者基本上由其组成,或由其组成)本文所述的聚氨酯嵌段共聚物中的一种或多种的内部核心结构或层。聚合物药物装置单元还可以包含作为套或涂层的外部层,所述外部层完全、基本上或至少部分覆盖或包封内部核心结构或层。外部层可以包含本文所述的聚合物嵌段共聚物中的一种或多种,基本上由其组成或者由其组成。内部核心结构或层可以包含活性剂(例如喹高利特)。活性剂可以不存在于外部层、套或涂层中。在不希望受理论约束的情况下,据信,这样的储层型结构的优点是其可以明显地改善装置的初期和长期释放特征的控制。内部核心可以包含可挤出基底,基本上由可挤出基底组成或者由可挤出基底组成。可挤出基底可以采取糊或凝胶的形式并且可以包含下列各项的混合物:聚合物材料、药物级聚合物、赋形剂、稀释剂等。这些可挤出基底可以与活性剂(例如喹高利特)混合,并且进料、插入或填充至包含本文所述的聚氨酯嵌段共聚物中的一种或多种的中空管中。可以通过共挤出过程或共注塑成型过程来形成上述类型的层状结构。备选地,可以通过管挤出和管填充过程的组合来形成储层型聚合物药物装置单元。发明人已经发现,本文所述的聚氨酯嵌段共聚物不仅促进药物活性剂如喹高利特的持续和连续递送,而且它们还提供更好地控制加载的活性剂的初期释放的聚合物药物装置单元。例如,本发明的聚合物和/或聚合物药物装置单元可以限制或降低药用活性剂的任何“爆发释放(burstrelease)”。术语“爆发释放”是指药用活性剂在相对短的时间期间从聚合物药物装置单元中的快速和/或不受控的释放。药用活性剂从聚合物药物装置单元中的爆发释放可以在使用的初期阶段和/或在释放介质中放置之后会是特别明显的。尽管任何“爆发释放”效果都可能是瞬时和/或短暂存在的,但是对于受控释放聚合物药物装置单元来说这是特别的问题,因为初期的高(爆发)剂量可能具有不利的药理学效果并且可能降低受控释放聚合物药物装置单元的有效寿命。本发明部分在某种程度上基于以下观察:包含本发明的聚合物的药用聚合物药物装置单元展现出对在其中分散或含有的药物活性剂的释放的更好的控制。例如,包含在本文中所公开的聚合物的任一种的聚合物药物装置单元在使用中(例如在向需要其的受试者阴道内施用之后)展现出在其中分散或含有的任何药物试剂的爆发释放得到降低。这特别适用于含有或在其中分散有喹高利特的聚合物药物装置单元;在这样的装置中,喹高利特的释放被更好地受控并且较少地经历如上所述的任何爆发释放现象。本发明的聚合物药物装置单元可以包括限制或含有药用活性剂的任何爆发释放的聚氨酯嵌段共聚物。任何爆发释放的控制可以是使得被治疗的受试者不暴露于毒性或有害的“爆发”剂量。本发明的聚合物药物装置单元可以包括限制或含有相对于药剂的稳态释放的活性剂的初期爆发释放的聚氨酯嵌段共聚物。通过在初期24小时时间期间的释放百分比除以在稍后时间段(例如等于在施用之后7-14天的时间段)期间的释放百分比计算的商可以提供爆发释放的相对大小的指示。例如,较低的释放商可以表示相对于稳态释放的降低的爆发释放。本文所述的聚合物可以提供在0.05至10之间的商。在一些实例中,聚合物组合物可以提供在约0.1至0.5之间或在0.2至0.4之间的商。某些储层型聚合物药物装置单元可以提供特别低的释放商。本文所述的聚氨酯嵌段共聚物可以具有在约45,000da至150,000da之间或在约50,000da至100,000da之间的范围内的分子量。例如,聚氨酯嵌段共聚物可以具有约60,000da、约70,000da或80,000da的分子量。技术人员将会理解,聚氨酯嵌段共聚物的分子量可以取决于聚合物制造的方法。多分散度指数(pdi)(有时被称为分散性或不均匀性指数)是在聚合物样品中的分子量分布的量度。可以使用下式计算pdi:pdi=mw/mn其中mw是质均分子量并且mn是数均分子量。聚氨酯嵌段共聚物可以具有在约1至5的范围内的pdi。在许多情况中,聚氨酯嵌段共聚物可以具有在约1至2之间的pdi。例如,聚氨酯嵌段共聚物可以具有约1.5或1.6的pdi。如以下更详细地描述的,用于在本发明中使用的聚氨酯嵌段共聚物是弹性的、可变形的/挠性的和/或软的。聚合物的弹性体性质归因于两个主要因素:硬嵌段和软嵌段的微相分离;和聚合物的半结晶性,该聚合物的非晶相具有低的玻璃化转变温度。硬嵌段通常由二官能化合物和二异氰酸酯形成。软嵌段通常由聚环氧烷烃和任选的聚环氧烷烃嵌段共聚物部分形成。弹性可以取决于硬嵌段与软嵌段的比率,并且可以由肖氏硬度测量表示。备选地或另外地,聚合物的弹性可以通过拉伸测量确定。在一些实施方案中,硬嵌段可以占聚合物的总重量的30至70重量%之间,具体40至60重量%之间。相反,软嵌段可以占聚合物的总重量的30至70重量%之间,具体40至60重量%之间。在优选的实施方案中,基于聚合物的总重量,聚合物可以包含50重量%的硬嵌段和大约50重量%的软嵌段。聚氨酯嵌段共聚物可以具有在约-60至-20℃之间的玻璃化转变温度(tg)。例如,聚氨酯嵌段共聚物可以具有约-40℃的玻璃化转变温度。聚氨酯嵌段共聚物的晶体熔化温度(tm)可以随着在聚合物中存在的硬嵌段的量而增加。聚氨酯嵌段共聚物的晶体熔化温度可以在约10至50℃之间。例如,晶体熔化温度可以是约20℃、约25℃或约30℃。本发明的聚合物药物装置单元可以包含不仅促进所需药物洗脱特征(即基本上连续、持续递送而没有明显的爆发释放)而且还可以展现出适用于、促进或允许在阴道腔中使用和/或放置的力学性能的聚氨酯嵌段共聚物。例如,用于在本发明的聚合物药物装置单元中使用的聚氨酯嵌段共聚物可以是弹性的、可变形的、软的和/或挠性的。聚氨酯嵌段共聚物可以展现出使得其能够变形以实现安装和插入并且之后释放以基本上回复其在原位时的初始形状的记忆程度。聚合物药物装置单元可以适应和/或符合阴道腔的内部轮廓和/或外形。用于使用的聚合物的软的、挠性的、可变形的和弹性的性质确保含有其的聚合物药物装置单元不仅穿戴舒适而且还在使用者/患者移动期间并且尽管使用者/患者移动也保持在适当位置。为了提供适合在阴道腔中使用、放置和/或保持的聚合物药物装置单元,将可商购的产品(merck)的力学性能用作比较(如在下表2中所示)。表2:可商购获得的阴道环的力学性能在不限于任何具体聚氨酯嵌段共聚物的情况下,用于在本发明中使用的聚合物可以具有与相似的弹性模量和/或拉伸值。聚合物药物装置单元可以具有在约5至100mpa之间的弹性模量。例如,聚合物药物装置单元可以具有在约5至30mpa之间的弹性模量。聚合物药物装置单元可以具有在约10至20mpa之间的弹性模量。在一些情况中,当在水合状态下时,聚合物药物装置单元可以具有在约10至20mpa之间的弹性模量。用于在本发明中使用的聚氨酯嵌段共聚物可以容易地(注塑)成型、挤出或以其他方式形成为具有在约1mm至约10mm之间任何数值的横截面直径的管。例如,聚合物管的横截面直径可以是约2mm、3mm、4mm、5mm、6mm、7mm、8mm或9mm。本发明的聚合物药物装置单元可以采取环的形式,所述环凭借其聚合物组合物而具有软的、挠性的、弹性的和/或可变形的性质。环可以由连接的管状长度的聚合物制成。环可以具有如上所述的常规或可变横截面直径。本发明的阴道环的形状可以是圆环面。环的形式的阴道内聚合物药物装置单元可以具有在约40mm至80mm(例如约50mm至70mm,或约50mm或60mm)的范围内的外(大)直径。例如,用于在子宫内膜异位症的治疗和/或预防中使用的环可以包含如在本文中所描述的加载有喹高利特的聚氨酯嵌段共聚物,所述加载有喹高利特的聚氨酯嵌段共聚物采取具有约4mm的横截面(小)直径的软的、挠性环的形式。尽管本发明的聚合物药物装置单元通常是用于阴道(内)用途的环,在其他实施方案中,本发明的聚合物药物装置单元可以包括栓剂、用于阴道用途的子宫托、用于口腔施用的口腔插入物、用于经皮施用的贴剂、等等。本发明的聚合物药物装置单元可以包含约25至约15000微克(μg)或约200至5000μg的量或剂量的喹高利特(或其药用盐:例如喹高利特盐酸盐)。例如,聚合物药物装置单元可以包含约400-3000μg的剂量的喹高利特。通常,在本发明的聚合物药物装置单元内含有(或分散有)约200μg、约400μg、约800μg、约1200μg、约1500μg约2400μg和约3000μg的喹高利特。在使用中,本发明的聚合物药物装置单元可以显示出或实现喹高利特向阴道组织的连续释放。技术人员将会理解,从本发明的聚合物药物装置单元中连续释放的喹高利特的大小或量将会根据加载至聚合物药物装置单元中和/或在聚合物药物装置单元内分散的量而变化。通常,在特定/预定的时间期间,释放可以是稳定和恒定的。本发明的聚合物药物装置单元可以连续释放在约1至约100μg、150μg或350μg之间的任何数值的喹高利特/天;例如1至约50μg喹高利特/天。根据组成(和可能的其他因素),聚合物药物装置单元可以连续释放约5、约10、约15、约20或约30μg喹高利特/天。聚合物药物装置单元可以连续释放至少约5、至少约10、至少约15、至少约20或至少约30μg喹高利特/天。作为另一个实例,药物装置单元可以连续释放约45、约40、约35、约30或约25μg喹高利特/天。可以使用确定在一些预定温度下(例如在约37℃(±0.5℃)下)喹高利特在溶出介质(缓冲液,如水)中的释放的方法或方案来评估、监测或确定喹高利特从本发明的药物装置单元中的释放。适合的方案可以使用适当的体积的水以确保分析物(在这种情况中,“喹高利特”)的释放的下沉(sink)条件。可以将样品(例如本发明的样品或试验药物装置单元)在封闭容器例如duran烧瓶等中容纳预定的时间段(例如约35天——然而精确时间可以根据条件和方案而变化)。在整个方案中,可以将封闭容器搅动和/或振荡/搅拌设定的或沿长的时间段。备选地或另外地,本发明的聚合物药物装置单元可以用于在患者中实现喹高利特的治疗上有效的血浆浓度而没有不利和/或毒性的效果。例如,本发明的药物装置单元可以配制为使得喹高利特的血浆浓度等于或低于一些预定的安全(无毒水平)。例如(并且在不希望受理论或实例约束的情况下),聚合物药物装置单元可以提供在血浆中小于或等于约50pg/ml的喹高利特的浓度。在更长时间期间(例如在21天期间、28天期间或35天期间),聚合物药物装置单元可以在血浆中提供在约1至100pg/ml之间或约1至50pg/ml之间(例如约1至20pg/ml之间)的喹高利特的基本上恒定的水平。可以在施用之后1至48小时内(例如截至约36至约46小时以上(在初始患者值中))实现喹高利特的基本上恒定的血浆浓度。因此,在不受理论约束的情况下,本发明的聚合物药物装置单元可以提供将喹高利特施用至患者的安全方法。在本文中所公开的聚氨酯嵌段共聚物调节在聚合物药物装置单元的初期施用之后12-36小时内(例如约24小时内)的喹高利特的初期爆发释放和稳态释放。此外,使用本发明的聚合物药物装置单元,可以在长时间期间(例如21天期间,28天期间或35天期间)在血浆中实现喹高利特的基本上恒定的水平。喹高利特可以作为粒化制剂例如湿粒化制剂加载至所述聚合物药物装置单元中。这样的喹高利特制剂可以起结合喹高利特的作用并且还在使用中妨碍喹高利特从聚合物药物装置单元中释放。因此,喹高利特的制剂可以有助于控制(例如最小化)喹高利特从聚合物药物装置单元中的初期和/或长期释放二者。技术人员将会理解,为了提供活性剂的湿粒化制剂,可以将粒化或润湿液体加入至粉末状药剂中。液体/粉末混合物的搅动导致提供了之后可以干燥使用的湿颗粒。粒化或润湿液体可以包含溶剂,例如挥发性溶剂。溶剂可以包含水、醇(例如异丙醇(ipa))或其混合物。一旦润湿,就可以使待粒化的材料经过筛网从而形成颗粒。用于使用的喹高利特可以与一种或多种赋形剂混合、组合和/或配制。赋形剂可以选自天然聚合物,纤维素(如微晶纤维素),以及它们的衍生物(如乙基纤维素、(羟丙基)甲基纤维素(hpmc)和羟丙基纤维素(hpc))。其他可以使用的赋形剂包括多糖(如预糊化淀粉和支链淀粉)、玉米素和聚乙烯吡咯烷酮(pvp)。例如,喹高利特可以与微晶纤维素(如)和乙基纤维素配制。粒化制剂可以包含在约1至99重量%之间的赋形剂。例如,粒化制剂可以包含在约50至99重量%之间的赋形剂。在一些情况中,粒化制剂可以包含在约5-15重量%之间的乙基纤维素(例如7重量%)和/或约50-95重量%的微晶纤维素。为了进一步辅助将喹高利特加载至聚氨酯嵌段共聚物中,可以使用抗静电添加剂。当使用热熔挤出方法加载喹高利特时,这样的添加剂可以具有特定用途。在这样的过程中,通常通过重量进料器(gravimetricfeeder)将活性剂(通常为颗粒或粉末形式)分配至聚合物进料中。使用抗静电添加剂可以改善活性剂从重量进料器的流动。因此,这种添加剂可以有助于为聚氨酯嵌段共聚物中的活性剂(喹高利特)提供增加的均匀性。抗静电剂可以是气相法二氧化硅(例如aerosil)。喹高利特的粒化制剂可以包含在约0.5至5重量%之间的抗静电剂。例如,抗静电剂可以以粒化制剂的大约1.5重量%的量存在。应该指出的是,可以使用任何适合的抗静电剂并且对于本领域技术人员来说大量适合的药剂将会是已知的。鉴于以上,通过进一步举例,本发明的聚合物药物装置单元可以包含具有以下组成的粒化喹高利特制剂(粒化喹高利特制剂通过例如湿粒化而形成):*对于400μg、800μg和1200μg剂量的喹高利特盐酸盐,喹高利特的等效剂量分别是366.2μg、732.5μg和1098.7μg。表3:示例性粒化喹高利特制剂为了制备根据本发明的药物装置单元,可以对药物组分(喹高利特)和任何赋形剂/润湿剂(例如微晶纤维素、乙基纤维素和2-丙醇)进行颗粒药物配制过程。例如,可以将组分共混以引发可以筛分的湿粒化物质的形成。之后可以将颗粒干燥并且与抗静电剂(例如亲水性气相法二氧化硅)共混。同样地,可以筛分混合物。本发明还提供制备聚氨酯嵌段共聚物的方法。可以通过反应性挤出过程或通过间歇过程制造聚氨酯嵌段共聚物。所述方法可以包括在反应之前将聚环氧烷烃、二官能化合物和任选的嵌段聚环氧烷烃共聚物熔融并且干燥。例如,可以在85℃至100℃的温度下在真空下将这些组分干燥。通常将这些组分单独干燥。所述方法可以包括以任何适合顺序将起始组分(a)、(b)、(c)和(d)混合。例如,可以在加入(c)之前将组分(a)、(b)和(d)组合在一起。备选地,所述方法可以包括在加入二官能化合物(组分(b))之前将组分(a)、(c)和(d)混合。本发明还提供了用于制备聚合物药物装置单元的方法。所述方法可以包括将喹高利特加载至聚氨酯嵌段共聚物中。可以通过热熔体混合过程将喹高利特加载至聚合物中。例如,热熔体混合过程可以是热熔挤出过程。在加载步骤之前,可以将喹高利特配制为如在本文中所公开的颗粒。如所述的,本发明的药物装置单元可以采取用于阴道内使用的环的形式。环可以通过挤出过程形成,其中将短长度的挤出聚合物形成为具有通过包括例如胶粘(使用例如,医用级粘合剂)、焊接、激光焊接和紧固在内的任何适合方法连接的末端的环。备选地,可以通过包括注塑成型的过程形成环型药物装置单元。除了以上之外,本发明的第二方面提供用于子宫内膜异位症的治疗和/或预防的本发明的聚合物药物装置单元。在第三方面中,本发明还可以提供本发明的聚合物药物装置单元在用于子宫内膜异位症的治疗和/或预防的药物的制造中的用途。此外,在第四方面中,本发明提供治疗和/或预防子宫内膜异位症的方法,所述方法包括向需要其的受试者施用本发明的聚合物药物装置单元。所述方法可以包括将药物装置单元插入至受试者(例如患者)的阴道中,将装置留在原位预定或规定的时间段并且之后移除所述单元。可以向受试者施用另外的药物装置单元。要施用本发明的聚合物药物装置单元、组合物或药物的需要其的受试者或实际上的受试者可以是罹患或展现出子宫内膜异位症的症状的任何受试者。还可以向易于或倾向于发展为子宫内膜异位症的那些人施用本发明的装置或组合物/药物。应该指出的是,本发明的药物装置单元可以是自施用的。也就是说,药物装置单元可以由待治疗的受试者施用。需要或被指定本发明的药物装置单元的受试者可以例如从任何包装和敷布中将装置移除,或者将药物装置单元(其为环形)变形(手动)以使得其可以被插入至阴道腔中。一旦释放,药物装置单元就(可以恢复其圆环形状并且)可以抓紧并且符合阴道腔的内部轮廓/外形。以这种方式,药物装置单元可以在原位保持必需时间段和/或直到将其移除(可能被受试者/穿戴者移除)并且用另一个替换。可以每个月经周期向要施用本发明的药物装置单元的受试者施用一个药物装置单元。技术人员将会理解,在女性受试者之间、甚至在任何给定女性中,月经周期的持续时间可以变化。考虑到这种变化,任何给定的受试者都可以每21-35天插入或被施用药物装置单元一次,确切时间取决于周期的长度;环可以在原位存在完整月经周期的全部或至少一部分的时间段。如所述的,一旦周期结束(即经血结束)。可以在经血的早期或开始(或根据受试者和/或其他因素如周期的持续时间和/或待治疗的疾病的严重性,在一些其他时间)施用本发明的药物装置单元(即插入至阴道中)。例如,可以在月经周期的约第1天至约第7天,例如第2、3、4、5或6天,施用本发明的药物装置单元。药物装置单元可以在月经周期期间被留在原位并且可以在周期期间的任何时间被移除,任选用另一个药物装置单元替换。在使用中,可以直到周期结束或者直到周期刚刚结束之后才移除药物装置单元。可以在第2个或随后的月经周期的约第1天至约第7天将药物装置单元移除并且用新药物装置单元替换。可以根据需要的频繁程度重复这种施用方案,并且在经血的早期和/或在任何给定月经周期的约第1天至约第7天插入和/或移除本发明的药物装置单元。还应当指出,在性交期间(或者为了性交),可以将本发明的药物装置单元移除或留在原位。如果在数小时之后移除并且替换环,对药物装置单元的总体功效应该没有影响。在第五方面中,本发明还提供了包含如在本文中所描述的一个或多个聚合物药物装置单元和一个或多个涂覆器的套盒。例如,套盒可以含有单一的(任选包裹的/包装的)本发明的药物装置单元和因此的涂覆器,或者多个药物装置单元和相应数量的涂覆器。套盒可以含有足够的药物装置单元(和一个或多个涂覆器)以提供治疗过程。套盒可以含有足够的药物装置单元,以用于在1、2、3、4、5、6或更多个以上月经周期期间使用和/或用于在1-12、1-4、1-6、1-8、1-10个月时间期间/跨度内(例如在2-10、3-8个月或4-6个月期间或跨度内)使用。可以将药物装置单元填充并且密封。例如,可以将药物装置单元填充并且密封在箔袋中。可以单独填充药物装置单元和/或任何涂覆器。药物装置单元可以不是无菌的。涂覆器可以促进聚合物药物装置单元向患者中的插入。例如,涂覆器可以促进聚合物药物装置单元(如阴道环)向阴道腔中的插入。在套盒中,可以将聚合物药物装置单元预加载至涂覆器中或涂覆器上。可以将套盒容纳在无菌包装中。应该理解的是,针对本发明的第一方面详细描述的那些特征可以等同地适用于本发明的第二、第三、第四和第五方面。详细描述现在将参照以下附图详细地描述本发明,其示出了:图1:用于根据本发明的一个实施方案的聚合物药物装置单元的一个示例性制造过程的一般概述。图2:示出在28天时间期间喹高利特从多种加载有药物的聚氨酯嵌段共聚物(1.0%w/w,4x4mm嵌段)中释放的体外溶解曲线。图3:示出喹高利特从加载有药物的聚合物rlst0183和rlst0157中释放的体外溶解曲线。图4:示出在28天时间期间喹高利特从加载有药物的聚合物rlst0072和rlst0154(0.5%w/w,4x4mm嵌段)中释放的体外溶解曲线。图5:示出在10天时间期间喹高利特从相比于rlst0072和rlst0154的另外的加载有药物的聚氨酯嵌段共聚物中释放的体外溶解曲线。图6:示出对于批次qh12019、qh12020和qh12022在20天时间期间喹高利特的释放的体外溶解曲线。图7:在绵羊中的第一研究中,在28天时间期间喹高利特从批次qh12020和qh12022中的体内释放。图8:在绵羊中的第二研究中,在28天时间期间喹高利特从批次qh13005和qh13006中的体内释放。图9:在28天时间期间发现于第一和第二绵羊研究中的喹高利特盐酸盐从批次qh12020、qh12022、qh13005和qh13006中的体内释放的平均每日速率。图10:在第一和第二绵羊研究期间的28天时间期间的喹高利特(q)和活性代谢物(m1和m2)的血浆浓度。图11:示出在28天时间期间喹高利特的释放的共挤出批次qh13017-qh13024的溶解曲线。图12:在绵羊中的阴道环的体内释放曲线。在35天时间期间的喹高利特(q:400ug(a组):800ug(b组):1100ug(c组))和活性代谢物(m1和m2)的血浆浓度。图13:喹高利特代谢物m1和m2。图14:绵羊中喹高利特随阴道环施用的时间进程。在28天期间在用喹高利特阴道环治疗的绵羊中的喹高利特的中值血浆浓度。释放速率是5μg/天(蓝)、10μg/天(红)和15μg/天(黑)。图15:示出关于以400、800或1200μg加载的延长释放的阴道环的平均喹高利特浓度的人类数据。图16:示出在三个月经周期期间的实例/可能的基于药物装置单元的治疗的图。在该图中,根据本发明的第1药物装置单元在第1周期(在该实例中持续28天)早期插入并且留在原位直到第2周期早期,此时将第1装置移除并且插入根据本发明的第2药物装置单元。之后在第二周期的28天时间的剩余时间内将该第2药物装置单元保持在原位。在第3周期(也持续28天)的早期,将第2药物装置单元移除并且插入本发明的第3药物装置单元。该过程可以在随后的循环的跨度内或期间重复。应该指出的是,在该实例中的周期持续28天,然而周期的长度可以根据受试者变化。制造过程概述在图1中示出了用于根据本发明的聚合物药物装置单元的实例制造过程的一般概述。在框100、105、110、115和120中示出了制造过程的五个主要阶段。第一阶段涉及原料和催化剂的制备(框100)。可以使用反应性挤出、分批处理或任何其他适合方法制造聚氨酯嵌段共聚物(框105)。单独地,并且任选平行地,可以制备作为颗粒制剂的活性剂(框110)。接下来的阶段包括用活性剂加载聚合物(框115)。将颗粒药物与聚合物均匀结合或混合。该过程的第五阶段包括环产品的形成。可以通过任何数量的适合方法形成环,包括,例如,使用医用级粘合剂或者焊接,例如热焊接或激光焊接,将挤出圆柱形聚合物管的末端结合在一起。备选地,环可以通过注塑成型过程形成。之后将环产品包装以允许储存。例如,可以将环产品放置在防止水分和/或气体进入的包装中。在以下实例中,将会进一步描述在该制造过程的每一个阶段。聚合物合成用于聚合物制造的原料的制备通过在真空下加热将起始聚合物组合物(聚环氧烷烃、二官能化合物和(如果存在)聚环氧烷烃嵌段共聚物)干燥以移除水。在使用前在氮下将二官能异氰酸酯搅拌并且加热。催化剂的制备催化剂可以制备作为分散液或溶液使用或者以纯净使用。可以使用本文所述的催化剂的任一种。例如,将铋催化剂(bicat)(例如新癸酸铋)(10g)溶解在乙醇中。将1,5-戊二醇(100g)加入至溶液中,并且之后使用旋转蒸发器移除乙醇以提供bicat在1,5-戊二醇中的分散液(10重量%)。借助反应性挤出过程的聚合物的制造使用液体进料系统将反应物(聚环氧烷烃、二官能化合物、二官能异氰酸酯和(如果存在)聚环氧烷烃嵌段共聚物)分配至挤出机中。注射器泵将催化剂或催化剂分散液同时从体积校准的注射器分配至挤出机中。使用对于本领域技术人员来说将会已知的方法,固定单独液体物流中的每一个向挤出机中流动的速率以确保最终聚合物含有适当比例的起始组合物材料中的每一种。将聚氨酯嵌段共聚物从挤出机中以线材方式排出。将线材通过水浴和冷却盘管输送至造粒机中。在造粒之后,将聚合物粒料储存在室温下直到需要。可以借助注塑成型过程将粒料形成为本发明的药物装置单元(例如阴道环)。借助间歇过程的聚合物的制造典型间歇反应器包括容器和可以套有加热/冷却系统的搅拌器。一旦到达初始温度,即用反应物和催化剂填装反应器。备选地或另外地,在将反应物进料至反应器容器中之后调节温度。在整个聚合持续时间中监测反应温度和扭矩。当扭矩水平到达平衡时,认为聚合完成。之后将聚合物从反应器中排出并且造粒。颗粒药物制剂的制备可以使用例如以下所述的湿粒化过程制备作为颗粒药物制剂的喹高利特盐酸盐。将喹高利特盐酸盐(qh)与微晶纤维素(例如avicelph101)直接共混。在需要较低剂量的喹高利特盐酸盐的那些情况中,将作为在异丙醇(ipa)中的溶液的喹高利特盐酸盐加入至微晶纤维素中。之后将在ipa中的乙基纤维素的混合物加入至喹高利特盐酸盐/微晶纤维素共混物中。使湿混合物经过制粒机筛以形成颗粒。将颗粒在烘箱中干燥。一旦干燥,即将颗粒与亲水性气相法二氧化硅(例如aerosil200vv)混合,之后使用更细的制粒机筛进一步降低尺寸。之后将最终材料手动筛分。测试每个批次的颗粒以确保含量均匀性并且监测剩余的水和ipa的水平。示例药物装置制造构成聚合物骨架的长链二醇ppg-2000和ppg-peg2000可以用dmdi末端封端并且使用1,5-戊二醇链延长。可以使用新癸酸铋催化反应。在进行反应之前,可以将二醇的水含量降低(通过例如干燥)至小于1.0%。可以将起始材料分配至挤出机中,在那里它们在反应性挤出过程中反应以形成聚合物(以上描述的)。之后可以将聚合物挤出、造粒和收集。在随后的步骤中,可以将颗粒药物制剂和聚合物粒料加载至单独的进料器中。这些进料器可以用于将它们的材料准确地分配至存在颗粒和聚合物的热熔挤出的挤出机中。可以将挤出的线材切成长条并且使用例如医用级粘合剂形成为适合的药物装置单元(即“环”)。在该过程的所有阶段中均存在一系列过程中控制。颗粒组成的计算如将理解的,在颗粒制备期间使用的喹高利特盐和其他组分的确切的量将会取决于在最终药物装置单元中所需的剂量。为了得到在最终药物装置单元中的活性剂的所需剂量,技术人员将会需要解释在随后的药物加载步骤中的挤出过程的目标通过速率、颗粒中活性剂的浓度以及目标药物装置单元重量。仅通过举例,已经采用以下参数:-目标阴道环重量:2.4g-聚合物中喹高利特hcl颗粒的目标浓度:2%-挤出期间药物进料器的目标通过速率:40g/小时-挤出期间聚合物进料器的目标通过速率:1960g/小时-制备的喹高利特hcl颗粒的批次规模:300g-阴道环中喹高利特hcl的目标剂量:400mcg、800mcg和1200mcg可以如在下表4中所示计算特定批次规模所需的喹高利特盐酸盐浓度、环重量和目标剂量:表4:针对400mcg、800mcg和1200mcg的目标剂量的喹高利特盐酸盐浓度的计算在表5、6和7中示出了在实例颗粒批次中存在的其他赋形剂的浓度和量。材料颗粒中的%w/w所需的量(g)喹高利特hcl0.83342.500avicelph10190.667272.00乙基纤维素7.00021.00aerosil200vv1.5004.500总固体100.00300.00异丙醇固体含量的53%159.00表5:阴道环中400mcg喹高利特盐酸盐的目标剂量表6:阴道环中800mcg喹高利特盐酸盐的目标剂量材料颗粒中的%w/w所需的量(g)喹高利特hcl2.5007.500avicelph10289.000267.00乙基纤维素7.00021.00aerosil200vv1.5004.500总固体100.00300.00异丙醇固体含量的53%159.00表7:阴道环中1200mcg喹高利特盐酸盐的目标剂量使用热熔挤出将活性剂加载至聚合物中使用热熔挤出过程将包含喹高利特盐酸盐的颗粒与预制备的聚合物粒料混合。热熔挤出是在制药行业中广泛使用的将活性剂加载至聚合物中的方法。将颗粒药物制剂和聚合物粒料装入重量进料器中并且以一定速率分配至挤出机中以提供在最终环产品中的活性剂的所需剂量。还选择一组适当的混合螺杆、螺杆速度和温度曲线。如将理解的,所选择的确切参数可以取决于最终产品中的聚合物组合物的性质、颗粒和目标剂量。这样的参数的适当选择将完全在技术人员的能力范围内。在挤出之后,使加载有药物的聚合物线材经过切割单元并且切成所需的长度。线材的长度决定最终环产品的周长。因此,所需的长度将会取决于最终环产品的目标尺寸。之后将切割的线材长条密封在箔袋中并且在冰箱中储存直到随后的环形成过程。环形成将底涂成分从加压喷雾分配器分配至聚合物线材的圆柱形末端上,之后使用蠕动泵分配器将医用级粘合剂涂覆至线材的第一末端。之后将线材的第一末端连接至线材的第二末端以形成阴道环产品。如将理解的,可以使用将线材的末端连接的其他方法以形成阴道环产品。例如,可以将末端胶粘(使用医用级粘合剂)或通过热或激光焊接过程焊接在一起。备选地,可以通过注塑成型形成环。在这样的情况中,可以将挤出的聚合物线材造粒,之后转移至注塑机。在这样的情况中,聚合物直接形成为环形。在形成之后,将环产品包装在单独的箔袋中。聚合物组合物聚氨酯嵌段共聚物可通过使下列组分一起反应获得:(a)聚环氧烷烃;(b)二官能化合物;(c)二官能异氰酸酯;和(d)任选的包含聚环氧烷烃嵌段的嵌段共聚物。使用在表8中确定的起始聚合物组成制备聚氨酯嵌段共聚物,其随后被研究以用于包含喹高利特的药物装置单元。在表8中示出了这些组分的相对量和性质。表8:用于制备用作包含喹高利特的药物装置单元的聚氨酯嵌段共聚物的示例起始聚合物组成。在示例组合物中使用的嵌段共聚合物如下:ppg-peg-ppg2000包含大约50重量%的peg。例如,具有其构成嵌段的大约25:50:25的重量百分比的嵌段共聚物。peg-ppg-peg2000包含大约10重量%的peg。例如,具有其构成嵌段的大约5:90:5的重量百分比的嵌段共聚物。聚氨酯嵌段共聚物的评价溶解测试当放置到含有液体介质的容器中时剂型将会以取决于制剂的限定方式释放药物。该过程被称为溶解,可以用作体内释放机制的体外标记。以常规间隔进行取样并且通过分光光度计或hplc分析样品中的药物的量。数据通常表示为标记的含量相对于时间的释放。拉伸测试使用2mm模具在定制热压机上制备每种聚合物的膜。在热压机上设定的温度根据聚合物组成而变化以确保线性熔化并且得到适合的膜。将2mm聚合物膜从它们的模具中移除并且用ray-ran手动操作的切割压机冲压以制造如在iso标准(国际标准化组织)37:2005(e)概述的2型尺寸的狗骨骼形或圆柱形长条样品。使用instron3343力学测试仪并且针对在200mm/分钟速率下的破坏测试样品并且记录应力-应变曲线。用于这种试验的测压元件的限度(capacity)是1000n。还在干燥、水合、空白和加载有药物的状态下对所形成的环进行拉伸测试。动态力学分析(dma)使用动态力学分析仪记录储存模量和损耗模量(分别为g’和g”)和作为温度的函数的损耗正切(g’/g”)。将样品冷却至玻璃化转变温度以下,之后以2℃/分钟的速率加热。根据以上在“拉伸测试”下概述的方法制备样品(1mm)。凝胶渗透色谱(gpc)通过凝胶渗透色谱(gpc)进行聚合物的分子量分析(mw、mn和多分散度指数(pdi))。将每个样品溶解在四氢呋喃(thf)中。在操作样品之前至少24小时将体系洗脱液转化为thf。使用聚苯乙烯窄和宽标准品校准设备并且在使用之前在该设备中设置用2xplgelmixed-c、5μm、300x7.5mm柱(包括保护柱)。以1ml分钟-1的流量操作样品。喹高利特的释放为了提供用于递送喹高利特的聚氨酯嵌段共聚物的适用性的初期分析,用喹高利特加载多种聚合物并且评估它们的释放曲线。通过在间歇混合机中将喹高利特和粒化的聚氨酯嵌段共聚物混合来制备示例性的加载有药物的聚氨酯嵌段共聚物。将所得的1.0%w/w加载有药物的聚合物加工为样品嵌段(4x4mm)并且进行溶解测试。结果在表9和图2中示出。表9:在28天时间期间喹高利特从多种加载有药物的聚合物组合物(1.0%w/w、4x4mm嵌段)中的释放。商(24h释放/7-14天释放)提供了相对于稳态释放的活性剂的“爆发释放”的测量。在表9中,商已经通过在初期24小时时间段中释放的药物的百分比除以在7至14天之间释放的药物的百分比(代表1个月产品的稳态)来计算。聚合物rlst0072和rlst0044提供较低的商值,表明这样的聚合物将会适用于具有最小爆发释放的释放曲线。其他聚合物rlst0027、rlst0047、rlst1015和rlst0098提供较高的商值并且因此当需要喹高利特递送的较高初期速率时将会是可用的。还在图3中示出了喹高利特从聚合物rlst0183和rlst0157中的释放。作为结果,开发了聚合物批次rlst0154并且将其释放曲线与rlst0072的释放曲线进行比较。在间歇混合机中将两种聚合物与喹高利特混合以制备0.5%w/w加载有药物的聚合物,并且加工为嵌段并且测试溶解(如在表10和图4中所示)。表10:在28天时间期间喹高利特从两种加载有药物的聚合物(0.5%w/w、4x4mm嵌段)中的释放。结果表明,当与聚合物rlst0072相比时,聚合物rlst0154提供了相比较而言稍微降低的爆发释放(较低商值)和相似的释放曲线。在聚合物中的活性剂的剂量还对与药剂从聚合物中的稳态释放相比的相对爆发释放具有影响。当加载有1.0%w/w和0.5%w/w的喹高利特时,这在针对聚合物rlst0072观察到的不同商值中例示(分别0.9和3.5)。为了开发提供比rlst0154和rlst0072慢的释放速率的聚合物,通过调节用于制备聚合物rlst0154的起始聚合物组成而制造大量聚合物。评估针对rlst0072和rlst0154的这些新聚合物批次的相对性能并且结果在表11和图5中给出。1,2通过反应性挤出过程制造。3对于qu12023、024&025,在7天之后停止溶解。因此,最后一栏示出了在24小时释放与7天释放的商。表11:喹高利特从与rlst0072和rlst0154相比另外的加载有药物的聚合物中的释放,包括剂型和加载细节。绵羊研究试验用喹高利特加载聚合物批次并且将其制造为用于绵羊研究的环。表12提供了所制造的聚氨酯嵌段共聚物的详情并且表13提供了力学性能的详情。应该指出的是,使用热熔挤出将药物与聚合物混合并且因此将喹高利特与avicel干燥共混以使得将药物分配至挤出机中的粉末进料器能够满足以良好含量均匀性为目标的低剂量。使用热密封过程将热熔挤出材料制造为环。表12:用于第一绵羊研究的聚合物批次。表13:在第一绵羊研究中使用的干燥共混物制剂详情和制剂的力学性能。在图6中示出了qh12019、qh12020和qh12022的溶解曲线。将阴道环放置在绵羊中并且在28天时间期间监测体内释放的喹高利特的量。该第一绵羊研究的结果在下表14中示出并且在图7中图示。批号剂量(mcg)释放的喹高利特(mcg)28天期间的平均每日释放量(mcg)qh1202020001065.538.1qh1202231001461.652.2表14:在第一绵羊研究中在28天时间期间的喹高利特体内释放量。出于比较的目的,还在图7上示出了喹高利特从qh12020和qh12022中的体外释放。使用基于rlst0157的聚合物批次进行在绵羊中的第二研究。已经显示该聚合物具有比rlst0072慢的释放曲线。下表15和16示出了制剂详情和所测试的聚合物的力学数据。表15:用于第二绵羊研究的聚合物批次。表16:在第二绵羊研究中使用的干燥共混物制剂详情和制剂的力学性能。将阴道环放置在绵羊中并且在28天时间期间监测体内释放的喹高利特的量。该绵羊研究的结果在下表17中示出并且在图8中图示。表17:在第二绵羊研究中在28天时间期间的喹高利特体内释放量。出于比较的目的,还在图8上示出了喹高利特从qh13005和qh13006中的体外释放。如在第一和第二绵羊研究中发现的喹高利特盐酸盐从批次qh12020、qh12022、qh13005和qh13006中的释放的平均每日速率在图9中进一步图示(关于喹高利特剂量,参见表14和17)。在第一和第二绵羊试验期间,在28天时间期间监测喹高利特(q)的血浆浓度。还在绵羊中监测活性代谢物(m1和m2:参见图13)的血浆浓度。结果在图10中图示(关于喹高利特剂量,参见表14和17)。发现在28天时间期间使用由批次qh12022、qh12020和qh13006制成的阴道环提供基本上恒定的血浆中的喹高利特水平。此外,在研究期间的任何点,血浆中的喹高利特浓度都不超过50pg/ml。活性代谢物m1和m2的水平在血浆中以比喹高利特低大约10倍的摩尔浓度存在。在绵羊中进行进一步研究以确定具有目标为递送5、10和15μg/天的喹高利特加载量的聚合物环在35天时间期间的体内释放。下表18显示实现了与目标几乎相同的实际释放速率并且已经减少了在第一天的初期释放。表18:在绵羊中的阴道环的体内释放曲线。通过与表18中所示的数据进行比较的方式,表19(以下)示出了在临床研究000155(安慰剂对照的、双盲、平行、随机研究)中的阴道环的体内释放曲线。在本研究中,在以下持续时间内,施用具有5、10和15μg/天的预期释放速率的400、800、和1200μg三种剂量强度的喹高利特和安慰剂阴道环:7天:12名受试者(活性)14天:12名受试者(活性)28天:32名受试者(24活性+8安慰剂)35天:12名受试者(活性);68名健康女性,18-40岁,具有18-30kg/m2的bmi,具有常规月经周期)。表19储层型药物装置单元使用喹高利特hcl与avicel赋形剂共混物制造药物浓度为3.5%的储层型喹高利特阴道环,与作为核心的rlst072混合并且与在核心周围的作为套或帽的rlst072或rlst0047或rlst0046(其不含喹高利特hcl)共挤出,以形成共挤出管,将所述共挤出管切成长条并且形成为环。储层型环的溶解数据在图11和下表20中示出。表20:储层型环的组成和释放详情。观察到这些储层型阴道环能够提供具有很少或没有爆发释放的基本上零级的释放和低稳态释放。储层型环的%24小时释放除以7至14天之间的%药物释放的商均是极低的(0.09至0.35)。^中值注释:括号外的数字表示平均值;括号内的数字表示标准差。表21:在临床研究000155中通过阴道环施用的喹高利特的pk变量的总结。在阴道内施用之后,喹高利特的血浆浓度增加,在大约37-39小时时达到最大,并且随后缓慢下降直到将环移除(参见图15)。在全部三个剂量组之间,达到最大血清浓度的平均时间是相似的,但是具有大幅的个体间差异。c最大随着剂量增加而增加,而在全部三种剂量中平均终端半衰期估值是适当相同的(表21:以上)。力学性能的调节进一步开发工作集中于聚合物的力学性能的调节。已经发现,rlst0157(具有大约52mpa的杨氏模量)提供相对坚硬的环聚合物药物装置。令人感兴趣的是开发具有降低的刚性的另外的组合物,而降低的刚性可以被证实对最终用户来说更舒适的。下表22提供了所制造的另外的聚合物的详情。1硬链段含量是二醇和二异氰酸酯组分的组合重量%。表22:力学性能的研究过程中制备的聚合物测试这些聚合物的力学性能并且如在下表23中所示将结果与rlst0157进行比较。表23:多种聚合物的力学性能。如可以从上表中看到的,所有测试的聚合物都展现出比rlst0157低的弹性模量值。基于力学数据,选择rlst0210用于进一步研究,作为用于临床试验制造的主导聚合物(leadpolymer)。动态力学分析以张力模式进行样品的动态热力学分析(表24)。聚合物批次硬链段含量(%)tg(℃)tm1(℃)rlst020846-4121rlst021349-4328rlst021050-4326rlst021251-4132rlst021152-4233rlst015757-4040表24.通过dma确定的实例聚合物的热转变在所有实例聚合物中观察到玻璃化转变(tg)和低熔点(tm1、tm2)。聚合物都显示出与非晶软链段相对应的大约-40℃的tg。随着硬链段的量的增加,观察到tm1的逐渐增加。观察到聚合物rlst0208的熔化峰特别宽(46%硬链段)。聚氨酯嵌段共聚物很少完全相分离,反而经历液-液反混合(demixing)。除了将熔化峰归因于遥爪(telechelic)二醇的晶体链段和含有氨基甲酸酯的链段(硬链段)之外,这种现象可能会使得难以清楚地确定熔化峰。凝胶渗透色谱(gpc)分析通过gpc进行实例聚合物的分子量分析(参见表25)。表25:通过gpc确定的分子量不存在实例聚合物的多分散度指数(pdi)的明显差异,并且观察到的差异在预期的20%误差容限范围内。由于样品的量不足,不进行弹性体rlst0212-001的gpc。湿粒化制剂为了提高直链聚合物中喹高利特的含量均匀性并且有助于初期爆发释放期间的进一步控制,开发了湿粒化制剂(使用rlst0210作为基础聚合物)。该制剂使用与药物结合并且阻止其释放的赋形剂。首先,测试不同的粘合剂如玉米素、pvpk10和乙基纤维素的适用性。由于它们的水溶性,舍弃玉米素和pvpk10。然而,发现乙基纤维素系湿粒化制剂在使爆发释放最小化方面有效。测试不同的乙基纤维素浓度并且选择7%w/w的优化水平用于以后的批次。尽管湿粒化明显提高含量均匀性,但是发现由于粉末中的静电荷,从这些制剂中的粉末流动是不规则的。为了纠正该问题,以1.5%w/w结合气相法二氧化硅(商品名称)。这提高了流动性以及最终产品的含量均匀性。所测试的全部rlst0210开发批次的制剂详情和力学数据在下表26中示出并且可以在表27中找到它们的释放性能。发现聚合物和喹高利特湿粒化制剂的组合使这些制剂的%24小时释放除以7至14天之间的%药物释放的商明显降低(0.24-0.33)。*在所有批次中,使用ipa作为在制造过程期间蒸发的造粒溶剂。表26:rlst0210开发批次的制剂详情和力学数据。表27:在表24中描述的多种rlst02010制剂的释放数据。为了提供在体内的环的力学性能的指征,还在水合48小时的时间之后评估批次qh13067r、qh13068r和qh13069r。结果在下表28中示出。表28:48小时水合之后的力学性能。观察到在水合之后rlst0210的弹性模量降低至大约13-16mpa。因此,在水合之后,该聚合物具有可与可商购获得的产品的弹性模量相比的弹性模量。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1