一种紫杉醇药物组合物及其药物制剂、制备方法和用途与流程
本发明涉及一种紫杉醇药物组合物及其药物制剂、制备方法和用途,具体涉及一种包含活性成分紫杉醇的药物组合物以及包含所述药物组合物的药物制剂、制备方法和用途。
背景技术:
紫杉醇(paclitaxel,ptx)是从红豆杉属植物中提取的天然生物碱,其化学名称为5β,20-环氧-1,2α,4,7β,10β,13α-六羟基紫杉烷-11-烯-9-酮-4,10-二乙酸酯-2-苯甲酸酯-13[(2’r,3’s)-n-苯甲酰-3-苯基异丝氨酸酯],结构式如下:
紫杉醇是一种新型的抗微管药物,通过促进微管蛋白聚合抑制解聚,保持微管蛋白稳定,抑制细胞有丝分裂。体外实验证明紫杉醇具有显著的放射增敏作用,可使细胞中止于对放疗敏感的g2和m期。由于紫杉醇具有稳定细胞微管的独特作用机理,而且治疗效果好、广谱性强、副作用小,因而被国际上公认为是首选的抗癌药物。目前,紫杉醇被广泛用于多种恶性肿瘤,例如卵巢癌、子宫颈癌、乳腺癌、肺癌、喉癌和食道癌等的治疗。
当前临床上最常用的紫杉醇注射液主要有例如bristol-myerssquibb公司的
因此仅有少量紫杉醇制剂被批准用于临床,例如
然而,研制适用于口服固体制剂的紫杉醇药物组合物迄今仍受制于紫杉醇的低水溶性而进展缓慢。由于紫杉醇的pka为11.99,其在水中的溶解度低于约10μg/ml(据报道为0.1~<10μg/ml),而且紫杉醇结构中缺少功能性成盐基团,使得其无法通过制备成盐来改善溶解度。此外,由于胃肠道粘膜细胞中运转外排蛋白p-glycoprotein(p-gp)的外排作用,使得吸收入血中的紫杉醇的量减少,导致紫杉醇的口服生物利用度进一步降低(约为2%)。
因此,目前亟需开发一种新型的紫杉醇药物组合物及其口服固体制剂。
技术实现要素:
本发明一方面提供一种紫杉醇药物组合物,其包含活性成分紫杉醇和载体材料羟丙基甲基纤维素衍生物。
另一方面,本发明还提供一种药物制剂,其包含本发明的紫杉醇药物组合物以及药学上可接受的辅料。所述药物制剂为口服固体制剂形式,例如散剂、颗粒剂、丸剂、胶囊剂或片剂的形式。
第三方面,本发明还提供所述紫杉醇药物组合物及其药物制剂的制备 方法,例如包括但不限于热熔挤出法和喷雾干燥法。
最后,本发明还提供所述紫杉醇药物组合物及其药物制剂在制备用于预防和治疗恶性肿瘤和相关疾病的药物中的用途。
附图说明
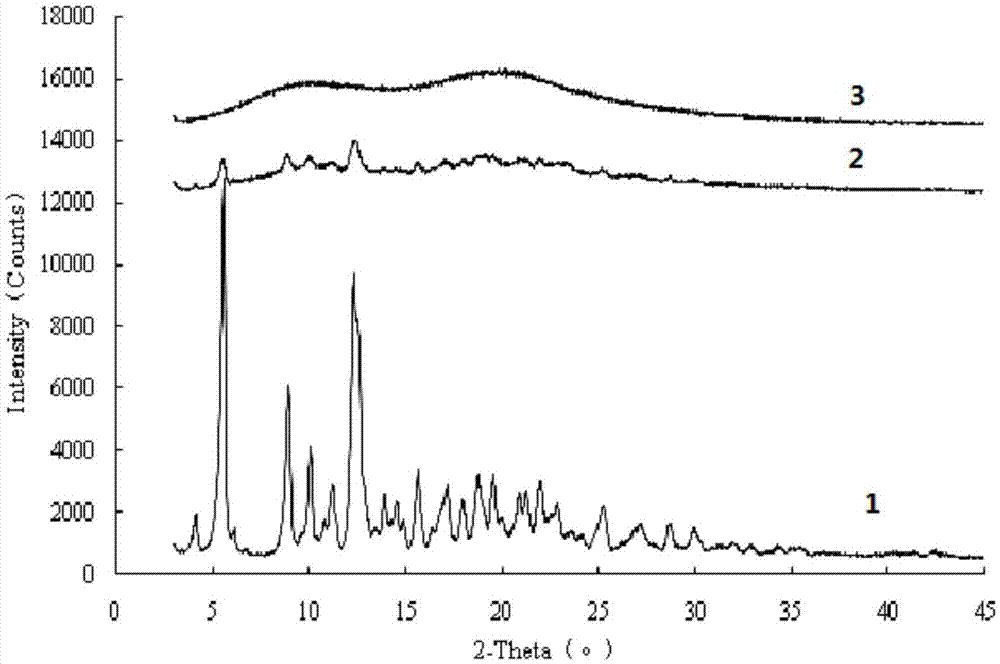
图1为各产品的x-rd图谱,其中1为原料药紫杉醇,2为紫杉醇-pvpk30-tpgs的物理混合物,3为对比组合物1-1。
图2为各产品的x-rd图谱,其中1为原料药紫杉醇,2为紫杉醇-hpmcas-tpgs的物理混合物,3为本发明的药物组合物2-4。
具体实施方式
以下将对本发明进一步详细说明,应理解,所述用语旨在描述目的,而非限制本发明。
定义
除非另有说明,本文使用的所有技术和科学术语具有与本发明所属领域技术人员通常所理解的相同的含义。若存在矛盾,则以本申请提供的定义为准。当以范围、优选范围、或者优选的数值上限以及优选的数值下限的形式表述某个量、浓度或其他值或参数的时候,应当理解相当于具体揭示了通过将任意一对范围上限或优选数值与任意范围下限或优选数值结合起来的任何范围,而不考虑该范围是否具体揭示。除非另有说明,本文所列出的数值范围旨在包括范围的端点和该范围内的所有整数和分数(小数)。
术语“约”、“大约”当与数值变量并用时,通常指该变量的数值和该变量的所有数值在实验误差内(例如对于平均值95%的置信区间内)或在指定数值的±10%内,或更宽范围内。
术语“计量比”是将各种物质按一定的重量进行配比。例如在本发明中,将活性成分紫杉醇与载体材料羟丙基甲基纤维素衍生物、任选存在的聚乙二醇1000维生素e琥珀酸酯(tpgs)按照指定的重量比进行配比。
术语“药学上可接受的”是指在正常的医学判断范围内与患者的组织接触而不会有不适当毒性、刺激性、过敏反应等,具有合理的利弊比且能有效用于目的用途。
术语“无定形状态分散”是指药物基本上以无定形形式分散于载体材料中,形成单一成相的物质。例如药物可完全以无定形状态存在,即在粉末x-衍射检测中不存在明显的晶体衍射特征峰。在本发明中,该术语是指活性成分紫杉醇以无定形形式完全分散于载体材料羟丙基甲基纤维素衍生物中,形成单一成相的药物组合物(固体分散体或固体溶液)。
术语“溶解在”、“无定形状态分散”、“固体分散体”、“固体溶液”在本发明中涵盖了任何和所有这些形态,这些术语在本文中视方便使用以描述在制备的各阶段和各种温度下的本发明的药物组合物。
术语“药物制剂”、“药剂产品”、“药物剂型”、“剂型”等指被施予需要治疗的患者的药品,其可以为固体或液体等形式,例如散剂、颗粒剂、丸剂、胶囊剂、片剂、溶液剂或混悬剂、贴剂等。
术语“药物组合物”是指包含活性成分紫杉醇、载体材料羟丙基甲基纤维素衍生物以及任选存在的tpgs的固体分散体形式的载药组合物。
术语“空白组合物”是指相对于相应的药物组合物,不含活性成分(即紫杉醇),但包含其它组分的固体分散体形式的组合物。
术语“物理混合物”是指将活性成分紫杉醇和载体材料羟丙基甲基纤维素衍生物以及任选存在的tpgs仅通过物理混合而制成的混合物。
药物组合物及其药物制剂和制备
本发明涉及一种紫杉醇药物组合物,其包含活性成分紫杉醇和载体材料羟丙基甲基纤维素衍生物。
在本发明的一个实施方案中,载体材料羟丙基甲基纤维素衍生物选自醋酸羟丙基甲基纤维素琥珀酸酯(hpmcas)、羟丙基甲基纤维素邻苯二甲酸酯(hpmcp)、羟丙基甲基纤维素丁二酸酯(hpmcs)、羟丙基甲基纤维素偏苯三甲酸酯(hpmct)、羟丙基甲基纤维素醋酸邻苯二甲酸酯(hpmcap)以及醋酸羟丙基甲基纤维素马来酸酯(hpmcam)中的一种或多种。
在本发明的一个优选的实施方案中,载体材料羟丙基甲基纤维素衍生物选自hpmcas、hpmct和hpmcam中的一种或多种。在本发明的一个更优选的实施方案中,载体材料羟丙基甲基纤维素衍生物选自hpmcas。
在本发明的一个优选的实施方案中,载体材料羟丙基甲基纤维素衍生 物选自具有以下乙酰基含量和琥珀酰基含量的hpmcas中的至少一种:
(i)基于hpmcas的总重量,具有5-9重量%的平均乙酰基含量和14-18重量%的平均琥珀酰基含量的hpmcas;
(ii)基于hpmcas的总重量,具有7-11重量%的平均乙酰基含量和10-14重量%的平均琥珀酰基含量的hpmcas;
(iii)基于hpmcas的总重量,具有10-14重量%的平均乙酰基含量和4-8重量%的平均琥珀酰基含量的hpmcas。
在本发明的一个特别优选的实施方案中,载体材料羟丙基甲基纤维素衍生物选自具有7-11重量%的平均乙酰基含量和10-14重量%的平均琥珀酰基含量的hpmcas,基于hpmcas的总重量。
更具体地,在本发明的一个非常特别优选的实施方案中,载体材料羟丙基甲基纤维素衍生物可选自例如shin-etsu公司的市售产品
在本发明的一个非常特别优选的实施方案中,载体材料羟丙基甲基纤维素衍生物选自
在本发明的一个实施方案中,活性成分紫杉醇与载体材料羟丙基甲基纤维素衍生物的重量比为约1:1-约1:10,优选为约1:1-约1:5,更优选为约1:1-1:3,例如包括但不限于1:1、1:2、1:3、1:4、1:5、1:6、1:7、1:8、1:9、1:10等。
此外,在本发明的另一个实施方案中,紫杉醇药物组合物还可进一步包含聚乙二醇1000维生素e琥珀酸酯(d-α-tocopherolpolyethyleneglycol1000succinate,又称作tpgs、vitaminetpgs或tocophersolan)。tpgs是维生素e的水溶性衍生物,其由维生素e琥珀酸酯(ves)与聚乙二醇(peg)1000酯化而成,相对分子量为约1513,已载入美国药典。tpgs在本发明的药物组合物中作为增溶剂起到增溶作用,并且可以进一步通过影响药物的外排来提高口服生物利用度。
在本发明的另一个实施方案中,tpgs例如可以是购自basf公司的市售产品
在本发明的另一个实施方案中,tpgs是
在本发明的紫杉醇药物组合物中,所使用的tpgs的量没有特殊限制,可以根据实际情况进行调整。通常,tpgs以基于活性成分紫杉醇和载体材料羟丙基甲基纤维素衍生物的总重量的约1-20重量%的量存在,优选5-15重量%,更优选5-10重量%,甚至更优选10-15重量%,例如包括但不限于5重量%、8重量%、10重量%、12重量%、15重量%、20重量%等。
此外,本发明还涉及一种药物制剂,其包含本发明的紫杉醇药物组合物。
在本发明的又一个实施方案中,除了以上所述的药物组合物之外,本发明的紫杉醇药物制剂还可额外包含药学上可接受的辅料。
在本发明的又一个实施方案中,药学上可接受的辅料包括但不限于表面活性剂、ph调节剂、稀释剂、崩解剂、粘合剂、润滑剂中的一种或多种。
在本发明的又一个实施方案中,表面活性剂可以是阴离子型、阳离子型、两性离子或非离子型的表面活性剂或它们的混合物。在本发明的又一个优选的实施方案中,表面活性剂为两性离子或非离子型的表面活性剂或它们的混合物。在本发明的又一个更优选的实施方案中,表面活性剂是两种或更多种表面活性剂的混合物。
表面活性剂的选择可根据本发明的药物制剂的具体组份及组成而变化。
在本发明的又一个优选的实施方案中,适合用于本发明的表面活性剂可选自以下物质中的一种或多种:
--聚氧乙烯蓖麻油衍生物,例如聚氧乙烯甘油三蓖麻醇酸酯、聚氧乙烯醚35蓖麻油(cremophorel,basf)。
--聚氧乙烯甘油基硬脂酸酯。
--聚乙二醇蓖麻油衍生物,例如聚乙二醇40氢化蓖麻油(cremophorrh40)或聚乙二醇60氢化蓖麻油(cremophorrh60)。
--环氧乙烷和环氧丙烷的嵌段共聚物,又称作聚氧乙烯聚氧丙烯嵌段共聚物或聚氧乙烯聚丙二醇,例如poloxamer124、poloxamer188、poloxamer237、poloxamer388或poloxamer407(basf)。
--聚氧乙烯(20)失水山梨醇的单脂肪酸酯,例如聚氧乙烯(20)失水山梨 醇单油酸酯(tween80)、聚氧乙烯(20)失水山梨醇单硬脂酸酯(tween60)、聚氧乙烯(20)失水山梨醇单棕榈酸酯(tween40)、聚氧乙烯(20)失水山梨醇单月桂酸酯(tween20)。
--聚乙二醇脂肪酸酯,例如peg-200单月桂酸酯、peg-200双月桂酸酯、peg-300双月桂酸酯、peg-400双月桂酸酯、peg-300双硬脂酸酯或pet-300二油酸酯。
--亚烷基二醇脂肪酸单酯,例如丙二醇单月桂酸酯。
--失水山梨醇脂肪酸单酯,例如失水山梨醇单月桂酸酯(span20)、失水山梨醇单油酸酯、失水山梨醇单棕榈酸酯(span40)或失水山梨醇硬脂酸酯。
在本发明的又一个优选的实施方案中,适合用于本发明的表面活性剂为聚氧乙烯蓖麻油衍生物、环氧乙烷和环氧丙烷的嵌段共聚物中的一种或多种,特别优选cremophorrh40和/或poloxamer188。
在本发明的又一个实施方案中,适合用于本发明的ph调节剂可选自柠檬酸、乙酸、反丁烯二酸、顺丁烯二酸、酒石酸、苹果酸、琥珀酸、草酸、丙二酸、苯甲酸、苦杏仁酸和抗坏血酸中的一种或多种,优选柠檬酸。
在本发明的又一个实施方案中,适合用于本发明的稀释剂可选自微晶纤维素、淀粉、预胶化淀粉、乳糖、甘露醇、磷酸氢钙中的一种或多种。
在本发明的又一个实施方案中,适合用于本发明的崩解剂可选自羧甲基纤维素、羧甲基纤维素钠、交联羧甲基纤维素钠、羧甲基纤维素钙、羧甲基淀粉钠、交联聚乙烯基吡咯烷酮(即交联聚维酮)、低取代羟丙纤维素(l-hpc)、羟甲基淀粉中的一种或多种。
在本发明的又一个实施方案中,适合用于本发明的粘合剂可选自羧甲基纤维素钠、羟丙基纤维素、甲基纤维素、乙基纤维素或羟丙甲纤维素中的一种或多种。
在本发明的又一个实施方案中,适合用于本发明的润滑剂可选自硬脂酸镁、二氧化硅、滑石粉、硬脂酸、氢化植物油中的一种或多种。
应当说明的是,上述所列举的药学上可接受的辅料只是阐述性和代表性的。因此,本发明的药物制剂并不限于本文以上所列举的药学上可接受的辅料。本领域技术人员可根据常规技术对上述辅料进行各种改变、调整 或等同替换,均未超出本发明的保护范围。
在本发明的一个实施方案中,所述药物制剂是口服固体制剂。例如散剂、颗粒剂、丸剂、胶囊剂或片剂的形式。
本发明还涉及一种制备所述紫杉醇药物组合物的方法,其包括但不限于热熔挤出法和喷雾干燥法。
在本发明的一个实施方案中,采用热熔挤出法来制备紫杉醇药物组合物,所述方法包括以下步骤:
将按照计量比的活性成分紫杉醇、载体材料羟丙基甲基纤维素衍生物以及任选存在的tpgs进料到预热至约120℃-约180℃的热熔挤出机中;
以及
将挤出后的混合物冷却,粉碎并过筛,即得到本发明的紫杉醇药物组合物。
在本发明的另一个实施方案中,采用热熔挤出法来制备紫杉醇药物组合物,但是对于进料顺序没有特别限制,只要能够获得本发明的目标产品即可。
在本发明的一个优选的实施方案中,采用热熔挤出法来制备紫杉醇药物组合物,其中在进料之前,将紫杉醇、载体材料羟丙基甲基纤维素衍生物以及任选存在的tpgs按照计量比混合;或者直接进料上述成分而无需事先混合。
在本发明的另一个实施方案中,对于冷却方式没有特别限制,其可包括风冷、水冷、机械冷却等。
适用于本发明方法的挤出机的类型也没有特别限制,其包括但不限于单螺杆或双螺杆型热熔挤出机。
在本发明的一个实施方案中,使用双螺杆型挤出机来制备紫杉醇药物组合物。在该情况下,对于螺杆转动的类型没有特别限制,其包括但不限于同向双螺杆、异向双螺杆和双锥型螺杆转动模式。
在本发明的一个优选的实施方案中,使用同向双螺杆型挤出机来制备本发明的紫杉醇药物组合物。
在本发明的一个优选的实施方案中,热熔挤出机设定的熔融温度为约120℃-约190℃,优选120℃-180℃,优选120℃-170℃,更优选120℃-160℃, 甚至更优选120-150℃,最优选140℃,例如包括但不限于120℃、130℃、140℃、150℃、160℃、170℃和180℃等。
在本发明的另一个优选的实施方案中,螺杆转速为约50-约500rpm,优选100-500rpm,更优选150-500rpm,甚至更优选150-200rpm,最优选150rpm,例如包括但不限于50rpm、100rpm、150rpm、200rpm、250rpm、300rpm、350rpm、400rpm、450rpm、500rpm等。
在本发明的另一个优选的实施方案中,螺杆长度和直径的比例(l/d)为约15-约40,优选约15-约35,更优选约15-约30,甚至更优选约15-约25,最优选约20-约30,最优选约25,例如包括但不限于15、18、20、25、30、35、40等。
如果熔融温度过低,l/d过短,螺杆转速过慢,则热熔过程中热能和机械能提供不足,进而导致紫杉醇、载体材料羟丙基甲基纤维素衍生物、任选存在的tpgs无法形成熔融态,从而使紫杉醇不能均匀分散于熔融的载体材料羟丙基甲基纤维素衍生物中。因为虽然紫杉醇与载体材料羟丙基甲基纤维素衍生物充分混合,但由于熔融温度过低,不能得到以无定形状态完全分散的、单一成相的固体分散体(固体溶液)。
然而,如果熔融温度过高、l/d过长、螺杆转速过快,则热熔过程中热能和机械能提供过量,即使得到的是以无定形状态完全分散的、单一成相的固体分散体,也会造成紫杉醇、载体材料羟丙基甲基纤维素衍生物以及任选存在的tpgs的不必要的降解。
因此,选择适合用于本发明方法的热熔挤出机的熔融温度、螺杆转速、螺杆长度和直径的比例是非常必要的。
试验表明,在根据本发明方法制得的紫杉醇药物组合物中,紫杉醇是以无定形状态完全分散于或溶解在载体材料羟丙基甲基纤维素衍生物中的。
根据需要,可将本发明的紫杉醇药物组合物与药学上可接受的辅料混合,通过特定设备制成各种不同类型的口服固体制剂,例如使用单冲压片机(上海天凡药机制造厂dp-5型)进行压片,制成片剂。或者还可以使用其它设备将其制成散剂、颗粒剂、丸剂或胶囊剂的形式,以方便临床应用。
本发明还涉及紫杉醇药物组合物及其药物制剂在制备用于预防和治疗 恶性肿瘤和相关疾病的药物中的用途。
有益效果
与现有技术相比较,本发明的药物组合物及其药物制剂的制备工艺简单、易操作,特别是热融挤出工艺,容易研磨,具有较好的可压性,重现性好,可大规模生产;并且试验表明,采用该方法获得的药物组合物中,紫杉醇是以无定形状态完全分散于载体材料羟丙基甲基纤维素衍生物中的。
本发明人还出人意料地发现,相对于原料药紫杉醇以及相应的对比例1的组合物,本发明的包含活性成分紫杉醇和载体材料羟丙基甲基纤维素衍生物的药物组合物的溶解度和体外溶出度明显提高;当进一步加入tpgs时,所得到的药物组合物的溶解度和体外溶出度更加增强。说明载体材料hpmcas和tpgs对药物组合物具有协同增溶作用。
实施例
以下将通过具体实施例来进一步描述本发明的技术方案。应注意,所述实施例仅为示例性,而非对本发明保护范围的限制。本发明还可有其他实施方案,或能够以多种方式实践或进行。
除非另有说明,本文中所有的百分比、份数、比值等均是按重量计。
紫杉醇药物组合物的物理化学性质的评价测定方法
粉末x-衍射(x-rd):分别取适量的紫杉醇原料药、物理混合物,和对比组合物或本发明的药物组合物,在cu靶、45kv电压、45ma电流的条件下,记录它们的粉末x衍射图谱(bruker制造的d8advance型x-射线衍射仪)。
表观溶解度测定:称取过量的药物组合物放入容器中,分别加入约相当于容器体积2/3的ph6.8磷酸盐缓冲液后,将其置于37℃的摇床中震荡3h,将所得溶液用0.45μm滤膜过滤后,收集滤液,用适量的甲醇进一步稀释,并经过涡旋混合后经hplc分析。
其中,hplc分析参数如下:
溶出度测定:
其中ph6.8表示模拟人体肠道(小肠)的环境。
溶出样品分析:将溶出度测定试验中获得的溶液用0.45μm滤膜过滤后收集滤液,用适量的甲醇进一步稀释,并经过涡旋混合后hplc进样分析。溶出样品的hplc分析方法与上述溶解度测定hplc分析方法相同。
对比例1紫杉醇-pvpk30药物组合物(非本发明)
1、制备
1)组成:
紫杉醇-pvpk30药物组合物/物理混合物的具体组成如表1-1所示。
2)制备:
紫杉醇-pvpk30药物组合物:按照表1-1中的具体组成和用量,将紫杉醇和载体材料pvpk30(购自basf,商品名kollidon
紫杉醇-pvpk30物理混合物:按照表1-1中的具体组成和用量,将活性成分紫杉醇和载体材料pvpk30(购自basf,商品名kollidon
根据需要,将上述获得药物组合物/物理混合物与表1-2中的药用辅料混合均匀并进行制剂,即获得相应的药物制剂。
表1-1紫杉醇-pvpk30药物组合物/物理混合物的具体组成(重量份)
表1-2紫杉醇-pvpk30药物组合物/物理混合物的辅料(重量份)
2、物理化学性质评价
1)粉末x-衍射(x-rd)测试:
x射线粉末衍射(x-rd)用于进一步确认活性成分紫杉醇在原料药/药物组合物/物理混合物中的分散状态/晶体结构。
从图1可以看出,紫杉醇原料药存在明显的晶体衍射特征峰;包含紫杉醇、载体材料pvpk30和tpgs的物理混合物中也存在部分紫杉醇的晶体衍射特征峰,说明该物理混合物中有部分紫杉醇是以晶体状态存在的;而在包含紫杉醇、载体材料pvpk30和tpgs的药物组合物(即对比组合物1-1)中,紫杉醇的结晶特征峰消失,说明紫杉醇是以无定形状态完全分散于该药物 组合物中的。
试验还表明,仅包含紫杉醇和载体材料pvpk30的物理混合物中仍然存在部分晶体衍射特征峰,说明该物理混合物中有部分紫杉醇是以晶体状态存在;而包含紫杉醇和载体材料pvpk30的药物组合物(即对比组合物1-2)的紫杉醇晶体特征峰消失,说明在该组合物中紫杉醇是以无定形状态完全分散于药物组合物中的。
2)表观溶解度测定
根据上述方法,测定原料药紫杉醇和对比组合物1-1、1-2的表观溶解度。结果参看下表1-3。
表1-3在ph6.8磷酸盐缓冲液中的表观溶解度
由表1-3可以看出,与原料药紫杉醇相比较,包含紫杉醇和载体材料pvpk30的药物组合物(即对比组合物1-2)的溶解度有一定程度提高,当进一步加入
3)溶出度测定
根据上述方法,测定原料药紫杉醇和对比组合物1-1、1-2的溶出度。结果参看下表1-4。
表1-4在ph6.8的介质转换中的溶出度
由表1-4可以看出,原料药在ph6.8条件下的溶出度非常低,60min时仅为14.8%,而包含紫杉醇和pvpk30的药物组合物(即对比组合物1-2)在60min时的溶出度提高至33.6%。进一步加入
实施例1紫杉醇-hpmcas药物组合物/物理混合物(本发明)
1、制备
1)组成:
紫杉醇-hpmcas药物组合物/物理混合物的具体组成如表2-1所示。
2)制备:
紫杉醇-hpmcas药物组合物:按照表2-1中的具体组成和用量,将紫杉醇和载体材料hpmcas(具体为
物理混合物:将活性成分紫杉醇和载体材料pvpk30以及任选存在的
根据需要,将上述获得的药物组合物与表2-2的药用辅料混合均匀,即制得相应的药物制剂。例如可以使用单冲压片机(上海天凡药机制造厂dp-5型)进行压片,制成片剂。或者还可以使用其它设备将其制成散剂、颗粒剂、丸剂或胶囊剂的形式。
表2-1本发明的紫杉醇-hpmcas药物组合物的组成(重量份)
表2-2本发明的紫杉醇-hpmcas药物组合物的药用辅料(重量份)
2、物理化学性质评价
1)粉末x-衍射(x-rd)测试:
x射线粉末衍射(xrd)用于进一步确认活性成分紫杉醇在原料药/药物组合物/物理混合物中的分散状态/晶体结构。
从图2可以看出,紫杉醇原料药存在明显的晶体衍射特征峰;包含紫杉醇和载体材料hpmcas的物理混合物中也仍然存在部分晶体衍射特征峰,说明该物理混合物中有部分紫杉醇是以晶体状态存在;然而在本发明的药物组合物(例如组合物2-4)中,紫杉醇的结晶特征峰消失,说明紫杉醇是以无定形状态完全分散于药物组合物中的。
试验还表明,仅包含紫杉醇和载体材料hpmcas的物理混合物中也存在部分晶体衍射峰,说明该物理混合物中有部分紫杉醇是以晶体状态存在;而包含紫杉醇和载体材料hpmcas的药物组合物(例如组合物2-2、2-3)中,紫杉醇晶体特征峰消失,说明紫杉醇是以无定形状态完全分散于该药物组合物中的。
2)表观溶解度测定
根据上述方法,测定各组合物的表观溶解度。结果参看下表2-3。
表2-3在ph6.8磷酸盐缓冲液中的表观溶解度
由表2-3可以看出,与原料药紫杉醇和对比例1相比较,包含紫杉醇和载体材料hpmcas的本发明的药物组合物(例如组合物2-2)的溶解度明显提高,说明载体材料hpmcas对紫杉醇具有增溶作用,可以明显提高原料药紫杉醇的溶解性和溶出度,当进一步加入
3)溶出度测定
根据上述方法,测定各组合物的溶出度。结果参看下表2-4。
表2-4在ph6.8的介质转换中的溶出度
由表2-4可以看出,原料药紫杉醇在ph6.8条件下的溶出度非常低,60min时仅为14.8%,本发明的药物组合物2-1(紫杉醇:hpmcas=1:1,重量比)在60min时溶出度为38.7%左右,较好;并且随着载体材料hpmcas的增加,本发明的组合物2-2(紫杉醇:hpmcas=1:3,重量比)和组合物2-3(紫杉醇:hpmcas=1:5,重量比)在60min的溶出度分别增加至55.8%和72.7%。然后进一步在组合物2-2的基础(即紫杉醇:hpmcas=1:3,重量比)上分别加入相应量的
并且,从表2-4还可以看出,本发明的组合物从15min至120min,其溶出度都是在逐步提高,而原料药紫杉醇则在该期间的溶出度并未有明显变化。
以上试验表明,与紫杉醇原料药和对比例1相比较,本发明的药物组合物能显著提高紫杉醇的溶解性和溶出度。尤其是当进一步加入向本发明的药物组合物加入
虽然本发明已阐述并描述了典型的实施方案,但本发明并不限于所述细节。由于各种可能的修改和替换没有背离本发明的精神,本领域技术人员可使用常规试验能够想到的本发明的变型和等同物,因此所有这些变型和等同物都落入由以下权利要求书所定义的本发明的精神和范围内。
- 还没有人留言评论。精彩留言会获得点赞!