冬凌草治疗皮肤疾病的用途的制作方法
本发明属于中药领域,涉及冬凌草治疗皮肤疾病的用途。具体而言,本发明涉及冬凌草在制备用于治疗与角质形成细胞过度增殖有关的皮肤疾病、特别是银屑病的药物组合物中的用途。
背景技术:
表皮是保护机体免受外界环境因素损伤的重要屏障,其由两大类细胞组成,即角质形成细胞(keratinocytes)和树枝状细胞,其中角质形成细胞占表皮的80%以上。角质形成细胞最终产生角质蛋白。根据其分化阶段,角质形成细胞可以由深层至浅表分为五层,即基底层、棘层、颗粒层、透明层以及角质层。
在一些皮肤疾病中,角质形成细胞过度增殖是主要的病理学特征,这些疾病包括皮肤角化病、银屑病、角质形成细胞肿瘤等,例如掌跖角化病、鱼鳞病、光化性角化病、过度角化症和毛发角化病。
据报道,角质形成细胞的过度增殖在特异性皮炎和变应性接触性皮炎的发病中发挥作用。研究表明,在外界刺激和细胞因子刺激下,角质形成细胞表达一系列过量的细胞因子、趋化因子和粘附分子,积极地参与到诸如特应性皮炎和变应性接触性皮炎的慢性炎症性皮肤病的发病机制中[1]。
银屑病(psoriasis)是一种常见的慢性炎症性皮肤病,其致病原因较为复杂,包括遗传、感染、免疫异常、内分泌失常及精神紧张等多种因素。其发病机制目前还没有完全阐述明白,但是在组织病理学中其主要表现为角质形成细胞的过度增殖、新生血管形成、白细胞浸润和炎症反应等重要变化[2,3]。目前,抗银屑病药物为针对上述病理变化所设计,比如抑制角质形成细胞增殖的蒽林等,抑制新生血管生成的血管内皮生长因子(vegf)受体酪氨酸激酶抑制剂su5416等,抑制炎症的糖皮质激素等[4,5]。但是,这些药物在临床上的使用存在副作用较大或者疗效不甚好等问题,导致目前对银屑病的治疗仍然面临极大的困境。因此,开发具有较少毒副作用、更好疗效的抗银屑病药物具有重要意义。
冬凌草(rabdosiarubescens)又名冰凌草,为唇形科香茶属多年生草本。冬凌草以全草或地上部分入药,具有清热解毒,活血止痛的作用。另外,研究发现其还具有抗肿瘤的作用。然而,至今未见有关其对角质形成细胞过度增殖相关性皮肤疾病例如银屑病的治疗作用的报道。本发明人发现,冬凌草能够显著抑制角质形成细胞增殖和炎症反应,而且能够显著逆转咪喹莫特诱导的银屑病样改变,表明冬凌草对角质形成细胞过度增殖相关性皮肤疾病例如银屑病具有治疗效力。
技术实现要素:
在本发明的一方面,提供冬凌草(rabdosiarubescens)在制备用于治疗与角质形成细胞过度增殖有关的皮肤疾病的药物组合物中的用途。
在本发明的另一方面,提供冬凌草在制备用于治疗银屑病的药物组合物中的用途。
附图简要说明
图1显示冬凌草乙醇提取物(终浓度分别为50、20、10、0μg/ml)以浓度依赖性的方式显著降低hacat细胞的细胞活力。***表示与不添加冬凌草乙醇提取物(即0μg/ml)时比较,p<0.001。
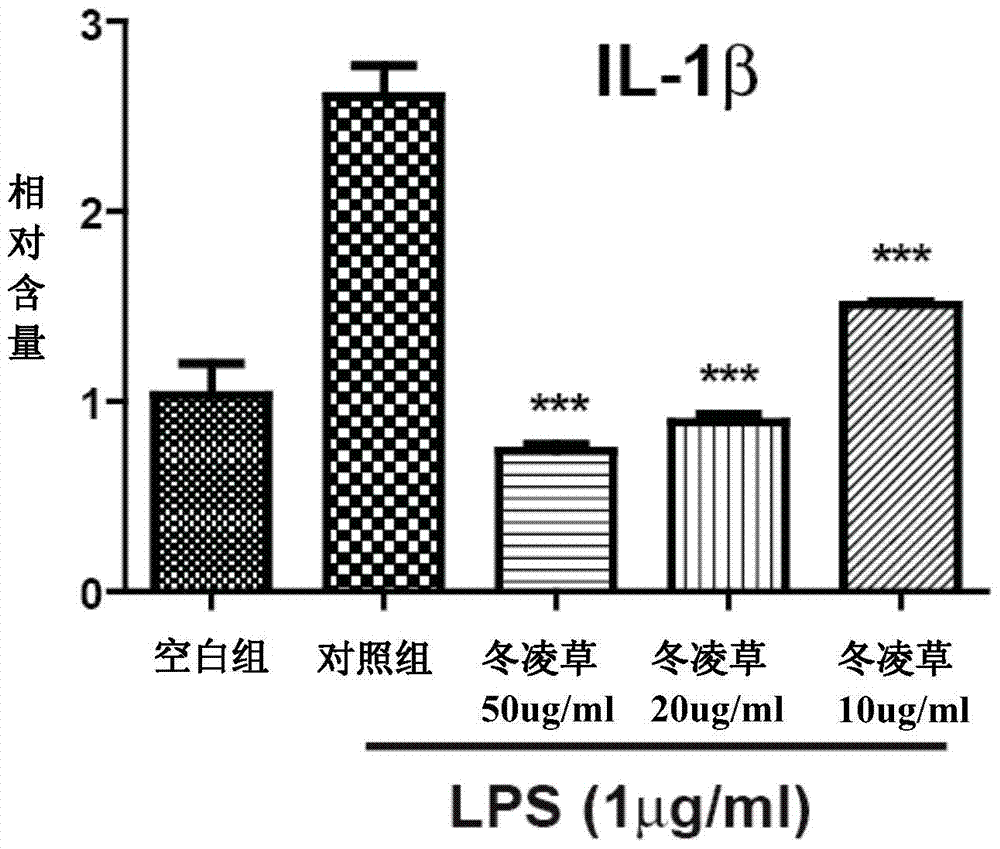
图2a和图2b分别显示冬凌草乙醇提取物(终浓度分别为50、20、10、0g/ml)以浓度依赖性的方式显著降低受细菌脂多糖(lps)刺激的raw264.7细胞中il-1βmrna和il-6mrna的含量。***表示与对照组比较,p<0.001。
图3显示冬凌草乙醇提取物明显改善咪喹莫特所致银屑病模型小鼠的背部鳞屑数目评分。***表示与对照组比较,p<0.001。
具体实施方式
现在详细地参照本发明的代表性实施方案描述本发明。这些实施方案仅仅是例示性的,不应理解为以任何方式限制本发明的范围。相反地,本发明意图涵盖权利要求书所限定的在本发明范围内的所有替代、修改和等同。
除非另外指明,本文所用的技术和科学术语具有与本发明所属领域的普通技术人员的通常理解相同的含义。
本文中所用术语“冬凌草”是指冬凌草(rabdosiarubescens)植物的未经炮制或经过炮制的全草或地上部分,特别是地上部分;以及其提取物。
本文中所用的术语“个体”是指动物,包括但不限于灵长类动物(如人、猴、黑猩猩、大猩猩等)、啮齿动物(如大鼠、小鼠、沙鼠、仓鼠、白鼬和类似啮齿动物)、兔形目动物、猪科动物(如猪、小型猪)、马科动物、犬科动物、猫科动物等,优选为人。
本文中所用的术语“治疗”是指疾病的完全或部分治愈,包括但不限于选自下列中的一种、或者两种或更多种的组合:减轻或消除引起疾病或病症的病因;改善或消除其病理学改变;减轻或消除其一种或多种症状;延缓或停滞其进展;减轻其严重性;降低其发病率;减少其复发;以及改善其预后。
本发明的一个方面基于以下发现:冬凌草能够显著抑制hacat细胞的增殖,这表明其能够有效抑制角质形成细胞的增殖。
因此,本发明的一个方面是冬凌草在制备用于治疗与角质形成细胞过度增殖有关的皮肤疾病的药物组合物中的用途。
在一实施方案中,所述皮肤疾病为角质形成细胞肿瘤,包括皮肤鳞状细胞癌和基底细胞癌。
在另一实施方案中,所述皮肤疾病为皮肤角化病。
“皮肤角化病(keratoderma)”是指以表皮角化过度为主要病理变化的一组皮肤疾病,其发病机制与角质形成细胞过度增殖有关。皮肤角化病包括但不限于银屑病、掌跖角化病、鱼鳞病(如表皮松懈性角化过度症)、光化性角化病、过度角化症(如持久性豆状角化过度症)、毛发角化病,等等。
在又一实施方案中,所述皮肤疾病选自银屑病、掌跖角化病、鱼鳞病、光化性角化病、过度角化症、毛发角化病及其组合。在另一实施方案中,所述皮肤疾病选自表皮松懈性角化过度症、持久性豆状角化过度症及其组合。
角质形成细胞的过度增殖在特异性皮炎和变应性接触性皮炎的发病中发挥作用。因此,在一实施方案中,所述皮肤疾病选自特应性皮炎、变应性接触性皮炎及其组合。
此外,本发明还基于以下发现:冬凌草能够抑制lps刺激引起的巨噬细胞表达炎症因子il-1β和il-6增加,这表明冬凌草还具有抗炎效力。
除了角质形成细胞过度增殖是银屑病的主要致病因素之一以外,炎症在银屑病的发病中也起着重要的作用。
银屑病的一个重要病理特征为皮损中有角质层下明显的中性粒细胞聚集,这是受趋化因子吸引迁移至此并被活化的结果。活化的中性粒细胞同时又能影响表皮角质形成细胞的生长和分化以及t细胞的活化,同时t细胞分泌的各种细胞因子如il-1β和il-6等又可影响中性粒细胞在表皮的迁移,通过生成淋巴因子影响角质形成细胞产生促炎症介质。因此,抑制il-1β和il-6等炎症因子,则可影响中性粒细胞在表皮的迁移,进而影响角质形成细胞产生促炎症介质的过程,从而起到抑制炎症的作用。
基于上文所述的冬凌草具有抑制角质形成细胞增殖和抗炎效力的发现,可以预期其对银屑病具有潜在的治疗效力。
本发明人进一步发现,冬凌草能够显著改善咪喹莫特所致银屑病模型小鼠的银屑病症状,从而证明其可有效地治疗银屑病。尽管不希望受到任何特定理论的束缚,本发明人认为,冬凌草对于银屑病的治疗效力与其抑制角质形成细胞增殖和抗炎效力相关。
因此,本发明的另一方面在于提供冬凌草在制备用于治疗银屑病的药物组合物中的用途。
在一实施方案中,所述银屑病选自寻常型银屑病(psoriasisvulgaris;又称斑块状银屑病(plaquepsoriasis))、脓疱型银屑病(pustularpsoriasis)、红皮病型银屑病(erythrodermicpsoriasis)、关节病型银屑病(psoriasisarthropathica)及其组合。
在又一实施方案中,所述银屑病选自头皮型银屑病、点滴状银屑病(guttatepsoriasis)、反转型银屑病(inversepsoriasis)及其组合。
在上述本发明的用途中,所述药物组合物包含作为活性成分的单独的冬凌草或者其与一种或多种其他药理活性组分的组合,以及任选存在的药学可接受的载体。
在本发明的又一方面,提供治疗个体的一种或多种上述疾病的方法,所述方法包括向所述个体给药治疗有效量的冬凌草。
在本发明的又一方面,提供治疗个体的一种或多种上述疾病的方法,所述方法包括向所述个体给药治疗有效量的药物组合物,所述药物组合物包含作为活性成分的单独的冬凌草或者其与一种或多种其他药理活性组分的组合,以及任选存在的药学可接受的载体。
在本发明的又一方面,提供冬凌草,其用于治疗一种或多种上述疾病。
上述疾病中的每一种以及任意两种或多种的组合都代表上述本发明的方法和药物组合物的一个实施方案。
在一实施方案中,所述药物组合物仅包含单独冬凌草作为活性成分。
在另一实施方案中,所述药物组合物包含冬凌草与一种或多种其他药理活性组分的组合作为活性成分。在一实施方案中,所述一种或多种其他药理活性组分是一种或多种其他中草药。在本发明的教导下,本领域技术人员可以根据中医药理论,通过辨证施治,选择适合的一种或多种其他中草药与冬凌草配伍使用。
在另一实施方案中,所述一种或多种其他药理活性组分是本领域已知的对于上述疾病或病症具有治疗效力的一种或多种化学治疗剂、生物治疗剂或其组合。通过与冬凌草组合使用,可以实现包括但不限于下列效果:联合治疗以提高每种药物组分所带来的整体疗效;降低其他药理活性组分的剂量以避免副作用;以及保持治疗效力。所述化学治疗剂包括但不限于:抗肿瘤剂例如甲氨喋呤,非甾体抗炎剂,糖皮质激素,免疫抑制剂例如他克莫司、匹美莫司,角质层分离剂,焦油类例如煤焦油、松馏油、糠馏油和黑豆馏油,腺苷酸环化酶抑制剂,蒽林,维生素c,维生素d3类似物例如卡泊三醇和他卡西醇,以及维a酸类如他扎罗汀(tazarotene)。所述生物治疗剂包括但不限于多克隆或单克隆抗体以及重组融合蛋白,例如英夫利西单抗(inflaximab)、阿达木单抗(adalimumab)、抗il-12/il-23单抗(ustekinumab)、依法珠单抗(efalizumab)、依那西普(etanercept)、阿法赛特(alefacept)等。医师可以根据所治疗的疾病的类型、其严重性、个体的一般健康状况、性别、年龄等因素决定所述化学治疗剂和/或生物治疗剂的选择。
所述药物组合物还任选地包含药学可接受的载体,例如赋形剂、崩解剂、稀释剂、粘合剂、助流剂、润滑剂、ph调节剂、防腐剂、分散剂、助悬剂、软膏基质、乳化剂、润肤剂、促渗剂、表面活性剂、抛射剂、调味剂、甜味剂、药物释放调节剂,等等。本领域技术人员可以根据所述药物组合物的期望的制剂形式、给药方式和药物释放特征等选择合适的载体。
所述药物组合物可以配制成适于通过本领域可用的任何公认的给药方式给药的固体、半固体或者液体形式的剂型,包括但不限于:(1)适于局部给药的:例如用于皮肤或者粘膜的硬膏剂、软膏剂、乳膏剂、喷雾剂或凝胶剂等;(2)适于经皮给药的:例如贴剂、凝胶膏剂等;(3)适于口服给药的:例如片剂、胶囊、散剂、颗粒、含片、含水或无水溶液或混悬剂、糖浆,等等;(4)适于肠胃外给药的:例如皮下、肌肉或者静脉注射,比如无菌溶液剂或混悬剂;(5)适于经阴道或直肠给药的:例如栓剂、乳剂、凝胶剂或者泡腾片等。
在本发明中,所述冬凌草可以是未经炮制的植物材料的形式、经炮制的饮片的形式或者其提取物的形式。在一实施方案中,所述冬凌草是其提取物的形式。适于制备冬凌草提取物的提取溶剂包括但不限于水、醇、醇水溶液、丙酮、乙酸乙酯及其任意组合(例如乙酸乙酯和乙醇),所述醇可以为c1-c6醇,例如甲醇、乙醇、正丙醇、异丙醇、正丁醇或异丁醇。在一实施方案中,所述冬凌草提取物是冬凌草的醇提取物,例如一种或多种c1-c6醇如甲醇、乙醇、异丙醇或其组合的提取物。在一个优选的实施方案中,所述冬凌草的醇提取物是甲醇提取物、乙醇提取物、异丙醇提取物或其组合,优选乙醇提取物。
所述冬凌草提取物可以通过本领域已知的方法制备。在一实施方案中,所述冬凌草的乙醇提取物是通过乙醇冷浸提取、温浸提取或者加热回流提取的方法制得的。
在一实施方案中,所述乙醇冷浸提取方法包括:
(1-1)在任选地辅以超声处理的条件下,将任选地干燥和粉碎的冬凌草用5-10倍质量的70-95%的乙醇在室温下浸泡5-7天,然后过滤;
(1-2)从滤液回收乙醇,然后浓缩剩余物,得到浸膏形式的冬凌草乙醇提取物。
在另一实施方案中,所述乙醇温浸提取方法包括:
(2-1)在任选地辅以超声处理的条件下,将任选地干燥和粉碎的冬凌草用5-10倍质量的70-95%的乙醇在40℃~60℃下浸泡2-4小时,然后过滤,取滤液;
(2-2)再重复步骤(2-1)1、2或3次,优选2次;
(2-3)合并滤液,从所述滤液回收乙醇,然后浓缩剩余物,得到浸膏形式的冬凌草乙醇提取物;
在又一实施方案中,所述乙醇加热回流提取方法包括:
(3-1)在任选地辅以超声处理的条件下,将任选地干燥和粉碎的冬凌草与5-10倍质量的70-95%的乙醇的混合物在加热回流下提取30分钟-2小时,然后过滤,取滤液;
(3-2)再重复步骤(3-1)1、2或3次,优选2次;
(3-3)合并滤液,从所述滤液回收乙醇,然后浓缩剩余物,得到浸膏形式的冬凌草乙醇提取物。
下面通过实施例更详细地说明本发明,但这些实施例并不对本发明构成任何限制,本发明的范围仅由权利要求书定义。
实施例
实施例1:冬凌草提取物的制备
取100g冬凌草地上部分(来自康美药业有限公司,批号:141009111),干燥,粉碎,然后加入5倍质量的90%乙醇,在超声处理下于60℃浸泡3小时。然后过滤,取滤液。重复以上浸泡和过滤步骤2次。合并滤液,并从滤液回收乙醇,然后浓缩剩余物,得到约2g浸膏形式的冬凌草提取物,用于后续研究。
实施例2:冬凌草显著抑制角质形成细胞的增殖
所有细胞培养试剂(dmem、fbs等)均购于gibico公司;mtt(噻唑蓝)、dmso购于sigma公司;角质形成细胞hacat细胞购于美国典型培养物保藏中心(atcc)细胞库(atcc编号:crl-2310)。
将hacat细胞按照每孔10000个细胞接种到96孔板上,每孔含有添加了10%胎牛血清(fbs)、100u/ml青霉素、100mg/ml链霉素的dmem(dulbecco’smodifiedeaglemedium)培养液,于5%co2和37℃下培养过夜。第二天加入冬凌草乙醇提取物的dmso溶液至不同终浓度(50、20、10、0μg/ml),再培养72小时。然后,每孔加入5mg/mlmtt溶液20μl,继续孵育4小时。吸出孔内培养液以终止培养,然后每孔加入150μldmso,振荡10分钟以充分溶解结晶物。在490nm处测定各孔的吸光度值(od),记录结果,以od值的相对值表征hacat细胞的相对活力。结果如图1所示。
如图1所示,冬凌草乙醇提取物能够以浓度依赖性的方式显著抑制hacat细胞的增殖,表明冬凌草能够显著抑制角质形成细胞的增殖。
实施例3:冬凌草显著抑制小鼠巨噬细胞炎症因子的表达
所有细胞培养试剂(dmem、fbs等)来自gibico公司;反转录试剂盒、实时荧光定量pcr(rt-pcr)试剂盒购于takara公司;lps购于sigma公司;小鼠巨噬细胞raw264.7购于atcc细胞库(atcc编号:tib-71tm)。raw264.7在5%co2和37℃下培养于添加了10%胎牛血清(fbs)、100u/ml青霉素、100mg/ml链霉素的dmem(dulbecco’smodifiedeaglemedium)培养液中。
将raw264.7细胞于6孔板中培养至60%密度,加入lps至终浓度(1μg/ml)。对于实验组,加入冬凌草乙醇提取物的dmso溶液至不同终浓度(50、20、10μg/ml);对于对照组,加入dmso至终浓度1μg/ml。另设空白组,不向其中添加lps,仅加入dmso至终浓度1μg/ml。孵育24h后,进行总mrna的抽提。具体方法简述如下:以pbs洗涤细胞三遍,加入1mltrizol,静置5分钟后收集于1.5mlep管,加入200μl氯仿,剧烈晃动后静置3分钟。随后,在4℃以13000转/分钟的速度离心15分钟,取上清,然后加入0.5ml异丙醇混匀,室温下放置10分钟,在4℃以13000转/分钟的速度离心15分钟,弃上清,取沉淀并以0.5ml75%乙醇清洗,然后在4℃以13000转/分钟离心15分钟,最后清除干净上清,将沉淀在室温下干燥15分钟,加入20μldepc水溶解沉淀,得到mrna,并测定含量。
根据反转录试剂盒生产商提供的方法将mrna反转为cdna。具体步骤如下:将mrna进行定量,加入反转录试剂盒中所提供的随机引物、逆转录酶、oligodt以及总量为1μg的mrna,于37℃反转录15分钟,得到cdna。
用实时荧光定量pcr试剂盒生产商提供的方法进行定量pcr。具体程序如下:94℃下持续5分钟,然后开始进行43个的循环:94℃下持续3秒,63℃下持续10秒,72℃下持续60秒。
引物如下:
小鼠gapdh:
正向序列5’-aggtcggtgtgaacggatttg-3’,
反向序列5’-ggggtcgttgatggcaaca-3’;
小鼠il-6:
正向序列5′-agttgccttcttgggactga-3′,
反向序列5′-ttctgcaagtgcatcatcgt-3′;
小鼠il-1β:
正向序列5′-ggctgtggagaagctgtggc-3′,
反向序列5′-gggtgggtgtgccgtctttc-3′。
结果如图2a和图2b所示。
图2a和图2b表明,冬凌草乙醇提取物能够以浓度依赖性的方式显著抑制lps刺激引起的炎症因子il-1β和il-6的增加,提示冬凌草还具有抗炎效力。
实施例4:冬凌草显著改善咪喹莫特所致银屑病模型小鼠的银屑病症状
1.实验原理
咪喹莫特为免疫应答调节剂,临床上主要用于治疗外生殖器疣,但是临床上发现咪喹莫特能诱发导致银屑病[6]。而且,实验研究发现咪喹莫特能够诱发鼠类银屑病样病变。因此,目前咪喹莫特诱导的银屑病模型为抗银屑病药物研究的重要动物疾病模型之一[7,8]。
2.实验方法
将体重约20g的9周龄雌性balb/c小鼠(购于北京维通利华公司)饲养在无特定病原体的环境下,不限制食物和水的量,光照和黑暗各12小时,温度23-25℃。适应环境后,将动物随机分成对照组和实验组,各10只小鼠。各组动物接受如下处理:
对照组:将小鼠背部的毛发剃除干净,每次先取1ml无水乙醇滴于小鼠背部局部皮肤,在吸收后均匀涂抹5%的咪喹莫特乳膏(购于英国3m公司)62.5mg(含3.125mg咪喹莫特)。每天1次,连续6天。
实验组:将小鼠背部的毛发剃除干净,每次先取1ml冬凌草乙醇提取物(溶解于无水乙醇,10mg/ml)滴于小鼠背部局部皮肤,在吸收后均匀涂抹5%的咪喹莫特乳膏(购于英国3m公司)62.5mg(含3.125mg咪喹莫特)。每天1次,连续6天。
然后,根据小鼠背部的鳞屑面积进行评分,具体如下:
0分-小鼠背部鳞屑数目小于等于10%;
1分-小鼠背部鳞屑数目大于10%,小于等于30%;
2分-小鼠背部鳞屑数目大于30%,小于等于50%;
3分-小鼠背部鳞屑数目大于50%,小于等于70%;
4分-小鼠背部鳞屑数目大于70%。
每组10只小鼠,对其得分进行统计学分析,采用t-检验。
3.实验结果
结果示于图3。如图3所示,以10mg/次给予冬凌草乙醇提取物能够明显改善咪喹莫特诱导的银屑病的鳞屑数目,表明冬凌草具有很好的改善银屑病的效力。
在本申请中引用的所有出版物和专利申请指明了本公开内容所属领域的技术水平。它们都通过援引以其整体加入本文。
根据以上描述,本领域技术人员可确定本发明的必要特征,并可在不背离本发明精神和范围下对本发明进行各种变化和修改以使其适于各种用途和条件。所有这样的修改和修改也包括在本发明的范围中。因此,本发明的范围应当由所附的权利要求和它们的法律等同方案来确定。
参考文献:
1.涂红琴,李新宇,角质形成细胞在变应性接触性皮炎和特应性皮炎中的作用,国际皮肤性病学杂志,2006,32(6):371-373。
2.griffithsce,barkerjn.pathogenesisandclinicalfeaturesofpsoriasis.lancet,2007;370:263–71.
3.gudjonssonje,johnstona,dysonm,valdimarssonh,elderjtmousemodelsofpsoriasis.jinvestdermatol.,2007;127:1292–308.
4.crawshawaa,griffithsce,younghs.investigationalvegfantagonistsforpsoriasis.expertopininvestigdrugs,2012;21:33-43.
5.georgese,andersonrj,haswellm,groundwaterpw,aninvestigationoftheeffectsofdithranol-inducedapoptosisinahumankeratinocytecellline.jpharmpharmacol.,2013;65:552-560.
6.kirciklh,delrossojq,thetreatmentofinflammatoryfacialdermatoseswithtopicalcorticosteroids:focusonclocortolonepivalate0.1%cream.jdrugsdermatol.,2012;11:1194-1198.
7.patelu,marknm,machlerbc,levinevj.imiquimod5%creaminducedpsoriasis:acasereport,summaryoftheliteratureandmechanism.brjdermatol.,2011mar;164(3):670-2.
8.
9.aroran,shahk,pandey-rais,inhibitionofimiquimod-inducedpsoriasis-likedermatitisinmicebyherbalextractsfromsomeindianmedicinalplants.protoplasma,2015may28。
- 还没有人留言评论。精彩留言会获得点赞!