Metrnl蛋白或基因在治疗内皮功能受损中的应用的制作方法
本发明涉及分子生物学和生物医药领域,具体地说,涉及metrnl蛋白或基因在治疗内皮功能受损中的应用。
背景技术:
内皮细胞(endothelialcells,缩写ecs)是一薄层的专门上皮细胞,由一层扁平细胞所组成,呈多边形,细胞的边缘呈锯齿状,相互嵌合。它位于血液与血管组织之间,形成血管的内壁,是血管管腔内血液与血管壁的接口。内皮细胞沿着整个循环系统,由心脏直至最小的微血管。
内皮细胞提供血液与血管壁之间的屏障,并能完成血浆和组织液的代谢交换,还能合成和分泌多种生物活性物质,以保证血管正常的收缩和舒张,起到维持血管张力,调节血压以及凝血与抗凝平衡等特殊功能,进而保持血液的正常流动和血管的长期通畅。其中,血管舒张有两种形式:①内皮依赖性血管舒张:指内皮细胞在药物(如乙酰胆碱)和生理性刺激(如血流切应力)的作用下释放内皮依赖性舒张因子(edrf),作用于血管平滑肌引起血管扩张,这依赖于结构和功能正常的血管内皮,内皮细胞受损或功能异常时,no释放减少,血管扩张能力降低;②非内皮依赖性血管舒张:指不依赖于血管内皮的外源性no供体(如硝酸甘油、硝普钠等)注入体内则直接作用于血管平滑肌引起血管舒张。
正常内皮功能包括抑制血管平滑肌收缩、血小板聚集、血管平滑肌细胞增生、白细胞粘附和血栓形成等。内皮功能障碍主要表现为:内皮依赖性血管舒张功能下降,血管通透性增加,白细胞粘附,炎症反应,内皮结构性损害,内皮细胞脱落等。
近年来,越来越多的研究表明内皮功能的改变与诸多疾病的发生、发展有密切的联系,诸多疾病发生的早期均有血管内皮功能受损。其中,高血压、冠心病、糖尿病、高胆固醇血症、动脉粥样硬化、血栓、缺血性心脑血管疾病均存在内皮依赖性血管舒张功能障碍,血脂异常、肥胖及长期吸烟者也存在内皮依赖性血管舒张功能障碍。同样地,在以上心脑血管疾病的发生过程中,伴有内皮细胞的异常生长。
metrnl在ncbi中的小鼠、大鼠、人基因号分别为210029、316842和 284207。小鼠metrnl位于第11号染色体qe2位点,人metrnl位于第17号染色体q25.3位点,二者蛋白序列具有77%的同源性。metrnl开放阅读框架包含四个外显子,由936个碱基对编码311个氨基酸,其中包括由45个氨基酸构成的n端信号肽序列和由266个氨基酸构成的分子量约为30kda的成熟蛋白分子,整个蛋白分子没有跨膜区域。metrnl在白色脂肪等组织中具有较高的表达(cnsneuroscither.2014apr;20(4):344-54),在胰岛素敏感性调节等过程中具有重要作用(diabetes.2015dec;64(12):4011-22;中国专利号zl201310525181.5&zl201310525184.9)。
目前关于metrnl蛋白和基因的功能研究报道极少,尤其是与内皮功能之间的关系尚无报告。因此,进一步探索metrnl蛋白和基因的用途,将有助于相关疾病发生发展机制的研究和治疗药物的开发。
技术实现要素:
本发明的目的是针对现有技术中的不足,提供metrnl蛋白或基因在治疗内皮功能受损中的应用。
在本发明的第一方面,提供了一种metrnl蛋白或基因及其增效剂的用途,用于制备治疗或改善内皮功能受损相关疾病的药物。
所述的内皮功能受损相关疾病为内皮依赖性血管舒张功能障碍相关疾病或内皮细胞损伤相关疾病等。
所述的内皮细胞损伤相关疾病伴有内皮细胞生长异常。
所述的内皮功能损伤相关疾病包括高血压、冠心病、糖尿病、高胆固醇血症、动脉粥样硬化、血栓、缺血性心脑血管疾病、血脂异常、肥胖、吸烟损害等。
作为本发明的一种具体实施方式,所述metrnl蛋白的氨基酸序列如seqidno.1所示。
在本发明的第二方面,提供了一种metrnl蛋白或基因及其增效剂的用途,用于:
a)制备治疗或改善内皮依赖性血管舒张功能障碍的试剂;或
b)用于制备促进内皮细胞增殖的试剂。
作为本发明的一种具体实施方式,所述metrnl蛋白的氨基酸序列如seqidno.1所示。
在本发明的第三方面,提供了一种筛选治疗或改善内皮依赖性血管舒张功 能障碍的潜在物质的方法,包括以下步骤:
a)将候选物质与含有metrnl蛋白或基因的体系接触,
b)观察候选物质对于metrnl蛋白或基因表达及活性的影响,其中,若所述候选物质能够促进metrnl基因表达或提高metrnl蛋白活性,则所述候选物质是治疗或改善内皮依赖性血管舒张功能障碍的潜在物质。
在本发明的第四方面,提供了一种非诊断和治疗目的的调节内皮依赖性血管舒张功能的方法,包括以下步骤:促进或抑制血管内皮细胞中metrnl基因的表达或metrnl蛋白的活性。
在本发明的第五方面,提供了一种治疗或改善内皮功能受损相关疾病的药物组合物,所述的药物组合物含有metrnl蛋白、基因或它们的增效剂,以及常规药用载体。
本发明优点在于:
一方面,发明人首次建立了metrnl内皮特异性敲除小鼠模型,基于该模型证实血管内皮缺乏metrnl引起内皮依赖性舒张功能下降,metrnl具有扩张血管的功能;另一方面,发明人基于人脐静脉内皮细胞株(huvec)和metrnl内皮特异性敲除小鼠原代内皮细胞,证实了敲减血管内皮metrnl后,细胞增殖下降,表明metrnl具有促进内皮细胞增殖的作用。因此,metrnl蛋白或基因及其增效剂可用于制备治疗或改善内皮依赖性血管舒张功能障碍的试剂,制备调节内皮细胞增殖的试剂,并用于内皮功能受损相关疾病药物的开发。
附图说明
图1.人、大鼠、小鼠metrnl氨基酸序列全长比对图。
图2.野生小鼠胸主动脉免疫组化染色显示内皮metrnl。
图3.野生小鼠胸主动脉免疫荧光染色显示内皮metrnl。
图4.原代小鼠主动脉内皮细胞生长图片。
图5.原代小鼠主动脉内皮细胞cd31的流式鉴定结果。
图6.原代小鼠主动脉内皮细胞cd31的免疫荧光染色鉴定结果。
图7.原代培养小鼠主动脉内皮细胞(maec)中metrnl表达的定量分析结果。
图8.metrnl内皮特异性敲除小鼠构建流程图。
图9.metrnl内皮特异性敲除小鼠基因组dna的tek-cre以及metrnl-flox基因型鉴定电泳图。
图10.metrnl内皮特异性敲除小鼠(ec-metrnl-/-)免疫荧光染色显示内皮缺乏metrnl。
图11.metrnl内皮特异性敲除小鼠原代内皮细胞metrnl的表达。
图12.metrnl内皮特异性敲除小鼠(ec-metrnl-/-)及同窝对照小鼠(wt)对去氧肾上腺素(phe)引起的血管收缩反应检测结果。
图13.metrnl内皮特异性敲除小鼠(ec-metrnl-/-)及同窝对照小鼠(wt)对乙酰胆碱(ach)引起的内皮依赖性舒张反应检测结果。
图14.metrnl内皮特异性敲除小鼠(ec-metrnl-/-)及同窝对照小鼠(wt)对硝普钠(snp)引起的内皮非依赖性血管舒张反应检测结果。
图15.huvec细胞转染荧光图片。
图16.metrnl敲减效率的验证结果。
图17.huvec的细胞增殖实验结果。
图18.metrnl内皮特异性敲除小鼠原代内皮细胞的细胞增殖实验结果。
具体实施方式
下面结合附图对本发明提供的具体实施方式作详细说明。
metrnl蛋白及基因
本文中,术语“metrnl蛋白”、“metrnl多肽”可互换使用。人、大鼠、小鼠metrnl氨基酸序列全长比对图见图1。可参考文献:cnsneuroscither.2014apr;20(4):344-354。
在本文中,所用的metrnl蛋白可以是天然存在的,比如其可被分离纯化自哺乳动物。此外,所述metrnl蛋白也可以是人工制备的,比如根据常规基因工程技术来制备得到。任何合适的metrnl蛋白均可适用于本发明。所述metrnl蛋白包括全长的metrnl蛋白或其生物活性片段。优选地,可以与seqidno.1所示的氨基酸序列基本相同。
经过一个或多个氨基酸残基的取代、缺失或添加而形成的metrnl蛋白的氨基酸序列也包括在本发明中。metrnl蛋白或其生物活性片段包括一部分保守氨基酸的替代序列,所述氨基酸替代的序列并不影响其活性或保留了其部分活性。适当替换氨基酸是本领域内的公知技术,所述技术可以很容易地被实施并且确保不改变已知分子的生物活性。这些技术使本领域人员认识到,一般来说,在一种多肽的非必需氨基酸区域改变单个氨基酸并不会改变生物活性。
任何一种metrnl蛋白的生物活性片段均可以应用到本发明中。在这里, metrnl蛋白的生物活性片段的含义是指一种多肽,其仍然能保持全长的metrnl蛋白的全部或部分功能。通常情况下,所述的生物活性片段至少保持50%、60%至99%或者100%的全长metrnl蛋白的活性。
本发明也可以采用经修饰或改良的全部或部分氨基酸的metrnl蛋白,比如,可以为了促进半衰期、有效性、代谢和/或蛋白的效力而加以修饰或改良的metrnl蛋白。所述经过修饰或改良的metrnl蛋白可以是一种metrnl蛋白的共轭物,或其可被取代的或人工的氨基酸。所述经过修饰或改良的metrnl蛋白或基因可以与天然metrnl蛋白或基因有一定的不同点,但也能够扩张血管,且不会带来其它不良反应或毒性。也就是说,任何不影响metrnl蛋白的生物活性或者说是基因的生物学功能的变化形式都可用于本发明中。
metrnl增效剂及其用途
所述的“metrnl增效剂”包括了激动剂、上调剂、稳定剂等,是指任何可提高metrnl的活性、提高metrnl的稳定性、上调metrnl的表达、增加metrnl有效作用时间的物质,这些物质均可用于本发明。它们可以是化合物、化学小分子、生物分子等。所述的生物分子可以是核酸水平(包括dna、rna)的,蛋白水平的,也可以是上调metrnl表达的病毒产品等。
实施例1metrnl在野生小鼠血管内皮细胞中的表达分布研究
1实验材料
c57小鼠:购于上海南方模式生物科技发展有限公司。
一抗metrnl:购于abcam公司。
一抗cd31:购于武汉谷歌生物科技有限公司。
二抗羊抗兔,二抗驴抗山羊:购于jackson公司。
山羊血清:购于武汉博士德。
dapi:购于碧云天公司。
抗荧光淬灭剂:购于碧云天公司。
高糖dmem:购于hyclone公司。
ⅰ型胶原酶:购于invitrogen公司。
egm-2内皮细胞专用培养基:购于lonza公司。
胰酶:购于gibco公司。
带有fitc荧光标记的cd31抗体:购于ebioscience。
trizol:购于invitrogen公司。
2实验方法
2.1免疫组化染色观察metrnl在血管内皮的表达分布
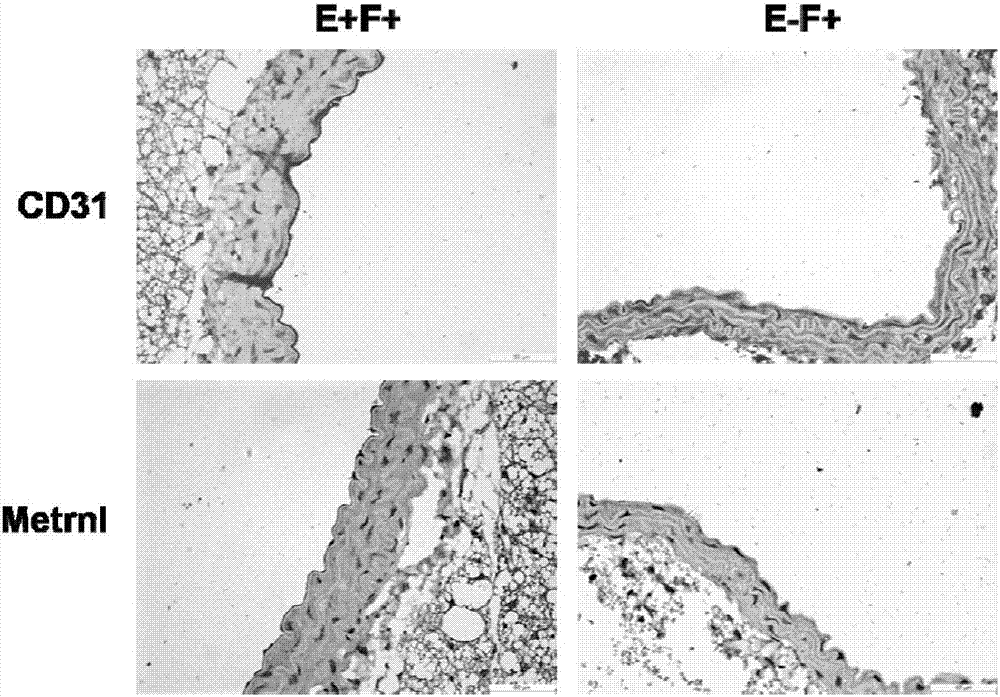
分离c57小鼠胸主动脉,将主动脉剪成3mm一段,其中一段使用弯镊去除主动脉内皮细胞层(e-f+),另一段保证内皮细胞层的完整性(e+f+)。使用多聚甲醛脱水完全后用石蜡包埋样本制成石蜡切片;石蜡切片60℃烤片后脱蜡水化,使用3%过氧化氢封闭内源性过氧化物酶;选择高压锅处理技术对片子进行抗原修复;使用山羊血清37℃封闭15min;分别在标本上滴加一抗metrnl、一抗cd31,4℃过夜孵育;漂洗片子后滴加生物素化的二抗,37℃孵育40min;漂洗后滴加sab复合物,37℃孵育40min,漂洗后进行dab显色观察。
2.2免疫荧光技术观察metrnl在血管内皮的表达分布
分离c57小鼠胸主动脉,去除主动脉外膜脂肪,剪成约2-3mm一段,浸泡于4%多聚甲醛溶液中脱水直至样本沉底;将脱水处理后的主动脉取出,使用包埋剂竖直固定于冻台上并将样本连冻台一起置于-80℃冷冻约30min;取出固定有样本的冻台,将其固定于冰冻切片机样品固定台上开始切片,每张片子厚度为10μm,采用贴片法将片子固定于防脱载玻片上,一个样本切片约20张;将切好的片子放置于37℃烘箱中烤片2小时;使用1×pbs静置漂洗片子3次,每次5min;使用柠檬酸三钠对片子进行热修复10min;使用1×pbs静置漂洗片子3次,每次5min;将片子周围水迹擦干,使用油笔在样本周围划一圈;使用山羊血清室温封闭样本1小时;甩去山羊血清加入一抗(cd311:50,metrnl1:50),4℃孵育过夜;使用1×pbs静置漂洗片子3次,每次5min;二抗孵育(1:200)室温避光孵育1小时;使用1×pbs静置漂洗片子3次,每次5min;dapi复染室温3-5min;使用1×pbs静置漂洗片子3次,每次5min;滴加抗荧光淬灭剂,封片拍照呈像。
2.3原代小鼠主动脉内皮细胞(maec)的培养鉴定
2.3.1原代小鼠主动脉内皮细胞培养
4-5周龄c57小鼠麻醉处死;打开胸腔腹腔,将主动脉两头连着心脏、肾脏完整剪下将其放置于1×pbs中,置于冰上短时间保存;在解剖镜下将主动脉外膜脂肪及筋膜剔除干净,视野下仅剩下完整的主动脉连着心脏和肾脏部分;剪去心脏心尖部分,使用1ml注射器针头从心脏剪口处插入主动脉,使用1×pbs将主动脉中血液冲干净;再使用高糖dmem配制的2mg/mlⅰ型胶 原酶溶液注射入主动脉,使主动脉内充满ⅰ型胶原酶,使用两个蝴蝶夹将主动脉两头夹死,将主动脉放入37℃细胞培养箱消化45min;打开蝴蝶夹,使用1ml注射器分多次吸取15ml含有20%血清的dmem培养基反复从心脏冲洗主动脉,将主动脉内层内皮细胞吹下;收集所有吹下的溶液,使用70μm细胞筛网过滤至离心管中;1200rpm,5min离心收集细胞;使用20%血清的dmem培养基重悬细胞,将细胞种板于铺有fibronectin(corning)的细胞平皿中;2小时后将培养基换成egm-2内皮细胞专用培养基,隔天换液直至细胞长至融合。
2.3.2内皮细胞的流式鉴定
将原代内皮细胞使用胰酶消化,于离心管中离心1000rpm,5min;弃上清,使用100μl1×pbs重悬细胞沉淀,按抗体说明书要求向其中加入一定体积带有fitc荧光标记的cd31抗体,避光孵育30min;离心沉淀细胞后再加入300μl1×pbs重悬细胞,流式检测。
2.3.3内皮细胞的免疫荧光染色鉴定
吸弃细胞培养基,使用1×pbs漂洗细胞三次,使用4%多聚甲醛固定细胞10min;使用山羊血清室温封闭细胞1小时;吸弃山羊血清加入一抗cd31(1:50),4℃孵育过夜;使用1×pbs静置漂洗细胞3次,每次5min;二抗孵育(1:200)室温避光孵育1小时;使用1×pbs静置漂洗细胞3次,每次5min;dapi复染室温3-5min;使用1×pbs静置漂洗细胞3次,每次5min;拍照呈像。
2.4原代培养c57小鼠主动脉内皮细胞中metrnl的表达检测
使用trizol提取原代培养maec以及成熟脂肪细胞(matureadipocyte)的mrna,将其逆转录为cdna;使用metrnl基因上下游引物对细胞内的metrnl进行定量分析。
引物序列如下所示:
上游引物:ctggagcagggaggcttattt(seqidno.2),
下游引物:ggacaacaaagtcactggtacag(seqidno.3)。
3实验结果
3.1免疫组化染色结果
结果见图2,在内皮细胞层完整的主动脉血管环上(e+f+)可见metrnl与内皮特异性表面标记分子cd31一样,沿内皮层呈连续分布;而去除内皮细 胞层的血管环上(e-f+)cd31与metrnl均没有明显连续的表达。说明metrnl在小鼠胸主动脉内皮中具有较高的表达。
3.2免疫荧光染色结果
结果见图3,我们发现metrnl与cd31共定位于主动脉内皮细胞层,进一步证实metrnl可在血管内皮中表达。
3.3原代小鼠主动脉内皮细胞培养与鉴定结果
结果见图4-6,我们进行了maec的原代培养,并对体外培养的maec进行了内皮细胞表面标志分子cd31的流式鉴定,结果显示原代培养的细胞95.52%呈现cd31阳性,即为内皮细胞;我们对体外培养的maec进一步进行cd31染色,证实原代培养的细胞为内皮细胞。
3.4原代培养c57小鼠主动脉内皮细胞中metrnl的表达检测结果
结果见图7,可见metrnl在成熟脂肪细胞中具有较高的表达(cnsneuroscither.2014apr;20(4):344-354),将maec与成熟脂肪细胞中metrnl表达进行比较,发现maec中metrnl也具有较高的表达。
实施例2metrnl内皮特异性敲除小鼠构建和鉴定
1实验材料
tek-cre小鼠:购自thejacksonlaboratory,b6.cg-tg(tek-cre)12flv/j(stocknumber:004128)。
鼠尾基因组提取试剂盒:购于zymo公司。
2实验方法
2.1metrnl内皮特异性敲除小鼠培育
2.1.1metrnlloxp/loxp小鼠培育
metrnlloxp/loxp小鼠为实验室早期构建,已用于培育多种组织特异性敲除小鼠,具体培育方法可参见参考文献:diabetes.2015dec;64(12):4011-22,也可从中国人民解放军第二军医大学购买。
2.1.2metrnlloxp/loxptek-cre培育
将metrnlloxp/loxp小鼠与tek-cre小鼠杂交,得到的metrnlloxp/wttek-cre小鼠再与metrnlloxp/loxp小鼠进行回交,得到的metrnlloxp/loxptek-cre即为metrnl内皮特异性敲除小鼠(ec-metrnl-/-),培育流程见图8。
2.2metrnl内皮特异性敲除小鼠的基因型鉴定
使用鼠尾基因组提取试剂盒提取小鼠鼠尾基因组dna,使用tek-cre以及 metrnl-flox基因上下游引物对提取的基因组dna进行pcr扩增并进行琼脂糖凝胶电泳,分别在100bp以及243bp同时出现目的条带才能确定为metrnl内皮特异性敲除小鼠。
tek-cre以及metrnl-flox基因引物序列为:
tek-cre上游引物:gcggtctggcagtaaaaactatc(seqidno.4),
tek-cre下游引物:gtgaaacagcattgctgtcactt(seqidno.5),
metrnl-flox上游引物:tgagggttggaggctcctagc(seqidno.6),
metrnl-flox下游引物:ggatgagcgtttgagcacagc(seqidno.7)。2.3metrnl内皮特异性敲除小鼠表型验证(一)
取metrnl内皮特异性敲除小鼠(ec-metrnl-/-)及同窝对照小鼠(wt)主动脉做冰冻切片并进行组织免疫荧光染色(具体操作同实施例1中的记载)。2.4metrnl内皮特异性敲除小鼠表型验证(二)
提取metrnl内皮特异性敲除小鼠(ec-metrnl-/-)及同窝对照小鼠(wt)主动脉内皮细胞maec(具体操作同实施例1中的记载),提取maec的mrna逆转成cdna后使用metrnl基因上下游引物对细胞内的metrnl表达进行定量分析。
3实验结果
3.1metrnl内皮特异性敲除小鼠的基因型鉴定结果
结果见图9,可见在100bp以及243bp同时出现目的条带,确定metrnl内皮特异性敲除小鼠模型构建成功。
3.2metrnl内皮特异性敲除小鼠表型验证结果
结果见图10,可见与同窝野生型小鼠内皮层明显的metrnl荧光染色相比,ec-metrnl-/-内皮层无明显的metrnl表达,进一步证明metrnl内皮特异性敲除小鼠模型构建成功。
3.3metrnl内皮特异性敲除小鼠原代内皮细胞metrnl表达
如图11所示,metrnl内皮特异性敲除小鼠(ko)的maec较同窝对照小鼠(wt)相比,metrnl的表达下降了99%以上。
实施例3metrnl内皮特异性敲除小鼠血管舒张功能检测
1实验材料
氯化钾:购于国药集团。
乙酰胆碱:购于sigma公司。
去氧肾上腺素:购于sigma公司。
硝普钠:购于sigma公司。
2实验方法
metrnl内皮特异性敲除小鼠(ec-metrnl-/-)及同窝对照小鼠(wt)在戊巴比妥钠麻醉下开胸,剪开心脏放血后迅速分离、剪取胸主动脉段,去除血管外膜脂肪后,制备成长度约为3mm血管环2个,并小心连接于张力换能器,通过记录系统连续记录血管张力变化。调节静息张力至预定值1.5g;稳定1小时,使静息张力保持1.5g,30min时更换一次k-h液(37℃,含95%o2+5%co2),使各个浴槽中k-h液为20ml;采用kcl60mm引起血管收缩,5min后用k-h液(37℃,含95%o2+5%co2)冲洗标本3-5次,最后一次加入k-h液20ml。稳定15min,调节使静息张力保持1.5g,再次采用kcl60mm引起血管收缩,5min后用k-h液(37℃,含95%o2+5%co2)冲洗标本3-5次,最后一次加入k-h液20ml。稳定30min,调节使静息张力保持1.5g,采用单剂量去氧肾上腺素(phe)3×10-7m引起血管预收缩,当血管收缩反应达到坪值时,采用乙酰胆碱(ach)1×10-8,3×10-8,1×10-7,3×10-7,1×10-6,3×10-6,1×10-5,3×10-5,1×10-4,3×10-4m由低剂量到高剂量累积给药检测血管舒张功能,在每一剂量引起的血管舒张反应达到最大值时立即累加下一剂量。然后用k-h液(37℃,含95%o2+5%co2)冲洗标本3-5次,最后一次加入k-h液20ml。稳定30min,调节使静息张力保持1.5g,采用单剂量phe3×10-7m引起血管预收缩,当血管收缩反应达到坪值时,采用硝普钠(snp)1×10-10,3×10-10,1×10-9,3×10-9,1×10-8,3×10-8,1×10-7,3×10-7,1×10-6,3×10-6,1×10-5,3×10-5,1×10-4m由低剂量到高剂量累积给药,在每一剂量引起的血管舒张反应达到最大值时,立即累加下一剂量,记录snp引起血管舒张反应时张力的最小值。最后,储存、分析结果。
3实验结果
见图12-14,可见metrnl内皮特异性敲除小鼠(ec-metrnl-/-)及同窝对照小鼠(wt)对phe引起的血管收缩反应没有显著性差别,而ec-metrnl-/-对ach引起的内皮依赖性舒张反应明显低于wt,ec-metrnl-/-及wt对snp引起的内皮非依赖性血管舒张功能无明显差异。因此证实ec-metrnl-/-对ach引起的内皮依赖性舒张功能下降是由于血管内皮缺乏metrnl引起的,metrnl具有扩张血管的功能。
实施例4内皮细胞敲减metrnl后细胞增殖减慢
(一)人脐静脉内皮细胞株(huvec)
1实验方法
1.1细胞转染
将人脐静脉内皮细胞(huvec)按照1×105个/孔的密度铺板于六孔板中,待细胞贴壁10-12小时后按照moi=20的滴度分别转入对照病毒(scramble)和metrnl敲减病毒(metrnlshrna)。转染细胞24小时后,吸弃含有病毒的培养基,加入新鲜的完全培养基继续培养细胞,48小时后可在镜下观察细胞中的荧光强度,估测细胞的转染效率。
metrnlshrna干扰序列为:caggtgctctcatcgttaacc(seqidno.8)。
1.2metrnl敲减效率的验证
使用trizol提取经对照病毒(scramble)和metrnl敲减病毒(metrnlshrna)转染huvec细胞的mrna,将其逆转录为cdna;使用人源metrnl基因上下游引物对细胞内的metrnl进行定量分析。
引物序列如下所示:
上游引物:tggagaactgagactgctggt(seqidno.9),
下游引物:tactggaagcctgtggtcct(seqidno.10)。
1.3细胞增殖实验
将对照病毒(scramble)和metrnl敲减病毒(metrnlshrna)转染后的huvec细胞按照1×105个/孔的密度铺板于六孔板中,使用完全培养基正常培养。细胞生长48小时后拍照,记录细胞的增殖情况。
2实验结果
2.1细胞转染结果
结果见图15,表明两种病毒的转染效率均非常高。
2.2metrnl敲减效率的验证结果
结果见图16,表明使用metrnlshrna对huvec细胞中metrnl敲减效率大于80%,因此说明慢病毒介导的metrnl敲减细胞模型成功构建。
2.3细胞增殖实验结果
结果见图17,表明huvec细胞敲减metrnl后增殖速度明显慢于对照组细胞。
(二)metrnl内皮特异性敲除小鼠原代内皮细胞增殖减慢
1实验方法
1.1metrnl内皮特异性敲除小鼠原代内皮细胞培养
提取metrnl内皮特异性敲除小鼠(ec-metrnl-/-)及同窝对照小鼠(wt)主动脉内皮细胞maec(具体操作同实施例1中的记载),隔天换液直至细胞长至融合。
1.2细胞增殖实验
将metrnl内皮特异性敲除小鼠(ec-metrnl-/-)及同窝对照小鼠(wt)主动脉内皮细胞maec按照1×105个/孔的密度铺板于六孔板中,使用完全培养基正常培养。细胞生长48小时后拍照,记录细胞的增殖情况。
2实验结果
如图18所示,metrnl内皮特异性敲除小鼠(ko)的maec增殖速度明显慢于野生型小鼠maec。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员,在不脱离本发明方法的前提下,还可以做出若干改进和补充,这些改进和补充也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!