奥替普拉在逆转人类儿童早衰症衰老表型中的应用的制作方法
本发明属于生物医药领域,涉及一种奥替普拉的新用途,具体为奥替普拉在逆转人类儿童早衰症衰老表型中的应用。
背景技术:
衰老是人体逐渐走向紊乱的过程,被认为是对肿瘤、心血管等多种疾病影响最大的致病因素。人体具有一定的自我更新能力,同时这种自我更新能力也受到严格调控。随着机体的衰老,干细胞自我调节平衡被破坏,组织器官再生能力下降,从而引发衰老相关疾病。因此,目前干细胞衰老被认为是机体衰老的重要诱因之一,而如何延缓或逆转干细胞衰老也成为全球衰老基础和转化研究领域的研究热点。儿童早衰症(Hutchinson-Gilford progeria syndrome,HGPS)是一种极其罕见的人类早衰疾病,患者平均寿命仅为13岁。近年来,科学研究发现HGPS致病机理为人多能干细胞中的核纤层蛋白Lamin A发生基因突变,该突变激活了异常的RNA剪接,从而导致异常的Lamin A变体蛋白Progerin的表达,由于Progerin缺失了可降解信号,因此导致其在细胞中的异常累积,进而引发一系列的细胞缺陷,包括核膜异常,异染色质的丢失,DNA损伤修复能力受损和细胞抗氧化应激通路的改变等,最终导致干细胞过早衰老和耗竭(Kudlow,B.A.,Kennedy,B.K.,and Monnat,R.J.,Jr.(2007).Werner and Hutchinson-Gilford progeria syndromes:mechanistic basis of human progeroid diseases.Nat Rev Mol Cell Biol 8,394-404.)。体内多能干细胞的提前衰老和耗竭导致HGPS患者呈现出加速衰老的临床表型,多数患者最终死于衰老相关的动脉粥样硬化引发的心血管疾病,由此可见,HGPS是研究人类自然衰老机理和干预策略的天然模型和重要突破口。
目前已有少量利用小鼠模型或从HGPS患者分离获得的成纤维细胞模型对HGPS衰老进程进行小分子化合物干预的研究报道,其使用的小分子化合物包括雷帕霉素(Rapamycin)、萝卜硫素(Sulforaphane)和法尼基转移酶抑制剂(Farnesyltransferase inhibitors)等。然而迄今未见利用小分子化合物有效改善HGPS患者来源的成体干细胞衰老表型的体外和体内研究。
奥替普拉(Oltipraz),商品名吡噻硫酮,于70年代在法国问世,用于治疗埃及血吸虫和曼氏血吸虫病。目前尚无任何将奥替普拉用于HGPS相关研究的报道。
技术实现要素:
本发明的目的是提供一种奥替普拉的新用途。
本发明所提供的奥替普拉的新用途,具体在如下(I)或(II)中的应用:
(I)制备用于延缓或逆转人类儿童早衰症衰老表型的产品;
(II)延缓或逆转人类儿童早衰症衰老表型。
进一步,为在如下(A)或(B)中的应用:
(A)制备用于改善人类儿童早衰症患者来源的成体干细胞的衰老表型的产品;
(B)改善人类儿童早衰症患者来源的成体干细胞的衰老表型。
更加具体的,为在如下(a)或(b)或(c)或(d)中的应用:
(a)制备用于降低人类儿童早衰症患者来源的成体干细胞中β-半乳糖苷酶染色阳性的细胞比例的产品;或降低人类儿童早衰症患者来源的成体干细胞中β-半乳糖苷酶染色阳性的细胞比例;
(b)制备用于维持人类儿童早衰症患者来源的成体干细胞的核膜完整性的产品;或维持人类儿童早衰症患者来源的成体干细胞的核膜完整性;
(c)制备用于上调人类儿童早衰症患者来源的成体干细胞中核膜相关蛋白LAP2和/或LaminB1的表达量的产品;或上调人类儿童早衰症患者来源的成体干细胞中核膜相关蛋白LAP2和/或LaminB1的表达量;
(d)制备用于提高人类儿童早衰症患者来源的成体干细胞在体内的存活能力的产品;或提高人类儿童早衰症患者来源的成体干细胞在体内的存活能力。
当然,所述新用途也可为如下(1)或(2)中的应用:
(1)制备抑制成体干细胞衰老的产品:
(2)抑制成体干细胞衰老。
相应的,本发明还请求保护一种产品,其活性成分为奥替普拉,所述产品具有如下功能中的至少一种:
(a1)延缓或逆转人类儿童早衰症衰老表型;
(a2)改善人类儿童早衰症患者来源的成体干细胞的衰老表型;
(a3)降低人类儿童早衰症患者来源的成体干细胞中β-半乳糖苷酶染色阳性的细胞比例;
(a4)维持人类儿童早衰症患者来源的成体干细胞的核膜完整性;
(a5)上调人类儿童早衰症患者来源的成体干细胞中核膜相关蛋白LAP2和/或LaminB1的表达量;
(a6)提高人类儿童早衰症患者来源的成体干细胞在体内的存活能力;
(a7)抑制成体干细胞的衰老。
在本发明中,所述人类儿童早衰症患者来源的成体干细胞具体为人类儿童早衰症患者来源的间充质干细胞。所述成体干细胞具体为间充质干细胞。
更加具体的,所述人类儿童早衰症患者来源的间充质干细胞是按照包括如下步骤的方法制备获得的:
(1)将人类儿童早衰症患者来源的多能干细胞进行拟胚体分化(如分化14天),获得拟胚体;
(2)将所述拟胚体接种于基质胶(matrigel)包被的培养板中进行培养,培养至纤维状细胞出现(培养时间如2周);再经过一次传代后,分选其中CD73、CD90、CD105均为阳性的细胞类群,即为所述人类儿童早衰症患者来源的间充质干细胞。
在本发明的一个实施例中,所述人类儿童早衰症患者来源的多能干细胞为人类儿童早衰症患者来源的诱导多能干细胞;具体为“Liu,G.H.,Barkho,B.Z.,Ruiz,S.,Diep,D.,Qu,J.,Yang,S.L.,Panopoulos,A.D.,Suzuki,K.,Kurian,L.,Walsh,C.,et al.(2011a).Recapitulation of premature ageing with iPSCs from Hutchinson-Gilford progeria syndrome.Nature 472,221-225.”一文中公开的“HGPS-iPSCs”。
其中,所述产品可为药物。
在本发明的实施例中,所述奥替普拉的使用浓度为25μM。
本发明利用已获得的HGPS-iPSC和cHGPS-iPSCs分化产生相应的MSCs,并利用这两种具有相同遗传背景的MSCs,通过体外和体内研究方法筛选具有延缓或逆转HGPS衰老表型的小分子化合物奥替普拉。实验证明,奥替普拉能够降低HGPS-MSCs中β-半乳糖苷酶染色阳性的细胞比例、上调HGPS-MSCs中核膜相关蛋白LAP2和/或LaminB1的表达量,并提高HGPS-MSCs在体内的存活能力,即奥替普拉能够改善HGPS-MSCs的衰老表型,对延缓或逆转人类儿童早衰症衰老表型具有重要作用。
附图说明
图1为本发明产生了携带LMNA(C1824T)突变的诱导多能干细胞分化获得的MSC。其中,A为流式分析MSC表面分子标记表达的数据;B为基因型鉴定确定携带LMNA(C1824T)突变(GC-MSC表示cHGPS-MSC);C为Progerin表达上升的鉴定(GC表示cHGPS-MSC;HGPS表示HGPS-MSC)。图中,***表示p<0.001。
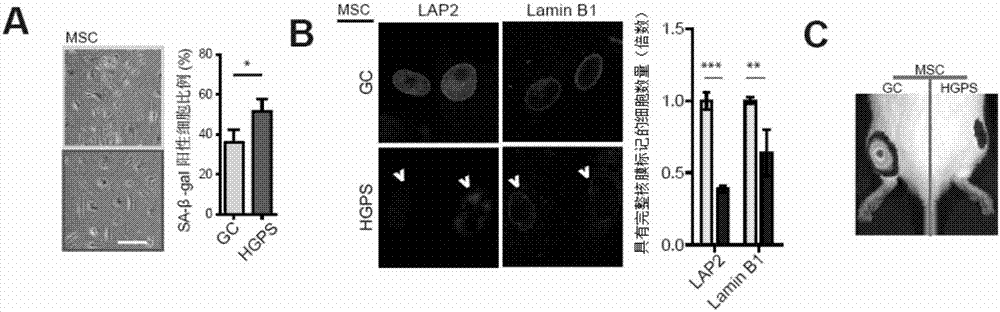
图2为本发明涉及的HGPS-iPSC衍生的MSC具有衰老的表型。其中,A为衰老相关β-半乳糖苷酶染色结果;B为衰老相关核膜标记物LAP2和Lamin B1表达情况的鉴定结果(柱形图中,表达量相对较低的为HGPS-MSC;表达量相对较高的为cHGPS-MSC);C为体内移植后MSC细胞存活能力检测的结果。图中,*表示p<0.05;**表示p<0.01;***表示p<0.001。GC表示cHGPS-MSC;HGPS表示HGPS-MSC。
图3为奥替普拉(Oltipraz)可以逆转HGPS-MSC的衰老表型。其中,A为衰老相关β-半乳糖苷酶染色染色结果;B为衰老相关核膜分子标记物LAP2和Lamin B1表达情况的鉴定结果;C为奥替普拉处理的HGPS-MSC体内存活能力增强的数据。图中,“对照(即Vehicle)”表示未添加奥替普拉。图中,**表示p<0.01;***表示p<0.001。GC-MSC表示cHGPS-MSC。
具体实施方式
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
下述实施例中的细胞培养条件如无特殊说明,均为37℃,5%CO2。
下述实施例中的定量实验均至少设置三次重复,结果取均值。
奥替普拉(Oltipraz):Sigma公司产品,其产品目录号为O9389。≥98%(HPLC),别名:4-Methyl-5-(2-pyrazinyl)-1,2-dithiole-3-thione;BRN 0978110;CCRIS 4048;NSC 347901;RP 35972;经验分子式(希尔表示法)C8H6N2S3;分子量226.34;EINECS编号264-736-6。
HGPS病人来源的iPSC(简称HGPS-iPSCs):记载于“Liu,G.H.,Barkho,B.Z.,Ruiz,S.,Diep,D.,Qu,J.,Yang,S.L.,Panopoulos,A.D.,Suzuki,K.,Kurian,L.,Walsh,C.,et al.(2011a).Recapitulation of premature ageing with iPSCs from Hutchinson-Gilford progeria syndrome.Nature 472,221-225.”一文,公众可从申请人处获得,仅用于重复本发明实验使用。
与HGPS-iPSC具有相同遗传背景的对照细胞系(简称cHGPS-iPSCs)记载于“Liu,G.H.,Suzuki,K.,Qu,J.,Sancho-Martinez,I.,Yi,F.,Li,M.,Kumar,S.,Nivet,E.,Kim,J.,Soligalla,R.D.,et al.(2011b).Targeted gene correction of laminopathy-associated LMNA mutations in patient-specific iPSCs.Cell Stem Cell 8,688-694.”一文,公众可从申请人处获得,仅用于重复本发明实验使用。
1、用于流式细胞术分选MSC的荧光标记抗体如下:
荧光素FITC标记的抗人细胞表面识别分子CD90抗体,BD Biosciences,货号:555595。
荧光素PE标记的抗人细胞表面识别分子CD73抗体,BD Biosciences,货号:550257。
荧光素APC标记的抗人细胞表面识别分子CD105抗体,BD Biosciences,货号:17-1057-42。
荧光素APC标记同型对照抗体,BD Biosciences,货号:555751。
荧光素PE标记同型对照抗体,BD Biosciences,货号:555749。
荧光素FITC标记同型对照抗体,BD Biosciences,货号:555742。
2、用于免疫荧光的抗体如下:
抗人LAP2抗体,BD Biosciences,货号:611000。
抗人Lamin B1抗体,Santa Cruz Biotechnology,货号:sc-6216。
3、下述实施例中的培养基配方如下:
1)诱导多能干细胞(iPSC)培养基配方:80%(体积百分含量)DMEM/F12培养基(Invitrogen)、20%(体积百分含量)Knockout血清替代物(Invitrogen)、0.1mM非必需氨基酸(Invitrogen)、1mM GlutaMAX(Invitrogen)、1%(1g/100ml)青霉素/链霉素(Invitrogen)、55μMβ-巯基乙醇(Invitrogen)、10ng/ml人重组FGF2(Joint Protein Central)。
2)间充质干细胞(MSC)培养基配方:MEM培养基(Invitrogen,12571071);10%(体积百分含量)胎牛血清(Invitrogen,10091148);1%(1g/100ml)青霉素/链霉素(Invitrogen,15070-063);10ng/ml重组人成纤维细胞生长因子(JPC,bFGF);5ng/ml TGFβ(Humanzyme,HZ1131)。
实施例1、获得HGPS-MSC及其衰老表型的鉴定
1、HGPS病人来源的诱导多能干细胞的培养与MSC的分化
HGPS病人来源的iPSC(HGPS-iPSCs),其中LMNA基因发生了突变(LMNA基因组序列为GenBank:NG_008692.2;cDNA序列为GenBank:NM_170707.3),突变类型为C1824T(GGCGG突变为GGTGG),该位点参比序列为LMNA cDNA序列GenBank:NM_170707.3中的CDS区域。本实施例将HGPS-iPSCs进一步体外定向分化为间充质干细胞(HGPS-MSC)。具体方法如下:
将HGPS-iPSCs进行拟胚体(EB)分化,分化14天,将EB接种于基质胶(matrigel)包被的6孔板中进行培养,继续培养2周至纤维状细胞出现。再经过一次传代后,利用流式细胞术分选其中CD73、CD90和CD105均为阳性的细胞类群,即为HGPS病人来源的间充质干细胞(记为HGPS-MSC)(见图1中A)。实验同时设置基因矫正后的cHGPS-iPSCs分化获得的MSC作为对照,所得间充质干细胞记为cHGPS-MSC。
2、HGPS-MSC的衰老表型鉴定
(1)基因型和Progerin蛋白累积鉴定
利用引物(P1+P2)对步骤1获得的两种MSC细胞(HGPS-MSC和cHGPS-MSC)的基因组分别进行PCR,获得纯化的PCR产物进行测序。结果显示,HGPS-MSC携带HGPS特异的突变(C1824T),而在cHGPS-MSC该突变已经被矫正(见图1中B)。
P1:5’-TACAAGCTTGCTCCCGTTCTCTCTTCTTTTCCTCTTAAGCT-3’;
P2:5’-GAAGGGAGGTAGCATCTCCCCCATCCCTCACACTC-3’。
进一步,通过实时荧光定量RT-PCR(引物P3+P4)检测步骤1获得的两种MSC细胞(HGPS-MSC和cHGPS-MSC)中Progerin基因的表达情况,内参为18S rRNA,引物序列为18S-F和18S-R。结果显示,HGPS-MSC相较于cHGPS-MSC大幅高表达Progerin(见图1中C)。HGPS病人特异间充质干细胞中含有过量的Progerin毒蛋白符合HGPS病人细胞模型的特征。
P3:5’-GCGTCAGGAGCCCTGAGC-3’;
P4:5’-GACGCAGGAAGCCTCCAC-3’。
18S-F:5’-GTAACCCGTTGAACCCCATT-3’;
18S-R:5’-CCATCCAATCGGTAGTAGCG-3’。
其中,引物序列P3和P4来源于已发表文献,已被认可,其出处为“Liu,G.H.,Barkho,B.Z.,Ruiz,S.,Diep,D.,Qu,J.,Yang,S.L.,Panopoulos,A.D.,Suzuki,K.,Kurian,L.,Walsh,C.,et al.(2011a).Recapitulation of premature ageing with iPSCs from Hutchinson-Gilford progeria syndrome.Nature 472,221-225.”一文。
(2)衰老相关β-半乳糖苷酶染色鉴定
细胞衰老β-半乳糖苷酶染色是一种基于衰老时衰老相关β-半乳糖苷酶染色(senescence-associated beta-galactosidase)活性水平上调而对衰老细胞或组织进行染色检测的方法。
分别以步骤1获得的HGPS-MSC细胞和cHGPS-MSC细胞为供试细胞(第5代),吸去6孔板中培养的供试细胞的细胞培养液,用PBS洗涤1次,再加入染色固定液(4%多聚甲醛),室温固定15分钟。弃去固定液,用PBS洗涤1次,每孔加入1ml染色工作液。以X-Gal为底物,在衰老特异性的β-半乳糖苷酶催化下会生成深蓝色产物。在普通的光学显微镜下就可以观测到细胞或组织的衰老情况,并进一步对两组细胞中的衰老相关β-半乳糖苷酶染色染色阳性细胞比率进行定量统计分析。
结果如图2中A所示,HGPS-MSC组的衰老相关β-半乳糖苷酶染色染色阳性细胞比率(51.6±6.1%)显著高于cHGPS-MSC组的衰老相关β-半乳糖苷酶染色染色阳性细胞比率(36.0±6.2%)(P<0.05)。可见,HGPS-MSC细胞表现出严重衰老的症状。
(3)HGPS病人特异间充质干细胞中细胞核结构受损情况鉴定
利用免疫荧光技术标记间充质干细胞中核膜特异蛋白,用以评价细胞核膜的完整性。具体步骤如下:将培养于盖玻片上的供试细胞(HGPS-MSC和cHGPS-MSC)用4%的多聚甲醛室温固定30分钟,PBS漂洗(3次,5分钟/次)后,使用含有0.4%(体积百分含量)Triton X-100的PBS室温孵育30分钟,继而换用10%(体积百分含量)驴血清(Jackson ImmunoResearch Laboratories,Inc.货号:017-000-121)室温封闭1小时。之后分别换用添加一抗(anti-LaminB1,兔源,abcam公司,ab16048);anti-LAP2 alpha,兔源,abcam公司,ab5162)的封闭液于4℃孵育过夜。PBS漂洗(3次,5分钟/次)后,然后加入对应二抗(anti-LaminB1:Alexa555标记的驴抗兔抗体,Invitrogen公司,货号为A-31572;anti-LAP2 alpha:Alexa488标记的驴抗兔抗体,Invitrogen公司,货号为A-21206),室温孵育1小时。PBS漂洗(3次,5分钟/次)后,用工作浓度为2g/ml的Hoechst 33258(Invitrogen,货号:H3569)室温孵育15分钟,最后封片和观察。
结果显示:HGPS病人特异间充质干细胞(HGPS-MSC)中核膜特异蛋白LaminB1和LAP2标记的细胞核膜均出现异常,表现为荧光强度降低且核膜出现缺损(如图2中B所示),经过统计发现,HGPS-MSC中由核膜相关蛋白LAP2和LaminB1免疫荧光染色所标示的核膜异常的细胞核数量分别为cHGPS-MSC原有的39.0±2.4%和63.8±1.6%,表明HGPS病人特异间充质干细胞(HGPS-MSC)中细胞核结构受到损伤。
(4)体内移植能力检测
使用表达荧光素酶的慢病毒载体病毒(辉骏生物,货号为FT124)感染步骤1获得的HGPS-MSC细胞和cHGPS-MSC,感染滴度为109慢病毒载体感染5×105细胞,具体步骤为:首先按5×105/孔将细胞接种于六孔板中,8-12小时后换液培养,换液1小时后将109慢病毒载体加入培养基中,轻微晃动混匀,随后继续培养12小时后换液,换液36小时后,即病毒感染48小时后收集细胞并重悬于含有5%葡萄糖的PBS中,细胞密度为106/50μl,随后将病毒感染的cHGPS-MSC细胞悬液注射入NOD/SCID免疫缺陷小鼠(北京维通利华实验动物技术有限公司)左腿胫骨前肌中,将病毒感染的HGPS-MSC细胞悬液注射入NOD/SCID免疫缺陷小鼠(北京维通利华实验动物技术有限公司)右腿胫骨前肌中,每次注射体积为50μl。细胞移植5天后用小动物成像系统(IVIS Spectrum Pre-clinical In Vivo Imaging System)进行检测。具体做法如下:首先麻醉动物,然后腹腔注射300μg/ml的荧光素底物200μL/只小鼠。15分钟后,小鼠放入仪器,自动收集荧光素酶的荧光信号,通过同一只动物的左右腿的信号值评价细胞存活能力。细胞存活越多,则荧光信号越强,由于本实验将两组MSC分别移植到小鼠的左右腿,因此通过比较左右的荧光信号值,就可以判断哪一组MSC具有更强的体内存活能力,随着动物数量的增加,就可以完成数值统计,判断两组MSC是否存在统计学差异。
结果显示:HGPS-MSC体内移植后存活细胞产生的荧光值为cHGPS-MSC的29.3±15.4%。图2中C为荧光信号直观结果图;图3中C中柱形图的左侧图为对图2中C的荧光信号值的统计结果。
以上结果充分表明,步骤1构建的HGPS-MSC细胞能够表现出典型的儿童早衰症的症状。
实施例2、利用HGPS-MSC筛选抗衰老表型的小分子化合物
本发明的发明人在培养实施例1制备的HGPS-MSC时,建立了针对抗衰老表型的小分子化合物的筛选方法,发现奥替普拉(Oltipraz)可以逆转HGPS-MSC的衰老表型。具体如下:
将HGPS-MSC细胞以5×104每孔铺于六孔板中,细胞贴壁的第二天开始,在实验组加入含25μM的奥替普拉(Oltipraz)培养基继续培养(同时设置未经奥替普拉处理的HGPS-MSC细胞作为对照),连续培养21,期间经历三次细胞传代,随后对经所述奥替普拉(Oltipraz)处理的HGPS-MSC以及对照进行以下分析:
(1)衰老相关β-半乳糖苷酶染色
具体方法参照实施例1步骤2(2)进行。
结果如图3中A所示,相比于对照,在HGPS-MSC细胞培养体系中添加奥替普拉可以使β-半乳糖苷酶染色阳性的细胞比例降低到44.1±15.1%。
(2)免疫荧光检测细胞核膜分子标志物
具体方法参照实施例1步骤2(3)进行。LAP2和Lamin B1免疫荧光染色信号越强,同时标示的细胞核膜越完整,则说明细胞核膜完整性更高,因此如果两组细胞的LAP2和Lamin B1染色标示的细胞核膜完整性有显著差异,就可以判断药物处理可以逆转HGPS-MSC的核膜异常的衰老表型。
结果显示,相较于HGPS-MSC且不添加奥替普拉对照组,添加了奥替普拉的实验组中由LAP2和Lamin B1染色标示的具有完整核膜的细胞核数量分别增加3.3±0.2和1.3±0.1倍(图3中B)。
(3)体内移植检测
具体方法参照实施例1步骤2(4)进行,不同之处在于将感染了表达荧光素酶的慢病毒载体病毒的经过奥替普拉处理的HGPS-MSC细胞注射入免疫缺陷小鼠右腿的胫骨前肌中,将感染了表达荧光素酶的慢病毒载体病毒的未经过奥替普拉处理的HGPS-MSC细胞注射入免疫缺陷小鼠左腿的胫骨前肌中。
结果显示,对于HGPS-MSC且不添加奥替普拉对照组,添加了奥替普拉的实验组体内移植后细胞的存活能力增强2.8±1.1倍(图3中C)。
本实施例的结果说明,奥替普拉能够降低HGPS-MSCs中β-半乳糖苷酶染色阳性的细胞比例、上调HGPS-MSCs中核膜相关蛋白LAP2和/或LaminB1的表达量,并提高HGPS-MSCs在体内的存活能力,即奥替普拉能够改善HGPS-MSCs的衰老表型,对延缓或逆转人类儿童早衰症衰老表型具有重要作用。
- 还没有人留言评论。精彩留言会获得点赞!