依普利酮口服固体制剂及其制备方法与流程
本发明属于医药技术领域,更具体的说,涉及一种依普利酮口服固体制剂及其制备方法。
背景技术:
依普利酮(eplerenone),化学名为(7α,11α,17α)-9,11-环氧-17-羟基-3-氧代-孕甾-4-烯-7,21-二羧酸,γ-内酯,7-甲酯,其化学结构式如(1)所示:
依普利酮是一种口服高选择性醛固酮受体拮抗剂(sab),它可以阻断肾素-血管紧张素-醛固酮系统(raas)的作用,通过竞争性抑制醛固酮与盐皮质激素受体结合,拮抗醛固酮与上皮(如肾脏)和非上皮(如心脏、血管和脑)组织中的盐皮质激素受体结合,在调节人体心血管系统功能时发挥着重要作用。因此依普利酮能有效的控制高血压,减轻心、脑和肾等靶器官的损害,改善ii型糖尿病患者微量蛋白尿,而且其副作用发生率与安慰剂相似,耐受良好。对于高血压患者控制高血压、预防与靶器官损害相关的心血管疾病、改善高血压患者的预后等方同均具有重要意义。
依普利酮分子不含电离结构,且在水中几乎不溶,依普利酮生物药剂学分类为bcsiii类。依普利酮具有难溶于水,低渗透性的特点。采用常规制剂工艺手段制得的固体制剂的口服生物利用度低,为提高依普利酮片剂的溶出度和生物利用度,cn1230179c和us20030215518a1公开了微粉化依普利酮药物组合物、ep1527782a1公开了使用微粉化依普利酮制成片剂和胶囊。通过微粉化药物的方法,虽然能在一定程度上提高其体外溶出度和体内生物利用度,但由于微粉化后物料的粉体特性会有较大的改变,对制剂工艺要求更高,生产成本和物料控制成本较高。
us2003236236a1和cn101152187a公开了通过加入表面活性剂,包括聚山梨酷、聚氧乙烯脂肪酸醋、脂肪酸山梨坦、泊洛沙姆,来增加难溶性药物的方法,虽然其溶出度和生物利用度获得提高,但是相对于易被水湿润的药物,加入表面活性剂,不必要地降低了液体的表面张力,不利于水分透入和片剂崩解。
技术实现要素:
针对上述现有技术的不足,本发明人研发了一种快速、高溶出度的依普利酮口服固体制剂,本发明可以大大提高活性成分(api)的溶解性,在制剂处方中不需要添加表面活性剂,同时api也不需要进行微粉化处理。本发明制剂在体外ph1.0-6.8的介质中10分钟溶出度可达到90%以上。
本发明的目的是提供一种快速、高溶出度的依普利酮口服固体制剂。
本发明的另一个目的是提供上述口服固体制剂的制备方法。
具体的说,在本发明的实施方案中,本发明提供了一种高溶出度依普利酮口服固体制剂,其包含依普利酮-聚乙烯吡咯烷酮复合物。
在本发明的实施方案中,本发明提供的高溶出度依普利酮口服固体制剂为普通片、分散片、胶囊、口腔崩解片、颗粒剂、或散剂,优选地为普通片,分散片或胶囊。
在本发明的实施方案中,本发明提供的依普利酮口服固体制剂,其中,所述依普利酮-聚乙烯吡咯烷酮复合物是通过如下方式制备的:
a将聚乙烯吡咯烷酮溶于乙醇或丙酮中,加入依普利酮,加热溶解,得到澄清的溶液;
b将上述的澄清溶液采用流化床喷雾干燥一步制粒即得。
在本发明的实施方案中,本发明提供的依普利酮口服固体制剂,所述依普利酮-聚乙烯吡咯烷酮复合物的制备方法,步骤a中加热的温度为40-80℃,优选为50-70℃,更优选为50-60℃。
在本发明的实施方案中,本发明提供的依普利酮口服固体制剂,所述依普利酮-聚乙烯吡咯烷酮复合物的制备方法,步骤a中聚乙烯吡咯烷酮与乙醇或丙酮的重量比为1∶30~1∶1,优选为1∶20~1∶2,更优选为1∶10~1∶3,依普利酮与乙醇或丙酮的重量比为1∶30~1∶1,优选为1∶25~1∶2,更优选为1∶20~1∶5;依普利酮与聚乙烯吡咯烷酮的重量比为1∶10~1∶0.1,优选为1∶5~1∶0.5,更优选为1∶3~1∶0.8。
在本发明的实施方案中,本发明提供的依普利酮口服固体制剂,所述依普利酮-聚乙烯吡咯烷酮复合物的制备方法,步骤b中流化床喷雾干燥一步制粒为:设置流化床的风机频率5~20hz,进风温度35~75℃,物料温度控制25~70℃,雾化压力0.1~0.3mpa,将依普利酮-聚乙烯吡咯烷酮的乙醇溶液通过蠕动泵喷入流化床内,喷液速度1~10g/min,待该乙醇溶液喷完后,继续流化状态干燥0.5~4小时,即得依普利酮-聚乙烯吡咯烷酮复合物。
在本发明的实施方案中,本发明提供的依普利酮口服固体制剂,除了包含依普利酮复合物外,还可以包括下列辅料中的一种或两种以上:选自填充剂、粘合剂、崩解剂、润滑剂。
在本发明的实施方案中,本发明提供的依普利酮口服固体制剂,其中,所述的填充剂可选自乳糖、微晶纤维素、预胶化淀粉、淀粉、甘露醇、木糖醇、或磷酸氢钙,优选为乳糖、微晶纤维素、或预胶化淀粉。所述填充剂的用量为10重量%~90重量%,优选为30重量%~60重量%,这里所述的重量百分比是指与所述口服固体制剂最终产品重量百分比。
在本发明的实施方案中,本发明提供的依普利酮口服固体制剂,其中,所述的粘合剂可选自羟丙基纤维素、羟丙甲纤维素、聚乙烯吡咯烷酮、明胶、或阿拉伯胶,优选为羟丙基纤维素、羟丙甲纤维素、或聚乙烯吡咯烷酮。所述粘合剂的用量为0.5~8重量%,优选为1~5重量%。
在本发明的实施方案中,本发明提供的依普利酮口服固体制剂,其中,所述的崩解剂选自交联羧甲基纤维素钠、羧甲基淀粉钠、低取代羟丙基纤维素、或交联聚乙烯吡咯烷酮,优选为交联羧甲基纤维素钠、或低取代羟丙基纤维素。所述崩解剂的用量为2重量%~15重量%,优选为5重量%~10重量%。
在本发明的实施方案中,本发明提供的依普利酮口服固体制剂,其中,所述的润滑剂选自硬脂酸镁、富马酸硬脂酸钠、二氧化硅、十二烷基硫酸钠、聚乙二醇、硬脂酸、滑石粉,优选为硬脂酸镁、富马酸硬脂酸钠、二氧化硅。所述润滑剂的用量为0.1~5重量%,优选为0.5~3重量%。
另一方面,本发明提供了上述依普利酮口服固体制剂的制备方法,该方法包括:
(1)将依普利酮-聚乙烯吡咯烷酮复合物与填充剂、崩解剂、或润滑剂等混合,研磨过筛;
(2)干燥,然后压片,或填充胶囊。
在本发明的一种实施方案中,本发明提供的一种依普利酮口服固体制剂为分散片或口腔崩解片,其中,组分和用量如下:
组分和含量:
其中,依普利酮-聚乙烯吡咯烷酮复合物的制备方法:
a.将聚乙烯吡咯烷酮溶于乙醇中,加入依普利酮,加热下搅拌至溶解;
b.将步骤a的溶液采用流化床喷雾干燥一步制粒;
所述分散片或口腔崩解片的制备方法包括:
(1)将喷雾制粒得到的依普利酮-聚乙烯吡咯烷酮复合物固体分散体粉末与乳糖、微晶纤维素,交联羧甲基纤维素钠研磨,过40目筛混合,加入硬脂酸镁混合均匀;
(2)将混合后的粉末置于55℃烘箱中烘至干燥失重小于2%时,取出过40目筛,压片,片子硬度5-10kg,片重约180mg。
在本发明的一种实施方案中,本发明提供的一种依普利酮口服固体制剂为胶囊剂,其中,组分和用量如下:
组分和用量:
其中,依普利酮-聚乙烯吡咯烷酮复合物的制备方法:
a.将聚乙烯吡咯烷酮溶于乙醇中,加入依普利酮,加热下搅拌至溶解;
b.将步骤a的溶液采用流化床喷雾干燥一步制粒;
所述胶囊剂的制备方法包括:
(1)将喷雾制粒得到的依普利酮-聚乙烯吡咯烷酮复合物固体分散体粉末与乳糖、微晶纤维素,交联羧甲基纤维素钠、二氧化硅研磨,过40目筛混合;
(2)将混合后的粉末置于60℃烘箱中烘至干燥失重小于2%时,取出过40目筛,灌装胶囊,每粒胶囊内容物重量约170mg。
与现有技术相比,本发明的有益技术效果体现在采用聚乙烯吡咯烷酮pvp和依普利酮api在乙醇中溶解后采用一步造粒的方法将依普利酮api均匀分散于pvp骨架中,依普利酮api采用一步造粒时其晶体的表现形式为无定型,制成无定型的多孔松散状的依普利酮均匀分布于pvp骨架,从而使得依普利酮api的理化性质发生重大改变,使其在水及ph1.0-6.8的水性介质中的溶解度及溶出度大幅度提高,从而达到优异的制剂技术效果。
经过本法制备的固体制剂10分钟溶出可达90%以上。在隔水包装的情况下,加速40℃,rh75%条件下6个月测试本制备方法下的制剂的溶出度水平维持不变,显示出良好的稳定性。
附图说明
图1表示的是本发明实施例1、2和3的溶出度曲线图。
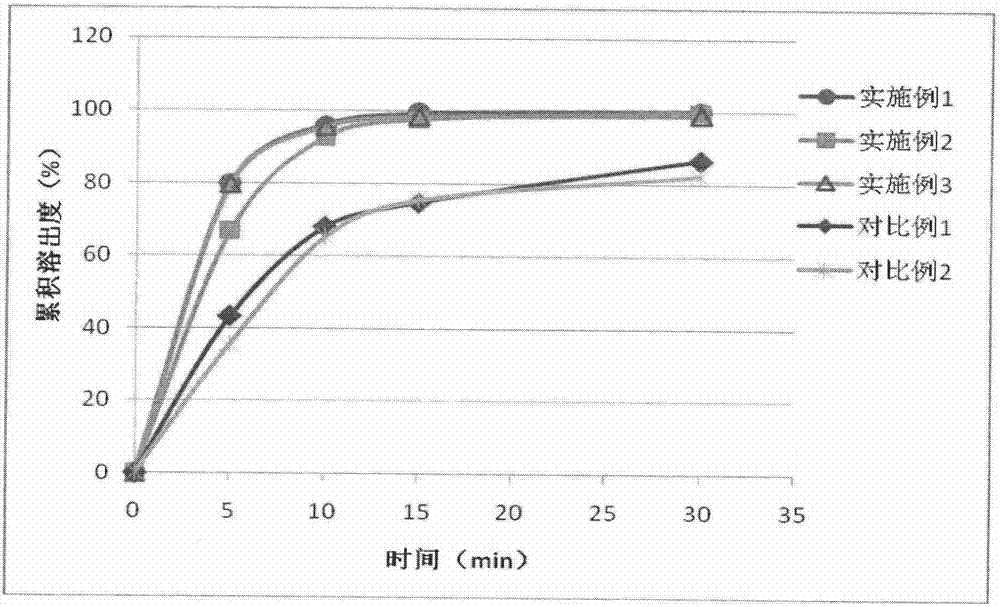
图2表示的是本发明实施例1-3与对比例1-2的溶出度曲线对比。
图3表示的是本发明实施例1-3、对比例1-2加速6月的溶出度曲线变化图。
具体实施方式
下面通过实施例来进一步描述本发明。对于本领域技术人员而言,根据本发明的教导,采用现有技术对下列实施例进行等同替换式改进仍属于本发明的保护范围。
实施例1
依普利酮分散片或口腔崩解片
处方:
制备方法:
其中,依普利酮-聚乙烯吡咯烷酮复合物的制备方法:
a.将聚乙烯吡咯烷酮溶于乙醇中,加入依普利酮,加热下搅拌至溶解;
b.将步骤a的溶液采用流化床喷雾干燥一步制粒;
所述分散片或胶囊的制备方法包括:
(1)将喷雾制粒得到的依普利酮-聚乙烯吡咯烷酮复合物固体分散体粉末与乳糖、微晶纤维素,交联羧甲基纤维素钠研磨,过40目筛混合,加入硬脂酸镁混合均匀;
(2)将混合后的粉末置于55℃烘箱中烘至干燥失重小于2%时,取出过40目筛,压片,片子硬度5-10kg,片重约180mg。
实施例2
依普利酮胶囊
组分和用量:
其中,依普利酮-聚乙烯吡咯烷酮复合物的制备方法:
a.将聚乙烯吡咯烷酮溶于乙醇中,加入依普利酮,加热下搅拌至溶解;
b.将步骤a的溶液采用流化床喷雾干燥一步制粒;
所述胶囊剂的制备方法包括:
(1)将喷雾制粒得到的依普利酮-聚乙烯吡咯烷酮复合物固体分散体粉末与乳糖、微晶纤维素,交联羧甲基纤维素钠、二氧化硅研磨,过40目筛混合;
(2)将混合后的粉末置于60℃烘箱中烘至干燥失重小于2%时,取出过40目筛,灌装胶囊,每粒胶囊内容物重量约170mg。
实施例3
依普利酮片
处方:
制备方法:
其中,依普利酮-聚乙烯吡咯烷酮复合物的制备方法:
a.将聚乙烯吡咯烷酮溶于乙醇中,加入依普利酮,加热下搅拌至溶解;
b.将步骤a的溶液采用流化床喷雾干燥一步制粒;
所述片剂的制备方法包括:
(1)将喷雾制粒得到的依普利酮-聚乙烯吡咯烷酮复合物固体分散体粉末与乳糖、微晶纤维素,羟丙基纤维素混合均匀,加入乙醇制软材,软材过40目筛制湿颗粒
(2)将湿颗粒置于55℃烘箱中烘至干燥失重小于2%时,取出,过40目筛整粒;
(3)将交联羧甲基纤维素钠、硬脂酸镁加入干颗粒中,混合均匀,压片,片子硬度5-10kg,片重约180mg。
对比例1:
采用cn1230179c公开的“微粒化依普利酮组合物”的制备方法制备依普利酮片。
处方:
制备方法:
1.将微粉化后的依普利酮(d90≈60μm)与乳糖一水合物、微晶纤维素、羟丙甲纤维素、十二烷基硫酸钠混合均匀,加水制软材,软材过40目筛网制湿颗粒;
2.将湿颗粒置55℃烘箱中烘至干燥失重小于2%时,取出,过40目筛整粒。
3.将交联羧甲基纤维素钠、滑石粉、硬脂酸镁加入干颗粒中,混合均匀,压片,片子硬度5-10kg,片重约170mg。
对比例2:
采用cn101152187a公开的“依普利酮药物组合物”的制备方法制备依普利酮片。
处方:
制备方法:
1.将上述辅料分别粉碎过100目筛;
2.将依普利酮、甘露醇、微晶纤维素、低取代羟丙基纤维素、泊洛沙姆338充分混合均匀,加入适量聚乙烯吡咯烷酮水溶液制成软材,20目筛制粒;
3.将湿颗粒置55℃烘箱中烘至干燥失重小于2%时,取出,20目筛整粒;
4.将交联聚乙烯吡咯烷酮和硬脂酸镁加入干颗粒中,混合均匀,压片,片子硬度8-15kg,片重约250mg。
试验例1
溶出度评价的测定条件及方法
介质:0.1m盐酸溶液;介质温度:37±0.5℃;浆法;
转速:50r/min;
观察点:5分钟、10分钟、15分钟、30分钟时间点的对应溶出度;
上述各处方工艺制得的制剂溶出度测定结果表
结果显示:采用实施例1-3制剂方案制备的固体制剂所达到的溶出度效果在5分钟、10分钟、15分钟三个时间点明显高于对比例1-2方法所制备的制剂,具有优异的溶出度效果。
试验例2:
实施例1-3的片剂或胶囊、对比例1-2的片剂在40℃加速6个月后溶出度测定结果:
结果显示:采用实施例1-3的制剂方案制备的固体制剂,在加速试验条件下放置6个月,溶出度测定在5分钟、10分钟、15分钟、30分钟各个时间点没有明显变化,稳定性良好。对比例1、2的固体制剂在加速试验条件下放置6个月,溶出度在各个时间点均出现了下降,其中对比例2制剂的下降趋势较明显。
由于依普利酮生物药剂学分类为bcsiii类。依普利酮具有难溶于水,低渗透性的特点,因此,本发明的制剂克服了原料药难溶于水的特性,采用发明方法制得的制剂具有优异的溶出度效果和良好的稳定性,有效地解决了api的溶解度低的特性导致生物利用度低的问题。
- 还没有人留言评论。精彩留言会获得点赞!