一种调节脂解和脂肪酸氧化代谢的方法与流程
本发明属生物制药领域,具体涉及一种调节脂解和脂肪酸氧化代谢的方法和用途。
背景技术:
甘油三酯(TG)是哺乳动物细胞能量储存的主要形式。当能量摄入超过能量消耗,多余的能量将会以甘油三酯的形式储存于脂肪细胞以及含有脂肪细胞的组织和肝脏等器官中,长期以来会最终导致脂肪细胞能量积累以及肥胖。动物脂肪细胞的脂解是个复杂过程,其受各种激素和生理信号共同调控,这种调控的失衡可导致肥胖和相关疾病。脂肪细胞中甘油三酯的降解是一个精细的调节过程,与维持细胞或者机体能量的动态平衡和代谢健康密切相关。脂解活性降低可促进脂肪组织甘油三酯的积累,过度脂解可能导致脂肪营养障碍综合征,脂肪组织甘油三酯的降低或重新分配,导致循环脂肪酸浓度高和甘油三酯的异位贮存。甘油三酯的脂解作用至少被三种酶催化:脂肪细胞甘油三酯酶(ATGL)主要催化甘油三酯的第一个酯键水解,产生的二酰基甘油被激素敏感酯酶(HSL)催化产生单酰基甘油,单酰基甘油被单酰基甘油酯酶(MGL)催化(Jaworski K等人,2007,Am J Physiol Gastrointest Liver Physiol 293:1-4)。脂肪细胞中ATGL和HSL是最重要的脂解酶,共同控制小鼠白色脂肪组织中甘油三酯95%的水解活性(Schweiger M等人,2006,J Biol Chem 281:40236-40241)。脂解生成的脂肪酸可释放入血,与白蛋白结合形成脂酸白蛋白运输至其它组织被利用。脂肪酸的分解是以氧化的形式进行的,而氧化的方式有α-氧化,β-氧化和ω-氧化,其中β-氧化是主要的方式。
HSL作为经典脂肪分解限速酶,作用底物几乎包括了除磷脂以外大多数酯,包括甘油三酯、二酰基甘油、单酰基甘油、胆固醇酯和视黄酯,其被认为是脂解作用调控酶,水解甘油三酯产生单酰基甘油,单酰基甘油在其水解酶作用下彻底水解。磷酸化的HSL是其活性形式,其激活依赖于cAMP-PKA途径。HSL基因敲除鼠并未表现出肥胖,并且其脂肪组织具有甘油三酯水解活性(Fortier M等人,2004,Am J Physiol Endocrinol Metab 287:282-288;Haemmerle G等人,2002,J Biol Chem 277:4806-4815)。水解产物二酰基甘油在白色脂肪组织、棕色脂肪组织、肌肉和睾丸中积累(Haemmerle G等人,2002,J Biol Chem 277:4806-4815)。这些结果表明,HSL是脂肪组织和肌肉中二酰基甘油水解的限速酶。脂解反应发生时,ATGL催化的反应对TG第一个脂肪酸的水解具有专一性,并产生DG,DG的利用依赖于细胞的代谢状态(Lass A等人,2006,Cell Metabolism 3(5):309-31)。在需能的情况下,儿茶酚胺与β-肾上腺素受体结合,G蛋白介导的信号活化腺苷酸环化酶。高水平的环腺苷酸(cAMP)活化PKA,PKA进一步磷酸化HSL和Perilipin A。磷酸化的Perilipin A通过改变构象促进磷酸化HSL从胞液易位至脂滴表面,磷酸化的HSL靠近磷酸化的Perilipin A,能与脂肪滴中的TG和DG底物结合。DG进一步被HSL水解为单酰基甘油(MG)和脂肪酸(FA),MG在单酰甘油酯酶作用下水解为甘油和FA,脂肪酸和甘油离开脂肪细胞并进入循环。大量研究表明,营养和激素等因子调控着脂肪组织中脂肪的降解(Jaworski K等人,2007,Am J Physiol Gastrointest Liver Physiol 293:1-4;Lass A等人,2006,Cell Metabolism 3(5):309-31)。在饲喂状态下,胰岛素通过引起HSL脱磷酸化和磷酸二酯酶活化,降低cAMP水平,进而抑制脂解(Carmen GY等人,2006,Cell Signal 18:401-408;Langin D等人,2006,Pharmacol Res 53(6):482-491)。
过氧化物酶体增殖物激活受体(PPARs)作为一种核受体,可调控多种核内基因的表达,其编码的蛋白质和其他的核受体具有相似的功能区和结构区。现已发现PPARs存在三种不同的亚型,分别命名为PPARα、PPAPβ以及PPARγ。该三种亚型的结构相似,但组织分布具有差异性,其中PPARα亚型主要分布在脂肪酸氧化率较高的心脏、肝脏、肾脏和骨骼肌细胞中(Issemann I等人,1990,Nature 347(6294):645-650)。PPARα对脂肪酸代谢具有重要调控作用,可促进细胞对脂肪酸的摄取、转运、活化和β氧化。PPARα及其激动剂具有消除脂代谢障碍、改善胰岛素抵抗和逆转心肌肥厚等作用,具有保护心血管的作用。活化后的PPARα后与PPRE相结合,可激活乙酰辅酶A合成酶和脂肪酸转运蛋白的表达,并活化肉毒碱酯酰转移酶-1(CPT-1),提高脂肪酸摄取、转运和氧化等方面的效率,进而促进脂肪酸的β氧化,提高脂代谢,为机体提供更多能量。PPARα基因缺失的小鼠出现肥胖及脂肪细胞变大等表型(Costet P等人,1998,J Biol Chem 273(45):29577-29585;Knauf C等人,2006,Endocrinology 147:4067-4078)。
细胞脂代谢异常是导致肥胖、非酒精性脂肪肝等代谢综合症的主要病理因素。无论在发达国家还是发展中国家,肥胖的流行正在全世界范围内迅速增长。因此,针对脂代谢过程中的关键转录因子或者催化酶,有效促进甘油三酯的脂解过程,提高脂肪酸的氧化速度,将是治疗肥胖症及其相关疾病的重要靶点之一和治疗关键及难点。
FADD(Fas-associated death domain protein,Fas相关死亡结构域蛋白)细胞凋亡信号通路中的重要衔接蛋白,介导Fas及其它死亡受体引起的凋亡信号通路。1995年,Dixit和Wallach两个研究小组利用酵母双杂交系统,几乎同时发现了人和小鼠FADD/MORT1基因(Chinnaiyan AM等人,1995,Cell 81(4):505-512;Boldin MP等人,1995,J Biol Chem 270(14):7795-7798)。人源的FADD基因约3.6kb,包含两个外显子(分别为286bp和341bp)和一段2kb的相隔其间的内含子。该基因位于11号染色体的长臂上(11q13.3)(Kim PK等人,1996,J Immunol 157(12):5461-5466),FADD与同位于11q13的1型糖尿病易感位点(IDDM4)共定位(Eckenrode S等人,2000,Hum Genet 106(1):14-18;Nakagawa Y等人,1998,Am J Hum Genet 63(2):547-556),因此,FADD基因的突变可能会影响胰岛素依赖的糖尿病的发生。人和小鼠FADD基因分别编码208个和205个氨基酸组成的FADD蛋白。人和小鼠FADD蛋白68%氨基酸残基完全相同,在蛋白质的一级结构上同源程度高达80%。人和小鼠FADD蛋白均分别包括3个结构域:死亡结构域(death domain,DD),死亡效应结构域(death effect domain,DED),和C-末端结构域(C-terminal domain,CTD)。死亡效应结构域DED由约76个氨基酸残基组成,靠近N-末端,可寡聚化并通过疏水作用招募含DED的蛋白,共同组成死亡诱导信号复合物(death inducing signal complex,DISC),从而向下游传导死亡受体介导的凋亡信号。死亡结构域DD由约70个氨基酸残基组成,靠近C-末端并与CTD结构域部分重叠,可与Fas的DD结构域相互作用,接受凋亡信号。C-末端结构域CTD由约20个氨基酸残基组成,含有易于磷酸化的Ser和Thr残基,可能与FADD介导的细胞的非凋亡功能相关(Hua ZC等人,2003,Immunity 18:513-521)。
将蛋白质中易于磷酸化的Ser和Thr残基突变成为天冬氨酸或者谷氨酸是国际上已经广泛认可和使用的研究蛋白质磷酸化的方法。如Kim Y等人在其研究中将WAVE1蛋白310位的丝氨酸突变成为天冬氨酸来模拟其磷酸化状态(Kim Y 等人,2006,Nature 442(7104):814-817);Paroo Z等人在其研究中将TRBP蛋白142、152、283、286位的丝氨酸突变为天冬氨酸来模拟其磷酸化状态(Paroo Z等人,2009,Cell 139:112-122);Papinski D等人在其研究中将Atg9蛋白丝氨酸残基(S802,S831,S948和S969)突变成天冬氨酸来模拟其磷酸化状态(Papinski D等人,2014,Mol Cell 53(3):471-483);Bajorek M等人在其研究中将RSV基质蛋白220位的丝氨酸突变为天冬氨酸来模拟其磷酸化状态(Bajorek M等人,2014,J Virol 88(11):6380-6393);Pozo-Guisado E等人在其研究中将STIM1蛋白575,608和621位的丝氨酸替换为谷氨酸来模拟其磷酸化(Pozo-Guisado E等人,2013,J Cell Sci 126(Pt 14):3170-3180);Bin L等人在其研究TnI蛋白时将144位的苏氨酸突变成天冬氨酸、谷氨酸来模拟其磷酸化(Liu B等人,2014,PLoS One 9(1):e86279)。用天冬氨酸或者谷氨酸模拟丝氨酸磷酸化,无论在电荷上、还是在碳链长度上、或是在功能上,许多实验都已证明天冬氨酸或者谷氨酸完全可以与丝氨酸磷酸化相一致。因此,将FADD蛋白191位丝氨酸突变成为天冬氨酸来研究其磷酸化功能是一种常规的、可行的方法。
到目前为止,已发现的可能调控FADD磷酸化状态的激酶有37kD大小的CKIα蛋白(Alappat EC等人,2005,Mol Cell 19:321-332)及130kD大小的FIST-HIPK3蛋白(Rochat-Steiner V等人,2000,J Exp Med 192:1165-1174)等,磷酸酶有AK2蛋白(Kim H等人,2014,Nat Commun 5:3351)。这些调控FADD磷酸化状态的靶点是已知的、已广为研究的,利用常规的分子设计方法进行这些酶的底物类似物的分子设计、化学合成及活性评价,通过调节上述酶的活性、便可很容易获得具有调控FADD磷酸化状态功能的物质。基于这些理念,早在2010年国际上就已有高通量筛选调控FADD磷酸化的化合物的方法,这些方法已被证明是可大规模进行重复筛选的,是常规的、可行的(Khan AP等人,2010,J Biomol Screen 15(9):1063-1070)。因此,对于筛选调控FADD磷酸化状态的物质而言,无论在相应的靶点蛋白、还是高通量筛选方法,这些技术方法都是完全可行的,能够为本领域技术人员所容易熟练掌握的。
技术实现要素:
本发明的目的是提供一种调节细胞脂解和脂肪酸氧化代谢的方法,其特征在于:表达模拟Fas相关死亡结构域蛋白磷酸化的基因,或者以Fas相关死亡结构域蛋白磷酸化程度为指证筛选提高Fas相关死亡结构域蛋白磷酸化的物质,上述方法的共同目的是提高Fas相关死亡结构域蛋白的磷酸化。
进一步的,一种调节细胞脂解和脂肪酸氧化代谢的方法,其特征在于:调节增加细胞内cAMP浓度,提高激素敏感酯酶HSL的磷酸化程度及活性;调节PPARα转录活性,提高参与脂肪酸β氧化过程的酶的活性,包括过氧化物酶酰基辅酶A氧化酶1(Acox1)、三羟酰辅酶A脱氢酶(Ehhadh)、极长链酰基辅酶A脱氢酶(Acadvl)、长链酰基辅酶A脱氢酶(Acadl)和中链酰基辅酶A脱氢酶(Acadm)。
进一步的,一种调节脂解和脂肪酸氧化代谢的方法在制备治疗脂代谢紊乱疾病药物中的应用。
进一步的,上述调节脂解和脂肪酸氧化代谢的方法在制备治疗脂代谢疾病药物中的应用,与现有脂代谢紊乱疾病治疗药物和技术的联合应用。
进一步的,一种药物组合物,其特征在于:围绕一种调节脂解和脂肪酸氧化代谢的方法、利用药学上常规的载体或赋形剂或稀释剂进行的组合配方。
进一步的,一种调节脂解和脂肪酸氧化代谢的方法在制备治疗脂代谢紊乱疾病药物中的应用。
在本发明的第一方面,提供了一种调节脂解和脂肪酸氧化代谢的方法,其特征在于通过调节Fas相关死亡结构域蛋白的磷酸化,从而实现对脂解和脂肪酸氧化代谢的调节。
所述调节脂解和脂肪酸氧化代谢的方法,不仅能够提高激素敏感酯酶HSL的磷酸化程度及活性,增强PPARα转录活性,而且能够提高参与脂肪酸β氧化过程的酶的活性。
在本发明的第二方面,提供了一种通过筛选能够提高Fas相关死亡结构域蛋白的磷酸化的物质的方法,其特征是以Fas相关死亡结构域蛋白磷酸化程度的变化为指证筛选能够提高Fas相关死亡结构域蛋白磷酸化的物质,从而实现对脂解和脂肪酸氧化代谢的调节。
所述的一种通过筛选能够提高Fas相关死亡结构域蛋白的磷酸化的物质的方法,其特征是以调控Fas相关死亡结构域蛋白磷酸化的已知的调控蛋白质为靶点,通过设计、合成或者通过常规方法筛选能够调控Fas相关死亡结构域蛋白磷酸化程度的物质,筛选过程中以Fas相关死亡结构域蛋白磷酸化程度的变化为筛选指证。
所述的能够提高Fas相关死亡结构域蛋白磷酸化的物质,包括了能够提高Fas相关死亡结构域蛋白磷酸化水平的大分子物质,例如,蛋白质、核酸、多糖、脂肪酸、维生素及其纳米分子等;也包括了能够提高Fas相关死亡结构域蛋白磷酸化水平的小分子物质,例如,天然产物、化学合成或者化学改造的产物、有机小分子、无机分子等。
在本发明的第三方面,提供了一种通过引入模拟Fas相关死亡结构域蛋白磷酸化的基因进行表达,从而调节脂解和脂肪酸氧化代谢的方法。
所述的模拟Fas相关死亡结构域蛋白磷酸化的基因,其特征是指人Fas相关死亡结构域蛋白的第194位丝氨酸突变为天冬氨酸或者谷氨酸的人Fas相关死亡结构域蛋白突变基因。上述模拟Fas相关死亡结构域蛋白磷酸化的基因可用于基因治疗。
在本发明的第四方面,提供了如上述的调节脂解和脂肪酸氧化代谢的方法在制备脂代谢紊乱疾病治疗药物中的应用。所述应用包括了通过筛选获得的能够提高Fas相关死亡结构域蛋白的磷酸化的物质或者模拟Fas相关死亡结构域蛋白磷酸化的基因单独用于制备脂代谢治疗药物,或与现有的脂代谢治疗药物组成组合物,或与现有化学药物治疗、中药治疗、生物治疗、物理治疗等方法在脂代谢治疗中联合运用。
在本发明的第五方面,提供了一种药物组合物,包括药学上可接受的载体或赋形剂或稀释剂,以及有效量的权利要求1所述的调节脂解和脂肪酸氧化代谢的方法。
在本发明的第六方面,提供了如上述的调节脂解和脂肪酸氧化代谢的方法在制备脂代谢紊乱疾病治疗药物中的具体应用。
附图说明
为了使本发明的内容更容易被清楚地理解,下面根据具体实施例并结合附图,对本发明作进一步详细的说明,其中:
图1.FADD磷酸化上调小鼠胚胎成纤维细胞株中脂肪酸氧化代谢速度
图1A.FADD磷酸化的细胞株中脂肪酸氧化速度增加。通过t-test进行显著性分析,*P<0.05。
图1B.FADD磷酸化的细胞株中线粒体数量增多。标尺=500nm。
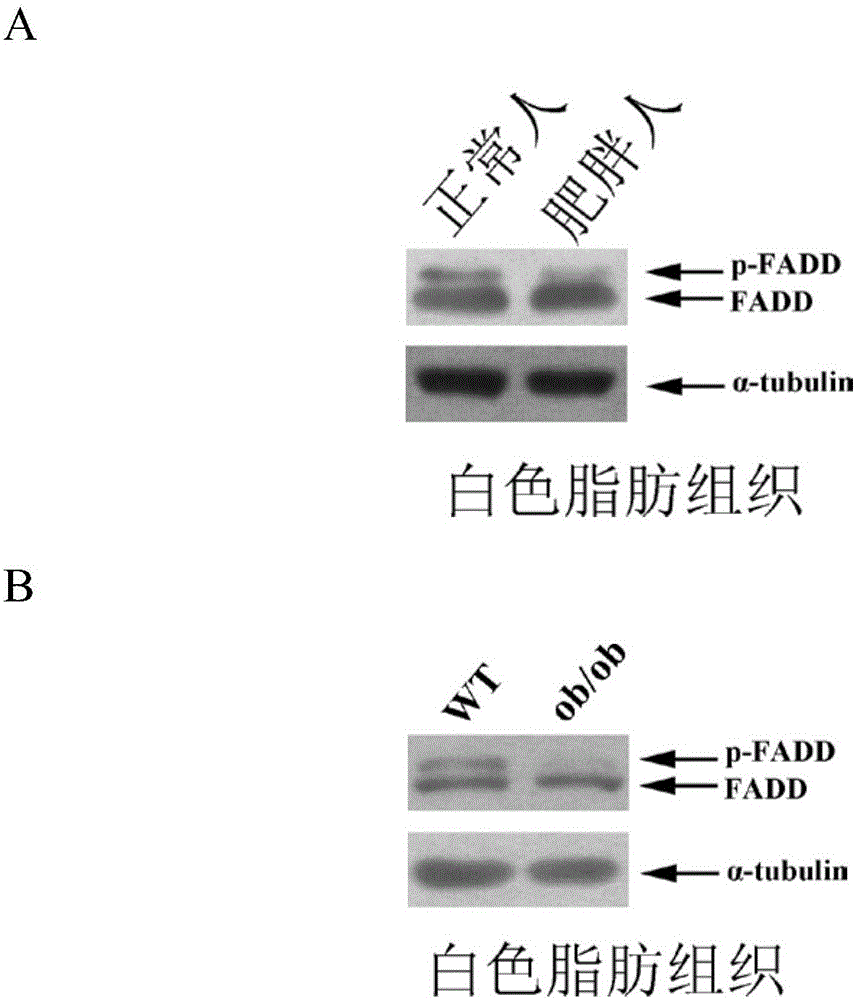
图2.肥胖人与正常人、ob/ob肥胖小鼠与正常小鼠脂肪组织中FADD磷酸化水平比较
图2A.取外科手术中正常人及肥胖人的白色脂肪组织制样做Western Blot,检测FADD磷酸化水平。
图2B.取标准饮食喂养的20周龄大小的ob/ob小鼠及正常对照小鼠的白色脂肪组织制样做Western Blot,检测FADD磷酸化水平。
图3.FADD磷酸化对ob/ob肥胖小鼠体重及脂肪含量的影响
图3A.上:标准饮食喂养的20周龄大小的ob/ob小鼠及FADD磷酸化的ob/ob小鼠照片;下:ob/ob小鼠及FADD磷酸化的ob/ob小鼠的肝脏及附睾脂肪照片。
图3B.左:标准饮食喂养的ob/ob小鼠及FADD磷酸化的ob/ob小鼠体重生长曲线;右:标准饮食喂养的ob/ob小鼠及FADD磷酸化的ob/ob小鼠每日进食量。
图3C.标准饮食喂养下ob/ob小鼠及FADD磷酸化的ob/ob小鼠体内各组织脂肪块的重量:1.附睾;2.肾脏;3.腹股沟。
通过t-test进行显著性分析,*P<0.05,**P<0.01。
图4.FADD磷酸化对正常小鼠体重及脂肪含量的影响
图4A.左:标准饮食喂养的10周龄大小的正常对照小鼠及FADD磷酸化的小鼠解剖照片;右:正常对照小鼠及FADD磷酸化的小鼠的白色脂肪组织及肝脏组织照片。
图4B.左:标准饮食或髙脂饮食喂养的正常对照小鼠及FADD磷酸化的小鼠的体重生长曲线;右:正常对照小鼠及FADD磷酸化的小鼠单位体重每日进食量:1.正常对照小鼠;2.FADD磷酸化的小鼠。
图4C.左:髙脂饮食喂养下正常对照小鼠及FADD磷酸化的小鼠体内各组织脂肪块的重量占体重的百分比:1.附睾;2.肾脏;3.腹股沟。中:髙脂饮食喂养下正常对照小鼠及FADD磷酸化的小鼠体内褐色脂肪组织块的重量占体重的百分比:1.正常对照小鼠;2.FADD磷酸化的小鼠。右:髙脂饮食喂养下正常对照小鼠及FADD磷酸化的小鼠体内肝脏重量占体重的百分比:1.正常对照小鼠;2.FADD磷酸化的小鼠。
图4D.核磁共振扫描正常对照小鼠及FADD磷酸化的小鼠体内脂肪的分布。
图4E.小鼠白色脂肪组织、褐色脂肪组织切片后进行HE染色观察各组织细胞大小及形态。肝脏组织切片后进行油红O染色观察肝脏中甘油三酯的含量。
通过t-test进行显著性分析,**P<0.01,***P<0.001。
图5.FADD磷酸化对小鼠各组织及血清甘油三酯等代谢指标的影响
图5A.髙脂饮食喂养的正常对照小鼠及FADD磷酸化的小鼠肝脏及肌肉中甘油三酯的含量:1.肝脏;2.肌肉。
图5B.髙脂饮食喂养的正常对照小鼠及FADD磷酸化的小鼠血清中游离脂肪酸及甘油三酯的含量:1.正常对照小鼠;2.FADD磷酸化的小鼠。
图5C.标准饮食或髙脂饮食喂养下正常对照小鼠及FADD磷酸化的小鼠血清中瘦素的含量:1.标准饮食;2.髙脂饮食。
通过t-test进行显著性分析,*P<0.05,**P<0.01。
图6.FADD磷酸化对小鼠体内甘油三酯的脂解速度的影响
图6A.取禁食过夜的小鼠附睾白色脂肪组织块,在基础条件或者异丙肾上腺素的刺激下每隔两小时测定甘油或者游离脂肪酸的释放量,绘制脂解速度曲线图。
图6B.髙脂饮食饲养的小鼠附睾白色脂肪组织中cAMP的含量:1.正常对照小鼠;2.FADD磷酸化的小鼠。
图6C.取髙脂饮食饲养的小鼠附睾白色脂肪组织制样做Western Blot,检测p-HSL,HSL和α-tubulin的蛋白表达量。右图为对Western Blot结果的定量分析:1.HSL;2.p-HSL。
通过t-test进行显著性分析,*P<0.05,**P<0.01,***P<0.001。
图7.FADD磷酸化对小鼠体内脂肪酸的氧化速度的影响
图7A.从髙脂饮食饲养的小鼠附睾白色脂肪组织中分离白色脂肪细胞,利用脂肪酸β氧化速率比色法检测试剂盒测定其脂肪酸氧化速度:1.正常对照小鼠;2.FADD磷酸化的小鼠。
图7B.取髙脂饮食饲养的小鼠附睾白色脂肪组织制样做Western Blot,检测PPARα的蛋白表达量。下图是对Western Blot结果的定量分析:1.正常对照小鼠;2.FADD磷酸化的小鼠。
图7C.取髙脂饮食饲养的小鼠附睾白色脂肪组织,石蜡包埋切片,用PPARα的抗体做免疫组化分析(每组4只小鼠),标尺=50μm。
图7D.取高脂饮食饲养的小鼠附睾白色脂肪组织,检测脂代谢相关基因的mRNA表达水平。1.PPARα;2.Acox1;3.Ehhadh;4.Acadvl;5.Acadm;其中,白色为正常对照小鼠,深灰色为FADD磷酸化的小鼠;每组 4-6只小鼠,每个样三个重复,以GAPDH为内标;
图7E.取髙脂饮食饲养的小鼠附睾白色脂肪组织制样做Western Blot,检测脂代谢相关蛋白的表达水平,包括VLCAD,LCAD,MCAD和PTL,以α-tubulin作为内标:1.正常对照小鼠;2.ob/ob小鼠;3.FADD磷酸化的小鼠;4.FADD磷酸化的ob/ob小鼠;
图7F.取髙脂饮食饲养的小鼠附睾白色脂肪细胞,进行ChIP(染色质免疫沉淀)试验,检测PPARα(左)与FADD(右)与PPRE(过氧化物酶体增殖物激活受体反应元件)调控区的结合能力:1.正常对照小鼠;2.FADD磷酸化的小鼠;通过t-test进行显著性分析,*P<0.05,**P<0.01。
具体实施方式
实施例1
FADD磷酸化上调小鼠胚胎成纤维细胞株中脂肪酸氧化代谢速度
构建FADD永久磷酸化(FADD-D,将191位丝氨酸突变成为天冬氨酸)和FADD永久非磷酸化(FADD-A,将191位丝氨酸突变成为丙氨酸)的小鼠胚胎成纤维细胞株。培养细胞,用脂肪酸β氧化速率比色法检测试剂盒(上海宝曼生物科技有限公司)测定比较FADD磷酸化细胞株、FADD非磷酸化细胞株、野生型细胞株中脂肪酸氧化代谢速度,并用电镜观察三个细胞株中线粒体的形状和数量。
脂肪酸氧化速度测定发现FADD磷酸化细胞株中脂肪酸的氧化代谢速度显著高于FADD非磷酸化细胞株和野生型细胞株,而FADD非磷酸化细胞株中脂肪酸氧化代谢速度与野生型细胞株无显著差异(图1A)。线粒体是能量代谢的主要场所,电镜观察发现FADD磷酸化的细胞株中线粒体的数量也高于FADD非磷酸化细胞株和野生型细胞株(图1B),说明了FADD磷酸化细胞株中能量代谢更加活跃。
实施例2
比较肥胖人与正常人、ob/ob肥胖小鼠及正常小鼠脂肪组织中FADD磷酸化水平
人组织样品制备:从医院外科手术中获得体重正常人群及肥胖人群的白色脂肪组织样品,制样进行western blot分析其组织中FADD磷酸化的水平。
小鼠组织样品制备:所有的实验小鼠都是在通风无菌,恒温恒湿的SPF级别环境下进行饲养繁殖的。小鼠可以自由获取水和饲料。ob/ob小鼠及正常对照小鼠各选4只,标准饮食饲养小鼠,待其生长到20周龄大小,处死小鼠解剖并取其白色脂肪组织制样做western blot分析其组织中FADD磷酸化的水平。
Western Blot:组织在细胞裂解液(50mM Tris-HCl,pH 7.4,250mM NaCl,50mM NaF,5mM EDTA,5mM磷酸甘油,1mM Na3VO4,1%NP40)中匀浆后12,000rpm离心,收集上清,并用Bradford方法检测蛋白浓度。等量(约50μg)蛋白用12%的SDS-PAGE凝胶电泳分离后转移到PVDF膜中。然后用FADD的抗体进行检验。
FADD在细胞内以非磷酸化及磷酸化两种形式存在,用FADD抗体可以检测到两条条带,其中上面那条的是磷酸化形式的FADD,下面那条是非磷酸化形式的FADD[Hua ZC等人,2003,Immunity 18:,513--521]。Western blot结果显示,肥胖人白色脂肪组织中磷酸化形式的FADD条带比正常人要弱(图2A);标准饮食饲养的20周龄的ob/ob小鼠白色脂肪组织中磷酸化形式的FADD条带明显弱于正常对照小鼠(图2B)。这些结果说明磷酸化形式的FADD的表达水平降低可以导致小鼠或者人的肥胖,即磷酸化形式的FADD可以致小鼠或者人变瘦。
实施例3
Fas相关死亡结构域蛋白(FADD)磷酸化对ob/ob肥胖小鼠体重及体内脂肪含量的影响
所有的实验小鼠都是在通风无菌,恒温恒湿的SPF级别环境下进行饲养繁殖的。小鼠可以自由获取水和饲料。将FADD磷酸化的小鼠按照文献报道的方式与OB/ob小鼠交配繁殖[Hua ZC等人,2003,Immunity 18:,513--521],获得FADD磷酸化的ob/ob小鼠。通过PCR方法进行基因型的鉴定。
每种基因型小鼠选6只,标准饮食饲养小鼠,从小鼠6周开始,每周称量小鼠的体重,直到小鼠35周,绘制小鼠体重生长曲线,并用代谢笼计算小鼠的每日进食量。比较20周龄大小的ob/ob小鼠和FADD磷酸化的ob/ob小鼠的体型、附睾白色脂肪组织及肝脏大小。称量比较小鼠附睾、肾脏、及腹股沟部位的白色脂肪块的重量。
由于正常状态下,FADD以非磷酸化为主,磷酸化形式只在特定的生理及病理状态下才存在。为了观察FADD磷酸化对脂代谢的影响,本专利构建了模拟FADD磷酸化的基因改造小鼠(将小鼠FADD基因191位丝氨酸突变为天冬氨酸,以此模拟磷酸化的FADD,该种模型已经为国际公认)[Hua ZC等人,2003,Immunity 18:513-521],并将该小鼠与OB/ob小鼠交配繁殖获得FADD磷酸化的ob/ob小鼠。标准饮食饲养的20周龄的FADD磷酸化的ob/ob小鼠体型明显比ob/ob小鼠瘦,其附睾白色脂肪含量也明显比ob/ob小鼠少,肝脏大小差不多,但是ob/ob小鼠的肝脏呈现出明显的脂肪肝,而FADD磷酸化的ob/ob小鼠肝脏没有脂肪肝现象(图3A)。比较FADD磷酸化的ob/ob小鼠与ob/ob小鼠的体重生长曲线发现,FADD磷酸化的ob/ob小鼠体重生长明显低于ob/ob小鼠,并且与正常野生型小鼠相似,也就是说,FADD磷酸化可以逆转ob/ob小鼠的肥胖表型(图3B,左)。代谢笼实验发现尽管FADD磷酸化的ob/ob小鼠体重远比ob/ob小鼠低,但是每日进食量还比ob/ob小鼠略高,说明体重的降低不是因为进食量的减少而引起的(图3B,右)。本专利也检测了小鼠体内三个组织的白色脂肪块重量,包括附睾、肾脏及腹股沟,结果发现FADD磷酸化的ob/ob小鼠体内各组织白色脂肪块的重量也明显低于ob/ob小鼠(图3C),说明FADD磷酸化可以促进小鼠体内脂肪含量下降而引起小鼠体重的降低,逆转了ob/ob小鼠的肥胖表型。
根据本实施例的结果,体内实现“FADD蛋白的第194位丝氨酸突变为天冬氨酸”蛋白的表达可以逆转肥胖表型,达到治疗肥胖症及肥胖相关代谢综合征的目的。
从世界范围来讲,基因治疗已进入高速发展的快车道。无论是病毒载体还是非病毒载体转入外源基因的方法已经非常成熟,因此,通过基因治疗手段在体内进行“FADD蛋白的第194位丝氨酸突变为天冬氨酸”蛋白的表达是非常简易、方便和经济的。
此外,由于FADD基因和蛋白在哺乳动物当中是高度保守的,人和小鼠FADD蛋白68%的氨基酸残基完全相同,在蛋白质的一级结构上同源程度高达80%,在其他哺乳动物(包括人)中FADD也具有类似的功能(Chinnaiyan AM等人,1995,Cell 81(4):505-512;Boldin MP等人,1995,J Biol Chem 270(14):7795-7798.)。
而且由实施例2中的结果(图2A和2B)可知:肥胖人白色脂肪组织中磷酸化形式的FADD条带比正常人要弱(图2A);标准饮食饲养的20周龄的ob/ob小鼠白色脂肪组织中磷酸化形式的FADD条带明显弱于正常对照小鼠(图2B)。这些结果说明磷酸化形式的FADD的表达水平降低可以导致小鼠或者人的肥胖,即磷酸化形式的FADD可以致小鼠或者人变瘦。
因此,再结合本实施例的结果,可以肯定通过上调FADD磷酸化来下调肥胖小鼠体内脂肪含量及体重的方法同样适用于其他哺乳动物、尤其是人。
实施例4
FADD磷酸化对正常基因型小鼠体重及体内脂肪含量的影响
除了研究FADD磷酸化对ob/ob小鼠体重的影响,本发明还检测了FADD磷酸化对正常野生型小鼠体重及体内脂肪含量的影响。按照文献报道的方式[Hua ZC等人,2003,Immunity 18:,513--521],获得FADD磷酸化的小鼠。实验小鼠分为两组,一组为同窝正常对照小鼠,一组为FADD磷酸化的小鼠。通过PCR方法进行基因型的鉴定。标准饮食喂养断奶的小鼠到10周龄大小,解剖小鼠,拍照,比较正常对照小鼠与FADD磷酸化的小鼠体内附睾脂肪含量及肝脏大小。另外,每种基因型小鼠各选6只,标准饮食或者髙脂饮食饲养小鼠,从小鼠5周开始,每周称量小鼠的体重,直到小鼠20周,绘制小鼠体重生长曲线,并用代谢笼计算小鼠的每日进食量。检测比较高脂喂养的20周龄的小鼠附睾、肾脏、及腹股沟部位的白色脂肪块的重量及褐色脂肪占体重的比例。利用核磁共振仪(Bruker Medical,Germany)扫描小鼠体内脂肪分布。取小鼠白色脂肪组织、褐色脂肪组织,在10%的磷酸缓冲福尔马林中,石蜡包埋后,切成5μm厚度的薄片,并对白色脂肪组织及褐色脂肪组织切片进行苏木精-伊红染色法(HE)染色,显微镜下观察比较各细胞的大小及形态变化。取小鼠肝脏组织,快速冰冻切片,并对冰冻切片进行油红O染色,比较肝脏组织中甘油三酯的含量。
与实施例3类似,FADD磷酸化同样可以使正常小鼠变瘦。与正常小鼠相比,FADD磷酸化的小鼠附睾脂肪含量显著减少(图4A),体重生长速度也明显低于正常对照小鼠(图4B,左);代谢笼实验发现尽管FADD磷酸化的小鼠体重远低于正常对照小鼠,但是单位体重每日进食量甚至于高于正常对照小鼠,说明体重的降低不是因为进食量的减少而引起的(图4B,右)。本专利同样检测了小鼠体内三个组织的白色脂肪块重量,包括附睾、肾脏及腹股沟,结果发现FADD磷酸化的小鼠体内各组织白色脂肪块的重量也明显低于正常对照小鼠(图4C,左),褐色脂肪含量也显著下降(图4C,中),而肝脏大小变化不大(图4C,右)。核磁共振扫描发现FADD磷酸化的小鼠不管是皮下脂肪还是内脏脂肪均显著低于正常对照小鼠(图4D)。组织切片HE染色结果发现FADD磷酸化的小鼠白色脂肪细胞及褐色脂肪细胞均显著小于正常对照小鼠;肝脏油红O染色结果也表明FADD磷酸化的小鼠肝脏中甘油三酯的含量显著低于正常对照小鼠(图4E),这些结果说明FADD磷酸化可以抑制髙脂饮食或年龄增长引起的小鼠肥胖。
实施例3和实施例4的结果说明FADD磷酸化不仅可以使ob/ob肥胖小鼠变瘦,还可以抑制髙脂饮食或年龄增长引起的正常基因型小鼠的肥胖,因此,可以以FADD磷酸化程度的变化为指证,筛选能够提高FADD磷酸化的物质的方法来进行肥胖症及相关代谢综合征的治疗。这些物质主要包括能够提高FADD蛋白磷酸化水平的大分子物质,例如,蛋白质、核酸、多糖、脂肪酸、维生素及其纳米分子等;也包括了能够提高FADD磷酸化水平的小分子物质,例如,天然产物、化学合成或者化学改造的产物、有机小分子、无机分子等。再结合实施例2的结果,以上方法对人同样适用。
实施例5
FADD磷酸化对小鼠各组织及血清内甘油三酯等代谢指标的影响
按照文献报道的方式[Hua ZC等人,2003,Immunity 18:,513--521],获得FADD磷酸化的小鼠。实验小鼠分为两组,一组为同窝正常对照小鼠,一组为FADD磷酸化的小鼠。通过PCR方法进行基因型的鉴定。小鼠高脂喂养。肌肉和肝脏组织中的甘油三酯和胆固醇含量分别用甘油三酯检测试剂盒(上海盈公生物技术有限公司)、胆固醇检测试剂盒(上海必优生物科技有限公司)进行检测。血清中游离脂肪酸含量、甘油三酯含量分别用游离脂肪酸检测试剂盒及甘油三酯检测试剂盒(均购自Sigma公司)进行相应检测。血清中的瘦素水平通过悬液芯片进行检测(Bio-Rad Laboratories,Hercules,CA,USA)。
为了进一步研究FADD磷酸化对脂代谢的影响,本专利还进一步检测了肝脏及肌肉组织中的甘油三酯含量,结果发现FADD磷酸化的小鼠肝脏及肌肉组织中甘油三酯的含量显著小于正常对照小鼠(图5A,左),FADD磷酸化的小鼠肝脏中胆固醇含量稍低于正常对照小鼠,肌肉中胆固醇二者含量相当(图5A,右)。高脂喂养后,FADD磷酸化的小鼠血清中游离脂肪酸及甘油三酯的含量显著低于正常对照小鼠(图5B),血清中瘦素的含量也显著低于正常对照小鼠(图5C)。这些结果表明FADD磷酸化促进了甘油三酯的分解。FADD磷酸化小鼠血清中游离脂肪酸浓度也下降,说明了FADD磷酸化可能也促进了脂肪酸的氧化代谢。
实施例6FADD磷酸化对小鼠体内甘油三酯的脂解速度的影响
实验小鼠:按照文献报道的方式[Hua ZC等人,2003,Immunity 18:,513--521],获得FADD磷酸化的小鼠。实验小鼠分为两组,一组为同窝正常对照小鼠,一组为FADD磷酸化的小鼠。通过PCR方法进行基因型的鉴定。
脂解速度测定:取小鼠白色脂肪块,制备组织匀浆,利用游离脂肪酸检测试剂盒(Sigma)及甘油检测试剂盒(北京鸿跃创新科技有限公司)在不同时间点(0小时、2小时、4小时、6小时、8小时)分别测定基础状态下或者刺激条件(加100nM异丙肾上腺素)下游离脂肪酸、甘油浓度,然后绘制脂解速度图。
cAMP含量测定:cAMP含量用竞争性免疫试验(R&D)进行测定。
Western Blot:Western blot实验方法参见实施例2,分别用HSL、phospho-HSL的抗体进行检验。对Western Blot图进行Image J灰度扫描并进行定量分析。
数据分析:所有的数据结果都表示成平均值±SEM。用Prism software(GraphPad,San Diego,CA)中的two-tailed Student’s t-test进行两种基因型之间的差异性分析。当P值小于0.05时被认为数据具有统计学差异。
白色脂肪组织是脂代谢的主要场所。为了研究FADD磷酸化对甘油三酯的代谢影响,本发明观察了小鼠白色脂肪组织的脂解速度。不论在基础状态下还是在异丙肾上腺素刺激下,FADD磷酸化的小鼠白色脂肪组织中的甘油三酯分解速度均显著高于正常对照小鼠(图6A)。cAMP是经典脂解信号通路中的关键信号分子,本发明继续检测了白色脂肪组织中的cAMP含量,结果表明FADD磷酸化的小鼠白色脂肪组织中cAMP含量明显高于正常对照小鼠(图6B)。cAMP会促进下游的激素敏感酯酶HSL的磷酸化,磷酸化的HSL被活化从而促进甘油三酯的分解。因此,本专利继续观察了HSL的磷酸化水平是否受到FADD磷酸化的影响。结果表明,FADD磷酸化的小鼠白色脂肪组织中HSL的磷酸化水平明显高于正常对照小鼠(图6C),说明HSL被活化,促进了甘油三酯的分解,这与前面我们观察到的FADD磷酸化加速了甘油三酯的分解现象一致。这些结果表明,FADD磷酸化增加了白色脂肪组织中cAMP含量,激活了脂解信号通路,促进了甘油三酯的分解,降低了体内脂肪的含量,导致小鼠体重变低,这与前面我们观察到的结果吻合。
实施例7FADD磷酸化对小鼠体内脂肪酸的氧化速度的影响
实验小鼠:按照文献报道的方式[Hua ZC等人,2003,Immunity 18:,513--521],获得FADD磷酸化的小鼠。实验小鼠分为两组,一组为同窝正常对照小鼠,一组为FADD磷酸化的小鼠。通过PCR方法进行基因型的鉴定。
脂肪酸氧化速度测定:小鼠髙脂饮食饲养。取小鼠白色脂肪组织,胶原蛋白酶消化组织,分离白色脂肪细胞,用脂肪酸β氧化速率比色法检测试剂盒(上海宝曼生物科技有限公司)测定比较FADD磷酸化小鼠及正常对照小鼠的脂肪酸氧化速度。
Western Blot:检测方法同实施例2。
RNA提取及定量实时PCR:用TRIzol(Invitrogen,Carlsbad,CA,USA)处理组织后根据附带的说明书提取RNA,然后用PrimeScript RT reagent Kit(Takara,Otsu,Shiga,Japan)进行逆转录制备cDNA。定量实时PCR(qRT-PCR)在ABI机器(Applied Biosystems,Foster City.CA,USA)上进行。引物如下:PPARα:正向引物:5’-TCGCGGGAAAGACCAGCAACAA-3’;反向引物:5’-GCCAGGCCGATCTCCACAGC-3’;Acox1:正向引物:5’-CGCCGCCACCTTCAATCCAGAG-3’;反向引物:5’-TCCAGGCCGGCATGAAGAAAC-3’;Ehhadh:正向引物:5’-TCCCCCACTACCATCGCCACAG-3’;反向引物:5’-ACCAAATCGCCCAGCTTCACAGAG-3’;Acadvl:正向引物:5’-CCCATGGGCTCCCTGAAAAGAAGA-3’;反向引物:5’-GGCCGCCTCCGAGCAAAAGAT-3’;Acadm:正向引物:5’-TCGCCCCGGAATATGACAAAA-3’;反向引物:5’-AGAACGTGCCAACAAGAAATACCA-3’;GAPDH:正向引物:5’-ACTGAGGACCAGGTTGTC-3’;反向引物:5’-TGCTGTAGCCGTATTCATTG-3’。所有的结果都是3次实验的平均值,以GAPDH作为内参。
ChIP(染色质免疫沉淀)实验:小鼠高脂喂养,取小鼠白色脂肪组织,胶原蛋白酶消化组织,分离白色脂肪细胞,用10厘米培养皿培养。
第一天:
1.弃培液后,沿壁加入3毫升冷的PBS,缓慢转动培养皿使PBS充分冲洗细胞后,倒去PBS,用枪头吸干净。
2.每个皿加4毫升4%的多聚甲醛,混匀铺满皿后,在摇床上边摇边固定10分钟。
3.直接在摇床上边晃动边滴加1.25M的Glycine溶液,450微升/皿,继续摇晃5分钟。
4.倒去所有的液体,用冷的PBS洗两次,每次至少3毫升,再用1毫升PBS 刮收细胞。3000rpm,离心5分钟收集细胞。PBS再洗一遍,弃尽上清。
5.每管加100微升Nuclei Lysis Buffer(PI 1:100),吹散细胞后冰上放10分钟。
6.每管再加900微升IP dilution Buffer(PI 1:100),准备好冰水混合物,开始超声。
7.12000rpm,4度离心10分钟,取上清加抗体(PPARα抗体或者FADD抗体),抗体用量至少要2微克,4度垂直混合器上混合过夜。
第二天:
8.用fish sperm DNA封闭protein G,4度孵育2小时。
9.在样品中加入封闭好的protein G之后,继续在4度垂直混合器上孵育2小时。
10.5000rpm离心1分钟,收集protein G。每个样保存400的上清,之后用作对照,上清在-20度暂时保留。
11.其余的上清弃去,使用以下的buffer依次清洗protein G。清洗顺序如下:
A.Low Salt Immune Complex Wash Buffer,洗一次
B.High Salt Immune Complex Wash Buffer,洗一次
C.LiCl Immune Complex Wash Buffer,洗一次
D.TE buffer,洗两次。
12.配制新鲜的Elution Buffer(1%SDS,0.1M NaHCO3)
13.在每个管子里加入Elution Buffer 200微升,室温下,在涡旋震荡器上边震荡边混合15分钟,洗脱15分钟后5000rpm离心1分钟,吸取上清。之后再用200微升Elution Buffer再洗脱一遍,同样是15分钟,再离心收上清,把两次的上清混合在一起后,总共400微升的洗脱产物。
14.这时每个样都有400微升的洗脱上清了,还有之前保留的400微升的对照上清,接下来两批样同时平行处理。
15.每个样加16微升5M NaCl,65度水浴孵育4小时,然后就可以冻-20度,待用。
第三天:
16.样品化冻以后,每个样中加8微升0.5M EDTA,16微升1M Tris-HCl,PH6.5和4微升100×的proteinase K后,50度水浴孵育1小时。
17.每400微升的样品中加入280微升饱和NaCl,与700微升的氯仿,混合均匀。
18.10000rpm,4度离心10分钟,小心吸取上清至2毫升离心管中,每个样加入20微克的鱼精DNA作为载体DNA,混匀后开始提基因组。
19.加入1.3毫升的无水乙醇,在冰上放10分钟后,可以微微看到白色的浑浊。20.12000rpm,4度离心10分钟,小心吸去上清后,沉淀用75%的乙醇洗样晾干。
21.用20微升的DDW溶解沉淀后,进行PCR。PCR引物:CPT1b,5’-CCTGTGCTGGTCCCCAACTCACAGC-3’与5’-CTCCTGGTGACCTTTTCCCTACATT-3’(279bp)。
血清中游离脂肪酸主要来源于储存在脂肪组织中的甘油三酯的分解。尽管FADD磷酸化的小鼠脂解速度增加,血清中游离脂肪酸浓度却低于正常对照小鼠,因此我们推测FADD磷酸化的小鼠脂肪酸氧化速度也同样增加。与我们推测的一致,本专利发现FADD磷酸化的小鼠白色脂肪组织中脂肪酸的氧化速度显著高于正常对照小鼠(图7A),这与前面发现FADD磷酸化的小鼠血清中游离脂肪酸含量低于正常对照小鼠结果吻合。PPARα对脂肪酸代谢具有重要调控作用,可促进细胞对脂肪酸的摄取、转运、活化和β氧化。本发明还检测了转录因子PPARα在脂肪组织中的表达,Western blot和免疫组化实验均表明FADD磷酸化的小鼠脂肪组织中PPARα的表达远高于正常对照小鼠(图7B和7C)。PPARα的表达增加会激活其调控的参与脂肪酸氧化代谢的靶基因的表达。与此一致,本专利发现FADD磷酸化小鼠白色脂肪组织中PPARα及几个参与脂肪酸氧化代谢的关键酶的mRNA水平表达增加,包括过氧化物酶酰基辅酶A氧化酶1(Acox1)、三羟酰辅酶A脱氢酶(Ehhadh)、极长链酰基辅酶A脱氢酶(Acadvl)和中链酰基辅酶A脱氢酶(Acadm)(图7D)。Acadvl、Acadm、长链酰基辅酶A脱氢酶(Acadl)、过氧化物酶3-酮脂酰CoA硫解酶(PTL)蛋白表达水平也显著提高(图7E)。这些酶的高表达促进了脂肪酸氧化速度的上调。为了进一步考察PPARα的转录活性及对脂肪酸氧化速度的调控,本专利还利用ChIP实验检测了PPARα对脂肪酸代谢途径中重要的酶之一肉毒碱棕榈酰基转移酶1b(CPT1b)的转录调控作用,结果发现,FADD磷酸化可以促进PPARα结合到CPT1b基因调控区的PPRE元件上去,增强了CPT1b基因的表达,促进了脂肪酸的氧化代谢(图7F)。
FADD的磷酸化可以增加脂肪组织中cAMP的浓度,激活了经典脂解通路,增强了HSL的磷酸化水平,促进了甘油三酯分解为游离脂肪酸及甘油。FADD磷酸化还可以增强PPARα的转录水平,从而增加了PPARα调控的参与脂肪酸代谢的酶的表达,促进了脂肪酸的氧化代谢。因此,本发明FADD磷酸化为治疗包括肥胖在内的脂代谢疾病提供了一个新的药物靶点。利用FADD磷酸化水平作为筛选标志就可以获得可以调控FADD磷酸化的物质,从而发现调节脂代谢的药物。
本发明通过转入一个模拟FADD磷酸化的FADD突变基因,直接实现了对激素敏感酯酶(HSL)、过氧化物酶体增殖物激活受体α(PPARα)、过氧化物酶酰基辅酶A氧化酶1(Acox1)、三羟酰辅酶A脱氢酶(Ehhadh)、极长链酰基辅酶A脱氢酶(Acadvl)、长链酰基辅酶A脱氢酶(Acadl)和中链酰基辅酶A脱氢酶(Acadm)这些关键转录因子或酶的表达的调控,从而有效地调节了脂代谢速度。因此,模拟FADD磷酸化的FADD突变基因的基因治疗必然成为调节脂代谢疾病的一种有效手段。
因此,通过FADD磷酸化调节脂解和脂肪酸氧化速度的方法能够直接应用于脂代谢疾病治疗药物的发现、制备,和治疗。该方法并且能够与现有化学药物治疗、中药治疗、生物治疗、物理治疗等脂代谢治疗方法联合运用,产生更好的治疗效果。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种基于动态pet影像的心肌脂肪酸代谢量化检测方法
- 作为抗脂解药用于治疗血脂异常等代谢相关疾病的5-取代的2h-吡唑-3-甲酸衍生物的制作方法
- 用作抗异常脂肪血症及相关疾病的fxr调节剂的2,3-取代的吲唑或4,5,6,7-四氢-吲唑类的制作方法
- 一种脂肪酸代谢显像剂β-甲基-15-对氟[的制作方法
- 作为RXR激动剂用于治疗异常脂肪血症、高胆固醇血症和糖尿病的1
- 微拟球藻NgAUREO1基因在调控脂肪酸代谢中的应用的制作方法
- 人参皂苷代谢物m1单脂肪酸酯类化合物的制备方法
- 一种用于治疗水液代谢异常的中药组合物及其制备方法
- 软骨代谢异常疾病改善用健康食品及药品组合物的制作方法
- 作为rxr激动剂用于治疗异常脂肪血症、高胆固醇血症和糖尿病的二氢-[1h]-喹啉-2-酮 ...的制作方法