消融导管的制作方法
本发明涉及医疗器械领域,尤其涉及一种消融导管。
背景技术:
高血压是常见的慢性病,在其形成机制中,肾素-血管紧张素-醛固酮系统(reninangiotensinaldosteronesystem,raas)作为重要的血压调控系统起到关键作用。raas通过对心脏、血管、肾脏的调节维持机体水、电解质及血压的平衡。研究证实,raas通过以下三个途径引起高血压:(1)raas激活引起钠潴留;(2)raas激活可以增加交感神经系统活性;(3)raas激活可以直接收缩血管。其中,肾动脉交感神经对于诱发和保持系统性高血压起着决定性作用,其过度活跃使得高血压患者的血压难以降低。
图1显示了肾动脉的典型解剖结构。肾动脉主干2的入口处连接主动脉1,血流从主动脉1依次经由肾动脉2、分支血管31、及由分支血管31所分出来的下一级分支血管311、312(以下简称二级分支血管311、312)流向肾脏。一般地,二级分支血管311及312的内径小于分支血管31。
经导管肾动脉交感神经消融术是针对肾动脉交感神经的消融,其典型的作用方式是经导管将电极输送到患者肾动脉的血管内,并通过这些电极的部分外表面与血管壁贴合而对肾动脉血管施放能量,以达到消融肾动脉血管壁内的肾交感神经而降低患者血压的目的。
现有射频消融导管的远端通常设有裸露的环形电极,该环形电极与消融导管同轴。当该消融导管进入肾动脉中比消融导管粗的血管内时,远端环形电极的一部分外表面与血管贴壁释放消融能量,其余部分外表面与血管壁隔开,但当消融导管进入较细的分支血管中时,环形电极的全部外表面或绝大部分外表面将与血管壁接触,由此会对血管的整周截面或大部分圆周弧度都产生消融能量。消融能量的施加会对肾动脉血管壁的内皮产生损伤、水肿等损害,从而刺激细胞增生,若血管的整周截面或大部分圆周弧度都产生内皮损伤,将导致血管狭窄几率增加,甚至导致堵塞血管。
技术实现要素:
基于此,有必要提供一种能降低血管狭窄风险的消融导管。
本发明提供一种消融导管,包括消融组件。所述消融组件包括电绝缘的柔性外管、设在所述柔性外管内的支撑管,和至少一个电极。所述柔性外管的侧壁设有通孔,所述电极的至少一部分从所述通孔中暴露出形成消融电极。
所述电极可为独立于支撑管和柔性外管设置的部件。所述电极可为环形电极、半环形电极、块状电极或呈其他不规则形状,只要其具有与通孔大小大致相等的消融电极即可。所述电极的一部分从所述通孔中暴露出形成所述消融电极,其余部分位于支撑管和柔性外管之间,被所述柔性外管覆盖。在其中一个实施例中,所述支撑管由具有导电性的材料制成,即所述支撑管具有导电性,所述电极为所述支撑管自身的一部分,即所述支撑管的一部分从所述通孔中暴露出来形成消融电极。
在其中一个实施例中,所述消融电极沿所述支撑管长度方向上的长度为0.5毫米至8毫米,所述消融电极沿所述支撑管的圆周方向上的长度与所述消融电极所在处的所述消融导管的外圆周长度之比范围为0.1至0.75。
在其中一个实施例中,所述消融电极的消融面积不小于1.5平方毫米。
在其中一个实施例中,所述消融导管可从低轮廓递送构型向膨胀构型转变,所述消融导管还包括与所述消融组件的近端相连的导管主体,所述消融电极有多个,当所述消融组件处于膨胀构型时,从所述消融组件的远端沿轴向向近端看,多个所述消融电极在垂直于所述导管主体的轴线的截面上的投影位于同一圆周上。
在其中一个实施例中,所述消融电极有多个,多个所述消融电极在垂直于所述导管主体的轴线的截面上的投影所对应的圆周的外径为2毫米至10毫米。
在其中一个实施例中,所述消融导管可从低轮廓递送构型向膨胀构型转变,在膨胀构型下,所述消融导管包括相连的远端螺旋段及近端螺旋段,所述近端螺旋段的外径大于或者等于所述远端螺旋段的外径,所述消融电极位于所述远端螺旋段上。
在其中一个实施例中,在相同外力的作用下,所述近端螺旋段的刚度不小于所述远端螺旋段的刚度。
在其中一个实施例中,所述消融导管还包括一个导丝套管,所述导丝套管收容于所述支撑管内,且贯穿所述支撑管的近端及远端,所述导丝套管的远端与所述柔性外管的远端相连。
在其中一个实施例中,所述支撑管的远端设有柔性头部。
在其中一个实施例中,所述支撑管包括近端部分、远端部分及位于所述近端部分及远端部分之间的多个切槽,所述近端部分和远端部分上未开设切槽。
在其中一个实施例中,所述电极包括缠绕在所述支撑管上的金属丝。
与现有技术相比,本技术方案的消融导管的消融电极并未覆盖其所处的消融导管的整个圆周,故,在垂直于血管轴向的同一截面上,消融电极不会对血管的整周或大部分圆周弧度都产生消融能量,降低了细小的分支血管因消融产生狭窄的风险。
附图说明
图1为肾动脉的典型解剖结构示意图;
图2为本发明第一实施例提供的消融导管系统的示意图;
图3为图2中的消融导管系统的消融导管处于低轮廓递送构型时的示意图;
图4为图2中的消融导管系统的消融导管处于膨胀构型时的示意图;
图5为图2中的消融导管系统的消融导管的部分剖视图;
图6为图5中的消融导管的柔性外管的示意图;
图7为图5中的消融导管的未定型状态下的支撑管的示意图;
图8为图5中的消融导管的远端的俯视图;
图9为图2中的消融导管系统中的消融导管中穿设有导丝的示意图;
图10为图9中a部分的剖视图;
图11为图5中的消融导管与分支血管内壁贴合的示意图;
图12为采用图2中的消融导管系统在分支血管内消融后的造影图;
图13为s型消融导管的示意图;
图14为拱形消融导管的示意图;
图15为本发明第二实施例提供的消融导管处于分支血管内的示意图;
图16为图15中的消融导管的示意图;
图17为图16中的消融导管的支撑管在未定型状态下的示意图。
具体实施方式
为使本发明的上述目的、特征和优点能够更加明显易懂,下面结合附图对本发明的具体实施方式做详细的说明。在下面的描述中阐述了很多具体细节以便于充分理解本发明。但是本发明能够以很多不同于在此描述的其它方式来实施,本领域技术人员可以在不违背本发明内涵的情况下做类似改进,因此本发明不受下面公开的具体实施的限制。
需要说明的是,在介入领域,通常将相对操作者近的一端称为近端,相对操作者远的一端称为远端。
除非另有定义,本文所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。本文中在本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不是旨在于限制本发明。本文所使用的术语“及/或”包括一个或多个相关的所列项目的任意的和所有的组合。
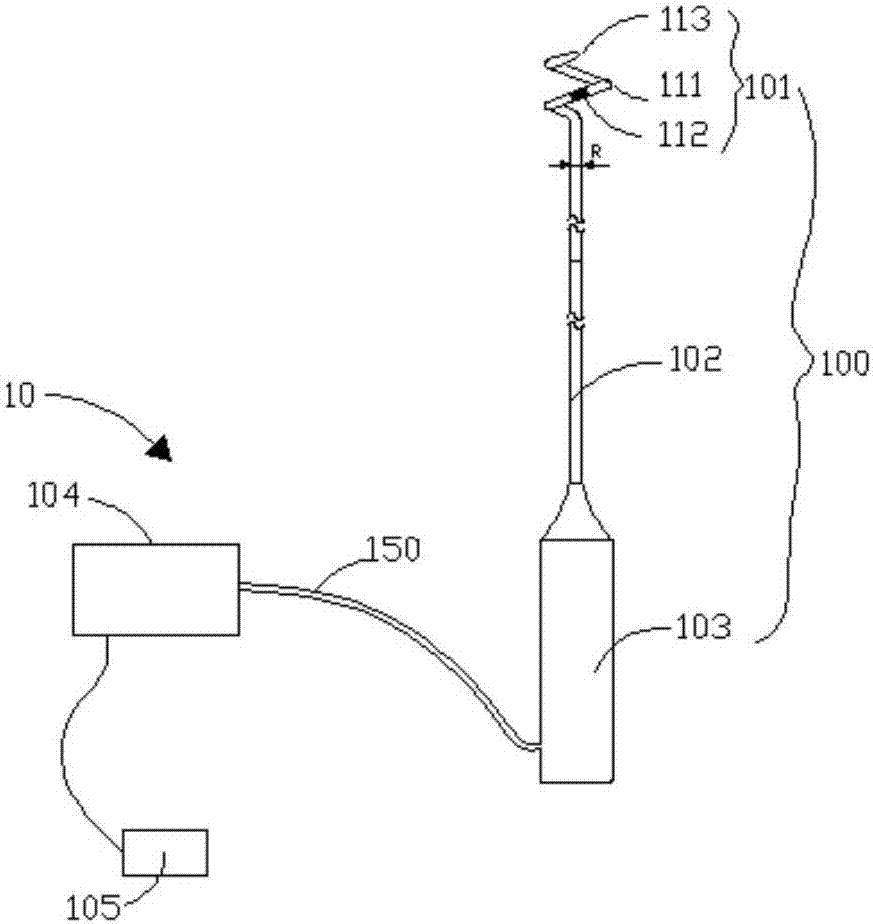
请参阅图2,本发明第一实施例提供的消融导管系统10。消融导管系统10包括消融导管100(以下简称导管100)、射频仪104及附件(如负极板105,线缆150等)。射频仪104可被构造成经由自动控制算法和/或在临床医生的控制下,通过连接电缆150向导管100的电极112递送射频能量,并与患者体表的负极板105形成回路,从而消融与电极112接触及覆盖的组织。
导管100包括消融组件101、呈细长状的导管主体102及手柄103。消融组件101的远端可利用例如柔性头113终止导管100,以使消融组件101在血管中递送时不会刮伤血管壁。
请一并参阅图1和图2,本实施例中,消融组件101的直径小于或者等于分支血管31的内径时,在低轮廓递送构型下的消融组件101可进入分支血管31。消融组件101的直径是指,当消融组件101在被约束成低轮廓递送构型时,消融组件101垂直于消融组件101的长度方向的截面所对应的外径r。可以理解的是,其他实施例中,当消融组件101的直径小于或者等于二级分支血管311的内径时,在低轮廓递送构型下的消融组件101可进入二级分支血管311。
导管100可被构造用于经整体交换导丝(otw)技术递送到肾血管内。导丝120可至少部分的从消融组件101插入消融组件101并伸出柔性头113,以及从柔性头113沿原路撤出,以将消融组件101在低轮廓递送构型(参阅图3)与膨胀构型(参阅图4)之间转变。具体地,导丝120被初始的递送到肾动脉内,然后将指引导管(图未示)的远端沿导丝送至肾动脉入口处,再将导丝撤出体外,接着在体外将导丝120远端经导管100近端的手柄103穿入消融组件101直至将将消融组件101约束成低轮廓递送构型,并沿着指引导管建立的路径将消融组件101推送到肾动脉内。在将消融组件101递送至分支血管31内的靶位置后,导丝120从消融组件101中撤走,消融组件101恢复成自然形状,即被构造成至膨胀构型(例如,大体上螺旋或螺旋状的构型),以用于在分支血管31递送消融能量。消融组件101还可使用各种合适的机构或技术(例如,自膨胀)在低轮廓递送构型与膨胀构型之间进行转换。
请参阅图5,消融组件101包括支撑管件111及设于支撑管件111上的至少一个电极112。支撑管件111包括电绝缘的柔性外管115和收容于柔性外管115内的预成型的支撑管116。柔性外管115可由电绝缘的聚合物材料构成,例如pebax、pet、聚烯烃、pi等材料。柔性外管115可通过热熔的方式与支撑管116紧密结合在一起,同时在热熔的过程中还可以将与电极112相连的导线固定于柔性外管115与支撑管116之间。可以理解的是,消融组件101的直径也可以是指,在被约束成低轮廓递送构型时,收容支撑管116后的柔性外管115垂直于柔性管115的长度的截面所对应的外径r1。
请一并参阅图5和图6,柔性外管115侧壁设有至少一个与柔性外管115的管腔相连通的通孔118。通孔118未在柔性外管115的周面上贯穿柔性外管115,即未将柔性外管115沿其长度方向分隔成至少两段。因此,可以理解的是,当柔性外管115在其长度方向上包括首尾隔开的两段时,位于该两段之间且把所述两段隔开的空隙不应理解为所述通孔。通孔118可以在柔性外管115上事先裁剪形成,也可在柔性外管115与支撑管116连接为一体之后再采用激光切割技术在柔性外管115裁剪形成。本实施例中,通孔118的个数与电极112的个数相同,电极112为环形电极,且至少一个通孔118与至少一个电极112一一对应,以便于每个电极112的一部分均可以从与其相对应的通孔118暴露出形成消融电极117(参阅图8),而电极112的其余部分被柔性外管115覆盖,也就是说,电极112的其余部分位于支撑管116与柔性外管115之间;通孔118在柔性外管115上事先裁剪形成。
支撑管116为管状结构,具有形状记忆功能,例如镍钛管,其可使用激光、电火花加工、电化学磨削、或其他合适的手段切割等形成所需要的长度及形状,以适应不同形状和尺寸的肾动脉血管。
请参阅图7,支撑管116可以选择具有超弹性的镍钛管经激光切割且热定型制成,其具有近端部分122、与近端部分122相对的远端部分123及位于近端部分122和远端部分123之间的多个切槽121。近端部分122和远端部分123未经过激光切割处理,且均具有一定的长度,所述长度为0至10毫米,优选的,所述长度为0至2毫米。本实施例中,近端部分122和远端部分123的长度相等,且为1毫米。近端部分122的长度可以大于远端部分123的长度,以便于可以更好地将支撑管116与导管主体102相连。
多个切槽121中的每个切槽121均与支撑管116的内腔相连通,其可经激光切割处理后形成。通过调整切槽121的螺旋升角、数量、宽度、及相邻两个切槽121之间的间距等参数中的一个或多个参数来调整支撑管116的刚度,进而调整支撑管件111的刚度,从而可以使得消融组件101的螺旋构型与肾动脉的贴壁性能达到最优。本实施例中,多个切槽121共同构成一个连续的螺旋状切槽。可以理解的是,多个切槽还可以间隔分布,相邻两个切槽首尾并不相连。还可以理解的是,多个切槽中也可以有一部分切槽构成一个连续的螺旋状切槽,剩余的切槽中与该螺旋状切槽相邻的切槽与该螺旋状切槽间隔分布。
需要说明的是,支撑管116可由本领域常使用的具有形状记忆功能的材料制成,本发明中不对具体材料进行限定,只要适用于人体且具有形状记忆功能的材料即可。
可以理解的是,其他实施例中,当支撑管116由具有导电性能的材料(例如镍钛)制成时,可直接将支撑管116的一部分从柔性外管115的通孔118中暴露出来形成消融电极,也就是说,消融电极为支撑管自身的一部分,无需再单独设置如前述的电极112。
请一并参阅图5及图8,优选的,电极112的数量为2至4个;在膨胀状态下,从消融组件101的远端沿轴向向近端看,多个电极112在垂直于导管主体102的轴线的截面上的投影位于同一圆周上,且均匀地分布在该圆周。该圆周的外径为2毫米至10毫米,以更好地适应血管的内径。
优选地,本实施例中,为使消融组件101的柔性更好,以适应更小解剖形态的肾动脉分支血管,电极112由金属丝缠绕在支撑管116上形成(以下简称“绕制形成”),即金属丝缠绕在支撑管116上形成一个套在支撑管116上的弹簧管状的环形电极112,例如,由黄金圆丝(即横截面为圆形的黄金丝)缠绕在支撑管116上形成。黄金圆丝的直径优选地在0.01毫米至0.15毫米之间,以使得消融组件101具有较好柔性的同时,消融组件101的电极所处之处的外径较小,从而可以减小递送消融导管100所需指引导管的尺寸。当设有电极112的支撑管116上套上柔性外管115后,每个电极112的一部分均从相应的通孔118露出,且与柔性外管115的外表面基本齐平,每个电极112的其余部分由柔性外管115包覆,如此,形成多个消融电极117,即每个通孔118由一个消融电极117填充。可以理解的是,其他实施例中,黄金丝也可为黄金扁丝,例如厚度0.05毫米、宽度0.1毫米的黄金扁丝。需要说明的是,电极112由金属丝缠绕在支撑管116上形成时,导管100的制作工艺比较简单,且电极112不易从支撑管116上脱落,确保了手术的安全有效性。
本实施例中,消融电极117均位于膨胀状态下的消融组件101的外侧,以保证当消融组件101在血管内定位时,消融电极117能够完全贴壁。优选地,消融电极117沿支撑管116长度方向上的长度(以下简称“消融电极117的长度”)为0.5毫米至8毫米,消融电极117沿支撑管116的圆周方向上的长度(以下简称“消融电极117的宽度)与消融电极117所在处的导管100的外圆周长度(即导管100的外径所对应的圆周长度)之比为0.1至0.75,以保证足够的有效消融面积的同时,又能确保非目标血管组织不受到消融热的影响。更优选地,消融电极117的消融面积不小于1.5平方毫米(例如消融电极117的长度为4毫米,消融电极117的宽度与消融电极117所在处的导管100的圆周长度之比为0.45,消融电极117的宽度约为2.1mm),以保证足够的消融面积的同时,又能保护非目标血管组织受到消融热的影响。
可以理解的是,在其他实施例中,电极112还可以是其他非金属丝绕制的环形电极,或非环形电极,例如点状电极、半环形电极、块状电极或其他非规则形状的非环形电极。当电极112为前述点状电极或者块状电极等非环形电极时,电极112可以部分从通孔118露出形成消融电极(即,电极112的其余部分被柔性外管116覆盖),也可以全部从通孔118中露出形成消融电极,只要电极112具有与通孔大小基本相等的消融电极即可。请一并参阅图9及图10,导管100还包括一个收容于支撑管116中的导丝套管124。导丝套管124从近端手柄103到远端轴向贯穿导管100,并终止于柔性头113。导丝套管124的内腔可被用于递送标准医用导丝120,例如,直径0.356mm的导丝,由此可实现整体交换导丝技术将导管100递送至肾分支血管中。导丝套管124的材料可为聚合物材料(例如pebax、hdpe、pet、ptfe、pi等),或由多层聚合物材料构成(例如外层是热熔性能良好的pebax材料、内层是具有润滑性能的ptfe材料)、或带编织层的聚合物材料(例如带不锈钢编织网的pi管)。柔性外管115的远端125与导丝套管124的远端126齐平,通过热熔或灌胶等方法使两者紧密结合在一起,且导丝套管124的远端开口,如此,形成柔性头113。
优选地,选用热熔的方式可将导丝套管124的远端126的外壁和柔性外管115的远端125熔为一体。可以理解的是,导丝套管124也可以穿设于支撑管116与柔性外管115之间,例如柔性外管115为双腔管,导丝套管位于一个腔中,支撑管位于另一个腔中;在低轮廓递送构型时,导丝套管124与支撑管116平行,也可以实现本发明的目的。还可以理解的是,柔性头113也可以单独成型,再通过粘结的方式与柔性外管115及导丝套管124连接为一体。
请一并参阅图11,消融组件101还包括设于消融电极117与支撑管116之间的温度传感器140及电极导线141。温度传感器140用于感测消融电极117的温度,以反馈给射频仪104;温度传感器140的导线及电极导线141在柔性外管115与支撑管116之间延伸并进入导管主体,最终焊接在近端手柄103的连接器(未示出)上。
优选地,支撑管116与电极112之间设置有柔软的绝缘层142。绝缘层142可以是医用epfte薄膜或ptfe电缆膜缠绕在支撑管116表面形成,或者由聚合物热缩管热缩于支撑管116的表面形成;也可以是与柔性外管115相同材质的聚合物管材热熔在支撑管116上形成,例如pebax管,以利于柔性外管115与绝缘层142的热熔结合。
与现有技术相比,本发明的导管100的消融电极117不会对血管的整周或大部分圆周弧度都产生消融能量,降低了细小的分支血管因消融产生狭窄的风险。导管100在肾动脉分支内经过消融后(例如采用温控模式:温度设置65度,输出功率8瓦,时间90秒)撤回腹主动脉,通过x光造影图可以看到,肾动脉分支血管内的消融处没有产生狭窄(参阅图12)。此外,由于电极112除去消融电极112外的其余部分由柔性外管115包覆,因此不会与血液接触,在消融过程中不会加热周围的血液,降低了溶血的风险。并且,柔性外管115的外表面为一整体,制作简单,在导管100输送过程中不会产生制成柔性外管115的材料从导管100上脱落的风险。
可以理解的是,其他实施例中,支撑管也可以为其他可以为电极提供支撑的形状,例如s形(参阅图13),单拱形9(参阅图14)等等,其中,s形及单拱形的高度h在2毫米至10毫米之间,以具有较好的贴壁性。
请一并参阅图15、16及17,本发明第二实施例提供的消融导管100a,其与消融导管100大体上相同,不同之处在于,消融导管100a的支撑管116a包括相连的远端螺旋段118a及近端螺旋段119a。其中,远端螺旋段118a上设置有至少一个消融电极117a;近端螺旋段119a上设置有至少一个环形电极112a。进行消融时,远端螺旋段118a承载消融电极117a进入肾动脉分支血管31,近端螺旋段119a承载环形电极112a进入肾动脉主干远端21。在本实施例中,支撑管116a选择具有超弹性的镍钛管经激光切割制成。
支撑管116a还具有一个与消融导管100a的导管主体102a相连的连接部分121a。近端螺旋段119a连接于远端螺旋段118a与连接部分121a之间,且远端螺旋段118a、近端螺旋段119a及连接部分121a上均具有经激光切割处理后形成的切槽。通过调整切槽的螺旋升角、数量、宽度、及间距等其中的一个或多个参数来调整支撑管116a各部分的刚度,进而可调整支撑管116a的刚度,从而使得膨胀状态下的消融导管100a具有电极与肾血管贴壁性能,及低轮廓形态时的输送性能达到最优。优选地,在相同外力作用下,近端螺旋段119a的刚度不小于远端螺旋段118a的刚度;近端螺旋段119a的刚度不大于连接部分121a的刚度。
支撑管116a的远端还具有柔性头部120a。柔性头部120a具有一定的轴向长度,所述轴向长度范围为小于等于10毫米,以防止消融导管100a的远端在血管中移动时损伤血管内壁,且由于柔性头部120a较柔软,更利于导丝的远端穿出消融导管100a的远端。优选地,所述轴向长度范围小于等于5毫米。柔性头部120a去除部分材料以有利于柔性头部120a柔性的增加,更能够利于通过细小曲折的分支血管,降低损伤血管的风险。
消融电极117a的结构与消融电极117结构相似,直径相等,即两者均只覆盖其所处的柔性外管的整个圆周的一部分,因此均不会对血管的整个周截面或大部分圆周弧度都产生消融能量,降低了细小的分支血管因消融产生狭窄的风险。电极112a的结构与消融电极117的结构可以相似,直径相等,即两者均只覆盖其所处的柔性外管的整个圆周的一部分,因此均不会对血管的整周截面或大部分圆周弧度都产生消融能量,降低了血管因消融产生狭窄的风险。在其他实施例中,消融电极112a覆盖其所处的柔性外管的整个圆周,直径与消融电极117a相等,因其对主干远端21消融,而主干远端21的内径相对分支血管31内径大,故电极112a所在的柔性外管表面只有部分与主干远端21贴合,较难对主干远端21的整周截面或大部分圆周弧度都产生消融能量,主干远端21也较难因消融产生狭窄的风险。
优选地,在膨胀状态下,近端螺旋段119a的外径不小于远端螺旋段118a的外径,以便于远端螺旋段118a及近端螺旋段119a可分别对分支血管31及主干远端21进行消融。故,相较仅能对主干中的交感神经进行消融的消融导管,本实施例中的消融导管不仅可以对主干中的交感神经进行消融,还可以对分支血管中的交感神经进行消融,可以取得更好的治疗高血压的效果。
在膨胀构型下,远端螺旋段118a的外径在2毫米至10毫米之间;近端螺旋段119a的外径在4毫米至10毫米之间,使得消融导管100a的远端螺旋段118a与分支血管31及二级分支血管311的贴壁性、及近端螺旋段119a与主干远端21的贴壁性均达到最好。需要说明的是,远端螺旋段118a的外径是指在膨胀状态下远端螺旋段118a围绕消融导管100a的中心轴所形成的圆锥体的最大外径;近端螺旋段119a的外径是在指膨胀状态下近端螺旋段119a围绕消融导管100a的中心轴所形成的圆锥体的最大外径。
本实施例中,远端螺旋段118a的外径为4毫米;近端螺旋段119a的外径为6毫米;近端螺旋段119a的电极112a可为片状或管状结构,其可通过模压或使用粘合剂结合等方式设置于近端螺旋段119a上。电极112a可由任何合适的金属材料形成,例如,金、铂、铂铱合金等。每个电极112a下都设置有温度传感器,用于检测相应的电极112a的温度并反馈给射频仪。可以理解的是,电极112a也可以采用黄金圆丝或黄金扁丝绕制形成。
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对本发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
- 还没有人留言评论。精彩留言会获得点赞!