一种无定型Venetoclax与药用辅料的固体分散体及其制备方法与流程
本发明属于药物制剂领域,具体涉及一种无定型venetoclax与药用辅料的固体分散体及其制备方法。
背景技术:
venetoclax,化学名为4-[4-[[2-(4-氯苯基)-4,4-二甲基-1-环己-1-基]甲基]-1-哌嗪基]-n-[[3-硝基-4-[[(四氢-2h-吡喃-4-基)甲基]氨基]苯基]磺酰基]-2-(1h-吡咯[2,3-b]吡啶-5-基氧基)-苯甲酰胺,商品名为venclexta,是美国艾伯维公司和瑞士罗氏公司联合开发的一种b-细胞淋巴瘤2(bcl-2)抑制剂,用于治疗带有17p基因突变并且曾接受过至少一种治疗的慢性淋巴细胞白血病(cll)患者,于2016年4月11日,获美国食品和药品监管局(fda)批准上市。venclexta是fda批准的首个b细胞淋巴瘤因子-2抑制剂,之前fda已授予其突破性药物认定、优先审查资格、加速审批资格。值得一提的是,截至目前,venclexta已斩获fda3个突破性药物资格。bcl-2蛋白支持癌细胞的生长,并且在许多cll患者中过度表达,代表着血液癌症治疗的一个新靶标。venclexta能够帮助恢复让白血病细胞自我毁灭的自然过程,代表着预后极差且治疗选择十分有限的17p删除突变cll患者群体中的一种新的治疗方式。业界对venclexta的商业前景也十分看好。该药物的结构如式(i)所示:
虽然venetoclax的疗效已获得广泛认可,但仍然存在一些缺陷。专利cn103328474公开了venetoclax的无定型和多种晶型,包括:游离碱的无水无晶型、游离碱水合物晶型、游离碱溶剂合物以及盐酸盐晶型、盐酸盐溶剂合物。该专利指出无定型因纯化困难,难以作为药物活性成分而用于药物制剂的制备。该专利同时指出,可通过盐或晶型调节和改良药物活性成分的物理化学性质,使之更适于药物制剂的开发和生产。但热力学稳定的晶型会使活性成分在水中的溶解度会降低,从而影响药物的生物利用度。
药物的固体形态直接影响原料药的溶解速率、制剂的溶出度和生物利用度,为了提高药物的生物利用度,降低用量、降低毒副作用,通常会开发药物的新的固体形态,因此,开发该药物溶解性更好、生物利用度更高的固体形式就显得很有必要。
药物的固体形态除晶态外,还有无定型状态,药物的无定型状态作为固体物质的一种特殊形态,一般具有更好的溶解性,在药物制备中有着重要的用途。因此,通过多种技术手段和方法提高无定型态药物的稳定性,使之成为具有优良品质的药物就显得十分必要。
技术实现要素:
本发明的目的是提供一种venetoclax与药用辅料的固体分散体及其制备方法,得到稳定性及分散性良好的无定型态的venetoclax与药用辅料的固体分散体,增加了venetoclax的溶出度,该制备方法不受干燥过程的限制,也不受溶剂种类和溶剂量的限制,操作简便,成本低廉,易于实现,可实现工业化生产。
为了达到上述目的,本发明的技术方案如下:
一种venetoclax与药用辅料的固体分散体,该固体分散体包含venetoclax与药用辅料,两者的重量比为1:0.1~100,其中,所述的venetoclax为无定型态,所述固体分散体的x-射线粉末衍射光谱中,扣除药用辅料的背景峰后无venetoclax的晶体的特征峰。
进一步,所述药用辅料选自稀释剂、润滑剂、粘合剂、崩解剂、表面活性剂、成膜材料、包衣材料和胶囊材料中的至少一种。
优选地,所述的药用辅料选自羟丙甲基纤维素、羟丙基纤维素、聚维酮,聚乙二醇、乙基纤维素、脂质体、甲基丙烯酸共聚物、聚醋酸乙烯、羧甲基乙基纤维素、羧甲基纤维素邻苯二甲酸酯、羟丙甲基纤维素邻苯二甲酸酯、羟丙甲基纤维素醋酸酯琥珀酸酯、聚丙烯酸树脂、聚羧乙烯、藻酸盐、卡拉胶、羧基乙酸内酯、树胶、聚乙烯醇、预胶化淀粉、交联淀粉、羧甲基淀粉钠、糊精、聚环氧乙烷、壳聚糖、几丁聚糖、离子交换树脂和胶原蛋白中的至少一种。
本发明提供一种venetoclax与药用辅料的固体分散体的制备方法,包括如下步骤:
1)将venetoclax和药用辅料在溶剂中混合,混合温度为-50~150℃,形成含venetoclax和药用辅料的溶液或悬浮液,其中,venetoclax与溶剂的重量比为0.001~100:1,venetoclax与药用辅料的重量比为1:0.1~100;
2)除去步骤1)得到的溶液或悬浮液中的溶剂,得到无定型态的venetoclax与药用辅料的固体分散体。
进一步,所述药用辅料选自稀释剂、润滑剂、粘合剂、崩解剂、表面活性剂、成膜材料、包衣材料和胶囊材料中的至少一种。
优选地,步骤1)中所述的药用辅料选自羟丙甲基纤维素、羟丙基纤维素、聚维酮、微晶纤维素、聚乙二醇、乙基纤维素、脂质体、甲基丙烯酸共聚物、聚醋酸乙烯、羧甲基乙基纤维素、羧甲基纤维素邻苯二甲酸酯、羟丙甲基纤维素邻苯二甲酸酯、羟丙甲基纤维素醋酸酯琥珀酸酯、聚丙烯酸树脂、聚羧乙烯、藻酸盐、卡拉胶、羧基乙酸内酯、树胶、聚乙烯醇、预胶化淀粉、交联淀粉、羧甲基淀粉钠、糊精、聚环氧乙烷、壳聚糖、几丁聚糖、离子交换树脂和胶原蛋白中的至少一种。
又,步骤1)所述溶剂选自含12个以下碳原子的醇类、酚类、醚类、卤代烃、酮类、醛类、腈类、酰胺、砜、亚砜、羧酸和水中的至少一种,步骤2)除去溶剂的方法包括:蒸发、真空蒸发、喷雾干燥、冷冻干燥、热熔挤出、过滤、离心或搅拌薄膜干燥。
本发明还提供了一种药用组合物,所述药用组合物包含含有无定形态的venetoclax的固体分散体和至少一种的药学上可接受的辅料。
进一步,以上任一所述的组合物用于制备治疗肿瘤疾病、免疫性疾病和自身免疫性疾病的药物的用途,其中肿瘤疾病选自:间皮瘤、膀胱癌、胰腺癌、皮肤癌、头或颈癌、皮肤或眼内的黑色素瘤、卵巢癌、乳腺癌、子宫癌、输卵管癌、子宫内膜癌、宫颈癌、阴道癌、外阴癌、骨癌、结肠癌、直肠癌、肛区癌、胃癌、胃肠(胃、结直肠和/或十二指肠)、慢性淋巴细胞性白血病、食道癌、小肠癌、内分泌系统癌、甲状腺癌、甲状旁腺癌、肾上腺癌、软组织肉瘤、尿道癌、阴茎癌、睾丸癌、肝细胞(肝脏和/或胆管)癌、原发性或继发性中枢神经系统肿瘤、原发性或继发性中枢神经系统脑肿瘤、霍奇金并、慢性或急性白血病、慢性粒细胞白血病、淋巴细胞性淋巴瘤、成淋巴细胞性白血病、滤泡性淋巴瘤、t细胞或b细胞源的淋巴恶性肿瘤、黑色素瘤、多发性骨髓瘤、口腔癌、非小细胞肺癌、前列腺癌、小细胞肺癌、肾和/或输尿管癌、肾细胞癌、肾盂癌、中枢神经系统的瘤、原发性中枢神经系统淋巴瘤、非霍奇金淋巴瘤、脊椎轴肿瘤、脑干神经胶质瘤、垂体肿瘤、肾上腺皮质癌、胆囊癌、脾癌、胆管上皮癌、纤维肉瘤、神经母细胞瘤、视网膜细胞瘤及其组合。
本发明的venetoclax与药用辅料的固体分散体,使用cu-kα辐射,以度2θ表示的x-射线粉末衍射光谱中扣除药用辅料的背景峰无venetoclax结晶态的特征峰,表明venetoclax为无定型状态。现有技术中一般使用venetoclax的结晶态,未见其无定型态的报道。一般由于晶态物质分子的有序和周期性排列,降低了分子间相互作用的能量,能量较低,而本发明的venetoclax为无定型态,分子处于高度无序状态,物质的表面自由能更大,固体物质中的分子较晶态固体物质中的分子有更高的能量,更容易分散,增加其溶出度,提高venetoclax的生物利用度。
本发明将venetoclax和药用辅料混合均匀后,使用“固体分散剂”法,通过药用辅料的多聚体网状结构将药物分子阻隔,抑制结晶的发生,使其保持分散和无定型状态。本发明采用应用广泛、价格低廉、溶解性好的药用辅料,这些药用辅料与venetoclax混合,配合蒸发、喷雾干燥、冷冻干燥和热熔挤出等技术可以得到venetoclax的无定型形式,增加本发明venetoclax的固体分散体中的venetoclax的无定型态的稳定性。
本发明选用在药学上应用广泛的、价格低廉的辅料,得到venetoclax与药用辅料的固体分散体,易于开发制剂配方,本发明的制备方法不受干燥过程的限制,也不受溶剂种类和溶剂量的限制,操作简便,成本低廉,易于实现,可实现工业化生产。
与现有技术相比,本发明的有益效果是:
1)本发明制备的无定型venetoclax与药用辅料的固体分散体具有高度分散性及稳定性,在制成固体制剂后,经过崩解可使药物粒子的分散程度更好,分散及溶出速度更快,有利于药物的吸收。因此,无定型状态药物的溶出度明显增加,更有利于机体对药物的吸收,提高药物的生物利用度,使药物能够更好地发挥临床疾病治疗作用。
2)本发明无定型状态的venetoclax与药用辅料的固体分散体的制备方法不受干燥过程的限制,也不受溶剂种类和溶剂量的限制,操作简便,成本低廉,易于实现,可实现工业化生产。
3)本发明制备的无定型状态的venetoclax与药用辅料的固体分散体在加速试验条件下(40±2℃,湿度75%±5%),能保持良好的物理稳定性和化学稳定性。因此,本发明将会有广阔的应用前景。
附图说明
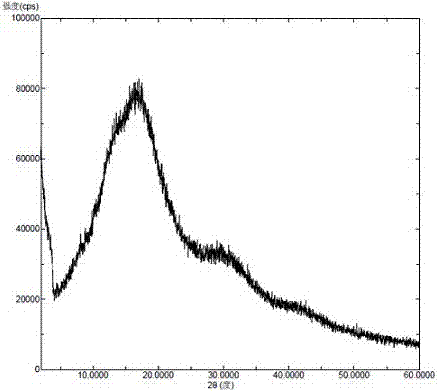
图1为本发明实施例1的无定型venetoclax和聚维酮-k30的固体分散体的x-射线粉末衍射图。
图2为本发明实施例10的无定型venetoclax和聚丙烯酸树脂eudragitl100的固体分散体的x-射线粉末衍射图。
具体实施方式
以下结合具体实施例对本发明作进一步说明,但本发明的保护范围不受以下实施例的限制。
本发明所述的x-射线粉末衍射图在ultimaivx-射线衍射仪上采集。本发明所述的x-射线粉末衍射的方法参数如下:
x-射线粉末参数:cu-kα
kα
电压:40千伏
电流:40毫安
发散狭缝:自动
扫描模式:连续
扫描范围:自2.0至60.0度
取样步长:0.0200度
扫描速率:60度/分钟
实施例1
将venetoclax(5克)和聚维酮k30(10克)加入水(300毫升)中,加热到60℃搅拌溶清。将上述溶液用jisl微型喷雾干燥机lsd-48干燥,维持进口温度60℃、出口温度50℃,收集出口物料,得到白色固体,进一步真空干燥得到无定型venetoclax与聚维酮-k30的固体分散体。x-射线粉末衍射图如图1所示,该固体分散体的x-射线粉末衍射图中,扣除药用辅料的背景峰后无venetoclax晶型的特征峰。
实施例2
将venetoclax(1克)和羟丙甲基纤维素e50(0.2克)加到水(10毫升)中,加热到40℃搅拌溶清。将上述溶液冷冻干燥,得到白色固体,即无定型venetoclax与羟丙甲基纤维素e50的固体分散体,该固体分散体的x-射线粉末衍射图中,扣除药用辅料的背景峰后无venetoclax晶型的特征峰。
实施例3
将venetoclax(1克)和聚乙二醇8000(50克)加热到熔融,搅拌下迅速冷却到室温,得到白色固体。将上述固体粉碎,得到白色粉末状固体,即无定型venetoclax与聚乙二醇8000的固体分散体,该固体分散体的x-射线粉末衍射图中,扣除药用辅料的背景峰后无venetoclax晶型的特征峰。
实施例4
将venetoclax(1克)和聚乙二醇10000(100克)加热到240℃,混合均匀,迅速冷却到室温,得到白色固体。将上述固体粉碎,得到白色粉末状固体,即无定型venetoclax与聚乙二醇10000的固体分散体,该固体分散体的x-射线粉末衍射图中,扣除药用辅料的背景峰后无venetoclax晶型的特征峰。
实施例5
将venetoclax(1克)、异丙醇(20克)和脂质体(4克)的混合物加热到90℃,搅拌,混合均匀,真空蒸发除去溶剂,冷却到室温得到白色固体,即无定型venetoclax与脂质体的固体分散体,该固体分散体的x-射线粉末衍射图中,扣除药用辅料的背景峰后无venetoclax晶型的特征峰。
实施例6
将venetoclax(1克)、甲醇(20克)和甲基丙烯酸共聚物a型(4克)的混合物加热到50℃,搅拌,溶清,真空蒸发除去溶剂,冷却到室温得到白色固体,即无定型venetoclax与甲基丙烯酸共聚物a型的固体分散体,该固体分散体的x-射线粉末衍射图中,扣除药用辅料的背景峰后无venetoclax晶型的特征峰。
实施例7
将venetoclax(1克)、异丙醇(20克)和乙基纤维素(2克)的混合物加热到30℃,搅拌,混合均匀,真空蒸发除去溶剂,冷却到室温得到白色固体,即无定型venetoclax与乙基纤维素的固体分散体,该固体分散体的x-射线粉末衍射图中,扣除药用辅料的背景峰后无venetoclax晶型的特征峰。
实施例8
将venetoclax(1克)、甲醇(20克)和羟丙基纤维素ssl(4克)的混合物加热到30℃,搅拌溶清,真空蒸发除去溶剂,冷却到室温得到白色固体,即无定型venetoclax与羟丙基纤维素ssl的固体分散体,该固体分散体的x-射线粉末衍射图中,扣除药用辅料的背景峰后无venetoclax晶型的特征峰。
实施例9
将venetoclax(1克)、甲醇(20克)、水(10克)和聚醋酸乙烯(4克)的混合物加热到30℃,搅拌溶清,真空蒸发除去溶剂,冷却到室温得到白色固体,即无定型venetoclax与聚醋酸乙烯的固体分散体,该固体分散体的x-射线粉末衍射图中,扣除药用辅料的背景峰后无venetoclax晶型的特征峰。
实施例10
将venetoclax(50毫克)和聚丙烯酸树脂eudragitl100(100毫克)加入到甲醇(750微升),室温下搅拌溶清。将上述溶液在旋转蒸发器中迅速浓缩至干,得到白色固体,即无定型venetoclax与聚丙烯酸树脂eudragitl100的固体分散体,该固体分散体的x-射线粉末衍射图如图2所示,x-射线粉末衍射图中扣除药用辅料的背景峰后无venetoclax晶型的特征峰。
实施例11
将venetoclax(50毫克)和聚丙烯酸树脂eudragits100(5毫克)加入到甲醇(4毫升)和乙酸乙酯(1毫升),-30℃下搅拌溶清。将上述溶液在旋转蒸发器中迅速浓缩至干,得到白色固体,搅拌下析出白色固体,即无定型venetoclax与聚丙烯酸树脂eudragits100的固体分散体,该固体分散体的x-射线粉末衍射图中,扣除药用辅料的背景峰后无venetoclax晶型的特征峰。
实施例12
将venetoclax(50毫克)和聚羧乙烯carbomer940(50毫克)加入到甲醇(4毫升)和四氢呋喃(1毫升),-30℃下搅拌混合均匀。将上述溶液在旋转蒸发器中迅速浓缩至干,得到白色固体,搅拌下析出白色固体,即无定型venetoclax与聚羧乙烯carbomer940的固体分散体,该固体分散体的x-射线粉末衍射图中,扣除药用辅料的背景峰后无venetoclax晶型的特征峰。
实施例13
将venetoclax(50毫克)和预胶化淀粉pharma-gel(100毫克)加入到甲醇(4毫升)和水(1毫升),室温下混合均匀。将上述溶液在旋转蒸发器中迅速浓缩至干,得到白色固体,搅拌下析出白色固体,即无定型venetoclax与pharma-gel预胶化淀粉的固体分散体,该固体分散体的x-射线粉末衍射图中,扣除药用辅料的背景峰后无venetoclax晶型的特征峰。
实施例14
将venetoclax(50毫克)和高支链交联淀粉(50毫克)加入到甲醇(4毫升)和水(1毫升),室温下搅拌溶清,将上述溶液在旋转蒸发器中迅速浓缩至干,得到白色固体,搅拌下析出白色固体,即无定型venetoclax与高支链交联淀粉的固体分散体,该固体分散体的x-射线粉末衍射图中,扣除药用辅料的背景峰后无venetoclax晶型的特征峰。
实施例15
将venetoclax(50毫克)和羧甲基纤维素钠scmc(500毫克)加入到二甲基亚砜(5毫升),室温下搅拌溶清。将上述溶液在旋转蒸发器中迅速浓缩至干,得到白色固体,即无定型venetoclax与羧甲基纤维素钠scmc的固体分散体,该固体分散体的x-射线粉末衍射图中,扣除药用辅料的背景峰后无venetoclax晶型的特征峰。
实施例16
将venetoclax(50毫克)和几丁聚糖(500毫克)加入到乙醇(5毫升),室温下搅拌溶清,将上述溶液在旋转蒸发器中迅速浓缩至干,得到白色固体,即无定型venetoclax与几丁聚糖的固体分散体,该固体分散体的x-射线粉末衍射图中,扣除药用辅料的背景峰后无venetoclax晶型的特征峰。
实施例17
将venetoclax(50毫克)和羧甲基淀粉钠explotab(500毫克)加入到乙醇(5毫升),室温下搅拌混合均匀,将上述溶液在旋转蒸发器中迅速浓缩至干,得到白色固体,即无定型venetoclax与羧甲基淀粉钠explotab的固体分散体,该固体分散体的x-射线粉末衍射图中,扣除药用辅料的背景峰后无venetoclax晶型的特征峰。
实施例18
将venetoclax(50毫克)和藻酸盐e401(500毫克)加入到乙醇(5毫升),室温下搅拌混合均匀。将上述溶液在旋转蒸发器中迅速浓缩至干,得到白色固体,即无定型venetoclax与藻酸盐e401的固体分散体,该固体分散体的x-射线粉末衍射图中,扣除药用辅料的背景峰后无venetoclax晶型的特征峰。
实施例19
将venetoclax(50毫克)和羧甲基纤维素邻苯二甲酸酯agucoatcpd(5克)悬浮于甲醇(30毫升),加热到50℃搅拌混合均匀。将上述溶液在旋转蒸发器中迅速浓缩除去大部分溶剂,过滤,干燥,得到白色固体,即无定型venetoclax与羧甲基纤维素邻苯二甲酸酯agucoatcpd的固体分散体,该固体分散体的x-射线粉末衍射图中,扣除药用辅料的背景峰后无venetoclax晶型的特征峰。
实施例20
将venetoclax(50毫克)和卡拉胶e407(500毫克)悬浮于甲醇(30毫升),加热到50℃搅拌混合均匀,将上述溶液在旋转蒸发器中迅速浓缩除去大部分溶剂,过滤,干燥,得到白色固体,即无定型venetoclax与卡拉胶e407的固体分散体,该固体分散体的x-射线粉末衍射图中,扣除药用辅料的背景峰后无venetoclax晶型的特征峰。
实施例21
将venetoclax(50毫克)和壳聚糖(5克)悬浮于甲醇(50毫升),加热到50℃搅拌混合均匀。将上述溶液在旋转蒸发器中迅速浓缩除去大部分溶剂,过滤,干燥,得到白色固体,即无定型venetoclax与壳聚糖的固体分散体,该固体分散体的x-射线粉末衍射图中,扣除药用辅料的背景峰后无venetoclax晶型的特征峰。
实施例22
将venetoclax(30毫克)和聚丙烯酸树脂eudragite100(30毫克)溶于异丙醇(600微升)和n,n-二甲基甲酰胺(600微升)中,加热到50℃搅拌溶清,将上述溶液降温到10℃,析出白色固体,过滤,干燥,得到无定型venetoclax与聚丙烯酸树脂eudragite100的固体分散体,该固体分散体的x-射线粉末衍射图中,扣除药用辅料的背景峰后无venetoclax晶型的特征峰。
实施例23
将venetoclax(30毫克)和胶原蛋白peptan(300毫克)溶于异丙醇(600微升)和乙腈(600微升)中,加热到50℃搅拌溶清。将上述溶液降温到10℃,析出白色固体,过滤,干燥,得到无定型venetoclax与胶原蛋白peptan的固体分散体,该固体分散体的x-射线粉末衍射图中,扣除药用辅料的背景峰后无venetoclax晶型的特征峰。
实施例24
将venetoclax(30毫克)和树胶galactosol(300毫克)溶于异丙醇(600微升)和甲醇(600微升)中,加热到50℃搅拌溶清。将上述溶液降温到10℃,析出白色固体,过滤,干燥,得到无定型venetoclax与树胶galactosol的固体分散体,该固体分散体的x-射线粉末衍射图中,扣除药用辅料的背景峰后无venetoclax晶型的特征峰。
实施例25
将venetoclax(30毫克)和羟丙甲基纤维素邻苯二甲酸酯hpmcp(30毫克)加入到乙醇(750微升)和水(750微升),加热到80℃搅拌混合均匀。将上述溶液在旋转蒸发器中迅速浓缩除去溶剂,得到白色固体,即无定型venetoclax与羟丙甲基纤维素邻苯二甲酸酯hpmcp的固体分散体,该固体分散体的x-射线粉末衍射图中,扣除药用辅料的背景峰后无venetoclax晶型的特征峰。
实施例26
将venetoclax(30毫克)和离子交换树脂amberliteira-400(300毫克)加入到乙醇(750微升)和水(750微升),加热到80℃搅拌混合均匀。将上述溶液在旋转蒸发器中迅速浓缩除去溶剂,得到棕色固体,即无定型venetoclax与离子交换树脂amberliteira-400的固体分散体,该固体分散体的x-射线粉末衍射图中,扣除药用辅料的背景峰后无venetoclax晶型的特征峰。
实施例27
将venetoclax(30毫克)和羧基乙酸内酯(300毫克)加入到乙醇(750微升)和水(750微升),加热到80℃搅拌混合均匀。将上述溶液在旋转蒸发器中迅速浓缩除去溶剂,得到棕色固体,即无定型venetoclax与羧基乙酸内酯的固体分散体,该固体分散体的x-射线粉末衍射图中,扣除药用辅料的背景峰后无venetoclax晶型的特征峰。
实施例28
将venetoclax(30毫克)和糊精maltrinm100(300毫克)加入到乙醇(750微升)和水(750微升),加热到80℃搅拌混合均匀。将上述溶液在旋转蒸发器中迅速浓缩除去溶剂,得到棕色固体,即无定型venetoclax与糊精maltrinm100的固体分散体,该固体分散体的x-射线粉末衍射图中,扣除药用辅料的背景峰后无venetoclax晶型的特征峰。
实施例29
将venetoclax(30毫克)和羧甲基纤维素钠scms(3毫克)加入到水(30毫升),加热到100℃搅拌混合均匀。将上述溶液在旋转蒸发器中迅速浓缩除去溶剂,得到白色固体,即无定型venetoclax与羧甲基纤维素钠scmc的固体分散体,该固体分散体的x-射线粉末衍射图中,扣除药用辅料的背景峰后无venetoclax晶型的特征峰。
实施例30
将venetoclax(30毫克)和β-环糊精(30毫克)加入到甲醇(300微升)和水(300微升),室温下搅拌溶清。将上述溶液在旋转蒸发器中迅速浓缩除去溶剂,得到白色固体,即无定型venetoclax与β-环糊精的固体分散体,该固体分散体的x-射线粉末衍射图中,扣除药用辅料的背景峰后无venetoclax晶型的特征峰。
实施例31
将venetoclax(30毫克)和羧甲基纤维素钠scmc(30毫克)加入到甲醇(300微升)和水(60微升),60℃下搅拌混合均匀。将上述溶液在旋转蒸发器中迅速浓缩除去溶剂,得到白色固体,即无定型venetoclax与羧甲基纤维素钠scmc的固体分散体,该固体分散体的x-射线粉末衍射图中,扣除药用辅料的背景峰后无venetoclax晶型的特征峰。
实施例32
将venetoclax(5毫克)和聚环氧乙烷polyoxwsr301(60毫克)加入到甲醇(300微升)和水(60微升),60℃下搅拌混合均匀。将上述溶液在旋转蒸发器中迅速浓缩除去溶剂,得到白色固体,即无定型venetoclax与聚环氧乙烷polyoxwsr301的固体分散体,该固体分散体的x-射线粉末衍射图中,扣除药用辅料的背景峰后无venetoclax晶型的特征峰。
实施例33
将venetoclax(30毫克)和聚乙烯醇eg-40(60毫克)加入到甲醇(300微升)和水(60微升),60℃下搅拌溶清,将上述溶液在旋转蒸发器中迅速浓缩除去溶剂,得到白色固体,即无定型venetoclax与聚乙烯醇eg-40的固体分散体,该固体分散体的x-射线粉末衍射图中,扣除药用辅料的背景峰后无venetoclax晶型的特征峰。
实施例34
将venetoclax(50毫克)和羟丙甲基纤维素醋酸酯琥珀酸酯agoatmg(2克)加入到乙醇(10毫升)和水(2毫升),80℃下搅拌混合均匀,将上述溶液在旋转蒸发器中迅速浓缩至干,得到白色固体,即无定型venetoclax与羟丙甲基纤维素醋酸酯琥珀酸酯agoatmg的固体分散体,该固体分散体的x-射线粉末衍射图中,扣除药用辅料的背景峰后无venetoclax晶型的特征峰。
实施例35
将venetoclax(50毫克)和羧甲基乙基纤维素(2克)加入到乙醇(10毫升)和水(1毫升),80℃下搅拌混合均匀,将上述溶液在旋转蒸发器中迅速浓缩至干,得到白色固体,即无定型venetoclax与羧甲基乙基纤维素的固体分散体,该固体分散体的x-射线粉末衍射图中,扣除药用辅料的背景峰后无venetoclax晶型的特征峰。
实施例36:无定型venetoclax与聚维酮k30固体分散体的影响因素试验
材料:实施例1所得无定型venetoclax与聚维酮k30的固体分散体
表1:
表1说明:无定型venetoclax与聚维酮k30固体分散体在高温、高湿条件下,放置10天,有关物质无显著改变,无venetoclax结晶析出。
实施例37:无定型venetoclax与聚维酮k30固体分散体的影响因素试验
材料:实施例1所得无定型venetoclax与聚维酮k30的固体分散体
实验条件:温度40℃±2℃,湿度75%±5%
表2:
表2说明:无定型venetoclax与聚维酮k30固体分散体在加速试验条件下,放置6个月,有关物质无显著改变,无venetoclax结晶析出。
本发明的venetoclax与药用辅料的无定型固体分散体,其溶出度明显增加,更有利于提高药物的生物利用度,使药物能够更好地发挥临床疾病治疗作用,该无定型物在加速试验条件下(40±2℃,湿度75%±5%),能保持良好的物理稳定性和化学稳定性。
- 还没有人留言评论。精彩留言会获得点赞!